UNIVERSIDADE FEDERAL DE OURO PRETO
NÚCLEO DE PESQUISAS EM CIÊNCIAS BIOLÓGICAS NUPEB PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS
AVALIAÇÃO DA UTILIZAÇÃO DE Lactobacillus delbrueckii UFV
H2b20 COMO ADJUVANTE NA VACINAÇÃO CONTRA Leishmania
braziliensis
Autora: Juciane Maria de Andrade Castro Orientador: Prof. Dr. Luís Carlos Crocco Afonso
Dissertação de Mestrado apresentada ao Programa de Pós-graduação em Ciências Biológicas da Universidade Federal de Ouro Preto, como parte dos requisitos para obtenção do Título de Mestre em Ciências
Biológicas, área de concentração:
Imunobiologia de Protozoários.
DEDICATÓRIA
D
EDICATÓRIAAGRADECIMENTOS
Agradecimentos
Ao professor Dr. Luís Carlos Crocco Afonso, pela grande confiança depositada desde a iniciação científica, pela incomparável orientação e por me apresentar o glorioso caminho da ciência, e, especialmente, pelos grandes ensinamentos no que diz respeito a profissionalismo, dignidade e respeito, e também pelo apoio, amizade e carinho sempre demonstrados.
À professora Dra. Vanessa Carla Mosqueira, por ter aberto as portas do seu laboratório sempre com muita disposição, pelos conhecimentos transmitidos e pelos grandes exemplos de conduta e busca do saber.
À professora Dra. Beatriz Stransk pelos ensinamentos e estímulos a busca constante por conhecimentos, e principalmente pela amizade.
Aos professores Dr. Elio Hideo Baba, Dr. Milton Hércules Guerra de Andrade e a Dra Renata Guerra, pelas discussões e tentativas de resolução das questões, e também pela amizade e carinho.
À professora Dra. Marta de Lanna pela preocupação, amizade e carinho sempre demonstrados.
Aos professores do NUPEB, por terem contribuído com minha formação, cada um de sua maneira.
À professora Dr. Leda Quércia Vieira (Departamento de Bioquímica e Imunologia ICB UFMG) por estar sempre disposta a ajudar no quer fosse necessário.
Ao professor Dr. Marcelo Porto Bemquerer (Departamento de Bioquímica e Imunologia ICB UFMG), por toda a ajuda e disponibilização do seu laboratório.
Ao professor Dr. Adriano Monteiro de Castro Pimenta (Departamento de
Bioquímica e Imunologia ICB UFMG), pela atenção e ajuda em solucionar uma grande
questão.
AGRADECIMENTOS
À Alcan, especialmente ao Ailson Torres, por toda atenção e pela disponibilização de aparelhos para nossa utilização.
Ao Leandro, por se mostrar sempre disposto a ajudar e contribuir com os materiais. À Cidinha, por estar sempre disposta a nos ajudar, pela amizade e alegria.
À Tati e Laura, que compartilharam os resultados, pelo aprendizado, pelas alegrias e tristezas e por estarem sempre dispostas a ouvir e ajudar.
À Míriam, por ser uma criatura iluminada que me ajudou, incondicionalmente e me transmitiu muitas lições de amizade, carinho, seriedade, profissionalismo e principalmente humildade e amor ao próximo.
À Juliana e Roberta, pela ajuda, pela alegria e palavras de carinho e estímulo nos momentos mais difíceis.
A todos que fazem parte da minha história no LIP: Tati, Joana, Denise, Renata, Laura, Sebastião, Wilson, Cláudia, Daniel, Allysson, Márcia, Érica, Amanda, Roberta, Juliana, Cássio, Eduardo, Silvia, Beatriz, Simone, Leonardo, Jamile, Djalma, Guilherme, Tiago, Wagner e Elisângela. Obrigado pela grande ajuda, indispensável à concretização deste trabalho. Obrigada também pela amizade, carinho e alegria constante que tornam o LIP o melhor laboratório.
À Dani e Jailinha, grandes amigas, pela amizade, apoio e conselhos.
A todos da inesquecível turma de mestrado, Os Nupebmans : Ângelo, Marcelo, Dani, Graça, Lis, Ana, Jailinha, Helen, Marcos Vinicius, Dudu, Regina, Kátia, Jorgino, Jaqueline. Obrigado pela amizade e pelos momentos de descontração.
AGRADECIMENTOS ESPECIAIS
A
GRADECIMENTOSE
SPECIAISAgradeço a Deus, que me conduz com muita luz em todos os momentos.
Aos meus pais, Maria José e José Olinto, por me apoiarem em todas as decisões e pelas grandes lições de humildade, perseverança e respeito ao próximo, e, por sempre compreenderem minha ausência.
A Filinha e Almir por tornarem possível minha formação e pela grande presença em minha vida.
Aos meus familiares pelo carinho, torcida e força em todos os momentos.
A Leonor, Renato, Léo e Gabriela que me acolheram como membro da família e me deram muito carinho e apoio. Obrigada pelos inesquecíveis momentos de alegria, conselhos e principalmente carinho.
A Míriam pela ajuda indispensável com seu imensurável conhecimento e principalmente pela amizade e por compartilhar todos os momentos.
As minhas grandes amigas: Olívia, Carol, Pati e Sandrinha que estavam presentes em todos os momentos, sempre dispostas a ajudar. Obrigada pelos inesquecíveis anos de convivência e pela eterna amizade.
Aos queridos Frank e Abel, pelo carinho e pela grande amizade.
ÍNDICE
ÍNDICE
DEDICATÓRIA... IV
AGRADECIMENTOS... VI
AGRADECIMENTOS ESPECIAIS... VIII
LISTA DE FIGURAS E TABELAS... XI
RESUMO... XIII
ABSTRACT... XV
LISTA DE ABREVIATURAS... XVI
INTRODUÇÃO... 2
OBJETIVO GERAL... 20
OBJETIVOS ESPECÍFICOS... 22
MATERIAL E MÉTODOS... 24
RESULTADOS E DISCUSSÃO... 34
CONCLUSÃO... 61
LISTA DE FIGURAS E TABELAS
LISTA DE FIGURAS E TABELAS
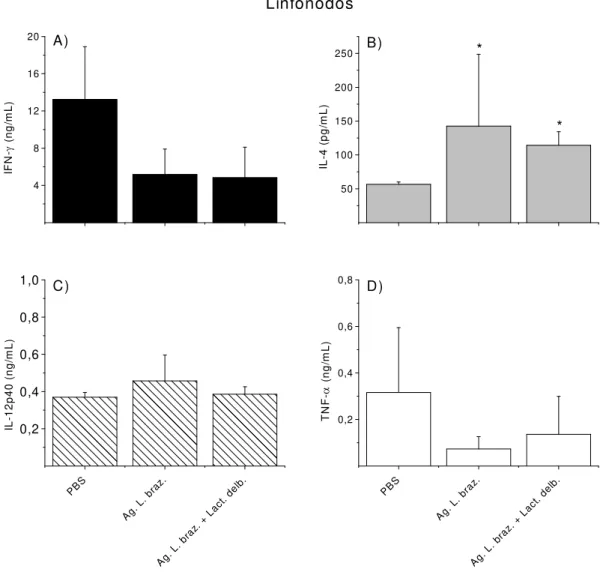
Figura 1 Avaliação da produção de citocinas por esplenócitos de camundongos BALB/c
induzida por diferentes doses de Lact. delbrueckii morto pelo calor... 36
Figura 2 Avaliação da produção de citocinas por células de linfonodos de camundongos
BALB/c inoculados com Lact. delbrueckii ... 39
Figura 3 Avaliação da produção de citocinas por esplenócitos de camundongos BALB/c inoculados com Lact. delbrueckii ... 40
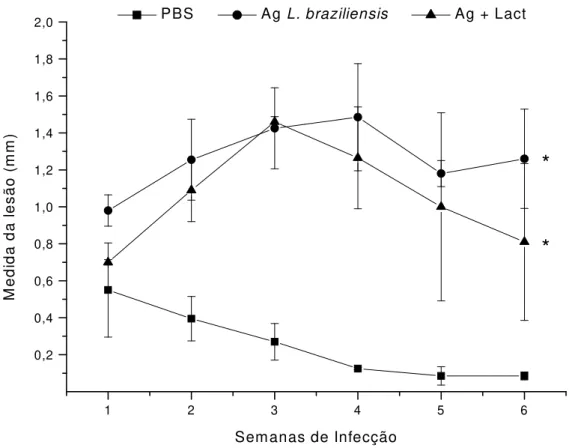
Figura 4 Desenvolvimento de lesão em camundongos imunizados com Lact. delbrueckii
na presença ou ausência de antígeno de L. braziliensis....43
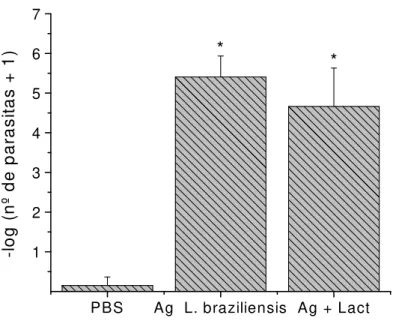
Figura 5 Quantificação de parasitas na lesão em camundongos imunizados com Lact. delbrueckii na presença ou ausência de antígeno de L. braziliensis... 44
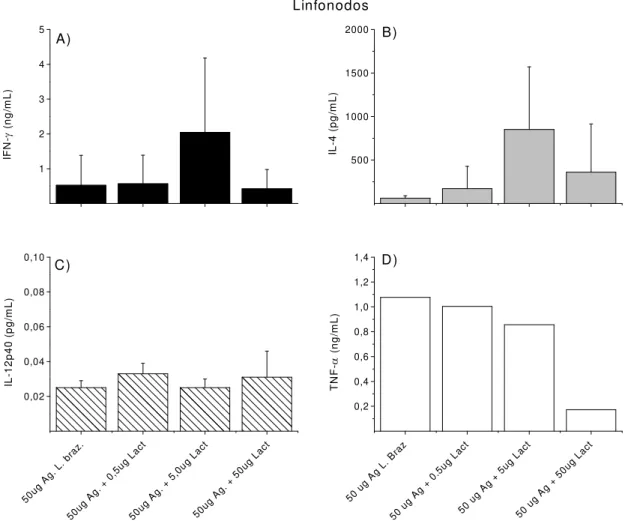
Figura 6 Avaliação da produção de citocinas por células de linfonodos de camundongos
BALB/c inoculados com antígeno de L. braziliensis em presença ou não de Lact.
delbrueckii... 46
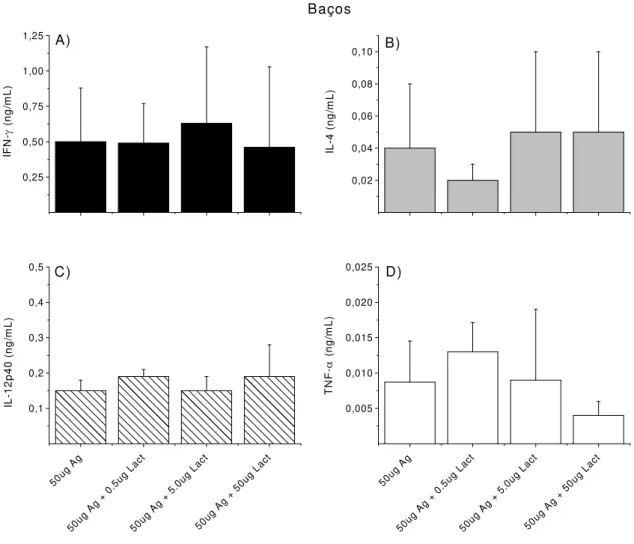
Figura 7 Avaliação da produção de citocinas por células de baços de camundongos
BALB/c inoculados com antígeno de L. braziliensis em presença ou não de Ldmc... 47
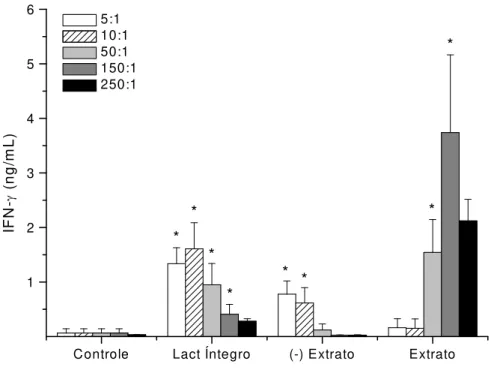
Figura 8 Avaliação da capacidade do Extrato de Parede do Lact. delbrueckii em
diferentes doses de induzir a produção de IFN- por esplenócitos de camundongos
BALB/c... 52
LISTA DE FIGURAS E TABELAS
Figura 10 Eletroforese em Gel de Poliacrilamida em Presença de Duodecil Sulfato de Sódio SDS PAGE do Ldmc íntegro e do seu Extrado de Parede... 55
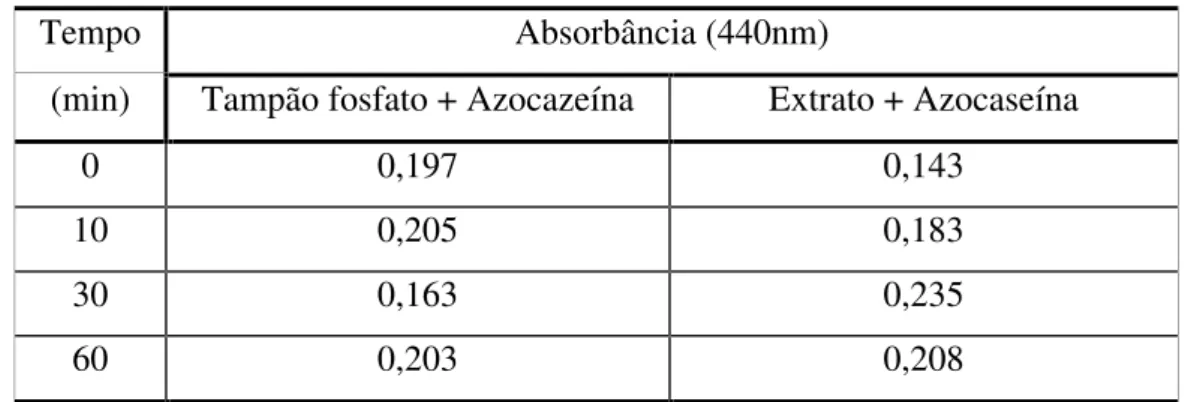
Tabela 1 Determinação da Atividade Proteásica (0-60 minutos)... 56
Tabela 2 Determinação da Atividade Proteásica (0-120 minutos)... 56
Figura 11 Avaliação da capacidade imunoestimulante do Extrato de Parede do Ldmc concentrado em esplenócitos de camundongos BALB/c... 58
RESUMO
Resumo
Um dos grandes desafios na formulação de uma vacina efetiva contra Leishmania é
a descoberta de um adjuvante com efeito imunomodulador que direcionem a resposta imune a um perfil de resistência aos parasitas, uma vez que as vacinas testadas até o momento não apresentam eficácia apropriada.
O Lactobacillus delbrueckii UFV H2b20 já teve seu efeito imunomodulador
comprovado em camundongos, induzindo produção de IL-12, IFN- e TNF- in vitro, e
aumentando o poder de eliminação de Escherichia coli patogênica por esses animais. Em
células mononucleares do sangue periférico humano de voluntários sadios, induziu a
produção de IL-12, IFN- e TNF- e estimulou a ativação de mecanismos efetores da
imunidade inata, levando à diferenciação de linfócitos T virgens em linfócitos Th1
específicos para antígeno de Leishmania amazonensis.
Neste trabalho, verificou-se a capacidade do Lact delbrueckii de proteger
camundongos BALB/c contra infecção por Leishmania braziliensis, funcionando, assim,
como adjuvante indutor de uma resposta que levaria a eliminação desse parasita.
Verificou-se que o Lact delbrueckii induziu a produção, in vitro, de altos níveis de IL-12, IFN- e
TNF- por esplenócitos de camundongos BALB/c. Porém, quando inoculado na presença
de antígeno de L. braziliensis, essa bactéria não foi capaz induzir proteção aos
camundongos contra a inoculação de formas infectantes desse parasita. Esse resultado pode
ser explicado pela indução concomitante da citocina IL-10 pelo Lact delbrueckii, o que
ocasionaria uma supressão da resposta protetora.
Diante dessas constatações, decidiu-se isolar a molécula do Lact delbrueckii
responsável pela indução da produção de IL-12. Para isso, obteve-se um extrato de parede
dessa bactéria. Esse extrato induziu IFN- , in vitro, de uma maneira peculiar e distinta à
RESUMO
Esses resultados demonstram a importância em se efetivarem estudos mais
detalhados com o Lact. delbrueckii e outras bactérias probióticas no sentido de caracterizar
ABSTRACT
Abstract
One of the greatest challenges in the formulation of a vaccine against Leishmania
parasites is the discovery of an adjuvant capable of enhancing the efficacy of the vaccine.
Lactobacillus delbrueckii UFV H2b20 presents an immunomodulatory effect
already known in mice where it induces IL-12, IFN- and TNF- production in vitro, and
increases the clearance of pathogenic Escherichia coli in these animals. In mononuclear
cells of the human peripheral blood of healthy volunteers, it induced the IL-12 production
IFN- and TNF- and stimulated the activation of effectors mechanisms of the innate
immunity, leading to the differentiation of naive T lymphocytes in Leishmania
amazonensis specific Th1 lymphocytes.
In this work, we decided to verify the capacity of the Lact delbrueckii to protect
mice BALB/c against infection for Leishmania braziliensis, acting, thus, as an adjuvant
inductor of a response that would control this parasite. It was verified that Lact delbrueckii
induced the production, in vitro, of high levels of IL-12, IFN- and TNF- for splenocytes
from mice BALB/c. However, when inoculated in the presence of L. braziliensis antigen,
this bacterium was not able to induce protection in the mice against the inoculation of infective forms of this parasite. This result could be explained by the concomitant induction
of IL-10 by Lact delbrueckii, that could cause a suppression of the protective response.
We also decided to isolate the molecule that was responsible for the induction of the
IL-12 production by the Lact delbrueckii. For this, an extract of the cell wall of this
bacterium was prepared. This extract induced IFN- , in vitro, in a peculiar and distinct way to the complete bacterium. The analysis of this extract demonstrated that the probable immunomodulatory molecule may be a low molecular weight carbohydrate.
These results demonstrate the importance of more detailed studies with Lact.
LISTA DE ABREVIATURAS
LISTA DE ABREVIATURAS
ABTS Ácido 2,2`-bio-azino-3-etilbenzil-tiazol-6-sulfônico
Ag Antígeno
BAL Bactérias produtoras de ácido lático
BCG Mycobacterium bovis Bacillus Calmette-Guérin
CMSP Células mononucleares do sangue periférico
ConA Concanavilina A
DC Células dendríticas
DMEM Dulbecco`s modified eagle medium
DNA Ácido desoxiribonucleico
ELISA Enzime linked immunosorbent assay
ETA Osteopontina responsável pela ativação precoce de linfócitos T
GPI Glicosilfosfatidilinositol
HCl Àcido clorídrico
HEPES N-2-hydroxyethylpiperazine-N`-2-ácido-etanosulfônico
IFN Interferon
Ig Imunoglobulina
IL Interleucina
IRF Fatores reguladores de Interferon
Lact Lactobacillus
Ldmc Lactobacillus delbrueckii UFV H2b20 morto pelo calor
L. braziliensis Leishmnia (Viannia) braziliensis
LPG Lipofosfoglicano
LPS Lipopolissacarídeo
LTA Ácido lipoteicóico
MHC Complexo de histocompatibilidade principal
MPL
Monofosforil lipídio
MRS De Man, Rogosa e Sharp
LISTA DE ABREVIATURAS
NF-kB Fator nuclear kappa B
NK Célula natural Killer
NO Óxido Nítrico
PAMP Padrões moleculares associados a patógenos
PBS Salina tamponada com fosfato
PRR Receptores de reconhecimento de patógenos
QuilA Adjuvante derivado da Quilaja saponaria Molina
QS21 Saponina extraída da Quilaja saponaria Molina
RNA Ácido ribonucléico
RNAm RNA mensageiro
PVDF Polifluoreto de vinilideno
RSV Vírus Sincitial Respiratório
RSV F Glicoproteína de superfície do vírus RSV
SDS Dodecil sulfato de sódio
SDS PAGE Eletroforese em Gel de Poliacrilamida em Presença de Duodecil
Sulfato de Sódio
SFB Soro fetal bovino
TCD4+ Linfócitos auxiliares CD4+
TCD8+ Linfócitos citotóxicos CD8+
TGF Fator de transformação do crescimento
TLR Receptores do tipo TOLL
TNF Fator de necrose tumoral
TRIS Tris (Hydroxymethyl) aminomethane
Tween 20 Polioxietilenosorbitano monolaurato
UFC Unidade bacteriana formadora de colônia
LISTA DE ABREVIATURAS
INTRODUÇÃO
Introdução
A leishmaniose é uma doença caracterizada por manifestações clínicas que variam de lesões na pele a infeção fatal de órgãos internos. Essa patologia é prevalente nos quatro continentes e estima-se que 350 milhões de pessoas estão sob risco de infecção por
parasitas do gênero Leishmania em 88 países no Mundo, estando o Brasil entre estes países.
É considerada uma patologia com grande impacto econômico e social uma vez que diminui
a vitalidade e produtividade necessárias ao desenvolvimento (World Health Organization,
2005). Portanto, fazem-se necessárias amplas medidas de controle.
Essas medidas gerais de controle devem ocorrer em níveis de atuação, tais como o
controle do inseto vetor e dos animais reservatórios. O controle do vetor e dos reservatórios, embora possíveis de serem executados com êxito em determinadas condições, não são aplicados à grande variedade epidemiológica e requerem infra-estrutura e vigilância que são incompatíveis à capacidade de muitos países onde a doença é endêmica. Portanto, a prioridade em programas que visam o combate da leishmaniose é o desenvolvimento de uma vacina segura e efetiva para a prevenção dessa doença. Entretanto, até o momento, não existe vacina efetiva para nenhuma forma clínica de leishmaniose. Nesse sentido, vários testes vêm sendo conduzidos na tentativa de obtenção de uma formulação eficiente.
Adjuvantes usados na formulação de vacinas são importantes para o direcionamento
efetivo da resposta imune e têm sido o foco dos estudos, devido a sua evidente proteção demonstrada com utilização do modelo murino.
Um dos grandes desafios na formulação de uma vacina efetiva contra Leishmania é
exatamente a descoberta de adjuvantes com efeito imunomodulador que direcionem a resposta imune a um perfil de resistência aos parasitas, uma vez que as vacinas testadas até o momento não apresentam eficácia apropriada (Modabber, 2000).
Trabalhos anteriormente desenvolvidos em nosso laboratório utilizando células mononucleares do sangue periférico (CMSP) de voluntários sadios permitiram inferir que o
INTRODUÇÃO
específicos para antígeno de Leishmania amazonensis, funcionando, assim, como adjuvante
na indução de uma resposta protetora contra o parasita.
Considerando esses dados, bem como outros da literatura que evidenciam a
utilização de probióticos na ativação do sistema fagocitário mononuclear, in vitro e in vivo,
analisou-se neste trabalho a ação do Lact. delbrueckii sobre a resposta imune, in vivo, a
antígenos de parasitas utilizando-se camundongos BALB/c inoculados com antígeno de
Leishmania (Viannia) braziliensis em presença ou não dessa bactéria, objetivando estudar o o seu efeito na modulação da produção de citocinas por células de linfonodos e baços, e sua possível utilização em processos de imunização contra leishmaniose.
E, com o objetivo de caracterizar as vias de modulação do sistema imune murino
pelo Lact. debrueckii, tendo em vista os numerosos e distintos efeitos de constituintes
celulares dos Lactobacillus, seguiu-se à execução de estudos a fim de caracterizar a
molécula do Lact. delbrueckii responsável por seus efeitos imunomoduladores em
camundongos BALB/c.
Leishmaniose
A leishmaniose é uma doença parasitária causada por várias espécies de
protozoários unicelulares digenéticos pertencentes à ordem Kinetoplastidae, família
Trypanosomatidae e gênero Leishmania. Tods as espécies são do gênero são parasitas intracelulares obrigatórios no hospedeiro vertebrado (Molyneux & Killick-Kendrick, 1987). Os parasitas apresentam dois estágios principais em seu ciclo de vida: as formas promastigotas, alongadas e com flagelo bem desenvolvido, que se reproduzem no trato digestivo dos insetos transmissores, e as formas amastigotas, sem flagelo aparente, arredondadas ou ovaladas, que se multiplicam no interior do vacúolo parasitóforo de
macrófagos em hospedeiros mamíferos (Mendonza-Léone cols., 1996).
Existem pelo menos cinco formas clínicas distintas da doença, causadas por
diferentes espécies de Leishmania, em associação com a resposta desenvolvida pelo
INTRODUÇÃO
Leishmania braziliensis e modelo experimental
A Leishmania braziliensis causa uma doença que é um sério problema de saúde pública na América do Sul. Clinicamente, a infecção humana com esse parasita apresenta-se como única ou múltiplas lesões cutâneas, com uma pequena porcentagem (2-5%) de
indivíduos progredindo para a forma mucosa (Barral-Nettoe cols., 1998). Enquanto a lesão
cutânea cura espontaneamente ou responde bem ao tratamento, a forma mucosa apresenta lesões desfigurantes, recorrentes e é refratária ao tratamento, portanto é uma forma grave
(Barral e cols., 1993). Embora a L. braziliensis seja importante, poucos trabalhos
experimentais têm sido realizados para caracterizar a reposta imune contra esse parasita.
Estudos sobre aspectos imunoregulatórios de infecção pelo parasita L. braziliensis são
escassos principalmente devido às dificuldades no estabelecimento de um modelo murino
(Barral e cols., 1993; Ramirez & Guevara, 1997), talvez porque esse patógeno em
particular, seja pouco infectante pra camundongos normais. Nesses modelo, L. braziliensis
induz uma lesão pequena, nodular que nunca ulcera e é caracterizada por uma resposta do padrão Th1 em todas as espécies de camundongos normalmente utilizadas no estudo da
leishmaniose (DeKrey e cols., 1998). O hamster quando inoculado com L. braziliensis
desenvolve lesões características facilmente. Entretanto, estudos com esse modelo
experimental são limitados principalmente pela falta de reagentes imunológicos (Melby e
cols., 2001), o que pode comprometer a interpretação dos resultadoNesse sentido, esforços têm sido concentrados no estabelecimento de um protocolo de infecção capaz de
desenvolver susceptibilidade em camundongos frente a infecção por L. braziliensis com o
objetivo de caracterizar os mecanismos imunológicos envolvidos na infecção humana por esse parasita.
Resposta imune à Leishmania
A infecção humana ocorre quando há inoculação de formas promastigotas na derme
pela picada do inseto fêmea infectado. Esse inseto pertence aos gêneros Phlebotomus, no
INTRODUÇÃO A interação inicial das formas promastigotas com as células do sistema imune ocorre principalmente com eosinófilos, neutrófilos e componentes do soro, especialmente
do sistema complemento (Mendonza-Léon e cols., 1996). Nesse primeiro contato,
aproximadamente 90% das promastigotas são lisadas, liberando assim, uma variedade de antígenos que estarão disponíveis para as células dendríticas (DC) residentes presentes na derme. As DC são as principais células apresentadoras de antígenos do parasita, e são responsáveis pela ativação de uma resposta imune primária. As formas que escapam ao ataque lítico se ligam a receptores específicos nos macrófagos, e são internalizadas por fagocitose mediada por receptor (Mosser & Rosenthal, 1993).
Após internalização dos antígenos pelas células dendríticas, estas se tornam maduras e migram para os linfonodos que drenam o local da infecção. Neste processo, sofrem mudanças fenotípicas e funcionais, incluindo aumento da expressão de moléculas tais como MHC, co-estimuladoras e de adesão, e produção de mediadores solúveis denominados citocinas, através dos quais as células do sistema imune interagem entre si. As DC produzem citocinas reguladoras da resposta imunológica como IL-12 e IL-10
(Banchereau & Steinman, 1998; Cella e cols., 1997; Kelsall e cols., 2002; Kelsall &
Strober, 1997).
Essas características tornam as DC capazes de fornecer sinais para a expansão
clonal das células T e também dirigir a diferenciação de células T CD4+ para os subtipos
Th1 ou Th2. De acordo com o perfil de citocinas que produzem, as DC podem ser divididas em dois grupos: mielóides (DC1), que produzem grande quantidade de IL-12 e induzem a
diferenciação de células T CD4+ Th0 em Th1, e linfóides (DC2), que secretam altos níveis
de IL-10 e TGF- e baixos níveis de IL-12, induzindo a diferenciação de células T CD4+
Th0 em Th2 (Rissoane cols., 1999). Assim, células dendríticas possuem um papel central
nas respostas imunológicas por primar a imunidade adaptativa.
INTRODUÇÃO durante a resposta imune inata e fornecem sinais acessórios necessários para o direcionamento da imunidade adaptativa. Os receptores TLR compreendem uma família de proteínas caracterizadas por uma porção extracelular rica em leucina que exibe grande diversidade e é necessária para o reconhecimento de diferentes moléculas. TLR também possuem uma porção citoplasmática altamente conservada (TIR), através da qual um grupo de proteínas denominadas adaptadoras conecta os TLR à maquinaria de sinalização intracelular. Assim, a ligação de componentes dos microrganismos aos TLR induz a ativação das proteínas adaptadoras que desencadeia à rápida ativação de fatores de transcrição gênica, como o fator nuclear kappa B (NF- B) e os fatores reguladores de IFN (IRF), fatores de transcrição citoplasmáticos latentes que, uma vez ativados, translocam-se para o núcleo e induzem a expressão de vários genes envolvidos na resposta imunológica, incluindo genes que codificam citocinas, quimiocinas, moléculas de MHC e
co-estimuladoras (Miettinene cols., 2000; Medzhitov, 2001).
Até o momento, foram identificados onze TLR (TLR1 a TLR11) em mamíferos, bem como várias moléculas capazes de ativar esses receptores. O TLR2 (que atua sinergicamente com TLR1 e TLR6) está envolvido no reconhecimento de peptideoglicano de bactérias Gram-positivas, lipoproteínas bacterianas, lipoarabinomanose (constituinte da
parede celular de micobactérias), glicosilfosfatidilinositol (GPI) de T. cruzi,
lipopolissacarídeo-LPS (produzido por Leptospira interrogans e Porphyromonas gingivitis)
e zimosan (componente da parede celular de leveduras); TLR4 reconhece LPS de bactérias Gram-negativas, ácido lipoteicóico (LTA) de bactérias Gram positivas e uma proteína viral denominada RSV F; TLR3 se liga principalmente ao RNA viral; TLR5 reconhece a flagelina bacteriana e TLR9 reconhece DNA bacteriano contendo motivos CpG não metilados (Medzhitov, 2001).
Sabe-se que o reconhecimento dos PAMP por diferentes TLR induz vias de sinalização distintas, o que leva a expressão diferencial de determinados genes para citocinas. A primeira evidência de que a expressão gênica de citocinas é distintamente
regulada por vários TLR foi obtida de estudos usando macrófagos murinos (Hirschfeld e
INTRODUÇÃO enquanto TLR2 induz IL-8, IL-10 e IL-23p19. Essas citocinas diferencialmente induzidas por TLR2 e TLR4 são importantes para o estabelecimento e manutenção de um balanço Th1/Th2, sugerindo que TLR diferem em sua capacidade de influenciar a diferenciação de células T. Sabe-se, ainda, que um microrganismo íntegro pode, simultaneamente, ativar diferentes TLR presentes nas DC e macrófagos, gerando um mecanismo de sinergismo ou antagonismo na indução de determinadas citocinas (Re & Strominger, 2004).
Os eventos responsáveis pela resistência ou susceptibilidadea Leishmania ocorrem
nas fases iniciais da infecção e parecem envolver elementos do sistema imune inato que desencadeiam o desenvolvimento de células Th1 e Th2 específicas (Chatelain e cols., 1992; Sypek e cols., 1993). Assim, moléculas como lipofosfoglicano (LPG) e GPI, presentes na
superfície de parasitas do gênero Leishmania, são capazes de se ligar aos TLR presentes em
DC e em células natural killer (NK), ativando vias de sinalização que translocam o fator
NF- B para o núcleo, fazendo com que haja ativação dos genes responsáveis pela síntese
de citocinas (Karin & Ben Neriah, 2000; Murphye cols., 1995) que direcionam a resposta
imune mediada pelas células T. Essa resposta é fundamental à eliminação desse parasita.
Clones de células T CD4+ Th1 ou Th2 ativados pelas DC produzem citocinas
distintas (Mosmann & Coffman, 1989; Mosmann e cols., 1986; Romagnani, 1991) cujo
balanço determinará a resistência ou susceptibilidde à leishmaniose experimental (Scott,
1989). As células Th1 produzem IL-2 e IFN- e estão envolvidas na resposta imune
mediada por células, como a reação de hipersensibilidade tardia e a eliminação de
patógenos intracelulares, devido a produção de IFN- e conseqüente ativação de
macrófagos. As células Th2 produzem IL-4, IL-5, IL-13 e IL-10 e estão envolvidas na indução da resposta humoral e fenômenos de eosinofilia mediados por IL-4.
A imunidade adquirida protetora contra leishmaniose usualmente é dependente da
capacidade do hospedeiro montar uma resposta com predominância de células T CD4+ Th1
(Afonso e cols., 1994). As vias imunológicas que levam ao desenvolvimento de uma doença progressiva, sem cura, são menos caracterizadas e controversas. De acordo com vários trabalhos, diversos mecanismos imunológicos podem contribuir para uma resposta
que não leva à cura em infecção por Leishmania sp: uma resposta Th2 dirigida por IL-4,
INTRODUÇÃO
uma resposta Th2 junto com uma resposta Th1 (Kaye e cols., 1991); ausência de uma
resposta Th1, independente da presença de uma resposta Th2 (Afonso & Scott, 1993;
Satoskar e cols., 1995); a falha em produzir ou responder a IL-12 (Guler e cols., 1996;
Kropf e cols., 1997; Wang e cols., 1994). Entretanto, as observações acima podem ser
decorrentes dos sistemas experimentais utilizados, onde a espécie do parasita e as linhagens de camundongos examinadas poderiam determinar o distinto perfil de resposta desenvolvido.
Em um estudo recente realizado por Anderson e cols. (2005), demonstrou-se que
camundongos são susceptíveis a determinadas espécies de Leishmania mesmo na presença
de uma forte resposta Th1, caracterizada por altos níveis de IFN- e ausência de 4 e
IL-13, citocinas características de um perfil Th2. Este trabalho mostrou que esta resposta deve-se a predeve-sença de citocinas reguladoras, principalmente IL-10. Essa citocina atua na regulação das respostas inflamatórias, suprimindo a função antimicrobian e tumoricida dos macrófago através de duas vias: I) inibição da produção da citocina IFN- pelas células Th1
através da inibição da produção de IL-12) e II) inibição da ação do IFN- nos macrófagos
(Bogdan e cols., 1991). Além disso, a IL-10 diminui a apresentação de antígenos, por
bloquear a translocação do complexo MHC-II-antígeno para a membrana (De Smedt e
cols., 1997). Assim, a IL-10 é uma citocina que inibe a montagem de uma resposta
inflamatória adequada, responsável pela eliminação de parasitas (Bhattacharyya e cols.,
2001; Viana e cols., 2002). Esses dados fornecem fortes evidências de que a
susceptibilidade à infecção por Leishmania não pode ser explicada pela presença de uma
forte resposta Th2, mas sim pela ativação excessiva de vias homeostáticas envolvidas no controle da resposta inflamatória.
Quanto ao mecanismo de resistência, como mencionado, na fase da imunidade inata
há produção de IL-12 por DC ou macrófagos. A IL-12 estimula as células NK, as quais
sintetizam IFN- , que é produzido também pelas células Th1 ativadas. O IFN- liga-se a
TNF-INTRODUÇÃO induz a produção de NO pelos macrófagos, principal composto responsável pela eliminação
do parasita (Gantte cols., 2001).
Vacinação contra leishmaniose
A aquisição de uma imunidade protetora após infecção com parasitas do gênero
Leishmania, tanto no homem, quanto nos animais, permite supor ser possível o desenvolvimento de uma vacina protetora contra leishmaniose.
Vacinas direcionadas a doenças infecciosas podem ser elaboradas com microrganismos vivos atenuados ou microrganismos mortos, sendo que, no último caso, muitas vezes são usadas frações deste. Vacinas com microrganismos mortos ou suas frações são as preferidas, devido à segurança oferecida pelas mesmas, inclusive para indivíduos imunocomprometidos. Porém, normalmente esse tipo de vacina possui imunogenicidade menor, requerendo o uso de um adjuvante que será necessário para ativar e direcionar a resposta imune inata e adaptativa aos antígenos da vacina (Schijns, 2003).
A vacinação contra leishmaniose cutânea tem sido praticada há séculos. A inoculação de organismos virulentos obtidos de lesões ativas é uma prática antiga
(Handman, 2001). Promastigotas de L. major crescidas em meio de cultura foram
primeiramente utilizadas na Rússia em 1937 para induzir proteção contra a infecção natural. Posteriormente, inóculos padronizados de promastigotas obtidos de cultura foram desenvolvidos por cientistas israelenses e usados em vários testes (Greenblatt, 1980). Esse processo, conhecido como leishmanização , é ainda utilizado em alguns países (Modabber, 2000); porém, há vários problemas relacionados, incluindo, principalmente, dificuldade no estabelecimento de uma vacina com baixa virulência, que não ocasione
lesões persistentes no local do inóculo (Nadime cols., 1983).
A vacinação utilizando preparações antigênicas obtidas de formas promastigotas de
várias espécies de Leishmania tem sido testada contra leishmaniose cutânea e visceral em
ensaios clínicos no Velho e Novo Mundo.
No Brasil, as primeiras experiências bem sucedidas foram realizadas por Mayrink e
INTRODUÇÃO diferentes áreas do Brasil, de diferentes formas clínicas, e cuja eficácia foi testada
utilizando-se voluntários humanos (Mayrinke cols., 1979; Mayrink e cols., 1985; Antunes
e cols., 1986).
A partir dos resultados obtidos, esforços foram concentrados na produção de uma vacina melhor adaptada à experimentação humana, que pudesse ser produzida em larga
escala. Então, essa vacina passou a ser produzida somente com uma cepa de L.
amazonensis (IFLA/BR/67/PH8), com o nome comercial de Leishvacin, pela BIOBRÁS
S/A (Genaro e cols., 1996). Mostrou-se segura para uso humano, uma vez que, após a
administração de duas doses, não houve ocorrência de efeitos colaterais (Marzochie cols.,
1998). Além disso, Genaro e cols. (1996) demonstraram que a Leishvacin foi capaz de modificar a viragem do teste de Montenegro para positivo, além de aumentar a proliferação
celular e a produção de IFN- em relação ao placebo. Os resultados obtidos foram
encorajadores, apesar da proteção conferida por essa vacina não ser completamente eficaz.
É sabido que uma vacina ideal contra leishmaniose deve, entre outras ações, ser
efetiva na prevenção da leishmaniose e induzir a diferenciação de linfócitos Th1 específicos.
Um revisão recentemente publicada sugere que uma vacina denominada de segunda geração , obtida com uma mistura que inclui várias moléculas que são,
preferencialmente, conservadas entre as diferentes espécies de Leishmania e expressas em
grande quantidade pela forma amastigota do parasita, é bastante promissora, uma vez que, além de induzir uma resposta protetora em humanos e animais, também é segura para uso humano (Coler & Reed, 2005). Essa revisão mostra, ainda, que a ação protetora dessas moléculas depende de sua combinação com determinados adjuvantes, já que estes direcionam a resposta do hospedeiro para um perfil de resolução da infecção.
INTRODUÇÃO de adjuvantes em vacinas, como toxicidade e efeitos colaterais. Sendo assim, um adjuvante ideal deve apresentar um equilíbrio entre a ação adequada e efeitos colaterais aceitáveis, ou seja, deve apresentar máxima estimulação da resposta imune e efeitos colaterais mínimos (Gupta & Siber, 1995).
Uma vez que a resposta imune protetora contra leishmaniose é caracterizada pela
produção inicial de IL-12 (Sypeke cols., 1993), deve-se ter em mente que é recomendável
o uso adjuvantes capazes de induzir a produção dessa citocina, assim como suprimir ou não induzir a produção de citocinas anti-inflamatórias, como a IL-10. Vários adjuvantes já foram testados na produção de uma vacina contra leishmaniose, como BCG e agonistas dos receptores TLR. Além disso, os probióticos constituem candidados promissores a uso como adjuvantes, uma vez que possuem ação compovada no sistema imune inato humano e murino, induzindo a produção de IL-12.
O BCG foi testado como adjuvante para vacinação contra Leishmania em vários
estudos e, apesar de induzir produção de IFN- e proliferação celular, não há, ainda,
conclusões sobre seu efeito protetor (Castes e cols., 1994; Bahar e cols., 1996; Convit,
1996; Dowlati e cols., 1996; Momeni e cols., 1999). Outro candidato a adjuvante testado
em camundongos foi a própria IL-12, que demonstrou eficácia no aumento da resposta protetora da vacina. Porém sua utilização em larga escala seria inviável, devido ao seu alto
custo (Afonsoe cols., 1994).
Várias outras substâncias têm sido avaliadas em modelos animais, a fim de se aumentar a resposta Th1 e, conseqüentemente, a eficácia da vacina. Essas substâncias
incluem agonistas dos TLR como o monofosforil Lipídio A (MPL ) e o CpG (Coler &
Reed, 2005); o QuilA, um adjuvante comercial presente no extrato aquoso da Quilaja
saponaria Molina (Santos e cols., 2002) bem como a saponina QS21 obtida desse extrato
(Aebischer e cols., 2000; Santos e cols., 2002); a osteopontina ETA-1, responsável pela
INTRODUÇÃO
Probióticos e modulação do sistema imune
Um adulto normal abriga uma massa bacteriana equivalente à aproximadamente 1,2 kg, sendo que a maior parte se concentra na luz intestinal, e o restante distribui-se na pele,
cavidades rinoorofaríngeas e trato genital. O número total de bactérias, em torno de 1014,
excede o número total de células do corpo humano, e é constituído por cerca de 600 a 1000 espécies, na sua maioria anaeróbias e microaerófilas, Gram-positivas e Gram-negativas (Bocci, 1992; Conway, 1995). O grande número e a enorme diversidade de microrganismos habitantes das superfícies e mucosas humanas representam complexos ecossistemas constituídos de vários elementos em equilíbrio.
Segundo Sander a cols. (2000), em raras ocasiões microrganismos desenvolvem uma relação patogênica com o hospedeiro, resultando no estabelecimento de doença ou morte. Por outro lado, diferenças entre animais convencionais e isentos de germes demonstram que a colonização microbiana tem importantes efeitos benéficos para a saúde, como proteção ecológica, imunoestimulação e contribuição nutricional.
Dentre os microrganismos pertencentes a microbiota normal com evidente função benéfica ao organismo estão as bactérias do ácido lático (BAL). As BAL habitam o trato intestinal de vários organismos, incluindo humano, suíno e de roedores (Tannock, 1995). Filogeneticamente, BAL pertencem ao grupo de bactérias Gram-positivas, sem motilidade, não formadoras de esporos, aerotolerantes e que fermentam hexoses a ácido lático
(Adamberg e cols., 2003). A partir do ácido lático, essas bactérias podem produzir uma
variedade de outras substâncias, incluindo bacteriocinas, peróxido de hidrogênio e ácidos orgânicos, que podem causar inibição do crescimento de outros microrganismos (van de
Guchtee cols., 2001).
As BAL são importantes na indústria alimentícia devido a seu papel na fermentação de alimentos, especialmente produtos lácteos. Vários estudos mostram que BAL exibem uma variedade de efeitos fisiológicos e terapêuticos, incluindo estimulação da resposta
imune e supressão do crescimento de patógenos (Fuglsang e cols., 2002; Klaenhammer,
INTRODUÇÃO
Bifidobacterium, Streptococcus, Enterococcus, Leuconostoc e Pediococcus (Mombelli & Gismondo, 2000), mas apenas a respeito dos dois primeiros é que se apresentam estudos e dados consistentes.
O reconhecimento dos efeitos da colonização microbiana no corpo humano, juntamente com a combinação de esforços para evidenciar as atividades positivas dos microrganismos comensais, incluindo as BAL, levou à teoria probiótica.
O termo probiótico significa para a vida e é derivado do idioma grego. Foi utilizado pela primeira vez por Lilly e cols. (1965) para descrever substâncias produzidas por um microrganismo que estimulam o crescimento de outro. Desde então, o conceito de probióticos vem sendo reformulado na tentativa de incluir suas amplas características e aplicações clínicas.
Segundo Schrezenmeir e cols. (2001), probióticos são preparações contendo determinados microrganismos viáveis e em número suficiente, que alteram a microbiota em um compartimento do hospedeiro, exercendo, para este, efeitos benéficos.
No entanto, para incluir as amplas aplicações e dados científicos recentes que mostram a ação benéfica de microrganismos mortos ou de seus componentes celulares, Salminen e cols. (1999) propõem a seguinte definição para probióticos: preparações ou componentes de células microbianas que possuem um efeito benéfico na saúde e bem estar do hospedeiro . Essa definição é compatível com vários estudos que demonstram que a
viabilidade não é necessária para todos os efeitos dos probióticos (Salminene cols., 1998;
Ouwehand & Salminen, 1998; Saavedra, 1995).
Para um microrganismo ser considerado um probiótico efetivo, ele deve apresentar características (não necessariamente todas) como: ser de origem humana; ser resistente a destruição por processamento térmico, pela bile e pelo suco gástrico; aderir ao epitélio intestinal; ser capaz de colonizar o trato gastrointestinal, mesmo que temporariamente; produzir substâncias antimicrobianas; influenciar atividades metabólicas humanas (metabolismo do colesterol, produção de vitamina, digestão da lactose, etc.) e modular o
sistema imune (Collins & Gibson, 1999; Dunnee cols., 2001; Teitelbaum & Walker, 2002).
INTRODUÇÃO nocivos à saúde e ao bem estar do hospedeiro (Ishibashi & Yamazaki, 2001; Guarner &
Schaafsma, 1998; Salminene cols., 1999).
Efeitos benéficos associados aos microrganismos probióticos são: diminuição do colesterol sérico e da reabsorção de compostos aminados indesejáveis; aumento da absorção de minerais como cálcio, ferro e magnésio; liberação de enzimas que favorecem o metabolismo de algumas substâncias como a lactose; aumento da resistência natural a doenças infecciosas do trato intestinal; supressão do câncer e estimulação do sistema imune
(Fuller, 1989; Gonzalez e cols., 1995; Saavedra, 1995; Gibson & Roberfroid, 1995). Para
isso, são propostos mecanismos de ação que incluem: atividade antimicrobiana; capacidade de resistência e colonização; efeitos antimutagênicos; influência na atividade enzimática; liberação de enzimas e modulação da resposta imune (Sanders, 2000).
Nesse sentido, probióticos têm sido usados em humanos e animais como alternativa para controlar e tratar infecções, através da introdução no organismo de bactérias benéficas, viáveis ou não, para evitar o crescimento de microrganismos patogênicos.
O grupo dos probióticos inclui um crescente número de microrganismos, dentre os quais dois são particularmente estudados experimental e clinicamente: as BAL e leveduras.
As BAL mais comumente utilizadas como probióticos, são: gênero Lactobacillus
(Lact. rhamnosus, Lact. acidophilus, Lact. casei, Lact. delbrueckii subsp bulgaricus, Lact.
reuteri, Lact. brevis, Lact. fermetum, Lact. plantarum), gênero Bifidobacterium
(Bifidobacterium bifidum, Bifidobacterium adolescentis, Bifidobacterium infantis e
Bifidobacterium longum) e cocos Gram-positivos como Lactococcus lactis (Collins & Gibson, 1999; McFarland & Elmer, 1997).
A importância da microbiota intestinal na proteção imune tem sido intensamente estudada em modelos animais. Tem sido observado que a colonização do trato
gastrointestinal de roedores isentos de germes com lactobacilos exerce influência negativa
na colonização de microrganismos enteropatogênicos. Além disso, vários estudos em modelos animais sugerem que as propriedades imunomoduladoras dos probióticos podem
ser importantes para proteção contra infecções. Lact rhamnosus HN001 foi capaz de
reduzir a gravidade da infecção por Escherichia coli em modelo murino. Camundongos
INTRODUÇÃO mostraram aumento da atividade fagocítica dos leucócitos sanguíneos em relação aos camundongos controle, sugerindo que mecanismos imunes são importantes para proteção destes animais (Shu & Gill, 2002).
A grande maioria dos microrganismos probióticos com ação no sistema
imunológico são BAL Gram-positivas pertencentes aos gêneros Lactobacillus e
Bifidobacterium (Crosse cols., 2004).
Dentre os mecanismos pelos quais os probióticos podem influenciar o sistema imune do hospedeiro estão os efeitos na ativação de células da imunidade inata e direcionamento da resposta imune específica efetiva para controle de determinados patógenos.
Estudos mostram que probióticos ou seus componentes celulares podem ativar
células do sistema imune inato (Erickson & Hubbard, 2000; Saucier e cols., 1992;
Miettinen e cols., 1996), incluindo monócitos, macrófagos e DC, que são importantes na
ativação da resposta imune antígeno-específica, bem como na eliminação de patógenos. Vários estudos têm demonstrado a habilidade dos probióticos em modular a ativação de NF-kB e STAT presentes no citoplasma de DC e macrófagos, que, uma vez ativados, determinam a expressão de citocinas reguladoras da resposta imune a uma
variedade de patógenos (Klebanoffe cols., 1999; Miettinene cols., 2000).
Um importante aspecto resultante do estímulo das células do sistema fagocítico mononuclear pelos probióticos diz respeito à modulação da produção de citocinas, como
IL-12, TNF- , IFN e IL-10, por estas células. Foi demonstrada a produção de IFN- e
por macrófagos peritoneais murinos estimulados com Lact. acidophilus, e a expressão de
RNAm de IFN- em macrófagos estimulados com Lact. gasseri (Kitazawa e cols., 1992;
Kitazawa e cols., 1994). Além disso, a estimulação de CMSP com Lact. rhamnosus GG
induziu a produção de IFN- (Pohjavuori e cols., 2004). Outros estudos mostram que Lact.
casei Shirota induz produção de IL-12 e IFN- por esplenócitos murinos (Kato e cols.,
1999) e de IL-12 e TNF- por células J774A.1 (Crosse cols., 2004). Hessle e cols, (1999 e
2000) demonstraram que bactérias Gram positivas como Lact. plantarum, Lact. rhamnosus
INTRODUÇÃO altos níveis de IL-12 por CMSP de voluntários normais. Nesse estudo foi demonstrado
também que Lact. plantarum e Bifidobacterium adolescentis são capazes de induzir
produção de IFN- e proliferação de CMSP totais desses voluntários. Estudos realizados
com monócitos humanos estimulados in vitro com diferentes espécies de Lactobacillus e
Bifidobacterium mostraram que essas bactérias induzem alta produção de TNF- . Morita e
cols. (2002), estudando várias espécies e cepas de Lactobacillus, mostrou que todas as
bactérias testadas estimularam a secreção de IL-6, IL-12 e TNF- , e grande parte estimulou
também a produção de IL-10. Isso mostra que Lactobacillus podem ativar macrófagos para
secretar tanto citocinas pro-inflamatórias, quanto citocinas anti-inflamatórias.
No que diz respeito à produção de citocinas por DC induzidas pelos probióticos, sabe-se que diferentes espécies de BAL mostram distinta habilidade para induzir sua
expressão. Segundo Mohamadzadeh e cols. (2005), determinadas espécies de Lactobacillus
podem induzir a produção de IL-12 e IL-18, mas não de IL-10, gerando ativação e
proliferação de células Th1. Porém, segundo Christensen e cols. (2002), Lact. casei é um
potente indutor de IL-12, IL-6 e TNF- , enquanto Lact. reuteri é um pobre indutor de
IL-12 e inibidor da expressão de CD86 induzida por outras espécies de Lactobacillus. Além
disso, vários trabalhos mostraram que diferentes espécies de Lactobacillus e outros
probióticos podem induzir a produção de IL-10 por DC derivadas da medula óssea
(Christensen e cols., 2002; Hart e cols., 2004). Isso indica que diferentes espécies de
Lactobacillus podem determinar se a DC favorecerá o desenvolvimento de uma reposta Th1 ou Th2.
Além da produção de citocinas descrita anteriormente, a ativação do sistema
mononuclear fagocitário, in vitro e in vivo, é uma propriedade bem estabelecida para
diversas espécies de probióticos. Essa ativação é demonstrada pelo aumento da eliminação
de patógenos como a E. coli (Neumann e cols., 1998; Neumann e cols., 1996) ou de
partículas inertes como o carbono coloidal (Perdigone cols., 1988; Perdigone cols., 1986b;
Neumann e cols., 1998), pelo aumento da liberação de enzimas com atividade citostática
como a fosfatase ácida em camundongos tratados com Lact. casei (Katoe cols., 1983),
INTRODUÇÃO
mistura de Lact. casei e Lact. acidophilus (Perdigon e cols., 1986a), e pelo aumento da
produção de radicais oxigenados e óxido nítrico em células humanas expostas a
Bifidobacterium (Park e cols., 1999). Experimentos realizados in vitro também revelam
aumento da fagocitose de E. coli após administração de BAL (Schiffrine cols., 1995).
Além dos efeitos citados de ativação da capacidade fagocítica dos macrófagos, os probióticos também podem aumentar a eficiência do processo de apresentação de antígeno pelas DC. Christensen e cols. (2002) mostraram que a exposição de DC murinas a
determinadas espécies de Lactobacillus induz a expressão de marcadores de maturação,
como MHC II e CD86. Além disso, em um estudo recente, Mohamadzadeh e cols. (2005),
mostraram que DC mielóides expostas a Lactobacillus sp. aumentam a expressão de
marcadores como CD83, CD40, CD80 e CD86, e induzem a proliferação de células T CD4+ Th1, evidenciada pela secreção de IFN- , mas não IL-4 ou IL-13.
Sabe-se que, dentre as moléculas imunomoduladoras presentes nas bactérias Gram-positivas, possivelmente as mais importantes são os peptidoglicanos e o ácido lipoteicóico. Este efeito modulador pode está associado à capacidade do peptidoglicano (Lawrence &
Nauciel, 1998) e do ácido lipoteicóico (Clevelande cols., 1996) em induzir a produção de
IL-12. Diferentes trabalhos mostraram que essas moléculas isoladas de diferentes espécies de bactérias Gram-positivas são capazes de induzir a produção de citocinas como 1,
IL-6, TNF- , IFN- e radicais nitrogenados por CMSP humanas (Mattsson e cols., 1993; De
Kimpe e cols., 1995; Arakaki e cols., 1998; Wang e cols., 2000; Morath e cols., 2002).
Portanto, esses componentes, uma vez em contato com as células do sistema imunológico do hospedeiro, poderiam ter efeito imunomodulador. Em vários estudos, eles são utilizados para inibir a inflamação, sendo importantes para o desenvolvimento, funcionamento e
manutenção do sistema imune (Hamanne cols., 1998).
Além desses componentes, vários estudos demonstraram a participação de
diferentes estruturas moleculares constituintes de diversas espécies de Lactobacillus na
estimulação de células do sistema imunológico. Sato e cols. (1988), demonstraram que o
tratamento de macrófagos murinos com frações da parede celular de Lact. casei aumenta a
atividade in vitro e in vivo de macrófagos, potencializando seu poder microbicida contra
INTRODUÇÃO
citoplásmáticas extraídas de Lact. casei e de Bifidobacterium longum (Lee e cols., 2004),
bem como fragmentos específicos de DNA do Lact. delbrueckii ssp. bulgaricus NIAI B6
(Kitazawae cols., 2003), na estimulação do sistema imune.
Como resultado da ativação dos macrófagos e DC pela ação dos probióticos, pode
haver aumento da resistência do hospedeiro a infecções intracelulares, como mostrado em estudos realizados por Sato e cols. (1988a e 1988b) e por Popova e cols. (1993), que
demonstraram que o tratamento de camundongos com lisado de Lact. bulgaricus aumenta a
resistência do hospedeiro a infecções bacterianas intra e extracelulares. Como mencionado, a ativação e direcionamento da resposta imune específica é uma propriedade bem estabelecida para os probióticos.
Efeito adjuvante dos probióticos
A ação adjuvante do Lactobacillus casei foi relatada em um modelo onde diferentes
cepas de Lactobacillus foram administradas oralmente a camundongos aos quais era
concomitantemente injetado um antígeno definido (globulina de galinha trinitrofenilada).
Esse estudo mostrou que as espécies Lactobacillus casei Shirota e Lactobacillus plantarum
apresentam indução de alta reação de hipersensibilidade retardada, equivalente à induzida
pelo adjuvante Specol. Isso demonstra a ação adjuvante dos Lactobacillus através de uma
reposta mediada por célula T (Pouwelse cols., 1998).
Corroborando tais estudos que mostram que determinadas espécies de Lactobacillus
possuem capacidade de aumentar a resposta imune específica, quando administradas em
combinação com antígeno (Link-Amster e cols., 1994; Pouwels e cols., 1998), os dados
apresentados anteriormente demonstram que Lactobacillus podem melhorar a resposta
imune a um determinado patógeno, possuindo, assim, efeito adjuvante satisfatório, através da indução da produção de IL-12.
INTRODUÇÃO
Membros do gênero Lactobacillus são freqüentemente encontrados no trato
gastrointestinal de aves e mamíferos. Esses foram os primeiros microrganismos que, ingeridos em forma viável, foram associados com um efeito benéfico, quando, no início do século passado, Mectchnikoff sugeriu o consumo de leite fermentado para a modulação da microbiota gastrointestinal (Metchnikoff, 1907).
Lactobacillus delbrueckii é um microrganismo importante industrialmente, pertencente ao grupo das BAL que são largamente usadas na fermentação de alimentos. Além de sua relevância em processos de fermentação láctea, essa bactéria tem sido
estudada quanto a sua capacidade de produzir fatores de inibição de crescimento (Mitevae
cols., 1998a; Mitevae cols., 1998b).
A estirpe Lactobacillus delbrueckii UFV-H2b20 é de origem humana, isolada de
fezes de recém-nascido, na Universidade Federal de Viçosa (UFV). Esta estirpe,
anteriormente chamada de Lactobacillus acidophilus UFV-H2b20, foi capaz de resistir a
condições estressantes no trato gastrointestinal de camundongos e se manter
consideravelmente viável em todas as porções desses órgãos (Neumann e cols., 1998).
Também foi demonstrado que o Lactobacillus delbrueckii é capaz de ativar o sistema
fagocitário mononuclear de camundongos e estimular mecanismos de defesa dos mesmos, e
também induzir a produção de IL-12, TNF- e NO por células murinas (Neumann e cols.,
1998; Neumann e cols., 1996). Portanto, possui características que permitem classificá-lo
como probiótico.
Dados obtidos em nosso laboratório mostram que o Lactobacillus delbrueckii
UFV-H2b20 induziu produção de IL-12, IFN- e TNF- por CMSP de voluntários normais.
Além disso, esse mesmo estudo revelou que essa bactéria foi capaz de ativar macrófagos
infectados com L. amazonensis e primar células T virgens, induzindo sua diferenciação em
linfócitos Th1 específicos para antígeno desse parasita(Castanheirae cols., 2005).
Tendo em vista o impacto da infecção humana por parasitas do gênero Leishmania,
e a necessidade do desenvolvimento de uma resposta imune protetora na eliminação do parasita e controle da doença, considerando as propriedades adjuvantes de microrganismos
INTRODUÇÃO
interessante estudar a possível ação do Lactobacillus delbrueckii UFV-H2b20 na
modulação do sistema imune de camundongos infectados com esse parasita.
Com o objetivo de caracterizar as vias de modulação do sistema imune murino pelo
Lact. delbrueckii, e considerando a relevante participação de distintas estruturas
moleculares constituintes de diferentes espécies de Lactobacillus na estimulação dessas
células (Satoe cols., 1988; Lee e cols., 2004; Kitazawa e cols., 2003), torna-se evidente a
importância de se efetivarem estudos a fim de caracterizar a molécula do Lactobacillus
OBJETIVO GERAL
Objetivo geral
O objetivo geral deste trabalho foi analisar a capacidade do Lactobacillus
delbrueckii UFV H2b20 em proteger camundongos BALB/c contra infecção por
OBJETIVOS ESPECÍFICOS
Objetivos específicos
Verificar, in vitro, o efeito da variação da dose do Lactobacillus delbrueckii na indução
da produção de citocinas (IFN- , TNF- , IL-12 e IL-4) por esplenócitos de camundongos BALB/c;
Avaliar, in vivo, o efeito da variação da dose do Lact. delbrueckii na indução da
produção de citocinas (IFN- , TNF- , IL-12 e IL-4) em presença de antígeno de L.
braziliensis em sobrenadantes de cultura de células de linfonodos e baços de camundongos BALB/c;
Avaliar o curso de infecção por L. braziliensis em camundongos imunizados com
antígeno de leishmania e/ou com Lact. delbrueckii;
Quantificar o número de parasitas no local da infecção;
Comparar a produção de citocinas, IFN- , TNF- , IL-12 e IL-4 em sobrenadantes de cultura de células de linfonodos e baços de camundongos imunizados com antígeno de
leishmania e/ou com Lact. delbrueckii e desafiados com L. braziliensis;
Verificar, in vitro, o efeito da variação da dose do extrato de parede do Lact. delbrueckii
na indução da produção de citocinas (IFN- , TNF- , IL-12 e IL-4) por esplenócitos de camundongos BALB/c;
Avaliar a presença de proteínas no extrato de parede do Lact. delbrueckii através da
realização dos seguintes métodos: varredura espectral; eletroforese em gel de poliacrilamida-SDS e dosagem de proteínas por diferentes métodos (método de Lowry, Bradford e reação de ninidrina);
MATERIAL E MÉTODOS MATERIAL E MÉTODOS
Animais experimentais
Utilizaram-se fêmeas de camundongos BALB/c com idade média entre cinco e oito semanas, provenientes do Biotério Central da Universidade Federal de Minas Gerais (UFMG). Os animais eram mantidos em estante com sistema de filtração de ar, recebendo
água e ração ad libidum.
Microrganismos
Utilizou-se o Lactobacillus delbrueckii estirpe UFV H2b20 fornecido pelo
Departamento de Microbiologia da Universidade Federal de Viçosa (UFV), Minas Gerais.
As culturas de Lactobacillus delbrueckii UFV H2b20 foram trazidas em meio Ágar + MRS
(De Man, Rogosa e Sharp, Merck, São Paulo, Brasil) e repicadas duas vezes em caldo MRS (De Man, Rogosa e Sharp, Difco Becton, Dickinson and Company, USA) sendo incubadas por dezoito horas a 37 C. Posteriormente as culturas foram congeladas em leite desnatado reconstituído (LDR) a 12% (Molico, Nestle, São Paulo, Brasil) a uma temperatura de
-70 C.
Para a realização de cada experimento, as culturas em LDR 12% eram descongeladas à temperatura ambiente e repicadas duas vezes em caldo MRS para ativação, como descrito por Neumann e cols, (1998).
Obtenção do Lactobacillus delbrueckii UFV-H2b20 Íntegro
Foram utilizados o Lactobacillus delbrueckii UFV-H2b20 íntegro e o extrato de
parede dessa mesma bactéria, ambos obtidos após autoclavação da cultura. Após esse
processo, os microrganismos foram denominados Ldmc, que significa Lactobacillus
MATERIAL E MÉTODOS As culturas ativadas eram adicionadas em tubos estéreis de polipropileno de fundo cônico com capacidade para 15ml (Falcon-Becton Dickinson Labware and Company
Franklin Lakes NJ, USA) e centrifugadas a 2740 x g por 20 minutos, a 4 C. Desprezava-se
o sobrenadante e lavava-se o sedimento por duas vezes em solução salina tamponada com fosfato (PBS) estéril. Ressuspendiam-se os microrganismos no volume original de PBS (10mL). Uma alíquota da suspensão de bactérias era retirada e diluída 1:10 em PBS, para leitura em espectrofotômetro a 550nm e uma aliquota era destinada à realização do método de Gram (Gram, 1884). A partir do valor de transmitância, calculava-se a quantidade total
de bactérias existentes e ajustava-se a concentração de bactérias de modo a se obter 1x1010
UFC/ml. A cultura era, então, autoclavada a 121 C, por 15 minutos, a preparação era resfriada a temperatura ambiente. Em seguida, armazenavam-se as preparações a uma temperatura de -70 C, até sua utilização para realização dos experimentos.
Obtenção do Extrato de Parede do Lactobacillus delbrueckii UFV-H2b20
As culturas, após ativação, eram lavadas por duas vezes em PBS estéril, como descrito acima. Então, ressuspendiam-se os microrganismos em 10mL de PBS e retirava-se uma alíquota da cultura, a fim de quantificar as bactérias, por leitura espectrofotométrica,
conforme já descrito. Após ajuste da concentração, procedia-se à autoclavação a 121 C, por 15 minutos, seguida do resfriamento da preparação à temperatura ambiente.
As células bacterianas obtidas eram centrifugadas três vezes a 2740 x g, por 20
minutos, a 4 C, em tampão HEPES 50mM, pH 7.0 (Sigma Sigma Chemical CO, St
Louis, MO, USA), contendo 20mM de CaCl2 (Reagen, RJ, BR). Após lavagem,
ressuspendia-se o sedimento em tampão fosfato 50mM, pH 7.0 (Synth-Labsynth, SP, BR; VETEC-Vetec Química Fina Ltda, RJ, BR) e incubava-se a suspensão a 30 C por duas
horas. Utilizou-se a razão de 10 L de tampão fosfato para 1mg de sedimento obtido. Após
a incubação, a preparação era centrifugada a 12.000 x g durante cinco minutos, a 4 C . O
sobrenadante era rotulado como extrato de parede . O sedimento era rotulado como Lact
MATERIAL E MÉTODOS
1x1010 UFC/mL. Ambos eram armazenados em uma temperatura igual a -70 C, até o
momento de utilização nos experimentos (Tsakalidoue cols., 1999).
Concentração do Extrato de Parede doLact. delbrueckii UFV-H2b20
Na tentativa de concentrar o extrato de parede obtido conforme descrito anteriormente, foi realizado um protocolo onde se utilizou filtração do extrato de parede através de membranas de celulose com poros de 3000 dáltons (3kDa) acopladas em sistemas de tubos centrifugáveis do tipo Centricon (Millipore- Industria e comércio Ltda- SP- Brazil) YM-3.
Foram aplicados 2mL do extrado de parede ao compartimento destinado à
reservatório da amostra e o sistema foi submetido a centrifugação a 2000 x g por, no
mínimo, 90 minutos, a fim de obter um volume de amostra concentrada igual a aproximadamente 1/3 do volume original. Após este tempo, o volume contido no tubo retentor, era coletado e armazenado a -20 C até o momento de utilização nos experimentos.
As amostras do extrato de parede do Ldmc concentradas como descrito acima eram
submetidas à análise quanto a sua capacidade indutora da produção de citocinas como o
IFN- por esplenócitos murinos (descrito abaixo).
Identificação da Molécula Imunoestimuladora Presente no Extrato de Parede
do Lact. delbrueckii
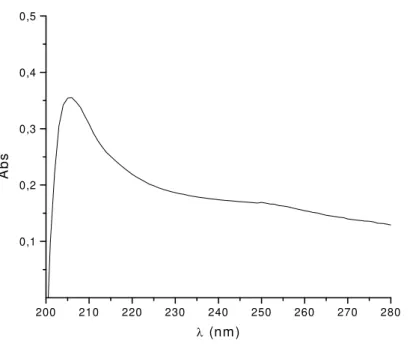
1) Detecção da Presença de Proteínas de Baixo Peso Molecular
Varredura Espectral
MATERIAL E MÉTODOS Dosagem de Proteínas
O extrato de parede foi submetido à dosagem de proteínas pelo método de Bradford (1976), pelo método de Lowry e cols. (1951) ou pela reação de ninidrina (Yemm & Cocking, 1955).
Eletroforese em Gel de Poliacrilamida em Presença de Duodecil Sulfato de Sódio
SDS PAGE
A eletroforese em gel de poliacrilamida-SDS foram realizadas segundo a técnica de (Laemmli, 1970) e o método de coloração utilizado foi o da prata descrito por (Tunon &
Johansson, 1984). As amostras aplicadas ao gel foram: Ldmc íntegro sonicado, através de 4
ciclos de 40 segundos, com intervalos de 10 segundos no gelo (Sonicador Branson, Sonifer
250) e extrato de parede do Ldmc obtido conforme descrito acima.
Detecção da Presença de Protease
A análise da presença de uma protease ativa no extrato de parede do Ldmc foi
realizada através da determinação da atividade proteásica a temperatura ambiente e a 37 C, utilizando-se a azocaseína como descrito por Tomarelli e cols. (1949) .
2) Detecção da Presença de Carboidratos
A análise da presença de carboidratos foi realizada através da aplicação das
amostras do extrato de parede do Ldmc em membrana de PVDF (Gelman Sciense) e
posterior incubação em 1mM de MnCl2 em presença de 50mg/mL de Concanavalina A