Pró-Reitoria de Pós-Graduação e Pesquisa
Programa de Pós-Graduação Stricto Sensu em Ciências
Genômicas e Biotecnologia
Busca de mutações no exon 1 do gene KRAS em amostras de
carcinoma de vesícula biliar
Brasília - DF
2013
JOSÉ ANTONIO PANIAGUA
BUSCA DE MUTAÇÕES NO EXON 1 DO GENE KRAS EM AMOSTRAS DE CARCINOMA DE VESÍCULA BILIAR
Brasília 2013
Dissertação apresentada ao Programa de Pós-Graduação Stricto Senso em Ciências Genômicas e Biotecnologia da Universidade Católica de Brasília, como requisito para obtenção do título de Mestre em Ciências Genômicas e Biotecnologia.
Ficha elaborada pela Biblioteca Pós-Graduação da UCB
22/07/2013
P192b Paniagua, José Antonio
Busca de mutações no exon 1 do gene KRAS em amostras de carcinoma de vesícula biliar. / José Antonio Paniagua – 2013.
93f. : il ; 30 cm
Dissertação (Mestrado) – Universidade Católica de Brasília, 2013. Orientação: Prof. Dr. Rinaldo Wellerson Pereira.
1. Diagnóstico molecular. 2. Mutação (Biologia). 3. Câncer. 4. Vesícula biliar. I. Pereira, Rinaldo Wellerson., orient. II. Título.
Disscrlaçào de alllaria de José Antonio Paníagua. intitulada "BUSCA DE MUTAÇÕES NO EXON I DO GENE KRAS EM AMOSTRAS DE CARCI OMA DE VEsíCULA BILIAR .... apresentada eorno requisito parcial para obtenção de grau de Mcslrc em Ciências Gcnôrnicas c Biolccnologia da Universidade Católica de Brasília. em 26 de junho de 2013. defendida c aprovada pela banca examinadora abaixo assinada:
ProL Dr. Rinaldo Wcicrson Pereira Oricmador
(Programa de Pós GraduaçãoSrriclo Sellsu em Ciências Gcnómicas e BiOlccnologia- UCB)
ProLJ Dr.d Juliana Forte MazzclI de Araujo
Examinadora Externa
(Universidade de Brasília - UnB)
Profa. Dra. Rosangela Vieira de Andrade Membro Inlerno
(Programa de Pós GraduaçãoSrricto Sensll em Ciências Genómicas e Biotecnologia- UCB)
Membro Interno
(Programa de Pós GraduaçãoStricto Sel1su em Ciências Gcnômicas c Biolccnologia- UCB)
À meus pais Antônio Rodrigues Paniagua e Dalila Azevedo Naves (in memorian). Estes
AGRADECIMENTO
Ao meu orientador, Dr. Rinaldo Wellerson Pereira, professor e diretor do curso de pós graduação da UCB/DF, que sem medir esforços muito me auxiliou, me dando tanto autonomia como liberdade irrestrita para executar os ensaios que gestaram este trabalho.
À minha esposa e filhos, minhas sínceras e eternas desculpas pelas minhas ausências (mal compensadas). Ao Cleiseano, obrigado pelos incentivos. Ao meu filho, Antonio Rodriguês Paniagua, sinto muito por abrir mão de ser seu professor nas séries finais do Ensino Fundamental, quando comecei a investir neste trabalho. Às minhas queridas e inesquecíveis irmãs. E em especial, a irmã caçula, Solange (a fonte de minha esperança e ânimo), que a seu modo muito me estimulou e sempre acreditou no findar positivo desta trajetória.
À Secretaria de Estado de Educação (MG) e ao programa de Pós-Graduação (DF) em Biologia Molecular pelo auxílio e apoio concedidos durante o meu Mestrado Acadêmico.
À Profª. Drª. Rosângela Vieira de Andrade (UCB-DF), que se alegra na arte de pesquisar e ensinar o meu muito obrigado a esta profissional que sempre ouviu minhas dúvidas e me direcionou no caminho certo.
Ao Prof. Dr. Robert Edward Pogue (UCB-DF), que prontamente dirimiu minhas dúvidas e me proporcionou as melhores sugestões, todos os momentos requeridos.
Á Profª. Drª. Andréa Barreto Motoyama (Universidade de Brasília - UnB), que através de e-mails nunca deixou de atender a um questionamento meu sempre com muito carinho.
Ao Médico Oncologista Pediátrico do Hospital da Criança de Brasília, Dr. Luis Henrique Toshihiro Sakamoto, que muito contribuiu com suas sugestões em relação à extração de DNA de tecido fixado em formol e emblocado em parafina.
Á Profª. Drª. Alessandra R. Aos Prof. Dr. João A. Barbosa (UCB-DF) e Dr. Francisco Prosdocimi (UFRJ-RJ) minhas boas lembranças das conversas que oportunamente tivemos.
Ao Biólogo (Mestre em Patologia Clínica pela Escola Paulista de Medicina-UNIFESP, Presidente da Sociedade Brasileira de Histotecnologia), Joaquim S. de Almeida, pelo apoio sem igual. Sua objetividade e franqueza muito cooperaram para a conclusão deste trabalho.
Aos colegas da Plataforma de Genômica da UCB-DF, em especial a Patrícia pela sua prontidão e meiguice em servir sempre no seqüenciamento das amostras estudadas no presente trabalho. Aos meus amigos de laboratório Virgílio, Laiane Santos, Cristiane Santos, Larissa Lemos, Luiz Felipe, Ricardo, Felipe e Loiane, que muitas vezes trocamos idéias em conversas muito produtivas. Aos inesquecíveis colegas de bancadas e de “consultas”, Elizabeth, Clarissa, Marcela, Taina. De fato, vocês tanto me ensinaram quanto me toleraram.
É preciso dançar sobre os abismos Rir de tudo e de todos
É preciso superar o “aqui e agora” “Ser uma ponte e não um fim” É preciso conviver com incertezas Desconfiar, desconfiar, desconfiar Tudo é passível de questionamento Os valores, os conceitos e preceitos O “equilíbrio” e a loucura
os sentimentos mais dignos, a ciência, a história, a religião Nada, absolutamente nada pode Ser considerado “definitivo”
Concluir é atrofiar, estagnar, morrer...
RESUMO
Referência: Paniagua, José Antonio. Busca de mutações no gene KRAS em amostras de
carcinoma de vesícula biliar. 2013. 93f. Mestrado em Ciências Genômicas e Biotecnologia – Universidade Católica de Brasília, Brasília, 2013.
O câncer de vesícula biliar (CaVB) é uma neoplasia muito agressiva, com diagnóstico incidental, via de regra, prognóstico desfavorável e com consequência letal. Entretanto, o conhecimento da evolução natural desse câncer ainda é muito imaturo, parcialmente em função de sua raridade, ausência de sintomatologia, escassez e contradições na literatura. Tais fatos, contribuem para dificultar o diagnóstico dessa doença comprometendo o êxito no prognóstico e no tratamento. Colecistectomias é uma (falta de) opção oferecida aos pacientes como preventivas ou como curativas, em casos suspeitos ou avançados, respectivamente. Portanto, a cirurgia não tem como objetivo melhorar o prognóstico e sim a qualidade de vida e a sobrevida do paciente. Estudos populacionais têm postulado que há diversos fatores e marcadores de riscos associados ao CaVB. No entanto, tais fatores têm baixo ou questionável potencial para auxiliar no prognóstico e terapêutica. Várias classificações embasadas em aspectos morfofisiológicos e histológicos têm contribuído positivamente para gerir melhor o diagnóstico e o prognóstico do CaVB, esses esforços são justificados pelo grande volume de incidências e vítimas com morte. Contudo, são muito limitados quando comparados à evolução no diagnóstico precoce e prognóstico direcionado para outros cânceres. Acredita-se que a presença de macromoléculas marcadoras de oncogenicidade deverão se impor prioritariamente como estratégias para melhor gerir cânceres agressivos. De fato, a literatura é unânime em registrar que vários genes do sistema de controle do ciclo celular são encontrados mutados em diversos cânceres humano e estão clinicamente associados a um fenótipo de maior agressividade e menor sobrevida. O KRAS2B é um dos oncogenes deste sistema, capaz
de imprimir nas células fisiologia patológica com características típicas de células malignas com alto potencial reprodutivo, então, a identificação precoce dos mecanismos moleculares subjacentes que desecadeiam a tumorigenese otimiza o prognóstico. Devido a importância do
KRAS na homeostasia celular e sua maior incidência como oncogene em diversos tipos de
cânceres, descrever o status mutado do exon 1 desse gene, tem sido um alvo atrativo da medicina molecular. Portanto, neste estudo retrospectivo, propôs-se sequenciar e avaliar o exon 1 do KRAS, em busca de mutações patogênicas nos sítios codantes 12 e 13, como um
marcador molecular robusto para auxiliar no prognóstico. A fonte de DNA utilizada para estes testes são oriundas de 42 biópsias de CaVB primário, fixadas em formol e emblocadas em parafina. Foi extraído e amplificado por PCR um fragmento de 295 pb de 40,4% dessas amostras. Pela análise dos eletroferogramas produzidos pelos sequenciamentos nenhuma mutação foi detectada no exon 1 do KRAS, objeto deste estudo. Otimizar essa tecnologia do
ABSTRACT
The gallbladder cancer (GBC) is a very aggressive cancer, diagnosed incidentally, as a rule, poor prognosis and therefore lethal. However, knowledge of the natural history of this cancer is still very immature, partially due to its rarity, absence of symptoms, scarcity and contradictions in the literature. These facts contribute to make the diagnosis of this disease affecting the successful outcome and treatment. Cholecystectomy is an (lack of) option offered to patients as a preventive or curative as in suspected cases or advanced, respectively. Therefore, surgery is not meant to improve the prognosis, but the quality of life and survival of patients. Population studies have postulated that there are several factors and risks associated with GBC. However, these factors have low or questionable potential to help the prognosis and therapy. Several classifications based on solid and histological aspects Morphophysiological has contributed positively to better manage the diagnosis and prognosis of GBC, these efforts are justified by the sheer volume of incidents and victims to death. However, very limited compared to developments in early diagnosis and prognosis directed to other cancers. It is believed that the presence of markers oncogenicity macromolecules should be imposed as priority strategies to better manage aggressive cancers. Today, it is known that
KRAS2B mutations can print pathological physiology in cells with features typical of
malignant cells with high reproductive potential. In fact, the literature is unanimous registering that several genes from cell-cycle control system are found mutated in many human cancer and are clinical phenotype associated with poorer survival. The KRAS2B is an
oncogene part of this system which is able to print in cells a pathologic physiology with typical features of malignant cells with high reproductive potential, then, the early identification of the subjacent molecular mechanisms that trigger the tumorigenesis, optimizes the prognosis. Because of the importance of KRAS in cellular homeostasis and its higher incidence as oncogene in several types of cancers, describe the status of the mutated in exon 1 of this gene, has been an attractive target of molecular medicine. Therefore, in this retrospective study, and evaluate proposed sequencing of exon 1 of KRAS in search of pathogenic mutations in the sites codantes 12 and 13, as a robust molecular marker to aid in prognosis. The source of DNA used for these tests are from 42 biopsies CaVB primary, formalin-fixed paraffin-embedded. It was extracted and amplified using PCR a fragment of 295 bp 40.4% of samples. the analysis of sequencing electropherograms produced by no mutation was detected in exon 1 of KRAS, the object of this study. However, the analysis of
sequencing electropherograms produced by these fragments no mutation was detected in exon 1 of KRAS, the object of this study. Optimize this technology for the efficient use of paraffin
material in molecular pathology with satisfactory results has been a challenge. However, this did not prevent obtaining good sequencing, and did not compromise the results found in full agreement with the low frequency of KRAS mutations in GBC, reported in the literature.
LISTA DE ILUSTRAÇÕES
Figura 1 Incidência do carcinoma de vesícula no mundo... 18
Figura 2 Perfil molecular e genético do Câncer de Vesícula Biliar... 35
Figura 3 As mutações patogênicas somáticas mais comuns no exon 1 do KRAS... 40
Figura 4 Janela do banco Sanger expondo as diversas mutações no KRAS... 41
Figura 5 Sequência de nucleotídeos de um fragmento contendo o exon 1do KRAS. 50 Figura 6 Eletroforese para constatar a amplificação do exon 1 do gene KRAS2B.... 61
Figura 7 Amostras 31A e 31B dos amplicons do KRAS... 62
Figura 8 Bandas com baixo peso molecular em géis de agarose... 63
Figura 9 Eletroferograma parcial de uma sequência reversa do exon 1 do KRAS.... 64
Figura 10 Fotografias de géis de agarose a 2% com DNA muito degradado... 70
Gráfico 1 Associação entre o percentual de amostras e os procedimentos utilizados como estratégia para estudo do exon 1 do gene KRAS... 65
LISTA DE TABELAS
Tabela 1 Classificação histológica (tipos celulares) do CaVB... 21
Tabela 2 Grau Histológico de diferenciação e conteúdo glandular dos CaVB... 22
Tabela 3 Descrição dos primers utilizados para flanquear o exon 1 do KRAS 50
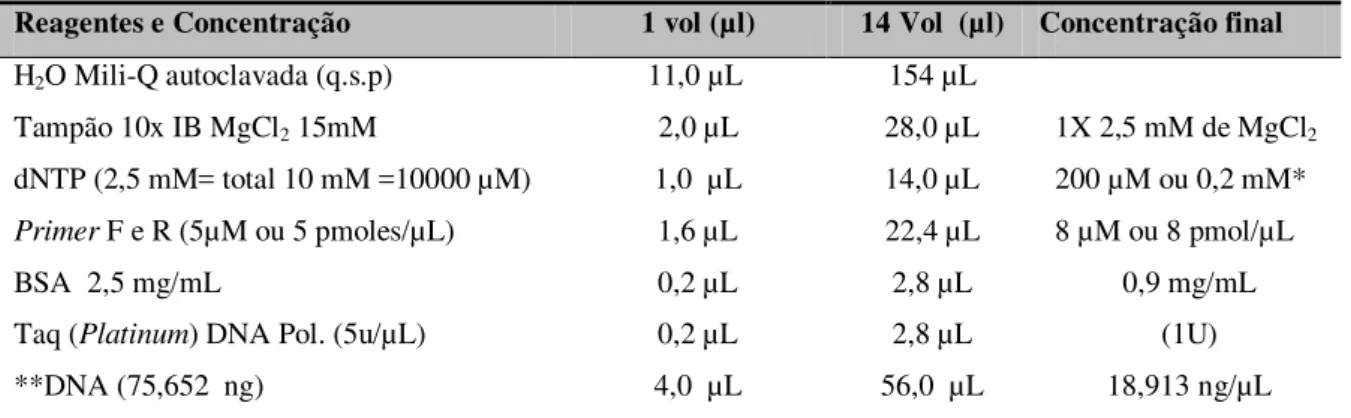
Tabela 4 Volumes pipetados, concentração final dos reagente da solução de PCR 51
Tabela 5 As condições da PCR para o exon 1 do gene KRAS... 53
Tabela 6 Quantificação por fluorimetria de uma amostra de DNA genômico... 61
LISTA DE ABREVIATURAS
A, C, G, T Adenina, Citosina, Guanina, Timina; Bases orgânicas dos nucleotídeos BSA Albumina de soro bovino (Bovine Serum Albumin)
Ca Carcinoma
CIS Câncer in situ
CN Controle negativo CP Controle positivo
CaVB Carcinoma de Vesícula Biliar CNVs Copy Number Variations H2OD Água destilada deionizada
DNA Ácido Desoxirribonucleico (Deoxyribonucleic Acid)
DNAg DNA genômico
dNTP Desoxirribonucleotídeos 5´-trifosfatados DP Desvio Padrão
EDTA Ácido etilenodiamino tetra acético
GST Gene Supressor de Tumor IMS Instabilidade de Microssatélites
JADPB Junção Anômala dos Ductos Pancreato-biliar KCl Cloreto de potássio
MgCl2 Cloreto de Magnésio
ORF Janela de leitura (Opening Reading Frame)
pb pares de bases
PCR Reação em cadeia da polimerase (Polymerase Chain Reaction) pH Potencial de hidrogênio de uma solução
Pmol Picomol = 10-12 mols
Primer Cadeia de ácidos nucleicos iniciadora da replicação R0 Ressecção Cirúrgica Curativa
rpm Rotações por minuto
SCCC Sistema de Controle do Ciclo Celular TAE Tris-Acetato-EDTA
Tm Temperatura de fusão (melting temperature) Tris Tris (hidroximetil) aminometano
Tris-HCl Tris Hidrocloreto UI Unidade Internacional
UTR Região não traduzida (Untranslated Region) VB Vesícula Biliar
LISTA DE SÍMBOLOS
% Porcentagem
°C Graus Celsius
g Grama
F/R F - usado para designar o primer forward e R – primer reverse
k(p)b Kilo (pares) de bases
µ Micro, prefixo que designa 10-6
mM Milimolar
M Molaridade
nm Nanometro, equivalente a 1,0×10−9 do metro
U Unidade
V Volt, Unidade SI de voltagem elétrica
< Menor
± Mais ou menos
- Negativo
+ Positivo
≤ Menor ou igual
SUMÁRIO
1 INTRODUÇÃO ... 17
1.1 CARCINOMA DE VESÍCULA BILIAR ... 17
1.2 DIAGNÓSTICO E PROGNÓSTICO HISTOPATOLÓGICO ... 20
1.3 DIAGNÓSTICO E PROGNÓSTICO POR IMUNOHISTOQUÍMICA EM CAVB ... 23
1.4 PROGNÓSTICO BASEADO EM ANÁLISE DE DNA ... 34
1.5 PROGNÓSTICO BASEADO NO STATUS MUTADO DO KRAS EM VÁRIOS CÂNCERES ... 35
1.6 DIAGNÓSTICO MOLECULAR EM TECIDO FIXADO EM FORMOL E EMBEBIDO EM PARAFINA ... 41
2 OBJETIVOS... 43
2.1 OBJETIVO GERAL ... 43
2.2 OBJETIVOS ESPECÍFICOS ... 43
3 MATERIAIS E MÉTODOS... 44
3.1 AMOSTRAS ... 44
3.2 DESPARAFINIZAÇÃO E REIDRATAÇÃO DE TECIDO FIXADO EM FORMOL .... 45
3.3 QUANTIFICAÇÃO DE DNA... 48
3.4 AMPLIFICAÇÃO POR PCR ... 49
3.5 ELETROFORESE EM GEL DE AGAROSE DE PRODUTOS DE PCR... 53
3.6 QUANTIFICAÇÃO EM GEL DE AGAROSE DO DNA AMPLIFICADO ... 55
3.7 PURIFICACÃO DOS PRODUTOS DE PCR ... 55
3.8 PURIFICAÇÃO DOS PRODUTOS DE PCR NO SEQUENCIAMENTO ... 56
3.9 SEQUENCIAMENTO DO EXON 1 DO KRAS PELO MÉTODO DE SANGER ... 58
3.10 ANÁLISE DE SEQUÊNCIAS ORIGINADAS DESTE ESTUDO ... 59
4 ANÁLISE ESTATÍSTICA... 60
5 RESULTADOS E DISCUSSÃO... 61
5.1 EXTRAÇÃO E QUANTIFICAÇÃO DE DNA EM AMOSTRAS DE CAVB EM FFPE 61 5.2 AMPLIFICAÇÃO PELA PCR ... 62
5.3 SEQUENCIAMENTO PELO MÉTODO DE SANGER ... 64
5.4 O GENE KRAS EM CARCINOMA DE VESÍCULA BILIAR ... 72
6 CONCLUSÃO... 75
1 INTRODUÇÃO
1.1 CARCINOMA DE VESÍCULA BILIAR
Em 1777, Maximilan DeStoll com base em autópsias descreveu pela primeira vez o carcinoma de vesícula biliar (CaVB). No entanto, uma melhor caracterização foi publicada somente 200 anos depois da descrição de DeStoll (LAZCANO-PONCE et al., 2001; MOHAMED, et al., 2010).
A vesícula biliar é uma víscera oca, em forma de pera, de cor azulada, com cerca de 7 a 10 cm de comprimento e 3 a 4 cm de largura, com paredes delgadas de tecido muscular e fibroso, situada no leito inferior do fígado (fosseta cística), amarrada por tecido conectivo frouxo, rico em vasos sanguíneos e linfáticos. Está dividida anatomicamente em três regiões: infundíbulo ou colo livre do peritônio, corpo e fundo recoberto pelo peritônio. No colo estão as glândulas e o epitélio que secretam mucina.
A vesícula biliar é um órgão hormônio-dependente (ROCHA, 2004). Sua função é armazenar e concentrar na região fundica, um volume de 30 a 50 ml de bilis produzida no figado. Ela é constituída por quatro camadas teciduais: (1) a mucosa (epitélio cilíndrico e colunar simples revestido por microvilosidades e a lâmina própria - tecido conjuntivo frouxo), (2) uma camada de músculo liso (única e delgada), (3) uma camada de tecido conjuntivo frouxo perimuscular que é contíguo com o tecido conjuntivo interlobular do fígado, e (4) a serosa, mas, não há camada subserosa (peritônio visceral) na superfície superior da VB em contato e adjacente ao fígado e nem a muscular da mucosa (WISTUBA; GAZDAR, 2004). De acordo com os achados no momento do diagnóstico, a ausência da serosa e o tecido perimuscular compartilhado favorece a disseminação do tumor da parede da VB para órgãos adjacentes e a extensão do tumor direto para o leito do fígado, principalmente pela via linfática (WISTUBA; GAZDAR, 2004; CASTILLO; GARCÍA; ROA, 2010; SRIVASTAVA et al., 2011; DUTTA, 2012).
até os nossos dias, a biologia do tumor ainda é pouco conhecida, contribuindo para a manutenção de sua alta letalidade (AKE, 2012a; CZIUPKA et al., 2012).
Clinicamente o CaVB é uma neoplasia rara, assintomática, diagnosticada tardiamente por acidente, apresentando grande invasão loco- regional (LOBO; PRASAD; SATOSKAR, 2012), quimio-radiorresistente (ou pouco responsiva a maioria destas terapias, salvo exceções) e com prognóstico geralmente desfavorável (ECKEL; SCHMID, 2007; LAI; LAU, 2008; PARK et al., 2008; FAN et al., 2010; ZHU et al., 2010; QU et al., 2012; DUTTA, 2012). Apesar de grande parte dos CaVB ser de difícil detecção (ZHU et al., 2010; QU et al., 2012), a maioria são benignos (VIALLE et al., 2008; PARK et al., 2008; AKE, 2012a).
O CaVB apresenta incidência muito variável de acordo com o gênero e a origem etnogeográfica (veja a figura 1). Há áreas geográficas de concentração espalhadas pelo mundo, o exemplo característico é o Chile, onde é altíssima a taxa de mortalidade (35/100.000 indivíduos por ano) (LAZCANO-PONCE et al., 2001; ELDON, 2008; DUTTA, 2012). De modo geral, a frequência de CaVB é baixa em relação aos demais cânceres, representando uma parcela de 0,7 a 1,2%. No total de material de colecistectomia representam 1 a 3% (TORRES; ÁLVARO; AMARAL, 2010; LOBO; PRASAD; SATOSKAR, 2012).
As maiores taxas de incidência de CaVB foram registradas na América do Sul (América Andina), América do Norte (índios do Novo México e índios americanos) e norte da Índia (WISTUBA; GAZDAR, 2004; GABBI et al., 2010; DUTTA, 2012).
Figura 1: Incidência do carcinoma de vesícula biliar no mundo. Mulheres em áreas risco está em verde demonstrando os países com alta incidência (< 9 mulheres/100.000 habitantes). Moderada e alta incidência do CaVB é observado nas áreas em lilás, cuja incidência é em torno de 4 a 9 mulheres/100.000 habitantes.
No oriente é muito frequente em alguns países do Extremo Oriente da Ásia, incluindo a Coréia, Japão (7/100.000), Shanghai (onde os índices de prevalência tem aumentado consideravelmente) e norte da Índia (21,5/100.000 para as mulheres de Delhi) (SRIVASTAVA et al., 2011). O CaVB é a principal causa de morte oncológica no sexo feminino no norte da Índia (ELDON, 2008; DUTTA, 2012).
A incidência de CaVB no Brasil gira em torno de 0,8%, sendo o Rio Grande do Sul o estado com a maior incidência, com 3,09 de óbitos por 100.000 habitantes (LAZCANO-PONCE et al., 2001; WISTUBA; GAZDAR, 2004).
A maior incidência do CaVB em países subdesenvolvidos faz com que alguns autores sugiram a existência de uma associação entre este câncer e a pobreza (ANDIA et al., 2008). No entanto, a pobreza não é considerado um fator de risco robusto fora das áreas de risco. É notório o fato de que as mulheres africanas apresentam baixas incidência de CaVB (TORRES; ÁLVARO; AMARAL, 2010), embora, seja considerado raro em negros. A baixa incidência para o CaVB também ocorre nos caucasianos da Europa Ocidental e EUA e, para estes povos o CaVB é muito letal (ECKEL; SCHIMID, 2007; WOLF et al., 2010). Nos EUA são descritos em 5000 novos casos/ano, com 2500 mortes, sua incidência maligna no trato gastrointestinal é de 0,5% (ECKEL; SCHIMID, 2007; ELDON, 2008; GABBI et al., 2010)
O diagnóstico do CaVB - CID-O C23.0 - geralmente é tardio, no intra-operatório ou, menos comumente no pós-operatório seguido pelo pré-operatório de doença benigna da VB. O diagnóstico pode ser obtido por meio de análise macroscópica da VB, mas a sugestão é a confirmação por exame histológico (anátomo-cirúrgico [patológico]) da peça extirpada. Para 90% dos casos com diagnóstico precoce a sobrevida é de 10 anos (VELOSO; RODRIGUES, 2011). Exames, fatores demográficos, fatores de risco independentes devem ser requisitados com o objetivo de aumentar a acurácia para o diagnóstico precoce do CaVB (AGRAWAL et al., 2010; AKE, 2012a; DUTTA, 2012; GIANG et al., 2012; PAIS-COSTA et al, 2012). Geralmente, os pacientes recebem o diagnóstico de CaVB com idade média de 73 anos (EDON, 2008; SHRESTHA et al., 2010; CZIUPKA et al., 2012), no Brasil essa média cai para 71 anos (TORRES; ÁLVARO; AMARAL, 2010; PAIS-COSTA et al, 2012).
1.2 DIAGNÓSTICO E PROGNÓSTICO HISTOPATOLÓGICO
O estudo histopatológico da VB é o padrão ouro para distinguir os casos benignos dos malignos, inclusive para a identificação de malignidade oculta (SHRESTHA et al., 2010; VELOSO; RODRIGUES, 2011; LOBO; PRASAD; SATOSKAR, 2012).
De acordo com o relatório do Royal College of Pathologists, toda VB deve ser
examinada histologicamente, pois a malignidade pode estar oculta mesmo quando características morfológicas apresentarem normais. Algumas condições benignas da vesícula biliar podem ser confundidas com o CaVB quando o diagnóstico histopatológico é desprezado.
A adenomiomatose faz parte das lesões degenerativas benignas da VB (BOSCAK et al., 2006), mas pode apresentar potencial malignidade ao promover o espessamento tanto do epitélio da parede como da camada muscular da VB (TRIVED et al., 2008; TORRES; ÁLVARO; AMARAL, 2010). O exame histopatológico minucioso é um pré-requisito para identificação de lesões pré-neoplásicas suspeitas, para evitar que a subjetividade traga à tona o o letal diagnóstico falso negativo (VELOSO; RODRIGUES, 2011; GIANG et al., 2012).
A classificação de CaVB de acordo com a histopatologia mostra que entre 80 a 90% dos casos são adenocarcinomas (veja a tabela 1). Nem todos os percentuais de incidência e seus respectivos tipos celulares de CaVB foram citados.
Tabela 1: Classificação Histológica (Tipos celulares) do CaVB.
Tipos celulares (histopatológicos) Incidência %
1 - Adenocarcinoma 80 a 90%
2 - Carcinoma papilar 6%
3 - Adenocarcinoma, tipo intestinal 2,0%
4 - Adenocarcinoma mucinoso 4 a 5%
5 - Adenocarcinoma de células claras 0,5%
6 - Carcinoma de pequenas células (G4) < 5%
7 - Carcinoma adenoescamoso (G4) 3%
8 - Carcinoma escamoso 3%
9 - Ca com células tipo anel-de-sineto G4 (PP e baixa incidência). ________
10 - Carcinoma indiferenciado (G4) 6%
11 - sarcoma 0,2%
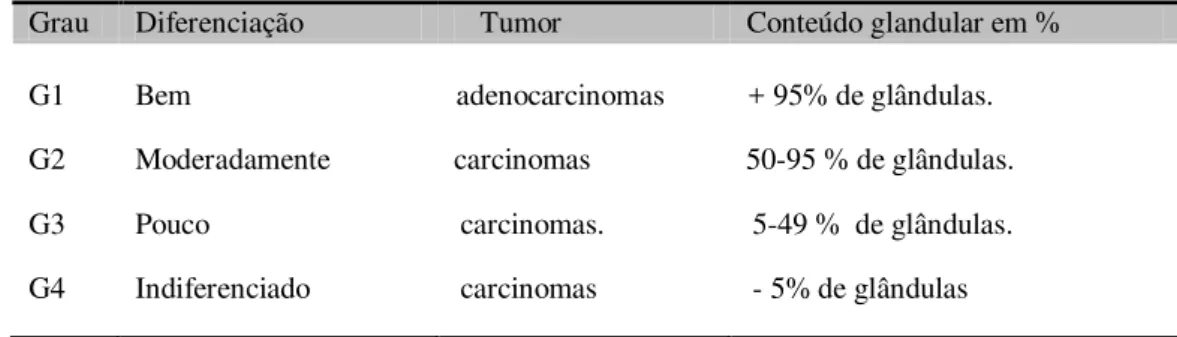
O grau histológico está correlacionado com o prognóstico, sendo que quanto maior o grau pior o prognóstico. Os adenocarcinomas são classificados de acordo com os graus citológicos de atipias celulares. São quatro os graus de diferenciação celular (veja a tabela 2): carcinoma bem diferenciados, moderados, pouco diferenciados e indiferenciados ou seja, anaplásicos sem diferenciação (ROA et al., 2002). Entre 10 a 20% são os Carcinomas epiteliais suberoso que são pouco diferenciados e com 37% de sobrevida em 5 anos. O Carcinoma epitelial seroso apresenta 10% de sobrevida em 5 anos (ISHAK et al., 2011), enquanto que o Carcinoma de pequenas células apresenta uma sobrevida de 5 e 10 anos, de 8 e 0%, respectivamente (ALBORES-SAAVEDRA et al., 2011). O adenoescamoso misto (glandular e mucoso, moderado e pouco diferenciado) é muito raro, representando 1 a 3,5% dos casos de CaVB e é caracterizado por infiltração local e metástase hepática. A duplicação celular do Carcinoma adenoescamoso misto é cerca de metade do tempo que aquela dos adenocarcinomas, com pior prognóstico (ROJAS et al., 2010; ALBORES-SAAVEDRA et al., 2011). O Carcinoma escamoso se caracteriza por crescer lentamente e geralmente não apresentar metástase, mas seu prognóstico comparado ao adenocarcinoma é pior (RAI et al., 2009).
Tabela 2: Grau Histológico descritivo de diferenciação e conteúdo glandular dos CaVB.
Grau Diferenciação Tumor Conteúdo glandular em %
G1 Bem adenocarcinomas + 95% de glândulas. G2 Moderadamente carcinomas 50-95 % de glândulas.
G3 Pouco carcinomas. 5-49 % de glândulas.
G4 Indiferenciado carcinomas - 5% de glândulas Fonte: Adaptado de TORRES (2010).
1.3 DIAGNÓSTICO E PROGNÓSTICO POR IMUNOHISTOQUÍMICA EM CAVB
Até recentemente, os únicos fatores prognósticos reconhecidos para o CaVB eram: o tipo, o grau histológico da lesão, a invasão vascular e o estadiamento do tumor. Esses fatores ainda são muito utilizados, mas o advento de várias técnicas moleculares tem otmizado a acurácia do diagnóstico e consequentemente favorecido o prognóstico. Atualmente há uma corrida em busca de marcadores biológicos que possam ser validados para atuar complementando os parâmetros clínicos e histopatológicos norteando a apuração do diagnóstico diferencial em CaVB. Já fora identificadas uma gama de proteínas como potenciais marcadores tumorais para otimizar o prognóstico em CaVB (TORRES; ÁLVARO; AMARAL, 2010). No entanto, testes moleculares específicos para detectar este câncer em estágio precoce ainda não tem. Relevantes avanços tecnológicos e metodológicos na área de biologia molecular permitiram fazer uso de biópsias fixadas em formalina neutra (solução aquosa de formaldeído a 3,7 ou 4%, convencionalmente a 10%) e emblocadas em parafina (Formalin fixed parafin embebed - FFPE). As técnicas permitem análises moleculares por imuno-histoquímica testando vários marcadores para diagnóstico e preditores de prognóstico em tecidos FFPE (FOX; HARRIS, 2004; ROCHA, 2004).
Os marcadores tumorais são macromoléculas produzidas primariamente pelo tumor ou pelo hospedeiro em resposta à atividade tumoral. Podem ser investigados para sua presença no tumor, no plasma ou em outros fluídos corporais. A lista dos marcadores tumorais é enorme, mas aqui limitou-se a considerar aqueles melhor estudados ou mais divulgados e alguns, cujo uso é melhor reportado em diagnóstico e prognóstico de CaVB.
Biomarcadores imuno-histoquímico isolados não tem sido suficientes para estabelecer diagnóstico ou prognóstico em CaVB, então, é razoável constituir um rol desses marcadores para otimizar a precisão tanto na detecção como na mensuração da evolução deste câncer. O conjunto de marcadores moleculares discutidos aqui é constituído de uma seleção de proteínas, cuja expressão foi estudada e revisada sistematicamente em artigos recentes (CASTILLO; GARCÍA; ROA, 2010; MALAGUARNERA et al., 2011; AKE, 2012b; MAURYA et al., 2012).
Os testes imuno-histoquímicos tradicionais são os que utilizam dos níveis de marcadores tumorais ou marcadores biológicos para diagnóstico sorológico associado ao desenvolvimento do tumor, no que se refere à invasão, metástases e prognóstico como os codificados pelos antígenos carboidratos: CA 19-9; CA125; CA15-3 (incluídos juntamente com o CEA, no grupo dos epítopos na estrutura de carboidratos presentes em glicoproteínas ou glicolipídeos) e o CA 242.
O antígeno CA 19-9 (glicolipídio CA 19,9, Sialyl Lewis A – SleA) é um
tetrassacarídeo ligado à proteoglicanas na superfície da célula. Não apresenta especificidade por ser expressado em tecidos de diversos órgãos, mas pode facilitar a localização do tumor primário. Seu nível normal no plasma sanguíneo é de até 37U/ml, enquanto sua sensibilidade e especificidade são respectivamente, 79,4% e 79,2% (MALAGUARNERA et al., 2011).
O antígeno carcinoembrionário (CEA) é uma imunoglobulina oncofetal glicosilada (como a maioria das proteínas da membrana plasmática), solúvel, específica para o cólon (cujo nível plasmático normal é de 5 a 10ng/ml), com função principal de promover a adesão entre as células hemolíticas normais. O CEA é secretado em níveis mais elevados em tumores gastrointestinais, portanto, auxilia no diagnóstico sendo sua superexpressão um potencial preditor de mau prognóstico em CaVB, (NOSHIRO et al., 2003; CHOI et al., 2004; MALAGUARNERA et al., 2011). Percebe-se que o CEA tem duplo papel no CaVB, como marcador de diagnóstico e prognóstico. Mas, numa reação negativa entre o antígeno CEA e o seu anticorpo é entendida como 100% de ausência do tumor, enquanto a coloração intensa no epitélio se traduz em 80% de probabilidade de CaVB (AGRAWAL et al., 2010).
A sensibilidade do CA 19.9 e do CEA para CaVB é equivalente, porém a especificidade do primeiro é 20% maior que a do segundo (sensibilidade de 55% e especificidade de 99%).
Há três padrões diferenciais de expressão de acordo com a região das células (apical, estromal e citoplasmática) epiteliais da mucosa da VB. O CA125 é um antígeno que tem seus níveis séricos aumentados em CaVB, além de ser considerado um preditor de invasão peritoneal que não é influenciado (mascarado) pela colecistite crônica (CHAUBE et al., 2006; MALAGUARNERA et al., 2011). Os níveis séricos de CA125 aumentados substancialmente sugere que o tumor já está num estágio avançado (T3 ou T4) e o prognóstico é ruim (MALAGUARNERA et al., 2011). No entanto, exames bioquímicos isolados não decidem o diagnóstico do câncer (SUSUMU et al., 2009), portanto, a superexpressão de CA19-9 isolada não é um preditor de malignidade, mas, preconiza-se que seja utilizado concomitante à outros marcadores bioquímicos para otmizar o prognóstico em CaVB (FONTES et al., 2012).
Análises moleculares têm demonstrado que a perda ou diminuição da adesão celular é uma fase da transformação celular e está correlacionada à fenótipos malignos (invasão e metástase) em diversos tipos de cânceres. A importância dada hoje ao estudo de moléculas de adesão levaram à classificação das mesmas de acordo com suas propriedades bioquímicas e estruturais em: imunoglobulinas (Ig), integrinas, caderinas e selectinas (CHOI et al., 2004). Alterações na expressão destas proteínas (influenciadas por outras em vias metabólicas diferentes ou na mesma via, ou ainda, por defeito da própria proteína) tem atraído a atenção de pesquisadores no sentido de estudá-las como biomarcadores de prognóstico ou diagnóstico em diferentes tipos de cânceres. Assim, os estudos utilizam preferencialmente a detecção por coloração imuno-histoquímica devido à facilidade, rapidez e o baixo custo desse método (CHOI et al., 2004; PUHALLA et al., 2004).
Altos níveis de expressão da glicoproteína endoglina podem ser detectados por imuno-histoquímica utilizando anticorpos, anti-CD105 (FOX; HARRIS, 2004). Esta glicoproteína (hemodimérica, transmembranar com 180 kDa) é uma das mais bem estudadas devido à sua especificidade e superexpressão no endotélio densamente neovascularizado nas circunjacências do tumor, sendo um indicador de índice angiogênico, além de ser um componente acessório da estrutura do complexo de receptores do fator de crescimento transformante (TGF-β 1, fator supressor de linfócito T); o que a torna envolvida numa
complexa via de sinalização que regula vários aspectos comuns do fenótipo celular canceroso (ROCHA, 2006; FONSATTI et al., 2009).
padronizada internacionalmente, para quantificação por coloração imuno-histoquímica de proteínas específicas da angiogênese em áreas de altos índices de novos vasos sanguíneos, sugeriram a possibilidade de correlacionar a imunorreatividade com as proteínas VIIIAg, CD31, 34 e o 105 com o prognóstico de alguns cânceres (FOX; HARRIS, 2004). Então, a partir destes estudos, preconizaram o CD105 como um útil biomarcador preditor de prognóstico desfavorável em uma gama de cânceres de tecidos sólidos incluindo o CaVB, por diversos motivos como: 1) melhor pontuação em angiogênese; 2) especificidade e superexpressão no endotélio de novos vasos sanguíneos em torno e dentro do tumor e; 3) seu envolvimento com o TGF-β (ROCHA, 2006).
A superexpressão de imunoglobulinas (Igs) em células epiteliais tem servido como ferramentas para prognóstico em diversos carcinomas, sendo sugestivas de estágio avançado via metatástica e, portanto, cotadas como um fator independente de mal prognóstico - menor sobrevida em CaVB (ROA et al., 2001; CHOI et al, 2011; JUNG et al 2011). As variantes de imunoglobulinas são produzidas em diversos epitélios e estão envolvidas no crescimento, comunicação celular, angiogênese, produção de citocinas, motilidade, invasão e adesividade dos epitélios (CHOI et al, 2004).
Duas glicoproteínas (Ig) transmembranares CD54 (ICAM1, expressa em células hematopoiéticas) e a isoforma de CD44v6 (HCAMs, componente do receptor de adesão do ácido hialurônico), não são sintetizadas em epitélio biliar normal, a superexpressão de ambas (com simultânea queda de catenina e CD99) e superexpressão de CD147 e MMP2, imunoglobulinas foram correlacionadas à carcinomas avançados de VB (ROA et al., 2001; CASTILLO; GARCÍA; ROA, 2010; CHOI et al, 2011; AKE, 2012a). Em contrapartida a superexpressão de CD56 e CD44s (“S” de standard, variantes da glicoproteína de superfície da forma padrão CD44, expressa em células malignas, correlacionadas com metástase em tumores sólidos) foi, respectivamente, correlacionada à adenomas da VB com pior prognóstico (infiltração tumoral vascular, linfática e metástase) (CHOI et al., 2004; LEE et al., 2008).
tumores, potencialmente afeta a adesão intercelular e favorece o risco de progressão e o potencial metastático do tumor.
A perda de aderência celular é um ponto crítico e característico da desorganização do complexo E-caderina/catenina e está correlacionado à prognóstico ruim (quando comparado com a queda de apenas uma das proteínas do complexo) devido ao aumento do potencial metastático durante a progressão do CaVB (YANAGISAWA et al., 2001; ROA et al., 2002; CHOI et al., 2004; HIRATA et al., 2006).
A E-caderina também denominada caderina epitelial (glicoproteína transmembrana de sete passagem, dependente de cálcio localizada na porção basolateral de todo epitélio) é a principal molécula de adesão, sua expressão constante em epitélios é necessária à manutenção e regulação da adesão intercelular e a associação às cateninas e outras proteínas presentes na junção aderente de células epiteliais. A E-caderina se expressando normalmente, também inibe a transição de célula epitelial tumoral para mesenquimal (TEM) regulando a diferenciação e o crescimento celular, por manter o fenótipo epitelial normal: mobilidade, ancoramento e orientação (ROA et al., 2002; DENADAI et al., 2006). A expressão de E-caderina apical no epitélio normal da VB é reduzida, em comparação com o epitélio escamoso propício à carcinoma escamoso (AKE , 2012b).
A expressão de β-catenina normalmente se dá em baixos níveis no citoplasma e no núcleo celular (CHOI et al., 2004). No estudo de Puhalla et al (2005) e Ake (2012b), a expressão reduzida de E-caderina foi correlacionado com CaVB invasivo de grau 4 (indiferenciado). Há sugestão para a E-caderina ser validada como um marcador de prognóstico em CaVB (AKE, 2012b).
A fosforilação da β-catenina pela enzima GSK-3β, com sua posterior degradação pelo sistema proteossômico da ubiquitina, é um processo regulatório da sua própria expressão, monitorada pela proteína do gene APC (adenomatus polyposis coli - supressor de tumor)
complexado à GSK-3β, interação promovida pela proteína axina. Em caso de mutação com inativação do APC interrompe-se o complexo e o controle da expressão (pelo APC) de β
expressão de beta-catenina foi correlacionada com menor agressividade (CHANG et al., 2002; PUHALLA et al., 2005). Em alterações metaplásicas, displasias de baixo grau, adenomas e CaVB há uma queda dos níveis de expressão de β-catenina (CHOI et al., 2004). Essa expressão apical diminui quando observada a sequência, epitélio normal – CIS (AKE, 2012b). Estes estudos, cujos resultados são autoexplicativos pela função de adesão alterada da β-catenina, apenas confirmam a relação quantitativa do biomarcador e o grau de invasividade dos carcinomas assim como, sua inalteração no epitélio hiperplásico e displásico. A redução de beta-catenina apical foi correlacionada ao grau histológico do tumor em moderado a pouco diferenciado, desse modo, suas características de marcador biológico estão associados a mau prognóstico (CHANG et al., 2002; KIMURA et al., 2003; PUHALLA et al., 2005). A superexpressão de β catenina, como um único marcador testado, pode ser imunopositiva em mais de 50% dos espécimes de vesículas carcinomatosas (KIMURA et al., 2003).
A T-caderina ou H-caderina, produto do gene CDH13, é expressa em diversas células
epiteliais e, além da função de adesão célula-célula e transdução de sinais, também é supressora de tumor. A redução de sua expressão devido à hipermetilação na região promotora do gene com consequente silenciamento do mesmo está associada à alterações histológicas que favorecem a invasão do CaVB para órgão adjacentes (ADACHI et al., 2009). A imunoexpressão de moléculas de adesão L1 em CaVB é positiva (mas, não ocorre em epitélio normal) e pode ser usada como um fator preditor de redução de sobrevida e desenvolvimento do tumor, está associada à disseminação linfática e hematogênica, correspondendo ao grau 3 de diferenciação celular (CHOI et al, 2011).
A região promotora do gene MUC, contém ligação para o NF-kB (fator nuclear-Kb)
para TNFalfa, o receptor de estrogênio e de progesterona, codifica para a proteína MUC1, a mais estudada entre todas as mucinas relacionadas à cânceres (LEE et al., 2012). No entanto, as mucinas são uma família de glicoproteínas transmembranares com 14 membros, que se expressam na superfície externa da membrana plasmática (esse produto também é secretado para o lúmem da vesícula é um órgão hormônio-dependente) de células glândulares e ductais de mucosas normais (SASATOMI et al., 2000).
tumoral com potencial invasão e metástase linfática, está associada a mau prognóstico (CHANG et al., 2009; CASTILLO; GARCÍA; ROA, 2010; MAURYA et al., 2012).
A MUC1 não se expressa em mucosa normal, mas é frequentemente encontrada superexpressando em CaVB (CHANG et al., 2009; MAURYA et al., 2012). A MUC1 e 2 expressa fracamente em vesícula biliar inflamada, mas tem sua expressão aumentada à medida que as lesões vão se aproximando do CIS (CASTILLO; GARCÍA; ROA, 2010; LEE et al., 2012). Chang et al (2009) e Maurya et al (2012), sugerem a MUC1 como: (1) um marcador de progressão maligna, porque a MUC1 aumenta sua expressão à medida que as alterações histológicas vão evoluindo rumo ao CIS e; (2) marcador de invasão associado à característica de expressão despolarizada da MUC1.
A expressão de MUC2 diminui em tumores invasivos, enquanto a MUC1 está relacionada à proliferação de tumores invasivos com mau prognóstico, enquanto a maior expressão da MUC2 é associada à proliferação de tumores não invasivos com bom prognóstico (LEE et al., 2012).
A expressão de MUC4 em CaVB foi correlacionada a sobrevida desfavorável, o tempo de expressão de MUC4 é um fator de risco independente (por si só, tem maior chance de desenvolver a doença) em CaVB, além de ser um bom preditor de prognóstico seria útil como um marcador para selecionar paciente com alto risco de desenvolver CaVB (LEE et al., 2012).
A cicloxigenase 2 (COX2) é encontrada superexpressa em CaVB (WATANABE et al., 2004; WISTUBA; GAZDAR, 2004), assim como também foram encontradas as caspases 3, 6 e 8 (MAURYA et al., 2012). Foi demonstrado que a superexpressão da COX2 está correlacionado ao desenvolvimento das lesões precoces até o CaVB. Portanto, a superexpressão da COX2 tem potencial de um marcador biológico intermediário preditor de desenvolvimento do tumor (LEGAN et al., 2006; CASTILLO; GARCÍA; ROA, 2010; MAURYA et al., 2012). A LOH de p53 estimula a superexpressão de COX-2, a baixa expressão de COX2 foi identificada na mucosa normal de VB, mas essas taxas aumentaram em displasias e CaVB (45 a 70%), sugerindo a expressão desde fases precoces com progressão à medida que a histologia diferencia em direção ao CaVB.
A fosfoproteína TP53 selvagem (wt) é uma supressora de tumor, encontrada em pouca
A TP53 exerce uma função de “barreira molecular” em um ponto do ciclo celular, no qual ela checa e repara erros no DNA lesado e, quando esse objetivo não é alcançado ela direciona a célula lesada para as vias apoptóticas (AREVALO; ARIAS-STELLA; MONGE, 2007). Esta proteína selvagem é pouco estável com uma vida média de 5 a 10 minutos (MAYORA; ARVELOS, 2011; AKE, 2012b). No entanto, quando mutada nas fases iniciais da transformação maligna (MAURYA et al., 2012), os núcleos destas células mutadas superexpressam a oncoproteína TP53 com uma vida média aumentada entre 5 e 20 minutos, podendo se estender por hora (ROCHA, 2004; WISTUBA; GAZDAR, 2004; MAYORA; ARVELOS, 2011; AKE, 2012b).
A baixa expressão da TP53 coincide com a etapa de displasias, associada à colecistite crônica e a alta expressão coincide com o CaVB (WISTUBA; GAZDAR, 2004; AREVALO; ARIAS-STELLA; MONGE, 2007; CASTILLO; GARCÍA; ROA, 2010). Essa expressão vai acumulando no núcleo celular, à medida que o tumor vai progredindo, portanto, correlaciona-se com o estadiamento, tipo e o grau histológico do tumor (WISTUBA; GAZDAR, 2004; AGRAWAL et al., 2010; MALAGUARNERA et al., 2011). Sua máxima expressão coincide com CIS e carcinoma invasivo (CASTILLO; GARCÍA; ROA, 2010). Dessa forma, por imunohistoquímica pode-se inferir a dosagem sérica de anticorpos anti p53, como um marcador bioquímico em pacientes acometidos por CaVB (AKE, 2012b), emergindo então um marcador de progressão tumoral. No que se refere a utilização da TP53 como marcador de prognóstico, primeiro é necessário estabelecer qual é realmente a relação entre a sua superexpressão, a sobrevida e a reincidência (WISTUBA; GAZDAR, 2004; MAURYA et al., 2012), tendo em vista que esta proteína é frequentemente encontrada mutada em CaVB (AREVALO, ARIAS-STELLA; MONGE, 2007; AKE, 2012b).
O Fator de Crescimento Vascular Endotelial (VEGF), é um indutor de proliferação
celular (via Ras/MAPK) e do extravasamento vascular. O VEGF foi identificado imuno-histoquimicamente em quantidades significativas em colecistites crônica e, principalmente em adenomas e CaVB (35-75% e 38- 91%, taxas respectivas). Sua maior expressão foi observada em tumores avançados, portanto, suporta um tripé que correlaciona superexpressão do produto de VEGF, do TP53 e a progressão do tumor, com incremento de vasos sanguíneos
A análise do EGFR (fator de crescimento epidermal, também conhecido como
ERBB1, com atividade tirosina quinase ativam serina/treonina quinases citoplasmáticas) mutado pode ser feita via imuno-histoquímica, detectando as proteínas fosforiladas requeridas pela via de sinalização intracelular a jusante de MAPK e AKT (LEONE et al., 2006). O aumento de tecido intersticial diminui a porcentagem de positividade imunorreativa da proteína do EFG, enquanto aumenta a positividade da proteína do fator de crescimento
transformante (TGF-β 1), estas proteínas foram detectadas em colecistite crônica e em CaVB (YUKAWA et al., 1993). A superexpressão da proteína EGFR está relacionada à metástase linfonodal, a proliferação celular, ao bloqueio da apoptose (LEONE et al., 2006) e sobrevida reduzida (CHENG et al., 2013). Essa oncoproteína fosforila substratos na via de sinalização para estimular mitoses, quanto maior a expressão da oncoproteína maior a agressividade do tumor (KAUFMAN et al., 2008), e mais desfavorável é o prognóstico.
O marcador clássico, Ki67 é um antígeno nuclear, ativo em todas as fases do ciclo celular, exceto na interfase (G0), muito utilizado na clínica médica e quando expresso em altos níveis séricos é um indicador (marcador) de proliferação celular e agressividade em CaVB (MALAGUARNERA et al., 2011). A superexpressão de Ki67 (detectado por anticorpo em núcleos de células proliferativas) e p53 estão geralmente associadas à recidiva e menor sobrevivência em câncer de colo retal e outros, mas sua capacidade como preditor de prognóstico é baixa em CaVB (PUHALLA et al., 2004). Em CaVB escamoso foi
imuno-identificado um aumento na expressão de Ki67 em áreas proliferativas de células escamosas relacionado à maior número de mitoses nesse tipo histológico (ROJAS; MESSA; CHINCILLA, 2010; TOLEDO et al., 2012). O Ki67, foi observado mais reativo em lesões metaplásicas e CIS que em epitélio normal e adenomas (TOLEDO et al., 2012). A alta expressão de Ki67 está correlacionado a um prognóstico ruim (VARGA et al., 2004).
As proteínas, p21Wafl/Cip1, p27KIP1 e p57KIP2 são inibidoras de todas as kinases dependentes de ciclina. São proteínas produzidas e degradadas a cada ciclo celular para se ligarem às CDKs e fosforilar diversos substratos fundamentais à intermediação nos vários pontos de checagem (checkpoints), assim, as CDKs e ciclinas modulam e conduzem a
progressão da célula no ciclo celular (CASTILLO; GARCÍA; ROA, 2010). Fica subentendido que o ciclo celular é um dispositivo bioquímico compartimentalizado muito sensível às alterações moleculares no microambiente. Quando ocorre mutação com silenciamento da família WAFCIP1/KIP1 em tumores avançados leva à perda ou diminuição da expressão da
estejam mutados encontra-se uma menor sobrevida (MAURYA et al., 2012). A sobrevida de pacientes com expressão co-comitante de p21 e p27 está corelacionada à redução, em relação àqueles com imunoexpressão negativa da p21, correlacionados a maior sobrevida (CASTILLO; GARCÍA; ROA, 2010).
Os testes imunohistoquímicos em produtos proteicos do FHIT (tríade frágil do
histidine) em CaVB, indicam que a baixa coloração em epitélio revela perda de expressão da
proteína e, é quase ou totalmente imunorreativa, o KIP2 (dependente da proteína p57), um
outro gene (GST) inibidor das kinases também tem sua expressão proteica depletada, a baixa expressão destas proteínas traduz-se em pior prognóstico (WISTUBA; GAZDAR, 2004; RIQUELME et al., 2007; CASTILLO; GARCÍA; ROA, 2010; MAURYA et al., 2012).
A superexpressão do produto do DPC4, altera a via de sinalização de TGF-β e, foi
encontrado associado a CaVB, por suprimir o crescimento e a apoptose (WISTUBA; GAZDAR, 2004; MALAGUARNERA et al., 2011). Sugere-se que há uma relação entre a baixa expressão da proteína do TGF-β com a proliferação celular descontrolada no epitélio
vesical. A superexpressão desta proteína não induz apoptose e nem inibe a proliferação, o que ocorre é a diminuição da expressão da proteína SMAD4 e do TβRII (SHEN et al., 2007). A expressão do TGF-β foi encontrada em maiores proporções em CaVB com metástase do que
não metastático, além disso, a expressão elevada de TGF-β1 foi associada à progressão, invasão e metástase em CaVB (SHEN et al., 2007; GABBI et al., 2010).
Danos na via de sinalização PI3K/AKT está relacionado à iniciação e progressão do CaVB. A superexpressão da proteína ERK 1/2 nesta via foi relacionada à lesões benignas em estágios iniciais. Mas essa expressão também foi correlacionado à lesões adiantadas e pouco diferenciadas, a invasão local, nódulos linfáticos e metástase (CHENG et al., 2013).
A imunoexpressão da oncoproteína MYC está associada à prognóstico ruim com papel relevante na angiogênese, invasão e metástase (CASTILLO; GARCÍA; ROA, 2010; MALAGUARNERA et al., 2011; MAURYA et al., 2012). A expressão da proteína MYC participa das fases precoces, intermediárias e avançadas do CaVB, o percentual de positividade é proporcional ao dano (YUKAWA et al., 1993).
Espera-se que a imunoexpressão das oncoproteínas do genes HER2 e BCL2 (proteínas
que inibem a apoptose, da família homologous antagonist/killer) tenha impacto no
encontrava amplificado) foi detectada por imuno-coloração em metaplaisa intestinal e CIS (via displasia - CIS), na região basolateral do epitélio da VB (MAURYA et al., 2012; TOLEDO et al., 2012). Nesta região da membrana externa à célula medeia os sinais extracelulares que são internalizados e ativam a via Ras/MAPK de proliferação celular entre o mesênquima e o epitélio vesicular, via ERBB2, receptor transmembranar tirosina kinase. A proteína ERBB2 apresentou baixa expressão em carcinoma invasivo (CHAUBE et al., 2006; CASTILLO; GARCÍA; ROA, 2010; TOLEDO et al., 2012). Sua expressão imuno-histoquímica, foi posititiva em displasia e em adenoma da VB, com (super)expressão em carcinoma da VB, associado a um pior prognóstico, em relação aos tecidos que não a expressam (WISTUBA; GAZDAR, 2004; DIGIOVANNI; KIGUCHI, 2008; CASTILLO; GARCÍA; ROA, 2010). Em adenoma papilar essa expressão indica ocorrência precoce no processo e, é encontrado em pacientes mais jovens (CHAUBE et al., 2006).
Em um estudo recente, a ERBB2 foi identificada superexpressando em fases tardias do CaVB, em uma população do norte da Índia (BAITHA et al., 2012; MAURYA et al., 2012; TOLEDO et al., 2012). Mas, para Chaube et al (2006), a proteína ERBB2 poderia ser utilizada apenas como um marcador intermediário.
O KRAS, através da via MAPK (Proteína Quinase Ativada por Mitógenos em seu
resíduo [SER/TRE quinase]) e de suas proteínas efetoras, regula as seguintes funções celulares: ciclo celular, sobrevida, angiogênese, integridade do citoesqueleto, diferenciação, adesão e migração celular (ALBERTS et al., 2006). Devido a sua importância na homeostasia celular o KRAS é um dos alvos atrativos para estudos de terapia molecular do câncer devido
principalmente a sua influência na proliferação celular e apoptose (via MAPK) alicerçado em seu status mutado (FRIDAY; ADJEI, 2005). Pelas vias PI3K e RAL, o KRAS regula a
apoptose, exocitose e endocitose, respectivamente.
Mutações ativadoras no gene KRAS são responsáveis por uma variante oncogênica da
proteína Ras sinalizadora presente em cerca de 30 a 33% dos cânceres conhecidos (ALBERTS et al., 2006; FEHRENBACHER; BAR-SAGI; PHILIPS, 2009; KYRIAKIS, 2009; RIELY; MARKS; PAO, 2009; NAGUIB, 2011).
A proteína KRAS2B ou p21Kras selvagem superexpressada pode agir como uma supressora de tumor induzindo a parada no ciclo celular ou derivando a célula para a apoptose (JANCIK et al., 2010). Muitos estudos relataram as oncoproteínas KRAS2B e TP53 em epitélio metaplásico e displásico (HOUSTON, 2001; KIMURA et al., 2003).
DNA (PAI; MOJTAHED et al., 2011). Estes genes estão inseridos num sistema de controle do bloqueio da proliferação celular patológica, mas, as informações relacionadas ao equilíbrio do ciclo celular em CaVB são escassas (RIQUELME et al., 2007; MAURYA et al., 2012).
Os oncogenes Ras mutados pontualmente e ativados devido à alteração estrutural de sua proteína são mais sensíveis à tumorigênese (biologia do tumor) por eventos que propiciam a superexpressão da proteína KRAS (MCCOY; BARGMANN; WEINBERG, 1984). Através de estudos experimentais já demonstraram que a superexpressão dessa proteína conseguida por indução (utilizando ultravioleta ou radiação ionizante, choque térmico e citocinas) corrobora para o bloqueio do crescimento, apoptose e senescência celular, como um mecanismo de defesa, ou seja, tem atividade de um supressor de tumor (JANCIK et al., 2010).
1.4 PROGNÓSTICO BASEADO EM ANÁLISE DE DNA
Os primeiros conhecimentos da genética molecular das neoplasias originaram-se de estudos sobre tumores virais e consequentemente as descobertas dos proto-oncogenes como codificadores de proteínas reguladoras da apoptose, do crescimento e da diferenciação celular. Estas proteínas são estimuladas por ligantes externos à célula, que participam da transdução de sinais externos, transmitindo e amplificando estes sinais internamente e, assim regulam rigorosamente, os processos celulares normais sob o controle rigoroso do ciclo celular (WEINBERG, 2008). Estes proto-oncogenes mutados são ativados ou desativados e perdem sua função regulatória da homeostasia celular passando, então, a codificar proteínas insensíveis ao sistema de controle do ciclo celular (SCCC), que por sua vez superestimulam o crescimento, a proliferação celular, a perda interacional homotípica célula-célula (inibição por contato) e outros. São estes eventos que precedem a conversão de uma célula normal a uma maligna na ausência do controle apoptótico (ALBERTS et al., 2006; WEINBERG, 2008).
promotor - MS-PCR (ROA et al., 2006; LETELIER et al., 2012). Quando se pretende analisar a hipermetilação em um conjunto de genes alvos pode-se realizar por amplificação multiplex dependente de sondas para metilação específica - MLPA (GARCIA et al., 2009).
Alterações (deleções ou amplificações submicroscópicas) no número de segmentos de DNA, que variam de 1 kb a vários Mb, dispersas em cerca de 10% do genoma humano comparado a um genoma de referência, as denominadas CNVs (Copy Number Variations), parecem não ter sido investigadas ainda em CaVB (SRINVASTAVA et al., 2011).
Estudos de instabilidade de microssatélites (MSI, microsatellites instability) em CaVB são raros, pouco incidentes (10% em chilenos) e inconclusivos para MSI-H (ROA et al., 2005; RIQUELME et al., 2007; AKE , 2012b; MAURYA et al., 2012; CHENG et al., 2013).
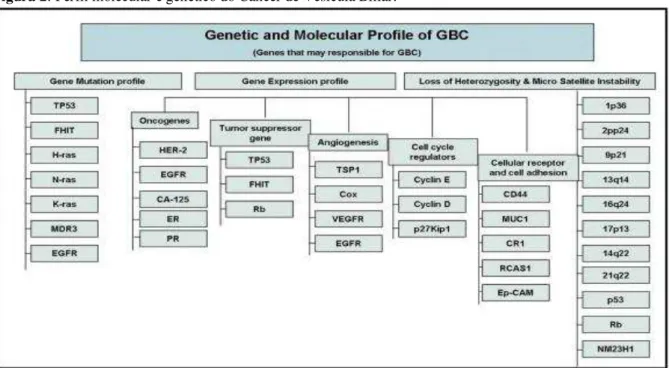
O perfil genético molecular em CaVB contabilizando as principais alterações de expressão gênica, perda de heterozigosidade e MSI foi alvo de extensa revisão bibliográfica (veja a figura 2).
Figura 2: Perfil molecular e genético do Câncer de Vesícula Biliar.
1.5 PROGNÓSTICO BASEADO NO STATUS MUTADO DO KRAS EM VÁRIOS
CÂNCERES
Cerca de 95% das mutações patogênicas, nos codons 12 e 13 do gene KRAS são
2004; SAETTA, 2006; AUSCH et al., 2009; SEIXAS; COLLARES, 2011; SHEN et al., 2011), é o proto-oncogene encontrado com maior incidência de mutações somáticas ativadoras em cânceres humanos é o KRAS (HOUSTON, 2001; HACHISUGA et al., 2005;
MULLIN, 2005; AUNER et al., 2009). Mutações somáticas ativadoras neste proto-oncogene leva-o a ativação com ganho de função ou superexpressão.
Três fenômenos genéticos são responsáveis por contribuir entre se para o aparecimento destes perfis ou standers mutacional por substituição de base: (a) uma das quatro bases é convertida em outra de acordo com as influências do meio; (b) as proteínas reparadoras de DNA danificadas e; (c) se o DNA mutado não é reparado resulta em alterações biológicas.
A isoforma comumente mutada esporadicamente adquirida em cânceres humanos é oriunda do KRAS2B, donde decorrem mutações somáticas missenses nas posições codantes
12, 13, 59 , 61, 63, 117, 119 e 146, estes aminoácidos circundam o bolso de catálise do GTP na proteína KRAS (FIORDALISI et al., 2003; JANCIK et al., 2010).
De acordo com a literatura analizada, o KRAS2B está associado à diversos cânceres
nas seguintes propoções: pâncreas (90%), colo-retal (40%), pulmão (30 a 50% dos casos), tireóide (50%), leucemias mielóide (30%), mama (5%) e outros como pele, bexiga, vesícula biliar, fígado, endométrio, colo do útero, e outros (TYNER et al., 2009; NAGUIB, 2011). Porém, várias outras mutações missenses (patogênicas) associadas à cânceres diversos já foram relatadas nas posições 146 (A146T) para câncer de colo retal e; posições incomuns tanto para leucemias mielóides (74, 141, 146), quanto para Síndrome Noonam (14, 34, 58, 153, 156) outros resíduos também são trocados (TYNER et al., 2009). Mutações no exon 6 do KRAS2B foram reportadas em indivíduos com diversas síndromes, inclusive a síndrome de
Noonan (CARTA et al., 2006).
Mutações missenses nos codons 12, 13 e 61 ativando o proto-oncogene KRAS e
emergindo na via ras aberrante foram encontrados em cerca de 80-90% dos cânceres de pâncreas (NAGUIB, 2011). O montante de mutações no KRAS pode ser útil como uma
ferramenta para auxiliar no diagnóstico de câncer de pâncreas (HACHISUGA et al., 2005). De acordo com Ogino et al (2009), estudos de base populacional tem demonstrado que cerca de 30% a 50% dos cânceres de colo-retal abrigam mutações pontuais nos três codons supracitados, e menos comumente no codon 146 das mutações relatadas para o KRAS (FENG
Mutações acumuladas em diferentes vias moleculares envolvendo diversos genes, em particular o KRAS, num estágio adenomatoso avançado e precoce da carcinogênese em
múltiplas etapas (FEARON; VOLGELSTEIN,1990), também está associado à progressão do
câncer de colo-retal por transformação da mucosa retal normal em maligna, com a mutação mais frequente p.Gly12Val, associada a um pior prognóstico e menor sobrevida com maior probabilidade de recorrência (JONSSON et al., 2009; FENG et al., 2011).
O câncer de pulmão de não-pequenas células (CPNPC), responde por 80% dos dois tipos histológicos primários de câncer de pulmão. Há mais de 20 anos se sabe que no CPNPC os dois proto-oncogenes mais comumente encontrados mutados são os oncogenes KRAS
(codons 12, 13 e 61) e o RFCE- receptor de fator de crescimento epidérmico (EDKINS et al., 2006; WEINBERG, 2008). Acredita-se que as mutações no KRAS estão associadas à
prognóstico ruim em câncer de pulmão avançado. Estudos tem reportado que a exposição ao tabaco é um nexo para esse câncer e mutação pontual ativadora do KRAS nos codons 12 e 13
é incidente em cerca de 97% dos CPNPC, destes, 90% são adenocarcinomas de pulmão. Mutação no KRAS em células escamosas de pulmão é muito raro (RIELY; MARKS; PAO,
2009).
As leucemias mieloide aguda (LMA) são um grupo de doenças neoplásicas muito heterogêneas, com mutações cromossômicas e gênicas. A evolução de eventos mutagênicos até a gênese da LMA decorre de mutações nos mesmos hot spots tradiconais conhecidos com
acréscimo para o codon 146 do KRAS (SABNIS et al., 2009). Conclui-se que esses quatro
aminoácidos “titulares” são essenciais para a proteína KRAS gerir sua função catalítica
normal, no entanto, mutações pontuais nestes codons estão comumente associadas às agressivas LMA em 25-30% dos casos esudados (EDKINS et al., 2006; AHMAD, 2009).
O KRAS é um dos gene candidatos a mutar com ganho de função ativadora e está
associado à 90% dos cânceres mieloproliferativos como as leucemias mielomonocíticas crônica e da primeira infância ou juvenil (LMMC e LMMJ) estas doenças por sinal são muito agressivas e letais (SABNIS et al., 2009), e não são sensíveis a quimioterapia convencional. A LMMJ e LMMC resulta de distúrbio na via efetora RAS/RAF/MEK/ERK com mutação no codon 12 (G12D), “assinatura molecular” de malignidade podendo evoluir para LMA (CUTTS et al., 2009; LYUBYNSKA et al., 2011).
Em leucemia mieloide aguda (LMA), além dos hot spot tradiconais já conhecidos (nos
codons 12G, 13G e 61Q), mutações adicionais ativadoras do KRAS, foram reportadas também
gerir sua função catalítica, no entanto, alterações genéticas nestes codons são encontradas em cerca de 25-30% das LMA, sendo as mutações mais comuns e agressivas (EDKINS et al., 2006; AHMAD, 2009).
Os tumores malignos da tireóide representam 1% de todos os demais cânceres, sendo o adenocarcinoma de tireóide o mais incidente. Os principais tipos histológicos de câncer da tireóide são: papilar (PTC), folicular (FTC), anaplásico (ATC) e o adenoma benigno da tireóide (BTA) é o mais comum. O carcinoma do epitélio folicular da tireóide (FTP) é um dos tumores de tecido sólido mais agresivos, cuja incidência é de 5 a 10% dos carcinomas de tireóide, com sobrevida média de 3 a 7 meses. Acredita-se que o FTP resulta de eventos mutagênicos sequenciais englobando mutações ativadoras do KRAS nas fases iniciais da
tumorigênese (MACIEL et al., 2005). O status mutado do KRAS não é eficiente como um
preditor de prognóstico em Ca de tireóide (MACIEL et al., 2005).
O câncer gástrico intestinal (CGI) é o quarto mais frequente no mundo e o segundo com maior número de vítimas de morte. O KRAS mutado é encontrado em 10% deste
processo carcinogênico de múltiplos passos, cuja taxa de sobrevida nos EUA, é de 21% em qualquer tipo histológico (intestinal ou difuso). O status mutado do KRAS (G12C ou G12S) é
observado na etapa inicial da tumorigênese do CGI, como um preditor do aumento de p21RAS associado à estágios sequenciais histopatológicos (eventos pré-neoplásico: hiperplasia, atrofia e metaplasia epitelial [mucosa gátrica a mucosa intstinal secretora]) e progressivos que se orientam para malignidade de pior prognóstico (MATKAR et al., 2011). Mutações ativadoras do KRAS são encontradas entre 20 - 50% dos cânceres de estômago e também pode ser
detectada em esofago de Barret. Entre todos os tecidos que o KRAS pode ser induzido à
mutação ativadora o estômago parece ser o mais sensível (MATKAR et al., 2011).
O carcinoma de “pele” não melanoma é o câncer dermatológico mais comum no Brasil, e o sexo não é fator predisponente, geralmente não produz metástase e, é classificado histologicamente em espinocelular e basocelular. O carcinoma basocelular é o mais diagnósticado nos EUA. Ao contrário o melanoma é o carcinoma de pele mais agressivo e com pior prognóstico. Este câncer resulta comumente da disfunção da via Ras (RAS/RAF/MEK/ERK), na qual o KRAS é encontrado mutado em 2% dos melanomas e
segundo os modelos animais essa mutação pode ser um dos eventos que contribuem para a tumorigênese de carcinoma de pele (MILAGRE et al., 2010).
Diversos estudos tem mostrado que mutações no proto-oncogene KRAS estão
mais frequênte relatada (HACHISUGA et al., 2005). No câncer de ovário seroso e mucinoso (borderline de baixo grau [via I]), as alterações moleculares mais bem caracterizadas, são as
mutações (mutuamente exclusivas) de maior incidência encontradas nos proto-oncogenes
KRAS e BRAF, essas mutações evoluem lentamente a partir de adenofibromas com o KRAS
mutado (codons 12 e 13) no início da tumorigênese. Geralmente, são detectadas em estágio já bem avançado, com processo de invasibilidade de baixo grau em 1/3 dos borderline e 1/3 dos
micropapilares (VANG; SHIH; KURMAN, 2009). Mutações no gene KRAS, codons 12 e 13,
são as alterações genéticas encontradas com alta frequência em carcinoma de ovário e não respondem bem a terapias alvo. Na Europa o câncer de ovário foi reconhecido em 2005, pela OMS (Organização Mundial de Saúde), como o 5º câncer com maior número de óbitos (AUNER et al., 2009). Além dessas mutações somáticas uma variante germinativa do KRAS
também pode ser encontrada em câncer de ovário assim como em carcinoma oral escamoso (KEANE; RATNER, 2010).
O câncer de bexiga é o 4º carcinoma de maior incidência nos EUA, responsável por muitas vítmas com morte. Mutações ativadoras do KRAS tem sido associadas a tumorigênese
do carcinoma de bexiga e extensivamente registradas na literatura (NANDA et al., 2010) O KRAS mutado no codon 12 também é mais comum nos colangiocarcinomas (CC)
relacionado aos codons 13 e 61, porém, G12D, é a mutação mais frequente (ao invéz de G12T). A incidência de KRAS mutado em CC em ingleses é de 100%, felizmente é um câncer
raro do sistema hepato-biliar. Em CC o status mutado do KRAS pode ser usado como um
preditor de localização e de etiologia do tumor (OKUDA; NAKANUMA; MIYAZAKI, 2002). O carcinoma hepatolcelular (CCI), cujas mutações também tem preferências muito semelhantes ao colangiocarcinoma, exceto pela mutação no codon G12C. Sua maior expressão ocorre na fase precoce da carcinogênese. Nos pontos mais baixos da árvore biliar e está relacionado a metástase linfonodal, status mutado do KRAS associado a pior prognóstico
(KUMAR; ZHAO; WANG, 2011).
Entre as moléculas de sinalização celular a proteína KRAS tem sido uma das mais estudadas ultimamente (BAR-SAGI, 2001; FEHRENBACHER; PHILIPS, 2009). Os genes Ras canônicos, com ênfase para o KRAS2B, hoje são reconhecidamente o maior exemplo de
biomoléculas envolvidas na homeostasia celular da tumorigênese e na manutenção da mesma em diversos cânceres, sendo o oncogene mais comumente mutado em cânceres humano (HOUSTON, 2001; ALBERTS et al., 2006; WANG, 2011). Estudos reportaram que o KRAS