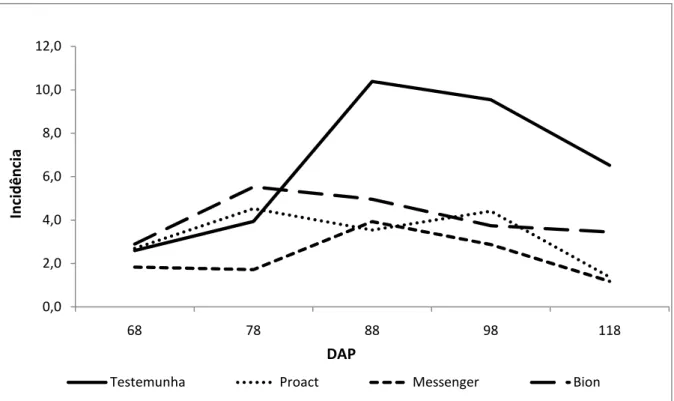
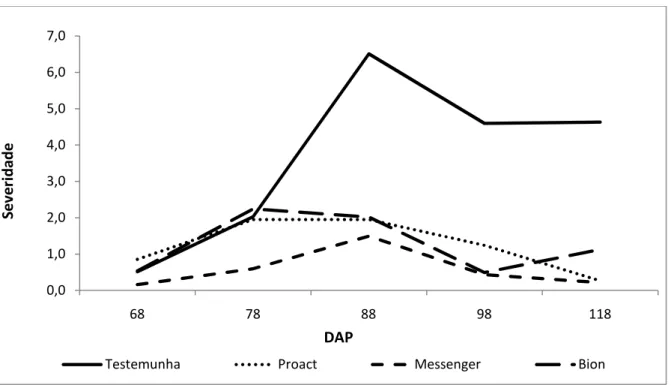
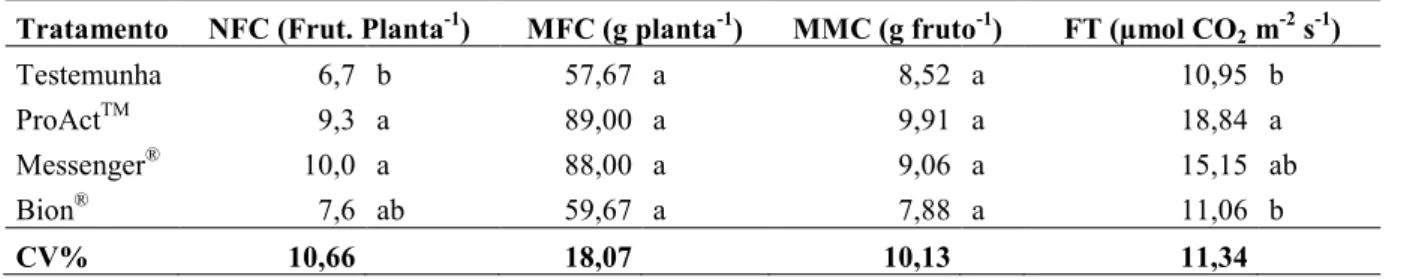
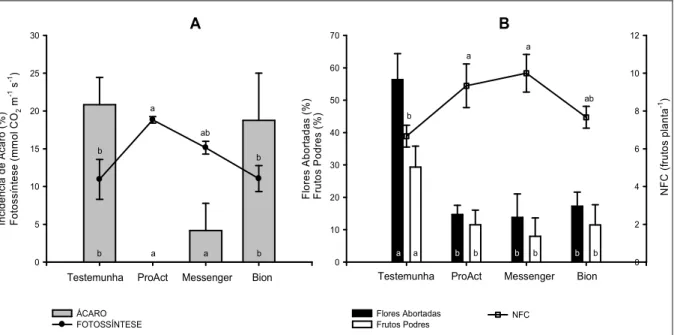
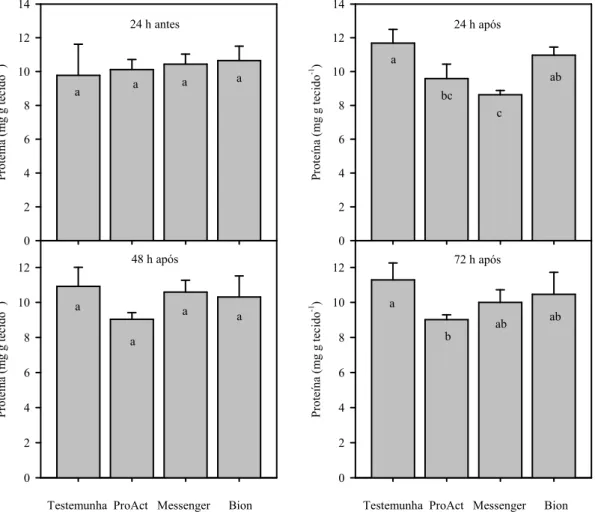
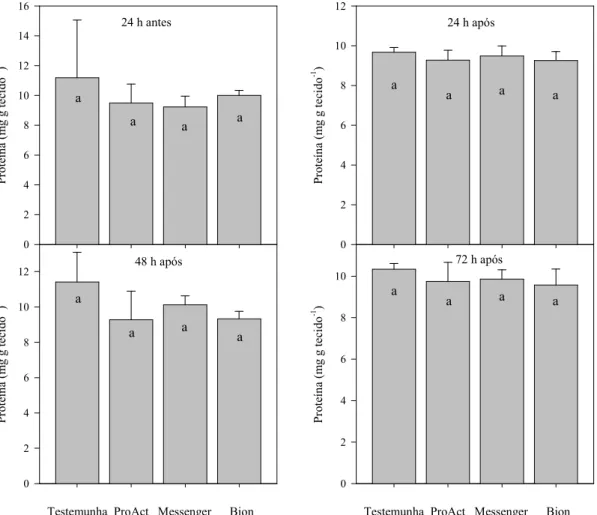
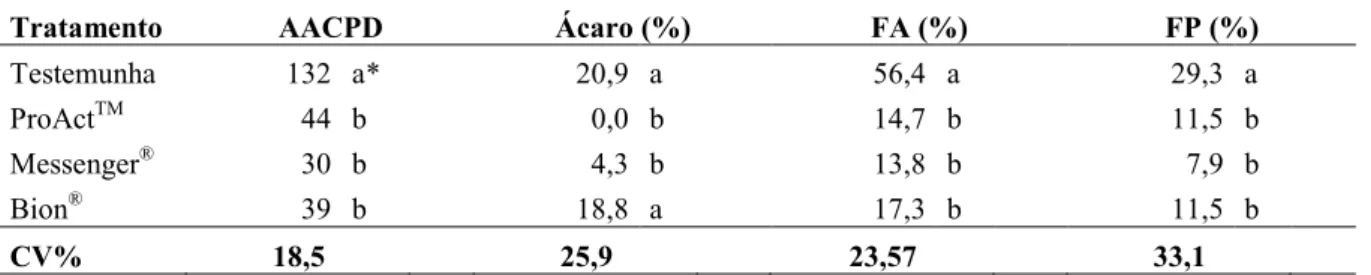
ESISTÊ CIA A DOE ÇAS EM MORA IBE ZOLAR-S-METIL E HARPI A EM COLHEITA
Texto
Imagem



Documentos relacionados
4, inciso XXII da Lei Federal n.º 10.520/2002, acolho a ADJUDICAÇÃO do Pregoeiro e o Parecer Jurídico Conclusivo, no julgamento do PROCESSO N.º 019/2020, na modalidade
Ganhos na seleção para a produtividade de látex em população natural de Hevea brasiliensis na Reserva Chico Mendes: estudo de caso das IAPs (Ilhas de alta produtividade).. Genetic
Quando questionados quanto à definição da ESF, os profissionais entrevistados a descreveram como estratégia envolvendo ações de prevenção e educação em saúde através
Resposta: para traçar os efeitos de curto prazo e longo prazo de uma redução na demanda agregada real por moeda na taxa de câmbio, taxa de juros e nível de preços, é necessário
O artigo 2, intitulado “Tecnologias de Informação e Comunicação (TIC): Estar fora da família, estando dentro de casa”, foi resultado da realização de uma pesquisa de
A experiência desenvolvida pelo Sistema Estatístico Nacional (SEN), com a implementação do Sistema de Indicadores de Contexto do QREN (SIC QREN), definido na
Em nosso grupo de pesquisa, temos nos apropriado de DSR de um modo particular, o que nos levou a desenvolver o Modelo-DSR (Figura 5) em que sintetizamos as principais lições
Even for the usual Becker-D¨ oring equations with input of monomers, the long time behaviour of solutions is not completely understood, [12], and so it seemed advisable to start with