F
OTOQUÍMICA E
C
ARACTERIZAÇÃO
E
SPECTROSCÓPICA
DE
N
OVOS
C
ORANTES
C
IANÍNICOS
Érica Fontes da Silva Torres
Dissertação para a obtenção do Grau de Mestre em
Análises Laboratoriais
Orientador:
________________________________________________
Co
‐Orientador:_____________________________________________
Julho
2010
i
A
GRADECIMENTOS
Às minhas orientadoras Prof.ª Doutora Anabela Sousa Oliveira (no Laboratório de Fotoquímica de Superfícies, do Centro de Química-Física Molecular, do Instituto Superior Técnico) e Prof.ª Doutora Lucinda Vaz Reis (no Laboratório de Química Orgânica, do Centro de Química – Vila Real, da Universidade de Trás-os-Montes e Alto Douro).
Ao Professor Doutor Luis Filipe Vieira Ferreira, por me ter recebido no Laboratório de Fotoquímica de Superfícies, do Centro de Química-Física Molecular, do Instituto Superior Técnico, Universidade Técnica de Lisboa, e me ter dado a oportunidade de efectuar no seu grupo de investigação grande parte do trabalho experimental desta tese.
Aos meus pais por todo o empenho, apoio e dedicação, durante a minha vida, a quem dedico esse trabalho com muito amor.
Às minhas amigas Elisabete, Sandra, Catarina, Bruna, Mariana, Catarina, e Susana por todo o carinho e lições de vida inestimáveis.
À Maria João Brites e Augusta Medeiros pela auto-estima que me deu força para sempre seguir em frente e concluir esse trabalho.
Não podia também deixar de agradecer a toda a minha família pelo apoio incondicional que sempre me deram. Sei que estão orgulhosos de mim por ter concluído mais esta fase, e este trabalho é em parte para vós.
Um agradecimento especial, ao Willian, meu Amor. Obrigado por suportar meus momentos de desânimo, nervosismo, tristeza e desespero quando pensei que não conseguiria cumprir minhas responsabilidades! Você, com palavras e atitudes que às vezes não entendia, foi uma pessoa fundamental para que eu cumprisse mais essa passagem! Muito obrigado!
ii
R
ESUMO
Este trabalho divide-se em duas partes: (1) estudo das propriedades fotofísicas e fotoquímicas de carbocianinas em solução e depositadas em celulose microcristalina. Tanto para as amostras em solução como para as amostras em celulose mediram-se os espectros de absorção do estado fundamental e de fluorescência da série das 3,3´-dialquiltiocarbocianinas e das 3,3´-dialquilselenocarbocianina (alquilo = metilo, etilo, propilo, hexilo e decilo). Determinaram-se os rendimentos quânticos de emissão de fluorescência (em diclorometano e em celulose microcristalina) e de formação de oxigénio singuleto (em clorofórmio) e (2) síntese e caracterização estrutural de novos corantes cianínicos esquarílicos que possuem simultaneamente átomos de selénio e de iodo, o que pressupõe o aumento do rendimento quântico de oxigénio singuleto, requisito essencial para a sua utilização como fotossensibilizadores em Terapia Fotodinâmica (PDT). No esquema abaixo, encontra-se um resumo dos compostos sintetizados neste trabalho. Em geral para cada composto sintetizado é descrito o ponto de fusão e os espectros no Infravermelho (IV), Ultravioleta/visível (UV/VIS), Ressonância Magnética Nuclear de protão e de massa (EM-FAB e EMAR-FAB).
Esquema 1: Síntese do corante esquarílico 7. O O OH HO Se N N Se I I O O -7 N Se I 5 N Se R 1 R = H 2 R = NO2 3 R = NH2 4 R = I Se N N Se I I O OCH3 CF3SO3 -CF3SO3CH3 8 CH3CH2I I -6
iii
This work is divided into two parts: (1) study of photophysical and photochemical properties of carbocyanines in solution and deposited onto microcrystalline cellulose. Both for solution and solid samples ground state absorption spectra and the fluorescence were measured for the series of 3,3´-dialkylthiocarbocyanines and 3,3´-dialkylselenocarbocyanines (alkyl = methyl, ethyl, propyl, hexyl and decyl). Furthermore fluorescence emission (in dichloromethane and microcrystalline cellulose) and singlet oxygen formation quantum yields (in chloroform) were determined and (2) synthesis and structural characterization of new squarylium cyanine dyes that simultaneously have selenium and iodine atoms, what should imply an increase in the quantum yield of singlet oxygen, an essential requirement for their use as photosensitizers in photodynamic therapy (PDT). In the scheme bellow, there is a summary of the compounds synthesized. In general for each synthesized compound is described melting point, infrared spectrum (IR), Ultraviolet/visible (UV/VIS), 1H NMR and mass (FAB- MS and FAB-HRMS).
Scheme 1: Synthesis of squarylium cyanine dyes 7. O O OH HO Se N N Se I I O O -7 N Se I 5 N Se R 1 R = H 2 R = NO2 3 R = NH2 4 R = I Se N N Se I I O OCH3 CF3SO3 -CF3SO3CH3 8 CH3CH2I I -6
iv
S
ÍMBOLOS E
A
BREVIATURAS
c - velocidade da luz no vácuo c.c.f. - cromatografia em camada fina CDCl3 - clorofórmio deuterado
calc. - calculado d - dupleto
dd - dupleto duplo dec. - decomposição
EM-FAB - espectrometria de massa por bombardeamento com átomos rápidos
EMAR-FAB - espectrometria de massa de alta resolução por bombardeamento com átomos rápidos eq. - equivalente f - forte fr - fraca g - grama h - hora (s)
1H-RMN - ressonância magnética nuclear de protão
Hz – Hertz
h - constante de Planck IV - infravermelho
ISC - cruzamento intersistemas IC - conversão interna
J- constante de acoplamento lit. - literatura
v mmol - milimole
m/z - relação massa/carga (espectrometria de massa) m - média m - multipleto [M+] - ião molecular min. - minuto mL - mililitro nm - nanómetro
ppm - partes por milhão pág. - página
p.f. - ponto de fusão PDT - terapia fotodinâmica
p-TSA - ácido p-toluenossulfónico hepta-hidratado p/v - peso por volume
Rf - factor de retardação
s - singuleto sl - singuleto largo S0 - estado fundamental
Sn - n-ésimo estado excitado singuleto
t.a. - temperatura ambiente t - tripleto
TMS - tetrametilsilano
Tn - n-ésimo estado excitado tripleto
UV/VIS - ultravioleta/visível v/v - volume por volume δ - desvio químico
3O
vi µmol - micromole
η - rendimento
φ∆ - rendimento quântico de formação de oxigénio singuleto
φF - rendimento quântico de fluorescência
λ - comprimento de onda
λmáx - comprimento de onda do máximo de uma banda de absorção no UV(nm)
υmáx - número de onda do máximo de uma banda de absorção no IV (cm-1)
εmáx - coeficiente de absorção molar
3-NBA - álcool 3-nitrobenzílico 4-NBA - álcool 4-nitrobenzílico
vii
Í
NDICE
C
APÍTULOI
-
I
NTRODUÇÃO1.1.
C
ORANTES...2
1.1.1. Origem da Cor e Espectro Electromagnético ... 3
1.1.2. Estrutura Molecular dos Corantes ... 4
1.1.3. Cianinas ... 5
1.1.3.1. Nomenclatura das Cianinas ... 6
1.1.4. Cianinas Esquarílicas ... 7
1.1.5. Agregados ... 8
1.2.
F
OTOFÍSICA EF
OTOQUÍMICA EMS
OLUÇÃO ES
UPERFÍCIES... 10
1.2.1. Estudo Fotofísico e Fotoquímico: Aspectos Teóricos ... 10
1.2.2. Processos Fotofísicos ... 10
1.3.
O
XIGÉNIOS
INGULETO ET
ERAPIAF
OTODINÂMICA... 13
1.3.1. Oxigénio Singuleto ... 13
1.3.1.1. Geração de Oxigénio Singuleto ...14
1.3.2. Terapia Fotodinâmica ... 16
1.4.
D
ETERMINAÇÃO DER
ENDIMENTOSQ
UÂNTICOS DEF
LUORESCÊNCIA... 19
1.4.1. Método de Determinação dos Rendimentos Quânticos de Fluorescência
em Solução ... 20
1.4.2. Métodos de Determinação dos Rendimentos Quânticos de Fluorescência
de Sondas Depositadas em Celulose Microcristalina ... 21
1.4.2.1. Método I ...21
1.4.2.2. Método II ...22
viii
C
APÍTULOII
-
A
PRESENTAÇÃO ED
ISCUSSÃO DOSR
ESULTADOS DEF
OTOQUÍMICA2.1.
C
ARBOCIANINAS EMS
OLUÇÃO... 35
2.1.1. 3,3´-dialquiltiocarbocianinas ... 35
2.1.1.1. Absorção UV-VIS...35
2.1.1.2. Emissão de Fluorescência ...38
2.1.1.3. Rendimentos Quânticos de Emissão de Fluorescência ...39
2.1.1.4. Rendimentos Quânticos de Formação de Oxigénio Singuleto ...40
2.1.2. 3,3´-dialquilselenocarbocianinas ... 43
2.1.2.1. Absorção UV-VIS...43
2.1.2.2. Emissão de Fluorescência ...45
2.1.2.3. Rendimentos Quânticos de Emissão de Fluorescência ...46
2.1.2.4. Rendimento Quântico de Formação de Oxigénio Singuleto ...48
2.2.
C
ARBOCIANINASA
DSORVIDAS EMC
ELULOSEM
ICROCRISTALINA... 50
2.2.1. 3,3´-dialquiltiocarbocianinas ... 50
2.2.1.1. Absorção do Estado Fundamental das 3,3´- dialquiltiocarbocianinas Adsorvidas em Celulose Microcristalina ...50
2.2.1.2. Emissão de Fluorescência das 3,3´-dialquiltiocarbocianinas Adsorvidas em Celulose Microcristalina ...54
2.2.1.3. Rendimentos Quânticos de emissão de Fluorescência em Celulose Microcristalina ...58
2.2.1.3.1 Método I ...58
2.2.1.3.2. Método II ...63
2.2.2. 3,3´-dialquilselenocarbocianinas ... 67
2.2.2.1. Absorção do Estado Fundamental das 3,3´-dialquilselenocarbocianinas Adsorvidas em Celulose Microcristalina ...67
2.2.2.2. Emissão de Fluorescência das 3,3´-dialquilselenocarbocianinas Adsorvidas em Celulose Microcristalina ...72
2.2.2.3. Rendimentos Quânticos de emissão de Fluorescência em Celulose Microcristalina ...75
2.2.2.3.1. Método I ...75
2.2.2.3.2. Método II ...79
ix
2.4.
R
EFERÊNCIASB
IBLIOGRÁFICAS... 88
C
APÍTULOIII
-
D
ISCUSSÃO DAS
ÍNTESE DEC
OMPOSTOSO
RGÂNICOS3.1.
D
ISCUSSÃO DAS
ÍNTESE DEC
OMPOSTOSO
RGÂNICOS... 93
3.1.1. Síntese do 2-metil-6-nitro-1,3-benzoselenazole (2) ... 93
3.1.2. Síntese do 6-amino-2-metil-1,3-benzoselenazole (3) ... 95
3.1.3. Síntese do 6-iodo-2-metil-1,3-benzoselenazole (4) ... 97
3.1.4. Síntese do iodeto de 3-etil-6-iodo-2-metil-1,3-benzoselenazólio (5) ... 99
3.1.5. Síntese de
(4Z)-4-[(3-etil-6-iodo-1,3-benzoselenazol-3-io-2-il)metilideno]-
2-[(Z)-(3-etil-6-iodo-1,3-benzoselenazole-2-(3H)-ilideno)metil]-3-oxociclobut-1-en-1-olato (7) ... 101
3.1.6. Tentativas de Síntese do trifluormetanossulfonato de
6-iodo-3-etil-2-[(Z)-
3-etil-6-iodo-1,3-benzoselenazole-2(3H)-ilideno)metil]-2-metoxi-4-oxociclobut-2-en-1-ilideno)metil]-1,3-benzoselenazol-3-io (8) ... 103
3.2.C
ONCLUSÕES... 105
3.3.
R
EFERÊNCIASB
IBLIOGRÁFICAS... 106
C
APÍTULOIV
-
P
ARTEE
XPERIMENTAL4.1.
P
ROCEDIMENTOE
XPERIMENTAL PARA OSE
STUDOSF
OTOQUÍMICOS... 108
4.1.1. Materiais e Reagentes ... 108
4.1.1.1. Cianinas ... 108
4.1.1.2. Substrato ... 111
4.1.1.3. Solventes ... 111
4.1.2. Preparação das Amostras ... 111
4.1.2.1. Preparação das Amostras em Solução ... 111
4.1.2.2. Preparação das Amostras Depositadas em Celulose Microcristalina ... 111
4.1.3. Técnicas e Instrumentação de Espectroscopia Óptica ... 112
x
4.1.3.1.1. Espectroscopia de Absorção Ultravioleta/Visível ... 112
4.1.3.1.2. Reflectância Difusa no Estado Fundamental ... 113
4.1.3.2. Luminescência Estacionária e Resolvida no Tempo ... 116
4.1.3.2.1 Detecção do Oxigénio Singuleto... 118
4.2.
P
ROCEDIMENTOE
XPERIMENTAL PARA AS
ÍNTESE DEC
OMPOSTOSO
RGÂNICOS.. 120
4.2.1. Materiais e Reagentes ... 120
4.2.2. Síntese do Corante Cianínico Esquarílico (7) ... 121
4.2.2.1. Síntese do 2-metil-6-nitro-1,3-benzoselenazole (2) ... 121
4.2.2.2. Síntese do 6-amino-2-metil-1,3-benzoselenazole (3) ... 122
4.2.2.3. Síntese do6-iodo-2-metil-1,3-benzoselenazole (4) ... 123
4.2.2.4. Síntese do iodeto de 3-etil-6-iodo-2-metil-1,3-benzoselenazólio (5) ... 126
4.2.2.5. Síntese de
(4Z)-4-[(3-etil-6-iodo-1,3-benzoselenazol-3-io-2-
il)metilideno]-2-[(Z)-(3-etil-6-iodo-1,3-benzoselenazole-2-(3H)-ilideno)metil]-3-oxociclobut-1-en-1-olato (7) ... 127
4.2.2.6. Tentativas de síntese do trifluormetanossulfonato de
6-iodo-3-etil-2-[(Z)-
3-etil-6-iodo-1,3-benzoselenazole-2(3H)-ilideno)metil]-2-metoxi-4-oxociclobut-2-en-1-ilideno)metil]-1,3-benzoselenazol-3-io (8) ... 128
xi
Í
NDICE DE
F
IGURAS
Figura 1.1: Espectro electromagnético ... 3 Figura 1.2: Estrutura e classificação geral das cianinas. ... 6 Figura 1.3: Grupos heterocíclicos terminais mais comuns nas cianinas: (a) benzoxazole, (b)
benzotiazole, (c) benzoselenazole, (d) benzimidazole, (e) quinolina, (f) 3-H-indole, (g) naftoxazole, (h) naftotiazole ... 7
Figura 1.4: Estrutura geral das cianinas esquarílicas. ... 8 Figura 1.5: Diagrama de Jablonski: Os processos fotofísicos são representados por (1)
absorção de luz (processo radiativo, com tempo da ordem de 10-15 - 10-18 s), (2) relaxação
vibracional (processo não radiativo, com tempo da ordem de 10-12 s) (3) conversão interna
(IC) (processo não radiativo, com tempo da ordem de 10-12 s), (4) fluorescência (processo
radiativo, com tempo da ordem de 10-9 s), (5) cruzamento intersistemas (ISC) (processo não
radiativo, com tempo da ordem de 10-7 s) e (6) fosforescência (processo radiativo, com tempo
da ordem de 10-6 s) ... 11
Figura 1.6: Representação do estado fundamental e dos estados excitados singuleto e
tripleto de uma molécula ... 14
Figura 1.7: Esquema ilustrativo do processo de transferência de energia a partir do
sensibilizador no estado tripleto excitado, para a molécula de oxigénio no estado fundamental,
produzindo oxigénio singuleto nas formas 1Δg e 1Σg... 16
Figura 1.8: Mecanismo de acção da PDT. ... 17 Figura 1.9: Intensidade de emissão de fluorescência da Rodamina 101 adsorvida em celulose
microcristalina, medida como a área total sob espectro de fluorescência e representada em
função de (1-R)*fcorante. ... 22
Figura 1.10: Espectros de reflectância difusa para a Rodamina 101 depositada em celulose
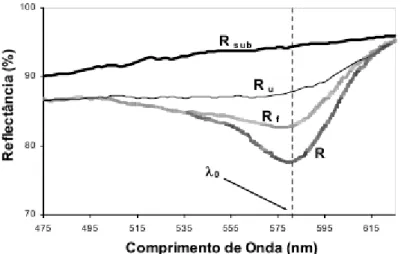
microcristalina. Rsub é a reflectância do substrato, Ru é a reflectância da amostra
desconhecida obtida na ausência de filtro, Rf é a reflectância obtida com filtro de “cut-on” e R
é a reflectância corrigida. Todas estas reflectâncias foram medidas no comprimento de onda
xii
Figura 2.1: a) Espectro de absorção das 3,3´-dialquiltiocarbocianinas (alquilo = metilo, etilo,
propilo, hexilo e decilo), em diclorometano, à temperatura ambiente (20ºC ± 1ºC),
Concentração = 2,0x10-4 M. b) Estruturas dos compostos estudados: (1) iodeto de
dimetiltiocarbocianina; (2) iodeto de dietiltiocarbocianina; (3) iodeto de dipropiltiocarbocianina; (4) iodeto de di-hexiltiocarbocianina; (5) iodeto de 3,3´-dideciltiocarbocianina. ... 35
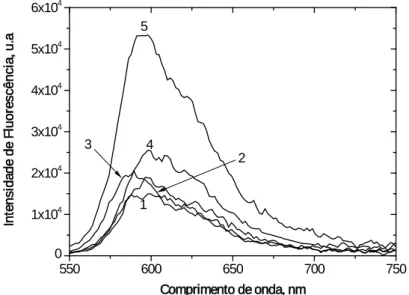
Figura 2.2: Espectros de emissão de fluorescência para a série das
3,3´-dialquiltiocarbocianinas (alquilo = metilo, etilo, propilo, hexilo e decilo) em diclorometano à
temperatura ambiente (20ºC ± 1ºC); Concentração = 2,0x10-4
M; (1) iodeto de dimetiltiocarbocianina; (2) iodeto de dietiltiocarbocianina; (3) iodeto de dipropiltiocarbocianina; (4) iodeto de di-hexiltiocarbocianina; (5) iodeto de 3,3´-dideciltiocarbocianina. ... 38
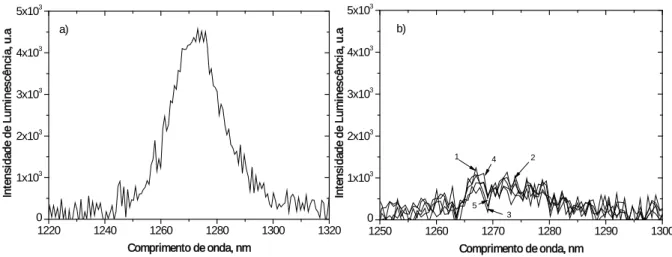
Figura 2.3: Espectro de emissão de oxigénio singuleto a) da fenanzina em clorofórmio
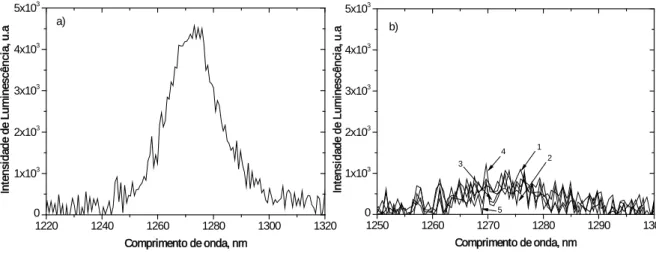
(padrão) b) das 3,3´-dialquiltiocarbocianinas em clorofórmio, à temperatura ambiente (20ºC ± 1ºC), densidade óptica de 0,3 a 337 nm, (1) iodeto de 3,3´-dimetiltiocarbocianina; (2) iodeto de 3,3´-dietiltiocarbocianina; (3) iodeto de 3,3´-dipropiltiocarbocianina; (4) iodeto de 3,3´-di-hexiltiocarbocianina; (5) iodeto de 3,3´-dideciltiocarbocianina. ... 40
Figura 2.4: a) Espectro de absorção das 3,3´-dialquilselenocarbocianinas (alquilo = metilo,
etilo, propilo, hexilo e decilo), em diclorometano, à temperatura ambiente (20ºC ± 1ºC),
Concentração = 2,0x10-4 M. b) Estruturas dos compostos estudados: (1) iodeto de
dimetilselenocarbocianina; (2) iodeto de dietilselenocarbocianina; (3) iodeto de dipropilselenocarbocianina; (4) iodeto de di-hexilselenocarbocianina; (5) iodeto de 3,3´-didecilselenocarbocianina. ... 43
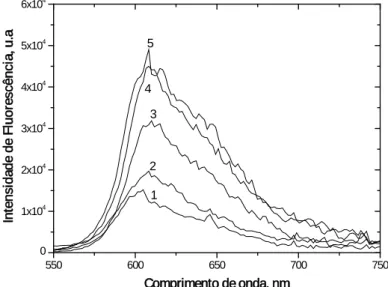
Figura 2.5: Espectros de emissão de fluorescência para a série das
3,3´-dialquilselenocarbocianinas (alquilo = metilo, etilo, propilo, hexilo e decilo) em diclorometano à
temperatura ambiente (20ºC ± 1ºC), Concentração = 2,0x10-4
M; (1) iodeto de dimetilselenocarbocianina; (2) iodeto de dietilselenocarbocianina; (3) iodeto de dipropilselenocarbocianina; (4) iodeto de di-hexilselenocarbocianina; (5) iodeto de 3,3´-didecilselenocarbocianina. ... 46
Figura 2.6: Espectro de emissão de oxigénio singuleto a) de fenanzina em clorofórmio
(padrão) b) das 3,3´-dialquilselenocarbocianinas em clorofórmio, à temperatura ambiente (20ºC ± 1ºC), densidade óptica de 0,3 a 337 nm, (1) iodeto de 3,3´-dimetilselenocarbocianina; (2) iodeto de 3,3´-dietilselenocarbocianina; (3) iodeto de 3,3´-dipropilselenocarbocianina; (4) iodeto de 3,3´-di-hexilselenocarbocianina; (5) iodeto de 3,3´-didecilselenocarbocianina. ... 48
xiii
Figura 2.7: a) Espectro de reflectância difusa b) Função de remissão normalizada no máximo
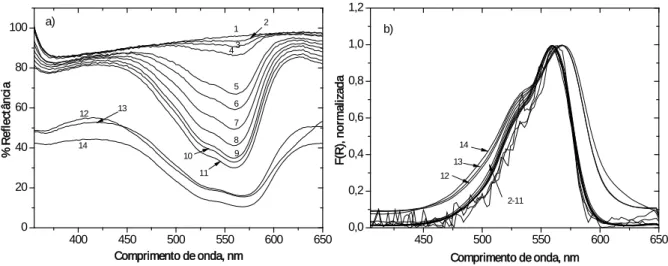
de absorção do monómero, para o iodeto de 3,3´-dimetiltiocarbocianina adsorvida em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,002 µmol/g (3) 0,005 µmol/g (4) 0,010 µmol/g (5) 0,050 µmol/g (6) 0,010 µmol/g (7) 0,20 µmol/g (8) 0,30 µmol/g (9) 0,50 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 24,0 µmol/g. ... 51
Figura 2.8: a) Espectro de reflectância difusa b) Função de remissão normalizada no máximo
de absorção do monómero, para o iodeto de 3,3´-dietiltiocarbocianina adsorvida em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,002 µmol/g (3) 0,005 µmol/g (4) 0,01 µmol/g (5) 0,05 µmol/g (6) 0,1 µmol/g (7) 0,2 µmol/g (8) 0,3 µmol/g (9) 0,5 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 24,1µmol/g. ... 51
Figura 2.9: a) Espectro de reflectância difusa b) Função de remissão normalizada no máximo
de absorção do monómero, para o iodeto de 3,3´-dipropiltiocarbocianina adsorvida em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,002 µmol/g (3) 0,005 µmol/g (4) 0,01 µmol/g (5) 0,05 µmol/g (6) 0,1 µmol/g (7) 0,2 µmol/g (8) 0,3 µmol/g (9) 0,5 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 25,0 µmol/g. ... 52
Figura 2.10: a) Espectro de reflectância difusa b) Função de remissão normalizada no
máximo de absorção do monómero, para o iodeto de 3,3´-di-hexiltiocarbocianina adsorvida em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,002 µmol/g (3) 0,005 µmol/g (4) 0,01 µmol/g (5) 0,05 µmol/g (6) 0,1 µmol/g (7) 0,2 µmol/g (8) 0,3 µmol/g (9) 0,5 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 25 µmol/g. ... 52
Figura 2.11: a) Espectro de reflectância difusa b) Função de remissão normalizada no
máximo de absorção do monómero, para o iodeto de 3,3´-dideciltiocarbocianina adsorvida em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,002 µmol/g (3) 0,005 µmol/g (4) 0,01 µmol/g (5) 0,05 µmol/g (6) 0,1 µmol/g (7) 0,2 µmol/g (8) 0,3 µmol/g (9) 0,5 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 25,0 µmol/g. ... 53
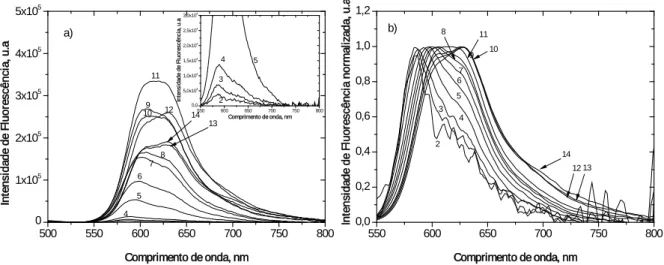
Figura 2.12: a) Espectros corrigidos de emissão de fluorescência de estado estacionário b)
Espectros corrigidos de emissão de fluorescência normalizado no máximo de emissão do monómero do iodeto de 3,3´-dimetiltiocarbocianina, adsorvido em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,002 µmol/g (3) 0,005 µmol/g (4) 0,010 µmol/g (5) 0,050 µmol/g (6) 0,010 µmol/g (7) 0,20 µmol/g (8) 0,30 µmol/g (9) 0,50 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 24,0 µmol/g. ... 55
xiv
Figura 2.13: a) Espectros corrigidos de emissão de fluorescência de estado estacionário b)
Espectros corrigidos de emissão de fluorescência normalizado no máximo de emissão do monómero do iodeto de 3,3´-dietiltiocarbocianina, adsorvido em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,002 µmol/g (3) 0,005 µmol/g (4) 0,01 µmol/g (5) 0,05 µmol/g (6) 0,1 µmol/g (7) 0,2 µmol/g (8) 0,3 µmol/g (9) 0,5 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 24,1µmol/g. ... 55
Figura 2.14: a) Espectros corrigidos de emissão de fluorescência de estado estacionário b)
Espectros corrigidos de emissão de fluorescência normalizado no máximo de emissão do monómero do iodeto de 3,3´-dipropilltiocarbocianina, adsorvido em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,002 µmol/g (3) 0,005 µmol/g (4) 0,01 µmol/g (5) 0,05 µmol/g (6) 0,1 µmol/g (7) 0,2 µmol/g (8) 0,3 µmol/g (9) 0,5 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 25,0 µmol/g. ... 56
Figura 2.15: a) Espectros corrigidos de emissão de fluorescência de estado estacionário b)
Espectros corrigidos de emissão de fluorescência normalizado no máximo de emissão do monómero do iodeto de 3,3´-di-hexiltiocarbocianina, adsorvido em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,002 µmol/g (3) 0,005 µmol/g (4) 0,01 µmol/g (5) 0,05 µmol/g (6) 0,1 µmol/g (7) 0,2 µmol/g (8) 0,3 µmol/g (9) 0,5 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 25 µmol/g. ... 56
Figura 2.16: a) Espectros corrigidos de emissão de fluorescência de estado estacionário b)
Espectros corrigidos de emissão de fluorescência normalizado no máximo de emissão do monómero do iodeto de 3,3´-dideciltiocarbocianina, adsorvido em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,002 µmol/g (3) 0,005 µmol/g (4) 0,01 µmol/g (5) 0,05 µmol/g (6) 0,1 µmol/g (7) 0,2 µmol/g (8) 0,3 µmol/g (9) 0,5 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 25,0 µmol/g. ... 57
Figura 2.17: Intensidade de fluorescência do iodeto de 3,3´-dimetiltiocarbocianina adsorvida
em celulose microcristalina e excitado a 337 nm, medida como a área total do espectro de
emissão corrigido, em função de (1-R)*fcorante. ... 59
Figura 2.18: Intensidade de fluorescência do iodeto de 3,3´-dietiltiocarbocianina adsorvida em
celulose microcristalina e excitado a 337 nm, medida como a área total do espectro de
emissão corrigido, em função de (1-R)*fcorante. ... 59
Figura 2.19: Intensidade de fluorescência do iodeto de 3,3´-dipropiltiocarbocianina adsorvida
em celulose microcristalina e excitado a 337 nm, medida como a área total do espectro de
xv
Figura 2.20: Intensidade de fluorescência do iodeto de 3,3´-di-hexiltiocarbocianina adsorvida
em celulose microcristalina e excitado a 337 nm, medida como a área total do espectro de
emissão corrigido, em função de (1-R)*fcorante . ... 60
Figura 2.21: Intensidade de fluorescência do iodeto de 3,3´-dideciltiocarbocianina adsorvida
em celulose microcristalina e excitado a 337 nm, medida como a área total do espectro de
emissão corrigido, em função de (1-R)*fcorante . ... 61
Figura 2.22: Intensidade de fluorescência do iodeto de 3,3´-dimetiltiocarbocianina adsorvida
em celulose microcristalina e excitado a 560 nm, como função da luz absorvida pelo corante,
que é proporcional a (1-R) *fcorante. ... 63
Figura 2.23: Intensidade de fluorescência do iodeto de 3,3´-dietiltiocarbocianina adsorvida em
celulose microcristalina e excitado a 560 nm, como função da luz absorvida pelo corante, que
é proporcional a (1-R) *fcorante. ... 64
Figura 2.24: Intensidade de fluorescência do iodeto de 3,3´-dipropiltiocarbocianina adsorvida
em celulose microcristalina e excitado a 560 nm, como função da luz absorvida pelo corante,
que é proporcional a (1-R) *fcorante. ... 64
Figura 2.25: Intensidade de fluorescência do iodeto de 3,3´-di-hexiltiocarbocianina adsorvida
em celulose microcristalina e excitado a 560 nm, como função da luz absorvida pelo corante,
que é proporcional a (1-R) *fcorante ... 65
Figura 2.26: Intensidade de fluorescência do iodeto de 3,3´-dideciltiocarbocianina adsorvida
em celulose microcristalina e excitado a 560 nm, como função da luz absorvida pelo corante,
que é proporcional a (1-R) *fcorante. ... 65
Figura 2.27: a) Espectro de reflectância difusa b) Função de remissão normalizada no
máximo de absorção do monómero, para o iodeto de 3,3´-dimetilselenocarbocianina adsorvida em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,003 µmol/g (3) 0,005 µmol/g (4) 0,010 µmol/g (5) 0,050 µmol/g (6) 0,10 µmol/g (7) 0,20 µmol/g (8) 0,30 µmol/g (9) 0,50 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 25,0 µmol/g. ... 68
Figura 2.28: a) Espectro de reflectância difusa b) Função de remissão normalizada no
máximo de absorção do monómero, para o iodeto de 3,3´-dietilselenocarbocianina adsorvida em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,003 µmol/g (3) 0,008 µmol/g (4) 0,015 µmol/g (5) 0,050 µmol/g (6) 0,10 µmol/g (7) 0,20 µmol/g (8) 0,30 µmol/g (9) 0,50 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 25,0 µmol/g. ... 68
xvi
Figura 2.29: a) Espectro de reflectância difusa b) Função de remissão normalizada no
máximo de absorção do monómero, para o iodeto de 3,3´-dipropilselenocarbocianina adsorvida em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,003 µmol/g (3) 0,007 µmol/g (4) 0,015 µmol/g (5) 0,050 µmol/g (6) 0,10 µmol/g (7) 0,20 µmol/g (8) 0,30 µmol/g (9) 0,50 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 25,0 µmol/g. ... 69
Figura 2.30: a) Espectro de reflectância difusa b) Função de remissão normalizada no
máximo de absorção do monómero, para o iodeto de 3,3´-di-hexilselenocarbocianina adsorvida em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,003 µmol/g (3) 0,008 µmol/g (4) 0,015 µmol/g (5) 0,050 µmol/g (6) 0,10 µmol/g (7) 0,20 µmol/g (8) 0,30 µmol/g (9) 0,50 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 25,0 µmol/g. ... 69
Figura 2.31: a) Espectro de reflectância difusa b) Função de remissão normalizada no
máximo de absorção do monómero, para o iodeto de 3,3´-didecilselenocarbocianina adsorvida em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,003 µmol/g (3) 0,008 µmol/g (4) 0,015 µmol/g (5) 0,050 µmol/g (6) 0,10 µmol/g (7) 0,20 µmol/g (8) 0,30 µmol/g (9) 0,50 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 25,0 µmol/g. ... 70
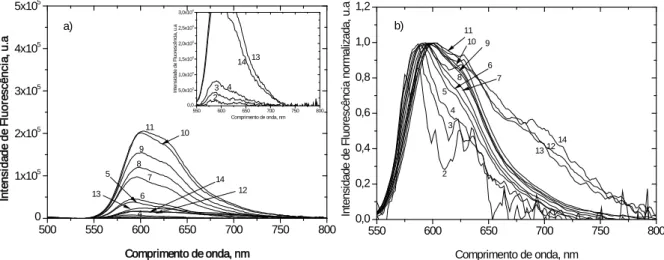
Figura 2.32: a) Espectros corrigidos de emissão de fluorescência de estado estacionário b)
Espectros corrigidos de emissão de fluorescência normalizado no máximo de emissão do monómero do iodeto de 3,3´-dimetilselenocarbocianina, adsorvido em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,003 µmol/g (3) 0,005 µmol/g (4) 0,010 µmol/g (5) 0,050 µmol/g (6) 0,10 µmol/g (7) 0,20 µmol/g (8) 0,30 µmol/g (9) 0,50 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 25,0 µmol/g. ... 72
Figura 2.33: a) Espectros corrigidos de emissão de fluorescência de estado estacionário b)
Espectros corrigidos de emissão de fluorescência normalizado no máximo de emissão do monómero iodeto de 3,3´-dietilselenocarbocianina, adsorvido em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,002 µmol/g (3) 0,005 µmol/g (4) 0,01 µmol/g (5) 0,05 µmol/g (6) 0,1 µmol/g (7) 0,2 µmol/g (8) 0,3 µmol/g (9) 0,5 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 24,1µmol/g. ... 73
xvii
Figura 2.34: a) Espectros corrigidos de emissão de fluorescência de estado estacionário b)
Espectros corrigidos da intensidade de emissão de fluorescência normalizado no máximo de emissão do monómero do iodeto de 3,3´-dipropilselenocarbocianina, adsorvido em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,003 µmol/g (3) 0,007 µmol/g (4) 0,015 µmol/g (5) 0,050 µmol/g (6) 0,10 µmol/g (7) 0,20 µmol/g (8) 0,30 µmol/g (9) 0,50 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 25,0 µmol/g. ... 73
Figura 2.35: a) Espectros corrigidos de emissão de fluorescência de estado estacionário b)
Espectros corrigidos da intensidade de emissão de fluorescência normalizado no máximo de emissão do monómero do iodeto de 3,3´-di-hexilselenocarbocianina, adsorvido em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,003 µmol/g (3) 0,008 µmol/g (4) 0,015 µmol/g (5) 0,050 µmol/g (6) 0,10 µmol/g (7) 0,20 µmol/g (8) 0,30 µmol/g (9) 0,50 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 25,0 µmol/g. ... 74
Figura 2.36: a) Espectros corrigidos de emissão de fluorescência de estado estacionário b)
Espectros corrigidos de emissão de fluorescência normalizado no máximo de emissão do monómero do iodeto de 3,3´-didecilselenocarbocianina, adsorvido em celulose microcristalina a partir do etanol. Concentração em micromoles de corante por grama de celulose: (1) celulose (2) 0,003 µmol/g (3) 0,008 µmol/g (4) 0,015 µmol/g (5) 0,050 µmol/g (6) 0,10 µmol/g (7) 0,20 µmol/g (8) 0,30 µmol/g (9) 0,50 µmol/g (10) 0,75 µmol/g (11) 1,0 µmol/g (12) 5,0 µmol/g (13) 10,0 µmol/g (14) 25,0 µmol/g. ... 74
Figura 2.37: Intensidade de fluorescência do iodeto de 3,3´-dimetilselenocarbocianina
adsorvida em celulose microcristalina e excitado a 337 nm, medida como a área total do
espectro de emissão corrigido, em função de (1-R)*fcorante. ... 76
Figura 2.38: Intensidade de fluorescência do iodeto de 3,3´-dietilselenocarbocianina
adsorvida em celulose microcristalina e excitado a 337 nm, medida como a área total do
espectro de emissão corrigido, em função de (1-R)*fcorante. ... 76
Figura 2.39: Intensidade de fluorescência do iodeto de 3,3´-dipropilselenocarbocianina
adsorvida em celulose microcristalina e excitado a 337 nm, medida como a área total do
espectro de emissão corrigido, em função de (1-R)*fcorante. ... 77
Figura 2.40: Intensidade de fluorescência do iodeto de 3,3´-di-hexilselenocarbocianina
adsorvida em celulose microcristalina e excitado a 337 nm, medida como a área total do
espectro de emissão corrigido, em função de (1-R)*fcorante. ... 77
Figura 2.41: Intensidade de fluorescência do iodeto de 3,3´-didecilselenocarbocianina
adsorvida em celulose microcristalina e excitado a 337 nm, medida como a área total do
xviii
Figura 2.42: Intensidade de fluorescência do iodeto de 3,3´-dimetilselenocarbocianina
adosrvida em celulose microcristalina e excitado a 574 nm, como função da luz absorvida
pelo corante, que é proporcional a (1-R) *fcorante. ... 80
Figura 2.43: Intensidade de fluorescência do iodeto de 3,3´-dietilselenocarbocianina adosrvida em celulose microcristalina e excitado a 574 nm, como função da luz absorvida pelo corante, que é proporcional a (1-R) *fcorante. ... 80
Figura 2.44: Intensidade de fluorescência do iodeto de 3,3´-dipropilselenocarbocianina adosrvida em celulose microcristalina e excitado a 574 nm, como função da luz absorvida pelo corante, que é proporcional a (1-R) *fcorante. ... 81
Figura 2.45: Intensidade de fluorescência do iodeto de 3,3´-di-hexilselenocarbocianina adosrvida em celulose microcristalina e excitado a 574 nm, como função da luz absorvida pelo corante, que é proporcional a (1-R) *fcorante. ... 81
Figura 2.46: Intensidade de fluorescência do iodeto de 3,3´-didecilselenocarbocianina adsorvida em celulose microcristalina e excitado a 574 nm, como função da luz absorvida pelo corante, que é proporcional a (1-R) *fcorante. ... 82
Figura 2.47: Rendimentos quânticos de emissão de fluorescência em diclorometano para a) dialquiltiocarbocianinas (alquilo = metilo, etilo, propilo, hexilo e decilo) b) 3,3´-dialquilselenocarbocianinas (alquilo = metilo, etilo, propilo, hexilo e decilo). ... 84
Figura 2.48: Função de remissão normalizada no máximo de absorção do monómero para a) baixas concentrações (0,005 µmol/g) e b) altas concentrações (25,0 µmol/g) do iodeto de (1) 3,3´-dimetiltiocarbocianina (2) 3,3´-dietiltiocarbocianina (3) 3,3´-dipropiltiocarbocianina (4) 3,3´-di-hexiltiocarbocianina (5) 3,3´-dideciltiocarbocianina. ... 85
Figura 2.49: Função de remissão normalizada no máximo de absorção do monómero para a) baixas concentrações (0,005 µmol/g) e b) altas concentrações (25,0 µmol/g) do iodeto de (1) 3,3´-dimetilselenocarbocianina (2) dietilselenocarbocianina (3) dipropilselenocarbocianina (4) di-hexilselenocarbocianina (5) 3,3´-didecilselenocarbocianina. ... 85
Figura 2.50: Rendimentos quânticos de emissão de fluorescência em celulose microcristalina para a) dialquiltiocarbocianinas (alquilo = metilo, etilo, propilo, hexilo e decilo) b) 3,3´-dialquilselenocarbocianinas (alquilo = metilo, etilo, propilo, hexilo e decilo). ο Método I,• Método II. ... 86
Figura 4.1: Cianinas estudadas neste trabalho. ... 108
Figura 4.2: Estrutura da cianina esquarílica sintetizada neste trabalho. ... 108
xix
xx
Í
NDICE DE
E
SQUEMAS
Esquema 1: Síntese do corante esquarílico 7. ... ii
Esquema 3.1: Síntese do 2-metil-6-nitro-1,3-benzoselenazole (2). ... 93
Esquema 3.2: Síntese do 6-amino-2-metil-1,3-benzoselenazole (3).... 95
Esquema 3.3: Métodos de síntese testados para a obtenção do 6-iodo-2-metil-1,3-
benzoselenazole (4). ... 97
Esquema 3.4: Síntese do iodeto de 3-etil-6-iodo-2-metil-1,3-benzoselenazólio (5). ... 99
Esquema 3.5: Síntese de
(4Z)-4-[(3-etil-6-iodo-1,3-benzoselenazol-3-io-2-il)metilideno]-2-[(Z)-(3-etil-6-iodo-1,3-benzoselenazole-2-(3H)-ilideno)metil]-3-oxociclobut-1-en-1-olato (7). ... 101
Esquema 3.6: Tentativas de síntese de trifluormetanossulfonato de
6-iodo-3-etil-2-[(Z)-3-etil-
xxi
Í
NDICE DE
T
ABELAS
Tabela 1.1: Ocupação dos orbitais moleculares antiligantes, notação espectroscópica e
energia relativa do estado fundamental, para os estados electrónicos do O2 ... 14
Tabela 2.1: Comprimento de onda máximo de absorção (λmáx, nm) e coeficiente de absorção
molar (
ε
, M-1.cm-1) das 3,3´-dialquiltiocarbocianinas em diclorometano à temperatura ambiente(20ºC ± 1ºC). ... 37
Tabela 2.2: Rendimento Quântico de Emissão de Fluorescência,
φ
F, das3,3´-dialquiltiocarbocianinas em diclorometano. ... 39
Tabela 2.3: Rendimento quântico de formação de oxigénio singuleto (
φ
∆) das3,3´-dialquiltiocarbocianinas em clorofórmio à temperatura ambiente (20ºC ± 1ºC), usando como padrão a fenanzina em clorofórmio. ... 41
Tabela 2.4: Comprimento de onda máximo de absorção (λmáx, nm) e coeficiente de absorção
molar (
ε
, M-1.cm-1) das 3,3´-dialquilselenocarbocianinas em diclorometano à temperaturaambiente (20ºC ± 1ºC). ... 44
Tabela 2.5: Rendimento Quântico de Emissão de Fluorescência,
φ
F, das3,3´-dialquilselenocarbocianinas em diclorometano. ... 47
Tabela 2.6: Rendimento quântico de formação de oxigénio singuleto (
φ
∆) das3,3´-dialquilselenocarbocianinas em clorofórmio à temperatura ambiente (20ºC ± 1ºC), usando como padrão a fenanzina em clorofórmio. ... 49
Tabela 2.7: Rendimentos Quânticos de Fluorescência,
φ
F, determinados pelo método I paraas 3,3´-dialquiltiocarbocianinas adsorvidas em celulose microcristalina. ... 61
Tabela 2.8: Rendimentos Quânticos de Fluorescência,
φ
F, determinados pelo método II paraas 3,3´-dialquiltiocarbocianinas adsorvidas em celulose microcristalina. ... 66
Tabela 2.9: Rendimentos Quânticos de Fluorescência,
φ
F, determinados pelo método I paraas 3,3´-dialquilselenocarbocianinas adsorvidas em celulose microcristalina. ... 78
Tabela 2.10: Rendimentos Quânticos de Fluorescência,
φ
F, determinados pelo método II paraxxii
Tabela 3.1: Rendimento e dados físicos e espectroscópicos do
2-metil-6-nitro-1,3-benzoselenazole (2). ... 94
Tabela 3.2: Rendimento e dados físicos e espectroscópicos do
6-amino-2-metil-1,3-benzoselenazole (3). ... 96
Tabela 3.3: Rendimento e dados físicos e espectroscópicos do
6-iodo-2-metil-1,3-benzoselenazole (4). ... 98
Tabela 3.4: Rendimento e dados físicos e espectroscópicos do iodeto de
3-etil-6-iodo-2-metil-1,3-benzoselenazólio (5). ... 100
Tabela 3.5: Rendimento e dados físicos e espectroscópicos do corante esquarílico 7. ... 102 Tabela 4.1: 3,3´-dialquiltiocarbocianinas usadas neste trabalho. ... 109 Tabela 4.2: 3,3´-dialquilselenocarbocianinas usadas neste trabalho. ... 110
1
CAPÍTULO I
Neste capítulo é feita uma introdução aos corantes cianínicos e cianínicos esquarílicos (estrutura e aplicações) e aos processos fotofísicos e fotoquímicos que serão estudados neste trabalho.
2
1.1.
C
ORANTES
Desde o início da civilização, o homem tentou reproduzir as cores da natureza. Para isso, desenvolveu métodos para isolar os corantes e pigmentos de fontes naturais, principalmente as de origem animal ou vegetal. No entanto, as propriedades de muitas destas substâncias estavam longe do ideal para as aplicações pretendidas, problema que se somava à sua indisponibilidade comercial e à dificuldade em reproduzir as cores. Tal conjunto de problemas potenciou a tentativa de síntese de corantes sintéticos com propriedades tecnicamente superiores, de baixo custo e rápida obtenção. Somente em 1856, o químico britânico William Henry Perkin descobriu, acidentalmente, uma via sintética para a produção de um corante orgânico, a Mauveína. A partir dessa descoberta, em poucos anos, os corantes sintéticos substituíram quase todos os antigos corantes naturais [1].
Actualmente, praticamente todos os corantes e pigmentos disponíveis são substâncias sintéticas orgânicas. Todos os anos centenas de novos compostos corados são descritos na literatura, para uma multiplicidade de aplicações. Existem numerosas estruturas químicas de corantes, sendo a sua classificação detalhada feita no Color Index, publicação que divide os corantes em 25 classes estruturais [2].
Existe alguma confusão quanto ao uso dos termos corante e pigmento, sendo que em muitas situações são considerados sinónimos. A diferença básica entre pigmento e corante está no tamanho das partículas e na solubilidade no meio em que são inseridos. Os pigmentos possuem, no geral, tamanho de partícula maior e são insolúveis no seio do substrato, enquanto que os corantes são moléculas solúveis no substrato que vai receber a cor [3-5]. Assim, pode-se afirmar que os corantes são utilizados em solução e os pigmentos em suspensão. Além disso, os pigmentos têm maior estabilidade química e térmica que os corantes [6].
Corantes e pigmentos são projectados para conferir cor a um material e, assim, a sua estrutura molecular possui um ou mais grupos químicos responsáveis por emitir essa
3
cor [7]. Cabe lembrar que até ao desenvolvimento da teoria quântica, na década de 1930, os químicos não possuíam um entendimento razoável dos motivos que levavam as substâncias a possuírem cor [8].
1.1.1.
O
RIGEM DAC
OR EE
SPECTROE
LECTROMAGNÉTICOA luz é uma forma de radiação electromagnética, que é composta por fluxos de fotões que carregam quantidades discretas de energia, em movimento ondulatório, e que obedecem à seguinte relação:
(1.1)
onde
h
é a constante de Planck (6,34 x 1034 J.s),c
é a velocidade da luz eλ
é o comprimento da onda [8].O espectro electromagnético é também composto por outros tipos de radiação, como os raios gama, os raios X, as ondas de rádio, etc., para além da radiação ultravioleta-visível, como mostrado a seguir, na Figura 1.1.
Figura 1.1: Espectro electromagnético [8b].
λ
λ
hc
fotão
4
A radiação visível (VIS) corresponde à região do espectro electromagnético que é percebida pelo olho humano e cujo comprimento de onda varia, para a maioria da população, entre 380 e 720 nm. Cada cor corresponde a uma parcela dessa faixa de comprimento de onda [8,9].
A radiação ultravioleta (UV), por sua vez, cobre uma pequena parte do espectro electromagnético, variando de 100 a 400 nm. A região UV é, ainda, dividida em três regiões: UVA, de 400-315 nm; UVB, de 315-280 nm; e UVC, de 280-100 nm [8,9].
As cores dos corantes e pigmentos são devidas à absorção de radiação electromagnética pelos compostos na faixa da luz visível (400-720 nm) [10,11]. Contudo, somente os compostos com ligações insaturadas conjugadas na sua estrutura química, tais como –C=C-, -N=N- e -C≡N-, são capazes de absorver radiação na faixa da luz visível. Em função de absorverem luz com elevada eficiência, em alguma região do espectro visível, alguns desses compostos podem também serem capazes de induzir ou participar em reacções fotoquímicas [12].
Actualmente, existe um considerável interesse na avaliação teórica e empírica das relações entre cor e estrutura molecular. Este interesse tem sido acentuado por áreas em expansão onde as cores e os corantes estão agora presentes, e as relações cor-estrutura são valiosas mesmo para cientistas trabalhando em áreas aparentemente não relacionadas. Sistemas de mostradores de cristais líquidos, sensores de radiação de alta energia, impressões laser a cores e utilização como fotossensibilizadores para terapia fotodinâmica (PDT), são exemplos recentes da aplicação de corantes sintéticos [1].
1.1.2.
E
STRUTURAM
OLECULAR DOSC
ORANTESA estrutura das moléculas de corante são complexas quando comparadas com a maioria dos compostos orgânicos. A formação da cor deriva da deslocalização de electrões através de sistemas conjugados de ligações duplas e simples. Isto implica que, as moléculas do corante sejam insaturadas, sendo na sua maioria conjuntos de anéis
5
aromáticos ligados entre si por grupos designados por cromóforos, que fornecem a conjugação necessária ao aparecimento da cor. O sistema conjugado permite deslocalizações extensas de electrões π a partir das ligações duplas e resulta em pequenas diferenças de energia entre as orbitais moleculares ocupadas e desocupadas para estes electrões. São necessárias pelo menos 5 ou 6 ligações duplas na estrutura molecular do composto para este ser corado [1,12].
1.1.3.
C
IANINASAs cianinas constituem uma classe da família dos corantes polimetínicos, cuja a estrutura geral se apresenta na Figura 1.2 [13]. Estas moléculas podem ser obtidas por métodos de síntese simples, e numa larga variedade estrutural podendo exibir uma ampla diversidade de cores dependendo do meio em que se encontram. Perdem a cor sob acção da luz (fotólise) ou em meio ácido. São compostos que apresentam bandas de absorção estreitas com elevados coeficientes de extinção molar no visível (∼105 M−1cm−1) [14]. Como grupo, as cianinas absorvem numa larga zona espectral compreendida entre o ultravioleta e o infravermelho próximo [11]. A intensa cor das cianinas está associada à interacção de ressonância entre os átomos de azoto nos dois extremos da cadeia conjugada, envolvendo a deslocalização da carga positiva [15].
Os corantes cianínicos apresentam um cromóforo que inclui um sistema linear de conjugação-π com número ímpar de átomos de carbono e dois anéis heterocíclicos contendo dois átomos de azoto nas suas extremidades. Um dos anéis heterocíclicos funciona como doador e o outro como aceitador de electrões [10,11]. Geralmente estes corantes apresentam geometria trans na sua forma mais estável e ocasionalmente podem sofrer fotoisomerização [16].
6 N X X N R1 R2 n Z Y Y
Figura 1.2: Estrutura e classificação geral das cianinas.
n = 0 – cianina; n = 1 – carbocinanina; n = 2 – dicarbocianina e n = 3 – tricarbocianina; X = S, Se, O, N, C(CH3)2…..
Y = Grupos heterocíclicos terminais (ver Figura 1.3) R1 e R2= CH3, C2H5, C3H7, C6H13, C10H21….
Z- = Cl-, I-…..
1.1.3.1.
N
OMENCLATURA DASC
IANINASAs cianinas classificam-se com base no comprimento da cadeia cromófora, o qual está relacionado com o número de grupos metinos ( CH ) entre os anéis
heterocíclicos terminais. Denomina-se cianina, aquela que tem um único grupo metino entre os anéis heterocíclicos (n=0) e carbocianina a que apresenta três grupos metino em posição idêntica (n=1). Dicarbocianina e tricarbocianina são cianinas que contêm cinco (n=2) e sete (n=3) grupos metino, respectivamente, entre os anéis heterocíclicos terminais [17]. O limite do comprimento da cadeia é controlado pelas possibilidades sintéticas e pela estabilidade química dos corantes sintetizados, que, normalmente, diminui à medida que se aumenta o comprimento da cadeia [17].
Os grupos de anéis heterocíclicos terminais, são designados pelos prefixos identificadores de cada núcleo (Figura 1.3). É normal indicar a posição e o tipo de substituinte ligado ao heteroátomo e os substituintes da cadeia cromófora, caso existam, antes do nome do heterocíclico. A posição da substituição é indicada numerando cada núcleo separadamente, sendo que o segundo núcleo distingue-se do primeiro através de um apóstrofo.
7
Figura 1.3: Grupos heterocíclicos terminais mais comuns nas cianinas: (a) benzoxazole, (b)
benzotiazole, (c) benzoselenazole, (d) benzimidazole, (e) quinolina, (f) 3-H-indole, (g) naftoxazole, (h) naftotiazole [18].
As cianinas podem apresentar estrutura simétrica ou assimétrica consoante os grupos terminais e os grupos substituintes ligados aos átomos de azoto sejam idênticos ou diferentes. Nas cianinas assimétricas, os núcleos heterocíclicos são indicados por ordem alfabética [17].
1.1.4.
C
IANINASE
SQUARÍLICASOs corantes cianínicos esquarílicos foram sintetizados pela primeira vez na década de 1960. Apresentam estruturas polimetínicas, e por isso são ocasionalmente classificadas como corantes cianínicos [17]. Eles apresentam intensa absorção de luz e, às vezes de emissão de fluorescência, semelhante aos corantes cianínicos, e por isso tem atraído a atenção do ponto de vista de possíveis aplicações tecnológicas.
Há, no entanto, uma diferença importante entre as estruturas electrónicas das cianinas e das cianinas esquarílicas. Os corantes cianínicos esquarílicos são uma classe de corantes com estrutura de ressonância zwitteriónica. Estes corantes, normalmente contêm um anel central de quatro membros deficiente em electrões e dois
N O N S N Se N H N N N C H3C CH 3 N O N S (a) (b) (c) (d) (e) (f) (g ) (h)
8
grupos dadores de electrões [19]. A estrutura geral das cianinas esquarílicas é apresentada na Figura 1.4.
Figura 1.4: Estrutura geral das cianinas esquarílicas.
R1 e R2 = grupo alquilo, ….. X = O-, OCH3, NH2, NHCH3, NH-(3-I-C3H4)….. Z- = I-, Cl-, CF3SO3 -….. Y = grupo aromático
Nos últimos anos, a família dos corantes esquarílicos tem recebido considerável atenção devido às suas propriedades, tais como estabilidade fotoquímica, elevada fotocondutividade e intensa absorção na região do visível e infravermelho próximo [20]. Estas e outras propriedades têm tornado estes corantes muito atraentes para diversas aplicações, tais como fotorreceptores xerográficos [21], células solares orgânicas [22] e meios ópticos de gravação [23]. Ultimamente, há um interesse crescente desta classe de corantes como sensores para a determinação de metais [24], técnicas de ensaios biológicos [25a], como sondas para detecção de proteínas [25b] e sensibilizadores para terapia fotodinâmica (PDT) [26,27].
1.1.5.
A
GREGADOSO estudo da absorção do estado fundamental das cianinas em solução [28] ou adsorvidas em substratos sólidos [29] mostra frequentemente o aparecimento de novas bandas de absorção desviadas, tanto para maiores como para menores comprimentos de onda, relativamente ao máximo de absorção do corante em soluções diluídas. Estas
Y N CH O X CH N Y R1 R2
Z
9
bandas crescem com o aumento da concentração, à custa do decréscimo da absorção do monómero, e são devidas à formação de espécies agregadas [16].
A formação de espécies agregadas resulta da interacção entre moléculas próximas de um dado composto. As moléculas envolvidas na formação dos agregados deixam de se comportar como espécies isoladas, uma vez que, as interacções moleculares estabelecidas, afectam fortemente a energia dos seus níveis electrónicos. A agregação é um processo reversível que depende da temperatura e da concentração de cianina em solução e é facilitada pela adsorção na superfície de sólidos, tais como quartzo e halogenetos de prata [30].
A formação de agregados é um processo comum para os compostos orgânicos com sistema de conjugação-π [30,31]. Em compostos deste tipo, observam-se dois tipos de agregados moleculares, conhecidos como agregados H e agregados J. Os agregados H apresentam desvios hipsocrómicos (para menores comprimentos de onda) relativamente à banda de absorção do monómero [30-32]. O aparecimento de uma banda geralmente estreita e intensa com um desvio batocrómico (para maiores comprimentos de onda) relativamente à banda do monómero é devida a formação de agregados do tipo J [33]. A primeira descrição para a formação de agregados J ocorreu em 1936 [34]. Estes são agregados unidimensionais de cianinas, e são usados como fotossensibilizadores eficientes em emulsões fotográficas. Algumas porfirinas iónicas que formam agregados similares foram descobertas posteriormente, em 1971 [35].
A agregação de um corante afecta a sua actividade fotodinâmica, pois induz a redução dos rendimentos quânticos e tempos de vida dos estados excitados singuleto e tripleto e consequentemente reduz a sua capacidade de produção de oxigénio singuleto [36,37].
10
1.2.
F
OTOFÍSICA E
F
OTOQUÍMICA EM
S
OLUÇÃO E
S
UPERFÍCIES
1.2.1.
E
STUDOF
OTOFÍSICO EF
OTOQUÍMICO:
A
SPECTOST
EÓRICOSO entendimento da fotofísica e da fotoquímica de um dado composto ou classe de compostos permite-nos compreender e explorar várias das suas propriedades. Boa parte dos métodos analíticos para o estudo e entendimento das propriedades fotofísicas e fotoquímicas de um composto baseia-se na interacção da luz com a matéria [38,39].
A absorção de luz, ultravioleta ou visível, por uma molécula é, geralmente, o resultado de uma transição electrónica, e pode ser estudada por espectroscopia electrónica. Uma transição electrónica consiste na promoção de um electrão do estado fundamental para outro de maior energia (estado excitado) como resposta à absorção de radiação electromagnética [38-40].
O espectro de absorção e o espectro de emissão de uma molécula fornecem-nos informações importantes com respeito à estrutura, energia e dinâmica dos processos que ocorrem a partir de níveis electronicamente excitados. As principais características observadas numa banda de um espectro de absorção são a posição e a intensidade. A posição da banda de absorção corresponde ao comprimento de onda da radiação necessária para que a transição ocorra. Já a intensidade está relacionada à probabilidade da transição ocorrer [39]. Numa banda de um espectro de emissão, analisa-se a sua posição, a intensidade e o tempo de vida.
1.2.2.
P
ROCESSOSF
OTOFÍSICOSQuando uma molécula é excitada, o estado em que ela se encontra, é energeticamente instável relativamente ao seu estado fundamental [38-40]. Se a molécula não sofrer rearranjo ou se fragmentar (processo químico), de alguma forma ela perderá energia para retornar ao estado fundamental (processo físico). Há diferentes possibilidades para a desexcitação dessa molécula. Alguns processos poderão ser mais favorecidos que outros, dependendo do tipo de molécula, da natureza dos estados
11
excitados envolvidos no processo, e do solvente. Esses caminhos são classificados em processos radiativos, não-radiativos e de extinção [39].
Os processos radiativos são fenómenos de luminescência através dos quais os estados excitados decaem para o estado fundamental, com emissão de radiação electromagnética. Os fenómenos de luminescência podem ser de fluorescência e fosforescência [39]. Estes processos são explicados por um diagrama que mostra os níveis de energia da molécula e permitem analisar as transições envolvidas tanto nos processos de absorção quanto nos de relaxação (Diagrama de Jablonski) [41]. A forma actual do diagrama de Jablonski representa o estado fundamental de uma molécula e seus estados excitados singuleto e tripleto, conforme representado na Figura 1.5.
Figura 1.5: Diagrama de Jablonski: Os processos fotofísicos são representados por (1) absorção
de luz (processo radiativo, com tempo da ordem de 10-15 - 10-18 s), (2) relaxação vibracional (processo não radiativo, com tempo da ordem de 10-12 s) (3) conversão interna (IC) (processo não radiativo, com tempo da ordem de 10-12 s), (4) fluorescência (processo radiativo, com tempo da ordem de 10-9 s), (5) cruzamento intersistemas (ISC) (processo não radiativo, com tempo da ordem de 10-7 s) e (6) fosforescência (processo radiativo, com tempo da ordem de 10-6 s) [modificado da Ref. 41].
Num diagrama de Jablonski, os estados electrónicos singuleto fundamental, e primeiro e segundo excitados são descritos por S0, S1, S2, respectivamente. Entre os
estados electrónicos, estão representados os subníveis que representam os estados vibracionais, os quais são desactivados por processos de relaxação vibracional. Para os estados tripleto, a descrição é Tn com n = 0, 1, 2, ... Os níveis de energia electrónicos
12
moleculares estão representados por linhas horizontais separadas verticalmente pela diferença de energia entre eles, ilustrando a natureza quase instantânea da absorção e emissão radiativas.
A absorção de radiação electromagnética, ocorre num intervalo de tempo entre 10-15e 10-18s, muito curto quando comparado com o movimento nuclear [41]. Assim, a transição electrónica mais provável será aquela em que não estão envolvidas mudanças nas coordenadas nucleares.
Após a excitação da molécula para um estado electrónico superior (Sn, com n>1),
a tendência usual é a desexcitação por relaxação vibracional e/ou conversão interna, até o primeiro estado singuleto excitado. Esse processo envolve a desexcitação da molécula através dos níveis vibracionais que unem esses estados.
A partir do primeiro estado excitado singuleto, S1, a molécula poderá fluorescer,
ou desactivar-se por conversão interna. Ainda é possível, a partir daí, obter a população de um estado tripleto, T
n, desde que E(Tn) ≤ E(S1), e que sejam obedecidas algumas
restrições de simetria orbital. Esse processo ocorre por cruzamento intersistemas, que é um processo de desactivação não radiativa que envolve a mudança de multiplicidade do spin electrónico (transição proibida).
A partir do estado tripleto, se n>1, a espécie excitada tende a perder vibracionalmente parte do excesso de energia por relaxação vibracional, até atingir o estado T
1. A partir desse estado, a molécula excitada pode desactivar-se para o estado
fundamental por dois caminhos: cruzamento intersistemas e fosforescência. Dependendo do tempo de vida dos estados S
1 e T1, outros processos podem
ocorrer, tais como transferência de energia, transferência de electrão, etc., que podem levar à desactivação da molécula para o estado fundamental, ou a transformações químicas, resultando em novas moléculas. Esses são os chamados processos de extinção [41].
13
1.3.
O
XIGÉNIO
S
INGULETO E
T
ERAPIA
F
OTODINÂMICA
1.3.1.
O
XIGÉNIOS
INGULETOO oxigénio singuleto (1O2) é uma espécie excitada do oxigénio molecular (3O2),
sendo uma das substâncias mais activas envolvida em reacções químicas e bioquímicas [42,43].
No estado fundamental, o oxigénio possui dois electrões desemparelhados nas orbitais moleculares πx*e πy*. Por serem orbitais degeneradas, os seus electrões possuem
o mesmo spin, de forma a produzir multiplicidade máxima, e, portanto, o estado de mais baixa energia (regra de Hund) [44].
Os termos singuleto e tripleto referem-se à multiplicidade de cada estado electrónico. Por multiplicidade, entende-se, o número total de configurações possíveis para os spins dos electrões. Logo, a multiplicidade singuleto reflecte que há apenas uma forma dos spins se ajustarem de modo a tornarem-se emparelhados (por emparelhado entende-se spin total nulo), enquanto por multiplicidade tripleto compreende-se que há três modos distintos de os spins dos electrões se combinarem de modo desemparelhado. Por outras palavras, pode-se dizer que o estado singuleto representa uma configuração com spins antiparalelos (electrões emparelhados, [↑↓]), e que o estado tripleto representa uma configuração de spins paralelos (electrões desemparelhados, [↑↑]) [39].
A multiplicidade M de um estado pode ser calculada por M = 2S+1, em que S corresponde à soma dos spins dos electrões em questão. Para o primeiro caso representado na Figura 1.6, um dos electrões possuiria spin S1 = +1/2, enquanto o outro,
S2 = -1/2 (dado que os spins são antiparalelos). Neste caso, S = S1+S2 = +1/2-1/2 = 0,
resultando M = 1, que representa a multiplicidade singuleto. Para o caso de spins paralelos, teríamos S = S1+S2 = 1/2+1/2 = 1, resultando em M = 2*1+1 = 3, ou seja, a multiplicidade tripleto. O estado fundamental do oxigénio é, então, um estado tripleto, sendo a sua notação espectroscópica é 3O2 ou 3Σg.
14
Figura 1.6: Representação do estado fundamental e dos estados excitados singuleto e tripleto de
uma molécula [43].
As primeiras evidências da existência do oxigénio singuleto datam de 1924 [45]. Entretanto, o estudo das suas propriedades teve início em 1963, quando Khan e Kasha estudaram a luminescência da reacção entre peróxido de hidrogénio e o ião hipoclorito [44]. A partir daí, Christopher Foote [46] estendeu o trabalho sobre a produção e reactividade dessa espécie activa de oxigénio, a partir de reacções fotossensibilizadas. A Tabela 1.1 apresenta a notação espectroscópica assim como as energias dos estados singuleto relativas ao estado fundamental, formados a partir da excitação electrónica do estado 3Σ
g. A origem dos estados singuleto 1∆
g e 1Σg é explicado adiante (ver Figura 1.7).
Tabela 1.1: Ocupação dos orbitais moleculares antiligantes, notação espectroscópica e energia relativa do estado fundamental, para os estados electrónicos do O2 [42].
Estado Ocupação dos Orbitais Energia, kJ/mol
3Σ g 1∆ g 1Σ g [ ↑ ] π x [ ↑ ] πy
[↑↓]πx*[ ] πy*ou [ ] πx*[↑↓]πy*
[ ↑ ] πx*[ ↓ ] πy*
0
92,4 159,61.3.1.1.
G
ERAÇÃO DEO
XIGÉNIOS
INGULETOA geração de oxigénio singuleto é possível através de vários processos, tais como descarga eléctrica em fase gasosa, decomposição do peróxido de hidrogénio,
15
decomposição térmica de peróxidos e transferência de energia. Além dos métodos citados acima, vários outros processos podem acontecer, porém de menor relevância [46,47].
O método mais comummente utilizado é a fotossensibilização [46,47], onde a acção combinada da luz, sensibilizador (corante) e oxigénio resulta na geração do oxigénio singuleto. Esse processo baseia-se na transferência de energia do estado excitado tripleto do sensibilizador para a molécula de oxigénio no estado fundamental. Para que isso aconteça, alguns requisitos são necessários [44]:
1. A radiação empregue deve ser capaz de excitar o sensibilizador; 2. O coeficiente de absorção molar do sensibilizador deve ser elevado;
3.O rendimento quântico de cruzamento intersistemas do sensibilizador deve ser elevado;
4. O tempo de vida do estado tripleto do sensibilizador deve se situar na faixa dos microsegundos;
5. A concentração de oxigénio no meio deve ser, aproximadamente, constante. O processo de fotossensibilização é descrito pelo seguinte conjunto de equações,
(1.2)
(1.3)
Reacções desse tipo, que ocorrem por transferência de energia de desactivação do sensibilizador (T.E.), são conhecidas como reacções Tipo II [46-48]. É possível que ocorra uma competição entre processos desse tipo e reacções de transferência de electrão (Reacções Tipo I). Concentrações elevadas de oxigénio favorecem as reacções Tipo II, e concentrações elevadas de substrato promovem as reacções Tipo I [49]. Ambos os processos ocorrem em competição. A sua eficiência relativa depende fortemente do meio ambiente e da natureza das moléculas do substrato [45,50].
( )
( )
( )
1 * ISC 1 * h 0M
S
M
T
S
M
→
υ
→
( )
( )
2 1 0 T.E 2 3 1 *O
S
M
O
T
M
+
→
+
16
A geração de oxigénio singuleto por transferência de energia ocorre por um processo difusionalmente controlado [46-48]. A Figura 1.7 ilustra o seu processo de geração.
Figura 1.7: Esquema ilustrativo do processo de transferência de energia a partir do sensibilizador
no estado tripleto excitado, para a molécula de oxigénio no estado fundamental, produzindo oxigénio singuleto nas formas 1Δg e
1
Σg [44].
A diferença entre as duas espécies excitadas do oxigénio deve-se à simetria da orbital. A diferença de simetria entre os estados excitado e fundamental, afecta o tempo de vida dessas moléculas. A forma 1Σ
g, por possuir a mesma simetria da molécula no
estado fundamental, possui tempo de vida muito menor que o apresentado pela forma 1Δ
g
[49].
1.3.2.
T
ERAPIAF
OTODINÂMICAA terapia fotodinâmica começou a ser empregada com sistemática científica em 1900, quando Raab descreveu a acção do corante de acridina e luz solar sobre paramécias, demonstrando que estes organismos unicelulares morrem sob essas condições [51]. Em 1903, Trappeiner utilizou a aplicação do corante de eosina e exposição à luz para o tratamento de um cancro de pele [52]. Policard, em 1925, estudou
17
porfirinas objectivando a produção de efeitos fototóxicos em tecidos, principalmente em tumores malignos [4b].
Assim surgiu a 1ª geração de fotossensibilizadores à base de porfirinas e metaloporfirinas [45]. Na década de cinquenta foi usada a hematoporfirina (2ª geração de fotossensibilizadores) [53].
A PDT para o tratamento do cancro teve início apenas na década de setenta. Do ponto de vista médico, é uma recente e promissora modalidade de tratamento para o cancro, baseada no uso de um agente fotossensibilizador (corante), que é preferencialmente usado ou retido por tecidos neoplásicos, adquirindo a actividade desejada somente quando excitado pela luz num comprimento de onda adequado. É necessário que as propriedades de fotossensibilização do corante envolvam predominantemente a transformação de oxigénio tripleto em oxigénio singuleto, que é um agente citotóxico, responsável pela destruição de células cancerosas [54].
A Figura 1.8 apresenta o mecanismo de acção da terapia fotodinâmica.
Figura 1.8: Mecanismo de acção da PDT.
A radiação electromagnética empregada deve atender a determinados parâmetros para que possa tornar eficiente o tratamento por PDT. Primeiramente, o seu comprimento de onda deve estar compreendido numa região do espectro electromagnético que seja ressonante com a banda de absorção do cromóforo utilizado, permitindo a eficiente excitação do mesmo e, por conseguinte, maior rendimento de geração de espécies
![Figura 1.3: Grupos heterocíclicos terminais mais comuns nas cianinas: (a) benzoxazole, (b) benzotiazole, (c) benzoselenazole, (d) benzimidazole, (e) quinolina, (f) 3-H-indole, (g) naftoxazole, (h) naftotiazole [18]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15882999.1089503/30.892.151.760.124.377/heterocíclicos-terminais-benzoxazole-benzotiazole-benzoselenazole-benzimidazole-naftoxazole-naftotiazole.webp)
![Tabela 1.1: Ocupação dos orbitais moleculares antiligantes, notação espectroscópica e energia relativa do estado fundamental, para os estados electrónicos do O 2 [42]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15882999.1089503/37.892.139.784.767.983/ocupação-orbitais-moleculares-antiligantes-notação-espectroscópica-fundamental-electrónicos.webp)