Ana Carolina Bertoldi Saad Tannus
Avaliação dos aspectos dosimétricos no
tratamento de câncer de tireóide com Iodo-131
Avaliação dos aspectos dosimétricos no
tratamento de câncer de tireóide com Iodo-131
Orientador: Renato Dimenstein
Botucatu
2009
Monografia apresentada ao Instituto
de
Biociências
da
Universidade
Estadual Paulista Júlio
de Mesquita
Filho , Campus de Botucatu, para a
obtenção do título de Bacharel em
Primeiramente a Deus, pela certeza de Sua presença em todos os momentos, fortalecendo-me e mostrando-me o caminho.
Aos meus pais, Roberto e Izabel, pela minha educação e apoio constante em todos os momentos da minha vida.
Ao meu irmão Marcelo.
À minha família, pelo incentivo constante e credibilidade. Aos meus professores, pelos ensinamentos.
A todos os meus colegas da III Turma de Física Médica.
Aos meus amigos, pela amizade e pela força para seguir em frente. Às meninas da República Mash, pelo carinho e companheirismo.
Ao Enrico Antonio Menegon,, pela compreensão, companheirismo, carinho e credibilidade.
À Carla Daruich de Souza, pela amizade, força, atenção e paciência nos meus momentos de desespero.
Às meninas da Rad Dimenstein.
“
O insucesso é apenas uma
oportunidade para recomeçar de
novo com mais inteligência.
”
O 131I (iodo radioativo) é um dos radionuclídeos mais utilizados na medicina nuclear para diagnóstico e tratamento.
O atual estudo avalia aspectos dosimétricos relacionados à iodoterapia após a tireoidectomia em pacientes com câncer de tireóide.
As amostras foram estudadas em 50 pacientes submetidos ao tratamento, buscando avaliar as exposições sobre trabalhadores (auxiliares de enfermagem, equipe de higiene, médicos e físicos), sobre o público em geral (acompanhantes e familiares) e sobre o meio ambiente.
Para avaliar os trabalhadores, foi feita uma pesquisa das condições do quarto terapêutico e das rotinas adotadas pelos mesmos durante o período do tratamento. Estimando-se a dose equivalente por mês para cada profissional, foi possível verificar que os máximos níveis obtidos para auxiliares de enfermagem, para a equipe da higiene, para médicos e para físicos foram considerados baixos em relação ao âmbito permitido pela legislação vigente.
Com a finalidade de avaliar o público, algumas situações foram sugeridas para o cálculo de doses equivalentes, nos quais foi possível verificar a fundamental importância do isolamento do paciente nos 2 primeiros dias.
Em relação ao meio ambiente, os rejeitos radioativos gerados por paciente tiveram volume de 1,0 m3 e atividade estimada em 0,91 mCi, levando um tempo de decaimento, para os eliminar, de aproximadamente 75 dias e para atingir o valor permitido de 2 Ci/Kg no sistema de coleta de lixo urbano. Portanto, todo rejeito radioativo retirado do quarto dos pacientes devem ser encaminhados ao depósito para um armazenamento temporário de rejeitos radioativos, localizado distante das áreas de trabalho normais.
The 131I (radioactive iodine) is one of the most used radionuclides in nuclear medicine for diagnosis and treatment.
The present study evaluates the dosimetric aspects related to radioiodine therapy after thyroidectomy in patients with thyroid cancer.
The samples were studied with 50 patients undergoing treatment, by assessing the exposures of workers (nursing assistants, staff hygiene, medical and physical), the general public (accompanying and family members) and on the environment.
To evaluate the workers, was made a survey of the environmental conditions of the room radioiodine and routines adopted by them during the treatment period. Estimating the dose equivalent per month for each employee, we observed that the maximum levels obtained for nursing assistants, the team of hygiene, medical and physicians were considered low in relation to the extent permitted by law.
In order to assess the public, some situations have been suggested for the calculation of equivalent doses in which it was possible to verify the fundamental importance of isolating the patient in the 2 days first.
Regarding the environment, the radioactive waste generated by patient had volume of 1.0 m3 and activity estimated at 0.91 mCi, taking a decay time for eliminating them about 75 days to reach the allowable value of 2 μCi / kg system of collecting garbage. Therefore, all radioactive waste removed from the patient's room should be sent to the warehouse for temporary storage of radioactive waste, located away from normal work areas.
RESUMO... 4
ABSTRACT ... 5
SUMÁRIO ... 6
1. INTRODUÇÃO ... 8
1.1 O câncer de tireóide ... 8
1.2 O iodo ... 8
1.2.1 O radioisótopo 131I ... 9
1.2.2 Utilização do Iodo-131 em Medicina Nuclear ... 9
1.2.3 Distribuição de iodo no organismo ... 10
1.2.4 Eliminação do 131I ... 10
1.3 A glândula tireóide ... 11
1.3.1 Anomalias ... 12
1.3.2 Tipos de carcinomas de tireóide... 12
1.4 Iodoterapia ... 14
1.5 Quartos terapêuticos ... 15
1.6 Rejeitos radioativos ... 17
1.6.1 Cálculo de decaimento de rejeitos radioativos ... 18
1.7 Tópicos utilizados ... 19
1.7.1 Decaimento radioativo e atividade ... 19
1.7.2 Tempo de meia-vida ... 20
1.7.3 Exposição ... 21
1.7.4 Dose equivalente ... 22
1.7.5 Blindagem ... 23
1.7.5.1 Camada semi-redutora ... 24
3.1 Estimativa da dose equivalente (H) ... 27
3.1.1 Dose equivalente para auxiliares de enfermagem, equipe da higiene, físicos e médicos. ... 28
3.1.2 Dose equivalente para público ... 28
3.2 Rejeitos radioativos ... 31
4. RESULTADOS E DISCUSSÃO ... 33
4.1 Estimativa da dose equivalente (H) ... 33
4.1.1 Dose equivalente para auxiliares de enfermagem, equipe da higiene, físicos e médicos. ... 35
4.1.2 Dose equivalente para público ... 37
4.2 Rejeitos radioativos ... 45
5. CONCLUSÃO ... 48
REFERÊNCIAS BIBLIOGRÁFICAS ... 49
APÊNDICE A ... 52
APÊNDICE B ... 54
APÊNDICE C ... 56
APÊNDICE D ... 58
1. INTRODUÇÃO
1.1 O câncer de tireóide
O número de casos de câncer tem aumentado de maneira considerável em todo o mundo, principalmente a partir do século passado. Nos dias atuais a doença se tornou um dos mais importantes problemas de saúde pública mundial. A freqüência de distribuição dos diferentes tipos de câncer apresenta-se variável em função das características de cada região.
Para os países desenvolvidos e em desenvolvimento, a doença é responsável por mais de seis milhões de óbitos a cada ano, representando cerca de 12% de todas as causas de morte no mundo. Embora as maiores taxas de incidência de câncer sejam encontradas em países desenvolvidos, 5,5 milhões são diagnosticados nos países em desenvolvimento.[1]
O câncer de tireóide é a neoplasia maligna mais freqüente do sistema endocrinológico, apesar de ser uma patologia relativamente rara, sendo responsável por aproximadamente 1% dos novos casos de câncer. Este é um dos tumores malignos que apresenta melhor taxa de cura, cujas estatísticas de diversos centros indicam que 85% a 93% dos pacientes adultos, tratados, estão vivos cerca de 10 anos após o diagnóstico inicial. A taxa de mortalidade por câncer de tireóide varia de 0,2 a 1,2 por 100 mil indivíduos entre os homens e 0,4 a 2,8 entre as mulheres.[2][3]
Os carcinomas do subtipo papilífero e folicular são os tipos mais comuns, correspondendo a 94% dos carcinomas de tireóide. A cada ano, nos EUA, surgem 14 mil novos casos, e ocorrem 1,1 mil mortes decorrentes desse tipo de carcinoma. No Brasil, estes números são proporcionais, ocorrendo 66 novos casos em cada 100 mil habitantes por ano. O tratamento considerado mais adequado, a tiroidectomia total seguida de ablação actínica com 131I, oferece ao paciente um prognóstico muito bom, com sobrevida longa, similar à da população que nunca teve câncer.[2][4]
Descoberto em 1811 por Courtois, o iodo, um halogênio, ocorre escassamente na forma de iodeto nas águas do mar, como traços de compostos de nitratos metálicos, e em águas salobras de reservatórios de óleo e sal. É chamado desta forma devido à liberação do vapor violeta quando aquecido (em grego, iodes = violeta). O iodo estável possui número atômico 53, e número de massa 127. Existem, identificados, trinta radioisótopos de iodo, variando em numero de massa de 115 a 141 e com meias-vidas de 0,5 segundos a 1,6 x 107 anos. Somente o isótopo estável, o 127I, é encontrado na natureza. Os radioisótopos usados em diagnostico e tratamento médicos são o 123I, 125I e 131I.[5]
1.2.1 O radioisótopo 131I
Esse radioisótopo tem a meia-vida de 8,05 dias e é produzido em reatores nucleares pela irradiação do Telúrio, ou através da fissão do 235U.
O 131I decai emitindo uma partícula - e um núcleo-filho de acordo com o esquema:[6]
131I → 131Xe + - +
(1)
Onde:
: anti-neutrino.
1.2.2 Utilização do Iodo-131 em Medicina Nuclear
Devido ao fato do iodo ser absorvido pelas células da tireóide e ao efeito biológico da radiação emitida pelo 131I, principalmente a sua emissão beta, este radioisótopo pode ser utilizado para reduzir o número de células funcionais no tratamento do hipertireoidismo ou no tratamento do câncer de tireóide, onde se eliminam as células neoplásicas que captam o radionuclídeo.[8]
1.2.3 Distribuição de iodo no organismo
O iodo é totalmente absorvido na forma de iodeto pelo trato gastrintestinal. Depois, é distribuído pelo sangue, alcança o equilíbrio com os fluidos do corpo em meia hora e é captado pela tireóide por transporte ativo.
A captação do iodo pela glândula tireóide é considerada nominalmente 25% do total da circulação sistêmica, ficando retido com uma meia-vida biológica da ordem de 80 dias. A tireóide contém a maior concentração de iodo do organismo, em torno de
8000 μg sob condições normais, a maior parte deste valor na forma de aminoácidos
iodados.[9]
1.2.4 Eliminação do 131I
Apos a ingestão de 131I, grandes quantidades do radionuclídeo aparecem rapidamente na urina. Aproximadamente 80% do iodo total administrado para um paciente é eliminado pela urina durante as primeiras 24 horas.
A taxa de exposição demonstrada pelos pacientes durante a terapia diminui com o tempo de meia-vida efetiva (Teff), que estabelece a real dinâmica da eliminação do 131I, no organismo humano.
1.3 A glândula tireóide
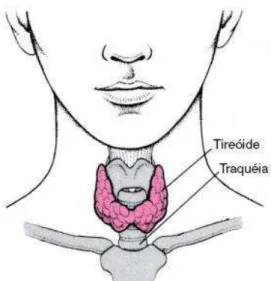
A glândula tireóide é a maior glândula especializada na função endócrina do corpo humano. Está localizada na região cervical anterior e apresenta dois lobos laterais, grosseiramente cônicos e unidos por uma delgada peça central, o ístmo, que se localiza sobre a terceira e quarta cartilagens traqueais e confere a glândula um aspecto de escudo (do grego thyreos = um escudo oblongo, eidos = forma).[11]
Através da Figura 1, podem-se verificar as características morfológicas e a
localização da tireóide.
Figura 1. Localização da glândula tireóide.
Fonte: Harbert, 1996.
O peso e o volume da tireóide variam de acordo com a idade, o sexo, a dieta e as condições funcionais da glândula. A tireóide é uma das maiores glândulas endócrinas do organismo humano, pesando normalmente de 20 a 30 g. Sua principal função conhecida é sintetizar, armazenar e secretar hormônios iodados indispensáveis ao metabolismo celular. Esta capta seletivamente o iodo inorgânico do sangue, transformando em tireoglobulina, componente principal do colóide (secreção armazenada no interior da unidade estrutural da tireóide chamada de folículo).[11][12]
1.3.1 Anomalias
A tireóide pode ser afetada por diferentes enfermidades ou desordens, onde as suas causas incluem características hereditárias, infecções, distúrbios imunológicos e radiações ionizantes. Cada condição resulta em alguma mudança detectável na glândula: metabolismo, atividade, níveis de hormônios ou captação do iodo. Dentre estas anormalidades destacam-se o hipotireoidismo (quantidade menor de hormônios tireoideanos com uma redução na taxa metabólica), o hipertireoidismo (excesso de hormônios tireoidianos com um aumento na taxa metabólica) e o carcinoma de tireóide.[13]
1.3.2 Tipos de carcinomas de tireóide
O câncer de tireóide é a neoplasia maligna mais freqüente do sistema endocrinológico. As neoplasias da tireóide são classificadas de acordo com o tipo histológico em: carcinoma papilar, carcinoma folicular, carcinoma medular e carcinoma anaplásico.
O carcinoma medular é uma neoplasia das células parafoliculares da tireóide, correspondendo a 5% a 8% dos tumores malignos da glândula, sendo mais freqüente na forma esporádica (75% a 80%) do que na hereditária (20% a 25%). Esse tipo manifesta-se clinicamente como um nódulo ou massa cervical e, freqüentemente, os pacientes já apresentam comprometimento em linfonodos cervicais ao diagnóstico.[14]
O carcinoma anaplásico é a forma mais agressiva das neoplasias tireoidianas e uma das neoplasias mais graves, em geral, sendo responsável por aproximadamente 1% dos carcinomas de tireóide. Na maioria dos casos, o carcinoma anaplásico representa o estágio mais avançado de um carcinoma folicular ou papilífero da tireóide. A agressividade do carcinoma anaplásico, associada a sua baixa incidência, dificultam a realização de estudos que definam a melhor estratégia terapêutica, pois não captam iodo.[15]
O carcinoma folicular corresponde a 15% a 25% de todas as neoplasias da tireóide, tendo a incidência aumentada nas regiões de deficiência de iodo. Geralmente possui um comportamento mais agressivo do que o carcinoma papilar, com tendência a disseminação hematogênica para ossos, pulmões, fígado e cérebro. Comparado a pacientes com carcinoma papilar, os pacientes com carcinoma folicular apresentam, ao diagnóstico, idade e estágio clínico mais avançado. O prognóstico é favorável na maior parte das vezes, no entanto a doença pode ter um curso agressivo e 20% dos casos desenvolvem recorrência loco-regional ou metástases à distância.[16]
Os carcinomas papilífero e folicular são considerados carcinomas diferenciados da tireóide (CDT), uma vez que mantêm uma semelhança estrutural e funcional com o tecido tireoidiano normal.
Os CDT são raros em crianças e adolescentes, apresentam aumento da incidência com a idade. A média de idade no diagnóstico é de 45 a 50 anos, sendo de 2 a 4 vezes mais freqüente em mulheres do que em homens.
Nas últimas décadas, a incidência do carcinoma de tireóide tem aumentado, particularmente em mulheres, enquanto a mortalidade vem diminuindo tanto em homens quanto em mulheres. Em parte, o aumento da incidência é devido ao aperfeiçoamento do diagnóstico e a redução da mortalidade ao diagnóstico precoce, ao tratamento inicial efetivo e à diminuição da incidência do carcinoma anaplásico.[17]
Fatores ambientais, em especial a deficiência de iodo, têm importante papel na patogênese destes tumores. Outros fatores como a radioterapia externa na infância e adolescência, exposição à radiação ionizante e doença tireoidiana preexistente são fatores de risco para o câncer de tireóide.
1.4 Iodoterapia
Após uma tiroidectomia, quase total, o paciente apresenta remanescentes de tecido, sendo, geralmente, submetido a uma dose ablativa com 131I. Nesta prática terapêutica, além da diminuição do risco cirúrgico da tiroidectomia total, há uma destruição de focos tumorais intratireoidianos e micrometástases, diminuindo, assim, os níveis de recidiva e aumentando a sobrevida do paciente.
As doses terapêuticas de 131I são administradas oralmente na forma líquida ou por meio de cápsula. As vantagens do iodo radioativo são: fácil administração, eficácia, baixo custo e ausência de dor. Quando administrado por via oral em solução de iodeto de sódio, o iodo é rapidamente absorvido, concentrado e incorporado pela tireóide nos folículos de armazenamento.
Os objetivos do 131I administrado após a cirurgia para ablação dos restos tireoidianos são:
Eliminar focos microscópicos da doença, diminuindo índices de recorrência e mortalidade;
Melhorar o acompanhamento dos pacientes com detecção precoce de recorrência através de dosagens de tireoglobulina e PCI (Pesquisa de Corpo Inteiro) com 131I;
Detectar a presença de metástases anteriormente não diagnosticadas através da PCI feita após a dose ablativa.[19]
Podem-se diferenciar varias modalidades em função da atividade a ser administrada: a modalidade de doses baixas, a de doses médias, a de doses altas e a da estimativa individualizada das doses.
Quando se aumenta a atividade da dose ablativa, o nível de eficácia também aumenta. A modalidade de doses baixas varia de 1,11 GBq a 1,85 GBq (Atividades de 30 mCi até 50 mCi). Na modalidade de doses médias, as atividades variam de 1,85 a 2,78 GBq (Atividades de 50 mCi ate 75 mCi), já se fazendo necessária a hospitalização do paciente. No emprego da modalidade de doses elevadas, as atividades utilizadas variam de 2,78 GBq a 5,55 GBq (Atividades de 75 mCi ate 150 mCi), obtendo-se um elevado índice de êxito e sendo adotado pela maioria dos autores.
ablação, se recorre a uma reablação, cujas atividades a serem empregadas deverão, então, serem maiores que as iniciais, já que houve a indução de fibrose no tecido com a primeira dose, aumentando, assim, o número de células radioresistentes.[20]
O esquema mais adotado consiste na administração de 30 a 150 mCi para ablação de remanescentes glandulares e atividades progressivamente maiores para o tratamento de metástases ganglionares, pulmonares ou ósseas (entre 150 e 400 mCi, definidos de forma empírica). Não há um consenso quanto à dose administrada, devido em parte à dificuldade de conduzir estudos prospectivos. Esta dificuldade decorre da própria historia natural da doença e do longo período necessário para detectar alterações na sua evolução, além de o tratamento com atividades mais elevadas de 131I ser usualmente indicado para pacientes de alto risco clínico.[21]
1.5 Quartos terapêuticos
No momento que o paciente recebe a dose de 131I acima de 30 mCi, ele deve permanecer internado em unidade hospitalar, pois o seu corpo emite radiação gama proveniente do decaimento do 131I. Neste caso, o quarto de internação possui paredes e portas revestidas de chumbo capazes de blindar a radiação gama, chamado de quarto terapêutico. Este quarto obedece aos critérios de radioproteção descritos na norma CNEN-NN-3.01 (2005).[22]
Antes, durante e após a administração do 131I, o paciente e o ambiente de internação são monitorados, geralmente pelo sistema contador Geiger-Müller, sob a responsabilidade do físico da medicina nuclear. A monitoração individual ou de exposição (região corpórea do paciente), dará subsídios para liberação ou alta do paciente que poderá ser liberado conforme o critério adotado pelo físico.
Os critérios de liberação dos pacientes foram elaborados pela Comissão Reguladora Nuclear, chamado de guia regulador 8.39 (NCR, 1997), o qual fornece três metodologias diferentes de liberação do paciente conforme descrito abaixo:[24]
a) Liberação baseada na Atividade Administrada
Este critério estabelece que um indivíduo do público não pode receber uma dose efetiva superior a 5 mSv. Assim, utilizando uma suposição conservativa (fonte pontual) para uma fonte de 131I, considera-se que o paciente pode ser liberado se a atividade retida no mesmo não for superior ao valor de 33 mCi (Tabela 1).
Tabela 1: Atividade e Taxa de Dose para liberação de pacientes tratados com 131I.
Radionuclídeo Atividade Taxa de dose a 1,0 metro
GBq mCi mSv/h mR/h
131
I 1,2 33 0,07 7
É o critério adotado pela maioria dos Serviços de Medicina Nuclear no Brasil.
b) Liberação baseada na medida da Taxa de Dose
Quando a taxa de dose medida por uma sonda de exposição, a uma distância de 1 metro do paciente na altura da tireóide, indicar 7 mR/h (0,07 mSv/h), considera-se que este paciente já pode ser liberado.
c) Calculo de Dose Efetiva Individualizada
(2)
Onde :
34,6: fator introduzido para eliminar unidades (hora e dia), obtido através da multiplicação de 24 horas/dia pelo valor 1,44 (constante obtida quando se considera a total eliminação do radionuclídeo);
Γ: constante específica da radiação gama para uma fonte pontual, em
(R.m2)/(h.Ci);
Qo : atividade da fonte pontual em mCi (atividade administrada ao paciente); T1/2: meia-vida física do radionuclídeo em dias
E: fator acrescentado para representar a fração total do tempo que um indivíduo ficara exposto a uma certa distância do paciente;
r: distância do paciente em metros.
A monitoração de área realizada com a sonda pancake, específica para leitura de contaminação, deve ser realizada nos pontos de riscos com revestimentos de plástico, nos restos alimentares, nas vestimentas pessoais, roupas de cama e de banho, lixos de banheiros, talheres e copos. No caso de contaminação, estes rejeitos sólidos devem ser armazenados em local apropriado, para sofrer o processo de decaimento, até atingir os níveis aceitáveis.[25]
1.6 Rejeitos radioativos
Segundo a Comissão Nacional de Energia Nuclear (CNEN), rejeito radioativo é definido por “qualquer material resultante de atividades humanas, que contenha radionuclídeos em quantidades superiores aos limites de isenção, especificadas na
Norma CNEN-NE-6.02, e para o qual a reutilização é imprópria ou não prevista”[26]
atividade e à taxa de exposição na superfície dos rejeitos (rejeitos de baixo, médio ou alto nível de radiação).[25]
Os rejeitos radioativos são gerados pelos estabelecimentos prestadores de serviços de saúde resultantes do uso de substâncias radioativas não-seladas para fins terapêuticos, de diagnóstico e de pesquisa. Esta geração se deve tanto à realização de trabalhos planejados como às tarefas de limpeza de materiais e de áreas de trabalho, em situações de incidente tais como derramamentos e vômitos de pacientes tratados com radioisótopo.
O físico do serviço de medicina nuclear é o responsável pela segregação e armazenamento dos rejeitos retirados do quarto terapêutico. Ao encaminhar os rejeitos radioativos para a área de decaimento, deve projetar a data prevista para a liberação ao meio ambiente e, posteriormente, eliminá-los pelo sistema de coleta municipal de lixo urbano (sólidos) ou esgotamento sanitário (líquidos).[27]
1.6.1 Cálculo de decaimento de rejeitos radioativos
Para que determinado rejeito possa ser descartado pelas vias convencionais é necessário que sua atividade não supere os limites de eliminação (2nCi/g para rejeitos sólidos). Para os rejeitos contendo emissores de meia-vida curta, os limites de eliminação podem ser alcançados após períodos de armazenamento relativamente curtos. Nesses casos, deve-se realizar um estudo simples de decaimento para cada um dos radioisótopos de forma que, partindo da atividade inicial e do período de semidesintegração, seja obtido o tempo necessário para não superar os limites de eliminação.[25][28]
Três metodologias podem ser utilizadas para verificar se a concentração da atividade ou a atividade específica do rejeito está em conformidade com os respectivos níveis de referência estabelecidos pela norma CNEN-NE-6.05:[25]
Por meio de hipóteses conservativas, isto é, supondo a atividade remanescente (adsorvida) em frascos, seringas, vidros e outros recipientes, igual a 2% da atividade inicial contida nos mesmos.
Por meio da medida da contaminação de superfície.
1.7 Tópicos utilizados
1.7.1 Decaimento radioativo e atividade
O decaimento radioativo é um processo espontâneo, ou seja, não há como prever o momento exato em que um núcleo instável submete-se a uma transformação radioativa, tornando-se um núcleo mais estável. Matematicamente, o decaimento radioativo é descrito em termos de probabilidades e taxas de decaimento médio.
A taxa de decaimento médio ( N/ t) é a atividade da amostra e tem dimensão de desintegrações por segundo (dps) ou desintegrações por minuto (dpm) e é essencialmente uma medida da quantidade de radioatividade de uma amostra. Suas unidades são Curie ou Bequerel. O Curie (Ci) é a mais antiga das unidades e é definida como 3,7.1010 dps (2,22.1012 dpm), enquanto que a unidade de atividade no Sistema Internacional (SI) é o Bequerel (Bq), que equivale a uma taxa de decaimento de 1 dps. Então:
(3)
Onde:
: constante de desintegração
N: número de átomos iniciais da amostra t: tempo decorrido durante o decaimento.
(4)
Onde:
N(t): número de átomos que permanecem após um certo tempot N0: número de átomos no tempo inicial (t=0)
t
e : fator de decaimento do tempo t.
A atividade A é proporcional ao número de átomos N, assim o fator de decaimento também pode ser aplicado à atividade versus tempo. Desse modo, tem-se a seguinte equação:[29]
(5)
1.7.2 Tempo de meia-vida
(6)
A meia-vida biológica é o tempo necessário para que o isótopo administrado a um organismo vivo passe pelas vias metabólicas e seja eliminada a metade da quantidade administrada.
Da associação entre os valores de meia-vida física e biológica tem-se o conceito de meia-vida efetiva, que é o tempo necessário para que a radiação que atinge um dado órgão diminua pela metade.[29]
(7)
Onde:
: tempo de meia vida física TB: tempo de meia-vida biológica
1.7.3 Exposição
A exposição é a grandeza física definida como sendo a quantidade total de cargas elétricas por unidade de massa, de todos os íons de um mesmo sinal produzidos no ar, quando todos os elétrons liberados pelos fótons no elemento de volume de ar são completamente freados no ar, isto é:
(8)
Onde:
A unidade de exposição no SI é C/kg. A unidade antiga de exposição tem como símbolo R (Roentgen), sendo:
1R = 2,58 10-4 C/kg.
A relação existente entre atividade (A) e Taxa de Exposição, , depende de processos básicos de interação entre a radiação e o ar. No entanto, para fontes pontuais emissoras gama, a seguinte aproximação é amplamente empregada:
(9)
Onde:
Γ - constante específica da radiação gama, expressa em (R.m2)/(h.Ci); d - distância da fonte em m;
A - atividade, expressa em Ci; - taxa de exposição em R/h.
Pode-se observar que a taxa de exposição é diretamente proporcional à atividade do radioinuclídeo e inversamente proporcional ao quadrado da distância entre a fonte pontual e o ponto considerado.[30]
1.7.4 Dose equivalente
Como os efeitos da radiação podem variar com a qualidade (tipo e energia) da radiação, para uma mesma dose absorvida, foi necessário criar um conceito com o qual fosse possível comparar os efeitos devido às diferentes qualidades de radiação. Assim, algumas radiações são mais efetivas do que outras em causar efeitos estocásticos. Para considerar isto, foi introduzida a grandeza dose equivalente, H, que é a dose absorvida média em um órgão ou tecido, (DT), multiplicada por um fator de peso adimensional da radiação, wR, relativo ao tipo e energia da radiação incidente R, ou seja:
A dose equivalente é expressa em J/kg no Sistema Internacional de Unidades. Para evitar confusão com a dose absorvida, a unidade para a dose equivalente recebe o nome especial de sievert (Sv).
Os fatores de peso da radiação, wR, foram estipulados pela ICRP-60 com base nos valores da Eficácia Biológica Relativa (RBE) da radiação na indução de efeitos estocásticos a baixas doses. Os valores de wR, apresentados na Tabela 2, são relacionados à radiação externa incidente sobre o corpo ou à radiação emitida por radionuclídeos depositados internamente no corpo.[31]
Tabela 2: Valores dos fatores de peso da radiação, wR.
Tipo e energia da radiação Fator de peso da radiação (wR)
Fótons, qualquer energia 1
Elétrons e mésons, qualquer energia 1
Nêutrons
< 10 keV 5
10 a100 keV 10
> 100 keV a 2 MeV 20
> 2 a 20 MeV 10
> 20 MeV 5
Prótons, outros além de prótons de recuo, energia > 2MeV 5 Partículas alfa, fragmentos de fissão, núcleos pesados 20
1.7.5 Blindagem
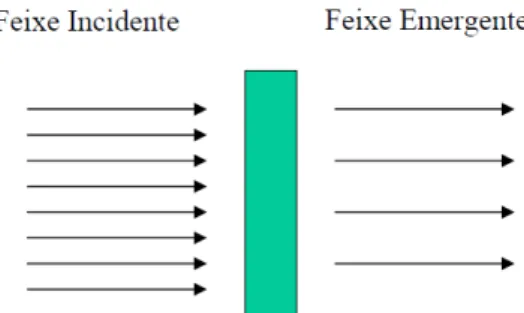
Algumas situações de cálculos de blindagem podem ser resolvidas pelo conhecimento dos processos pelos quais as radiações eletromagnéticas (X e ) interagem com a matéria.
Os três processos pelos quais as radiações eletromagnéticas cedem energia na blindagem são:
Efeito Fotoelétrico Efeito Compton Produção de Pares
Em cada um desses processos a radiação irá perder fótons do feixe incidente e, portanto, contribuem para a diminuição do feixe emergente.
A atenuação sofrida pelo feixe emergente é um processo exponencial em função da espessura da blindagem.
(11)
Onde:
I = Intensidade do feixe emergente I0 = Intensidade do feixe incidente
μL = coeficiente de atenuação linear (cm-1) x = espessura da blindagem
1.7.5.1 Camada semi-redutora
Uma camada semi-redutora reduz a intensidade do feixe à metade. Ela pode ser expressa por:
(12)
=
(13)
Onde:
n: número de camadas semi-redutoras.
Assim, a espessura do material de blindagem, para um determinado fator de redução, FR, é dada por:[32]
2. OBJETIVOS
3. METODOLOGIA E PROCEDIMENTO
EXPERIMENTAL
3.1 Estimativa da dose equivalente (H)
Conforme a norma CNEN-NE-3.01, para receber a dose de 131I acima de 30 mCi, o paciente deverá permanecer em isolamento no quarto terapêutico, podendo entrar no local apenas o físico, os auxiliares de enfermagem, a equipe da higiene e o médico. De acordo com o objetivo proposto de estimar as doses equivalentes dos trabalhadores envolvidos na rotina clínica de pacientes em isolamento, foram estudados 50 pacientes que receberam o 131I com atividade de 100 mCi, em uma unidade hospitalar.
O responsável pela administração do radioiodo é o físico. Durante a internação, este mede a taxa de exposição, com um Geiger-Müller com sonda de exposição, em dois momentos: no momento da ingestão, e no segundo dia.
Sabendo-se a atividade do radioiodo administrada, calculou-se o valor teórico da
taxa de exposição no momento da ingestão (t = 0), através da equação 9.
Com a taxa de exposição experimental obtida pela primeira medida, calculou-se a razão entre a taxa de exposição teórica e a taxa de exposição experimental, com o objetivo de obter um fator de correção (fcorreção), para ser aplicado na taxa de exposição medida no segundo dia.
Calculou-se a atividade no segundo dia, através da equação 9, utilizando a taxa de exposição experimental do segundo dia corrigida pelo fator de correção encontrado.
Sabendo-se os valores da Atividade inicial, da Atividade no segundo dia e o tempo decorrido da primeira medida para a segunda, calculou-se o tempo de meia-vida efetiva do Iodo-131 para o paciente, através da equação 5.
Em seguida, com os valores da Atividade Corrigida obtidos, calculou-se o valor da taxa de exposição a 0,5 m, 1,0 m, 2,0 m, 2,5 m e 3 m para os 7 dias utilizando a equação 9. Com as taxas de exposições para cada horário, é possível calcular a dose equivalente para cada trabalhador.
3.1.1 Dose equivalente para auxiliares de enfermagem, equipe da higiene, físicos e médicos.
Para calcular a dose equivalente é necessário saber os horários em que os trabalhadores entram no quarto do paciente, a distância do paciente e o tempo de permanência no quarto. Para isto, realizou-se uma pesquisa com os profissionais da área e elaborou-se uma rotina para os trabalhadores.
Sobre esta rotina, calculou-se a taxa de exposição para cada horário, conforme o procedimento anterior, e então, com os tempos de permanência e utilizando 100 R 0,89 Sv no ar, encontrou-se a dose equivalente no cristalino para cada atividade exercida.
Somando-se os valores das doses equivalentes obtidas para cada profissional obteve-se a dose equivalente que o profissional recebe no cristalino por cada paciente. Com a quantidade de paciente que cada profissional atende, em média, por mês, calculou-se a dose equivalente do profissional no mês.
Para descobrir a dose equivalente no tórax (atrás do biombo de chumbo), encontrou-se a taxa de exposição atrás do biombo através da equação 13 e repetiu-se o procedimento anterior.
3.1.2 Dose equivalente para público
Para o primeiro caso, escolheram-se algumas distâncias para então calcular a taxa de exposição em cada uma delas, com tempos variados, levando-se em consideração as recomendações de permanecer a uma distância mínima de 1,0 metro do paciente.
As distâncias escolhidas foram:
Situação A: permanecer a uma distância de 1,0 m do paciente pelo
tempo de:
A.1: 15 minutos A.2: 30 minutos A.3: 1 hora
As estimativas foram feitas de hora em hora, das 10:00 horas às 22:00 horas, do 3º ao 7º dia após a ingestão do radioiodo.
Situação B: permanecer a uma distância de 1,5 m do paciente pelo
tempo de:
B.1: 15 minutos B.2: 30 minutos B.3: 1 hora
As estimativas foram feitas de hora em hora, das 10:00 horas às 22:00 horas, do 3º ao 7º dia após a ingestão do radioiodo.
Situação C: permanecer a uma distância de 2,0 m do paciente pelo
tempo de:
B.1: 15 minutos B.2: 30 minutos B.3: 1 hora
As estimativas foram feitas de hora em hora, das 10:00 horas às 22:00 horas, do 3º ao 7º dia após a ingestão do radioiodo.
Situação D: dormir por 8 horas ao lado do paciente. D.1: d = 1,0 m
D.3: d = 2,0 m
A estimativa foi feita das 22:00 horas às 6:00 horas, do 2º ao 7º dia.
Sabendo-se os horários e os tempos em que ocorreu cada situação, calculou-se então a dose equivalente conforme feito anteriormente.
Para o segundo caso, estipulou-se que o acompanhante permaneça a maior parte do tratamento atrás do biombo a uma distância de 1,0 m, saindo de trás deste apenas para prestar algumas assistências ao paciente.
Para o terceiro caso, elaborou-se uma rotina para o paciente para as 34 horas consecutivas à ingestão do radioiodo. As atividades analisadas foram:
Primeiro dia:
10:30 h: Alta na recepção da enfermagem (d = 0,8 m) 10:35 h: Andar de elevador para sair do hospital (d = 0,5 m)
10:40 h: Ir embora por 30 min, 1 h ou 2 h de carro, transporte público e moto 12:30 h: Almoçar por 20 min (d = 0,6m ou 1,0 m)
18:30: Jantar por 20 min (d = 0,6m ou 1,0 m) 20:00 h: Assistir televisão por 30 min, 1 h ou 2 h
22:00 h: Dormir no mesmo quarto por 8h (d = 1,0 m ou 1,5 m)
Segundo dia:
08:00 h: Tomar café da manhã por 20 min (d = 0,6m ou 1,0 m) 12:30 h: Almoçar por 20 min (d = 0,6m ou 1,0 m)
14:00 h: Assistir televisão por 30 min, 1 h ou 2 h 18:30: Jantar por 20 min (d = 0,6m ou 1,0 m)
3.2 Rejeitos radioativos
O raioiodo ingerido que não for captado pelas células remanescentes da tireóide é eliminado pela urina, fezes, saliva, suor e secreções. Portanto, todos os objetos e forrações do quarto do paciente devem ser monitorados antes de serem descartados pelas vias convencionais.
Após a retirada dos resíduos do quarto do paciente, monitorou-se, uma vez ao dia, com o Geiger-Müller com sonda de contaminação tipo pancake, todos os resíduos gerados. Se estes estivessem acima de 300 contagens por minutos eram classificados como rejeitos radioativos e então selecionados em sacos. Segregaram-se os restos de alimentos, copos, talheres, bandejas, lixos de banheiro, frascos e luvas contaminados separadamente das forrações e garrafas. Mediu-se então a taxa de exposição a 10,0 cm de cada saco com o Geiger-Müller com sonda de exposição.
Com a finalidade de estimar a quantidade de rejeitos radioativos gerados por paciente, repetiu-se o procedimento para todos os pacientes durante 1 mês. Sabendo o número total de sacos, o número total de pacientes e a taxa de exposição de cada saco, encontrou-se a quantidade de sacos de rejeito radioativo gerados por paciente e a taxa de exposição média por saco.
Em seguida, mediu-se o raio e a massa de 10 sacos e calculou-se o raio médio e a massa média dos sacos. Com o raio médio, calculou-se o volume estimado de cada saco de rejeito radioativo.
Adotou-se a distância para a maior atividade dos rejeitos, como se todo o material radioativo do saco estivesse concentrado no centro, somando então o raio do saco aos 10 cm de distância entre o saco e o Geiger-Müller e, com a taxa de exposição média, calculou-se a atividade média por saco utilizando a equação 9.
Segundo a norma CNEN-NE 6.05, para eliminação de rejeitos sólidos no sistema de coleta de lixo urbano é necessário que sua atividade específica não supere 2 Ci/Kg. Multiplicando-se este valor pelo peso médio do saco de rejeitos encontrados, obteve-se a atividade máxima permissível sua para liberação.
necessária para o armazenamento temporário destes rejeitos radioativos, sabendo-se que cada cofre comporta 1,0 m3. Como os rejeitos costumam ser liberados uma vez ao mês, definiu-se uma quantidade superior de cofres para armazená-los.
Para efeito de blindagem do cofre, simulou-se a situação em que a atividade deste será máxima, com o cofre cheio com 15 sacos. Encontrou-se a data em que o primeiro saco foi armazenado e a data em que o ultimo saco foi armazenado, podendo assim encontrar a atividade total dos sacos contidos em um cofre através da soma da atividade contida em cada saco no momento em que este estiver com sua capacidade máxima atingida. Esta foi obtida através da data de entrada do saco pela equação 5.
Com a atividade máxima, encontra-se a atividade corrigida para 168 horas (7 dias). Calculou-se então a taxa de exposição a 0,5 m, pela equação 9 e, em seguida, encontrou-se a taxa de dose em Sv/h. Somando-se os valores obtidos para as 168 horas, obteve-se a taxa de dose em Sv/semana.
Em seguida, adotou-se um fator de ocupação de acordo com o tempo de permanência das pessoas no local. Multiplicando-se este fator pela taxa de dose encontrada e dividindo-se pelo limite máximo permissível, encontrou-se o fator redução (FR). Aplicando-se na equação 13, obteve-se o número de camadas semi-redutoras necessárias para a blindagem. Assim, pela equação 14, foi possível encontrar a espessura de concreto ou de chumbo necessária para a blindagem do cofre.
Para calcular a blindagem da parede da sala de rejeitos adotou-se um fator de ocupação de acordo com os locais situados ao redor da sala.
4. RESULTADOS E DISCUSSÃO
4.1 Estimativa da dose equivalente (H)
Para calcular o valor teórico da taxa de exposição no momento da ingestão do radioiodo, utilizou-se o valor da constante de radiação gama para I-131 de = 0,22 (R.m2)/(h.Ci). A uma distância de 1,0 m, o valor da taxa de exposição teórica para 100
mCi obtida pela equação 9 foi de .
Conforme descrito na seção 3.1, foram monitorados 50 pacientes com o Geiger-Müller com sonda de exposição. As taxas de exposição medidas para cada paciente, os horários das medidas, os tempos decorridos entre as duas medidas de cada paciente, os fatores de correção, as atividades corrigidas e os tempos de meia-vida efetiva encontrados estão dispostos na tabela 5 (Apêndice A).
Fazendo-se a média entre os tempos de meia-vida efetiva, o tempo de meia-vida efetiva médio encontrado foi de Teff = 12,13 h, significando que, transcorridas aproximadamente 12 horas e 8 minutos, a taxa de exposição emitida pelo paciente terá caído para a metade da taxa de exposição inicial. Esse tempo de meia-vida efetiva varia de acordo com o percentual de captação da tireóide, com a atividade de 131I administrada e com a preparação do paciente, dependendo se ele seguiu corretamente a dieta restritiva de iodo antes da internação.
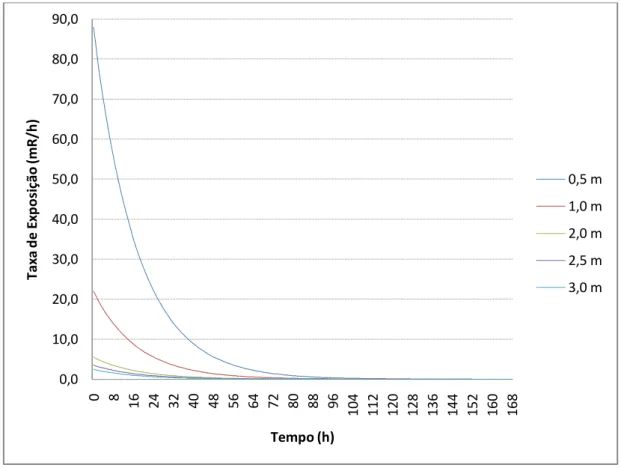
Com o tempo de meia-vida efetiva, conseguimos encontrar a atividade corrigida para 168 horas (7 dias) e assim encontrar taxa de exposição a 0,5 m, 1,0 m, 2,0 m, 2,5 m e 3,0 m.
Gráfico 1: Atividade Corrigida x Tempo
Gráfico 2: Taxa de Exposição x Tempo
Conforme podemos observar no gráfico 2, o aumento da distância entre uma fonte de radiação ionizante e um indivíduo é uma solução simples para minimizar a
0,0 10,0 20,0 30,0 40,0 50,0 60,0 70,0 80,0 90,0 100,0 0
12 24 36 48 60 72 84 96 108 120 132 144 156 168
A ti vi d ad e (m C i) Tempo (h) 0,0 10,0 20,0 30,0 40,0 50,0 60,0 70,0 80,0 90,0 0 8
16 24 32 40 48 56 64 72 80 88 96
104 112 120 128 136 144 152 160 168
exposição e, conseqüentemente, o acúmulo de dose, reduzindo de acordo com a lei do inverso do quadrado da distância. Outra forma de evitar exposições desnecessárias é pela redução, tanto quanto possível, do tempo de permanência em áreas onde estão presentes fontes de radiação ionizante, uma vez que a dose acumulada é diretamente proporcional ao tempo de exposição a essa radiação.
Para verificar a validade dos dados obtidos, foi certificado que o contador Geiger-Müller estava devidamente calibrado pelo IPEN (Instituto Nacional de Energia Nuclear) e foram feitos testes de reprodutibilidade mensais.
4.1.1 Dose equivalente para auxiliares de enfermagem, equipe da higiene, físicos e médicos.
Baseada nas respostas dos trabalhadores, foi montada uma rotina diária para cada profissional, com os horários, os tempos e as distâncias para exercer cada atividade no quarto terapêutico.
O biombo utilizado no quarto terapêutico foi fabricado com 6 mm de chumbo (2 CSR), obtendo-se assim uma taxa de exposição atrás do biombo de 25% da taxa de exposição sem o biombo.
A rotina dos profissionais e as doses equivalentes no cristalino e no tórax encontradas estão dispostas na tabela 6 (Apêndice B).
Para os turnos da enfermagem, foram considerados 3 auxiliares de enfermagem no turno da manhã, 4 auxiliares de enfermagem no turno da tarde e 3 auxiliares de enfermagem no turno da noite. Já equipe de higiene é composta por 2 trabalhadores. Há também um médico e um físico.
As doses equivalentes estimadas para os profissionais foram consideradas baixíssimas em relação aos limites permitidos pela legislação, conforme a tabela a seguir:
Tabela 3: Limites de doses anuais (CNEN-NE-3.01)
Limites de Dose Anuais
Grandeza Órgão Indivíduo ocupacionalmente exposto
Indivíduo do público
Dose equivalente efetiva Corpo inteiro 20 mSv * 1 mSv ** Dose equivalente Cristalino 150 mSv 15 mSv
Pele 500 mSv 50 mSv
Mãos e pés 500 mSv
* Média ponderada em 5 anos consecutivos, desde que não exceda 50 mSv em qualquer ano.
** Em circunstâncias especiais, a CNEN poderá autorizar um valor de dose efetiva de até 5 mSv em um
ano, desde que a dose efetiva média em um período de 5 anos consecutivos, não exceda a 1 mSv por
ano.
O limite de dose equivalente efetiva permitido para o trabalhador é de 50 mSv/ano, ou aproximadamente 4 mSv/mês, sendo considerado no nível de investigação se esta estiver acima de 1,6 mSv/mês. Todas as doses equivalentes para o tórax estimadas foram de, no máximo, 5% do valor permitido, ou 13% da dose no nível de investigação.
As doses equivalentes no tórax para auxiliares de enfermagem, equipe de higiene e médicos foram consideradas dentro dos limites de dose equivalente permissível ao público de 1,0 mSv/ano.
O limite de dose equivalente no cristalino é de aproximadamente 12,5 mSv/mês. As doses equivalentes no cristalino estimadas foram inferiores a 6,5% deste limite permito, porém esse valor poderia chegar a 1,6% se os trabalhadores seguissem a recomendação de utilizar sempre óculos plumbífero ao adentrarem no quarto terapêutico.
As doses equivalentes dos auxiliares de enfermagem, equipe de higiene e médicos registradas por dosímetros termoluminescentes foram abaixo do nível de registro (<0,2 mSv/mês), confirmando assim que os resultados aqui estimados
4.1.2 Dose equivalente para público
Para estimar a dose no público após a alta, foram estipulados algumas situações e calculadas as doses equivalentes de hora em hora, das 10:00 h às 22:00 h.
Como em casa o público fica mantém contato com o paciente sem o biombo de chumbo para separá-los, as doses equivalentes no tórax e no cristalino serão consideradas iguais.
Os resultados obtidos estão dispostos nos gráficos a seguir:
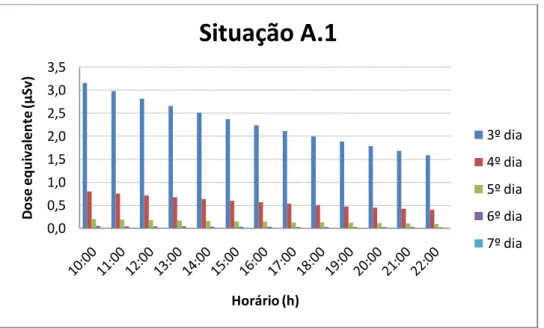
Gráfico 3: Dose Equivalente x Hora
Através da situação A.1 podemos estimar a dose equivalente no público durante o café da manhã, almoço, café da tarde e jantar por um tempo de 15 min a 1,0 metro de distância. Exemplo: se no 3º dia após a ingestão do radioiodo o paciente tomar café da manhã às 10:00 h, almoçar às 13:00 h, tomar café da tarde às 16:00 h e jantar às 19:00 h a 1,0 m de distância da mesma pessoa, sua dose equivalente efetiva será de 9,94 μSv. Se as mesmas atividades forem repetidas até o 7º dia, ao final a dose equivalente efetiva será de 13,3 μ“v.
0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5
D
o
se
e
q
u
iv
al
en
te
(
μ
Sv)
Horário (h)
Situação A.1
3º dia
4º dia
5º dia
6º dia
Gráfico 4: Dose Equivalente x Hora
Pela situação A.2, podemos estimar a dose equivalente no público durante uma viagem curta de carro, por meia hora, a uma distância de 1,0 metro do paciente. Exemplo: se o paciente andar de carro às 11:00 h do 3º dia, a dose equivalente do acompanhante será de 5,96 μSv. Caso essa situação seja no 4º, 5º, 6º ou 7º dia, a dose equivalente efetiva será de 1,51 μSv, 0,38 μSv, 0,1 μSve 0,0β μSv, respectivamente.
Gráfico 5: Dose Equivalente x Hora
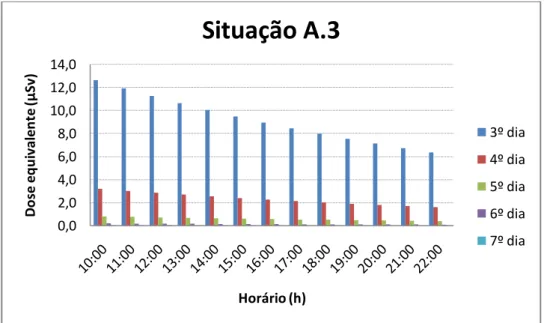
Caso o paciente necessite fazer uma viagem mais longa, podemos encontrar os valores de dose equivalente estimado pela situação A.3. Exemplo: se o paciente fizer uma viagem de 2 horas no 3º dia, das 11:00h às 13:00 h, a dose equivalente no acompanhante será de 23,17 μ“v.
Gráfico 6: Dose Equivalente x Hora
Gráfico 7: Dose Equivalente x Hora
Gráfico 8: Dose Equivalente x Hora
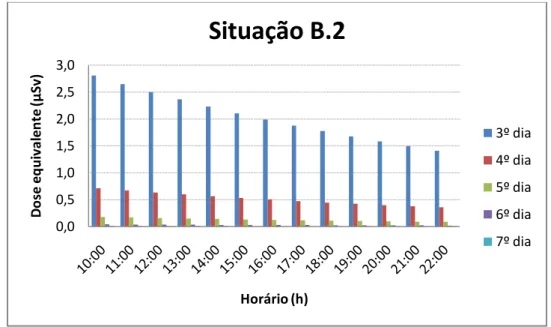
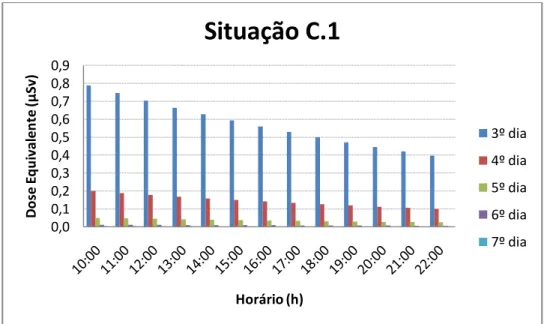
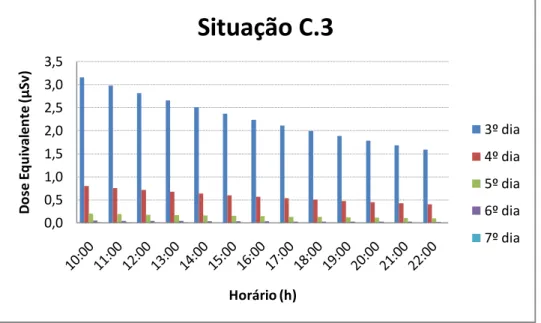
As situações B.1, B.2 e B.3 foram escolhidas para exemplificar algumas rotinas em que o paciente permaneça por 15 min, 30 min, 1 h ou mais a uma distância de 1,5 m de distância das demais pessoas, como exemplo: assistir televisão, fazer as refeições, entre outras.
Gráfico 9: Dose Equivalente x Hora
Gráfico 10: Dose Equivalente x Hora
Gráfico 11: Dose Equivalente x Hora
Gráfico 12: Dose Equivalente x Hora
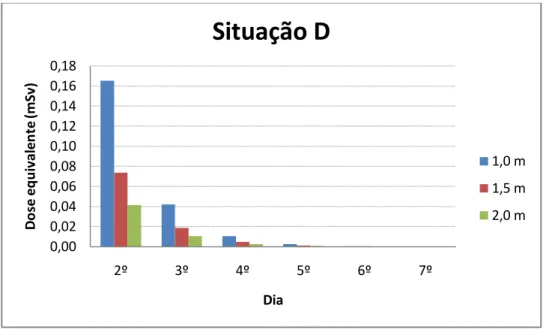
A situação D foi escolhida para estimar a dose equivalente caso o paciente durma no mesmo cômodo que o acompanhante. Se o paciente dormir por 8 horas consecutivas, das 22:00 h às 06:00 h no mesmo quarto, do 2º ao 7º dia, a 1,0m, 1,5 m ou 2,0 m de distância, a dose equivalente do acompanhante será de 0,22, 0,1 e 0,05 mSv, respectivamente.
O período de estimativa das doses (sete dias consecutivos) é suficiente para estimar cerca de 95% do total de dose fornecida pelos pacientes, uma vez que estudos anteriores mostraram que em cerca de cinco dias quase toda a atividade administrada aos pacientes é eliminada. Pelo gráfico 1, encontramos uma atividade de 0,11 mCi após cinco 5 dias da administração do Iodo-131, confirmando os valores encontrados em outros estudos.[10]
Através dos gráficos 3 a 12, podemos verificar que, após a alta hospitalar, o paciente apresenta uma taxa de dose baixa o suficiente para o convívio com as demais pessoas, desde que seja respeitado o critério de manter uma distância mínima de 1,0 a das demais pessoas.
Para estimar a dose equivalente em acompanhantes, partiu-se da suposição que o paciente permaneça a maior parte do tempo sentado em uma poltrona atrás do biombo enquanto o paciente permanece deitado no leito, a uma distância aproximada de 1,0 m e,
0,00 0,02 0,04 0,06 0,08 0,10 0,12 0,14 0,16 0,18
2º 3º 4º 5º 6º 7º
de hora em hora, preste assistência ao paciente por aproximadamente 10 min, a uma distância de 0,5 m sem o biombo.
A dose equivalente total no tórax obtida para o acompanhante foi de H = 1,89 mSv. Todos os valores encontrados estão dispostos nas tabelas 7, 8 e 9 (Apêndice C).
No caso de pacientes com problemas e que necessitam de acompanhamento, a dose equivalente específica para familiares que auxiliam nos cuidados de pacientes é considerada aceitável se for inferior a 5,0 mSv/ano, desde que a dose equivalente efetiva média, em um período de 5 anos consecutivos, não exceda a 1 mSv por ano. A dose equivalente efetiva calculada foi superior ao limite máximo anual permissível para público, porém está dentro do valor autorizado pela CNEN para estas circunstâncias. Portanto, sob o ponto de vista da proteção radiológica, não há impedimento algum para que uma pessoa acompanhe um paciente sob tratamento de câncer de tiróide com uso de 131I, tendo esse recebido atividade de 100 mCi, desde que se justifique sua necessidade de acompanhamento.
Para estimar a dose equivalente para o público caso o paciente não ficasse internado, foi elaborada uma rotina em que o paciente tenha contato com as demais pessoas nas 34 horas consecutivas à ingestão do radioiodo. As atividades analisadas e suas respectivas doses equivalentes encontradas estão dispostas na tabela 4 a seguir:
Tabela 4: estimativa da dose equivalente para o público sem internação.
Hora Distância
(m) Tempo (min) Dose Equivalente (mSv) 1º dia
Alta 10:30 0,8 10 0,0496
Andar de
elevador 10:35 0,5 1 0,0126
Viajar de carro no banco do
lado
10:40 0,65 30 0,2231
10:40 0,65 60 0,4461
10:40 0,65 120 0,8675
Viajar de carro no banco de
trás
10:40 1 30 0,0942
10:40 1 60 0,1885
10:40 1 120 0,3665
Viajar de transporte
público
10:40 0,5 30 0,3770
10:40 0,5 60 0,7539
Viajar de moto
10:40 0,35 30 0,7693
10:40 0,35 60 1,5386
10:40 0,35 120 2,9919
Almoçar 12:30 0,6 20 0,1572
12:30 1 20 0,0566
Jantar 18:30 0,6 20 0,1116
18:30 1 20 0,0402
Assistir televisão
20:00 0,6 30 0,1536
20:00 0,6 60 0,3072
20:00 0,6 120 0,5973
Assistir televisão
20:00 1 30 0,0553
20:00 1 60 0,1106
20:00 1 120 0,2150
Assistir televisão
20:00 2 30 0,0138
20:00 2 60 0,0276
21:00 2 60 0,0261
20:00 2 120 0,0538
Dormir no mesmo quarto
22:00 1 8h 0,6517492
22:00 1,5 8h 0,2896663
22:00 2 8h 0,1629373
2º dia
Tomar café da manhã
08:00 0,6 20 0,0516
08:00 1 20 0,0186
Almoçar 12:30 0,6 20 0,0399
12:30 1 20 0,0144
Assistir televisão
14:00 0,6 30 0,0549
14:00 0,6 60 0,1099
14:00 0,6 120 0,2136
Assistir televisão
14:00 1 30 0,0198
14:00 1 60 0,0396
14:00 1 120 0,0769
Assistir televisão
14:00 2 30 0,0049
14:00 2 60 0,0099
14:00 2 120 0,0192
Jantar 18:30 0,6 20 0,0283
18:30 1 20 0,0102
As doses equivalentes no cristalino e no tórax foram consideradas iguais, pois o paciente mantém contato com as demais pessoas sem o biombo de chumbo.
Supondo a seguinte rotina: se o paciente for embora de carro com um acompanhante, sentado no banco ao lado por 1h, almoçar sentado ao lado, jantar sentado ao lado, assistir televisão por 1h a 1,0 m de distância no primeiro dia e tomar café da manhã sentado ao lado, almoçar sentado ao lado, assistir televisão a 1,0 metro e jantar ao lado, no segundo dia, da mesma pessoa, em apenas 34 horas está já terá recebido 1,0 mSv, atingindo seu limite anual de dose.
Os pacientes tratados com iodo-131 podem expor indivíduos que permaneçam no seu campo de radiação ou que sofram incorporação de atividades do radioisótopo excretadas por eles. A hospitalização de pacientes que recebam atividades acima de 30 mCi é estabelecida como medida de radioproteção pelo órgão de regulamentação nacional (CNEN), visando proteger os familiares, os indivíduos do público e o meio ambiente contra possíveis exposições ou contaminações radioativas. Os valores estimados na tabela 4 demonstram a fundamental importância da internação do paciente nas primeiras 34 horas.
Caso o paciente não permaneça em isolamento, o princípio de limitação de dose individual estará sendo violado, a menos que exista uma justificativa para esta conduta.
4.2 Rejeitos radioativos
Foram monitorados todos os sacos de resíduos retirados do quarto do paciente durante 1 mês, somando um total de 31 sacos de rejeitos radioativos para 23 pacientes. O número de sacos de rejeitos radioativos por paciente encontrado foi de 1,34 sacos/paciente, sendo arredondado para 1,5 sacos/paciente. Somando-se a taxa de exposição de casa saco, obteve-se 50,5 mR/h, o que resulta numa taxa de exposição média de cada saco de aproximadamente 1,63 mR/h.
A massa média de cada saco encontrada foi de 700 g/saco. O raio médio encontrado para os sacos foi de 25 cm, tendo um volume de aproximadamente 0,07m3.
Para descobrir o limite para a liberação de cada saco, multiplicamos a massa obtida por 2 Ci/Kg, podendo assim liberar o saco com 1,4 Ci. Através da equação 5, encontramos o tempo mínimo de 75,11 dias para que a atividade específica de cada saco atinja este valor. Este valor está dentro do tempo de armazenamento adotado na prática.
Sabemos que em cada semana são internados 6 pacientes para o tratamento, sendo 2 na terça, 2 na sexta e 2 no domingo. Portanto em 75 dias teremos 64 pacientes, gerando um total de 96 sacos de rejeitos radioativos. Como cada cofre tem capacidade de 1,0 m3, podendo então armazenar 15 sacos de rejeitos radioativos, serão necessários 7 cofres para armazenar os 96 sacos gerados. Sabendo-se que os sacos são liberados 1 vez ao mês aproximadamente, adotam-se então 10 cofres para armazenagem temporária dos rejeitos radioativos, tendo uma capacidade total de 150 sacos de rejeitos radioativos. A partir da data de entrada, calcula-se a atividade corrigida de cada saco pela equação 5. Somando todos os valores encontrados, obtemos a atividade total de 10,24 mCi contida no cofre quando este estiver com sua capacidade máxima. Os valores obtidos para chegar a este valor estão na tabela 10 (Apêndice D).
Pela equação 5, encontramos a atividade corrigida para 168 h e então calculamos a taxa de exposição a 0,5 m pela equação 9 para cada hora. Todos os valores encontrados estão dispostos na tabela 11 (Apêndice E). Somando todos os valores, temos uma taxa de dose de 10,12 mSv/semana.
A norma CNEN-NE-6.05 estabelece critérios sobre a definição do local para o
armazenamento provisório de rejeitos, dentre os quais: “... situar-se distante das áreas
normais de trabalho...”. O depósito deve estar localizado fora das rotas disponíveis ao público e de acesso fácil para o transporte ou descarte do rejeito, devendo permanecer trancado, tendo acesso somente as pessoas autorizadas em ocasiões justificáveis de controle, armazenamento e liberação dos rejeitos.
Como os depósitos para armazenamento temporário são Áreas Controladas, tendo acesso somente os físicos e a equipe da higiene, os quais permanecem no máximo 5 min/dia para armazenar os rejeitos e 30 min/mês para liberar os rejeitos, adotou-se um fator de ocupação T = 1/16.
2,66 camadas semi-redutoras, encontradas através da equação 13. Sabendo-se que a camada semi-redutora do concreto para o Iodo-131 é de 3 cm e do chumbo é de 3 mm, será necessário que o cofre seja construído com 8 cm de concreto ou 8 mm de chumbo.
Para o cálculo de blindagem da parede, adota-se o limite máximo para Área Não Controlada fixado pela norma CNEN-NE-3.01 de 1,0 mSv/mês para público, ou aproximadamente 20 mSv/semana.
O fator de ocupação adotado foi de T = 1/4 (locais de pouca circulação de pessoas).
Utilizando a taxa de exposição na saída do cofre encontrada de 400 mSv/semana, encontramos um fator de redução FR = 5,0, sendo assim necessárias 2,32 camadas semi-redutoras para a blindagem. Portanto, a parede deverá ser construída com 7 cm de concreto. Sabendo-se que uma parede tem em média 15 cm, não será necessária uma blindagem adicional para as paredes da sala de armazenamento temporário de rejeitos radioativos.
O local ideal para que o depósito de rejeitos radioativos seja construído deverá ser afastado, com pouca circulação de pessoas, como exemplo garagens e subsolos, para assim diminuir o fator ocupação, diminuindo a espessura da blindagem e conseqüentemente o custo. Se os locais ao redor forem sem circulação de pessoas, como exemplo terrenos vazios e parques, não há necessidade do cálculo de blindagem da parede.
A espessura do cofre aqui citada serve apenas para armazenar os rejeitos radioativos liberados pelo paciente, e não uma fonte radioativa de maior atividade. Para armazenar estas fontes radioativas e os rejeitos no caso de o paciente vomitar uma atividade grande, uma nova espessura deverá ser calculada.
5. CONCLUSÃO
O presente estudo avaliou a dose equivalente em trabalhadores e público decorrentes do tratamento de câncer de tireóide com iodo-131.
As doses equivalentes máximas encontradas para os auxiliares de enfermagem foram de 0,0840 mSv/mês no tórax e 0,3360 no cristalino, para a equipe de higiene foi de 0,0034 mSv/mês no tórax e 0,0136 mSv/mês no cristalino, para físicos 0,2055 mSv/mês no tórax e 0,8220 mSv no cristalino e para médicos 0,0066 mSv/mês no tórax e 0,0265 mSv/mês no cristalino, podendo serem consideradas baixas em relação ao limite estipulado pela norma CNEN-NN-3.01 de 50 mSv/ano no tórax e 150 mSv/ano no cristalino.
A dose equivalente estimada para público após a alta do paciente foi considerada dentro dos limites permitidos pela CNEN de 1,0 mSv/ano para público, desde que seja mantida uma distância mínima recomendada de 1,0 metro. No caso de acompanhantes durante a internação, a dose estimada foi de 1,89 mSv, estando dentro dos limites autorizados pela CNEN para esta situação, de 5,0 mSv/ano.
Podemos, então, concluir que, tomando os devidos cuidados de proteção radiológica, todas as doses encontradas foram consideradas dentro dos limites permitidos pela norma CNEN-NN-3.01, respeitando o princípio de limitação de dose individual.
Estimando a quantidade de rejeito radioativo por paciente, obteve-se um tempo médio de armazenamento de, no mínimo, 75 dias para que sua atividade atinja o limite permitido para liberação de rejeitos sólidos de 2 Ci/Kg. Assim, todo rejeito radioativo retirado deve ser encaminhado ao depósito de rejeitos radioativos. Este deve ser devidamente blindado, localizado distante das áreas de trabalho normais, com pouca circulação de pessoas, tendo acesso somente as pessoas autorizadas em ocasiões justificáveis de controle, armazenamento e liberação dos rejeitos radioativos.
REFERÊNCIAS BIBLIOGRÁFICAS
[1] WORLD HEALTH ORGANIZATION. Policies and managerial guidelines for national cancer control programs. Rev Panam Salud Publica. 2002.
[2] MACIEL B. Câncer da tiróide. Endocrinologia Clínica, 2ª ed, 2001.
[3] PARKIN D.M., WHELAN S.L., FERLAY J. Cancer incidence in five continents. v.7, IARC Scientific Publication 143, International Agency for Research on Cancer, Lyon, 1997.
[4] SCHLUMBERGER M.J. Diagnostic follow-up of well-differentiated thyroid carcinoma: historical perspective and current status. J Endocrinol Inves. 1999.
[5] WAGNER H. N., BUCHANANA J. W., SZABO Z. Principles of nuclear medicine, Ed. W. B. Saunders Company, 2ª ed. 1995.
[6] CASTRO A. J. Guia Prático Em Medicina Nuclear. SENAC. 2000.
[7] CHANDRA, RAMESH. Introductory physics of nuclear medicine. Philadelphia-Lea and Febiger, 4ª ed. 1992.
[8] ROCHA A.F.G. Estudo da função tireoidiana, In: Medicina Nuclear. Guanabara Koogan. 1976.
[9] INGBAR S.H., WOEBER K.A. The Thyroid Gland. Textbook of Endocrinology, Robert H. Williams. 1981.
[10] WILLEGAIGNON, J. 131I effective Half-Life(Teff) for Patients with Thyroid Cancer. Health Physics, v.91, n. 2. 2006.
[11] HARBERT J.C. Radioiodine Therapy of Differentiated Thyroid Carcinoma. In: Nuclear Medicine Diagnosis and Therapy. Thieme. 1996.
[12] HAM A.W. Histologia. Guanabara Koogan. 1972.
[13] GUYTON A.C. Os hormônios metabólicos da tireóide. In: Tratado de fisiologia médica, 7º Ed. Interamericana. 1989.
[14] PUNALES M. K., ROCHA A. P., GROSS J. L., MAIA A. L. Carcinoma medular de tireóide: aspectos moleculares, clínico-oncológicos e terapêuticos. Arq Bras Endocrinol Metab, v. 48, n.1. 2004.
[16] GOLBERT L., WAJNER S. M., ROCHA A. P., MAIA A. L., GROSS J. L. Carcinoma Diferenciado de Tireóide: Avaliação Inicial e Acompanhamento, Arq Bras Endocrinol Metab. v. 49. 2005.
[17] WERNER S.C., INGBAR S.H., BRAVERMAN L.E., UTIGER R.D.. WERNER,
INGBAR’S. The Thyroid: a fundamental and clinical text, 9º ed. Philadelphia:
Lippincott Williams & Wilkins. 2005.
[18] SCHLUMBERGER MJ. Papillary and follicular thyroid carcinoma. N Engl J Med 1998.
[19] PACINI F., SCHLUMBERGER M., DRALLE H., ELISEI R., SMIT J.W.A., WIERSINGA W. European consensus for the management of pacients with differented thyroid carcinoma of the follicular epithelium. Eur J Endocrinol 2006.
[20] LIMA F.F. Otimização da dose terapêutica com 131I para carcinoma diferenciado da tiróide. Tese de D.Sc., Universidade Federal de Pernambuco. 2002.
[21] SAPIENZA M.T., ENDO I.S., CAMPOS G.C.N., TAVARES M.G.M., MARONE M.M.S. Tratamento do Carcinoma Diferenciado da Tireóide Com Iodo- 131: Intervenções Para Aumentar a Dose Absorvida de Radiação, Arq Bras Endocrinol Metab. v. 49, n.3. 2005.
[22] COMISSÃO NACIONAL DE ENERGIA NUCLEAR. Diretrizes Básicas de Proteção Radiológica. CNEN-NN- 3.01. CNEN. 2005.
[23] INTERNATIONAL COMMISSION ON RADIOLOGICAL PROTECTION. Release of patients after therapy with unsealed radionuclides. Oxford: Pergamon Press: ICRP Publication 94. 2004.
[24] NRC. U.S. NUCLEAR REGULATORY COMMISSION. Release of patients administered radioactive materials. Washington, DC: Publisher. Regulatory Guide 8.39. 1997.
[25] COMISSÃO NACIONAL DE ENERGIA NUCLEAR. Gerência de Rejeitos Radioativos em Instalações Radioativas. CNEN-NE-6.05. CNEN. 1985.
[26] COMISSÃO NACIONAL DE ENERGIA NUCLEAR. Licenciamento de instalações radioativas. CNEN-NE-6.02. CNEN. 1998.
[28] INTERNATIONAL ATOMIC ENERGY AGENCY. Management of small quantities of radioactive waste. Vienna: IAEA (IAEA-TECDOC-1041). 1998
[29] SPRAWLS P.Jr. Physical Principles of Medical Imaging, v.2. Madison, Wisconsin, USA: Aspen Publishers. 1995.
[30] CEMBER H. Introduction to Health Physics. USA: Pergamon Press, 3ª ed. 1996. [31] INTERNATIONAL COMMISSION ON RADIOLOGICAL PROTECTION, Recommendations of the International Commission on Radiological Protection. Oxford: Pergamon Press: ICRP Publication 60. 1991.