MINISTÉRIO DA EDUCAÇÃO
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS
LABORATÓRIO MULTIDISCIPLINAR – LABMULT
INFLUÊNCIA DO HIPOESTROGENISMO POR OOFORECTOMIA NA
ADAPTAÇÃO ANTIOXIDANTE EM RATAS WISTAR EXERCITADAS
REGULARMENTE
Ulisvaldo Brunno de Oliveira Macedo
Orientadora: Profa. Dra. Maria das Graças Almeida
MINISTÉRIO DA EDUCAÇÃO
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS
LABORATÓRIO MULTIDISCIPLINAR – LABMULT
INFLUÊNCIA DO HIPOESTROGENISMO POR OOFORECTOMIA NA
ADAPTAÇÃO ANTIOXIDANTE EM RATAS WISTAR EXERCITADAS
REGULARMENTE
Ulisvaldo Brunno de Oliveira Macedo
Dissertação submetida ao Programa de Pós-Graduação em Ciências Farmacêuticas como requisito para a obtenção do grau de MESTRE em Ciências Farmacêuticas.
Orientadora: Profa. Dra. Maria das Graças Almeida
CATALOGAÇÃO NA FONTE M141i
Macedo, Ulisvaldo Brunno de Oliveira.
Influência do hipoestrogenismo por ooforectomia na
adaptação antioxidante em ratas wistar exercitadas regularmente / Ulisvaldo Brunno de Oliveira Macedo. – Natal, 2013.
63f.
Orientadora Prof.ª Dr.ª Maria das Graças Almeida. Dissertação (Mestrado) – Programa de Pós-Graduação em Ciências Farmacêuticas. Centro de Ciências da Saúde.
Universidade Federal do Rio Grande do Norte.
1. Estrógenos– Dissertação. 2. Pós-menopausa – Dissertação. 3. Hipoestrogenismo – Dissertação. 4. Exercício físico –
Dissertação. I. Almeida, Maria das Graças. II. Título.
Nunca sejamos ”sábios” a ponto de perder a capacidade de refletir sobre nossos conceitos, nem ignorantes que não nos permitamos questionar a realidade que nos cerca!
DEDICATÓRIA
Em especial dedico essa obra à memória de meus saudosos avós, Francisco Anselmo
AGRADECIMENTOS
À sábia e dedicada Profª Drª Maria das Graças Almeida que esteve sempre ao meu lado desde o início de minha formação acadêmica orientando meus passos como aluno de pós-graduação.
Ao Profª Drª. Juarez Ferreira da Costa diretor do Centro de Ciências da Saúde da Universidade Federal do Rio Grande do Norte (CCS-UFRN) pelo constante e incansável apoio.
Ao Programa de Pós-Graduação em Ciências Farmacêuticas, na pessoa da Coordenadora Profª Drª Adriana Augusto de Rezende, pela forma como vem
conduzindo o programa e pela orientação como aluno de iniciação cientifica desde o
início de minha formação acadêmica.
À Profª Drª. Telma Maria de Araújo Moura Lemos, Chefe do Departamento de Análises Clínicas e Toxicológicas – UFRN, pela atenção desprendida sempre apoiando o Programa de Pós-graduação.
Ao Prof. Dr. José Brandão Neto, do Departamento de Medicina Clínica – UFRN, pela participação constante no crescimento LABMULT e sua vasta experiência na construção do saber.
Ao Doutorando Rand Randal Martins pela parceria nesse trabalho e apoio ao longo desses últimos anos que facilitou esse desafio permitindo o desenvolvimento desse trabalho.
À Profª Elisete Aparecida Ferreira Gomes da FATERN – Gama Filho pela
generosa colaboração na revisão desta obra.
Aos amigos e companheiros de trabalho Francisco Freire Neto, João Felipe
Bezerra, Marcela Abbott Galvão Ururahy, Melina Bezerra Loureiro, Yonara Monique da Costa Oliveira, Luziana Firmino Azevedo, Kleyton Thiago e Francisco Alexandre que foram companheiros ao longo dos últimos anos sempre
dando o apoio como em uma família e ajudando nos experimentos.
Aos funcionários da Secretaria da Pós-Graduação em especial Maria
Aureliana, sempre atenciosa e disposta a ajudar, os meus sinceros agradecimentos.
Aos funcionários do Biotério Central do CCS-UFRN, Ana Auxiliadora
Fernandes Vieira e Washington Fernandes da Rocha, pela atenção e primoroso
Ao Centro de Ciências da Saúde da Universidade Federal do Rio Grande
do Norte (CSS-UFRN), pelo suporte necessário para a conclusão desse trabalho. A meus pais, Ulisvaldo Macedo e Maria Leoneide de Oliveira Macedo, minha irmã Ilanna Paula de Oliveira Macedo que me deram de forma incondicional amor, educação, suporte emocional e material, necessários a essa caminhada.
A minha amada, Janile Bernardo Pereira, que me faz acreditar no amor e nas coisas que fazemos com esse sentimento tão sublime que são capazes de transformar realidades.
A os meus familiares, em especial a Otom Anselmo de Oliveira, Regina
Braz de Oliveira, Larissa Braz Oliveira, Juliana Braz de Oliveira e Uazir Orion Bezerra de Oliveira, pela presença sempre constante em minha vida, torcendo e
servindo de exemplo norteador de meus caminhos.
A meus amigos: Diego Revoredo, Ricardo Luiz Batista Santiago, Roberto
Cesar Santiago Filho, Maria Neide Soares da Silva, Maria de Lourdes Batista Santiago, e todos os Santiago, que por todos esses anos sempre dividiram comigo
todos os momentos, dos mais tristes aos mais felizes. Espero sempre poder está
sob a luz de seus olhos por toda a vida.
SUMÁRIO
1 INTRODUÇÃO 1
1.1 Climatério e pós-menopausa 1
1.2 Exercício físico no combate aos sintomas do hipoestrogenismo 4
1.3 Exercício físico, estresse oxidativo (EO) e defesa antioxidante 5
2 OBJETIVOS 11
2.1 Objetivo geral 11
2.2 Objetivos específicos 11
3 MATERIAIS E MÉTODOS 12
3.1 Animais 12
3.2 Protocolo de Exercício 13
3.3 Modelo de Hipoestrogenismo 13
3.4 Sacrifício dos Animais 14
3.5 Preparo das Amostras 14
3.5.1 Sangue 14
3.5.2 Hemolisado 15
3.5.3 Homogenato de tecidos 15
3.6 Determinação das Substâncias Reativas ao Ácido Tiobarbitúrico (SRAT)
15
3.6.1 Plasma 16
3.6.2 Tecidos (Cérebro e Fígado) 16
3.7 Determinação do conteúdo de Glutationa Reduzida (GSH) 17
3.7.1 Sangue Total 17
3.7.2 Tecidos (Cérebro e Fígado) 18
3.8 Determinação da atividade da Glutationa Peroxidase (GPx) 19
3.8.1 Intra-eritrocitária 19
3.8.2 Tecidos (Cérebro e Fígado) 19
3.9 Determinação da atividade da Superóxido Dismutase (SOD) 20
3.9.1 Intra-eritrocitária e tecidos (Cérebro e Fígado) 20
3.10 Determinação da atividade da Catalase (CAT) 21
3.10.1 Intra-eritrocitária 21
3.11 Análise Estatística 22
4 RESULTADOS 23
4.1 Avaliação da Peroxidação Lipídica 23
4.2 Biomarcadores Antioxidantes 26
4.2.1 Glutationa Reduzida (GSH) 26
4.2.2 Glutationa Peroxidase (GPx) 29
4.2.3 Superóxido Dismutase (SOD) 32
4.2.4 Catalase (CAT) 35
5 DISCUSSÃO 38
5.1 Peroxidação Lipídica 38
5.2 Biomarcadores Antioxidantes 40
5.2.1 Glutationa Reduzida (GSH) 40
5.2.2 Glutationa Peroxidase (GPx) 43
5.2.3 Superóxido Dismutase (SOD) 45
5.2.4 Catalase (CAT) 46
6 CONCLUSÃO 48
REFERÊNCIAS 49
ANEXO I - Aprovação pelo Comitê de Ética em Pesquisa 56
RESUMO
A pós-menopausa é um período do ciclo de vida da mulher que se caracteriza pela depleção dos estrogênios e, por conseqüência, o aumento da incidência de doenças cardiovasculares, neurodegenerativas, atrofia urogenital, osteoporose, fogachos e desconforto sexual. O estrógeno é um hormônio com ação antioxidante comprovada e sua depleção está relacionada à instalação de estresse oxidativo gerando danos a diversas biomoléculas importantes. O exercício físico regular vem sendo apontada como um fator de diminuição das complicações da pós-menopausa além de melhorar a defesa antioxidante diminuindo os danos oxidativos e conseqüente melhorando a qualidade de vida nesta parcela da população. O presente trabalho tem por objetivo avaliar a influência do hipoestrogenismo na adaptação antioxidante decorrente do exercício físico regular, mediante determinação das concentrações de Glutationa reduzida (GSH), Substâncias Reativas ao Ácido Tiobarbitúrico (SRAT) e atividade das enzimas antioxidantes, Glutationa Peroxidase (GPx), Superóxido Dismutase (SOD) e Catalase (CAT) em sangue, cérebro e fígado de ratas. Para se alcançar esse objetivo foram utilizadas 50 ratas Wistar, pesando entre 180-250 g, as quais foram divididas em dois grupos, controle - GC (25) e ooforectomizados - GO (25). Cada um dos grupos foi subdividido em cinco subgrupos: Não-treinado – NT (5), Não-treinado Exercício Agudo - NTEA (5), Exercitados regularmente 30 dias E30 (5), Exercitados regularmente 60 dias E60 (5) e Exercitados regularmente 90 dias E90 (5) dias. Cada um dos três subgrupos exercitados regularmente foi submetido a exercício agudo na véspera e no dia de sacrifício para coleta das amostras biológicas sangue, fígado e cérebro e posterior determinação das concentrações das SRAT, determinação do conteúdo de GSH e atividade das enzimas antioxidantes GPx, SOD e CAT. A avaliação dos resultados indicaram que os animais sedentários exercitados agudamente apresentaram estresse oxidativo e que a atividade física regular levou a adaptação antioxidante. No grupo ooforectomizado a adaptação antioxidante, vista nos animais controle apresentou-se prejudicada. Diferentemente dos resultados em sangue e fígado, no cérebro foi verificado uma proteção contra danos oxidativos decorrentes do exercício físico e que o hipoestrogenismo acarretou perda desse potencial antioxidante natural. Portanto, o hipoestrogenismo interfere negativamente na adaptação antioxidante decorrente do exercício físico regular.
ABSTRACT
Post-menopause is a period of women’s life cycle that is characterized by estrogen depletion and therefore increasing cardiovascular diseases, neurodegenerative disorders, urogenital atrophy, osteoporosis, hot flushes and sexual discomfort incidences. Estrogen is a hormone with comfirmed antioxidant action and its depletion is related to oxidative stress instalation and damaging various important biomolecules. Regular physical activity has been identified as a factor involved in reducing women’s post-menopausal complications in addition to improving antioxidant defense by reducing the oxidative damage and consequently improving life’s quality in this part of the population. This study aims to evaluate the influence of hypoestrogenism in antioxidant adaptation due to regular exercise, by determining reduced glutathione (GSH) and Thiobarbituric Acid Reactive Substances (SRAT) concentrations and antioxidant enzymes glutathione peroxidase (GPx), Superoxide Dismutase (SOD) and Catalase (CAT) activities in blood, brain and liver of rats. To achieve this goal we used 50 Wistar rats, weighing 180-250g which were divided into two groups, control - GC (25) and ooforectomized - GO (25). Each group was subdivided into five subgroups: Not-trained - S (5), Not-trained Acute Exercise - SEA (5), regular exercise 30 days - E30 (5), regular exercise 60 days - E60 (5) and regular exercise 90 days - E90 (5). Each of the three subgroups exercised regularly was subjected to acute exercise on the eve and the day of sacrifice to collect biological samples of blood, liver and brain and subsequent determination of SRAT concentration, GSH content and antioxidant enzymes GPx, SOD and CAT activities. The results indicated that the sedentary animals acutely exercised presented oxidative stress and regular physical activity led to antioxidant adaptation. In ooforectomized group the antioxidant adaptation seen in control animals showed to be impaired. Unlike the results from blood and liver, in brain there was a shield against oxidative damage originated by the exercise and that hypoestrogenism led to a loss of this natural antioxidant potential. Therefore, hypoestrogenism interferes negatively in antioxidant adaptation due to regular exercise.
LISTA DE ABREVIATURAS
ATP - Adenosina Trifosfato CAT - Catalase
CEP – HUOL - Comitê de Ética em Pesquisa DNA – Ácido Desoxirribonucléico
DTNB – Ácido 5,5’-ditiobis-[2-nitrobenzoico] EO – Estresse Oxidativo
ERO – Espécies Reativas de Oxigênio EDTA – Ácido Etilenodiamino Tetra-acético E30 – Exercitados durante trinta dias
E60 – Exercitados durante sessenta dias E60 – Exercitados durante noventa dias GC – Grupo Controle
GO – Grupo Ooforectomizado GPx – Glutationa Peroxidase GR – Glutationa Redutase GSSG – Glutationa Oxidada GSH – Glutationa Reduzida MDA – Malonildialdeido
NADPH – Nicotinamida Adenina Dinucleotídeo Fosfato
NAD+ – Nicotinamida Adenina Dinucleotídeo
NOS – Oxido Nítrico Sintase NF-κB – Fator Nuclear κB S - Sedentário
SEA – Sedentário Exercício Agudo SOD – Superóxido Dismutase
SRAT – Substâncias Reativas ao Ácido Tiobarbitúrico TBA – Ácido Tiobarbitúrico
TNB – Ácido Tio-2-nitrobenzoico TE – Terapia Estrogênica
TH – Terapia Hormonal
UFRN – Universidade Federal do Rio Grande do Norte XD – Xantina Desidrogenase
LISTA DE FIGURAS
FIGURA 1 – Mecanismo da biossíntese do estradiol nos diferentes
tecidos, em destaque a aromatase citocromo P450 19 (adaptado de
ÖSTERLUND; HURD, 2001).
2
FIGURA 2 – Representação esquemática de principais danos
promovidos pelas EROs e os mecanismos de reparo existentes
(adaptado de BOKOV, A., CHAUDHURI, A.; RICHARDSON, A, 2004).
5
FIGURA 3 – Interconversão de Glutationa nas suas formas reduzida
(GSH) e oxidada (GSSG) pela ação das enzimas Glutationa Peroxidase
(GPx) e Glutationa Redutase (GR) ROVER JUNIOR et al., 2001).
7
FIGURA 4 – Formação do O2●-, H
2O2 e OH● e ação das enzimas
antioxidantes SOD, Catalase e GPx no metabolismo do oxigênio na
mitocôndria.
7
FIGURA 5 – Geração do ânion superóxido via Xantina Oxidase
(adaptado de SACHDEV; DAVIES, 2007).
8
FIGURA 6 – Organograma da distribuição dos grupos (Controle e
Ooforectomizado) e subgrupos (Sedentários, Sedentários Exercício
Agudo, Exercitados 30 dias, Exercitados 60 dias e Exercitados 90 dias).
12
FIGURA 7 – Reação do TBA entre o ácido 2-tiobarbitúrico e o
malonildialdeído, formando o composto colorido, medido
espectrofotometricamente a 532 nm (OSAWA; FELICIO; GONÇALVES,
2005).
16
FIGURA 8 – Reação entre GSH e DTNB formando o TNB de coloração
amarela.
17
FIGURA 9 – Reação utilizada para determinação da atividade da GPx
que tem por base a medida do decréscimo de absorbância por oxidação
do NADPH.
19
FIGURA 10 – Reação utilizada para determinação da atividade da SOD
que compete com o Citocromo C+++ pelo Ânion Superóxido (McCORD;
FRIDOVICH, 1969).
FIGURA 11 – Ação da Catalase na eliminação do Peróxido de
Hidrogênio (H2O2)
21
FIGURA 12 – Influência do exercício físico na concentração de SRAT no
plasma dos grupos Controle (GC) e ooforectomizados (GO). Diferenças
significativas: * p<0,05 vs. Basal, # p<0,05 vs. Sedentário, ○ p<0,05 vs. 30 dias, ● p<0,05 vs. 60 dias e a p<0,05 vs. o respectivo do GC. Os resultados foram submetidos à ANOVA seguido do Teste de
Tukey-Kramer para comparar grupos independentes.
24
FIGURA 13 – Influência do exercício físico na concentração de SRAT
em fígado nos Grupos Controle (GC) e Ooforectomizados (GO).
Diferenças significativas: * p<0,05 vs. Basal, # p<0,05 vs. Sedentário, ○
p<0,05 vs. 30 dias e a p<0,05 vs. o respectivo do GC. Os resultados
foram submetidos à ANOVA seguido do Teste de Tukey-Kramer para
comparar grupos independentes.
25
FIGURA 14 – Influência do exercício físico na concentração de SRAT
em cérebro nos Grupos Controle (GC) e Ooforectomizados (GO).
Diferenças significativas: * p<0,05 vs. Basal, # p<0,05 vs. Sedentário e a
p<0,05 vs. o respectivo do GC. Os resultados foram submetidos à
ANOVA seguido do Teste de Tukey-Kramer para comparar grupos
independentes.
26
FIGURA 15 – Influência do exercício físico no conteúdo de GSH no
sangue total nos grupos controle (GC) e ooforectomizados (GO).
Diferenças significativas: * p<0,05 vs. Basal, # p<0,05 vs. Sedentário, ○
p<0,05 vs. 30 dias, ● p<0,05 vs. 60 dias e a p<0,05 vs. o respectivo do
GC. Os resultados foram submetidos à ANOVA seguido do Teste de
Tukey-Kramer para comparar grupos independentes.
27
FIGURA 16 – Influência do exercício físico no conteúdo de GSH em
fígado nos Grupos Controle (GC) e Ooforectomizados (GO). Diferenças
significativas: * p<0,05 vs. Basal, # p<0,05 vs. Sedentário, e a p<0,05 vs.
o respectivo do GC. Os resultados foram submetidos à ANOVA seguido
do Teste de Tukey-Kramer para comparar grupos independentes.
FIGURA 17 – Influência do exercício físico no conteúdo de GSH em
cérebro nos Grupos Controle (GC) e Ooforectomizados (GO). Diferenças
significativas: * p<0,05 vs. Basal, # p<0,05 vs. Sedentário, ○ p<0,05 vs.
30 dias e a p<0,05 vs. o respectivo do GC. Os resultados foram
submetidos à ANOVA seguido do Teste de Tukey-Kramer para comparar
grupos independentes
29
FIGURA 18 – Influência do exercício físico na atividade da GPx em
hemolisado nos Grupos Controle (GC) e Ooforectomizados (GO).
Diferenças significativas: * p<0,05 vs. Basal, # p<0,05 vs. Sedentário, ○
p<0,05 vs. 30 dias e a p<0,05 vs. o respectivo do GC. Os resultados
foram submetidos à ANOVA seguido do Teste de Tukey-Kramer para
comparar grupos independentes.
30
FIGURA 19 – Influência do exercício físico na atividade da GPx em
fígado nos Grupos Controle (GC) e Ooforectomizados (GO). Diferenças
significativas: * p<0,05 vs. Basal, # p<0,05 vs. Sedentário, ○ p<0,05 vs. 30 dias e a p<0,05 vs. o respectivo do GC. Os resultados foram
submetidos à ANOVA seguido do Teste de Tukey-Kramer para comparar
grupos independentes.
31
FIGURA 20 – Influência do exercício físico na atividade da GPx em
cérebro nos Grupos Controle (GC) e Ooforectomizados (GO). Diferenças
significativas: * p<0,05 vs. Basal, # p<0,05 vs. Sedentário, ○ p<0,05 vs.
30 dias e a p<0,05 vs. o respectivo do GC. Os resultados foram
submetidos à ANOVA seguido do Teste de Tukey-Kramer para comparar
grupos independentes.
32
FIGURA 21 – Influência do exercício físico na atividade da SOD no
hemolisado dos grupos controle (GC) e ooforectomizados (GO).
Diferenças significativas: * p<0,05 vs. Basal, # p<0,05 vs. Sedentário, ○
p<0,05 vs. 30 dias e a p<0,05 vs. o respectivo do GC. Os resultados
foram submetidos à ANOVA seguido do Teste de Tukey-Kramer para
comparar grupos independentes.
FIGURA 22 – Influência do exercício físico na atividade da SOD em
fígado nos Grupos Controle (GC) e Ooforectomizados (GO). Diferenças
significativas: * p<0,05 vs. Basal, # p<0,05 vs. Sedentário, ○ p<0,05 vs.
30 dias e a p<0,05 vs. o respectivo do GC. Os resultados foram
submetidos à ANOVA seguido do Teste de Tukey-Kramer para comparar
grupos independentes.
34
FIGURA 23 – Influência do exercício físico na atividade da SOD em
cérebro nos Grupos Controle (GC) e Ooforectomizados (GO). Diferenças
significativas: * p<0,05 vs. Basal e a p<0,05 vs. o respectivo do GC. Os
resultados foram submetidos à ANOVA seguido do Teste de
Tukey-Kramer para comparar grupos independentes.
35
FIGURA 24 – Influência do exercício físico na atividade da Catalase no
hemolisado nos grupos controle (GC) e ooforectomizados (GO).
Diferenças significativas: * p<0,05 vs. Basal, # p<0,05 vs. Sedentário e a
p<0,05 vs. o respectivo do GC. Os resultados foram submetidos à
ANOVA seguido do Teste de Tukey-Kramer para comparar grupos
independentes.
36
FIGURA 25 – Influência do exercício físico na atividade da CAT em
fígado nos Grupos Controle (GC) e Ooforectomizados (GO). Diferenças
significativas: # p<0,05 vs. Sedentário e a p<0,05 vs. o respectivo do GC.
Os resultados foram submetidos à ANOVA seguido do Teste de
Tukey-Kramer para comparar grupos independentes.
37
FIGURA 26 – Influência do exercício físico na atividade da CAT em
cérebro nos Grupos Controle (GC) e Ooforectomizados (GO). Diferenças
significativas: * p<0,05 vs. Basal e a p<0,05 vs. o respectivo do GC. Os
resultados foram submetidos à ANOVA seguido do Teste de
Tukey-Kramer para comparar grupos independentes.
TABELA
TABELA 1 – Protocolo de atividades atribuídas a cada Subgrupo
Sedentário Controle (S-C) e Sedentário Ooforectomizado (S-O);
Sedentário Exercício Agudo Controle (SEA-C) e Sedentário Exercício
Agudo Ooforectomizado (SEA-O); Exercitado 30 dias (E30-C) e
Exercitado 30 dias Ooforectomizado (E30-O); Exercitado 60 dias
Controle (E60-C) e Exercitado 60 dias Ooforectomizado (E60-O);
Exercitado 90 dias Controle (E90-C) e Exercitado 90 dias
Ooforectomizado (E90-O).
1 INTRODUÇÃO
1.1 Climatério e pós-menopausa
O climatério é a fase de evolução biológica da mulher que representa a
transição entre o período reprodutivo e o não reprodutivo, ou seja, da menacme à
senilidade (ALMEIDA, 2004). No período do climatério, ocorre a perimenopausa em
que um conjunto de sinais e sintomas prenuncia a chegada da menopausa, definida
pela parada da menstruação por período consecutivo igual ou maior que 01 ano
(LORENZI, 2005). Nesta fase da vida, ocorre diminuição da população ovariana
associadas a alterações do ciclo menstrual com anovulação e concomitante redução
gradual na produção dos hormônios sexuais femininos, sobretudo o estrógeno
(SPEROFF; CLARKSON, 2003; ALMEIDA, 2004).
O climatério é caracterizado por sinais e sintomas como: alterações
neurovegetativas como fogachos, sudorese, distúrbios do sono, depressão,
palpitação, vertigem, diminuição da memória, atrofia urogenital, dispareunia,
vaginites e incontinência urinária de esforço. Esse conjunto de sinais e sintomas
pode ser denominado de síndrome do climatério, síndrome menopausal ou moléstia
menopausal (SPEROFF; CLARKSON, 2003). As alterações ocorrem de forma
sistêmica e profunda, em vista da ampla distribuição dos receptores estrogênicos no
organismo (IMAMOV, 2005).
Somando-se à síndrome do climatério, o hipoestrogenismo promove o
aumento da incidência de doenças crônico degenerativas como diabetes melittus
(PEN-HUI, 2007), hipertensão arterial sistêmica (FULEIHAN; GHADA, 2008,
SCHWARZ, 2007; PEN-HUI, 2007), doenças cardiovasculares (PEN-HUI, 2007),
doença de Alzheimer, osteoporose (GARCIA-SEGURA; AZCOITIA; DONCARLOS,
2001, LORENZI, 2006;), comprometendo a qualidade de vida das mulheres (VAN
DER SCHOUW; GROBBEE, 2005; ZOLI, 2006). Dentre os mecanismos
desencadeados pelo hipoestrogenismo, na instalação dos sinais, sintomas e
complicações do climatério, está a geração de Espécies Reativas de Oxigênio
(ERO) e consequente Estresse Oxidativo (EO) (NILSEN, 2008).
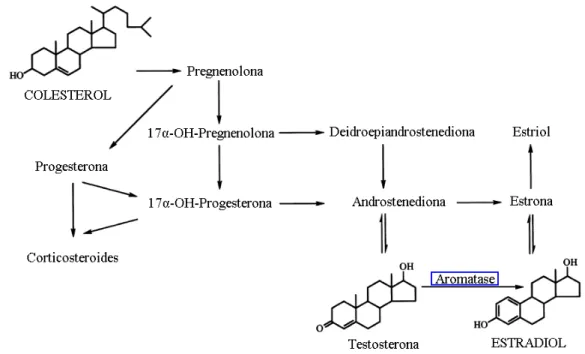
Os estrogênios são sintetizados principalmente nos ovários e
secundariamente no fígado e no tecido adiposo a partir de modificações enzimáticas
do colesterol, podendo se apresentar na forma de estrona, estriol e estradiol, sendo
este último o de maior potencial de ação. São produzidos a partir da oxidação do
colesterol a pregnenolona, posteriormente progesterona e os hormônios
anabolizantes (deidroepiandrostenediona, androstenediona e testosterona). Dentre
as enzimas envolvidas no processo, destaca-se a aromatase, responsável pela
formação do Estradiol (Figura 1) (ÖSTERLUND; HURD, 2001).
Figura 1 – Mecanismo da biossíntese do estradiol nos diferentes tecidos, em destaque a aromatase citocromo P450 19 (adaptado de ÖSTERLUND; HURD, 2001).
Os estrogênios, amplamente distribuídos e com inúmeros receptores em todo
organismo, influenciam vários processos fisiológicos nos mamíferos. Possuem
funções neuroendócrinas envolvidas no controle da ovulação, no desenvolvimento e
preparo cíclico do sistema reprodutor para a fertilização, implantação do óvulo, além
de várias características sexuais secundárias femininas (BRUCE et al., 2009). As
ações neuroendócrinas são dependentes das concentrações dos estrogênios no
sistema nervoso. Esses hormônios podem estar presentes no sistema nervoso
proveniente de três origens: transporte dos estrogênios, produzidos nos ovários,
pelo sangue, conversão da testosterona em estradiol nas células gliais e síntese
direta de estrogênios (GARCIA-SEGURA; AZCOITIA; DONCARLOS, 2001).
Nas mulheres em idade fértil, o transporte dos estrogênios pelo sangue até o
sistema nervoso merece destaque, sendo os outros dois mecanismos secundários a
essa via. Na pós-menopausa, ocorre uma deficiência desse hormônio em todo
organismo, visto que a via sanguínea participa de forma menos significativa,
sobretudo devido à falência ovariana (GARCIA-SEGURA; AZCOITIA; DONCARLOS,
2001). Assim, na senilidade, com a falência ovariana, resta à ação de células gliais
na síntese via conversão da testosterona em estradiol, a partir da reação catalisada
pela aromatase (ÖSTERLUND; HURD, 2001) e a síntese direta dos estrogênios.
(MELCANGI et al., 1999).
Em decorrência do hipoestrogenismo, as complicações da síndrome
climatérica associado ao aumento da expectativa de vida da mulher para 80 anos
nesse último século, fez com que o interesse científico pelo estrógeno e suas
funções no organismo aumentasse (NASSIF et al., 2004). O manejo da paciente
menopáusica representa tema de grande interesse na área clínica, epidemiológica e
de saúde pública (SPRITZER; WENDER, 2007). Estudos demográficos indicam que
em 1990 havia cerca de 467 milhões de mulheres com idade igual ou superior a 50
anos. Para o ano de 2030, a estimativa é que este grupo ultrapasse 1,2 bilhões de
mulheres (HUNTER, 1990).
A Terapia Hormonal (TH) representa o tratamento mais efetivo para o controle
dos sintomas decorrentes do climatério (SPRITZER; WENDER, 2007). Existem dois
tipos de TH: o tratamento exclusivo com estrógeno (TE) e combinado à
progesterona (P/ET) com finalidade de diminuir alguns dos efeitos colaterais do
estrógeno, como aumento das chances de câncer de endométrio (WASSMANN;
WASSMANN; NICKENIG, 2005). Comprovadamente a TH é eficiente contra
sintomas neurovegetativos, neuroendócrinos e urogenitais, além de diminuir a
incidência das doenças coronária isquêmica, osteoporose, doença de Alzheimer e
câncer colorretal (MARINHO, 2001).
Apesar dos benefícios da TH, foi descoberto que seu uso tem correlação
positiva com aumento da incidência de câncer de mama, útero e outros tipos de
câncer hormônio-dependente (SCAMBIA et al., 2000). Questionamentos acerca da
relação custo/benefício da TH levaram os pesquisadores a indicar maior cautela no
tratamento e a busca de alternativas ao seu uso (PALACIOS et al., 2003).
1.2 Exercício físico no combate aos sintomas do hipoestrogenismo
Uma alternativa coadjuvante no tratamento das complicações decorrentes do
hipoestrogenismo é a prática do exercício físico regular, conferindo à mulher
climatérica melhor qualidade de vida. Exercícios físicos regulares promovem maior
densidade mineral óssea, menores chances de doenças cardiovasculares, câncer de
colo do útero e eleva o potencial antioxidante do organismo (UEDA; TOKUNAGA,
2000; GALI, 2001; LAVOIRE, 2001; LANZILLOTTI, 2003; LATOUR; SHINODA;
WILDMAN et al., 2004).
O exercício físico regular proporciona múltiplos efeitos benéficos como:
antropométricos, neuromuscular, metabólico e psicológico, o que além de servir na
prevenção e tratamento de diversas situações clínicas, melhora significativamente a
qualidade de vida do indivíduo e sua independência (MATSUDO, 1992). Na
síndrome climatérica, o exercício físico regular é bastante indicado no combate às
consequências da pós-menopausa, principalmente a osteoporose e dislipidemias
(GREENDALE et al., 1998).
Um programa ideal de atividade física deve conter exercícios aeróbios de
baixo impacto, fortalecimento muscular e equilíbrio visando melhorar o padrão de
marcha e reflexos. Os exercícios aeróbios são aqueles que envolvem um grande
grupo muscular com movimentos repetitivos (caminhadas, natação, ciclismo,
hidroginástica), sem exigir o máximo do corpo e, por isso, os praticantes conseguem
mantê-los por longo período de tempo (SHEPHARD, 2003). O metabolismo do
oxigênio é estimulado proporcionalmente à intensidade do exercício físico,
demandando maior cuidado na prescrição dessa atividade em situações específicas
como o hipoestrogenismo. Um dos danos mais comuns provenientes da fosforilação
oxidativa é a geração de espécies reativas do oxigênio (HALLIWELL,
GUTTERIDGE, 2007).
O hipoestrogenismo favorece a produção de ERO que contribuem para a
condição de estresse oxidativo que vem sendo relacionado, a partir da década de
80, ao mecanismo de várias doenças como enfisema pulmonar, doenças
inflamatórias (THOMMASEN, 1985), aterosclerose (SPOSITO et al. 2007), câncer
(MARRET; THEIS; ASHBURY, 2000) e ao processo de envelhecimento
(SOUTHORN; POWIS, 1988).
1.3. Exercício físico, estresse oxidativo (EO) e defesa antioxidante.
As Espécies Reativas de Oxigênio, quando produzidas em grande
quantidade, podem acarretar uma condição de Estresse Oxidativo. Este termo
caracteriza a perda da capacidade de sinalização antioxidante e do controle do
equilíbrio redox gerando diversos danos a biomoléculas importantes (JONES, 2006).
A maioria das ERO apresenta elétrons desemparelhado em sua última camada, o
que confere a essas substâncias químicas um grande poder reativo. Os processos
oxidativos provenientes estão envolvidos em alterações orgânicas de relevância
clínica, danos moleculares como a peroxidação lipídica, oxidação de DNA e
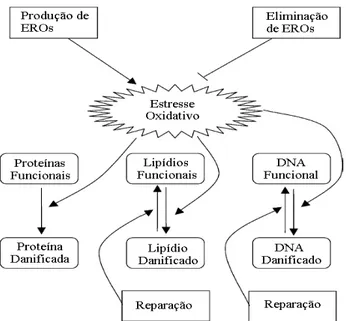
proteínas (Figura 2)(BOKOV; CHAUDHURI; RICHARDSON, 2004, HALLIWELL;
GUTTERIDGE, 2007).
Figura 2 – Representação esquemática de principais danos promovidos pelas EROs e os mecanismos de reparo existentes (adaptado de BOKOV, A., CHAUDHURI, A.; RICHARDSON, A, 2004).
Os efeitos biológicos das ERO são normalmente controladas in vivo por um
sistema de defesa antioxidante não enzimático composto por vitamina como A, C e
E que reagem de forma direta com as ERO, doando hidrogênio do componente
fenólico, e diminuindo o dano oxidativo. Além das vitaminas, há também a Glutationa
Reduzida (GSH) que funciona como co-fator para a Glutationa Peroxidase (GPx)
catalisar a eliminação o Peróxido de Hidrogênio (H2O2). Existe também o sistema de
defesa antioxidante enzimático composto pela Superóxido Dismutase (SOD),
Glutationa Redutase (GR), Catalase (CAT) e GPx, eliminando H2O2 (HALLIWELL,
GUTTERIDGE, 2007).
A GSH é um tripeptídeo (γ-L-glutamil-L-cisteinil-glicina) que está presente no
organismo sob duas formas, reduzida (GSH) e oxidada (GSSG), atuando direta ou
indiretamente em muitos processos biológicos importantes e proteção antioxidante e
funcionando como co-fator para a GPx (HALLIWELL, GUTTERIDGE, 2007). Assim,
um importante sistema de defesa enzimático contra o aumento de radicais livres,
envolve a enzima GPx, encontrada em muitos tecidos de origem animal.A atividade
da GPx é uma das formas do organismo controlar as concentrações de peróxido de
hidrogênio e hidroperóxidos lipídicos, oriundos do ataque de ERO (ROVER JUNIOR
et al., 2001).
A Glutationa Redutase (GR) atua no mesmo sistema antioxidante que a GPx.
Essa enzima não age diretamente na remoção de ERO, porém é responsável pela
regeneração da Glutationa à sua forma reduzida (GSH) na presença de
Nicotinamida Adenina Dinucleotídeo Fosfato (NADPH), tendo como objetivo impedir
a paralisação do ciclo metabólico da Glutationa (Figura 3). Assim, alguns trabalhos
tem sido desenvolvidos para determinação destas enzimas tanto em tecidos
celulares como no plasma sanguíneo (SOFFLER, 2007).
Figura 3 - Interconversão de Glutationa nas suas formas reduzida (GSH) e oxidada (GSSG) pela ação das enzimas Glutationa Peroxidase (GPx) e Glutationa Redutase (GR) ROVER JUNIOR et al., 2001).
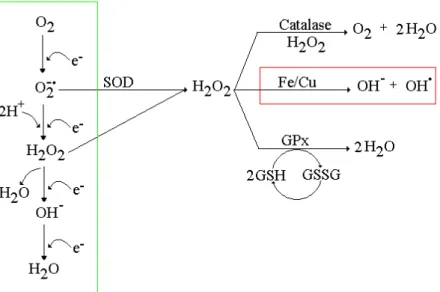
A origem do H2O2 formado é decorrente da ação da Superóxido Dismutase
(SOD), dependente de Cu2+ e Zn2+ como co-fatores, a qual promove a reação de
dismutação do radical superóxido (O2-●) em peróxido de hidrogênio e oxigênio,
(ROVER JUNIOR et al., 2001). A catalase atua de forma semelhante à GPx, sendo
responsável pela eliminação do peróxido de hidrogênio do meio (H2O2). A molécula
de H2O2 não é um radical livre, entretanto quando não sofre ação da Catalase e
GPx, essa ERO pode ser catalisada pelo Fe+2, na reação de Fenton, formando o
radical hidroxil altamente reativo (Figura 4)(GAETANI et al., 2008).
Figura 4 – Formação do O2●-, H2O2 e OH● e ação das enzimas antioxidantes SOD, Catalase e GPx no metabolismo do oxigênio na mitocôndria.
Além desses antioxidantes clássicos, estudos recentes demonstram um poder
antioxidante dos estrogênios, os quais não estão apenas relacionados à ligação a
receptores celulares e sim decorrentes de sua organização molecular. Esse grupo
de hormônios possui um componente fenólico capaz de doar hidrogênio, assim,
detoxificar radicais hidroxil altamente reativos, suprimindo o estresse oxidativo
gerado pelo ânion superóxido e peróxido de hidrogênio (BEHL, 2003). Os
estrogênios tem o potencial de promover elevação na expressão gênica de enzimas
antioxidantes, como a SOD (GOMES-CABRERA, DOMENECH, VIÑA, 2007).
A produção de ERO apresenta-se aumentada durante o exercício físico que
ocorre por diversos mecanismos como: ativação da via Xantina Oxidase (XO);
processos de isquemia e reperfusão; ativação de leucócitos, em particular os
neutrófilos; ativação da ciclooxigenase; ativação da enzima óxido nítrico sintase
(SACHDEV; DAVIS, 2008).
As Espécies Reativas do Oxigênio produzidas pela via da Xantina Oxidase
decorrem do consumo excessivo de Adenosina Trifosfato (ATP) na prática do
exercício intenso. Essa situação promove o bloqueio das bombas de ATP
dependentes de cálcio (Ca++), levando o aumento das concentrações intracelulares
desse metal. Essa elevação ativa a via da Xantina Oxidase (XO) através das
proteases dependentes de cálcio, que transformam a Xantina Desidrogenase (XD)
em Xantina Oxidase. A XO usa o oxigênio molecular (O2) como receptor de elétrons
ao invés do NAD+, promovendo, assim, a formação do ânion Superóxido (O2●-)
(Figura 5) (RADAK; CHUNG; GOTO, 2007).
Figura 5 – Geração do ânion superóxido via Xantina Oxidase (adaptado de SACHDEV; DAVIES, 2007).
A geração de ERO via isquemia e reperfusão ocorre em algumas situações,
patológica ou fisiológica como o exercício físico. A contração e relaxamento
muscular e a vasoconstricção nas vísceras, durante o exercício, promovem
situações de isquemia e reperfusão dos vasos. Assim, na isquemia se instala um
estresse redutivo e no retorno do aporte sanguíneo ocorre uma série de reduções
monoeletrônicas, as quais convertem o oxigênio molecular em ânion superóxido
(O2●-) (SACHDEV; DAVIS, 2008).
Os danos oxidativos resultantes do exercício físico irregular promovem a
ativação de leucócitos que podem estimular a produção de ERO para melhorar a
resposta ao dano induzido pelo exercício. Os neutrófilos podem reduzir o oxigênio
molecular, promovendo a geração O2●- via Nicotinamida Adenina Dinucleotídeo
Oxidase (NADPH Oxidase), a qual está inativa nas células em repouso (WARD;
TILL; JOHNSON, 1990).
Pode haver também a produção de ERO via ativação da fosfolipase A2 que
depende da elevação citoplasmática de cálcio. A fosfolipase A2 depois de ativada
promove a liberação do ácido araquidônico a partir dos fosfolipídios de membrana. O
ácido araquidônico sob ação da ciclooxigenase forma o radical hidroxil (OH●). Outro
mecanismo já esclarecido é decorrente da condição de hipóxia, a qual promove o
aumento da atividade da enzima óxido nítrico sintases (NOS), levando a formação
de radical óxido nítrico. Esse radical tem um pequeno poder oxidante, entretanto
combinado com o ânion superóxido pode formar um oxidante mais potente, o
peroxinitrito, e, posteriormente, o radical hidroxil.
O exercício físico regular tem a capacidade de fortalecer o sistema de defesa
antioxidante. Ji, Gomez-Cabrera e Vina (2004) propõem que a adaptação ao
exercício físico ocorre devido à produção de ERO que ativa a via do fator nuclear κB
(NF-κB), o qual promove uma cascata de eventos fisiológicos que aumenta a
expressão de enzimas antioxidantes, caracterizando a adaptação antioxidante.
Devido esses benefícios, o exercício físico regular vem sendo indicado para a
prevenção e tratamento de situações patológicas comuns no processo de
envelhecimento, fase da vida em que o organismo apresenta uma perda de sua
capacidade de combater Espécies Reativas do Oxigênio (BARNET; SPINKS, 2007;
FENSTER et al., 2002; GAGO-DOMINGUEZ; JIANG; CASTELAO, 2007; RADAK;
CHUNG; GOTO, 2007).
O exercício físico intenso tem um papel importante na elevação da produção
de ERO, podendo gerar em determinadas circunstâncias estresse oxidativo. Esse
fator associado ao hipoestrogenismo poderia gerar um efeito somatório, favorecendo
a instalação do estresse oxidativo e, assim, comprometendo a saúde da mulher,
sobretudo na pós-menopausa, fase que normalmente se prescreve a atividade física
como tratamento coadjuvante. Sendo assim, estudos que relacionem situações de
hipoestrogenismo, exercício físico e potencial antioxidante são de grande
importância para nortear os tratamentos referentes à pós-menopausa.
2. OBJETIVOS
2.1 Objetivo Geral
O presente trabalho tem por objetivo avaliar a influência do
hipoestrogenismo decorrente de ooforectomia na adaptação antioxidante em ratas
Wistar exercitadas regularmente.
2.2. Objetivos Específicos
• Avaliação da peroxidação lipídica através das concentrações das
Substâncias Reativas ao Ácido Tiobarbitúrico (SRAT) em plasma e homogenato de
fígado e cérebro.
• Determinação do conteúdo de GSH em sangue total e homogenato de
fígado e cérebro.
• Avaliação da atividade enzimática da SOD, Catalase e GPx em
hemolisado e homogenato de fígado e cérebro.
3 MATERIAIS E MÉTODOS
3.1 Animais
Foram utilizadas ratas da linhagem Wistar pesando entre 180 e 250g, as
quais foram mantidas no Biotério do Centro de Ciências da Saúde da Universidade
Federal do Rio Grande do Norte – UFRN, recebendo ração (Labina-Purina, São
Paulo, Brasil) e água ad libitum, com ciclo de claro/escuro de 12/12h e temperatura
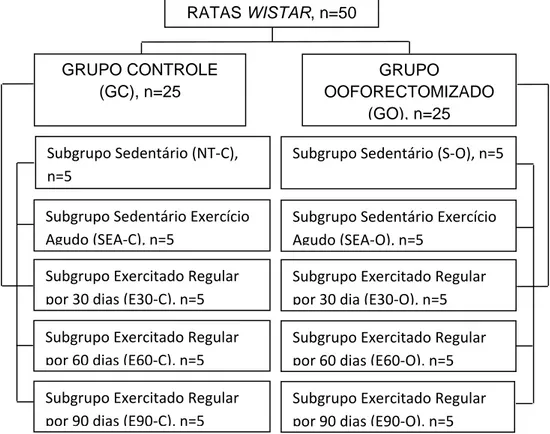
de 22 ± 2 ºC. Os animais (n=50) foram divididos em dois Grupos: Controle – GC
(n=25), Grupo Ooforectomizado – GO (n=25). Cada Grupo foi subdividido em cinco
Sub-Grupos: Sedentário – S (n=5), Sedentário Exercício Agudo – SEA (n=5),
Exercitado 30 dias – E30 (n=5), Exercitado 60 dias – E60 (n=5) e Exercitado 90 dias
– E90 (n=5). Esse trabalho foi aprovado pelo Comitê de Ética em Pesquisa do
Hospital Universitário Onofre Lopes (CEP-HUOL) com protocolo 016/07 (Anexo I).
FIGURA 6 – Organograma da distribuição dos Grupos (Controle e Ooforectomizado) e Subgrupos (Sedentário, Sedentário Exercício Agudo, Exercitados 30 dias, Exercitados 60 dias e Exercitados 90 dias).
RATAS WISTAR, n=50
GRUPO
OOFORECTOMIZADO (GO), n=25
Subgrupo Sedentário Exercício Agudo (SEA-C), n=5
Subgrupo Sedentário (NT-C), n=5
Subgrupo Exercitado Regular por 30 dias (E30-C), n=5
Subgrupo Exercitado Regular por 60 dias (E60-C), n=5
Subgrupo Exercitado Regular por 90 dias (E90-C), n=5
Subgrupo Sedentário Exercício
Agudo (SEA-O), n=5
Subgrupo Sedentário (S-O), n=5
Subgrupo Exercitado Regular por 30 dia (E30-O), n=5
Subgrupo Exercitado Regular por 60 dias (E60-O), n=5
Subgrupo Exercitado Regular por 90 dias (E90-O), n=5 GRUPO CONTROLE
(GC), n=25
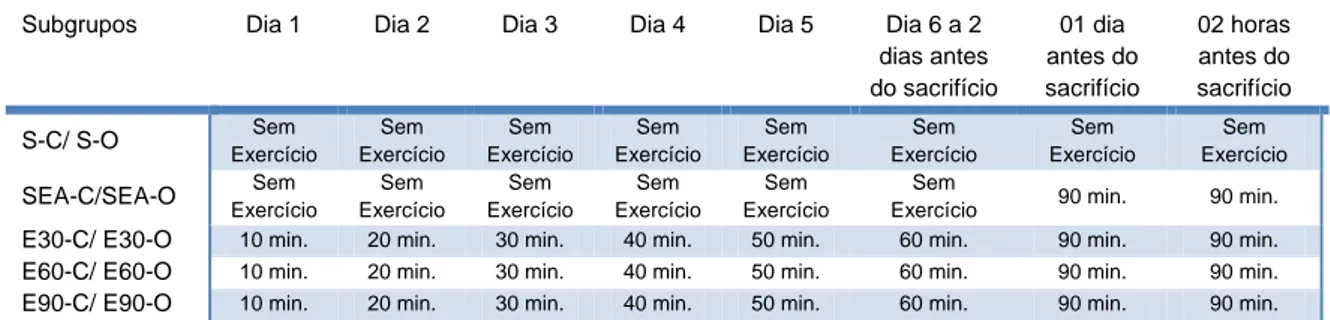
3.2 Protocolos de Exercícios
O modelo de exercício de escolha foi a natação forçada (GOBATTO et al.
2001; GÜNDÜZ et al 2004), baseado na colocação dos animais em recipiente com
água (100 x 200 de largura e comprimento e 50 cm de profundidade) e com
temperatura e tempo controlados. Inicialmente os animais foram submetidos a 10
minutos de exercício, sendo este tempo acrescido em 10 minutos diariamente até o
total de 60 minutos. Nos dias subsequentes, até antevéspera do sacrifício a natação
foi mantida por 60 minutos. Em dois momentos antes do sacrifício, na véspera e
duas horas antes, os animais dos subgrupos NTEA, E30, E60 e E90 foram
submetidos à carga de 90 minutos de exercício (Tabela 1).
Subgrupos Dia 1 Dia 2 Dia 3 Dia 4 Dia 5 Dia 6 a 2 dias antes do sacrifício 01 dia antes do sacrifício 02 horas antes do sacrifício S-C/ S-O Sem
Exercício Sem Exercício Sem Exercício Sem Exercício Sem Exercício Sem Exercício Sem Exercício Sem Exercício
SEA-C/SEA-O Sem
Exercício Sem Exercício Sem Exercício Sem Exercício Sem Exercício Sem
Exercício 90 min. 90 min.
E30-C/ E30-O 10 min. 20 min. 30 min. 40 min. 50 min. 60 min. 90 min. 90 min.
E60-C/ E60-O 10 min. 20 min. 30 min. 40 min. 50 min. 60 min. 90 min. 90 min.
E90-C/ E90-O 10 min. 20 min. 30 min. 40 min. 50 min. 60 min. 90 min. 90 min.
Tabela 1 – Protocolo de exercício atribuído a cada Subgrupo Sedentário Controle (S-C) e Sedentário Ooforectomizado (S-O); Sedentário Exercício Agudo Controle (SEA-C) e Sedentário Exercício Agudo Ooforectomizado (SEA-O); Exercitado 30 dias C) e Exercitado 30 dias Ooforectomizado (E30-O); Exercitado 60 dias Controle (E60-C) e Exercitado 60 dias Ooforectomizado (E60-(E30-O); Exercitado 90 dias Controle (E90-C) e Exercitado 90 dias Ooforectomizado (E90-O).
3.3 Modelo de Hipoestrogenismo
O modelo de escolha para a instalação do quadro de hipoestrogenismo foi a
ooforectomia. Todos os animais ficaram alocados em gaiolas próprias para ratos
(cinco ratas/gaiola) e receberam água e ração à vontade. Anestesiados com
Tiopental (45 mg/kg; i.p.), realizou-se laparotomia mediana de três centímetros de
extensão para a retirada dos ovários bilateralmente. O fechamento da parede
abdominal foi em dois planos, com pontos simples, utilizando fio de polipropileno
monofilamentar 5-0 para a aponeurose e mononáilon 4-0 para a pele. Esse
procedimento cirúrgico foi feito no Departamento de Cirurgia Experimental no Centro
de Ciências da Saúde da Universidade federal do Rio Grande do Norte
(CCS-UFRN).
3.4 Sacrifício dos Animais
Os animais foram anestesiados com tiopental sódico (Cristália, Brasil) (40
mg/kg de peso via i.p.), sendo em seguida submetidos à laparotomia para coleta de
cerca de 5 mL de sangue por punção cardíaca e posteriormente foram retirados o
fígado e cérebro para análise.
3.5 Preparo das Amostras
3.5.1 Sangue
Foram coletados 5 mL de sangue em tubo com anticoagulante (Ácido
Etilenodiamino Tetra-acético – EDTA 5%, Sigma E5134, PM = 372,24). 1mL da
amostra destinou-se a determinação do conteúdo de GSH. O restante (4 mL) foi
processado em centrifuga (Sigma Laborzentrifugen 2K15, Alemanha) a 604 x g
durante 10 minutos a 4ºC). O plasma obtido foi utilizado para a determinação das
Substâncias Reativas ao Ácido Tiobarbitúrico (SRAT) e os eritrócitos foram
destinados ao preparo do hemolisado para determinação da atividade enzimática
antioxidante.
3.5.2 Preparo do Hemolisado
As hemácias obtidas anteriormente foram lavadas com solução refrigerada
de tampão fosfato (Tampão: KH2PO4 Sigma P0662, PM = 136,09 / K2HPO4 Sigma
P0620, PM = 174,2) 0,05 M pH 7,0 e centrifugadas a 604 x g, durante 10 minutos, a
4ºC (Sigma Laborzentrifugen 2K15, Alemanha), desprezando-se, em seguida, o
sobrenadante. Esse procedimento foi repetido três vezes. Alíquotas de 0,1 mL foram
retiradas e hemolisadas com solução de β-mercaptoetanol 0,4 % (v/v) (sigma M6250, PM 78,13) por três ciclos de congelamento e descongelamento com
posterior armazenamento a -20 ºC para determinação da GPx, SOD. Sendo a
atividade da catalase determinada de imediato.
3.5.3 Homogenato de tecidos
Para o preparo do homogenato, após a remoção cirúrgica, os órgãos foram
pesados e, em seguida, homogeneizados (Homogeneizador tipo Potter-Elvehjem)
em solução tampão Fosfato (Tampão: KH2PO4 Sigma P0662, PM = 136,09 /
K2HPO4 Sigma P0620, PM = 174,2) 0,05M pH 7,0, na proporção de 1g do tecido
para 9mL do tampão em temperatura de 4 ºC durante 30 segundos. Os
homogenatos foram submetidos à centrifugação de 10.000 x g, 4ºC, por 4 minutos,
(IEC Multi RF – Thermo Electron Corporation®,USA) e as amostras obtidas utilizadas
para determinação dos biomarcadores de estresse oxidativo.
3.6. Determinação das Substâncias Reativas ao Ácido Tiobarbitúrico (SRAT)
A técnica fundamenta-se na determinação colorimétrica de produtos que
reagem com o Ácido Tiobarbitúrico (TBA), dentre elas o Malonildialdeido (MDA)
produzidos durante a peroxidação lipídica, conforme Figura 7 (YAGI, 1984):
Figura 7. Reação do TBA entre o ácido 2-tiobarbitúrico e o malonildialdeído, formando o composto colorido, medido espectrofotometricamente a 532 nm (OSAWA; FELICIO; GONÇALVES, 2005).
3.6.1 Plasma
A análise foi realizada em duplicata com cada microtubo contendo 300µL
plasma e 1,2 mL de solução com Ácido Tricloroacético (TCA, Sigma 116114, PM =
163,39) a 15% e TBA a 0,73%. Cada microtubo foi homogeneizado em vortex
durante 30 segundos, em seguida submetido a um banho de água fervente (100 ͦ C)
por uma hora e posterior banho de gelo por 20 minutos. Em seguida, os microtubos
foram centrifugados (Sigma Laborzentrifugen 2K15, Alemanha) a 16667 x g, a 4 ͦ C,
durante 10 minutos. Posteriormente, foi separado 1 mL do sobrenadante para leitura
espectrofotométrica, realizada a 535nm (Shimadzu UV-VISIBLE modelo 1650-PC,
Tokyo, Japão).
Para a preparação do branco, foi realizado o mesmo procedimento utilizado
para cada amostra, sendo adicionada água no lugar da amostra. A concentração de
SRAT foi expressa em µmol/L e calculada a partir da absorbância mensurada em
535 nm, utilizando-se coeficiente de extinção 0,156 µM-1.cm-1.
3.6.2 Tecidos (cérebro e fígado)
A técnica para a determinação das concentrações de SRAT, em tecidos
(cérebro e fígado), fundamenta-se na metodologia descrita por Yagi (1984) citada
anteriormente. Foram utilizados tubos contendo 1 mL do sobrenadante do
homogenato e 1 mL de Ácido Tricloroacético (TCA, Sigma 116114, PM = 163,39) a
15%. Cada tubo foi centrifugado (Sigma Laborzentrifugen 2K15, Alemanha) a 4.167
x g, a 4 °C, durante 4 min., homogeneizado em agitador tipo vortex durante 30
segundos, e, posteriormente, adicionou-se 1 mL de solução com Ácido
Tricloroacético (TCA, Sigma 116114, PM = 163,39) a 15% e TBA a 0,73%. Em
seguida, cada tubo foi submetido a um banho de água a 100°C durante uma hora,
banho de gelo por 20 minutos e centrifugação (Sigma Laborzentrifugen 2K15,
Alemanha) a 4.167 x g a 4°C durante 10 min. Logo após, 1 mL do sobrenadante foi
separado para a leitura (Shimadzu UV-VISIBLE modelo 1650-PC, Tokyo, Japão).
Para a preparação do branco, foi realizado o mesmo procedimento utilizado
para cada amostra, sendo substituída a amostra por água destilada. A concentração
de SRAT foi expressa em µmol/L e calculada a partir da absorbância mensurada em
535 nm, utilizando-se coeficiente de extinção 0,156 µM-1.cm-1.
3.7. Determinação do conteúdo de Glutationa Reduzida (GSH)
A Glutationa foi determinada em sangue total e homogenatos dos tecidos,
conforme metodologia descrita por BEUTLER et al. (1963) nos animais do grupo
controle e ooforectomizados. O método baseia-se na reação (figura 8) de redução
do ácido 5,5'-ditiobis-[2-nitrobenzoico] (DTNB) com a Glutationa (GSH), gerando o
ácido tio-2-nitrobenzoico (TNB) de cor amarela e estável sob refrigeração. As
leituras foram feitas a 412 nm (Shimadzu UV-VISIBLE modelo 1650-PC, Tokyo,
Japão).
Figura 8 - Reação entre GSH e DTNB formando o TNB de coloração amarela.
3.7.1 Sangue Total
Para a determinação da GSH, utilizou-se tubo contendo 0,2 mL de sangue
total e 800 µL de Ácido Tricloroacético (TCA, Sigma 116114, PM = 163,39) a 15%.
Cada tubo foi centrifugado (Sigma Laborzentrifugen 2K15, Alemanha) a 4.167 x g a
4°C durante 4 minutos, retirando-se, em seguida, 0,2 mL do sobrenadante que foi
adicionado em 2 mL de solução Tampão Fosfato (Tampão: KH2PO4 Sigma P0662,
PM = 136,09 / K2HPO4 Sigma P0620, PM = 174,2) 0,2M pH 8,0. Dessa mistura
transferiu-se 2 mL para cubeta e adicionou-se 0,2 mL de DTNB (ácido
ditiobisnitorbenzóico, sigma D8130, PM = 396,3) para posterior leitura. O branco foi
preparado sem o sangue ou homogenato, centrifugado (Shimadzu UV-VISIBLE
modelo 1650-PC, Tokyo, Japão) e submetido às mesmas condições da amostra
para posterior leitura (Shimadzu UV-VISIBLE modelo 1650-PC, Tokyo, Japão). A
concentração de GSH foi expressa em mmol/L e calculada a partir da absorbância
mensurada em 412 nm, utilizando-se coeficiente de extinção 14,1 µM-1.cm-1.
3.7.2 Tecidos (cérebro e fígado)
Para a determinação da GSH em tecidos (cérebro e fígado), utilizou-se tubo
contendo 1 mL do sobrenadante de homogenato e 1 mL de Ácido Tricloroacético
(TCA, Sigma 116114, PM = 163,39) a 15%. Cada tubo foi centrifugado a 4167 x g a
4°C durante 4 minutos, retirando-se, em seguida, 0,2 mL do sobrenadante que foi
adicionado em 2 mL de solução Tampão Fosfato (Tampão: KH2PO4 Sigma P0662,
PM = 136,09 / K2HPO4 Sigma P0620, PM = 174,2) 0,2M pH 8,0. Dessa mistura,
transferiu-se 2 mL para cubeta e adicionou-se 0,2 mL de DTNB para posterior
leitura. O branco foi preparado sem o sangue ou homogenato, centrifugado (Sigma
Laborzentrifugen 2K15, Alemanha) e submetido às mesmas condições da amostra
para posterior leitura (Shimadzu UV-VISIBLE modelo 1650-PC, Tokyo, Japão). A
concentração de GSH foi expressa em mmol/L e calculada a partir da absorbância
mensurada em 412 nm, utilizando-se coeficiente de extinção 14,1 µM-1.cm-1.
3.8 Determinação da atividade da Glutationa Peroxidase (E.C. 1.6.4.2)
A atividade da Glutationa Peroxidase (GPx) foi determinada pela técnica
descrita por SIES em 1979. O método baseia-se na medida do decréscimo de
absorbância promovido durante a oxidação do NADPH (Nicotinamida Adenina
Dinucleotídeo Fosfato reduzida, Sigma N1630, pureza 97%, PM = 833,4), medido a
340 nm, conforme mostrado na Figura 9 (ε = 6,22 mM-1. cm-1) (Shimadzu
UV-VISIBLE modelo 1650-PC, Tokyo, Japão).
Figura 9 – Reação utilizada para determinação da atividade da GPx que tem por base a medida do decréscimo de absorbância por oxidação do NADPH.
3.8.1 Intra-eritrocitária
Para a avaliação da atividade da enzima GPx, foi adicionado a cubeta 1 mL
do meio de reação, pipetado 10 μL do hemolisado (diluído 1/10 em solução do β
-mercaptoetanol) e 10 μL de solução de peróxido de t-butila (Sigma B2633, t-BuOOH,
PM = 90,12), posteriormente a leitura que foi feita por 5 minutos a 340nm e
temperatura de 30 °C. O branco foi obtido de forma semelhante, porém sem a
adição de 10 μL da amostra.
3.8.2 Tecido (cérebro e fígado)
Para a avaliação da atividade da enzima GPx nos tecidos, foi adicionado à
cubeta 1 mL do meio de reação, pipetado 10 μL do homogenato diluído 1/50 em
tampão (Tampão: KH2PO4 Sigma P0662, PM = 136,09 / K2HPO4 Sigma P0620, PM
= 174,2) 0,05M pH 7,0 e 10 μL de solução de peróxido de t-butila (Sigma B2633,
t-BuOOH, PM = 90,12), posteriormente a leitura que foi feita por 5 minutos a 340nm e
temperatura de 30 °C. O branco foi obtido de forma semelhante, porém sem a
adição de 10 μL da amostra.
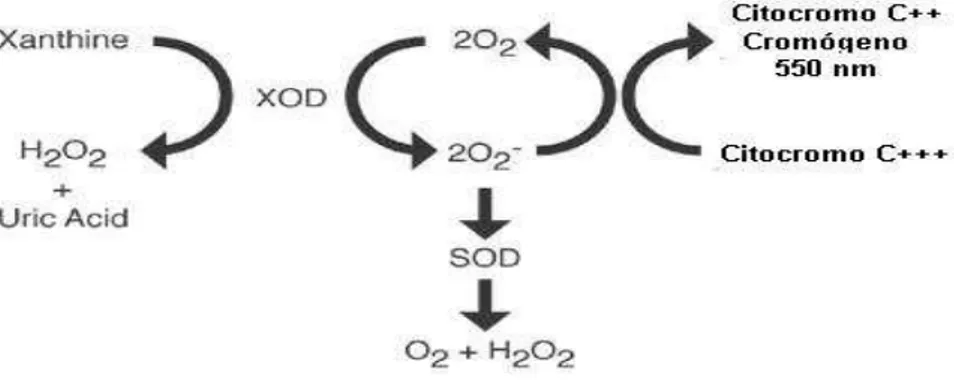
3.9 Determinação da atividade da Superóxido Dismutase (SOD) (E.C. 1.15.1.1)
A enzima superóxido dismutase (SOD) promove a captura do íon superóxido
e inibe a formação do Fe2+ pelo citocromo C (Sigma C7752, PM 12.384); o pico de
absorbância do complexo citocromo C – Fe2+ pode ser determinado a 550 nm, (ε =
21,0 x 103 M-1 cm-1), conforme Figura 10 (Shimadzu UV-VISIBLE modelo 1650-PC,
Tokyo, Japão) (McCORD, J.M.; FRIDOVICH, I., 1969).
Figura 10 – Reação utilizada para determinação da atividade da SOD que compete com o Citocromo C+++ pelo Ânion Superóxido (McCORD; FRIDOVICH, 1969).
3.9.1 Intra-eritrocitária e tecidos (cérebro e fígado)
Para a determinação da atividade da SOD intra-eritrocitária, foi centrifugado
(Sigma Laborzentrifugen 2K15, Alemanha) o hemolisado e homogenato a 4167 x g a
4°C durante 5 minutos, para posterior leitura. Inicialmente o zero de absorbância foi
ajustado com água destilada e, em seguida, feita a leitura do meio de reação
Xantina (Sigma X2502, PM 174,1)/Citocromo C (Sigma C7752, PM 12.384). O
branco desta reação tem que ser determinado antes da corrida da amostra através
de ensaios em que 1 ml do meio de reação adicionou-se quantidades crescentes de
xantina oxidase diluída, entre 20 a 40µL. O branco adotado foi aquele cujo delta de
absorbância apresentou-se entre 0,015 e 0,020. Após essa determinação foi feita a
leitura da amostra, adicionando na cubeta 1 ml de meio de reação, 20 a 40µL
xantina oxidase (Sigma X1875, EC 232.657.6) e 20µL da amostra (tabela 3).
3.10 Determinação da atividade da Catalase (CAT) (E.C. 1.11.1.6)
A catalase promove a decomposição de peróxido de hidrogênio a oxigênio e
água (Figura 11). A técnica empregada foi descrita por BEUTLER, em 1984, que
quantifica a velocidade de decomposição do peróxido pela enzima, através do
decréscimo da absorbância a 230 nm (ε = 0,071 mM-1.cm-1) (Shimadzu UV-VISIBLE
modelo 1650-PC, Tokyo, Japão).
Figura 11 – Ação da Catalase na eliminação do Peróxido de Hidrogênio (H2O2)
3.10.1 Intra-eritrocitária
Para avaliar a atividade da catalase foi utilizado 20 µL do hemolisado, o qual
foi acrescentado na cubeta de leitura, junto a 980 µL de um meio de reação
contendo Tris 1M (Tris Hidroxi-metil Aminometano, PM = 121,14) / EDTA
(Etilenodiamino Tetracético, Sigma E5134, PM = 372,24) (5 mM, pH 8,0), e peróxido
de hidrogênio a 50% (H2O2 10 mM), conforme tabela 4. Para a preparação do
branco, foi feito um pool do sobrenadante das amostras, do qual se retirou 20 µL que
foi colocado na cubeta de leitura, em um meio de reação contendo apenas Tris 1M
(Tris Hidroxi-metil Aminometano, PM = 121,14)/ EDTA (Etilenodiamino Tetracético,
Sigma E5134, PM = 372,24) (5 mM, pH 8,0). A atividade da catalase eritrocitária foi
expressa, respectivamente em U/mg de Hb.
3.10.2 Tecidos (cérebro e fígado)
Para avaliar a atividade da catalase no fígado, inicialmente homogenato foi diluído
em solução Tampão Fosfato (Tampão: KH2PO4 Sigma P0662, PM = 136,09 / K2HPO4
Sigma P0620, PM = 174,2) 0,05 M pH 7,0 (1/100). Quanto ao homogenato de cérebro,
não houve diluição. Em seguida, 20 µL dessas amostras foram acrescentado na cubeta de
leitura, junto a 980 µL de um meio de reação, contendo Tris 1M (Tris Hidroxi-metil
Aminometano, PM = 121,14)/ EDTA (Etilenodiamino Tetracético, Sigma E5134, PM
= 372,24) (5 mM, pH 8,0), e peróxido de hidrogênio a 50% (H2O2 10 mM). Para a
preparação do branco foi feito um pool do sobrenadante das amostras, do qual se retirou 20
µL que foi colocado na cubeta de leitura, em um meio de reação contendo apenas Tris 1M
(Tris Hidroxi-metil Aminometano, PM = 121,14)/ EDTA (Etilenodiamino Tetracético,
Sigma E5134, PM = 372,24) (5 mM, pH 8,0). A atividade da catalase nos tecidos foram
expressas em U/mg de proteína.
3.11 Análise Estatística
O tratamento estatístico foi feito através da Análise de Variância (ANOVA)
para amostras paramétricas e independentes, seguidas do teste de Tukey para
comparação de grupos independentes. Estes testes foram realizados através do
programa GraphPad InStat (Versão 3.05, 2000).
4 RESULTADOS
4.1 Avaliação da Peroxidação Lipídica
A peroxidação lipídica representa um importante mecanismo de dano celular
via ataque de ERO e os subprodutos formados são Substâncias Reativas ao Ácido
Tiobarbitúrico (SRAT). Analiticamente a quantificação das concentrações de SRAT
representa um importante marcador de dano oxidativo (THEROND, 2000).
A figura 12 mostra as concentrações de SRAT em plasma nos grupos
controle e ooforectomizados. Os animais submetidos ao exercício físico sem prévia
adaptação (SEA-C e SEA-O) apresentaram dano oxidativo superior aos seus
respectivos subgrupos, sedentários e exercitados; sendo este dano mais intenso nos
animais ooforectomizados (SEA-O). Os animais do grupo controle exercitados
regularmente, frente aos animais sedentários (E30-C, E60-C e E90-C vs. S),
apresentaram concentrações de SRAT inferiores nos primeiros dois meses, em
seguida alcançaram valores compatíveis no período de 90 dias. Já nos animais
ooforectomizados, dos subgrupos E30-O e E60-O ainda se mostravam com valores
superiores ao subgrupo sedentário, este compatível somente com E90-O.
Figura 12 – Efeito do exercício físico na concentração de SRAT no plasma dos grupos Controle (GC) e ooforectomizados (GO). Diferenças significativas: * p<0,05 vs. S, # p<0,05 vs. SEA, ○ p<0,05 vs.
E30, ● p<0,05 vs. E60 e a p<0,05 vs. o respectivo do GC. Os resultados foram submetidos à ANOVA
seguido do Teste de Tukey-Kramer para comparar grupos independentes.
GC
GO
0 25 50 75 100*
*
*
*
# # # ° • a a a a ## # Legenda
Sedentário - S
Sedentário exercício agudo - SEA Exercitados 30 dias - E30 Exercitados 60 dias - E60 Exercitados 90 dias - E90
S R AT ( µ m o l/ L)
Assim como no plasma, o fígado apresentou elevação significativa da
peroxidação lipídica nos subgrupos SEA-C e SEA-O representados na figura 13. Os
animais controle exercitados regularmente (E30-C, E60-C e E90-C) apresentaram
diminuição da peroxidação lipídica quando comparados ao subgrupo SEA-C e
semelhantes ao subgrupo S-C. Contudo, nos animais ooforectomizados a
diminuição ocorreu de forma significativa apenas no E90-0 quando comparado a
S-O. Além disso, todos os animais ooforectomizados exercitados regularmente (E30-0,
E60-O e E90-O) apresentaram peroxidação lipídica significativamente maior que os
respectivos do grupo controle.
Figura 13 – Efeito do exercício físico na concentração de SRAT em fígado nos Grupos Controle (GC) e Ooforectomizados (GO). Diferenças significativas: * p<0,05 vs. S, # p<0,05 vs. SEA, ○ p<0,05 vs. E30 e a p<0,05 vs. o respectivo do GC. Os resultados foram submetidos à ANOVA seguido do Teste de Tukey-Kramer para comparar grupos independentes.
GC GO
0 20 40 60 80 100
*
# # #
*
*
# # #°a a a
a
*
Legenda
Sedentário - S
Sedentário exercício agudo - SEA Exercitados 30 dias - E30 Exercitados 60 dias - E60 Exercitados 90 dias - E90
S
R
AT
(µ
m
o
l/
L)
Quanto ao perfil de lipoperoxidação no cérebro (figura 14), o grupo controle
não apresentou variação entre seus subgrupos. Porém, os animais
ooforectomizados e exercitados sem prévia adaptação (SEA-O) apresentaram
concentração de SRAT superiores a todos os demais grupos, ooforectomizados ou
controle.
Figura 14 – Efeito do exercício físico na concentração de SRAT em cérebro nos Grupos Controle (GC) e Ooforectomizados (GO). Diferenças significativas: * p<0,05 vs. S, # p<0,05 vs. SEA e a p<0,05 vs. o respectivo do GC. Os resultados foram submetidos à ANOVA seguido do Teste de Tukey-Kramer para comparar grupos independentes.
GC GO
0 20 40 60 80 100
*
# #
# a
Legenda
Sedentário - S
Sedentário exercício agudo - SEA Exercitados 30 dias - E30 Exercitados 60 dias - E60 Exercitados 90 dias - E90
S
R
AT
(µ
m
o
l/
L)
4.2 Biomarcadores antioxidantes
4.2.1. Glutationa Reduzida (GSH)
A Glutationa Reduzida (GSH) é um tripeptídeo (L-γ-glutamil-L-cisteinil-glicina)
implicado em inúmeras funções biológicas, destacando-se sua ação antioxidante. O
GSH é co-fator da Glutationa Peroxidase (GPx), funcionando como doador de H+
para estabilização de ERO e sendo oxidada no processo (GSSG). Sua depleção em
sistemas biológicos associa-se à elevação de agentes oxidantes no meio
(THEROND, 2000).
O conteúdo sérico de GSH nos subgrupos SEA-C e SEA-O se apresentaram
diminuídos quando comparados aos subgrupos S-C e S-O (figura 15),
respectivamente. No grupo controle, a atividade física regular (E30-C, E60-C e
E90-C) provocou inicialmente queda no conteúdo de GSH, só retornando aos valores
semelhantes ao subgrupo S-C com 90 dias de exercício regular. Os animais
ooforectomizados e exercitados regularmente (E30-O, E60-O e E90-O) em
comparação ao subgrupo SEA-O, não apresentaram decréscimo no conteúdo
sanguíneo de GSH no decorrer do protocolo experimental.
Figura 15 – Efeito do exercício físico no conteúdo de GSH no sangue total nos grupos controle (GC) e ooforectomizados (GO). Diferenças significativas: * p<0,05 vs. S, # p<0,05 vs. SEA, ○ p<0,05 vs. E30,
● p<0,05 vs. E60 e a p<0,05 vs. o respectivo do GC. Os resultados foram submetidos à ANOVA
seguido do Teste de Tukey-Kramer para comparar grupos independentes.
GC GO 0.0 0.5 1.0 1.5 2.0 # a a
* * *
° •*
## # Legenda
Sedentário - S
Sedentário exercício agudo - SEA Exercitados 30 dias - E30 Exercitados 60 dias - E60 Exercitados 90 dias - E90
G S H ( m m o l/L )
Assim como o resultado observado no conteúdo plasmático de GSH (figura
15), o exercício físico intenso sem prévia adaptação provocou em diminuição no
conteúdo de GSH hepático em ambos os subgrupos (SEA-C e SEA-O) (figura 16).
No entanto, o grupo controle apresentou melhora significativa com treinamento
regular (E30-C, E60-C e E90-C), mas não chegando a superar os valores do
subgrupo sedentário. Os valores de GSH nos subgrupos ooforectomizados foram
menores do que seus respectivos do grupo controle, exceto o subgrupo SEA-O.
Como também, a manutenção do conteúdo hepático de GSH pelo exercício físico,
este benefício só se mostrou evidente a partir de 60 dias de protocolo (E60-O e
E90-O).
Figura 16 – Efeito do exercício físico no conteúdo de GSH em fígado nos Grupos Controle (GC) e Ooforectomizados (GO). Diferenças significativas: * p<0,05 vs. S, # p<0,05 vs. SEA, e a p<0,05 vs. o respectivo do GC. Os resultados foram submetidos à ANOVA seguido do Teste de Tukey-Kramer para comparar grupos independentes.
GC GO
0 2 4 6 8 10
*
*
# #
#
# #
a a
a a
Legenda
Sedentário - S
Sedentário exercício agudo - SEA Exercitados 30 dias - E30
Exercitados 60 dias - E60 Exercitados 90 dias - E90
G
S
H
(
mmo
l/
L
)
Quanto ao conteúdo de GSH no cérebro (figura 17) dos animais controle, a
atividade física provocou sua elevação tanto nos animais sedentários exercitados
agudamente (SEA-C) quanto nos exercitados regularmente por pelo menos 60 dias
(E30-C e E60-C). Somente após 90 dias de atividade física (E90-C) houve regressão
do conteúdo de GSH, ficando semelhantes ao subgrupo S-C. Os animais
ooforectomizados não apresentaram diferenças significativas entre seus subgrupos,
entretanto os animais dos subgrupos SEA-O, E30-O e E60-O apresentaram
diminuição significativa quando comparados aos respectivos grupos controle.
Figura 17 – Efeito do exercício físico no conteúdo de GSH em cérebro nos Grupos Controle (GC) e Ooforectomizados (GO). Diferenças significativas: * p<0,05 vs. S, # p<0,05 vs. SEA, ○ p<0,05 vs. E30 e a p<0,05 vs. o respectivo do GC. Os resultados foram submetidos à ANOVA seguido do Teste de Tukey-Kramer para comparar grupos independentes.
GC GO
0.0 0.5 1.0 1.5 2.0 2.5 3.0
#° #°
*
*
*
a a
a Legenda
Sedentário - S
Sedentário exercicio agudo - SEA Exercitados 30 dias - E30 Exercitados 60 dias - E60 Exercitados 90 dias - E90
G
S
H
(
mmo
l/
L
)