Síntese e caracterização de complexos de Base
de Schiff com níquel (II) ancorados no
material mesoporoso SBA-15
Danielle de Oliveira Maia
____________________________________________
Tese de Doutorado
Natal/RN, julho de 2015
CENTRO DE CIÊNCIAS EXATAS E DA TERRA
INSTITUTO DE QUÍMICA
Danielle de Oliveira Maia
SÍNTESE E CARACTERIZAÇÃO DE COMPLEXOS DE BASE DE SCHIFF COM NÍ-QUEL (II) ANCORADOS NO MATERIAL MESOPOROSO SBA-15
Tese apresentada ao Programa de Pós Gradua-ção em Química da Universidade Federal do Rio Grande do Norte, como parte dos requisi-tos para obtenção do Título de Doutor em Química.
Orientador: Prof. Dr.Antonio Souza de Araujo Co-orientador: Prof. Dr. Francisco das C. D. de Lemos
Divisão de Serviços Técnicos
Catalogação da Publicação na Fonte. UFRN Biblioteca Setorial do Instituto de Química
Maia, Danielle de Oliveira.
Síntese e caracterização de complexos de base de schiff com níquel (ii) ancorados no material mesoporoso – SBA-15 / Danielle de Oliveira Maia. – Natal, RN, 2015.
91 f. : il.
Orientador: Antonio Souza de Araujo.
Co-orientador: Francisco das Chagas Dantas de Lemos.
Tese (Doutorado em Química) - Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Programa de Pós-Graduação em Química.
1. SBA-15 – Tese 2. Base de Schiff – Tese. 3. Materiais Mesoporosos – Tese. 4. Termogravimetria – Tese. 5. DRX – Tese. I. Araujo, Antonio Souza de. II. Lemos, Francisco das Chagas Dantas de. III. Universidade Federal do Rio Grande do Norte. IV. Título.
AGRADECIMENTOS
A Deus por ter me concedido a oportunidade em executar esse trabalho.
A minha família que sempre me apoiou e incentivou aos estudos.
Ao Prof. Dr. Antonio Souza de Araujo pela formação profissional, ensinamentos,
ami-zade e também oportunidade dada para que eu pudesse crescer um pouco mais.
A Prof. Dra. Ana Paula de Melo Alves Guedes pelos ensinamentos, formação,
paciên-cia e amizade.
A Prof. Dra. Amanda Duarte Gondim pelos ensinamentos, formação, paciência e
ami-zade.
Ao Prof. Dr. Francisco Chagas Dantas de Lemos pela amizade, paciência,
ensinamen-tos.
Ao Prof. Dr. Edward Ralph Dockal pela receptividade, amizade, ensinamento,
paciên-cia, formação profissional.
Aos integrantes da família LCP, Andresa, Marcela, Aruzza, Ana Ellen, Aneliése,
Leo-nardo, Luana, Taisa, Lidiane, João Paulo, Gabriela, Márcia, Larissa, Regineide, Alyxandra,
Ellen Kadja, César, Tatiane e Helson pela receptividade, amizade, incentivo, os cafezinhos da
tarde e convivência.
As amigas Roseane e Roberta pela amizade e paciência.
A Pós Graduação em Química, Severino Higino, Ana Alice, Cristóvam e a Prof.
Sibe-le Pergher.
Aos membros do Laboratório de Inorgânica e Catálise pela receptividade,
ensinamen-tos e paciência.
Ao amigo Franciel pelas análises de CHN;
A professora Kátia Bernardo Gusmão, do Rio Grande do Sul pela análise de adsorção
e dessorção de N2.
“Não se deve ir atrás de objetos fáceis. É preciso buscar o que só pode ir através de
maiores esforços”.
RESUMO
SBA-15 são materiais mesoporosos, que possuem uma rede de canais e poros de ta-manho bem definido na escala nanométrica, além de outras características, tais como, elevada estabilidade térmica e área superficial. Essa arquitetura particular de poros torna esses materi-ais promissores na área de ancoramento de uma variedade de compostos na matriz da sílica resultando em aplicações nas diversas áreas, dentre elas, na catálise. Nesse trabalho, foram sintetizados complexos de Base de Schiff com níquel (II) para serem ancorados na SBA-15 funcionalizada com 3-cloropropiltrimetóxisilano realizando um estudo da estabilidade térmica desses compostos. Após a síntese dos complexos, estes foram caracterizados por análise ele-mentar (CHN), ponto de fusão, condutividade, susceptibilidade magnética, espectroscopia de absorção na região do UV-visível, espectroscopia de absorção na região do infravermelho e análises térmicas (TG/DTG). A análise elementar sugere que os complexos apresentam as seguintes fórmulas químicas gerais: [Ni(C18H19N3O2)].2CH3COO.H2O, [Ni(C20H23N3O2)(2Cl)].2H2O, [Ni(C19H20N3O2)(2Cl)].3H2O, sendo L1= C18H19N3O2, L2= C20H23N3O2, L3 = C19H20N3O2. Na espectroscopia de absorção na região do UV – visível e infravermelho dos complexos foi evidenciada a coordenação metal – ligante. Após caracteri-zação dos complexos, confirmando a coordenação metal – ligante, estes foram ancorados no material mesoporoso. A caracterização desses materiais foi realizada por difração de raios - X, fluorescência de raios – X, adsorção e dessorção de N2, espectroscopia de absorção na região do infravermelho e análises térmicas (TG/DTG). No DRX foram observados três picos prin-cipais de difração, cujos índices de Miller são (100), (110) e (200), mostrando que mesmo após a ancoragem, os materiais mesoporosos não perderam suas características estruturais. As porcentagens dos elementos (níquel, cloro e sílica) encontrados nos materiais através da análi-se de fluorescência de raios – x mostraram que os complexos foram ancorados nos poros da sílica. Através da adsorção e dessorção de N2, foram observadas que os materiais apresenta-ram isoterma do tipo IV e histerese do tipo H1 característicos dos materiais mesoporos. Na espectroscopia de absorção na região do infravermelho, os materiais ancorados apresentaram bandas características dos ligantes (Base de Schiff) e da sílica evidenciando o sucesso da an-coragem. Na análise térmica, foram observadas a decomposição de água adsorvida, água co-ordenada, aminas, aromáticos, ligantes, cloropropiltrimetóxisilano e também um aumento na estabilidade térmica (eliminação dos ligantes) das sílicas ancoradas [Ni(L1)]SBA-15, [Ni(L2)]SBA-15 e Ni(L3)]SBA-15 quando comparado aos complexos livres, evidenciando o sucesso da ancoragem dos complexos na peneira molecular.
ABSTRACT
SBA-15 are mesoporous materials, having a network of channels and well defined pore size in the nanometer range, as well as, other features such as high thermal stability and surface area. This particular pore architecture makes these promising materials in the anchor-ing area of a variety of compounds in the silica matrix resultanchor-ing in applications in various fields, among them, in catalysis. In this work, complexes were synthesized Schiff base with nickel (II) to be anchored in the functionalized SBA-15 3 – chloropropyltrimethoxysilane and a study of the thermal stability of these compounds. After synthesis of the complexes, they were characterized by elemental analysis (CHN), melting point, conductivity, magnetic sus-ceptibility, absorption spectroscopy in the UV-visible region absorption, spectroscopy in the infrared region and thermal analysis (TG/DTG). Elemental analysis suggests that the comple-xes have the general formula chemical: [Ni(C18H19N3O2)].2CH3COO.H2O, [Ni(C20H23N3O2)(2Cl)].2H2O, [Ni(C19H20N3O2)(2Cl)].3H2O, and L1= C18H19N3O2, L2= C20H23N3O2, L3 = C19H20N3O2. In absorption spectroscopy in UV - visible and infrared com-plexes was evidenced the coordination metal - ligand. After characterization of the complex-es, confirming the metal - ligand coordination, they have been anchored in the mesoporous material. The characterization of these materials were made by x- ray diffraction, x- ray fluo-rescence, N2 adsorption and desorption spectroscopy, the infrared spectroscopy and thermal analysis (TG/DTG). XRD analysis revealed three main diffraction peaks, whose Miller indi-ces are (100), (110) and (200), showing that even after the anchoring, the mesoporous materi-als do not lose their structural characteristics.The percentages of the elements (nickel chloride and silica) found in the anchored materials through the x-ray fluorescence analysis showed that the complexes were anchored in the pores of the silica. Through adsorption and desorp-tion of N2, we observed that the materials presented isotherm type IV and type H1 hysteresis characteristic of mesoporous materials. In the infrared spectroscopy, the materials showed characteristic bands of ligands (Schiff base) and silica demonstrating the success of the an-chor. In the thermal analysis (TG/DTG), there were observed the decomposition of adsorbed water, coordinated water, amines, aromatics, ligands, chloropropyltrimethoxysilane and an increase in thermal stability (removal of ligand) of silicas anchored [Ni(L1)]SBA-15, [Ni(L2)SBA-15 and [Ni(L3)SBA-15 compared of free complexes, showing successful an-choring of complex molecular sieve.
Keywords: SBA-15 .Schiff Base .Mesoporous Materials.Thermogravimetry . XRD.
LISTA DE FIGURAS
Figura 1- Estrutura do ligante porfirina (a), ftalocianinas (b) e a Base de
Schiff - salen (c)... 20
Figura 2 - Formação da imina ou Base de Schiff... 21
Figura 3 - Estrutura do ligante L1(a), L2 (b) e L3 (c)... 22
Figura 4 - Série espectroquímica ... 24
Figura 5 - Exemplos de zeólitas... 25
Figura 6 - SBA-15 (mesoporos interligados por microporos)... 27
Figura 7 - Esquema estrutural do copolímero tribloco... 28
Figura 8 - Esquema representativo da estrutura da SBA-15 antes e após a cal-cinação... 28
Figura 9 - Funcionalização e ancoragem dos complexos de Base de Schiff com Mn (II) ... 29
Figura 10- Fluxograma da síntese da SBA-15... 31
Figura 11- Mecanismo de formação do material mesoporoso... 32
Figura 12- Fluxograma da funcionalização da SBA-15 com 3– cloropropiltrimetóxisilano... 33
Figura 13- Esquema da funcionalização da SBA-15 com 3–cloropropil- trimetóxisilano (3CPTMS)... 33
Figura 14 - Fluxograma da síntese dos ligantes... 34
Figura 15 - Bases de Schiff – L1, L2 e L3... 35
Figura 16 - Fluxograma da síntese do complexo [Ni(L1)] em clorofórmio... 36
Figura 17 - Fluxograma da síntese do complexo [Ni(L2)] em clorofórmio... 37
Figura 18 - Fluxograma da síntese do complexo [Ni(L3)] em metanol... 38
Figura 19 - Fluxograma da síntese da sílica ancorada com os complexos... 40
Figura 20 - Reação de ancoragem dos complexos na SBA-15... 40
Figura 21 - Ancoragem dos complexos [Ni(L1)] (1), [Ni(L2)] (2) e [Ni(L3)] (3) no material mesoporoso... 41
Figura 22 - Estrutura dos complexos (a) [Ni(L1)], (b) [Ni(L2)] e (c) [Ni(L3)].... 49
Figura 24 - Espectro de absorção na região do UV-visível do ligante L2 em
acetonitrila. Espectro do ligante ampliado na região de 315 a 520
nm (parte superior)... 52
Figura 25 - Espectro de absorção na região do UV-visível do ligante L3 em acetonitrila. Espectro do ligante ampliado na região de 300 a 520 nm (parte superior)... 53
Figura 26 - Espectro de absorção na região do UV-visível do ligante L1 DMSO... 54
Figura 27- Espectro de absorção na região do UV-visível do L2 em DMSO... 55
Figura 28 - Espectro de absorção na região do UV-visível do L3 em DMSO... 55
Figura 29 - Espectro de absorção na região do UV-visível do complexo [Ni(L1)] na concentração 1×10-3 mol L-1 em DMSO(a). Espectro ampliado na região de 550 nm a 1100 nm concentração de 1×10-2 mol L-1 ( b)... 57
Figura 30 - Espectro de absorção na região do UV-visível do complexo [Ni(L2)] na concentração 1×10-3mol L-1 em DMSO (a). Espectro ampliado concentração 1×10-2 mol L-1 na região de 470 a 1100 nm (b)... 58
Figura 31 - Espectro de absorção na região do UV-visível do complexo [Ni(L3)] na concentração 1×10-3 mol L-1 em DMSO (a). Espectro ampliado na região de 570 a 1100 nm com concentração de 1×10-2 mol L-1 (b)... 58
Figura 32 - Sobreposição dos espectros de absorção na região do infravermelho do ligante L1 e complexo [Ni(L1)] em pastilha de KBr... 61
Figura 33 - Sobreposição dos espectros de absorção na região do infravermelho do ligante L2 e complexo [Ni(L2)] em pastilha de KBr... 61
Figura 34 - Sobreposição dos espectros de absorção na região do infravermelho do ligante L3 e complexo [Ni(L3)] em pastilha de KBr... 62
Figura 35 - Espectros de infravermelho: (a) SBA-15, (b) SBA-15-Cl, (c) [Ni(L1)], d) [Ni(L1)]SBA- 15, (e) [Ni(L2)] (f) [Ni(L2)]SBA-15, (g) [Ni(L3)], (h) [Ni(L3)] SBA-15 em pastilha de KBr... 67
Figura 36 - Difratograma de raios – X (a) SBA-15, (b) SBA-15-Cl, (c) [Ni(L1)] SBA- 15, (d) [Ni(L2)]SBA-15, (e) [Ni(L3)]SBA-15... 67
[Ni(L1)] SBA-15, d) [Ni(L2)] SBA-15 e e) [Ni(L3)] SBA-15... 69
Figura 38 - Curvas termogravimétricas (TG/ DTG) dos complexos: [Ni(L1)], [Ni(L2)] e Ni(L3)]... 71
Figura 39 - Curvas termogravimétricas (TG/ DTG) da SBA-15, SBA-15-Cl, [Ni(L1)], [Ni(L2)] e Ni(L3)]SBA-15... 73
Figura 40 - Decomposição do [Ni(L1)] SBA-15... 75
Figura 41 - Decomposição do [Ni(L2)] SBA-15... 75
Figura 42 - Decomposição do [Ni(L3)] SBA-15... 76
LISTA DE TABELAS
Tabela 1 - Materiais utilizados nas sínteses de complexos e ancoragem... 30
Tabela 2 - Ligantes utilizados nas sínteses... 34
Tabela 3 - Complexos sintetizados... 38
Tabela 4 - Solubilidade dos complexos... 39
Tabela 5 - Dados de porcentagens de carbono, hidrogênio e nitrogênio nos com-plexos... 48
Tabela 6 - Valores de Ponto de Fusão dos complexos... 50
Tabela 7 - Condutividade e tipo de eletrólito dos complexos... 50
Tabela 8 - Dados de susceptibilidade magnética dos complexos... 51
Tabela 9 - Atribuições das bandas do UV-visível dos ligantes em acetonitri-la...,... 53
Tabela 10 - Atribuições das bandas de UV-visível dos ligantes em DMSO...56
Tabela 11 - Atribuições das bandas de UV-visível dos complexos em DMSO... 59
Tabela 12 - Atribuições das bandas de infravermelho dos ligantes e complexos... 63
Tabela 13 - Atribuições das bandas de infravermelho dos compostos... 65
Tabela 14 - Porcentagem de elementos nos compostos... 68
Tabela 15 - Propriedades texturais da SBA-15, SBA-15-Cl e SBA-15 ancorada com complexos... 70
LISTA DE SIGLAS
ALPOS’s - Aluminofosfatos – peneira molecular microporosa BET - Braumer – Ermmer-Teller
CHN - (Análise elementar de carbono, hidrogênio e nitrogênio)
3-CPTMS 3-cloropropiltrimetóxisilano
DMSO Dimetilsulfóxido
Dp - Diâmetro de poro
DRX - Difração de raios - x
DTG - Derivatie thermogravimetry – termogravimetria derivada
FRX - Fluorescência de raios – x
FTIR - Fourier transform infrared spectroscopy – espectroscopia de infravermelho
com Transformada de Fourier
IUPAC - International Union of Pure and Applied Chemistry – União Internacional
de Química Pura e Aplicada
L1 - Base de Schiff (utilizando a triamina: dietilenotriamina)
L2 - Base de Schiff (utilizando a triamina: 3’3 iminobispropilamina)
L3 - Base de Schiff (utilizando a triamina: 2-aminoetil-1,3-propanodiamina)
M41S - Família de materiais mesoporosos desenvolvido pela Mobil Corporation.
MCM-41 - Material mesoporoso (composição da matéria n° 41) desenvolvido pela
Mobil Corporation.
MCM-48 - Material mesoporoso (composição da matéria n° 48) desenvolvido pela
Mobil Corporation
Nay - Tipo de zeólita
P123 - Copolímero tribloco: poli-(oxido propileno)-poli-(oxido etileno)
SAPO’S - silicoaluminofosfatos – peneira molecular microporosa
SBA-15 - Santa Bárbara – Amorphous – material mesoporoso sintetizado por
pesqui-sadores da Califórnia
SUMÁRIO
1 INTRODUÇÃO... 15
2 OBJETIVOS... 17
2.1 OBJETIVOS ESPECÍFICOS... 17
3 FUNDAMENTAÇÃO TEÓRICA... 18
3.1 MATERIAIS HÍBRIDOS INORGÂNICO – ORGÂNICO... 18
3.1.1 Funcionalização da sílica gel... 19
3.2 COMPOSTOS NITROGENADOS (BASE DE SCHIFF... 20
3.3 O ÍON NÍQUEL (II)... 22
3.4 SÓLIDOS POROSOS E PENEIRAS MOLECULARES... 24
3.5 ANCORAGEM DOS COMPLEXOS EM PENEIRAS MOLECULA-RES... 28
4 MATERIAIS E MÉTODOS... 30
4.1 SÍNTESE DA PENEIRA MOLECULAR SBA-15... 31
4.1.1 Ativação do grupo silanol (Si-OH)... 32
4.1.2 Funcionalização da SBA-15 com 3–cloropropiltrimetóxisilano... 32
4.2 SÍNTESE DOS LIGANTES... 34
4.3 SÍNTESE DOS COMPLEXOS... 35
4.3.1 Síntese dos complexos em clorofórmio... 35
4.3.2 Síntese do complexo em metanol... 37
4.3.3 Solubilidade dos complexos... 39
4.4 ANCORAGEM DOS COMPLEXOS NA SBA-15... 39
4.5 CARACTERIZAÇÃO DOS MATERIAIS... 41
4.5.1 Análise Elementar (CHN)... 42
4.5.2 Ponto de Fusão... 42
4.5.3 Condutividade... 42
4.5.4 Susceptibilidade magnética... 43
4.5.5 Espectroscopia de absorção na região do ultravioleta-visível... 43
4.5.6 Espectroscopia de absorção na região do infravermelho... 44
4.5.7 Difratometria de raios – x... 45
4.5.8 Fluorescência de raios – x... 45
4.5.10 Termogravimetria/Termogravimetria Derivada... 47
5 RESULTADOS E DISCUSSÃO... 48
5.1 CARACTERIZAÇÃO DOS COMPLEXOS... 48
5.1.1 Análise Elementar... 48
5.1.2 Ponto de fusão... 50
5.1.3 Condutividade... 50
5.1.4 Susceptibilidade magnética... 50
5.1.5 Espectroscopia de absorção na região do UV- visível dos ligantes em acetonitrila... 51
5.1.6 Espectroscopia de absorção na região do UV visível dos ligantes em DMSO... 53
5.1.7 Espectroscopia de absorção na região do UV- visível dos complexos em DMSO... 56
5.1.8 Análise geral dos valores de absorção encontrados para os ligantes e complexos na região do UV- visível... 59
5.1.9 Espectroscopia de absorção na região do infravermelho dos ligantes e complexos... 59
5.1.10 Espectroscopia de absorção na região do infravermelho dos ligantes, complexos e complexos ancorados na sílica... 63
5.1.11 Difração de raios – x... 66
5.1.12 Fluorescência de raios – x... 67
5.1.13 Adsorção e dessorção de N2... 68
5.1.14 Análise Termogravimétrica TG/DTG... 70
6 CONCLUSÃO... 77
PROPOSTA PARA TRABALHOS FUTUROS... 79
1 INTRODUÇÃO
Nas últimas décadas diversos trabalhos foram dedicados ao estudo de zeólitas e
peneiras moleculares. A SBA-15 (Santa Barbara Amorphous) sintetizada na década de 90
na Universidade de Santa Bárbara na Califórnia é uma peneira molecular de sílica
sinteti-zada usando o ortosilicato de tetraetila (TEOS), como fonte de sílica e o copolímero
tri-bloco (PEO-PPO-PEO) poli-(oxido propileno)-poli-(oxido etileno) como agente
direcio-nador de estrutura (molde). Possui microporos formados pela penetração do óxido de
etileno, proveniente do surfactante P123, nas paredes da sílica. Este material contém
me-soporos de arranjos hexagonais uniformes e paredes espessas, o que proporciona uma
maior estabilidade térmica e hidrotérmica ao material [WHANG et al 2015., VEISI et al
2014., ZHAO et al., 1998a., ZHAO et al., 1998b]. Os poros bem definidos fazem da
SBA-15 um material muito promissor na área de ancoragem de uma variedade de
com-postos [SILVA et al., 2011], dentre eles complexos de Base de Schiff.
Bases de Schiff resultam da condensação de aminas primárias com compostos que
possuam grupo carbonila ativo (aldeído ou cetonas), sendo reportada pelo químico
ale-mão Hugo Schiff em 1864. São ligantes estruturalmente bem diversificados por
possuí-rem nitrogênio e oxigênio como átomos doadores, podendo em alguns casos sepossuí-rem
en-contrados átomos de enxofre, como fontes de elétrons livres.
A química da Base de Schiff vem sendo uma área de interesse crescente devido à
sua flexibilidade sintética, pelo fato de estabilizarem os diferentes metais em diversos
estados de oxidação, por apresentarem propriedades estéricas e eletrônicas e devido à
variedade de aplicações que esse material apresenta, em várias áreas, na biologia,na
me-dicina e na catálise em reações de epoxidação de cis olefinas, reações de polimerização,
decomposição de H2O2, dentre outras (adsorção, oxidação de sulfetos...)[GHUA et al., 2013., ABO-ALY et al., 2015., GRIVANI et al., 2012]. Esse complexo que possui metais
de transição em sua estrutura é bem conhecido pelas suas atividades catalíticas na
oxida-ção, bem como, redução de substratos orgânicos e para a síntese de produtos químicos
finos.
Portanto a ancoragem desses complexos em suportes sólidos fornece aos materiais
propriedades características, tais como, seletividade, um aumento na estabilidade térmica
do material e capacidade de regeneração [SHERINGTON et al., 1998].
Este trabalho tem como intuito sintetizar materiais híbridos (inorgânico-orgânico)
de realizar um estudo da estabilidade térmica através das análises térmicas (TG/DTG) dos
materiais obtidos antes e após de serem ancorados na sílica. A combinação das
proprie-dades do componente orgânico com o conteúdo inorgânico forma um material atraente do
ponto de vista científico pela possibilidade de combinar as funcionalidades da química
2 OBJETIVO
Este trabalho visa sintetizar e caracterizar complexos de Base de Schiff e ancorá-los na
matriz sólida da SBA-15 (Santa Bárbara Amorphous). Bem como, realizar um estudo da
esta-bilidade térmica dos materiais antes e após a ancoragem.
2.1 OBJETIVOS ESPECÍFICOS
O trabalho foi organizado em seis etapas, de maneira a se atender os objetivos
específi-cos a seguir:
Obter a sílica mesoporosa, tipo SBA-15, funcionalizada com o agente sililante, 3-
clo-ropropiltrimetóxisilano (3-CPTMS);
Sintetizar as Bases de Schiff: (dietilenotriamina, 3,3’ iminobispropilamina e N- (2-
aminoetil)-1,3 – propanodiamina) com níquel (II);
Ancorar os complexos de Base de Schiff com níquel (II) na SBA-15;
Caracterizar os complexos [Ni(L1)], [Ni(L2)] e [Ni(L3)] por: análise elementar (CHN),
ponto de fusão, condutividade, susceptibilidade magnética, espectroscopia de absorção
na região do UV-visível, espectroscopia de absorção na região do infravermelho
(FTIR) e análise termogravimétrica (TG/DTG).
Caracterizar os materiais ancorados por: difratometria de raios - x, espectrometria de
fluorescência de raios – x (FRX), espectrometria de absorção na região do
infraverme-lho (FTIR), adsorção e dessorção de N2 a 77K e análise termogravimétrica (TG/DTG).
Avaliar a estabilidade térmica dos novos materiais.
3 FUNDAMENTAÇÃO TEÓRICA
3.1 MATERIAIS HÍBRIDOS INORGÂNICO – ORGÂNICO
Materiais híbridos inorgânico-orgânicos constituem em uma classe especial de
com-postos, obtidos pela combinação adequada dos componentes orgânicos e inorgânicos, dando
origem a um único material com propriedades diferentes daquelas de origem. A vantagem
mais óbvia de tais materiais é que estes relacionam uma combinação favorável de
componen-tes inorgânicos e orgânicos, em um único material [JOSÉ et al., 2005]. O desenvolvimento
dessa área acelerou-se desde a década de 80, destacando-se a preparação de géis inorgânicos
impregnados por polímeros orgânicos [HIRATSUKA et al., 1995].
Esse termo híbrido inorgânico-orgânicos começou a ser usado com o desenvolvimento
de ORMOSILS, silicatos organicamente modificados [HU et al., 1993]. A ideia principal
as-sociada ao desenvolvimento de materiais híbridos se resume em aproveitar as vantagens das
melhores propriedades de cada componente, que constitui o material híbrido. Esse processo
consiste em se reduzir ou eliminar as desvantagens que cada componente orgânico ou
inorgâ-nico possui, garantindo que essa modificação proporcione a oportunidade para desenvolver
novos materiais com comportamento sinérgico, resultando em uma maior eficiência ou novas
propriedades úteis. Os materiais híbridos inorgânico–orgânicos oferecem flexibilidade, boa
estabilidade térmica e química e podem ser divididos em classes de acordo com a interface
entre as fases inorgânicas e orgânicas. Classe 1: é a classe em que as forças envolvidas nos
sistemas híbridos são fracas (interações de Van der Waals) e ligações de hidrogênio ou
intera-ções eletrostáticas. Classe 2: os componentes orgânico e inorgânico são unidos por meio de
fortes ligações químicas, covalente ou iônica. Os híbridos da classe II são os mais sintetizados
na área da sílica [JOSÉ et al., 2005, HIRATSUKA et al., 1995., HU et al., 1993].
Vários trabalhos de materiais híbridos inorgânicos – orgânicos vem sendo
desenvol-vidos na literatura, como por exemplo, a ancoragem de complexos de Base de Schiff
pentaco-ordenados [Bis(aminopropilamina)] com Co(II) através de uma interação de grupos silanóis
com grupo reativo (NH2) do ligante [MACHADO et al., 2014] .
Bagherzadeh et al, 2015 realizaram trabalhos de síntese de complexos com
molibidê-nio (VI) com ligante 2-picoloyl hidrazona salicilideno ancorados na SBA-15 através de uma
síntese direta de hidrólise e condensação da fonte de sílica (TEOS), o agente funcionalizante e
3.1.1 Funcionalização da sílica gel
A forma mais comum de modificação da superfície da sílica gel é através de reações
com agentes sililantes, também chamados de organossilanos proporcionando uma série de
diferentes reações de imobilização originando compostos híbridos inorgânico-orgânicos
resul-tantes de vários materiais com sílicas modificadas. A funcionalização permite o controle
pre-ciso sobre as propriedades da superfície e o tamanho do poro para aplicações específicas.
Se-gundo Jal et al, 2004 a funcionalização da superfície da sílica pressupõe a alteração da sua
composição química, podendo resultar de um processo físico (térmico ou hidrotérmico) ou da
incorporação de espécies inorgânicas ou orgânicas na superfície da sílica. A fórmula geral dos
agentes sililantes é representada por Y3Si-R-X3, onde Y pode ser um grupo alcóxido, R uma cadeia orgânica, como exemplo, grupos propil (CH2)3 e X um grupo funcional. Devido à bai-xa acidez de Lewis do átomo de silício, a ligação entre o átomo de silício e carbono tem
cará-ter apolar, por isso esses agentes sililantes são eficientes em reações de imobilização
condu-zindo a formação de uma ligação covalente forte entre a parte orgânica do agente com o
su-porte inorgânico. Essa ligação só é possível devido à reatividade dos grupos alcóxido frente
aos silanóis presentes na superfície da sílica.
A estrutura inorgânica assegura uma estrutura ordenada na mesoescala, além da
estabi-lidade térmica e mecânica. Já as espécies orgânicas incorporadas à mesoestrutura permitem o
controle das propriedades da interface, como, a porosidade, acessibilidade, propriedades
ópti-cas, elétricas ou magnéticas. Esta funcionalização pode ocorrer de duas formas: I) ligação
covalente com o esqueleto orgânico através dos poros (depois da síntese da mesoestrutura); II)
por incorporação direta da função orgânica durante a síntese da mesoestrutura.
O I é realizado através da condensação de grupos organosilanos com os grupos
sila-nóis presentes nos poros, onde o controle da distribuição e a concentração das funções
orgâni-cas são restringidos pela acessibilidade a estes grupos. Depende da reatividade do precursor e
de efeitos estéricos. II é realizado através de uma síntese direta, onde a condensação do
pre-cursor siloxano e do organosilano é feita sob a estrutura da micela. Com isso, o prepre-cursor
siloxano formará o esqueleto da estrutura da sílica com o auxílio do organosilano, além disso,
irá dotar o sólido final características da sua função orgânica [MOTTOLA et al., 1992.,
3.2 COMPOSTOS NITROGENADOS (BASE DE SCHIFF)
Na química de coordenação os compostos orgânicos nitrogenados são de especial
in-teresse, já que estes atuam como Base de Lewis frente a íons metálicos. Os compostos
nitro-genados com potencial a se coordenar a íons metálicos são chamados de ligantes. Podem ser
mencionados alguns tipos de ligantes com sistemas conjugados como as porfirinas (figura 1 a)
e ftalocianinas (figura 1 b) e sistemas não conjugados como são o caso das Bases de Schiff,
salen (figura 1 c).
Fonte: A autora.
Em 1864, na cidade de Pisa (Itália), Hugo Schiff através de seus experimentos
verifi-cou que ao reagir anilina com aldeídos, incluindo acetaldeído, varelaldeído, benzaldeído
ob-servava a formação de imina ou Base de Schiff. A partir dessa observação, concluiu que
imi-nas ou Bases de Schiff são resultados da reação de condensação de amiimi-nas primárias com um
composto que tenha um grupo carbonila ativo, figura 2. A formação da imina começou com
uma adição nucleofílica da amina ao grupo carbonilo. Esse ataque da amina seguido da
proto-nação do átomo de oxigênio e desprotoproto-nação da amina resulta em um intermediário
denomi-nado de carbonilamina. Esta carbonilamina é convertida a imina pela perda de uma molécula
de água e na formação da ligação dupla [RIZWANA et al., 2012].
Figura 1- Estrutura do ligante porfirina (a), ftalocianinas (b) e a Base de Schiff – salen (c).
b
Figura 2 - Formação da imina ou Base de Schiff.
Fonte: Adaptado de Estrela, 2004.
Na química de coordenação os ligantes Bases de Schiff se tornam os ligantes mais
comuns e estruturalmente bem diversificadas, possuindo na grande maioria dos casos, N e O
com átomos doadores, podendo ainda encontrar átomos de enxofre como fonte de elétrons
livres [BLAGUS et al., 2010].
Além de ser objeto de grande interesse devido a sua facilidade de síntese, apresentam
também propriedades estéricas e eletrônicas, formam complexos estáveis com vários metais
de transição, e serem capazes de estabilizar os diversos metais em diferentes estados de
oxi-dação. Esses ligantes possuem uma variedade de aplicações que abrange diversas áreas, da
médica como aplicações em tratamento de câncer, na biologia (como agente bacteriano) e na
catálise (englobando várias reações como oxidação, alquilação, epoxidação e adsorção
contro-lando o desempenho dos metais em grande variedade de transformações catalíticas quando
coordenados aos metais de transição) [LAYEKA et al., 2013., COZZI, 2004,
JEEVADASO-NA et al., 2014., MOHAMMADI et al., 2015., SHAFAATIAN et al., 2014].
De acordo com os trabalhos de Cimerman e colaboradores, 1997, Bases de Schiff
apresentam um papel importante na química de coordenação sendo muito eficazes como
li-gantes e por apresentarem um grupo funcional, geralmente OH, próximo do sítio ativo de
condensação. A ligação C=N destas bases apresentam propriedades básicas e uma forte
ten-dência a formar complexos com metais. Sendo que essa força dessa ligação é insuficiente
pa-ra, sozinha, formar complexos de coordenação através do par de elétrons livres a um íon
me-tálico. Sendo assim, para formar compostos estáveis, é necessário que esta ligação tenha um
outro grupo funcional próximo a um átomo de hidrogênio substituível a ponto de permitir que
anéis quelatos penta ou hexa membrados sejam formados através da reação com o íon
N-N’(bis-salicilideno)-etilenodiamina também conhecida pela abreviação Salen (uma
Base de Schiff muito citada na literatura), é obtida da reação de condensação entre o
salicilal-deído e etilenodiamina. O Salen é um ligante tetradentado utilizado na literatura para
descre-ver a classe de [O, N, N, O], apresentado na figura 1c. O Salen apresenta em sua estrutura. A
coordenação do centro metálico ao ligante é dado através de oxigênios e nitrogênios
presen-tes na estrutura do ligante. Esse ligante forma complexos estáveis com uma variedade de
me-tais de transição, me-tais como manganês, cromo, níquel, ferro, cobalto, paládio, dentre outros
[BLAGUS et al., 2010].
Os ligantes sintetizados nesse trabalho são Bases de Schiff resultantes da condensação
de diferentes triaminas com salicilaldeído. Quando na formação da Base de Schiff foi
utiliza-do a triamina, dietilenotriamina, o ligante foi denominautiliza-do de L1, figura 3a, quanutiliza-do a triamina
utilizada foi a 3,3’ iminobispropilamina, ligante L2, figura 3b e quando a triamina foi a
N-2(-aminoetil)-1,3-propanodiamina, ligante L3, figura 3c.
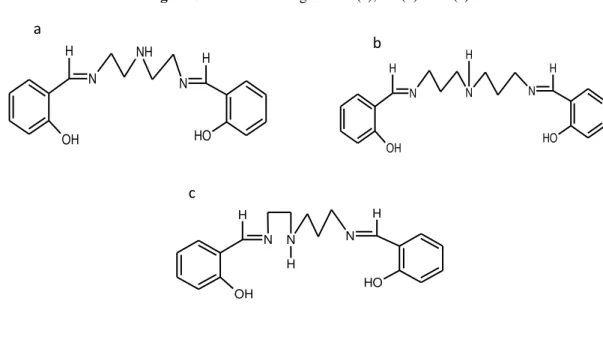
Figura 3 - Estrutura do ligante L1 (a), L2 (b) e L3 (c).
N
OH
NH
N H
O H H
N H
O H N
OH H
N
H
Fonte: Autora
3.3 O ÍON NÍQUEL (II)
O elemento níquel apresenta número atômico 28 e, portanto, o íon Ni (II) possui 26
elétrons e configuração eletrônica [Ar] 3d8. Os compostos de coordenação do Ni(II) são de particular interesse espectroscópico devido às variadas formas estereoquímicas que podem
ocorrer. Existem vários complexos de Ni(II) hexacoordenados (octaédricos),
pentacoordena-N H
O H N
OH H
N H
a
c
dos de estruturas piramidal com base quadrada e bipiramidal trigonal, tetraédricas e quadrado
planar. O número de coordenação máximo que o Ni(II) pode atingir é seis e os complexos do
íon hexacoordenado são geralmente, paramagnéticos, com estrutura octaédricas. Os
comple-xos de Ni(II) com número de coordenação quatro podem apresentar estrutura tetraédrica ou
quadrado planar. A estrutura quadrado planar é estabilizada por ligantes capazes de formar
ligações covalentes fortes ( ou π) com Ni(II), e frequentemente os comprimentos de ligação
Ni(II) – ligante são pequenos para essa estrutura. Nos complexos com ligantes de campo
forte, figura 4, os elétrons são forçados a se emparelharem gerando complexos quadrados
planares diamagnéticos, e apresentam, geralmente, cor avermelhada, laranja ou amarela. Os
complexos com geometrias tetraédricas e octaédricas podem apresentar propriedades
magné-ticas. Fazendo uma observação que na série espectroquímica não traz as triaminas usadas no
trabalho, então foram usados como referências os ligantes etilenodiamina e bipiridina, em
que ambos possuem nitrogênios e oxigênios como átomos doadores de elétrons estando mais
Figura 4 - Série espectroquímica.
Fonte: Lee, 1999.
Trabalhos na literatura de complexos com níquel (II) ancorados em materiais
mesoporosos vem sendo relatados na literatura. Gang et al, 2013 e Bhunia et al, 2011
realizaram um estudo de ancoragem de complexos de Base de Schiff com níquel (II) com o
material mesoporoso MCM-41 via alcóxido de silício.
Enérdeson et al, 2015 realizaram um estudo com os complexos diiminas: 2-(fenil)
amina-4-(fenil)imina-2-penteno e
2-(2,6-dimetilfenil)amina-4-(2,6-dimetilfenil)imina-2-penteno com o níquel (II) ancorados covalentemente na SBA-15.
3.4 SÓLIDOS POROSOS E PENEIRAS MOLECULARES
Devido às elevadas áreas superficiais, os sólidos porosos são usados como suportes de
catalisadores. De acordo com a definição da IUPAC, os materiais porosos são divididos em
três classes:
Microporosos (dp ≤ 2 nm)
Mesoporosos (2< dp > 50)
Dentro dos materiais porosos existe as zeólitas. A história das zeólitas, figura 5
come-ça em 1756 quando o mineralogista sueco Alex Frederick Cronstedt descobriu a primeira
zeó-lita mineral, a Stilbite (NaCa2Al5Si13O36. 14 H2O). Em 1896, Fiedel, desenvolveu a idéia de que a estrutura das zeólitas consistia num tipo de esponja depois de observar que vários
líqui-dos como, álcoois, benzeno e clorofórmio ficavam ocluílíqui-dos em zeólitas hidratadas. Em 1909,
Grandjean observou que a zeólita chabazita adsorvia amônia e outras moléculas
[FLANI-GEM., 2001].
Figura 5 - Exemplos de zeólitas.
Fonte: Aguiar, 2002.
Segundo CIOLA, 1981, zeólitas são estruturas cristalinas de aluminossilicatos
hidrata-dos baseadas no entrelaçamento tridimensional de tetraedros de AlO4 e SiO4, ligados um ao outro por compartilhamento de átomos de oxigênio. As zeólitas são os membros mais
conhe-cidos da classe dos sólidos porosos mas suas aplicações são limitadas pelo pequeno tamanho
da abertura dos poros.
Em 1925, Weighel e Steinhoff reportaram pela primeira vez o termo peneira
molecu-lar. Em 1932, McBain descreveu que, o termo peneira molecular aplica-se a sólidos capazes
de adsorver seletivamente moléculas cujo tamanho permitem sua entrada nos canais.
Desig-nou sólido que atuavam como peneiras a nível molecular após observar que cristais de
chaba-zita, que é um tipo de mineral zeolítico, adsorviam água, metanol, etanol e ácido fórmico, mas
rejeitavam benzeno, acetona e éter [MCBAIN et al., 1932., ZHAO et al., 1996].
Em 1948 é reportado à primeira zeólita sintética, um análogo da zeólita mineral
mo-dernita, alavancando pesquisa e desenvolvimento de materiais porosos. Baseado em uma
processos de separação importante. Em 1953 começaram os estudos de utilização dos sítios
ácidos de zeólitas em reações de craqueamento de hidrocarbonetos de elevado peso
molecu-lar, com objetivo de substituir os catalisadores de craqueamentos convencionais, que eram
constituídos principalmente de sílica/alumina amorfas. Donald W. Breck, em 1964, sintetizou
a zeólita do tipo Y (NaY) e revolucionou a indústria do petróleo, utilizando este material
co-mo suporte para craqueamento de catalisadores catalíticos devido ao maior diâmetro. Até o
início da década de 50, cerca de 8Å, alavancou a pesquisa em busca do desenvolvimento de
novos materiais apresentando diâmetro de poros maiores e acidez semelhante. Argauere
Lan-dolt, em 1972, sintetizaram a zeólita do tipo ZSM-5, utilizada em vários processos da
indús-tria petroquímica como isomerização de xilenos, alquilação. Schlenker e colaboradores, em
1978, sintetizaram a ZSM-5. Nos anos 80, Wilson e colaboradores, em 1982, descobriram os
aluminossilicatos (ALPO´s). Lok e colaboradores, em 1984, sintetizaram os
silicoaluminofos-fatos (SAPO´s) com diâmetro de poros de 0,8 nm. Em 1988, Davis e colaboradores relataram
a síntese do VPI-5, uma peneira molecular tipo AlPO com 1,3 nm de diâmetro de poro como
resultado de algumas tentativas para aumentar o tamanho de poros da zeólita. Diversos
mate-riais microporosos com esta faixa de abertura de poros têm sido sintetizados, o ALPO-8 com
diâmetro de poros (dp) de 0,9 nm, a cloverita com 1,3 nm de dp [FLANIGEM., 2001].
Na tentativa de buscar sólidos que apresentassem poros maiores que os materiais já
ci-tados, em 1992, pesquisadores da Mobil Corporation descobriram a MCM-41, constituintes
da família de peneiras moleculares nomeadas de M41S. Essa nova família era de grande
inte-resse para a catálise e para a ciência dos materiais, devido ser caracterizada por uma matriz
regular de poros com diâmetro uniforme, na faixa de 2 – 10 nm [KUMARAN et al., 2008]
com arranjos bem ordenados, elevada área superficial específica e volume de poros. No
entan-to, esses materiais, por apresentarem uma estrutura composta basicamente de sílica pura, são
de uso limitado para várias aplicações catalíticas, devido à falta de sítios ácidos, além de baixa
estabilidade térmica, hidrotérmica e mecânica [MCBAIN et al., 1932., KUMARAN et al.,
2008., ARAUJO et al., 2000]. A descoberta da MCM-41 é seguida pela síntese de uma série
de estruturas de mesoporosos como, KIT, SBA-15, etc.
No final da década de 90, um novo material foi descoberto por pesquisadores da
Uni-versidade da Califórnia, em Santa Bárbara nos EUA – a SBA-15 - (Santa Bárbara
Amor-phous), figura 6. Constituem uma família de peneiras moleculares mesoporosos à base de síli-ca. A sílica (dióxido de silício) é um polímero inorgânico de fórmula SiO2, podendo ser natu-ral ou sintética, cristalina ou amorfa. O silício também pode ser encontrado na forma de
superfície recoberta por grupos hidroxilas, sendo denominados de grupos silanóis. Estes
gru-pos se comportam como ácido fraco de Bronsted e são responsáveis pela reatividade da sílica,
desempenhando um papel muito importante nos processos relacionados à sua superfície. A
SBA-15 é uma combinação de material micro-mesoporoso com mesoporos ordenados
hexa-gonalmente com diâmetro de poros na faixa de (4-14 nm) [KRUK et al., 2000].
O diâmetro do microporo vai depender da condição de síntese podendo variar entre 0,5
e 3 nm. Consiste em uma grossa parede de sílica microporosa com tamanho de poro (3 – 6
nm) responsável pela elevada estabilidade térmica do material comparado a outros materiais
mesoporosos com poros menores, MCM-41 e MCM-48. A sílica vem conquistando um lugar
de destaque entre os materiais porosos inorgânicos devido ao conjunto de propriedades, tais
como: elevada resistência mecânica, elevada estabilidade térmica e física, elevada porosidade,
baixo custo, fácil manuseamento e autoxicidade. Os mesoporos ordenados hexagonalmente e
interligados por microporos, Figura 6 possibilitam o alojamento ou difusão de grandes
molé-culas o que confere a este material uma grande potencialidade na área de ancoramento de
bi-omoléculas, adsorção e catálise [NOSSOV et al., 2003., MEYNEM et al., 2009., VALLET et
al., 2004].
Figura 6 - SBA-15 (mesoporos interligados por microporos).
Fonte: Adaptado de Pérez – Pariente, 2003.
Todo esse conjunto de características faz deste material um excelente suporte com
di-versas aplicabilidades, dentre elas, a catálise. Devido aos poros mais largos, foi possível a
utilização destes materiais em processos com moléculas maiores, dentre elas complexos de
Base de Schiff.
Na síntese do material SBA-15, normalmente sintetizada em meio fortemente ácido
Zhao e colaboradores, (1998 a) utilizou como agente direcionador estrutural o copolímero
tribloco (Plurônico) poli(óxido de etileno)-poli(óxido de propileno)-poli(óxido de etileno),
direcio-nador, figura 7, foram formadas micelas que se agrupavam na forma de tubos cilíndricos
[FUSCO et al., 2006] consequentemente obtendo uma estrutura hexagonal tridimensional.
Figura 7 - Esquema estrutural do copolímero tribloco.
Fonte: Fusco, 2006.
A calcinação é uma etapa muito importante no processo de síntese. A forma e a curva
dos poros se dão após a decomposição térmica do agente direcionador (P123) realizada na
etapa de calcinação do material, figura 8. Os microporos originados nas paredes dos poros da
SBA-15 são originados após a decomposição da parte óxido de polietileno (PEO) do agente
direcionador enquanto a mesoporisidade é formada pela decomposição do óxido de propileno
[Kumaran et al., 2008., Meynem et al., 2009].
Figura 8 - Esquema representativo da estrutura de SBA-15 antes e após a calcinação.
Fonte: Meynem, 2009.
3.5 ANCORAGEM DOS COMPLEXOS EM PENEIRAS MOLECULARES
Trabalhos de complexos ancorados em peneiras moleculares já vem sendo realizados
metaloporfiri-nas encapsuladas em zeólitas [GENTRY et al., 1974] . A partir daí vários grupos passaram a
fazer esse estudo. Lunsford e colaboradores, sintetizaram complexos de bipiridina com cobre
em zeólitas; Mais tarde Herrone e colaboradores, sintetizaram complexos de cobre e Browers
e Dutra sintetizaram complexos de manganês para serem ancorados na zeólita Y [KIMURA et
al., 1990].
Sharma e colaboradores, 2012 sintetizaram complexos de base de Schiff (1,1’-
binap-thyl-2,2’ diamine) com Mn (III), figura 9.
Zhang e colaboradores, 2015, em seus trabalhos sintetizaram complexos de
molibdê-nio com Base de Schiff tetradentada para que fossem ancorados na SBA-15.
Figura 9 - Funcionalização e ancoragem de complexos de Base de Schiff com Mn (III).
Fonte: Sharma, 2012.
São várias metodologias utilizadas para ancoragem de complexos em materiais
meso-porosos para atender ao tipo de interação que possa existir ente o suporte SBA-15 e o
com-plexo: I) quando ocorre oclusão física devido à restrição de tamanho e/ou interações de fraca
intensidade entre o complexo e o sólido; II) por interações eletrostáticas, quando ocorre
permuta iônica do complexo com carga e os íons permutáveis do material de suporte; III)
quando ocorrem ligações covalentes entre o complexo e o material: neste caso podem
consi-derar-se a ancoragem direta do complexo ao material, e a ancoragem via spacers, quando o
suporte é previamente funcionalizado com moléculas que posteriormente se ligam ao
com-plexo e IV) adsorção física, onde as interações π- π desempenham um papel fundamental na
4 MATERIAIS E MÉTODOS
Neste capítulo, serão detalhados todos os materiais utilizados, tabela 1, bem como
to-das as sínteses realizato-das no trabalho.
Tabela 1 - Materiais utilizados nas sínteses de complexos e ancoragem.
Reagentes Marca
Diethylenetriamine – 99% Aldrich
3,3’ Iminobispropylamine – 98% Aldrich
3,3’ –Diamino-N-methyldipropylamine Aldrich N-(2-Aminoethyl)-1,3-propanediamine
97%
Aldrich
Salicylaldehyde – 98% Aldrich
Trietilamina Vetec – Química Fina - LTDA
Acetato de sódio Merck
Acetato de níquel Alfa – MortonTrokol, Inc
Sulfato de níquel Alfa – MortonTrokol, Inc
Cloreto de níquel Alfa – MortonTrokol, Inc
Metanol J.T Baker
Etanol Tec – Lab
Clorofórmio J.T Baker
Acetonitrila Cromoline – Química Fina – LTDA
Dimetilsulfóxido NEON
Hexano P.A Qhemis
Acetona P.A Gold Lab
Xileno P.A ACS Synth
Tolueno P.A Synth
4.1 SÍNTESE DA PENEIRA MOLECULAR SBA-15
A SBA-15 foi sintetizada de acordo com o fluxograma, figura 10, em meio ácido,
[ZHAO et al, 1998 a] utilizando o tetraetilortosilicato (TEOS) como fonte de sílica e o
copo-límero tribloco P123 (EO20 PO70 EO20) como direcionador em uma proporção 1,000 TEOS: 0,015 P123: 2,750 HCl: 166,0 H2O.
Figura 10 - Fluxograma da síntese da SBA-15.
Fonte: Zhao, 1998 a.
Inicialmente o direcionador P123 foi solubilizado sob agitação e aquecimento entre 35 e
40 ºC em água destilada e HCl, formando as micelas. Posteriormente elas se agruparam
for-mando tubos cilíndricos. Após esta etapa (2 horas) acrescentou-se a fonte de sílica TEOS
(te-traetilortosilicato). A função do tensoativo foi direcionar de que forma o precursor inorgânico
irá formar a mesoestrutura. A mistura foi mantida em agitação e aquecimento (35 e 40 ºC) por
24 horas. Então, o gel obtido a partir destas etapas iniciais foi submetido a um tratamento
hi-drotérmico a 100 ºC, por 24 horas, durante o qual, observa-se uma intensificação da
condensa-ção das espécies da sílica sobre a estrutura micelar do direcionador orgânico a qual originou a
P123 + HCl + H2O
P123 + HCl + H2O + TEOS
1º) Agitação por 2 horas (35- 40°C) 2º) Adicionar TEOS e manter em
agitação por 24 horas (35- 40°C)
3°) Tratamento hidrotérmico a 100°C - 48 horas
SBA-15 4°) Lavagem com etanol e
seco a temperatura ambiente
Caracterizações
5°) Calcinação a 540°C
P123 + HCl + H2O
P123 + HCl + H2O + TEOS
SBA-15
Caracterizações
estrutura mesoporosa SBA-15. Após o tratamento térmico o material obtido foi lavado com
etanol para remoção do excesso do direcionador e, em seguida, seco a temperatura ambiente.
Para desobstrução dos poros o material obtido foi submetido a um processo de calcinação, nas
seguintes condições: 540 ºC, velocidade de 0,01 m/s e tempo de 360 segundos. O mecanismo
de formação do material mesoporoso ocorreu de acordo com a figura 11.
Figura 11 - Mecanismo de formação do material mesoporoso.
Fonte: Beck ,1992.
4.1.1 Ativação do grupo silanol (Si-OH)
Para que ocorra a funcionalização com 3-CPTMS foi necessário haver a ativação dos
grupos silanóis, facilitando assim a ligação entre os compostos (RO)3Si(CH2)3X, e a estrutura sílica. Foram utilizadas 3 gramas da sílica mesoporosa (SBA-15) em 50 mL de HCl
submeti-dos a agitação por 1 hora. A sílica ativada foi lavada com porções de água destilada e em
se-guida foi deixada em uma estufa a vácuo por 24 horas [PARK et al., 2010].
4.1.2 Funcionalização da SBA-15 com 3 – cloropropiltrimetóxisilano
Inicialmente foram utilizadas 3 gramas da sílica mesoporosa (SBA-15) em 2,0 mL de
3-cloropropiltrimetóxisilano (3-CPTMS) refluxadas com 40,0 mL de xileno por 24 horas. Em
seguida o produto foi lavado sucessivamente com porções de xileno, etanol, acetona e éter
etíli-co para remover o material orgânietíli-co que não foi funcionalizado na peneira molecular. Após
esta etapa, foi deixada em uma estufa á vácuo por 18 horas [ALAVI et al., 2013]. O resumo do procedimento se encontra na figura 12. O sucesso da reação depende da disponibilidade dos
devi-do à reatividade devi-dos grupos alcóxidevi-dos com os grupos silanóis presentes na superfície da sílica
podendo estas ocorrer de forma: monodentada, bidentada ou tridentada, figura 13. A
funciona-lização ocorre para que haja uma maior eficiência na ancoragem dos complexos a sílica.
Figura 12 - Fluxograma da funcionalização da SBA-15 com 3-cloropropiltrimetóxisilano.
Fonte: Alavi et al, 2013.
Figura 13 - Esquema da funcionalização da SBA-15 com 3-cloropropiltrimetóxisilano (3-CPTMS).
Fonte: Adaptado de Cesarino, 2007.
SBA-15 3-CPTMS
SBA-15-Cl
Caracterizações
1º) Refluxo com 40 mL de xileno por 24 horas
2°) Lavado com xileno, etanol e
éter etílico
4.2 SÍNTESE DOS LIGANTES
Em um béquer foram adicionados 40 mL de metanol, 10 mmol de salicilaldeído sob
agi-tação e aquecimento (50 °C). Em seguida, adicionaram-se lentamente as triaminas (5 mmol)
deixando-se a mistura reagir por 1 hora. Após esta etapa, a Base de Schiff foi transferida para
um balão e deixada no rotaevaporador por 5 horas até que todo metanol evaporasse, figura 14.
Os ligantes, Bases de Schiff, utilizando as triaminas: dietilenotriamina (líquido amarelo –
vis-coso – L1), 3,3’ iminobispropilamina (óleo- amarelo - L2) e N-(2-aminoetil)–1,3–
propanodiamina (óleo - laranja- L3), são apresentadas na figura 15. A tabela 2 apresenta os
ligantes utilizados no trabalho.
Figura 14 - Fluxograma da síntese dos ligantes.
Fonte: A autora.
Tabela 2 - Ligantes utilizados nas sínteses.
Ligantes Triamina Coloração
L1 Dietilenotriamina amarelo
L2 3,3’ iminobispropilamina amarelo
L3 N-(2-aminoetil) –1,3– propanodia-mina
Laranja
Fonte: A autora.
Metanol Salicílaldeido
triaminas
Base de Schiff
1º) Agitação e aquecimento (50 ºC)
2º) Agitação e aquecimento a 50ºC por 1 hora
Figura 15 - Bases de Schiff – L1, L2 e L3.
Fonte:
4.3 SÍNTESE DOS COMPLEXOS
4.3.1 Síntese dos complexos em clorofórmio
Para a formação da Base de Schiff: 10 mmol de salicilaldeído foram solubilizados em
60 mL de clorofórmio sob agitação e aquecimento a 50 °C. Em seguida, 5 mmol da triamina
(dietilenotriamina) foi adicionada lentamente deixando a mistura reagir por 1 hora. Após esta
etapa, para a formação do [Ni(L1)], adicionou-se 5,2 g de NiCl2. 6H2O e 5,2 g de acetato de sódio. Para o complexo [Ni(L2)], a triamina utilizada na síntese foi a 3,3’ iminobispropilamina.
Após a etapa da formação da base de Schiff foram adicionados (1,18 g) de cloreto de níquel,
figuras 16 e 17. Os complexos foram filtrados e lavados à vácuo com porções de etanol e água
destilada. Por fim os sólidos resultantes foram secos em um dessecador sob sílica gel por 5
Figura 16 - Fluxograma da síntese do complexo [Ni(L1)] em clorofórmio.
Fonte: A autora.
Clorofórmio Salicílaldeido
NiCl2.6H2O Acetato de sódio
1º) Agitação e aquecimento (50 ºC)
Dietilenotriamina
2º) Agitação e aquecimento (50 ºC) por 1 hora
[Ni(L1)]
3º) Agitação e aquecimento (50 ºC) por 2 horas
Figura 17 - Fluxograma da síntese do complexo [Ni(L2)] em clorofórmio.
Fonte: A autora.
4.3.2 Síntese do complexo em metanol
Na formação da Base de Schiff: (10 mmol) do composto carbonilado (salicilaldeído)
fo-ram solubilizados em 60 mL de metanol sob agitação e aquecimento (50 ºC). Em seguida, 5
mmol da triamina (2-aminoetil-1,3-propanodiamina) foi adicionada lentamente deixando a
mis-tura reagir por 1 hora para a formação da Base de Schiff. Após esta etapa, foram adicionados a
reação (1,18 g) de NiCl2.6H2O deixando a mistura em agitação por 2 horas. Em seguida, o complexo formado, [Ni(L3)] foi lavado à vácuo com porções de etanol gelado. Por fim, o
com-plexo foi seco em um dessecador sob sílica gel por 5 dias, figura 18. A tabela 3 resume o
pro-cedimento das sínteses dos complexos.
Clorofórmio Salicílaldeido
3,3’iminobispropilamina
NiCl2.6H2O
[Ni(L2)]
1º) Agitação e aquecimento (50 ºC)
2º) Agitação e aquecimento (50 ºC) por 1 hora
3º) Agitação e aquecimento (50 ºC) por 2 horas
Figura 18 - Fluxograma da síntese do complexo [Ni(L3)] em metanol.
Fonte: A autora.
Tabela 3 - Complexos sintetizados.
Complexos Procedimento % Coloração
[Ni(L1)] Salicilaldeído – triamina (dietilenotriamina) - Acetato de
sódio – cloreto de níquel – clorofórmio.
53,0 Laranja
[Ni(L2)] Salicilaldeído – triamina (3,3 -iminobispropilamina) –
cloreto de níquel - clorofórmio
77,4 Verde
[Ni(L3)] Salicilaldeído - triamina -(2-aminoetil
-
1,3-
propanodiami-na) – cloreto de níquel – metanol
30,0 marrom
Fonte: Autora.
Metanol Salicílaldeido
(2-aminoetil-1,3-propanodiamina)
1º) Agitação e aquecimento (50 ºC)
2º) Agitação e aquecimento (50 ºC) por 1 hora
NiCl2.6H2O
[Ni(L3)] 4º) Lavagem com etanol
ge-lado/dessecador por 5 dias
4.3.3 Solubilidade dos complexos
Após a síntese dos complexos, determinou-se a solubilidade, para a escolha do
solven-te adequado na condutividade e análise de UV- visível. Foi utilizado uma série de solvensolven-tes
orgânicos polares e apolares, conforme tabela 4. A partir daí foi constatado que os complexos
foram solúveis em DMSO, parcialmente solúveis em acetona, acetonitrila e insolúveis em
hexano. Os testes foram realizados em temperatura ambiente (25 ºC).
Tabela 4 - Solubilidade dos complexos.
Complexos Água destilada
acetona acetonitrila hexano DMSO metanol etanol clorofórmio
[Ni(L1)] S PS PS I S PS S S
[Ni(L2)] S PS PS I S PS PS S
[Ni(L3)] PS PS PS I S S S PS
Fonte: Autora. S= solúvel; PS: Parcialmente solúvel; I: Insolúvel
4.4 ANCORAGEM DOS COMPLEXOS NA SBA-15.
Na síntese abaixo, foram ancorados no material mesoporoso os complexos [Ni(L1)],
[Ni(L2)] e [Ni(L3)] utilizando a mesma rota sintética para cada complexo. Inicialmente 1
gra-ma de SBA-15-Cl e 0,2 gragra-mas dos complexos, foram deixados em suspensão em 50 mL de
tolueno em refluxo por 24 horas. Após esta etapa, o catalisador foi separado em um extrator
Soxhlet (24 horas) com tolueno para remover o excesso do complexo na superfície externa da
SBA-15. Em seguida, os compostos foram lavados com água e etanol para remover o complexo
que não foi ancorado e levado para uma estufa (50 °C) por 24 horas. Por fim, o catalisador foi
levado para uma estufa a vácuo por 5 horas (50 °C), figura 19. O átomo de cloro (Cl) presente
na estrutura do material proveniente da funcionalização com 3-cloropropiltrimetóxisilano,
liga-do covalentemente, por ser muito reativo, foi facilmente substítuiliga-do por bases mais fortes
atra-vés de um ataque nucleofílico por parte do nitrogênio da Base de Schiff [ALLINGER et al.,
1976., ALAVI et al., 2013]. A figura 20 apresenta a reação de ancoragem dos complexos na
Figura 19 - Fluxograma da síntese da sílica ancorada com os complexos.
Fonte: A autora.
Figura 20 - Reação de ancoragem dos complexos na SBA-15.
Fonte: A autora.
SBA-15-Cl Complexos
[Ni(L1, L2, L3)]
Caracterizações
1º) suspensão em 50 mL de tolueno com refluxo por 24 horas
3º) Lavagem com etanol e água destilada 2º) O catalisador foi separado em
um extrator Soxlhet por 24 horas com tolueno
Na figura 21 é observado o esquema da funcionalização com cloropropiltrimetóxisilano
e ancoragem dos complexos na sílica funcionalizada.
Figura 21 - Ancoragem dos complexos [Ni(L1)] (1), [Ni(L2)] (2) e [Ni(L3)] (3) no material mesoporoso
Fonte: Adapatado de Alavi, 2013.
4.5 CARACTERIZAÇÃO DOS MATERIAIS
Os complexos sintetizados foram caracterizados por análise elementar (CHN), ponto de
fusão, condutividade, susceptibilidade magnética, espectroscopia de absorção na região do
UV-visível, espectroscopia na absorção do infravermelho e análises térmicas (TG/DTG).
Formados os complexos, estes foram ancorados no material mesoporoso e caracterizados por
absorção na região do infravermelho e análises térmicas (TG/DTG) para fazer um estudo da
estabilidade térmica dos materiais sintetizados.
4.5.1 Análise Elementar (CHN)
Análise elementar é um procedimento químico para se descobrir quais são os elementos
constituintes de uma determinada molécula e sua proporção.
As análises elementares de carbono, hidrogênio e nitrogênio foram determinadas no
Departamento de Química da Universidade Federal de Uberlândia – Minas Gerais, utilizando
o equipamento: Perkin Elmer 2400 Series II CHNS- O Elemental Analyzer , com as seguintes
condições de análise: aquecimento até 900ºC, padrão cisplatina (Perkin Elmer), gases queima
(O2), gás de arraste (He).
4.5.2 Ponto de Fusão
Fusão é a passagem do estado sólido para o estado líquido. Nesse processo, ocorre um
afastamento das moléculas que só será possível com o rompimento das ligações
intermolecu-lares
Os pontos de fusão dos complexos sintetizados foram determinados no aparelho
Mar-coni MA 381 do Laboratório de Sínteses Inorgânicas, Catálises e Cinética do Departamento
de Química da UFSCAR, após compilação da amostra em capilar fechado, até a temperatura
limite do aparelho, 400°C.
4.5.3 Condutividade
A Condutividade quantifica a habilidade dos materiais de conduzir energia térmica.
Estruturas feitas com materiais de alta condutividade térmica conduzem energia térmica de
forma mais rápida e eficiente que estruturas análogas feitas contudo de materiais com baixa
condutividade térmica. Ao fazer o uso de condutividade molar mantendo a concentração
cons-tante, o número de cargas existentes em um complexo pode ser deduzido por comparação com
dados tabelados.
Inorgânicas Catálises e Cinética – Departamento de Quimica da UFSCAR. As medidas de
condutividade para os complexos foram feitas em DMSO.
4.5.4 Susceptibilidade magnética
A susceptibilidade dos complexos foi obtida através de cálculos, seguindo as três
equações descritas abaixo:
Xµ= Xg. PM Eq.1
µ= K(Xµ. T)1/2 Eq.2
µ= [n(n+2)] 1/ Eq.3
Em que:
Xµ= susceptibilidade magnética; Xg= susceptibilidade (gramas); PM= peso molecular;
µ= momento magnético; K=cte= 2,84
T= temperatura em Kelvin; n= número de elétrons.
Na Equação 01, foi calculada a susceptibilidade magnética do material que será
apli-cada na Equação 2 para o cálculo do momento magnético. Tendo o momento magnético, na
Equação 3 calculou-se o número de elétrons desemparelhados.
As medidas de susceptibilidade magnética foram sucedidas no equipamento Magnetic
Susceptibility Balance (JM)- Balance de Gouyr do Laboratório de Estrutura e Reatividade de
Compostos Inorgânicos da UFSCAR.
4.5.5 Espectroscopia de absorção na região do ultravioleta-visível
A espectroscopia de absorção na região do ultravioleta – visível resulta das transições
eletrônicas que ocorrem devido à absorção de radiação pelos elétrons nas ligações ou grupos
funcionais específicos na molécula. O comprimento de onda de absorção é uma medida
ne-cessária para a referida transição enquanto a intensidade, em termos de coeficiente de
absor-ção molar, é funabsor-ção da probabilidade da ocorrência de transiabsor-ção, ou seja, obtêm-se bandas de
absorção correspondentes às transições eletrônicas do estado fundamental a um estado
excita-do. A espectroscopia de absorção envolve a absorção da luz UV/visível através de uma
molé-cula promovendo a passagem de um elétron desde um orbital molemolé-cular de menor energia
excita-ção que é necessária para a transiexcita-ção de elétrons entre orbitais moleculares que permitem
ob-ter informação sobre a estrutura do sistema [OWEN, 1996.,LAKOWICZ, 1999].
Os espectros de absorção na região do ultravioleta – visível dos complexos foram
rea-lizados no espectrofotômetro Shimadzu UV-1650 PC do Laboratório de Sínteses Inorgânicas,
Catálise e Cinética do Departamento de Química da UFSCAR. Para os ligantes foram feitos
espectros em acetonitrila (faixa de 190 a 1100 nm) e DMSO faixa de 275 a 1100 nm). Em
acetonitrila para visualizar bandas referentes π → π* do anel aromático (C=C) não vista no
espectro em DMSO devido à faixa de comprimento de onda começar em 275 nm, sendo essas
bandas observadas abaixo desse comprimento de onda. Os ligantes não foram pesados, por
formarem óleos. Os complexos foram preparados em solução de DMSO (faixa de 275 a 1100
nm) em concentração de 10-4, 10-3 e 10-2M. As medidas foram feitas em cubeta com caminho óptico de 1 cm. A absortividade molar dos complexos foram calculadas pela lei de
Lambert-Beer nos comprimentos de onda selecionados.
4.5.6 Espectroscopia de absorção na região do infravermelho
A espectroscopia de infravermelho é uma das mais importantes técnicas analíticas
hoje disponíveis para os pesquisadores de diversas áreas na Física e na Química. Uma das
grandes vantagens desta técnica é que praticamente todas as amostras podem ser estudadas em
qualquer estado. Líquidos, soluções, pastas, pós, filmes, fibras, gases e superfícies podem ser
analisados com a escolha de uma técnica de amostragem apropriada. A espectroscopia de
in-fravermelho é uma técnica baseada em vibrações dos átomos de uma molécula. Um espectro
de infravermelho é geralmente obtido pela passagem de radiação infravermelha através de
uma amostra e a determinação da fração da radiação incidente que é absorvida para uma dada
energia, onde os picos de absorção correspondem às freqüências de vibração de partes da
mo-lécula [Silverstein et al., 1994].
Os espectros de absorção na região do infravermelho dos ligantes e complexos foram
obtidos através de um espectrofotômetro IR Prestige-21 Fourier Transform Infrared
Spec-trophotometer – Shimadzu do Departamento de Química da Universidade Federal de São
Car-los, na região do infravermelho na faixa de 4000 – 300 cm-1. Os espectros foram obtidos utili-zando-se brometo de potássio (KBr) na proporção de 1 mg da amostra para 100,0 mg de KBr,







![Figura 17 - Fluxograma da síntese do complexo [Ni(L2)] em clorofórmio.](https://thumb-eu.123doks.com/thumbv2/123dok_br/15648127.112195/39.892.149.854.157.727/figura-fluxograma-da-síntese-do-complexo-ni-clorofórmio.webp)
![Figura 18 - Fluxograma da síntese do complexo [Ni(L3)] em metanol.](https://thumb-eu.123doks.com/thumbv2/123dok_br/15648127.112195/40.892.173.856.205.729/figura-fluxograma-da-síntese-do-complexo-ni-metanol.webp)