A en orm e q u ela dos caran gu ejos ch am a-m arés m ach os im pression ou os an tigos observadores da n atu reza, razão pela q u al, du as form as brasileiras foram descritas por Marcgrave em 1648 e, portan to, bem an tes de Lin n aeu s (CRANE 1975).
Mu itas espécies ocorrem sim patricam en te e em gran des q u an tid ad es, cu jo h ábito gregrário é atribu íd o ao com p orta-m en to de orta-m u ltidão egoísta (“selfish h erd”) por algu n s au tores com o VISCIDO & WETHEY (2002), ou com o m eio de lim itar a per-da de água por desidratação com o argum en ta YODERetal. (2005), n u m estu do específico de m edida de perda de águ a em gru pos de diferen tes tam an h os de Ucapugilator (Bosc, 1802).
An im ais típicos da zon a en trem arés de estuários de clim a tropical, subtropical e tem perado quen te, os ch am a-m arés esca-vam tocas de profun didade variada, de on de saem duran te a baixam ar para realizar as atividades de alim en tação e de repro-dução e se recolh em den tro das m esm as duran te as m arés altas. Para o plen o exercício de suas atividades, é n ecessário existir um a con jun ção dos fatores presen ça da luz do sol, tem peratura adequada, ausên cia de ven tos fortes e m aré baixa (CRANE 1975). En tretan to, algum as espécies com o U.pugilator n o litoral da Crolin a do Norte, Estados Un idos, têm atividades duran te as m a-rés baixas n oturn as (SALMON & HYATT 1983). Mais recen tem en te,
(Cr
(Cr
(Cr
(Cr
(Crustacea,
ustacea,
ustacea,
ustacea,
ustacea, Deca
Deca
Deca
Decapoda,
Deca
poda, Ocypodidae) na Baía de Guar
poda,
poda,
poda,
Ocypodidae) na Baía de Guar
Ocypodidae) na Baía de Guar
Ocypodidae) na Baía de Guar
Ocypodidae) na Baía de Guaratuba,
atuba, Par
atuba,
atuba,
atuba,
Par
Par
Par
Paraná,
aná,
aná, Br
aná,
aná,
Br
Br
Br
Brasil
asil
asil
asil
asil
11111Setuko M asunari
21 Contribuição número 1569 do Departamento de Zoologia, Universidade Federal do Paraná.
2 Curso de Pós-graduação em Zoologia, Departamento de Zoologia, Universidade Federal do Paraná. Caixa Postal 19020,
81531-980 Curitiba, Paraná, Brasil. E-mail: setmas@ufpr.br
ABSTRACT. DistrDistribDistrDistrDistribibibibutionutionutionutionution andandandandand ababundanceabababundanceundanceundanceundance ofofof fffffiddlerofof iddleriddleriddler criddlercrcrcrcrabsabs absabsabsUcaUcaUcaUcaUca LeachLeach (CrLeachLeachLeach (Cr(Cr(Cr(Crustaceaustacea DecaustaceaustaceaustaceaDecaDecaDecaDecapodapodapoda Ocypodidae)podapodaOcypodidae)Ocypodidae)Ocypodidae)Ocypodidae) ininininin Guar
Guar Guar Guar
Guaratubaatuba Baatubaatubaatuba BaBaBaBayyyyy, ParParParParParanaanaanaana StateanaStateStateStateState, southersouthersouthersouthernsouthernnnn BrBrBrBrBrazil.azil.azil.azil.azil. A study of the spatial distribution and abundance of fiddler crabs was carried out in Guaratuba Bay, Parana State, southern Brazil. Fiddler crabs were collected from 10 biotopes located along a salinity gradient from zero to 32 inside Guaratuba Bay (between 48°30’W-25°50’S and 48°45’W-25°54’S). Seven species were found, among which, Ucamordax (Smith, 1870) occurred only in biotopes inundated by low salinity water, from zero to 16. Remaining species tolerated wide range of salinity oscillation, but Ucamaracoani (Latreille, 1802-1803) and Ucaleptodactyla Rathbun, 1898 predominated in saltier waters, from 14 to 32, while U. burgersi Holthuis, 1967, Uca rapax (Smith, 1870), Uca thayeri Rathbun, 1900, and Uca uruguayensis Nobili, 1901 were collected in more than three biotopes and showed to be euryhaline: they tolerated salinities from 4 to 32. However, other soil characteristics such as pebble/sand/silt/clay balance, organic matter content and presence of seagrass also influenced the spatial distribution of these crabs. U. leptodactyla occurred with maximum density of 240 ind.m-2, a highest recorded value.
KEY WORDS. Density, granulometry, organic matter, salinity gradient.
RESUMO. Um estudo sobre distribuição espacial e abundância dos chama-marés Uca Leach, 1814 foi realizado na Baía de Guaratuba, Estado do Paraná. Foram coletados chama-marés de dez biótopos ao longo de um gradiente de salinidade de zero a 32 dentro da Baía de Guaratuba. Foram obtidas sete espécies, entre as quais, Ucamordax (Smith, 1870) que foi registrada somente em biótopos inundados por águas de baixas salinidades (de zero a 16). As demais espécies mostraram tolerância a uma ampla variação de salinidade, mas Ucamaracoani (Latreille, 1802-1803) e Uca leptodactyla Rathbun, 1898 predominaram em águas mais salinas, de 14 a 32, enquanto U. burgersi Holthuis, 1967, Ucarapax (Smith, 1870), Ucathayeri Rathbun, 1900 e Ucauruguayensis Nobili, 1901 foram coletadas em mais de três biótopos e mostraram uma tendência ao eurihalismo, suportando salinidades de 4 a 32. Entretanto, outras características do substrato tais como porcentagem relativa de cascalho/areia/silte/argila, teor de maté-ria orgânica e presença de marismas, também, influenciaram a distribuição espacial destes caranguejos.U.leptodactyla foi registrada com densidade máxima de 240 ind.m-2, o mais alto valor conhecido.
CHIUSSI & DÍAZ (2001) dem on straram que a posição do sol e o padrão da luz polarizada do sol sobrepujam as referên cias das paisagen s para a orien tação espacial destes an im ais.
Em bora estes caran gu ejos possu am características sem i-terrestres, as su as larvas desen volvem -se em am bien te aqu áti-co. As larvas (zoea) eclodem u su alm en te à n oite, du ran te as m arés altas q u e as tran sp ortam rap id am en te p ara lon ge d os h ábitats dos adu ltos. Um a vez levadas pelas m arés para águ as m ais profu n das, perm an ecem n o fu n do on de com pletam vári-as m u dvári-as e são tran sportadvári-as de volta ao estu ário para atin gir a m atu ridade (ver revisão em KELLMEYER & SALMON 2001).
Os caran guejos Uca Leach , 1814 foram objeto de estudos abran gen tes sobre sistem ática com o os de CRANE (1975) e, m ais recen tem en te, de vários autores cuja revisão foi feita por ROSENBERG (2001). No Brasil, destacam -se artigos sobre sistem ática (OLIVEIRA 1939, MELO et al. 1989, MELO 1996), fisiologia (LACERDA 1982, LACERDA & MCNAMARA 1983, MCNAMARA & MOREIRA 1983), com -portam en to (VON HAGEN 1987), estudos m orfom étricos (MASUNARI & SWIECH-AYOUB 2003, NEGREIROS-FRANSOZO et al. 2003, BENETTI & NEGREIROS-FRANSOZO 2004, CASTIGLIONI & NEGREIROS-FRANSOZO 2004, MASUNARI & DISSENHA 2005 e MASUNARI etal. 2005) e asp ectos reprodutivos (COLPO & NEGREIROS-FRANSOZO 2003).
Den tre as variáveis abióticas im portan tes q u e in flu en ci-am a distribu ição e a abu n dân cia destes an im ais estão a tem pe-rat u ra (CRAN E 1975), grad ien t e d e salin id ad e (CRAN E 1975 , THURMAN 1984, 1987, BARNW ELL 1986), tip o d e solo (BARNW ELL 1986, THURMAN 1987), n ível do su bstrato em relação à altu ra da m aré (THURMAN 1987), grau de dessecação do biótopo (THURMAN 1984, 1998), presen ça de vegetação e o tipo do em aran h ado de su as raízes (POW ERS & COLE 1976, RINGOLD 1979, SALMON & HYATT 1983, THURMAN 1987, NOBBS 2003).
Os ch am a-m arés con stitu em u m com pon en te sign ifica-tivo da biom assa m acrofau n ística da zon a en trem arés e u m a im portan te fon te de alim en to para vários an im ais com o m a-m ífero s, aves, p eixes e caran gu ejo s d e gran d e p o rt e d est e biótop o (CRANE 1975). Com o são an im ais n u m erosos, as ativi-dades alim en tares dos m esm os in flu en ciam a tran sferên cia de n u trien tes e en ergia de áreas in tertidais para o estu ário em ge-ral (MONTAGUE 1980). Estes caran gu ejos alim en tam -se de u m a varied ad e d e b act érias e m icro flo ra b en t ô n icas, t ais co m o diatom áceas e algas azu is q u e estão associadas com o com ple-xo su bstrato organ o-m in eral (CRANE 1975). A detecção de ali-m en to é feita através de q u iali-m iosen sores localizados n as q u elas e, possivelm en te n a região bu cal (ROBERTSONet al. 1980, 1981, ROBERTSON & NEW ELL 1982). Experim en tos com Ucarapax (Sm ith , 1870) dem on straram qu e estes an im ais cavam tocas em n ú m e-ro m aior do q u e o de in divídu os ali presen tes e, portan to, cada an im al n ão se lim ita a escavar apen as a su a toca. Este fato foi in terpretado com o u m m eio de au m en tar o su prim en to de alim en to para estes an ialim ais, pois, o ato de escavar galerias con -du z m atéria orgân ica para a su perfície terrestre, in crem en tan do a atividade m icrobian a q u e, por su a vez, estim u la o crescim en -to das gram as m arin h as (GENONI 1985, 1991).
Para o litoral do Paran á, a literatu ra n ão con tem pla q u al-q u er aspecto ecológico ou da h istória de vida dos caran gu ejos Uca. Som en te MELOetal. (1989) e MELO (1996) reportaram seis espécies do gên ero para este estado e, MASUNARI & DISSENHA (2005) e MASUNARIetal. (2005) realizaram estu dos de crescim en to rela-tivo em Ucam ordax (Sm ith , 1870) e Ucam aracoani (Latreille, 1802-1803) proven ien tes da Baía de Gu aratu ba. Apesar da cres-cen te u rban ização e da u tilização das áreas do estu ário da Baía de Gu aratu ba p ara a p rática de cu ltivo in ten sivo de an im ais m arin h os, n ão h á estu dos de m étodos de m an ejo dos h ábitats on de ocorrem popu lações adu ltas ou larvas de ch am a-m arés. Estu dos do passado n os litorais do exterior têm dem on strado qu e as popu lações de ch am a-m arés estão em fran ca extin ção local, d evid o à d egrad ação crescen te d os h ábitats in tertid ais p or p olu ição, dragagem e aterro. Devido à alta sen sibilidade destes an im ais a estes estresses, au tores com o BARNW ELL (1986) têm su gerid o q u e os ch am a-m arés p od eriam ser ú teis com o bioin dicadores de h ábitats ain da sadios.
Dian te d a exp ressiva abu n d ân cia d e ch am a-m arés n os b ió t o p o s a in d a n ã o d e gr a d a d o s n o in t e r io r d a Ba ía d e Gu aratu ba, e da u rgên cia de u m estu do abran gen te sobre fatores q u e regu lam a distribu ição deste im portan te elo trófico en -tre o am bien te terres-tre e o estu arin o, o presen te trabalh o pro-põe u m estu do descritivo da ocorrên cia e da abu n dân cia das p o p u laçõ es d e Uca em so lo s lo calizad o s n u m grad ien t e d e salin idade da águ a den tro da referida baía.
MATERIAL E MÉTODOS
Área de estudo
Bacia Hidrográfica de Gu aratu ba tem 1393 km2 de exten
-são e con stitu i u m dos sistem as flu viais m ais im portan tes da zon a litorân ea do Paran á. Ela é form ada p elos aflu en tes q u e n ascem n o prim eiro plan alto paran aen se e por dois rios (Des-coberto e Bogu açu ) q u e n ascem n o litoral (MAACK 1968).
Neste con texto situa-se a Baía de Guaratuba en tre as coor-den adas de 48°30’W, 25°50’S e 48°45’W, 25°54’S, com um a área de aproxim adam en te 40 km2. Ela é m argeada por m an guezais
relativam en te bem preservados, com exceção do lado sudeste, n as im ediações de sua con exão com o m ar, on de se localiza a região u rban a do m u n icípio de Gu aratu ba (Fig. 1). Matas de restin ga ocorrem n o fun do da baía e, baixios e m arism as – ban -cos d e gram as m arin h as d om in ad os p or Spartina alterniflora (Poaceae) – que em ergem duran te as m arés vazan tes ain da fazem parte da paisagem dos substratos terrestres. Resíduos de com -bustíveis são visíveis m ais freqüen tem en te próxim os à zon a ur-ban a e ao trech o de travessia de barcos n a boca da baía.
O clim a d o litoral p aran aen se é classificad o, segu n d o Koeppen , com o zon a tropical de tran sição, sem pre ú m ida, m ata plu viatropical, orlas de m an gu ezais m argin an do as baías, cu l-tu ras tropicais, região sem geadas n ol-tu rn as (MAACK 1968).
Figuras 1-4. (1) Baía de Guaratuba. Fotografia de satélite com indicação das seis estações de coleta. Os círculos representam o teor de salinidade (vermelho) e a densidade das assembléias dos caranguejos Uca (amarelo), cujo tamanho é proporcional aos valores médios registrados nas referidas estações. Imagem de satélite de 18/ IV/ 1996 fornecida pela Intersat para a Engefoto. (2) Chapeuzinho, vista parcial das imediações do Biótopo 1 com Ucamordax num dia de verão, às margens do Rio União. (3) Baixio M irim-areia, vista parcial do Biótopo 4 com uma população de Ucaleptodactyla que dominou fortemente e divide espaço com poucos indivíduos de U.uruguayensis; a maioria dos machos está em atividade de aceno sexual. Ao fundo observa-se o início do Biótopo 5 (Baixio M irim-marisma). (4) Baixio M irim-lodo, vista parcial do Biótopo 6 com Ucamaracoani em atividade fora da toca num dia de verão: os machos estão em aceno sexual.
1
o e st e p a r a o le st e d a Ba ía d e G u a r a t u b a : C h a p e u zin h o (4 8 º 4 3 ,8 3 4 ’W e 2 5 º 5 1 ,3 3 0 ’S), G u a x u m a (4 8 º 4 1 ,1 2 9 ’W e 25º51,398’S), Ilh a das Garcin h as (48º37,994’W e 25º52,284’S), Baixio Mirim (48º36,442’W e 25º52,370’S), Pon to d e Ven d a (48º35,205’W e 25º51,213’S) e Rio Fu n d o (48º34,958’W e 25º50,967’S). Elas estão localizad as, resp ectivam en te, a 15,0, 12,5, 7,0, 5,0, 2,3 e 1,5 km da en trada da baía; estas distân cias foram projetadas n u m a lin h a reta traçada do fu n do até a boca da baía (Fig. 1). Nas estações Pon to de Ven da e Baixio Mirim , foram discrim in ados e am ostrados três biótopos em cada u m a, em fu n ção da diversidade fisiográfica destas estações de coleta; n as dem ais, som en te u m biótopo foi am ostrado.
A Estação Ch apeuzin h o (Biótopo 1, Fig. 2) está localizada n a Ilh a do m esm o n om e, às m argen s do Rio Un ião, um afluen te do Rio São João. O local é coberto por um a vegetação de restin ga e as tocas dos ch am a-m arés foram observadas em m eio às raízes das árvores, em solo aren oso com pacto sem pre som breado pelas copas dos arbustos. A Estação Guaxum a (Biótopo 2) en con tra-se n a ilh a do m esm o n om e e o solo m ovediço parcialm en te cober-to por um a vegetação de porte h erbáceo que substituiu as árvo-res do m an guezal origin al derrubadas pelo h om em ; um a área com in cidên cia solar direta foi escolh ida com o local de am os-tragem dos caran guejos. A Estação Ilh a das Garcin h as (Biótopo 3) está localizada n um a pequen a ilh a do m esm o n om e, em fren -te à desem bocadura do Rio das Garças; a am ostragem foi feita em um baixio sem vegetação e rodeado de um lado por um m an -guezal e de outro por m arism as. O Baixio Mirim está localizado a oeste da zon a urban a de Guaratuba, e é form ado por um m o-saico de m arism as, substrato aren oso e substrato lodoso. Nesta estação, foram am ostrados três biótopos con tíguos com diferen -tes substratos: aren oso sem vegetação (Biótopo 4, Fig. 3), aren o-so de m arism as (Biótopo 5) e lodoo-so sem vegetação (Biótopo 6, Fig. 4). Na Estação Pon to de Ven da, tam bém , foram am ostrados três biótopos con tíguos: areia/lodo sem vegetação (Biótopo 7), areia/lodo de m arism as (Biótopo 8) e n o in terior do m an guezal (Bió t o p o 9). Est a est ação est á lo calizad a n o su l d a Ilh a d o Cap in zal, às m argen s d o Rio d o Leite, cu jos Biótop os 7 e 8 correspon dem a um a área aberta, on de o m an guezal origin al foi derrubado. A Estação Rio Fun do (Biótopo 10) localiza-se n a por-ção n ordeste da Ilh a do Capin zal, às m argen s do Rio Fun do, em fren te ao Morro Joaqu im Jorge. Em bora a am ostragem ten h a sido realizada n o in terior de um m an guezal, o solo sem pre som -breado era aren oso e com pacto.
Métodos
As coletas do m aterial biológico e dos dados das variá-veis abióticas foram realizadas m en salm en te, de abril de 2003 a m arço de 2004, du ran te as m arés de sizígia. Lu m in osidade, tem peratu ra do ar e do solo à su perfície e às profu n didades de 5, 10, 15 e 20 cm , e salin idade da águ a foram m edidas; as con -dições clim áticas por ocasião da coleta foram an otadas em to-das as am ostragen s. A tem peratu ra do ar foi m edida com u m t erm ô m et ro d e m ercú rio co m u m , a lu m in o sid ad e co m u m fotôm etro da m arca Extech e a salin idade com u m salin ôm etro
m an u al Mitu toyo. A tem peratu ra do solo foi tom ada com u m term ôm etro digital portátil Gu lterm , provido de u m sen sor térm ico n a extretérm idade de u térm a h aste térm etálica de 20ctérm de cotérm prim en to. As tem peratu ras m édias, m ín im as e m áxim as m en -sa is d o a r fo r a m t o m a d a s n a Est a çã o M et eo r o ló gica d e Gu aratu ba pelo In stitu to Tecn ológico SIMEPAR.
Foram calcu ladas as m édias e os valores m áxim os e m ín i-m os para os dados das variáveis abióticas e i-m édias e desvios-padrão para as den sidades an im ais.
Os sedim en tos foram obtidos por m eio de cores da su -perfície do solo até aproxim adam en te 12 cm de profu n didade. Estas am ostragen s foram realizadas em todos os biótopos em 20 de ou tu bro de 2004, 24 de fevereiro de 2005 e 28 de m arço de 2005, u m a vez qu e o sedim en to se m an tém con stan te ao lon go do estu do. As an álises gran u lom étricas foram realizadas n o Laboratório de Geologia, Cen tro de Estu dos do Mar, Un i-versidade Federal do Paran á, segu in do-se as técn icas tradicio-n ais de sedim etradicio-n tologia, abratradicio-n getradicio-n do a pipetagem para os sedi-m en tos fin os (lasedi-m a, ou silte + argila) e o pen eirasedi-m en to para a fração gro sseira (areia), u t ilizan d o -se a Escala Ph i segu n d o KRUMBEIN (1938 in SUGUIO 2003). Por ou tro lado, a determ in ação dos teores de carbon ato biodetrítico e m atéria orgân ica foram feitos, respectivam en te, por adição de HCl a 10% e qu eim a em m u fla por u m a h ora a 550ºC (SUGUIO 1973). Os parâm etros es-tatísticos gran u lom étricos (m éd ia e grau d e seleção), em p re-gan do a fórm u la de FOLK & WARD (1957), foram calcu lados atra-vés do program a SYSGRAN para m icrocom pu tadores.
Os ch am a-m arés foram coletados u tilizan do-se du as m e-todologias con form e a den sidade popu lacion al aparen te. Nos biótopos com m u itos caran gu ejos, foi am ostrada u m a área de 0,25 m2 (0,50 m de lado), on de todo solo con tido n este q u
adrado foi rem ovido até u m a profu n didade de 0,15 m , com au -xílio de pás de jardim e pen eirado em telas de 1m m de abertu ra d e m alh a. Nos biótop os d e m en or d en sid ad e d e an im ais, as am ostragen s foram feitas n u m a área de 4,0 m2 (2,0 m de lado),
e os an im ais foram obtidos por revolvim en to das tocas abertas. Esta coleta m an u al por escavação foi escolh ida pela com prova-ção d e ser a q u e gera m en os erros, q u an d o com p arad a com outras, com o con tagem direta dos an im ais com bin óculos (ocorre u m a su bestim ação) ou pela con tagem do n ú m ero de abertu -ras das tocas (ocorre su perestim ação) (MACIAetal. 2001, SKOV & HARTNOLL 2001). Nos biótopos de m arism as, as plan tas con tidas n o quadrado delim itado foram rem ovidas in tegralm en te do solo e após a coleta dos caran gu ejos, elas foram replan tadas n o lo-cal de origem . Com exceção dos exem plares de U. m aracoani q u e foram iden tificados e q u an tificados inloco e devolvidos ao local de origem , os dem ais foram tran sportados para o labora-tório em recipien tes resfriados, fixados em form ol a 4% glice-rin ado e con servados em a álcool 70% gliceglice-rin ado.
Nas estações Baixio Mirim e Pon to de Ven da, foram obti-das duas am ostras de 0,25 m2 em cada um dos biótopos 4, 5, 7 e
8. Nos Biótopos 1, 2, 3, 9 e 10 foi retirada um a am ostra de 4 m2
(Biótopo 6), local de ocorrên cia exclusiva da espécie U.m aracoani, n ão foi possível delim itar um a área de coleta em fun ção da com -plexidade e profun didade das tocas dos adultos que ultrapassa-vam 0,60 m . A abun dân cia n este biótopo foi estim ada em n ú-m ero de capturas por un idade de esforço (CPUE), que con sistiu n o n úm ero de caran guejos coletados por um caran guejeiro du-ran te 40 m in utos, n um a área de 400m2 aproxim adam en te.
A den sidade das espécies foi calculada em n úm ero de in -divíduos por m etro quadrado (n º.in d.m-2), com exceção de U.
m aracoani, cuja abun dân cia foi estim ada em n úm ero de in divíduos por un idade de esforço (CPUE). A sign ificân cia n a diferen -ça dos valores de tem peratura do solo en tre as profun didades foi calculada pelo Teste de Freedm an , a n ível de 5% (SIEGEL 1956), com auxílio do program a Statistica para m icrocom putadores.
Foi ch am ada de espécie con stan te aq u ela q u e foi regis-trada em , pelo m en os, 50% das am ostras (seis m eses). Espécie exclusiva correspon de àquela que n ão possui co-ocorren tes n um determ in ado biótopo (ACIESP 1997).
RESULTADOS
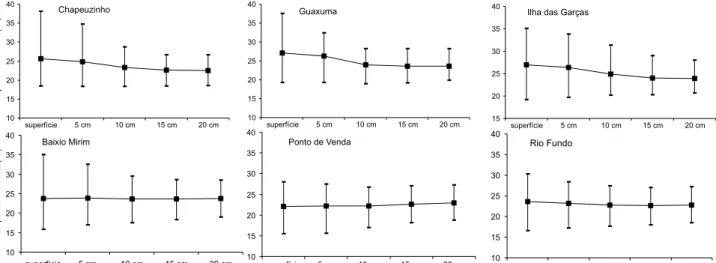
A tem peratura do solo se m ostrou m ais estável n as cam a-das m ais profun a-das do que n a superfície em toa-das as estações de coleta. En quan to a am plitude de variação n a superfície atin giu m ais de 19,00ºC (m ín im a de 18,40ºC e m áxim a de 38,10ºC em Ch apeuzin h o), a 20 cm de profun didade atin giu, n o m áxim o, 9,50ºC (19,00 a 28,50ºC, n o Baixio Mirim ). O valor m édio da tem peratu ra à su perfície variou de 22,13 ± 3,95ºC (Pon to de Ven da) a 27,12 ± 5,65ºC (Guaxum a), ao passo que, a 20 cm va-riou d e 22,90 ± 3,13ºC (Pon to d e Ven d a) a 23,55 ± 2,54ºC (Guaxum a). Com exceção do Pon to de Ven da, todas as estações de coleta m ostraram as m ais altas tem peraturas m édias n a su-perfície e as m ais baixas a 20 cm de profun didade duran te os m eses m ais quen tes (de agosto a m arço): valores in term ediários foram registrados n as dem ais profu n didades. En tretan to, n os m eses m ais frios (de abril a julh o), os valores absolutos ficaram in vertidos, ou seja, m ais baixos n a superfície e m ais altos a 20 cm de profun didade, em todas as estações de coleta. Houve diferen -ça sign ificativa n as m édias das tem peraturas en tre as cin co pro-fun didades 2 (N = 76, df = 4) = 10,63841 p < 0,03096 e, quan do
an alisadas duas a duas, h ouve diferen ça sign ificativa en tre as profun didades de 5cm e 10cm : 2 (N = 76, df = 1) = 7,895523,
p < 0,00496, e en tre a da superfície e a de 20cm : 2 (N = 21, df =
1) = 3,857143, p < 0,04954 para o período de abril a julh o e 2
(N = 42, df = 1) = 4,66666, p < 0,03076 para o período de agosto a m arço. Nas dem ais profun didades con tíguas (en tre superfície e 5 cm , en tre 10 e 15 cm e en tre 15 e 20 cm ) n ão h ouve diferen -ça sign ificativa a n ível de 5%. O solo m ais quen te foi registrado em Guaxum a, on de a m édia n o período de estudo variou de 23,56 ± 2,53ºC a 27,13 ± 5,65ºC. Em con traposição, o terren o m ais frio foi o do Pon to de Ven da, com m édias de 22,13 ± 3,95ºC a 22,90 ± 3,14ºC (Fig. 5).
A tem peratu ra m édia m en sal do ar para a cidade de Gu a-ratu ba n o período de coleta variou de 17,18 ± 3,84ºC em
agos-to de 2003 a 24,62 ± 3,30ºC em fevereiro de 2004. A m en or m ín im a m en sal absolu ta d e 8,30ºC foi registrad a em setem -bro/ 03 e a m aior m áxim a m en sal absolu ta de 33,70ºC, em abril/ 03 (SIMEPAR). Os valores registrados em cam po oscilaram de 13,00ºC a 35,00ºC (am bos n o Baixio Mirim ), ten do as m édias n o período estu dado variado de 21,45 ± 4,96ºC (Pon to de Ven -da) a 24,79 ± 5,22ºC (Ch apeu zin h o) (Fig. 6).
A lu m in osidade m édia variou de 40.371,67 ± 32.737,87 lu x n o Pon to de Ven da a 71.175,56 ± 56.128,19 lu x n a Ilh a das Garcin h as, d u ran te o p eríod o d e estu d o. En tretan to, baixos valores, com o 1.400 lu x, foram registrados n o Rio Fu n do (ju -n h o de 2003) e altos, com o 184.000 lu x, em Gu axu m a (-n o-vem bro de 2003) (Fig. 6).
As am ostras do solo apresen taram porcen tagen s de areia qu e variaram de 69,99% (Pon to de Ven da-areia/ lodo) até 100% (Baixio Mirim -areia); p or ou tro lado, o teor de argila foi baixo, varian do de 0% (Baixio Mirim -areia e Ch apeu zin h o) a 13,30% (Po n t o d e Ven d m arism a). So m en t e n o Po n t o d e Ven d a-m arisa-m a foi registrado 0,11% de cascalh o. Praticaa-m en te todas as am ostras foram com postas por areia fin a a areia m u ito fin a (Ph i en tre 2 e 4), varian do de bem selecion ado (Baixio Mirim -areia) a m u ito pobrem en te selecion ado (Pon to de Ven da-areia/ lodo e P.V.-m an gu ezal). O teor de m atéria orgân ica variou de 1,25% (Baixio Mirim m arism a) a 14,74% (Gu axu m a), en q u an -to o de carbon a-to biodetrítico, de 2,32% (Baixio Mirim -areia) a 6,34% (Ilh a das Garcin h as e Pon to de Ven da-m arism a). De u m a form a geral, solos com m ais de 85% da fração areia apresen ta-ram teores de m atéria orgân ica abaixo de 6% (Ch apeu zin h o, Baixio Mirim -areia, Baixio Mirim -m arism a e Rio Fu n do), m as, solos com taxa in ferior a 80% de areia, tam bém , foram pobres em m atéria orgân ica (Baixio Mirim -lodo e Pon to de Ven da-areia/ lodo) (Tab. I e Fig. 6).
A sa lin id a d e m éd ia d a á gu a va rio u d e 0 ,3 3 ± 1 ,1 5 (Ch apeu zin h o) a 23,63 ± 4,25 (Rio Fu n do), ten do valor zero n a m aioria dos m eses n aqu ela estação de coleta e valor m áxim o absolu to d e 32,00 n esta ú ltim a. Em Gu axu m a, a salin id ad e m éd ia n o p eríod o estu d ad o foi d e 7,92 ± 3,77, n a Ilh a d as Garcin h as 18,80 ± 4,32, n o Baixio Mirim 20,40 ± 5,10 e n o Pon to de Ven da 23,46 ± 4,23 (Fig. 6).
Foram obtidas sete espécies de ch am a-m aré: Ucaburgersi Holth u is,1967, Ucaleptodactyla Rath bu n , 1898, U. m aracoani, U.m ordax, U.rapax, Ucathayeri Rath bun , 1900 e Ucauruguayensis Nobili, 1901.
dis-tribu ição desta variável com a da abu n dân cia das popu lações de ch am a-m arés (Tab. I e Fig. 7).
Hou ve apen as dois biótopos q u e abrigaram espécies ex-clu sivas: Ch apeu zin h o com U.m ordax e Baixio Mirim -lodo com U. m aracoan i. En t ret an t o , d evid o à fo rt e d o m in ân cia d e U. leptodactyla n os Biótopos 4 e 5 do Baixio Mirim (m ais de 95%
do total de in divídu os), esta espécie tam bém foi con siderada exclu siva de am bos os biótopos. Por ou tro lado, a dom in ân cia com m ais de 50% do total de in divídu os registrados foi obser-vad a n o Pon to d e Ven d a-areia/ lod o com U. leptodactyla, n o Pon to de Ven da-m arism a com U. uruguayensis e n o Pon to de Ven d a-m an gu ezal com Ucathayeri. Nos d em ais biótop os, as Figura 5. Baía de Guaratuba. Temperaturas média (linha contínua horizontal), mínima e máxima (traço vertical) do solo nas diversas estações de coleta, à superfície e a 5cm, 10cm, 15cm e 20cm de profundidade.
Figura 6. Baía de Guaratuba. Variáveis abióticas registradas nas diversas estações de coleta. As linhas verticais nos gráficos indicam os valores mínimo e máximo, e os quadrados, o valor médio. A oscilação do número de espécies nos biótopos, também, está representada no gráfico da porcentagem de matéria orgânica. Biótopos: 1) Chapeuzinho, 2) Guaxuma, 3) Ilha das Garcinhas, 4) Baixio M irim-areia, 5) Baixio M irim-marisma, 6) Baixio M irim-lodo, 7) Ponto de Venda-areia/ lodo, 8) Ponto de Venda-marisma, 9) Ponto de Venda-manguezal, 10) Rio Fundo. Presença de vegetação de restinga no Biótopo 1, de marisma nos 5 e 8 e de manguezal nos 9 e 10 (gráfico inferior na coluna direita). Chapeuzinho 10 15 20 25 30 35 40
superfície 5 cm 10 cm 15 cm 20 cm
Guaxuma 10 15 20 25 30 35 40
superfície 5 cm 10 cm 15 cm 20 cm
Baixio Mirim 10 15 20 25 30 35 40
superfície 5 cm 10 cm 15 cm 20 cm
Ponto de Venda
10 15 20 25 30 35 40 superfície T emperatura do solo (°C) T emperatura do solo (°C)
5 cm 10 cm 15 cm 20 cm
Ilha das Garças
15 20 25 30 35 40
superfície 5 cm 10 cm 15 cm 20 cm
Rio Fundo 10 15 20 25 30 35 40
superfície 5 cm 10 cm 15 cm 20 cm
Luminosidade Vegetação 0 50 100 150 200 250
1 2 3 4 5 6 7 8 9 10
Lux
(x1000)
Temperatura do ar
10 15 20 25 30 35 40
1 2 3 4 5 6 7 8 9 10
Salinidade 0 5 10 15 20 25 30 35
1 2 3 4 5 6 7 8 9 10
Biótopos Biótopos Biótopos
Número de espécies Matéria orgânica Salinidade Granulometria T emepratura (°C) 0% 20% 40% 60% 80% 100%
1 2 3 4 5 6 7 8 9 10
Cascalho Areia Silte Argila
0 2 4 6 8 10 12 14 16
1 2 3 4 5 6 7 8 9 10
0 1 2 3 4 5 6 M.O. Espécies constantes
esp écies m ais ab u n d an t es fo ram co -d o m in an t es (Ilh a d as Garcin h as, Gu axu m a e Rio Fu n do) (Fig. 8).
A m en or den sidade m édia total de ch am a-m arés foi
re-gistrada n a Estação Ilh a das Garcin h as (2,56 ± 1,92 in d.m-2),
segu ida de Gu axu m a (6,79 ± 3,17 in d.m-2), Ch apeu zin h o (9,98
± 3,71 in d .m-2), Rio Fu n d o (13,17 ± 7,27 in d .m-2), Pon to d e
Tabela I. Baía de Guaratuba. M édia granulom étrica, classificação, grau de seleção, conteúdo de m atéria orgânica e de carbonato biodetrítico das amostras de solo dos biótopos estudados.
Biótopos Estações
de coleta
M édia
granulométrica Classificação Grau de
seleção Classificação da seleção
M atéria orgânica (%)
Carbonato biodetrítico (%)
1 Chapeuzinho Chapeuzinho 2,738 Areia fina 0,532 M oderadamente selecionado 5,64 5,58
2 Guaxuma Guaxuma 3,792 Areia muito fina 1,627 Pobremente selecionado 14,74 2,86
3 Ilha das Garcinhas Ilha das Garcinhas 3,124 Areia muito fina 1,276 Pobremente selecionado 9,43 6,34
4 Baixio M irim-areia Baixio M irim 2,267 Areia fina 0,480 Bem selecionado 1,38 2,32
5 Baixio M irim-marisma Baixio M irim 2,565 Areia fina 0,514 M oderadamente selecionado 1,25 2,87
6 Baixio M irim-lodo Baixio M irim 3,734 Areia muito fina 1,733 Pobremente selecionado 1,66 6,15
7 Ponto de Venda-areia/ lodo Ponto de Venda 3,748 Areia muito fina 2,192 M uito pobremente selecionado 2,96 2,99
8 Ponto de Venda-marisma Ponto de Venda 3,865 Areia muito fina 1,964 Pobremente selecionado 10,43 6,34
9 Ponto de Venda-manguezal Ponto de Venda 3,693 Areia muito fina 1,508 M uito pobremente selecionado 6,51 5,31
10 Rio Fundo Rio Fundo 3,064 Areia muito fina 0,755 M oderadamente selecionado 5,27 5,59
Figura 7. Baía de Guaratuba. Densidade média (nº.ind.m-2) e de abundância média (CPUE) da assembléia e das sete espécies de Uca
isoladamente nos dez biótopos analisados. Observe que a escala na abscissa é diferente para cada espécie. Nome dos biótopos na legenda da figura 6.
0 20 40 60 80 100 120 140 160
1
Densidade
(no.ind.m
)
ou
CPUE
-2
Número
de
espécies
2
Densidade média total Número de espécies
3 4 5 6 7 8 9 10 0
1 2 3 4 5 6
0 1 2 3 4 5 6
1 2 3 4 5 6 7 8 9 10 0
10 20 30 40 50 60
1 2 3 4 5 6 7 8 9 10
Densidade
(no.ind.m
)
-2
0 2 4 6 8 10 12 14 16 18
0 10 20 30 40 50 60 70
0 10 20 30 40 50 60 70 80
1 2 3 3 5 6 7 8 9 10
± Desvio Padrão ± Erro Padrão
Biótopos
Densidade
(no.ind.m
)
-2
0 2 4 6 8 10 12
1 2 3 4 5 6 7 8 9 10
Biótopos
0 50 100 150 200 250
1 2 3 4 5 6 7 8 9 10
Ven da (56,67 ± 17,66 in d.m-2), e Baixio Mirim (121,50 ± 49,29
in d.m-2) (Fig. 1). No Baixio Mirim -lodo, foi registrado u m valor
de 29,92 ± 13,61 CPUE (Fig. 7).
Uca m ordax ocorreu exclu sivam en te n as estações com salin id ad es b aix as d a Baía d e G u arat u b a (C h ap eu zin h o e Guaxum a). Uca burgersi, U. rapax, U. thayeri e U. uruguayensis ocorreram de m odo con stan te em m ais de três estações de
cole-ta, m ostran d o u m a ten d ên cia ao eu rih alism o: as salin id ad es m édias n estas estações variaram am plam en te, de 7,92 ± 3,78 (Gu axu m a) a 23,64 ± 4,25 (Rio Fu n d o ). Po r o u t ro lad o , U. leptodactyla e U.m aracoani foram espécies con stan tes som en te em biótopos com salin idades m édias superiores a 20,00 (Fig. 7). Espécie con stan te e exclusiva de Ch apeuzin h o (Fig. 8), U. m ordax ocorreu com den sidades m áxim a e m édia de 15,50 in d.m-2
Figura 8. Baía de Guaratuba. Freqüência relativa das espécies de Uca que ocorreram nos dez biótopos estudados.
Chapeuzinho
100,00%
Uca mordax
Baixio Mirim-Lodo
100,00%
Uca maracoani
Guaxuma
25,46% 10,43% 4,91%
24,85%
34,36%
Uca rapax Uca uruguayensis Uca thayeri Uca burgersi Uca mordax
Ponto de Venda-Areia
5,70% 3,36%
38,93% 52,01%
Uca leptodactyla Uca burgersi Uca uruguayensis Uca rapax
Ilha das Garças
33,77%
18,18% 3,90% 44,16%
Uca uruguayensis Uca thayeri Uca maracoani Uca rapax
Ponto de Venda-Marisma
6,81%
3,14% 10,47%
20,16% 59,42%
Uca uruguayensis Uca leptodactyla Uca burgersi Uca rapax Uca thayeri
Baixio Mirim-Areia
97,48% 0,23% 2,29%
Uca leptodactyla Uca uruguayensis
Uca maracoani
Ponto de Venda-Manguezal
0,81% 1,61%
33,06%
64,52%
Uca thayeri Uca uruguayensis Uca leptodactyla Uca rapax
Baixio Mirim-Marisma
95,21% 4,62% 0,17%
Uca leptodactyla Uca uruguayensis
Uca rapax
Rio Fundo
14,23% 1,08% 0,18%
36,04%
48,47%
Uca rapax Uca uruguayensis Uca leptodactyla Uca burgersi
e 9,98 ± 3,71 in d.m-2, respectivam en te (Fig. 7). Foram avistadas
populações adultas em altas den sidades à m argem do Rio Un ião em pon tos à m on tan te do local de coleta (Fig. 2). Em Guaxum a, ela foi en con trada esporadicam en te e com den sidade m édia de 0,33 ± 0,81 in d.m-2 (Fig. 7). Esta espécie ocorreu som en te n as
estações com salin idades m édias abaixo de 8 (Fig. 6).
Ucarapax ocorreu em sete biótopos, porém , com m aio-res den sidades e de m odo con stan te som en te em Gu axu m a, n os Biótopos 7 e 8 do Pon to de Ven da e n o Rio Fu n do, com valores m édios de 2,33 ± 1,87 in d.m-2, 3,33 ± 4,92 in d.m-2, 4,33
± 4,89 in d.m-2 e 5,60 ± 3,76 in d.m-2, respectivam en te. Nestes
biótopos, os solos foram classificados com o areia fin a ou m u i-to fin a e grau de seleção q u e variou de m u ii-to pobrem en te a bem selecion ado. A esp écie foi registrada esp oradicam en te e em baixas den sidades ain da n os Biótopos 3, 5 e 9 (Fig. 7).
Ucathayeri foi con stan te em q u atro biótopos e esporádi-ca n o Rio Fu n d o. As d en sid ad es m áxim a d e 10,00 in d .m-2 e
m édia de 2,00 ± 3,07 in d.m-2 foram registrad as n o Pon to d e
Ven da-m arism a. En tretan to, foi n o Pon to de Ven da-m an gu ezal q u e a esp écie foi d om in an te (m éd ia d e 1,67 ± 1,35 in d .m-2)
(Fig. 8). Ocorreu ain da em Gu axu m a (1,69 ± 2,24 in d.m-2) e n a
Ilh a das Garcin h as (0,54 ± 0,73 in d.m-2). O solo dos biótop os
de ocorrên cia desta espécie m ostrou as m aiores porcen tagen s de m atéria orgân ica (de 6,51% a 14,74%) e p orcen tagen s de silte+argila su periores a 15% (Figs 6 e 8).
Com forte predom in ân cia n o Pon to de Ven da-m arism a, on de o teor de m atéria orgân ica foi dos m ais altos (10,43%), Ucauruguayensis foi a terceira espécie m ais abu n dan te. Atin giu u m a den sidade m áxim a de 84,00 in d.m-2 e m édia de 38,10 ±
21,19 in d.m-2 n este biótopo. Presen te em oito biótopos e con
s-tan te em sete, n ão foi registrada som en te em Ch apeu zin h o e n o Baixio Mirim -lodoso. Em Gu axu m a e Rio Fu n do foi regis-trada em oito dos doze m eses de coleta, em bora com den sida-des m édias abaixo de 7 in d.m-2 (Fig. 7). Esta espécie, q u ase sem
-pre dividiu o esp aço com U.leptodactyla.
Ucaleptodactyla foi a espécie m ais n u m erosa, cu jas den si-dades m áxim a de 240,00 in d.m-2 e m éd ia d e 141,83 ± 50,26
in d.m-2 foram obtidas n o Baixio Mirim -areia, on de a
participa-ção da fraparticipa-ção areia foi de 100% (Tab. I e Fig. 6). Neste biótopo, a esp écie d ivid iu o esp aço co m o s raro s in d ivíd u o s d e U. uruguayensis, form an do exten sas áreas aren osas repletas de ori-fícios (Fig. 3). Dom in ou n os biótopos de solos aren osos com ou sem gram as m arin h as, tan to n o Baixio Mirim com o n o Pon to d e Ven d a, com exceção d o P.V.-m arism a on d e a esp écie foi su bd om in an te. O correu , ain d a d e m od o esp orád ico n o Rio Fu n do (m édia de 1,65 ± 2,59 in d.m-2) e n o P.V.-m an gu ezal (0,04
± 0,14 in d.m-2). O solo dos biótopos de dom in ân cia desta
espé-cie variou de areia fin a a areia m u ito fin a, com baixos teores de m atéria orgân ica (Figs 6 e 8).
Ucam aracoani foi u m a espécie con stan te e exclu siva n o Baixio Mirim -lodo (Fig. 8), n u m terren o con tígu o ao biótop o d e d om in ân cia d e U. leptodactyla, on d e atin giu a d en sid ad e m áxim a de 59,00 CPUE e m édia de 29,92 ± 13,61 CPUE. Este
biótopo foi classificado com o solo de areia m u ito fin a, pobre-m en t e selecio n ad o e co pobre-m b aixo t eo r d e pobre-m at éria o rgân ica (1,66%). Ocorrên cia n ão con stan te ain da foi registrada n a Ilh a das Garcin h as e Baixio Mirim -areia (Fig. 7).
Ucaburgersi foi u m a espécie con stan te e su bdom in an te, com den sidades m áxim a e m édia de 96,0 in d.m-2 e 38,43 ± 32,92
in d.m-2, respectivam en te, n o Pon to de Ven da-areia/ lodo, n u m
solo classificado com o areia m u ito fin a, m u ito pobrem en te se-lecion ado, com a m en or porcen tagem da fração areia (69,99%), e baixo teor de m atéria orgân ica (2,96%) (Tab. I). Foi con stan te ain da, em m arism as desta estação de coleta (m édia de 6,67 ± 7,30 in d.m-2) e em Gu axu m a (0,71 ± 1,07 in d.m-2), porém , n o
Rio Fu n do foi esp orádica (Fig. 7).
DISCUSSÃO
Den tre as espécies de Uca registradas n o presen te traba-lh o, U.burgersi, U.leptodactyla,U. rapax e U.thayeri são con si-d erasi-d as t ip icam en t e caribean as (BARNW ELL 1986), U. m ordax com o su l-am erican a con tin en tal e U.uruguayensis com o a m ais m eridion al do Atlân tico Ociden tal (CRANE 1975). Portan to, o litoral d o Estad o d o Paran á abriga u m a assem bléia m ista d e Uca de origen s diversificadas.
A m aioria das espécies en con tradas n a Baía de Gu aratu ba tem o litoral do Estado de São Pau lo, Paran á ou San ta Catarin a com o o lim ite su l de su a distribu ição geográfica. Som en te U. uruguayensis ocorre n o Atlân tico Ociden tal, do Rio de Jan eiro até Argen tin a (MELO 1996). U. burgersi e U. m ordax tiveram o seu lim ite de distribu ição su l esten dido para o Estado do Paran á. Das seis espécies de Uca citadas para o Estado do Paran á por MELO (1996), som en te Ucavocator (Herbst, 1804) n ão foi obtida n o presen te estu do. En tretan to, am ostragen s m ais abran gen tes em biótop os d istan tes d a boca d a baía p od erão con firm ar a existên cia desta espécie, pois, segu n do o m esm o au tor, ela pode ocorrer rio acim a, além dos lim ites dos m an gu ezais. Estes fatos ressalt am a n ecessid ad e d e t rab alh o s d escrit ivo s d a fau n a carcin ológica do litoral do Estado do Paran á.
A sim patria parece ser a form a m ais geral de ocorrên cia dos ch am a-m arés n o Atlân tico Ociden tal. Dos trabalh os sobre d istribu ição d e Uca realizad os n o litoral leste d as Am éricas, RINGOLD (1979) cita três espécies para o litoral da Carolin a do Norte, Estados Un idos (37º47’N), THURMAN (1984) cin co esp éces n o Golfo do México (n orte do México e Texas, Estados Un i-dos 22-29ºN), BARNW ELL (1986) seis espécies n a Jam aica, Mar do Caribe (22-23°N) e THURMAN (1987) on ze esp écies n o Golfo do México, litoral atlân tico do México (18-26ºN). Esta diferen ça n a diversidade de espécies con firm a, em parte, a afirm ação de CRANE (1975) de q u e os ch am a-m arés são caran gu ejos essen cialm en te tropicais. O n ú m ero de espécies registradas n o presen -te estu do (se-te) coloca o litoral do Estado do Paran á den tre os de m aior diversidade de espécies apesar de su a localização bem distan te dos tróp icos (25º50’-25º54’S).
d a tem p eratu ra absolu ta d iu rn a d o ar observad a (13,00ºC a 35,00ºC) n ão foi lim itan te para as atividades vitais com o ali-m en tação. As teali-m peratu ras ali-m ín iali-m as absolu tas do ar de 8,30ºC registradas n o in vern o e in ício de prim avera (SIMEPAR), pro-vavelm en te, ocorreram du ran te a m adru gada e, n esta ocasião, os ch am a-m arés estiveram sob o abrigo das profu n didades das tocas, on de as tem peratu ras são m ais am en as e estáveis. Em bo-ra os dados de tem pebo-ratu bo-ra do solo ten h am sido tom ados so-m en te du ran te o dia, o valor so-m ín iso-m o de 18,50ºC registrado eso-m ju lh o, a 20 cm de profu n didade n a Estação Rio Fu n do n ão su s-ten ta a su posição de CRANE (1975) de q u e as espécies verdadei-ram en te tropicais m orrem con geladas n as regiões su btropicais e tem peradas q u en tes com o n a Flórida e n o Rio de Jan eiro. Por ou tro lado, altas tem peratu ras do ar são m ais toleradas pelas espécies tropicais, as q u ais n ão alteram as su as atividades m es-m o às tees-m peratu ras de 42 a 44ºC; en tretan to 45ºC é letal para todos os ch am a-m arés (CRANE 1975). Na Baía de Gu aratu ba, a tem peratu ra m áxim a do ar de 35,00ºC está lon ge de ser letal m esm o para os an im ais n ão-tropicais com o U. uruguayensis; a favor desta h ipótese, a referida espécie foi de ocorrên cia con s-tan te em sete dos dez biótopos exam in ados (Fig. 8).
A estabilidade térm ica observada n as profun didades das tocas n a Baía de Guaratuba parece ser um padrão n atural e un i-versal. Em estudo detalh ado sobre m icroclim a de tocas de ch a-m a-a-m arés ocorren tes n a Ilh a Mustan g, Texas, Estados Un idos, POWERS & COLE (1976) m ediram a tem peratura do in terior das m esm as duran te um ciclo de 24 h oras e obtiveram um a variação de 29 a 34ºC à profun didade de 20cm , e de 27 a 41ºC n a super-fície e, portan to, um a am plitude de 5ºC n a profun didade e de 14ºC n a superfície. Assim , a estabilidade térm ica n as profun di-dades das tocas se faz presen te tan to n um ciclo diário com o an ual (n o presen te estudo, 9,50ºC de am plitude de variação a 20cm de profun didade e de 19,00ºC n a superfície) (Fig. 5).
A presen ça de vegetação in flu en cia diretam en te a tem -p erat u ra d o so lo e d o in t erio r d as t o cas d o s ch am a-m arés. Marism as den sas oferecem su perfícies m ais frescas de até 10ºC q u an do com paradas com su perfícies descobertas: u m fator q u e in du z Ucapanacea Novak & Salm on , 1974 a desen volver a m ai-oria das atividades diu rn as e de escavação perto destas plan tas (POW ERS & COLE 1976). Os biótopos vegetados de m arism as n o Baixio Mirim e n o Pon to de Ven da ilu stram u m a situ ação se-m elh an te à citada pelos au tores acise-m a, porése-m , as popu lações de U.leptodactyla estão m ais den sas n as áreas descobertas, in di-can do qu e, m esm o du ran te o dia, estes an im ais n ão n ecessi-tam de su bstratos som breados. Portan to, a procu ra de abrigo em locais som breados deve ocorrer som en te em clim as de tem -peratu ras extrem as com o é o caso da Ilh a Mu stan g, Texas, Esta-d os Un iEsta-d os, on Esta-d e a tem p eratu ra n a su p erfície Esta-d o solo p oEsta-d e ch egar a 40,6ºC ou m ais (POW ERS & COLE 1976). No p resen te estu do, o Baixio Mirim -areia poderia apresen tar u m a tem pera-tu ra n a su perfície do solo de até 37,60ºC (valor m áxim o absoluto registrado para Guaxum a duran te um dos m eses m ais quen -tes e n u m h orário p róxim o ao m eio-dia), u m valor q u e n ão
obrigaria os U. leptodactyla a realizar m igrações p ara as áreas vegetadas ou escavar tocas preferen cialm en te n estes locais. Em con dições de tem peratu ras altas in su portáveis n a su perfície, o refú gio n as profu n didades das tocas parece ser a estratégia m ais p rovável d estes caran gu ejos. Por ou tro lad o, estu d os fu tu ros p od erão m ostrar q u e p op u lações d e id ad es d iferen tes d e U. leptodactyla podem ocupar espaços diferen tes (vegetados ou n ão) com o registrou RINGOLD (1979) em p op u lações de Uca pugnax (Sm ith , 1870) e Ucam inax (Le Con te, 1855) de diferen tes ta-m an h os e h abilidades diversificadas eta-m fazer escavações en tre as raízes d as vegetações em p rad arias salgad as d o litoral d a Carolin a do Norte, Estados Un idos.
Ain da, NOBBS (2003) sugere que a som bra das árvores, m ais do que a estrutura arquitetural da superfície ou subsuperfície do solo, in flui diretam en te n a distribuição das três espécies de Uca ocorren tes n os m an guezais da Austrália. Em experim en tos reali-zados em laboratório, Ucasignata (Hess, 1865) e Ucaflam m ula (Cran e, 1975) são atraídas pela som bra, en quan to Ucaelegans (George & Jon es, 1982) a evita; isto sugere que a vegetação n ão oferece suporte para escavação das tocas ou refúgio con tra pre-dadores para qualquer destas espécies. Com o U. elegans utiliza sin ais visuais m ais do que as outras duas, ela evita h ábitats vege-tados, pois, estes prejudicariam a visibilidade. Para as outras duas espécies, a som bra da vegetação assegura um idade e tem peratu-ra m ais am en a, um a con dição m en os estressan te do que em áre-as expostáre-as ao sol. Com exceção de U.uruguayensis que m ostrou preferên cia por biótopos de m arism as, as espécies registradas em m ais de três biótopos diferen tes n a Baía de Guaratuba n ão m os-traram qualquer preferên cia quan to à presen ça de cobertura ve-get al; aliad o a est e fat o r, co m o n ão se co n h ece a b io lo gia com portam en tal das espécies registradas, n ão se pode in terpre-tar plen am en te o papel do som bream en to do biótopo com a presen ça de vegetação. Quan to à lum in osidade, a am plitude ob-servada n a Baía de Guaratuba (1.400 a 184.000 lux) foi adequa-da para as ativiadequa-dades dos ch am a-m arés fora adequa-da toca. A in ten siadequa-da- sida-de lum in osa esteve estreitam en te relacion ada com as con dições clim áticas do dia da coleta m ais do que com o som bream en to do biótopo pelas copas das árvores ou arbustos. Assim , estações de coleta som breadas com o o Ch apeuzin h o n em sem pre m ostraram lum in osidades m édias m en ores do que o Baixio Mirim -areia on de n ão h avia qualquer vegetação para am en izar a in so-lação. Os altos valores registrados em Guaxum a, n o en tan to, podem ser en ten didos com o um a con jun ção de dois fatores de aum en to de lum in osidade: ausên cia de vegetação que produz som bra e a h ora do dia em que as m edidas foram tom adas, qua-se qua-sem pre perto do m eio-dia (Fig. 5). En tretan to, um estudo es-pecífico poderá avaliar a h ipótese de que, ch am a-m arés da Baía de Guaratuba n ecessitam de lum in osidade in ten sa para as ativi-dades de acen o sexual dos m ach os, com o já descrito por CRANE (1975) para outras espécies de Uca.
30 du ran te a m aré vazan te. En tretan to, os valores obtidos pelo referido au tor foram sem pre m en ores do q u e a m édia registra-da para caregistra-da estação de coleta do presen te estu do. Na Ilh a registra-das Garcin h as, por exem plo, foi observada u m a am plitu de de vari-ação de 13 a 28, en q u an to o au tor acim a citou a ilh a en tre as isoh alin as de 12 e 21. Esta diferen ça n os valores, provavelm en -te, deve estar relacion ada com a data de coleta das am ostras de águ a feita em 1951: fin al de ou tu bro e in ício de n ovem bro e, portan to, época de in ício das ch u vas. Com o au m en to da va-zão d os rios d ecorren te d a m aior freq ü ên cia d e p recip itação n as en costas da serra, deve ter h avido u m a dilu ição das águ as da baía. Por ou tro lado, com o JAKOBI (1953) n ão am ostrou as águ as do Rio Fu n do, u m a com paração da salin idade desta esta-ção fica in viabilizada.
CRANE (1975) su gere u m a distribu ição diagram ática n u m a situ ação h ipotética de ocorrên cia de u m espectro com pleto de Uca n u m litoral tropical, em relação ao gradien te de salin idade (da m ais baixa para m ais alta): U.m ordax, U.vocator, U.burgersi, U.rapax, Ucam ajor (Herbst, 1782) Ucacum ulanta Cran e 1943, U.thayeri, U.m aracoani e U.leptodactyla. En tretan to, a própria au tora adm ite q u e tal distribu ição raram en te poderia ocorrer devido às con figu rações com plexas das praias e dos estu ários e das n ecessidades ain da descon h ecidas das esp écies com rela-ção aos biótopos. Por esta razão, três ou m ais espécies do refe-rid o esp ectro com p leto estarão sem p re faltan d o. Na Baía d e Gu aratu ba, esta seq ü ên cia foi observada praticam en te n a ín te-gra: som en te U.vocator, U.m ajor e U.cum ulanta estiveram au -sen tes, ten do sido su bstitu ídas por U.uruguayensis (Fig. 7).
O eu rih alism o d en t re o s ch am a-m arés é am p lam en t e con h ecido (CRANE 1975), sen do Ucalongisignalis Salm on & Atsai-des, 1968 e Ucasubcylindrica (Stim pson , 1859), am bas ocorren tes n as regiões sem i-áridas do Texas, EUA, as qu e su portam as m ai-ores variações de salin idade observadas em laboratório: de 2,0 a 90,0 e de 0,08 a 110,0, respectivam en te (RABALAIS & CAMERON 1985). Foi observado que n os h ábitats on de vive U.subcylindrica, a referida am p litu de de salin idade é u m a realidade devido à forte ten dên cia à evaporação da águ a n os am bien tes sem i-ári-dos do Texas, Estai-ári-dos Un ii-ári-dos (THURMAN 1984). En tretan to, es-tes an im ais estão sob in flu ên cia de vários fatores estabilizadores de salin idade, sen do o m ais im portan te a fraca dren agem da águ a den tro das tocas. Um resu ltado desta con dição é q u e os sais são m an tidos n o su bstrato e, portan to, a águ a da toca é n otadam en te m ais salgada do qu e as águ as tidais qu e flu em n a área. Portan to, q u an do os ch am a-m arés descem p ara as su as tocas para u m edecer su as brân q u ias, eles o fazem com águ a de alta salin idade, e assim con servam su a própria n ecessidade de sais. En tretan to, a am plitu de de tolerân cia é específica para cada esp écie (CRANE 1975). No p resen te trabalh o, as esp écies com ten dên cia ao eu rih alism o – U.burgersi, U.rapax, U.thayeri e U. uruguayensis – certam en te, possu em à disposição fatores de es-tabilização de salin idade sem elh an tes aos citados acim a.
A com posição gran ulom étrica do solo em con jun ção com o teor de m atéria orgân ica e presen ça de m arism as con stituiu a
m elh o r exp licação p ara a d ist ribu ição esp acial d as esp écies eurih alin as da Baía de Guaratuba. A con sistên cia das paredes das tocas estaria relacion ada com a com posição gran ulom étrica do solo, a dispon ibilidade de alim en to com o teor de m atéria orgân ica e a presen ça de m arism as com a am en ização das tem -peraturas extrem as diurn as. Assim , U.thayeri esteve in tim am en -te relacion ada com altos -teores de m atéria orgân ica em solos co m alt as p o rcen t agen s d e silt e+argila, ao p asso q u e, U. uruguayensis ocorreu in discrim in adam en te em todas as com po-sições gran ulom étricas, porém foi dom in an te em solos m ovediços de m arism as e alto teor de m atéria orgân ica (Pon to de Ven -da-m arism a). A afin idade desta espécie com h ábitats de m arism as é reportada tam bém por SPIVAKetal. (1991) n os m ares da Argen -tin a, on de n ão h á tam pouco m an guezais. Em con traste com esta últim a espécie, U. burgersi m ostrou dom in ân cia em solos com alta porcen tagem de silte+argila, porém , desprovido de vegeta-ção (Pon to de Ven da-areia/lodo). Já U. rapax m ostrou a m aior versatilidade em ocupar substratos com diversas características, corroboran do os trabalh os de THURMAN (1984, 1987) realizados n o Golfo do México. En tretan to, n a Baía de Guaratuba, a espé-cie preferiu biótopos com salin idades m ais altas: a den sidade m áxim a observada n o Rio Fun do fun dam en ta esta h ipótese.
Preferên cia por biótopos de salin idades m ais altas obser-vada em U.leptodactyla e U.m aracoani é bem con h ecida, aliada sobretu do com solos aren osos para a prim eira espécie e com solos lodosos perto dos m an gu ezais e n ão den tro dos m esm os para a segu n da (CRANE 1975, BARNW ELL 1986, THURMAN 1987). O teor de m atéria orgân ica foi baixo em am bos os biótopos de dom in ân cia das m esm as, o q u e dificu lta a explicação da exis-tên cia de tam an h a m u ltidão de caran gu ejos (Figs 3 e 4). Pes-qu isas recen tes têm revelado Pes-qu e a Pes-qu an tidade de m atéria or-gân ica, por con stitu ir alim en to dispon ível, in flu i n o n ú m ero de an im ais e n a reprodu ção das popu lações de Uca do litoral do Estado de São Paulo (COLPO & NEGREIROS-FRANSOZO 2003, BENETTI & NEGREIRO S-FRANSO ZO 2004, CASTIGLIO NI & NEGREIRO S-FRANSO ZO 2004), e n o ritm o rep rodu tivo de Ucalactea (de Haan , 1835) n a costa oeste da Coréia do Su l (KIM & CHOE 2003).
A sim patria en tre U.leptodactyla e U.uruguayensis é cita-d a p o r CRAN E (1975), p o rém a co -o co rrên cia n u m m esm o biótopo era descon h ecida. En tretan to, U.leptodactyla se m os-t ro u m a is a d a p os-t a d a a o s so lo s a ren o so s, a o p a sso q u e U. uruguayensis aos solos m ais lodosos (Figs 7 e 8), con cordan do com as descrições dos biótopos feitas pela au tora acim a.
A associação e a partição de recu rsos en tre du as ou m ais espécies de ch am a-m arés n u m m esm o m icroh ábitat parece ser m ais com u m do q u e a ocorrên cia de espécies exclu sivas. CRANE (1975) cita sim p atria ou co-ocorrên cia d e tod as as esp écies registradas n o presen te estu do com várias espécies. Adicion al-m en te, THURMAN (1984) registra a co-existên cia de cin co esp éci-es in clu in do U.rapax n o costa su l do Texas, Estados Un idos e THURMAN (1987) descreve, em três diferen tes biótopos, a co-ocor-rên cia de seis a sete espécies in clu in do U.burgersi, U.rapax, U. thayeri e U.leptodactyla n a costa leste do México. Esta observação pode in dicar q u e as espécies de ocorrên cia exclu siva possu -em adaptações especiais para con dições estressan tes do biótopo. Na Baía de Gu aratu ba, U.m ordax m ostrou ser u m a espécie ca-paz de viver em águ as con tin en tais, u m a con dição estressan te, já q u e os ch am a-m arés são de origem m arin h a. Por ou tro lado, as den sas popu lações de U.m aracoani e U.leptodactyla, in dica-ram h abilidade em viver em solos (lodoso e aren oso, respecti-vam en te) m u ito pobres em m atéria orgân ica. Su sten tam esta ú ltim a assu n ção, a diversidade de esp écies observada n o Rio Fu n do, on de o solo foi aren oso, porém , rico em m atéria orgâ-n ica, e em Gu axu m a oorgâ-n de foi registrado o m aior teor de m até-ria orgân ica em solo lodoso (Tab. I).
Das espécies registradas para a Baía de Gu aratu ba, a lite-ratu ra con tem pla som en te dados de den sidade de U.rapax para o litoral do Golfo do México: de 30 in d.m-2 para o su l do Texas,
Estados Un idos (THURMAN 1984), e de 7 a 15 in d.m-2 para o Mé-xico (THURMAN 1987). Os valores obtidos para Gu aratu ba (0,06 a 16,0 in d.m-2, v. Fig. 7) estão m ais próxim os da ú ltim a
locali-dade, talvez pela distân cia eq u ivalen te em relação aos respecti-vos Trópicos.
A dom in ân cia n u m érica de U.leptodactyla parece ser ca-racterística d a Baía d e Gu aratu ba, p ois, CRANE (1975) cita U. rapax com o a m ais n u m erosa em regiões tropicais, den tro do espectro com pleto e h ipotético das n ove espécies de Uca acim a m en cion ad o.
São con h ecidas altas den sidades para Ucaannulipes (H. Miln e Edwards, 1837) da Tan zân ia, África, com 77,8 in d.m-2
(SKOV & HARTNOLL 2001), p ara Ucapugilator (Bosc, 1802) do lito-ral da Carolin a do Norte, Estados Un idos, com até 65,0 in d.m-2
(COLBY & FONSECA 1984) e para Ucapanacea (Novak & Salm on , 1974) e Ucasubcylindrica (Stim pson , 1859), am bos proven ien -tes do su l do Texas, n o Golfo do México, com 30,0 in d.m-2 e
25,0 in d.m-2, respectivam en te (THURMAN 1984). Em bora dados
de den sidade de U.leptodactyla n ão estejam dispon íveis n a lite-ratu ra, o valor m áxim o de 240,00 in d.m-2 observado n o Baixio
Mirim -areia em n ovem bro de 2003 é o m ais alto já registrado. Esta discrepân cia en tre os valores de den sidade de U.leptodactyla
e d as d em ais esp écies ocorren tes em ou tras regiões p od e ser atribu ída, em parte, ao tam an h o atin gido pelas m esm as. Uca leptodactyla é u m a das espécies com m en or largu ra de carapaça (CRANE 1975), cu jo m ach o atin ge, n o m áxim o, 11,5m m n as po-pu lações do litoral de San ta Catarin a (MASUNARI & SW IECH-AYOUB 2003), perm itin do a co-existên cia de u m a den sa m u ltidão de caran gu ejos peq u en os. Já para os ch am a-m arés citados, CRANE (1975) registra largu ra m áxim a da carapaça dos m ach os de 19,0 m m para U. annulipes, 21,0 m m para U. pugilator e 18,5 m m p a ra U. su b cy lin d rica . A lit era t u ra n ã o co n t em p la d a d o s m orfom étricos de U.panacea.
De u m a form a geral, a alta diversidade de espécies de Uca está relacion ada com a diversidade arq u itetu ral dos biótopos existen tes n a Baía de Gu aratu ba, cu ja com plexidade estru tu ral é con ferida pela presen ça de vegetação e diferen tes com posições gran u lom étricas do solo. Aliado a estes fatores, o gradien -te de salin idade e a am pla variação n a qu an tidade de m atéria orgân ica do solo perm itiram q u e estes biótopos abrigassem as-sem bléias distin tas de ch am a-m arés. Mais do q u e n o in terior dos m an gu ezais, as altas den sidades de ch am am arés são en -con tradas em áreas a eles associadas, as q u ais recebem radiação solar d ireta, o q u e en fatiza a n ecessid ad e d e p reservar, tam -bém , su bsistem as ocorren tes n as vizin h an ças dos m an gu ezais. Estes su bsistem as, certam en te, devido à proxim idade com os m an gu ezais, recebem dos m esm os n u trien tes n ecessários para abrigar den sas popu lações de caran gu ejos.
AGRADECIMENTOS
Ao CNPq (Processo No 302194/ 83-5), Sim ep ar, Ju arez Fo n t an elli (En gefo t o ), Gu st avo Au gu st o Sch m id t d e Melo (MZUSP), Tereza C. dos S. Calado (UFAL), os acadêm icos ex-bolsistas do PIBIC/ CNPq-UFPR, Nadia Dissen h a, Rafael Carva-lh o Falcão, Massilon de Oliveira Astarita Ju n ior e Vitor San ch es, Jéferson Alexan dre da Silva e An dré Fon tan elli.
REFERÊNCIAS BIBLIOGRÁFICAS
ACIESP. 1997. Glo ssário deeco lo gia. São Pau lo, Palas Ath en a, 2ª ed., 352p.
BARNW ELL, F.H. 1986. Fiddler crabs of Jam aica (Decapoda, Bra-ch yu ra, Ocypodidae, Gen u s Uca). Crustacean a, Leiden , 5 0
(2): 146-165.
BENETTI, A.S. & M.L. NEGREIROS-FRANSOZO. 2004. Relative growth of Ucaburgersi (Cru stacea, Ocypodidae) from two m an groves in th e sou th eastern Brazilian coast. Ih erin gia, Série Zo o lo -gia, Porto Alegre, 9 4 (1): 67-72.
CASTIGLIONI, D.S. & M.L. NEGREIROS-FRANSOZO. 2004. Com parative an alysis of th e relative growth of Ucarapax (Sm ith ) (Crustacea, Ocypodidae) from two m an groves in São Paulo, Brazil. Re-vistaBrasileiradeZo o lo gia, Curitiba, 21 (1): 137-144. CHIUSSI, R. & H. DÍAZ. 2001. Mu ltiple referen ce u sage in th e zon al
COLBY, D.R. & M.S. FONSECA. 1984. Popu lation dyn am ics, spatial dispersion an d som atic growth of th e san d fiddler crab Uca pugilator. Marin e Eco lo gy Pro gress Series, Oden dorf, 1 6: 269-279.
CO LPO, K.D. & M.L. NEGREIRO S-FRANSO ZO. 2003. Rep ro d u ct ive output of Ucavocator (Herbst, 1804) (Brach yura, Ocypodidae) from th ree su btropical m an groves in Brazil. Crustacean a, Leiden , 7 6 (1): 1-11.
CRANE, J. 1975. Fid d ler crabs o f th e w o rld , Ocy p o d id ae: gen u s Uca . Prin ceton , Un iversity Press, 736p.
FOLK, R.L. & W.C. WARD. 1957. Brazos river bar: a stu dy in th e sign ifican ce of grain size param eters. Jo urn al o fSedim en -taryPetro lo gy, Tu lsa, 2 7: 3-26.
GENONI, G.P. 1985. Food lim itation in salt m arsh fiddler crabs Ucarapax (Decapoda, Ocypodidae). Jo urn alo fEx perim en -tal Marin e Bio lo gy an d Eco lo gy, Am sterdam , 8 7 (1): 97-110.
GENONI, G.P. 1991. In creased bu rrowin g by fiddler crabs Uca rapax (Sm ith ) (Decapoda: Ocypodidae) in respon se to low food su pply. Jo urn alo fEx perim en talMarin eBio lo gyan d Eco lo gy, Am sterdam , 1 4 7 (2): 267-286.
JAKOBI, H. 1953. Sôbre a distribu ição da salin idade e do pH n a Ba ía d e G u a ra t u b a . Arq u i v o s d o Mu se u Pa ra n a e n se, Cu ritiba, 1 0: 3-35.
KELLMEYER, K. & M. SALMO N. 2001. Hatch in g rh yth m s of Uca thayeri Rath bu n : tim in g in sem idiu rn al an d m ixed tidal re-gim es. Jo u rn al o f Ex p e ri m e n t a l Mari n e Bi o l o g y an d Eco lo gy, Am sterdam , 2 6 0: 169-183.
KIM, T.W. & J.C. CHOE. 2003. Th e effect of food availability on th e sem ilun ar courtsh ip rh yth m in th e fiddler crab Ucalactea (d e Haan ) (Brach yu ra: Ocyp od id ae). Beh av io ral Eco lo gy an d So cio bio lo gy, Heidelberg, 5 4: 210-217.
LACERDA, T.P. 1982. Aceleração do processo de m u da e m ortali-dade em Ucarapax Sm ith , 1870, apedu n cu lados (Cru stacea, Decapoda). Rev istaBrasileirade Bio lo gia, Rio de Jan eiro, 4 2 (2): 279-283.
LACERDA, T. P. & J.C. MCNAMARA. 1983. Colou r ch an ge in th e fiddler crab Ucauruguayensis Nobili (Decapoda Brach yu ra).
Crustacean a, Leiden , 4 5 (1): 48-52.
MAACK, R. 1968. Geo grafiafísicadoEstadodoParan á. Curitiba, Un iversidade Federal do Paran á, 350p.
MACIA, A.; I. QUINCARDETE & J. PAULA. 2001. A com p arison of altern ative m eth ods for estim atin g population den sity of th e fiddler crab Uca annulipes at Saco Man grove, In h aca Islan d (Mozam bique). Hydro bio lo gia, Dordrech t, 449: 213-219.
MASUNARI, S. &, N. DISSENHA. 2005. Alom etria n o crescim en to de Ucam ordax (Sm ith ) (Cru stacea, Decapoda, Ocypodidae) n a Baía d e Gu aratu ba, Paran á, Brasil. Rev ista Brasileira d e Zo o lo gia, Cu ritiba, 2 2 (4): 984-990.
MASUNARI, S. & B.P. SW IECH-AYOUB. 2003. Crescim en to relativo em Ucaleptodactyla Rath bu n (Cru stacea, Decapoda, Ocypo-didae). Rev istaBrasileiradeZo o lo gia, Curitiba, 2 0 (3): 487-491.
MASUNARI, S.; N. DISSENHA & R.C. FALCÃO. 2005. Crescim en to re-lativo e destreza dos q u elípodos de Ucam aracoani (Latreille) (Cru stacea, Decapoda, Ocypodidae) n o Baixio Mirim , Baía de Gu aratu ba, Paran á, Brasil. Rev istaBrasileira deZo o lo -gia, Cu ritiba, 2 2 (4): 974-983.
MCNAMARA, J.C. & G.S. MOREIRA. 1983. Ultrstru ctu re of crom a-toph ores from th e fiddler crab Ucarapax (Sm ith ) an d Uca uruguayensis (Nobili) (Decapoda, Brach yu ra). Crustacean a, Leiden , 4 4 (3): 300-309.
MELO, G.A.S. 1996. Man ual de id en tificação do sBrach y ura (c a ra n g u e jo s e si ri s) d o l i t o ra l b ra si l e i ro . São Pau lo , Plêiade/ FAPESP, 604p.
MELO, G.A.S.; V.G. VELOSO & M.C. OLIVEIRA. 1989. A fau n a de Brach yu ra (Cru stacea, Decap od a) d o litoral d o Estad o d o Paran á. Lista prelim in ar. Nerítica, Cu ritiba, 4 (1/ 2): 1-31.
MONTAGUE, C.L. 1980. A n atu ral h istory of tem perate western Atlan tic fiddler crabs (Gen u s Uca) with referen ce to th eir im pact on th e salt m arsh . Co n tributio n sinMarin eScien ce, Port Aran sas, 2 3: 25-55.
NEG REIRO S-FRAN SO ZO, M.L.; K.D. CO LPO & T.M. CO STA. 2 0 0 3 . Allom etric growth in th e fiddler crab Ucathayeri (Brach yu ra, O cyp o d id ae) fro m a su b t ro p ical m an gro ve. Jo u rn al o f Crustacean Bio lo gy, Lawren ce, 2 3 (2): 273-279.
NOBBS, M. 2003. Effects of vegetation differ am on g th ree species of fiddler crabs (Uca sp p .). Jo urn alo fEx perim en talMarin e Bio lo gy an dEco lo gy, Am sterdam , 2 8 4: 41-50.
OLIVEIRA, L.P.H. 1939. Con tribu ição ao con h ecim en to dos cru s-t á c e o s d o Rio d e Ja n e ir o . G ê n e r o Uca (D e c a p o d a : Ocypodidae). Mem ó riasdo In stitu to Osw aldo Cruz, Rio
de Jan eiro, 3 4 (1): 115-148.
POW ERS, L.W. & J.F. COLE. 1976. Tem peratu re variation in fiddler crab m icro h ab it at s. Jo u rn a l o f Ex p e ri m e n t a l Ma ri n e Bio lo gy an dEco lo gy, Am sterdam , 2 1: 141-157.
RABALAIS, N.N. & J.N. CAMERON. 1985. Ph ysiological an d m orph o-logical adap tation s of adu lt Uca subcylindrica to sem i-arid en viron m en ts. Bio lo gicalBulletin, Woods Hole, 1 6 8: 135-146.
RIEGER, P.J. 1997. Desen volvim en to larval de Uca (Minuca) m ordax (Sm ith , 1870) (Cru stacea, Decapoda, Ocypodidae) em labo-ratório. Trabalh o sOcean o gráfico sdaUFPE, Recife, 25: 227-267.
RINGOLD, P. 1979. Bu rrowin g, root m at den sity, an d th e distri-bu tion of fiddler crabs in th e eastern Un ited States. Jo urn al o fEx perim en talMarin eBio lo gyan dEco lo gy, Am sterdam , 3 6: 11-21.
ROBERTSON, J.R. & S.Y. NEW ELL. 1982. Experim en tal stu dies of par-ticle in gestion by san d fid d ler crab Uca pugilator (Bo sc).
Jo u rn al o f Ex p erim en tal Marin e Bio lo gy an d Eco lo gy, Am sterdam , 5 2: 1-21.
ROBERTSON, J.R.; J.A. FUDGE & G.K. VERMEER. 1981. Ch em ical an d live feedin g stim u lan ts of th e san d fiddler crab Ucapugilator (Bo sc). Jo u rn al o f Ex p e ri m e n tal Mari n e Bi o l o g y an d Eco lo gy, Am sterdam , 5 3: 47-64.
ROSENBERG, M.S. 2001. Th e system atics an d taxon om y of fiddler crabs: a ph ylogen y of th e gen u s Uca. Jo urn alo fCrustacean Bio lo gy, Lawren ce, 2 1 (3): 839-869.
SALMON, M. & G.W. HYATT. 1983. Spatial an d tem poral aspects of reproduction in North Carolin a fiddler crabs (Ucapugilator Bo sc). Jo u rn al o f Ex p e ri m e n t a l Ma ri n e Bi o l o g y an d Eco lo gy, Am sterdam , 7 0: 21-43.
SIEGEL, S. 1956. No n param etricstatistics. In tern ation al Studen t Edition . Tokyo, McGraw-Hill/ Kogaku sh a, 312p.
SKOV, M.W. & R.G. HARTNOLL. 2001. Com parative su itability of bin ocu lar observation , bu rrow cou n tin g an d excavation for th e quan tification of th e m an grove fiddler crab Ucaannulipes (H. Miln e Edwards). Hy d ro bio lo gia, Dordrech t, 4 4 9: 201-212.
SPIVAK, E.D.; M.A. GAVIO & C.E. NAVARRO. 1991. Life h istory an d stru ctu re of th e world¢s sou th ern m ost Uca popu lation s: Uca uruguayensis (Cru stacea, Brach yu ra) in Mar Ch iq u ita Lagoon (Argen tin a). Bulletin o fMarin eScien ce, Lawren ce, 4 4 (3): 679-688.
SUGUIO, K. 1973. In tro d u ç ão à se d im e n to lo g ia. São Pau lo ,
Edgard Blü ch er/ EDUSP, 317p.
SUG UIO, K. 2003 . Ge o l o g i a se d i m e n tar. São Pau lo , Ed gard Blü ch er, 400p .
THURMAN, C.L. 1984. Ecological n otes on fiddler crabs of sou th Texas, with special referen ce to Ucasubcylindrica. Jo urn al o fCrustacean Bio lo gy, Lawren ce, 4 (4): 665-681. THURMAN, C.L. 1987. Fiddler crabs (Gen u s Uca) of eastern Mexico
(Decapoda, Brach yu ra, Ocypodidae). Crustacean a, Leiden ,
5 3 (1): 94-105.
THURMAN, C.L. 1998. Evaporative water loss, corporal tem perature an d distribution of sym patric fiddler crabs (Uca) from south Texas. Co m parativeBio ch em istryan dPh ysio lo gyA, New York, 119 (1): 279-286.
VISCIDO, S.V. & D.S. WETHEY. 2002. Quan titative an alysis of fiddler crab flock m ovem en t: eviden ce for ‘selfish h erd’ beh aviou r.
An im alBeh av io ur, Lon don , 6 3: 735-741.
VON HAGEN, H.O. 1987. Morph ology an d wavin g display of a n ew species of Uca (Crustacea, Brach yura) from th e State of Espirito
San t o (Brazil). Mi tte i l u n g e n au sd e m Ham b u rg i sc h e n Zo o lo gisch enMuseum un dIn stitut, Ham burg, 84: 81-94.
YO DER, J.A.; K.A. REIN SEL; J.M. WELC H; D.M. CLIFFO RD & E.J. RELLINGER. 2005. Herdin g lim its water loss in th e san d fiddler cra b , Uca pu gila t or. Jo u rn a l o f Cru s t a c e a n Bi o l o g y, Lawren ce, 2 5 (1): 141-145.