0
UNIVERSIDADE ESTADUAL PAULISTA
"JULIO DE MESQUITA FILHO"
FACULDADE DE CIÊNCIAS FARMACÊUTICAS CÂMPUS DE ARARAQUARA
Programa de Pós-Graduação em Biociências e Biotecnologia aplicada à Farmácia
“
AVALIAÇÃO DOS EFEITOS FISIOLÓGICOS E BIOQUÍMICOS DO
TRATAMENTO COM CURCUMINA INCORPORADA AO IOGURTE NO
DIABETES EXPERIMENTAL
”
VÂNIA ORTEGA GUTIERRES
1
VÂNIA ORTEGA GUTIERRES
“
AVALIAÇÃO DOS EFEITOS FISIOLÓGICOS E BIOQUÍMICOS DO
TRATAMENTO COM CURCUMINA INCORPORADA AO IOGURTE NO
DIABETES EXPERIMENTAL
”
Dissertação de Mestrado no Programa de Pós-Graduação em Biociências e Biotecnologia aplicada à Farmácia da Faculdade de Ciências Farmacêuticas da Universidade Estadual “Julio
Mesquita Filho” câmpus de Araraquara como parte dos requisitos para o título de mestre em Biociências e Biotecnologia aplicada à Farmácia. Área de concentração: Bioquímica.
Orientador: Prof. Dr. Iguatemy Lourenço Brunetti
3
AVALIAÇÃO DOS EFEITOS FISIOLÓGICOS E BIOQUÍMICOS DO
TRATAMENTO COM CURCUMINA INCORPORADA AO IOGURTE NO
DIABETES EXPERIMENTAL.
COMISSÃO EXAMINADORA
_____________________________________________________________
Prof. Dr. Iguatemy Lourenço Brunetti Orientador e Presidente da Comissão Examinadora
_____________________________________________________________
Profa. Dra. Amanda Martins Baviera Membro Titular
_____________________________________________________________
Profa. Dra. Ana Angélica Henrique Fernandes Membro Titular
_____________________________________________________________
Profa. Dra. Maria Teresa Pepato Membro Suplente
_____________________________________________________________
5
Dissertação de Mestrado no Programa de Pós-Graduação em Biociências e
Biotecnologia aplicada à Farmácia da Faculdade de Ciências Farmacêuticas da
Universidade Estadual “Julio Mesquita Filho”
Câmpus de Araraquara como parte dos
requisitos para o título de mestre em Biociências e Biotecnologia aplicada à
Farmácia. Área de concentração: Bioquímica.
Trabalho desenvolvido no laboratório de Bioquímica Clínica do Departamento
de Análises Clínicas da Faculdade de Ciências Farmacêuticas
–
UNESP/Câmpus
Araraquara.
7 À Deus, que me concedeu sabedoria, inspiração, orientação, força e estímulo na escolha de minha vocação e foi amparo de minha dificuldade inicial quando minha família ficou longe em outra cidade. Fostes o amigo e confidente em minhas noites de solidão.
Aos meus heróis: meu pai Argemiro e minha mãe Neuza que me deram a vida e me ensinaram a vivê-lá com dignidade, iluminando meus caminhos e incentivando-me a seguir cheia de esperança, pois abriram as portas do meu futuro, consagrando-me com a luz mais brilhante que puderam encontrar: O ESTUDO. Vocês são juntos comigo os ganhadores desta conquista.
À minha irmã Lucilene e meu cunha Flávio pelos momentos de descontração, carinho, pela preocupação e pelo incondicional apoio, me incentivando sempre.
Ao Rodrigo, por sempre me apoiar e me incentivar com muito carinho e compreensão, dispensando muitas vezes de minha companhia para enfrentar minhas obrigações.
Á Cléo e Pechoto que incentivaram a realização deste sonho e pelas orações que me ajudaram muito ao longo desta minha caminhada.
Ao Prof. Dr. Iguatemy Lourenço Brunetti, por ser esta pessoa maravilhosa. Nunca medindo esforços para o meu aprendizado, sempre presente e exigente... obrigada por não adotar somente a postura de professor e sim ser um grande amigo e companheiro de trabalho, aceitando dividir com os livros a minha atenção e sempre me incentivando, meu maior respeito e agradecimento.
À Profª. Drª. Maria Teresa Pepato, por acreditar em mim e me ceder a oportunidade, por ser uma pessoa maravilhosa, dedicada, ética e sempre exigindo o melhor de nós.
A Profª. Drª. Regina Célia Vendramini, pelos ensinamentos.
A cabedal Clara Maria Pinheiro, pelo incondicional apoio, pelos momentos de descontração e por partilharmos do mesmo objetivo.
8 Aos amigos de laboratório: Renatinha, Juliana, Aline, Vanessa, Marciano, Ricardo, José Carlos, Flávia e Tânia pelos momentos de descontração e trabalho.
As estagiárias: Aline, Roberta, Tabata e Mayara pelo apoio e descontração.
Ao amigo Marcos Dangona, pelo carinho e compreensão, pelas incansáveis horas de conversas, pelo suporte técnico e por ser está pessoa tão especial e abençoada.
A Rosemira, pelo apoio, carinho e pelas maravilhosas horas de descontração.
9
RESUMO
A hiperglicemia é uma das características do Diabetes mellitus (DM) e a insulina e hipoglicemiantes orais têm sido utilizados em seu tratamento usual. Diversos trabalhos demonstram o efeito de produtos naturais na melhora da hiperglicemia e de suas conseqüentes complicações. A curcumina, um pigmento amarelo, extraído do rizoma da planta Curcuma longa L.
e incorporada em determinados veículos tem demonstrado efeito benéfico no diabetes experimental. Neste trabalho avaliamos os efeitos do tratamento crônico com curcumina incorporada em iogurte sobre as alterações nos parâmetros fisiológicos e bioquímicos do diabetes. Os animais diabéticos (STZ-40mg/kg peso corporal) e os animais controles (solução salina) foram pareados de acordo com os níveis glicêmicos e peso corporal, em 9 grupos (8 animais/grupo), os quais foram tratados duas vezes ao dia: por via intragástrica: água (DTH2O e CTH2O); iogurte (DTIOG e CTIOG); curcumina incorporada em iogurte, nas doses de 30, 60 e 90 mg/kg peso corporal/dia (DTC30, DTC60 e DTC90 e CTC90) e subcutaneamente com insulina (4U/dia) (DTI). O tratamento foi conduzido por 31 dias. Para todos os parâmetros analisados (ingestão alimentar e hídrica, volume urinário, peso corporal, glicemia, glicosúria, proteinúria, uréia urinária, aspartato e alanina aminotransferase e fosfatase alcalina) observamos que os grupos DTH2O, DTIOG e DTI foram significativamente diferentes, nos grupos DTH2O e DTIOG os parâmetros permaneceram alterados e no grupo DTI melhoraram, como esperado. Os grupos tratados com curcumina apresentaram melhorias significativas e concentração-dependentes, em relação aos grupos DTH2O ou DTIOG. A curcumina incorporada em iogurte e na maior concentração, demonstrou biodisponibilidade adequada para a ação anti-diabética; uma vez que levou a melhoria em todos os parâmetros avaliados.
10
ABSTRACT
The main well known consequence of diabetes mellitus (DM) is hyperglycemia, which is normally treated with insulin and/or oral hypoglycemic agents. A variety of studies has demonstrated the positive effects of diverse natural products on hyperglycemia and its clinical complications. Curcumin, the yellow pigment in the spice turmeric is extracted from the rhizome of Curcuma longa L. When added to certain food items, it has promoted a beneficial effect on experimental DM.
In this paper, we assessed the effects of prolonged treatment of diabetic rats with curcumin incorporated into yoghurt on the physiological and biochemical changes associated with DM. Diabetic animals (induced with 40mg STZ/kg bw, iv) and control animals (vehicle buffer, iv) were allocated to 9 groups of 8 animals each, matched for blood glucose level and body weight, which were treated by gavage twice a day for 31 days as follows: by gavage, with water (DTW, CTW), yoghurt (DTY,CTY) yoghurt supplemented with curcumin in doses 30, 60 and 90 mg/kg bw/day (DTC30, DTC60, DTC90 and CTC90) and by sc injection, with insulin at 4U/day (DTI). For every marker analyzed, the groups DW and DY became significantly different from DTI. In DTW and DTY, the DM-related changes observed in the markers remained or became worse, while in DI they improved, as expected. Curcumin-treated rats showed significant, dose-dependent improvements, relative to DTW or DTY. Curcumin, mixed into yoghurt at the highest dose tested, was sufficiently bioavailable to exhibit anti-diabetic activity, improving significantly all markers assessed in this study.
11
LISTA DE FIGURAS
Figura 1. Principais caminhos metabólicos no fígado no estado absortivo... 23
Figura 2. Reações catalisadas pelas transaminases AST e ALT durante o catabolismo dos aminoácidos... 25
Figura 3. Inter-relações teciduais no diabetes tipo 1 no metabolismo de lipídeos... 28
Figura 4. Mecanismos propostos para o estresse oxidativo no diabetes... 30
Figura 5. Mecanismos postulados de toxicidade pela estreptozotocina... 31
Figura 6. Estrutura molecular da curcumina, análogos naturais e principais metabólitos... 37
Figura 7. Efeito da curcumina em várias patologias... 38
Figura 8. Efeito da curcumina sobre o diabetes... 39
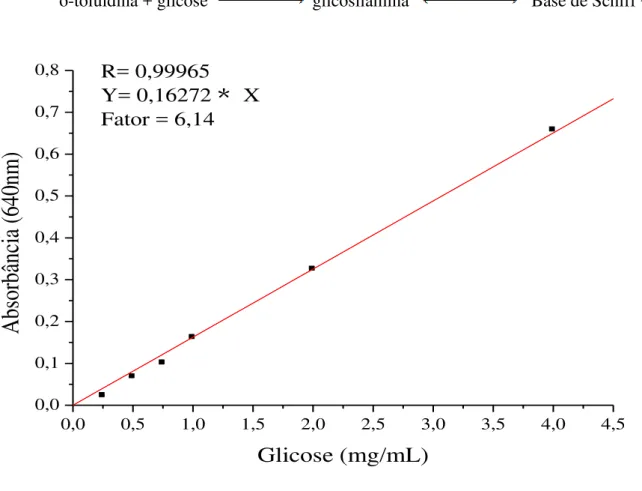
Figura 9. Curva analítica para a determinação da glicosúria... 51
Figura 10. Curva analítica para a determinação do glicogênio hepático... 52
Figura 11. Efeito do tratamento crônico com curcumina sobre o peso (g) de ratos diabéticos... 57
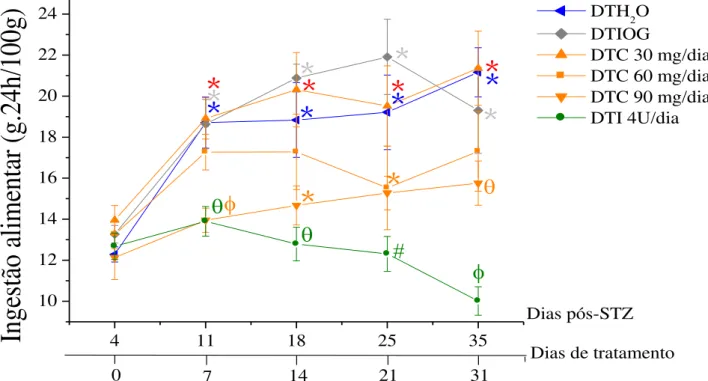
Figura 12. Efeito do tratamento crônico com curcumina sobre a ingestão alimentar (g.24h/100g) de ratos diabéticos... 58
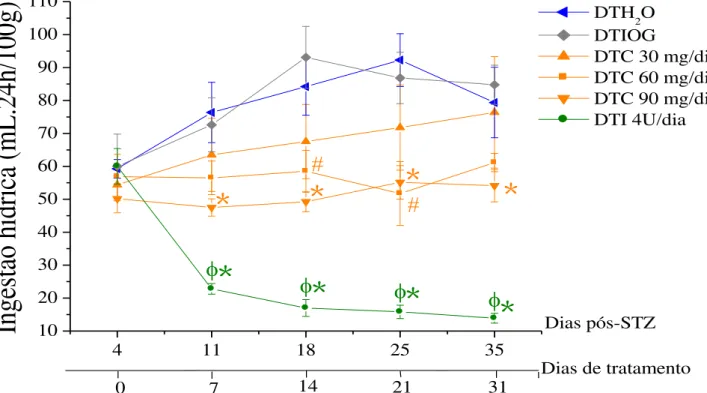
Figura 13. Efeito do tratamento crônico com curcumina sobre a ingestão hídrica (mL.24h/100g) de ratos diabéticos... 59
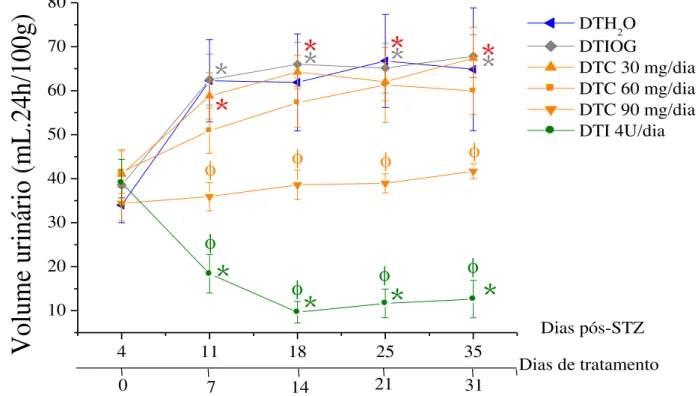
Figura 14. Efeito do tratamento crônico com curcumina sobre o volume urinário (mL.24h/100g)... 60
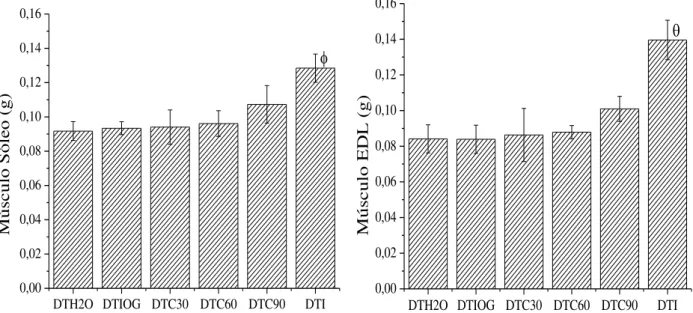
Figura 15. Efeito do tratamento crônico com curcumina sobre os músculos Sóleo e EDL (g) de ratos diabéticos... 61
Figura 16. Efeito do tratamento crônico com curcumina sobre as gorduras epididimal e retroperitonial (g/100g) de ratos diabéticos... 62
12
Figura 18. Efeito do tratamento crônico com curcumina sobre a glicosúria
(g.24h/100g) de ratos diabéticos... 67
Figura 19. Efeito do tratamento crônico com curcumina sobre a proteinúria
(mg.24h/100g) de ratos diabéticos... 68
Figura 20. Efeito do tratamento crônico com curcumina sobre a uréia urinária
(mg.24h/100g) de ratos diabéticos... 69
Figura 21. Efeito do tratamento crônico com curcumina sobre o triglicerídeos (mg/dL) de ratos diabéticos... 70
Figura 22. Efeito do tratamento crônico com curcumina sobre o colesterol (mg/dL) de
ratos diabéticos... 71
Figura 23. Efeito do tratamento crônico com curcumina sobre colesterol-HDL
(mg/dL) de ratos diabéticos... 72
Figura 24. Efeito do tratamento crônico com curcumina sobre o glicogênio hepático
(mg/100g) de ratos diabéticos... 73
Figura 25. Efeito do tratamento crônico com curcumina sobre ALT (U/L) de ratos
diabéticos... 77
Figura 26. Efeito do tratamento crônico com curcumina sobre AST (U/L) de ratos
diabéticos... 78
Figura 27. Efeito do tratamento crônico com curcumina sobre ALP (U/L) de ratos
13
LISTA DE TABELAS
Tabela 1. Valores médios de glicemia e peso corporal dos animais no 4º dia pós-STZ
(pareamento)... 45
Tabela 2. Parâmetros fisiológicos de ratos diabéticos obtidos durante 31 dias de
tratamento com curcumina (30,60 e 90mg)... 55
Tabela 3. Médias dos parâmetros bioquímicos de ratos obtidos durante 31 dias de tratamento com curcumina (30,60 e 90mg)... 75
Tabela 4. Médias dos parâmetros fisiológicos e bioquímicos de ratos não-
14
LISTA DE ESQUEMAS
Esquema 1. Fluxograma da preparação dos grupos de animais para o tratamento com curcumina... 45
Esquema 2. Fluxograma dos tratamentos dos animais, bem como das análises
15
LISTA DE ABREVIATURAS
AGE Glicação não-enzimática
ALP Fosfatase alcalina
ALT Alanina aminotransferase
AST Aspartato aminotransferase +CH
3 Íon carbênio
DM Diabetes mellitus
HDL Lipoproteína de alta densidade
IDL Lipoproteína de densidade intermediária LDL Lipoproteína de baixa densidade
O2●- Radical ânion superóxido
NO Óxido nítrico
SDH Sorbitol dehidrogenase
STZ Estreptozotocina
TAG Triacilgliceróis
16
SÚMARIO
RESUMO
ABSTRACT
LISTA DE FIGURAS
LISTA DE TABELAS
LISTA DE ESQUEMAS
LISTA DE ABREVIATURAS
1 INTRODUÇÃO... 19
1.1 Epidemiologia... 20
1.2 Fisiopatologia do diabetes mellitus... 20
1.3 Lipídeos e lipoproteínas no diabetes... 26
1.4 Estresse oxidativo e diabetes... 29
1.4.1 Via do Poliol... 29
1.4.2 Formação de produtos avançados de Glicação não-enzimática (AGE)... 29
1.5 Indução do diabetes experimental... 31
1.6 Tratamento da diabetes... 32
1.7 Alimentos funcionais... 34
1.8 Curcumina... 35
1.8.1 Biodisponibilidade da curcumina... 39
2 OBJETIVOS... 41
2.1 Geral... 42
2.2 Específicos... 42
3. MATERIAL E MÉTODOS... 43
17
3.2 Animais... 44
3.3 Indução da diabetes... 44
3.4 Preparo da suspensão de curcumina em iogurte... 44
3.5 Administração da insulina... 44
3.6 Tratamento crônico com curcumina nas doses de 30,60 e 90 mg/kg de peso corporal... 45 3.7 Métodos utilizados para dosagens séricas... 47
3.7.1 Glicemia... 47
3.7.2 Proteinúria... 48
3.7.3 Uréia urinária... 48
3.7.4 Colesterol... 48
3.7.5 Colesterol - HDL... 49
3.7.6 Triacilgliceróis... 49
3.7.7 Aspartato aminotransferase... 50
3.7.8 Alanina aminotransferase... 50
3.7.9 Fosfatase alcalina... 50
3.7.10 Glicosúria... 51
3.7.11 Glicogênio hepático... 51
3.8 Equipamentos... 52
3.9 Cômite de Ética... 52
3.10 Análise Estatística... 52
4 RESULTADOS... 53
4.1 Parâmetros fisiológicos... 56
4.2 Parâmetros bioquímicos... 65
18
5 DISCUSSÃO... 82
6 CONCLUSÃO... 88
19
20
1.1 Epidemiologia
A síndrome diabetes mellitus (DM) é uma condição patológica de origem metabólica causada pela insuficiência absoluta ou relativa de insulina (REPORT OF EXPERT COMMITTEE ON THE DIAGNOSIS AND CLASSIFICATION OF DIABETES MELLITUS, 2003). Esta síndrome é um dos principais problemas de saúde pública (NEGRI, 2005) uma doença que afetando cerca de 285 milhões de pessoas no mundo (SHAW et al., 2010).
Inúmeros países, nos últimos anos, têm reconhecido a DM como um problema de saúde pública, na medida em que esta doença produz, além dos danos ao paciente, graves repercussões sócio-econômicas, tais como mortes prematuras, absenteísmo e incapacidade para o trabalho, altos custos relacionados ao seu controle e ao tratamento de suas complicações, e apesar de sua alta prevalência a maioria dos seus portadores não estão em tratamento adequado, estando, portanto expostos ao risco de suas complicações crônicas (BATISTA; MONTEIRO, 2006).
Essa patologia está presente em todos os países do mundo afetando todas as classes sociais. De acordo com a OMS, cerca de 5,1% da população mundial entre 20 e 79 anos sofre desta patologia, além de previsões nada otimistas com estimativas de que em 2025 haverá 300 milhões de pessoas portadoras desta síndrome (BATISTA; MONTEIRO, 2006).
Quanto à epidemiologia do diabetes no Brasil, um estudo realizado entre 1980 a 1990 em 9 capitais revelou que a média geral de prevalência da doença foi de 7,6% variando de 2,7% para a população de 30 a 39 anos até 17,4% para a população 60 a 69 anos. Cerca de 46% dos entrevistados não sabiam que possuíam esta patologia e a prevalência foi maior nas áreas industrializadas, como as regiões Sul e Sudeste (MATHIAS; JORGE, 2004).
1.2 Fisiopatologia do Diabetes mellitus
O DM é um grupo de doenças metabólicas caracterizada por hiperglicemia resultante da deficiência na secreção e/ou ação da insulina, hormônio produzido e secretado pelas células das ilhotas de Langerhans do pâncreas (BROWNLEE, 2001). Esta hiperglicemia gera inúmeras complicações (SHARMA et al., 2006) que se correlacionam com patologias de origem microvascular (retinopatias, nefropatias e neuropatias) e macrovascular (esclerose de artérias que
irrigam o coração, cérebro e os membros, principalmente inferiores) (BROWNLEE, 2001;
COMMITTEE REPORT, 2003; SANTOS, et al., 2006; MAIA, 2007). O DM pode ser classificado em duas categorias principais:
21 sustentação da vida; a maioria destes indivíduos desenvolvem anticorpos anti-ilhota pancreática (ICA), auto anticorpo anti-insulina (IAA), anticorpo contra a isoforma de 65 KDa da descarboxilase do ácido glutâmico (GAD65) e antígenos associados ao insulinoma 1A – 2A. Alguns indivíduos diabéticos com características do diabetes tipo 1 não possuem evidências de auto-imunidade e são classificados como do tipo 1 idiopático. A maior incidência do diabetes tipo 1 ocorre na infância e na adolescência (TANNUS et al. 2007).
DM tipo 2 - deve-se a uma deficiência relativa na produção pancreática de insulina e/ou a uma redução da sensibilidade dos tecidos à insulina, também conhecida como resistência periférica à insulina. A resistência insulínica ocorre quando uma concentração normal desse hormônio produz uma resposta biológica inadequada nos tecidos periféricos, como o tecido adiposo e muscular. Essa resistência periférica à insulina ocorre por vários fatores: defeito na ação da insulina em função de um número menor de receptores ou afinidade menor destes pela insulina, pelo hormônio, por redução na quantidade de proteínas transportadoras de glicose ou na translocação destas do citoplasma para a membrana, sendo a última considerada a mais importante (SANTOS, et al., 2006; MCLELLAN et al. 2007). A transição da resistência insulínica para o DM é determinada principalmente pela incapacidade do pâncreas em aumentar a secreção da insulina adequadamente em resposta à hiperglicemia (MCLELLAN et al. 2007).
A função mais conhecida da insulina é a regulação dos níveis glicêmicos. Em especial no tecido hepático, a insulina promove a conversão de glicose em ácidos graxos (lipogênese) e no tecido adiposo inibe a quebra de lipídeos (lipólise). Ainda no fígado, a insulina auxilia na conversão
de glicose em glicogênio, além de diminuir a formação de glicose a partir de outras fontes como os aminoácidos, glicerol e lactato (neoglicogênese). A ação da insulina é contraregulada por outros hormônios, principalmente o glucagon. No estado de jejum, há tendência à queda da glicemia, o mesmo ocorrendo com a secreção de insulina, com subseqüente redução da síntese de gordura, e aumento da lipólise no tecido adiposo e da oxidação de ácidos graxos, principalmente nos músculos e no fígado (para obtenção de energia). Os níveis de glucagon no sangue aumentam, resultando na estimulação de dois processos hepáticos importantes para a manutenção dos níveis glicêmicos, a quebra do glicogênio para liberação de glicose (glicogenólise) e formação de glicose a partir de compostos não – glicídicos (neoglicogênese) (SACKS & PATH, 2006).
Assim a insulina, participa da regulação do metabolismo da glicose ocasionando:
22 ii) aumento da fosforilação da glicose, níveis elevados de insulina no fígado permitem à glicoquinase fosforilar a glicose, produzindo glicose-6-fosfato;
iii) estimulação da glicogênese, conversão de glicose-6-fosfato em glicogênio; através da estimulação da enzima glicogênio sintetase.
iv) estimulação da glicólise, conversão de glicose em piruvato e posteriormente a acetil-CoA, que por sua vez é utilizada para a síntese de ácidos graxos ou para fornecer energia, por oxidação no ciclo do ácido cítrico (ciclo de Krebs);
v) inibição da gliconeogênese, a relação insulina/glucagon observada no período absortivo também favorece a inativação de enzimas envolvidas no processo de gliconeogênese, destacando sua ação sobre as enzimas (Figura 1) (CARVALHEIRA, et al., 2002).
As alterações bioquímicas previamente descritas levam ao desenvolvimento dos sintomas clássicos do diabetes dentre os quais podemos destacar: poliúria (aumento do volume urinário), polidipsia (sede intensa com aumento na ingestão de líquidos), polifagia (aumento do apetite e conseqüentemente da ingestão alimentar), cetonúria (presença de corpos cetônicos na urina), poliastenia (perda de peso) hiperglicemia, glicosúria, proteinúria, elevação da uréia urinária e elevação plasmática nos níveis de determinadas enzimas hepáticas. A sintomatologia é similar tanto para o diabetes tipo 1 como para o tipo 2 (BALLAS, et al., 2006).
A hiperglicemia é conseqüência principalmente da associação entre o aumento na produção hepática de glicose e a sua baixa utilização periférica, devido à incapacidade das células musculares e adiposas de captarem a glicose, pelos mecanismos previamente descritos. A cetoacidose diabética ocorre devido a mobilização maciça de ácidos graxos do tecido adiposo (lipólise), seguida da velocidade de oxidação dos ácidos graxos, disponibilizando substratos (moléculas de acetil-CoA) para a cetogênese hepática, que também está estimulada (CHAMPE et al., 2006).
23 A manutenção da integridade da musculatura esquelética é importante, uma vez que este tecido é altamente especializado na conversão de energia química em movimento e força, variando de atividades rápidas e intensas a atividades continuas e de baixa intensidade (HOOD, 2001). O músculo sóleo realiza atividade lenta, mas estáveis, já o músculo EDL (Extensor longo dos dedos) realiza atividade mais intensa e rápida. A eficiência destas diferentes fibras musculares é realizada por composições específicas de proteínas miofibrilares. O músculo sóleo, possui maior quantidade de fibras de miosina de cadeia leve I e IIA, que confere a ele características ideais para a manutenção da tensão postural. Suas fibras são ricas em mitocôndrias, o que permite a execução de atividades contínuas com menos fadiga. Em contraste, o músculo EDL é rico em fibras carentes de
Figura 1. Principais caminhos metabólicos no fígado no estado absortivo (Adaptado de CHAMPE, et al., 2006).
Azul: intermediários para o metabolismo de carboidratos; Vermelho: intermediários para
o metabolismo de lipídeos; Verde: intermediário para o metabolismo de proteínas.
NH3
Proteína
Aminoácidos
(do intestino)
Acetil-CoA
Ácidos graxos
Triacilglicerol
VLDL
Aminoácidos
Quilomicra remanescentes
Ciclo do ácido cítrico
NH3
Glicose Glicose-6-P
Piruvato
Glicose (do intestino) Glicogênio
Glicogêniosintase
24 redes mitocondriais (miosina de cadeia leve IIB), que são atribuídas a movimentos rápidos e repentinos (ARANY et al., 2007).
A alta ingestão de líquidos (polidipsia) verificada no diabetes pode ser explicada através do seguinte mecanismo: a desidratação provoca uma redução moderada no volume do líquido extracelular, porém nos casos de acidose grave, há também uma grande perda de sódio, levando a redução acentuada do líquido extracelular. A perda de líquidos leva a um aumento na pressão osmótica e redução no líquido extracelular, que regula a ingestão de líquidos. A pressão osmótica age via osmorreceptores, localizados no hipotálamo anterior estimulando a sede. Reduções no volume do líquido extracelular também estimulam a sede por uma via independente daquela mediada em resposta ao aumento da osmolaridade plasmática. O efeito na depleção do volume do líquido extracelular na sede é mediado através do sistema renina-angiotensina. A secreção da renina é aumentada por hipovolemia e resulta em um aumento da angiotensina II circulante. Esta angiotensina age no órgão subfornical, uma área receptora especializada no diencéfalo, para estimular as áreas neurais relacionadas com a sede (GUYTON & HALL, 1996).
O aumento da ingestão alimentar que ocorre no diabetes pode ser atribuído a distúrbios nos processos de regulação da fome no centro da saciedade, localizado no núcleo hipotalâmico ventro-medial, que necessita de insulina para a captação de glicose e assim o centro da fome é inibido. Na ausência de insulina o núcleo hipotalâmico ventro-medial não capta a glicose, não inibindo o hipotálamo ventro-lateral, responsável pela sinalização da fome. Esta área não sendo inibida, sinaliza falta de glicose e fome, estimulando assim maior ingestão alimentar (BERGMAN & FELIG, 1995; JACOBSON, 1996).
A glicose é filtrada e reabsorvida nos rins, por co-transportadores de sódio; com a hiperglicemia há uma saturação da capacidade de reabsorção renal e a glicose excedente é eliminada do organismo através da urina, configurando o quadro de glicosúria (GANNONG, 2006).
O aumento da uréia urinária no diabetes é decorrente da alteração no metabolismo das proteínas, a qual se manifesta por conseqüência de: i) ativação de processos envolvidos na proteólise, ii) redução da velocidade de síntese protéica, iii) redução na captação de aminoácidos pelos tecidos, causados pela deficiência do hormônio insulina. A maior concentração de aminoácidos no sangue leva a maior oferta de substratos para a neoglicogênese hepática, para o aproveitamento da cadeia carbônica dos mesmos; e o grupo amino no fígado, dá origem a uma maior produção de uréia, a qual é secretada para o sangue e eliminada pela urina (SACKS, 2006).
25 metabolismo da glicose, a qual se eleva no sangue, aumentando a glicação protéica as quais, promovem alterações hemodinâmicas no tecido renal (BABU; SRINIVASAN, 1999; GNUDI, 2008).
Algumas enzimas apresentam-se elevadas no diabetes (MORI et al., 2003), sendo que as transaminases são enzimas amplamente difundidas no organismo e presentes nos hepatócitos em altas concentrações. A necrose ou mesmo um distúrbio que ocasione um dano celular no fígado aumenta os níveis sanguíneos de enzimas intracelulares como a aspartato aminotransferase (AST) e alanina aminotransferase (ALT) (SCOTT et al., 1984).
A AST catalisa a transferência de um grupo amino entre aspartato e -cetoglutarato formando oxalacetato e glutamato, a reação é reversível e seu equilíbrio favorece a formação do aspartato. Sua elevação no soro ocorre em doenças hepáticas como a hepatite, cirrose, carcinoma hepático, entre outras (Figura 2-A) (DUFOUR et al., 2000).
A ALT catalisa a transferência de um amino-grupo entre a L-alanina e -cetoglutarato. Em sistemas in vivo está reação forma o piruvato e este a acetil-CoA que participa do ciclo Krebs, e
glutamato que é desaminado formando amônia e -cetoglutarato. Embora não seja uma enzima órgão específica, é utilizada como marcador para o auxílio no diagnóstico de hepatotoxicidade, uma vez que sua atividade no sangue se torna elevada sempre que haja alteração da integridade dos hepatócitos (Figura 2-B) (BOONE et al., 2005).
Uma enzima muito utilizada para monitoramento de toxicidade hepatobiliar é a fosfatase alcalina (ALP). Esta enzima se localiza nas membranas das células dos canalículos biliares do fígado, suas isoenzimas também são encontradas nas células osteoblásticas do tecido ósseo e em outros tecidos como o epitélio intestinal, túbulos renais e placenta, porém as isoformas encontradas
Figura 2. Reações catalisadas pelas transaminases AST e ALT durante o metabolismo dos aminoácidos (Adaptado de CHAMPE, et al., 2006).
Glutamato Oxalacetato
Aspartato -Cetoglutarato
A
Alanina -Cetoglutarato
Piruvato Glutamato
B
26 no sangue originam-se em sua maior parte do fígado ou do músculo esquelético, e em menor proporção no intestino. A elevação da atividade desta enzima tende a ser marcante na disfunção do sistema hepatobiliar e doenças ósseas, entre outras (YAKUBU et al., 2005; PANTEGHINI, et al., 2006).
A detecção de elevação na atividade destas enzimas no plasma também é utilizada para avaliar os efeitos tóxicos de produtos naturais e xenobióticos. A elevação na atividade sérica das enzimas AST, ALT e ALP tem sido relatada em animais diabéticos e esta elevação é reduzida após o tratamento com insulina (PEPATO et al., 1993, 2002; MORI, 2002).
1.3 Lipídeos e lipoproteínas no diabetes
Os principais lipídios encontrados no plasma humano são colesterol, ésteres do colesterol, triacilglicerol (TAG), fosfolipídios e ácidos graxos não-esterificados. Os lipídeos são compostos insolúveis em água e seu transporte no sangue ocorre através de lipoproteínas. As lipoproteínas são complexos moleculares de proteínas transportadoras específicas em combinações variadas de lipídios. Os ácidos graxos livres são transportadas pela albumina (NELSON & COX, 2002).
As lipoproteínas podem ser divididas de acordo com sua densidade e/ou tamanho em quilomicrons, VLDL (lipoproteína de muito baixa densidade), IDL (lipoproteína de densidade intermediária), LDL (lipoproteína de baixa densidade) e HDL (lipoproteína de alta densidade) (NELSON & COX, 2002; SCHIAVO, et al., 2003).
O colesterol é esterificado e posteriormente transferido às lipoproteínas VLDL e LDL, sob ação da proteína de transferência de ésteres de colesterol (CETP). Essas lipoproteínas são captadas pelo fígado, que utiliza seus constituintes (fosfolipídeos, colesterol, apoproteínas e TAG) em vários processos (UINT et al., 2003; DE BIASE, et al., 2007).
O colesterol encontra-se praticamente em quase todas as células e líquidos orgânicos, é um álcool com esqueleto tetracíclico do ciclopentano-peridrofenantieno; seu transporte é descrito em duas vias: a via exógena, que representa o transporte dos lipídios provenientes da dieta, do intestino para o fígado; e a via endógena, representada pelo transporte das lipoproteínas sintetizadas nos hepatócitos para os tecidos periféricos (FERREIRA et al.,2003).
27 podem ser caracterizados como citotóxicos ou ainda mutagênicos, aterogênicos e carcinogênicos (MOURA; TENUTA FILHO, 2002).
Alterações no metabolismo do colesterol se refletem na hipercolesterolemia, e dependendo da intensidade, está fortemente associado a algumas doenças como: coronariopatias ateroscleróticas, hipertensão arterial e formação de cálculos biliares (LUDKE; LÓPEZ, 1999). Sabe-se que o colesterol também pode se encontrar elevado no diabetes, sendo este aumento explicado por alguns mecanismos como: i) a hiperprodução do VLDL- colesterol o qual gera subseqüentemente muitas unidades de LDL- colesterol, ii) diminuição da atividades dos receptores de LDL- colesterol em decorrência da queda de insulina, iii) dieta com elevado teor de ácidos graxos e colesterol que também diminui a atividade dos receptores de LDL- colesterol (RIFAI & WARNICK, 2006).
Os triacilgliceróis constituem cerca de 95% das gorduras do organismo, são formados por uma molécula de glicerol esterificado com três moléculas de ácidos graxos; é a forma de gordura estocada nos tecidos adiposos subcutâneos, principalmente abdominais, é armazenado promovendo o armazenamento de energia a ser utilizada em situações de demanda (SILVA; SANCHES, 2005).
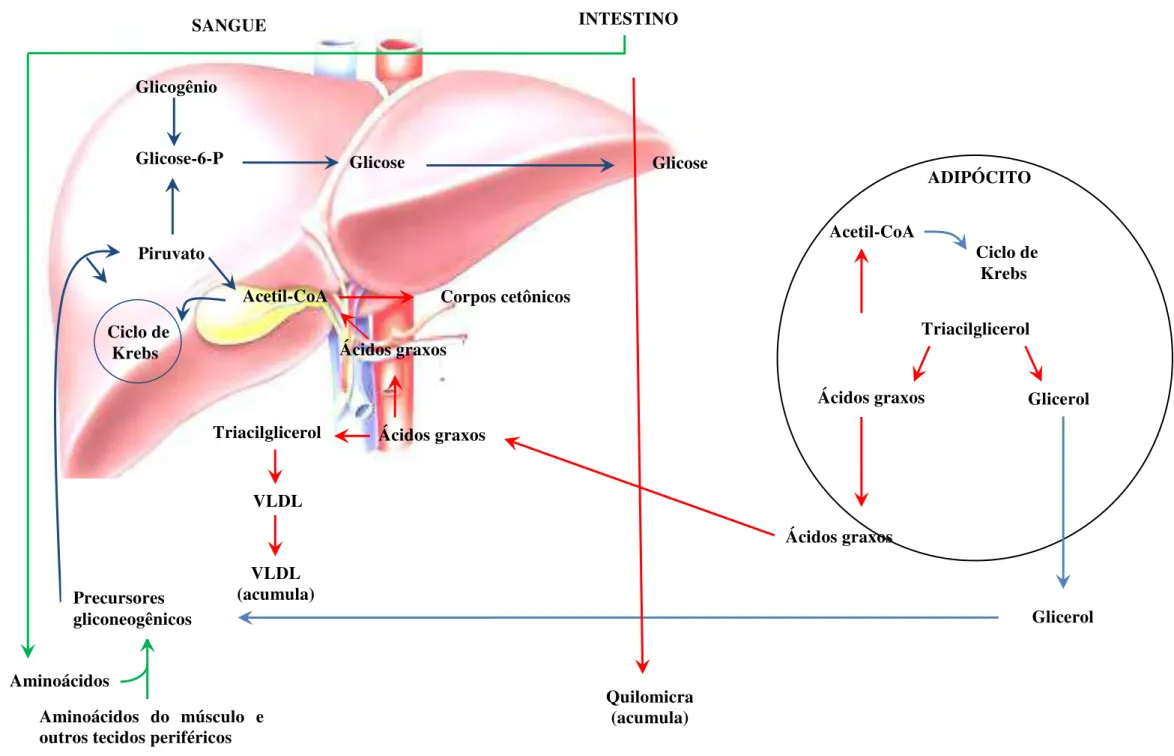
Em indivíduos diabéticos, o metabolismo das lipoproteínas está prejudicado, pois a insulina exerce um efeito importante sobre as lipases, como a ativação da lipase lipoprotéica do endotélio vascular e a inibição da lipase hormônio sensível, presente no tecido adiposo. Na deficiência de insulina, a lipase hormônio sensível estará ativada, ocasionando a hidrólise dos triacilgliceróis armazenados nos adipócitos, contribuindo para a diminuição de peso corporal, e, além disso, com elevação do substrato acetil-CoA, que é um precursor do colesterol. A ausência de insulina também inibirá a lipase lipoprotéica, não sendo observada a captação pelos tecidos periféricos dos triacilgliceróis transportados pelas lipoproteínas (quilomicron, VLDL), permanecendo, portanto na circulação (Figura 3) (RIFAI & WARNICK, 2006).
28 Ácidos graxos
Quilomicra (acumula) Glicose
VLDL (acumula)
VLDL
Triacilglicerol Ácidos graxos
Acetil-CoA Corpos cetônicos
Aminoácidos do músculo e outros tecidos periféricos Aminoácidos
Precursores gliconeogênicos
ADIPÓCITO
Glicerol Triacilglicerol
Ácidos graxos Acetil-CoA
Ácidos graxos
Glicerol Ciclo de
Krebs Piruvato
Glicose-6-P Glicogênio
Ciclo de Krebs
Glicose INTESTINO SANGUE
U
Figura 3. Inter-relações teciduais no diabetes tipo 1 em relação ao metabolismo de lipídeos (CHAMPE, et al., 2006)
29
1.4 Estresse oxidativo e diabetes
Participam dos sistemas de defesas antioxidantes do organismo compostos como: ácido úrico, glutationa reduzida, ácido ascórbico, -tocoferol, moléculas que contêm grupos sulfidrilas e enzimas antioxidantes, como: catalase (CAT), glutationa peroxidase (GPx) e superóxido dismutase (SOD) (STINEFELT et al., 2005).
Alguns mecanismos bioquímicos têm sido propostos para explicar as anormalidades estruturais e funcionais observadas no diabetes, e que têm correlação com prejuízos na capacidade antioxidante endógena, dificultando a ação contra os radicais livres e/ou espécies reativas, em especial de oxigênio (ERO) e nitrogênio (ERN). Algumas vias bioquímicas estritamente associadas com a hiperglicemia (via do poliol, produtos de glicação não-enzimática AGE) têm sido propostas para explicar os níveis elevados de radicais livres em pacientes diabéticos (SANTINI et al., 1997).
1.4.1 Via do Poliol
O aumento do fluxo pela via dos polióis, induzido pelo aumento de ERO, determina maior conversão de glicose a sorbitol, reduzindo NADPH e glutationa e aumentando o nível de estresse oxidativo ocasionado pela hiperglicemia. Sendo o sorbitol convertido em frutose, aumentando a relação NADH para NAD+, proporcionando a síntese de diacilglicerol (DAG), sendo este o principal ativador fisiológico da proteína quinase C (PKC) (Figura 4) (DARLEY-USMAR, et al., 1995; BROWNLE, 2005).
1.4.2 Formação de produtos avançados de glicação não-enzimática (AGE)
Os AGE são proteínas glicadas por açúcares oxidados, contribuindo para o desenvolvimento de aterosclerose (BROWNLE, 2005; GOLDIN et al., 2006), agem modificando proteínas intracelulares e moléculas da matriz extracelular, que ativam os receptores de AGE (RAGE), estimulando a produção de citocinas inflamatórias como: interleucinas (IL) 1 e 6, fator de crescimento I, fator de necrose tumoral prostaglandinas e fator estimulador de colônias de granulócitos (GOLDIN et al., 2006).
30
NADP+
NADPH
Hiperglicemia
Via do Poliol Glicação não-enzimática
Sorbitol Glicose
Frutose
GSH reduzida
GSSG oxidada
NAD+
NADH
S
DH
RADICAIS LIVRES e/ou ERO
Defesa Antioxidante
ESTRESSE OXIDATIVO
Figura 4. Possível mecanismo do estresse oxidativo na diabetes (BROWNLEE, 2005) * SDH: Sorbitol dehidrogenase
Complicações vasculares Retinopatia Nefropatia Neuropatia
Agregação plaquetária Oxidação LDL Vasodilatadores
Coagulação
31
1.5 Indução do diabetes experimental
Um dos métodos mais utilizados para a indução do diabetes experimental (tipo 1) consiste na administração do antibiótico estreptozotocina (STZ) produzido pela bactéria Streptomyces achromogenes (MURATA et al., 1999).
A STZ é um derivado 2-deoxi-D-glicose que destrói seletivamente as células β-pancreáticas, promovendo sua degranulação (aproximadamente uma hora após sua administração por via endovenosa). Consequentemente ocorre o aparecimento do diabetes (RERUP & TARDING, 1969; GOODNER, 1973; ANDERSON et al., 1974).
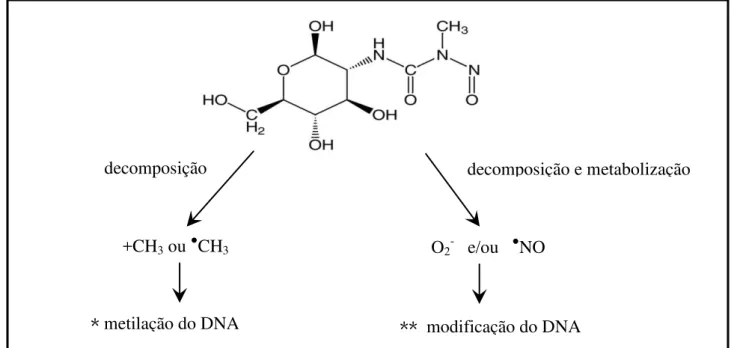
A estreptozotocina possui, em sua estrutura (Figura 5):
Grupo glicídico: reconhecido pelos transportadores de glicose das células β, permitindo sua
entrada no interior destas células (HERR et al., 1967; SCHEIN; LOFTUS, 1968; GOODNER, 1973; ANDERSON et al. 1974).
Grupo N-metil-N-nitrosouréia: citotóxico para as células β-pancreáticas (ANDERSON et al. 1974; SCHEIN; LOFTUS, 1968).
* Metilação do DNA induzida por +CH3 ou ●CH3.
** Modificação do DNA induzida por espécies reativas de oxigênio e/ou nitrogênio.
Figura 5. Mecanismos postulado de toxicidade pela estreptozotocina.
O grupo N-metil-N-nitrosouréia inibe a atividade da enzima superóxido dismutase (SOD), permitindo o acúmulo do ânion radical superóxido e outras espécies tóxicas às células β (FISCHER; HAMBURGUER, 1979; GRANKVIST, et al., 1981; PAPACCIO, et al., 1986). O acúmulo dessas
decomposição
+CH3 ou ●CH3
* metilação do DNA
decomposição e metabolização
O2- e/ou ●NO
32 espécies tóxicas promove a degradação do DNA nuclear (SANDLER, et al., 1983), e assim ocorre a ativação de uma enzima reparadora de DNA, a poli (ADP-ribose) sintetase (PARP) (YAMAMOTO, et al., 1981), que utiliza como substrato a forma oxidada da nicotinamida adenina dinucleotídeo (NAD+). A elevação da atividade desta enzima provoca a depleção de NAD+ intracelular (SCHEIN; LOFTUS, 1968), levando à inibição da respiração celular, da produção de ATP e da síntese protéica e consequentemente queda na síntese de pró-insulina (YAMAMOTO, et al., 1981; UCHIGATA et al., 1982), havendo perda do balanço iônico celular com posterior apoptose (SANDLER, et al., 1983).
Outros mecanismos pelos quais a STZ leva a danos em células β-pancreáticas têm sido propostos:
i) STZ como um potente agente alquilante, promovendo a alquilação direta do DNA através da adição de radicais metila ou cátions metila, via decomposição da STZ (JOHANSSON; TJALVA, 1978; BENNET; PEGG, 1981). Essa metilação ocorre mais especificamente nas guaninas, induzindo a apoptose nas células β (MURATA et al., 1999).
ii) Geração de espécies reativas do oxigênio e/ou de nitrogênio promovida pela STZ (KWON et al., 1994; KANETO et al., 1995; KRONCKE et al., 1995; BEDOYA, et al., 1996), contribuindo assim a toxicidade da molécula de DNA na diabetogênese.
1.6 Tratamento do diabetes
Atualmente o tratamento do diabetes Tipo 1 inclui injeções diárias de insulina, enquanto o tratamento do diabetes Tipo 2 inclui uma série de hipoglicemiantes orais administrados individualmente ou em terapia combinada, dependendo das necessidade do paciente, a fim de reduzir a hiperglicemia (SHUKLA et al., 2006).
O tratamento com a insulina apresenta várias complicações como reações cutâneas, lipodistrofia insulínica, lipohipertrofia, nódulos endurecidos, equimose, ardência, prurido e também alergia. Soma-se a isso a necessidade de várias administrações diárias por via subcutânea o que implica em grande desconforto para o paciente, além de causar prejuízos profissionais. Outro inconveniente é o seu alto custo para países em desenvolvimento (DAVIDSON, 2001).
33 Alguns tratamentos paliativos têm sido estudados para minimizar as injeções diárias como: i) insulina inalável, contudo além de não dispensar as injeções diárias, apresenta alguns desconfortos como: tosses ao inalar, produção de anticorpos contra insulina e pessoas que apresentaram perda de 1/3 da capacidade do pulmão depois de 6 meses de tratamento; ii) insulina transdérmica também está em fase de testes, porém dados iniciais demonstraram que o adesivo deve liberar uma descarga de alguns volts para que os poros sejam abertos uma vez que a insulina é um polipeptídeo grande; iii) bomba de insulina para tratar o diabetes tipo 1 a qual imita o pâncreas humano ao liberar automaticamente pequenas quantidades de insulina de ação rápida (em décimos ou centésimos de uma unidade) em intervalos de poucos minutos, a qual é conhecido como o nível basal de insulina. O nível basal de insulina visa manter constante o nível de glicose no sangue entre as refeições e durante o sono. Este método dispensa as incômodas injeções diárias, porém apresenta algumas desvantagens como: alto custo, período de ajustes, problemas na pele, depressão do paciente pela sensação de dependência do aparelho e dificuldades técnicas, pois por se tratar de um aparelho eletrônico existe a probabilidade de ocorrer problemas técnicos de tempos em tempos causando hipoglicemia ou hiperglicemia (SOCIEDADE BRASILEIRA DE DIABETES, 2008).
Existem estudos encaminhados para a possibilidade de cura do Diabetes, os quais ainda estão em desenvolvimento, sendo o transplante de ilhotas de Langerhans uma possibilidade já realizada, porém os resultados ainda não são plenamente satisfatórios devido ao alto custo, utilização de imunossupressores, a biotecnologia complexa para o isolamento e sobrevida das ilhotas ao longo dos anos (BALLAS, et al., 2006).
O quadro atual é que os pacientes diabéticos precisam estabelecer um controle rigoroso da glicemia, uma vez que ainda não existe uma cura para tal doença. Desta forma, a intervenção farmacológica se faz necessárias, porém os efeitos colaterais de diversas drogas e o desconforto do paciente tem levado vários pesquisadores à busca de novos fármacos e formas de administração (RATES, 2001).
Atualmente, estudos sobre novos fármacos hipoglicemiantes vêm sendo realizados, com enfoque especial para as plantas medicinais usadas na medicina popular (MUKHERJEE; WAHILE, 2006). Neste sentido, vários estudos realizados com vegetais mostraram efeito hipoglicemiante relacionado a algumas espécies vegetais, como por exemplo o extrato de Mormodica charantia
(GROVER et al., 2001), sendo apontado como uma alternativa segura para a diminuição dos níveis de glicose sanguínea (VIRDI et al., 2003); o extrato aquoso de Syzgium alternifolium apresentou
34 2001), as folhas de Myrcia uniflora mostrou redução da glicemia, polifagia, poliúria e da excreção
de glicose urinária (PEPATO et al., 1993).
Dentre os hipoglicemiantes orais já comercializados e amplamente indicados na terapia convencional do diabetes tipo 2 e que tem sua origem em produtos naturais, vale a pena destacar o produto Glucophage®. O principio ativo de Glucophage®, N-N-dimetilbiguanida ou metformina, foi descoberto a partir da utilização, na Europa Medieval, das partes aéreas da Galega officinalis e hoje
tem sido amplamente utilizado como anti-hiperglicêmico, aumentado a sobrevida de indivíduos com diabetes tipo 2 com sobrepeso e apresentando efeito inclusive na redução da mortalidade por causas cardiovasculares. Estudos dos séculos XVII e XVIII indicaram a presença de compostos guanídicos com certa toxicidade, e biguanidas, mais toleráveis, e finalmente no século XX a modificação molecular destas últimas levou a geração da dimetilbiguanida (BAILEY; DAY, 2004). Nesta busca por novos fármacos e/ou novas formas de administração vários estudos vêm analisando os pigmentos naturais, que apresentaram atividades em sistemas biológicos, como: ação antioxidante (SHUKLA et al., 2006), antiinflamatória (KUMAR et al., 2004) , hipolipidêmica (BAUM, et al., 2007; MANJUNATHA; SRINIVASAN, 2007), anticancerígena (CHENG, et al., 2001; SKRZYPCZAK-JANKUN, et al., 2003), antibacteriana (MAHADY et al., 2002) e antidiabetogênica (SRINIVASAN et al., 2003). O uso de pigmentos naturais em alimentos muitas vezes denominados de alimentos funcionais é atualmente uma tendência mundial. Devido à diversidade nas propriedades apresentadas pelos pigmentos naturais incorporados em alimentos, esses compostos vêm se tornando promissores como fonte de fármacos naturais, constituindo uma nova opção para o tratamento de diversas patologias (SILVA et al., 2002).
1.7 Alimentos Funcionais
Nas últimas décadas temos visto uma retomada no interesse do uso das plantas para o tratamento do DM. Esta crescente demanda tem incentivado, a indústria farmacêutica, as pesquisas acadêmicas e profissonais da saúde como nutricionistas e médicos, a buscar novas alternativas de alimentos funcionais (DAY; BAILEY,1988).
35 asseguradas por estudos científicos (SIRÓ, et al., 2008), demostrando redução do risco e da evolução de doenças crônicas degenerativas (NEUMANN, et al., 2000).
A utilização de certos alimentos na redução do risco de doenças ou mesmo de seu tratamento é considerada a milhares de anos. Hipócrates há cerca de 2500 anos já fazia esta recomendação como pode ser observado em uma de suas célebres frases: "Faça do alimento o seu medicamento". No entanto, somente no final do século passado, é que houve uma renovação acentuada no interesse por esse assunto, e o termo "alimento funcional" passou a ser utilizado com grande freqüência. As pesquisas se intensificaram e o conceito de alimento funcional tornou-se mais conhecido do público leigo e também de pesquisadores que até então não estavam envolvidos com estudos nessa área (SIRÓ, et al., 2008).
As justificativas pelo aumento da procura por alimentos funcionais são: i) os consumidores passaram a optar por prevenir ao invés de curar doenças; ii) aumento dos custos médicos; iii) os consumidores estão mais cientes sobre a relação entre a saúde e nutrição; iv) desejo de combater os males causados, por microrganismos e agentes químicos no ar, na água e nos alimentos e, vi) aumento das evidências científicas sobre a sua eficácia (SANDERS, 1998).
Para o iogurte, considerado um alimento funcional, observamos que sua produção e consumo crescem continuamente, devido às suas propriedades organolépticas e terapêuticas, como: a proteção contra distúrbios intestinais, a melhoria da digestão da lactose, a diminuição do risco de câncer e dos níveis de colesterol (DOORNBOS et al., 2005), a melhora do sistema imune (MARONA; PEDRIGON, 2004) e seu alto valor nutricional (HE et al., 2005).
A utilização do iogurte como alimento funcional via sua suplementação com pigmentos naturais derivados do morango, “blueberry” e pêssego, tem sido explorada para o controle da
hipertensão e do diabetes (APOSTOLIDIS et al., 2006).
1.8 Curcumina
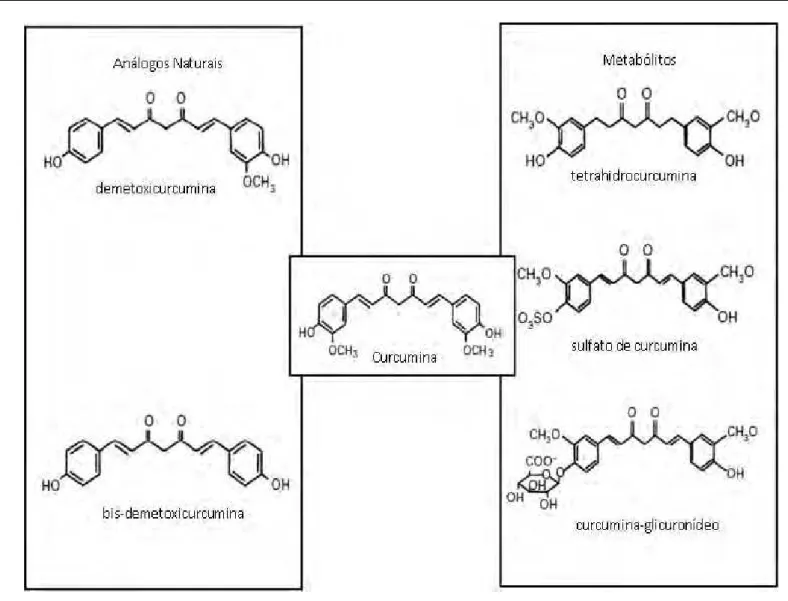
A curcumina tem sido proposta como candidata a novo fármaco para o diabetes. Estruturalmente, a curcumina consiste em uma molécula de dibenzoil-metano (1,7bis(4-hidroxi-3-metoxifenil)-1,6-heptadieno-3,5diona) e dois grupos metoxila (OCH3) (Figura 6) (ANAND et al., 2007). Foi isolada pela primeira vez em 1815 do rizoma da planta Curcuma longa L., e obtida em
36 condimentados com açafrão e curry (SRINIVASAN; SAMBAIAH, 1991; LODHA & BAGGHA, 2000; AGGARWAL, et al., 2003; DUTTA et al. 2005; GOEL, et al., 2008).
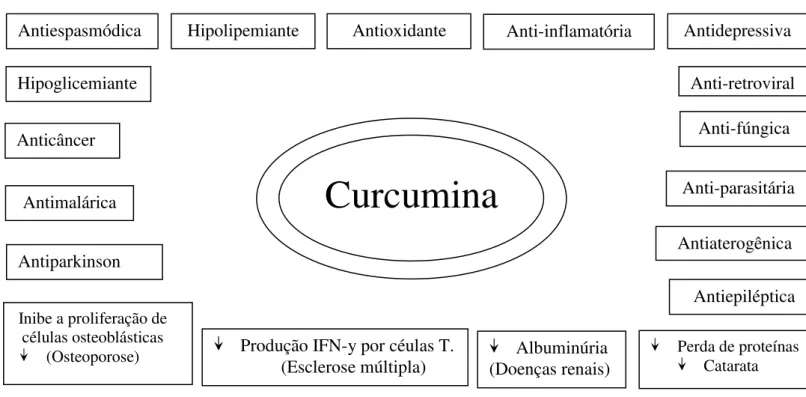
Vários estudos demonstraram seus efeitos benéficos no tratamento de várias patologias, tais como: doenças biliares (NIEDERAU; GOPFERT, 1999), diabetes (SRIVIVASAN et al., 2003), câncer (HUANG et al., 1998; AGGARWAL, et al., 2003; YOUSSEF et al., 2004), mal de Alzheimer (RINGMAN et al., 2005), catarata (SURYANARAYANA et al., 2005), psoríase (BOSMAN, 1994), mal de Parkinson (ZBARSKY et al., 2005), osteoporose (NOTOYA et al., 2006), doenças pulmonares (KALPANA, et al., 2005), esclerose múltipla (VERBEEK, et al., 2005), dislipidemia (BABU; SRINIVASAN , 1999), epilepsia (SUMANONT et al., 2006; GUPTA, et al., 2009), doenças renais (KUWABARA et al., 2006), depressão (XU (a,b) et al., 2005), AIDS (MAZUMDER et al., 1996). Possui ainda como propriedades: antiinflamatória (BALASUBRAMANYAM et al., 2003), antiparasitária (PEREZ-ARRIAGA et al., 2006), antioxidante (RUBY et al., 1995; SCARTEZZINI; SPERONI, 2000; FUJISAWA et al., 2004; YOUSSEF et al., 2004; AK; GÜLÇIN, 2008), antibacteriana (NEGRI, et al., 2005; NAZ et al., 2010), antifúngica (KIM, et al., 2003), antimalárica (NANDAKUMAR et al., 2006), antiaterogênica (OLSZANECKI et al., 2005), anti-espasmódicos (ITTHIPANICHPONG et al., 2003) (Figura 7), e atividades contra bactérias alimentares (UECHIS, et al., 2000), fungos e leveduras dermatófitos como Trichophyton spp. e Cândida spp. (APISARIYAKUL, et al., 1995).
As propriedades anti-inflamatórias e antitumorais da curcumina despertaram para o interesse na investigação dos mecanismos moleculares associados a estas atividades biológicas (AZUINE; BHIDE, 1994; CHAN, 1995; ANTUNES; BIANCHINI, 2004; AGGARWAL, et al., 2003; MESA, 2006). Sua ação antiinflamatória é devido a presença de grupos fenólicos na molécula, sendo essencial para inibição das prostaglandinas e leucotrienos (ARAUJO & LEON, 2001) e postula-se que a ação antitumoral ocorra através da indução de apoptose (KHAR et al., 1999).
37 A curcumina possui um excelente perfil de segurança tanto em animais (100 mg/kg/dia) (QURESHI, et al., 1992) quanto em humanos (12g/dia) (LAO et al., 2006), não apresentando toxicidade mesmo em altas doses. A curcumina interage com numerosos alvos, ligando-se a metais, albumina e outras moléculas inibindo a atividade de enzimas (ROMITI et al., 1998; ANUCHAPREEDA et al., 2002); se liga irreversivelmente à CD13 inibindo o crescimento tumoral e angiogênese (SHIM et al., 2003); age inibindo a ativação de fatores de transcrição, que regulam a expressão de genes, que contribuem para a tumorogênese, inflamação, angiogênese e cânceres humanos (LENGYEL, et al., 2007).
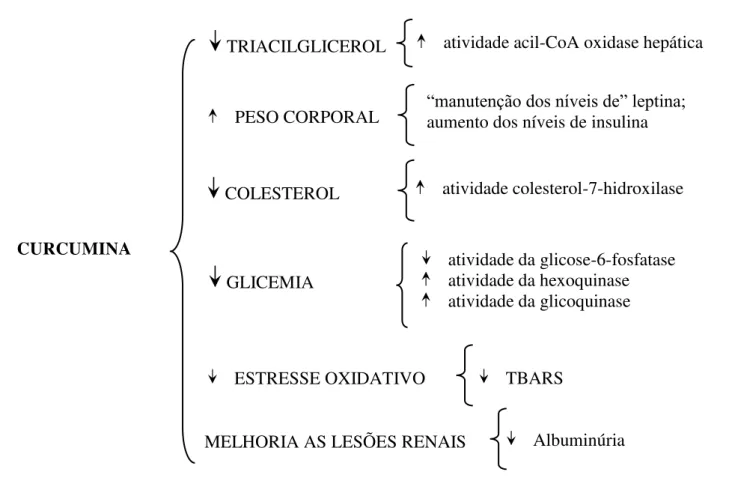
38 Em modelos de animais diabéticos induzidos por aloxano ou estreptozotocina, o tratamento baseado em curcumina, sob diversas formas de administração (solubilizada em extratos etanólicos ou incorporada em carboximetilcelulose ou mesmo em água), apresentou melhoria em diversos parâmetros relacionados ao diabetes, destacando-se: redução nos níveis de glicose sanguínea1; redução dos níveis de hemoglobina glicada2; diminuição na atividade sérica das enzimas séricas (AST e ALT)3; redução dos níveis séricos de colesterol4; e de triacilgliceróis5; aumento do peso corporal6; melhora nas lesões renais7 e redução dos níveis de espécies reativas do ácido tiobarbitúrico (TBARS) no fígado e plasma8 (Figura 8).
________________________________________________________________________________ 1-) (ARUN; NALINI, 2002; NARAYANNAMY, et al., 2003; AGGARWAL, et al., 2003; NISHIYAMA et al. 2005; BEST et al., 2007; MURUGAN; PARI, 2007; WONGEAKIN et al., 2009; HUSSEIN; ABU-ZINADAH, 2010); 2-) (ARUN; NALINI, 2002; KWON-LL, et al., 2008; HUSSEIN; ABU-ZINADAH, 2010); 3-) (HUSSEIN; ABU-ZINADAH, 2010); 4-) (BABU; SRINIVASAN, 1997; ASAI; MIYAZAWA, 2001; KALPANA, et al., 2005; NA et al. 2010; REDDY, et al., 2010); 5-) (ASAI & MIYAZAWA, 2001; NA et al. 2010; REDDY et al., 2010); 6-) (KWON-LL et al., 2008); 7-) (BABU; SRINIVASAN,1997, 1998); 8-) (ARUN; NALINI, 2002).
Figura 7. Efeitos benéficos da curcumina em várias patologia. Adaptado de AGGARWAL et al., 2005.
Hipoglicemiante
Anticâncer
Perda de proteínas Catarata
Antiparkinson
Inibe a proliferação de células osteoblásticas (Osteoporose) Hipolipemiante Albuminúria (Doenças renais) Antiaterogênica Antidepressiva o Antimalárica Anti-retroviral Anti-fúngica Anti-parasitária Anti-inflamatória
Produção IFN-y por céulas T. (Esclerose múltipla)
Antioxidante
Antiepiléptica Antiespasmódica
39
1.8.1 Biodisponibilidade da curcumina
As propriedades funcionais da curcumina não são plenamente exploradas devido a sua baixa biodisponibilidade (absorção, transporte e metabolização). Sabe-se que a curcumina é absorvida pelo trato gastrointestinal e possui uma alta afinidade por lipídios (IRESON et al., 2002). Sofre metabolização nos hepatócitos de ratos e humanos à curcumina-glicuronídeo, sulfato de curcumina, tetrahidrocurcumina (Figura 6) (OKADA et al., 2001; SOMPARN et al., 2007), sendo estes metabólitos encontrados no organismo de ratos, em culturas ex vivo de hepatócitos de ratos e
humanos em ensaios pré-clínicos (STRIMPAKOS; SHARMA, 2008). Uma vez metabolizada, seus metabólitos são excretados através da bile e urina (MESA, 2006).
Várias estratégias têm sido avaliadas para aumentar a atividade biológica da curcumina. Essas abordagens incluem: adjuvantes (SHOBA et al., 1998), nanopartículas (SHAIK et al., 2009), lipossomas (CHEN et al., 2009), micelas (LETCHFORD, et al., 2007; MA et al., 2007) e complexos de fosfolípidios (MAITI et al., 2007). Estas são formulações promissoras, que parecem
Figura 8. Efeito da curcumina sobre o diabetes.
CURCUMINA
PESO CORPORAL “manutenção dos níveis de” leptina; aumento dos níveis de insulina
ESTRESSE OXIDATIVO TBARS
MELHORIA AS LESÕES RENAIS Albuminúria GLICEMIA
atividade da glicose-6-fosfatase atividade da hexoquinase atividade da glicoquinase
40 oferecer melhor permeabilidade e resistência a processos metabólicos, visando principalmente a maior absorção e disponibilização da curcumina aos tecidos (ANAND et al., 2008).
As nanopartículas também são uma interessante opção para aumento da biodisponibilidade da curcumina, uma vez que podem proporcionar maior penetração em membranas plasmáticas devido ao seu pequeno tamanho, além de seu potencial de especificidade tornando-se excelente transportadoras de medicamento (KURIEN, et al., 2007).
A piperina foi utilizada como adjuvante da curcumina em estudos com ratos (2 g/kg de curcumina + 20 mg/kg de piperina) e em humanos (2g de curcumina + 20 mg de piperina) e esses estudos demonstraram que esta associação aumentou a biodisponibilidade da curcumina em 154% e 2000%, respectivamente, quando comparada a administração da curcumina isolada, mostrando claramente o efeito da piperina, sobre a biodisponibilidade da curcumina (SHOBA et al., 1998).
Para transpor o problema da biodisponibilidade Li e colaboradores investigaram o efeito da curcumina encapsulada em lipossomas, e os autores constataram que ela foi capaz de inibir o carcinoma pancreático em humanos, a supressão do tumor foi maior com a curcumina encapsulada em comparação a quimioterapia padrão ou com a administração da curcumina sem encapsulação (LI et al., 2005; 2007).
Estudos farmacocinéticos em que demonstraram que a administração da curcumina em formulação com fase micelar aumentou a meia vida e o volume de distribuição (Vd) do pigmento em 162 e 70 vezes, respectivamente. (MA et al., 2007).
41
42
2.1 Gerais
Avaliar os efeitos do tratamento de ratos diabéticos com várias concentrações de curcumina incorporada ao iogurte, sobre os parâmetros fisiológicos e bioquímicos classicamente alterados na diabetes.
2.2 Específicos
Avaliar, durante o período experimental de 31 dias, os efeitos da administração oral da curcumina à ratos diabéticos sobre:
i) os parâmetros fisiológicos: peso corporal, ingestão hídrica e alimentar e volume urinário; assim como as massas dos tecidos adiposos epididimal e retroperitoneal e dos músculos sóleo e Extensor longo dos dedos (EDL).
43
44
3.1 Material
Para realização dos experimentos foram utilizados: curcumina (Fluka®), estreptozotocina e tolueno (Sigma-Aldrich®). Para dosagem da glicemia, uréia urinária, proteinúria, colesterol total, colesterol-HDL, triacilgliceróis, AST, ALT e ALP foram utilizados Kits da Labtest Diagnóstica S.A. Iogurte natural (Nestlé®) para a incorporação da curcumina. Ácido acético glacial, álcool absoluto, antrona orto-toluidina e tiouréia (Merck®), heparina sódica (Liquemina Roche®); insulina (NPH 100 U/mL, Lilly®), Ácido Cítrico Monoidratado, Citrato Trissódico Diidratado, Ácido sulfúrico e Sulfato de sódio e Hidróxido de potássio (Synth®).
3.2 Animais
Foram utilizados ratos Wistar machos com peso corporal de 120 ± 5 gramas, procedentes do Biotério Central do Câmpus de Botucatu – UNESP – São Paulo Brasil.
3.3 Indução do diabetes
Após período de adaptação, 6 grupos de animais (48 animais, n=8 por grupo) foram submetidos a jejum prévio de 14-16 horas para administração de 40 mg de estreptozotocina (STZ) por kg de peso corporal (pc), dissolvida em tampão citrato 10 mM pH 4,5, por via endovenosa (jugular). Após 3 dias, os animais que receberam STZ apresentaram valores de glicemia de 450 - 500 mg/dL. Além destes grupos mais três grupos de 8 animais foram usados como controle não-diabético.
3.4 Preparo da suspensão de curcumina em iogurte
A curcumina (C21H20O6) foi preparada em concentrações de 15, 30 e 45 mg/kg/pc de cada animal incorporada em iogurte natural Nestle (Tabela 1). As massas foram obtidas e a incorporação ao iogurte ocorreu em ambiente termostatisado a 25ºC, durante 90 segundos, sob rotação de 27.000 rpm em homogeinizador modelo Metabo®.
3.5 Administração da insulina
45
Tabela 1. Valores nutricionais do iogurte natural (www.nestle.com.br). PORÇÃO 200 mL (1 unidade)
Quantidade por porção
Valor energético 126 Kcal= 529 KJ
Carboidratos 9,1 gramas
Proteínas 6,8 gramas
Gorduras totais 7,0 gramas
Gorduras saturadas 4,4 gramas
Gorduras trans Não contém
Fibra alimentar 0 gramas
Cálcio 247 miligramas
Sódio 97 miligramas
3.6 Tratamento crônico com curcumina nas doses de 30, 60 e 90mg/Kg de peso corporal
Os animais (72) foram colocados em gaiolas metabólicas individuais, recebendo água e
alimentação “ad libitum”, onde permaneceram durante 3 dias, para adaptação. O biotério
encontrava-se nas seguintes condições ambientais: ciclo de luz de 12 horas (luzes acessas ás 6:00 e desligadas ás 18:00 horas), temperatura constante de 23ºC ± 1ºC e umidade de 55 ± 5%.
Após adaptação, os animais foram tornados diabéticos como descrito no item 3.3 (PEPATO, et al., 2002).
Após administração da STZ, determinamos os seguintes parâmetros obtidos de gaiola metabólica e medimos: ingestão alimentar e hídrica, volume urinário e peso corporal. A urina foi coletada, seu volume quantificado e uma alíquota separada com conservante tolueno (300 µL), para a determinação da glicosúria, proteinúria e uréia urinária. O sangue foi coletado da cauda, e utilizando tubos Eppendorf contendo heparina sódica foi centrifugado a 2.500 rpm durante 10
minutos, no plasma obtido quantificamos a glicemia, e a atividade das enzimas AST, ALT e ALP. Os parâmetros glicemia e peso corporal foram utilizados para o pareamento dos animais diabéticos e não-diabéticos. O esquema 1 representa o fluxograma do delineamento dos grupos experimentais para o tratamento crônico com curcumina.
Grupo diabético tratado com água (DTH2O) (n=8),
Grupo diabético tratado com iogurte (DTIOG) (n=8),
46
Grupo diabético tratado com Curcumina 60 mg (DTC 60mg/kg/pc/dia) (n=8),
Grupo diabético tratado com Curcumina 90 mg (DTC 90mg/kg/pc/dia) (n=8),
Grupo diabético tratado com insulina (DTI) (n=8),
Grupo normal tratado com água (NTH2O) (n=8),
Grupo normal tratado com iogurte (NTIOG) (n=8) e
Grupo normal tratado com Curcumina 90 mg (NTC 90mg/kg/pc/dia) (n=8).
Esquema 1 – Fluxograma da preparação dos grupos de animais para o tratamento com curcumina.
O tratamento foi iniciado no 4º dia pós-STZ, sendo que cada animal dos grupos experimentais (DTC30, DTC60, DTC90 e NTC90) recebeu através de gavagem duas vezes ao dia (8:00 e 17:30 horas) curcumina incorporada em 0,5 mL de iogurte nas doses de 15, 30 e 45 mg/kg-pc de curcumina (totalizando 1mL de iogurte/dia e curcumina nas doses 30, 60 e 90mg/kg-mg/kg-pc de curcumina, respectivamente); os grupos DTH2O, DTIOG, NTH2O e NTIOG receberam o mesmo volume de água e iogurte pela mesma via de administração, no grupo diabético tratado com insulina (DTI) administramos 2U de insulina/por rato por via subcutânea em um volume de 0,3 mL (4U/0,6mL/dia). No dia da coleta de sangue, os animais recebiam duas horas antes por gavagem água, iogurte, curcumina e insulina subcutaneamente.
72 animais
48 animais 24 animais
Indução diabetes (STZ-40 mg/kg-pc)
Pareamento (glicemia e peso corporal)
Diabéticos Não -Diabéticos
DTH2O; DTIOG; DTC 30mg; DTC 60mg; DTC 90mg e DTI NTH2O; NTIOG e NTC 90mg
47 Após 31 dias de tratamento o sacrifício dos animais se deu por decapitação (STEPHEN et al., 1999); o sangue foi centrifugado a 2.500 rpm/10minutos para determinação: glicemia, os níveis do colesterol-HDL, colesterol total, triacilgliceróis e as atividades das enzimas AST, ALT e ALP . Os tecidos adiposos epididimal e retroperitoneal foram removidos e pesados bem como os músculos sóleo e EDL. Alíquotas do fígado foram retiradas e armazenadas a -20ºC para dosagem do glicogênio hepático. O esquema 2 representa o fluxograma dos tratamentos dos animais, bem como das análises realizadas.
A) Ingestão alimentar e hídrica, volume urinário, glicemia, glicosúria, proteinúria e uréia urinária
B) P (diferença de peso corporal em relação ao peso do dia da administração da STZ) C) AST, ALT e ALP
D) Colesterol, colesterol-HDL, triacilgliceróis, pesagem dos músculos EDL e sóleo e das gorduras epididimal e retroperitoneal e glicogênio hepático.
Esquema 2 – Fluxograma dos tratamentos dos animais, bem como das análises realizadas.
3.7 Métodos utilizados para as dosagens sangüíneas
3.7.1 Glicemia– método da glicose-oxidase (TRINDER, 1969; HALL, 2003).
Na primeira reação, a glicose oxidase, em fase aquosa, catalisa a oxidação da glicose da amostra produzindo, ácido glucônico e peróxido de hidrogênio.
48 O peróxido de hidrogênio formado oxida a 4-aminoantipirina na presença de fenol, sob ação catalisadora da peroxidase, formando a pirilquinoneimina que absorve em 505 nm, sendo a intensidade de absorção de luz proporcional à concentração de glicose na amostra.
2 H2O2 4-aminoantipirina fenol antipirilquinoneimina 4 H2O 3.7.2 Proteinúria –método Bradford modificado (BRADFORD, 1976).
Método colorimétrico que utiliza o corante Coomassie azul brilhante, o corante forma um complexo com a albumina e com diferentes globulinas, reagindo integralmente com todas as proteínas da urina, promovendo um deslocamento em sua banda de absorção para 545 nm.
3.7.3 Uréia urinária – método enzimático da urease (BOLLETER, et al., 1961; BERGMEYER, 1985).
A hidrólise da uréia catalisada pela urease, produz íons amônio e CO2. Uréia H2O 2NH4+ CO2
Os íons amônio reagem com salicilato e hipoclorito de sódio em meio alcalino na presença do catalisador nitroprussiato de sódio e forma o azul de indofenol, o qual pode ser monitorado espectrofotometricamente à 600 nm.
3.7.4 Colesterol– método colesterol-oxidase (MROZ, 2003; RIFAI & WARNICK, 2006).
Os ésteres de colesterol presentes na amostra são hidrolisados à colesterol e ácidos graxos livres, em reação catalisada pela colesterol esterase.
Ésteres de colesterol H2O colesterol ácidos graxos
O colesterol formado é posteriormente oxidado pela enzima colesterol oxidase formando colest-4-en-ona e peróxido de hidrogênio:
Colesterol O2 colest-4en-ona H2O2
49 2 H2O2 4-aminoantipirina fenol antipirilquinoneimina 4 H2O
3.7.5 Colesterol-HDL– método direto por inibição seletiva (HALLORAN et al. 1999).
O poliânion composto por fosfotungstato de sódio, 4-aminoantipirina e íons de magnésio forma complexos estáveis com a superfície das lipoproteínas de muito baixa densidade (VLDL), das lipoproteínas de baixa densidade (LDL) e dos quilomicrons. Os complexos formados com as partículas do colesterol-HDL presentes no soro não se estabilizam, ficando sujeitos à ação detergente de um segundo reagente composto por polioxietileno lauril éter, solubilizando-se e sob ação da colesterol esterase, colesterol oxidase, peroxidase e N-bis (DSBmt)-m toluidina, se, resultando em um pigmento que é diretamente proporcional à concentração de colesterol presente no colesterol-HDL da amostra.
3.7.6 Triacilgliceróis – método de acoplamento de reações enzimáticas com reações seqüenciais. Hidrolise dos triacilgliceróis, presentes no soro, catalisada pela enzima lipase, produz glicerol e ácidos graxos livres: (RIFAI & WARNICK, 2006).
Triacilglicerol + 3 H2O glicerol + 3ácidos graxos
A fosforilação do glicerol pelo ATP ocorre em reação catalisada pela gliceroquinase produzindo glicerol-3-fosfato e adenosina difosfato (ADP):
Glicerol + ATP glicerol-3-fosfato + ADP
Em reação subsequente ocorre a oxidação do glicerol-3-fosfato em reação catalizada pela à diidroxicetona e peróxido de hidrogênio:
Glicerol-3-fosfato + O2 diidroxicetona + H2O2
O peróxido de hidrogênio formado oxidada a com 4-aminoantipirina na presença de clorofenol, sob ação catalisadora da peroxidase, formando antipirilquinoneimina: A intensidade da cor da antipirilquinoneimina é proporcional á concentração de triacilgliceróis na amostra e monitorado espectrofotometricamente à 500 nm.