TUANE CRISTINA DOS SANTOS
Avaliação da degradação fotoquímica de corante alimentício e lixiviação de
corantes têxteis de fibras de algodão expostos a suor sintético por métodos
cromatográficos
Dissertação apresentada ao Instituto de Química, Universidade Estadual Paulista, como parte dos requisitos para obtenção do título de Mestre em Química
Orientadora: Profa. Dra. Maria Valnice Boldrin Zanoni
FICHA CATALOGRÁFICA
Santos, Tuane Cristina dos
S237a Avaliação da degradação fotoquímica de corante alimentício e lixiviação de corantes têxteis de fibras de algodão expostos a suor sintético por métodos
cromatográficos / Tuane Cristina dos Santos. –
Araraquara : [s.n], 2013 102 f. : il.
Dissertação (mestrado) – Universidade Estadual Paulista, Instituto de Química
Orientador: Maria Valnice Boldrin
1. Química analítica. 2. Fotodegradação. 3. Tartrazina. 4. Mutagenicidade. 5. Suor sintético. I. Título.
DADOS CURRICULARES
Identificação
Nome Tuane Cristina dos Santos
Nome em citações bibliográficas SANTOS, T.C.
Endereço
Endereço Profissional Universidade Estadual Paulista Júlio de Mesquita Filho, Instituto de Química Rua Professor Degni, 55, NDCom
Quitandinha
14800-900-Araraquara, SP, Brasil Telefone: (16) 33019519
Formação Acadêmica
2012 Mestrado Sanduíche em Química Analítica (Carolina do Norte, EUA) North Carolina State University, NCSU, Estados Unidos
Título: Avaliação da ação do suor sintético sobre o tecidos tingidos com corante índigo Vat Blue 1 , Direct Red 81 e Direct Azul 86, empregando técnicas cromatográficas e espectrometria de massas.
Bolsista: FAPESP. Duração: 6 meses.
2011 Mestrado em andamento em Química Analítica (Araraquara)
Universidade Estadual Paulista Júlio de Mesquita Filho, Unesp, Brasil.
Título: Avaliação da degradação fotoquímica de corante alimentício e lixiviação de corantes têxteis de fibras de algodão expostos a suor sintético por métodos cromatográficos.
Bolsista da: FAPESP, Brasil.
2004-2007 Graduação em Bacharelado em Química Tecnológica.
Universidade Estadual Paulista Júlio de Mesquita Filho, Unesp, Brasil.
Título: Relatório de Estágio Supervisionado na Companhia Brasileira de Metalurgia e Mineração.
Orientador: Ossamu Hojo.
Formação Complementar
2013-2013 Estágio docência: Química Analítica Quantitativa ( Carga horária: 60h). Universidade Estadual Paulista Júlio de Mesquita Filho, Unesp, Brasil.
Atuação Profissional
Bioagri Laboratórios
2013- Atual Vínculo: Celetista, Enquadramento funcional: Pesquisador I, Carga horária 44h.
Centro de Monitoramento e Pesquisa da Qualidade de Combustíveis e Biocombustíveis
2009-2011 Vínculo: Celetista, Enquadramento funcional: Técnico em Química, Carga horária 44h.
Companhia Brasileira de Metalurgia e Mineração
2007-2007 Vínculo: Estagiária, Enquadramento funcional: Estagiária, Carga horária 44h.
Participação em Congressos
2012 V Congresso Iberoamericano de Química Analítica (Montevideo, Uruguai)
Título do trabalho: Avaliação da degradação do corante tartrazina através do processo fotoquímico (Apresentação de poster).
2013 17° ENQA- Encontro Nacional de Química Analítica
Título do Trabalho: Determinação de corante diretos lixiviados de algodão tingido pela ação de suor sintético.
Produção bibliográfica
2013 LEME, DM.; OLIVEIRA, GAR. de; MEIRELES, G; SANTOS, TC; ZANONI, MVB; OLIVEIRA, DP de. Genotoxicological assessment of two reactive dyes extracted from cotton fibers using artificial sweat. Toxicology in Vitro, 2013.
Áreas de Atuação
1.Grande área: Ciências Exatas e da Terra / Área: Química / Subárea: Química Analítica/Especialidade: Análise de Traços e Química Ambiental.
DEDICATÓRIA
AGRADECIMENTOS
A Deus por minha vida e por todas as bênçãos recebidas.
À Clélia, meu exemplo de bondade e honestidade, por ter sido minha mãe e meu pai e ter me criado com dignidade e muito amor, me apoiando sempre em todas as minhas escolhas.
Aos amigos Michelle e Thiago, essenciais para a realização deste trabalho, por me ajudarem em todos os momentos.
Às minhas amigas, Denise, Gislaine, Carla e Nayara, pelo companheirismo de tantos anos, por todos os almoços e momentos de diversão.
À minha orientadora, Dra. Maria Valnice, pela dedicação dispensada na minha formação, por todas as oportunidades proporcionadas e, principalmente, pelos conhecimentos compartilhados e toda compreensão.
A todos os colegas e amigos de laboratório e professores do Grupo de Eletroanalítica, pelo apoio e atenção e de modo especial ao Jefferson, pelos momentos de descontração.
Ao Prof. Dr. Harold Freeman e seus colegas de laboratório, pela recepção e aprendizado durante o estágio sanduíche.
Ao Guilherme e Bianca, pela disponibilidade em ajudar e todo o tempo empregado na realização deste trabalho.
Aos funcionários da Seção de Pós-Graduação e da Biblioteca pela prestatividade e disposição em ajudar sempre que necessário.
Á FAPESP e CAPES pelo apoio financeiro.
Resumo
O presente trabalho investigou a degradação fotoquímica do corante tartrazina, amplamente empregado na indústria de alimentos, utilizando métodos espectrofométricos e de cromatografia líquida com detecção de arranjo de diodos (CLAE-DAD) e detecção por espectroscopia de massas (LC-MS/MS). Além disso, através do Teste de Ames, avaliou-se também o caráter mutagênico do corante e de seus subprodutos de fotodegradação. Os estudos de fotólise foram conduzidos utilizando radiação UV e solar, observando-se maior velocidade de
degradação sob luz artificial e em solução de pH ácido. A descoloração total de solução 1x10-5
mol L-1 de tartrazina foi obtida após 30 min de exposição à luz UV 125 W, demandando uma
dose de energia de 37,8 J cm-2. Os resultados obtidos mostraram a geração de 5 subprodutos,
oriundos da abertura do anel de cinco membros, identificados por análises de LC-MS/MS. A análise destes dados permitiu a proposição de uma rota de degradação para o corante tartrazina. O teste de Ames foi realizado para o corante em uma concentração de 5,34 mg/placa e para as soluções obtidas após exposição à radiação UV, e mostrou que a tartrazina não possuí
propriedades mutagênicas frente às linhagens TA98 e TA100 de S. typhimurium, com e sem
metabolização exógena (fração S9). Na segunda etapa do trabalho, investigou-se a lixiviação dos corantes Reativo Verde 19, Direto Azul 86 e Direto Vermelho 81, empregados na tintura de algodão, quando em contato com suor sintético. Os tecidos tingidos foram submetidos à ação de soluções de suor, mimetizando diferentes valores de pH, composição, temperatura e tempo de contato entre o tecido tingido e o suor. A lixiviação destes corantes na solução foi monitorada utilizando as técnicas de espetrofotometria na região UV-Vís, cromatografia em camada delgada (CCD) e LC-MS/MS. Espectros de massas e os cromatogramas do padrão e das amostras obtidas pelas soluções de suor sintético após extração do corante do tecido, mostraram que a lixiviação ocorre em todas as situações testadas, sendo menos eficiente em pH 6,5. As amostras analisadas não apresentaram mutagenicidade no teste de Ames para as linhagens testadas. Para os tecidos tingidos com os corantes diretos, Azul 86 e Vermelho 81, máxima lixiviação foi observada em pH 5,0. Os resultados obtidos por cromatografia em camada delgada (CCD) mostraram a formação de bandas, nas soluções de suor contendo o corante lixiviado do tecido, que não estavam presentes no corante original. Estes resultados não foram confirmados por análises de LC-MS/MS, indicando que os corantes não sofrem degradação.
Abstract
This work investigated the photochemical degradation of the dye tartrazine, widely used in food industry, using spectrophotometric methods and liquid chromatography coupled with diode array (HPLC-DAD) and mass spectrometry (LC-MS/MS) detection. Furthermore, through the Ames test, was studied the mutagenicity of the dye and it`s photodegradation by-products. The photolysis studies were conducted under UV and sunlight, with a more pronounced dye degradation achieved under artificial light in a solution of acidic pH. Total discoloration of a
1x10-5 mol L-1 tartrazine solution was obtained after 30 min of exposure to 125 W UV light,
demanding an energy dose of 37.8 J cm-2. The results showed the generation of 5 by-products,
derived from the opening of the five-membered ring, identified by LC-MS/MS analysis. The analysis of these data enabled the proposition of a degradation pathway for the dye tartrazine.
The Ames test, using Salmonella/microsome, was conducted for the dye at a concentration of
5.34 mg / plate and for the solutions obtained after exposure to UV irradiation, showing that the
dye does not possess mutagenic properties for strains TA98 and TA100 of S. typhimurium, with
and without exogenous metabolization (S9). In the next step, it was investigated the leaching of dyes Reactive Green 19, Direct Blue 86, Direct Red 81 applied to dye cotton fabrics, when in contact with synthetic sweat. The dyed fabrics were exposed to the synthetic sweat mimicking different pH values, composition, temperature and contact time between the dyed fabric and sweat. The releasing of these dyes in the solutions was monitored using the techniques of UV-Vis spectrophotometry, thin layer chromatography (TLC) and LC-MS/MS. Mass spectra and chromatograms of the Reactive Green 19 standard solution and the samples showed that the dye is extracted from the fabric, by sweat solutions, in all situations tested, and the lower concentrations were found in the pH 6.5 solutions. The samples analyzed showed no mutagenicity in the Ames assay for the tested strains. For fabrics dyed with direct dyes, Red 86 and Blue 81, higher dye concentrations were observed in the pH 5.0 sweat solutions. The results obtained by TLC showed the formation of chromatographic bands, in the extracted solutions, that were not present in the original dye. These weren’t confirmed by LC-MS/MS analysis, which indicated that those dyes weren’t degraded.
LISTA DE FIGURAS
Figura 1. Estrutura química do azo corante amarelo Tartrazina ... 5
Figura 2. Estrutura química do corante reativo Reativo Verde 19. ... 8
Figura 3. Estrutura dos corantes (A) Direto Azul 86 e (B) Direto Vermelho 81. ... 10
Figura 4. Representação da estrutura da cadeia celulósica. ... 11
Figura 5. Representação esquemática (A) do simulador solar e do (B) reator fotoquímico, utilizados para degradação fotolítica da tartrazina 1x10-5 mol L-1 . ... 17
Figura 6. Representação esquemática do reator fotoquímico utilizado para a degradação solar da solução 1x10-5 mol L-1 de tartrazina: vista lateral. ... 17
Figura 7. Etapas do processo de tingimento de fibra de algodão por corante reativo……….21
Figura 8. Máquina de tingimento utilizada no tingimento do algodão com os corantes Direto Azul 86 e Direto Vermelho 81. ... 25
Figura 9. Cromatogramas obtidos em =427 nm para a otimização das condições cromatográficas (I) FM: MeOH/H2O (a) 30:70, (b) 25:75, (c) 25:75+30 mmol L-1 LI e vazão dimuindo de 0,8 a 0,6 mol L-1; (II) FM: ACN/H 2O (d) 22:78, (e) 21:79, (h) 20:80+30 mmol L-1 LI, vazão 0,4 mol L-1, (f) 21:79+30 mmol L-1 LI e vazão 0,5 mol L-1, (g) 21:79+35 mmol L-1 LI e vazão 0,4 mol L-1; (III) FM: ACN/H 2O 20:80 (i) e (j) 30 mmol L-1 LI e vazão 0,5 mol L-1, (k) 40 mmol L-1 LI e vazão 0,4 mol L-1, (l) 50 mmol L-1 LI e vazão 0,4 mol L-1.(IV) Espectro de absorção obtido pelo detector DAD. ... 30
Figura 10. Curva analítica para concentrações de tartrazina (A) entre 10-6 e 10-3 mol L-1 e (B) 0,1 e 0,9x10-5 mol L-1 correspondentes às áreas dos picos nos cromatogramas obtidos utilizando FM ACN/H2O 20:80 + 50 mmol L-1 LI e vazão 0,4 ml min-1. ... 32
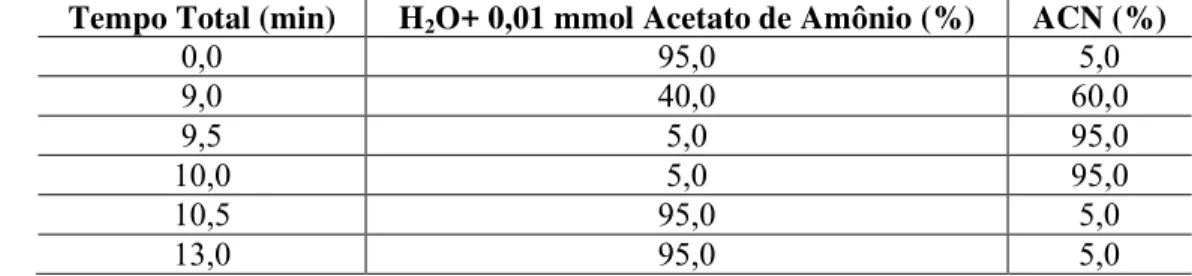
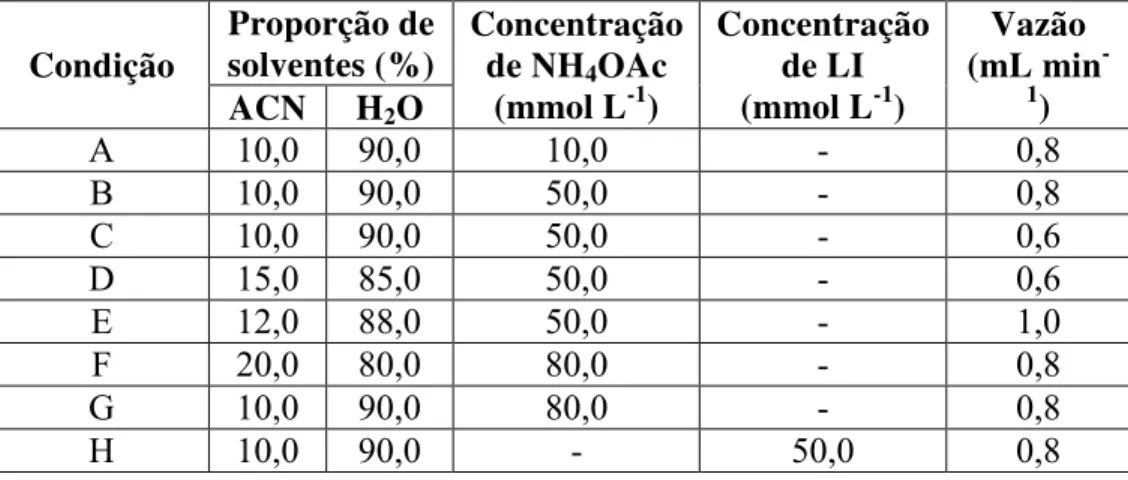
Figura 11. (I) Cromatogramas obtidos em =623 nm para a otimização das condições cromatográficas, utilizando FM: ACN/H2O nas proporções (A) 10:90+10 mmol L-1 NH4Ac e vazão 0,8 mL min-1, (B) 10:90+50 mmol L-1 NH 4OAc e vazão 0,8 mL min-1, (C) 10:90+50 mmol L-1 NH4OAc e vazão 0,6 mL min-1, (D) 15:85+10 mmol L-1 NH4OAc e vazão 0,6 mL min-1, (E) 12:88+50 mmol L-1 NH4OAc e vazão 1,0 mL min-1, (F) 20:80+80 mmol L-1 NH4OAc e vazão 0,8 mL min-1, (G) 10:90+80 mmol L-1 NH 4OAc e vazão 0,8 mL min-1, (H) 10:90+50 mmol L-1 LI e vazão 0,8 mL min-1. (II) Espectro de absorção obtido através do DAD. ... 33
Figura 13. Efeito da dose de energia proveniente de lâmpadas de (A) 80 W e (B) 125 W sobre
a porcentagem de mineralização de soluções (a) 5x10-6 mol L-1, (b)1x10-5 mol L-1, (c) 1x10-4 mol
L-1 e (d) 8x10-5 mol L-1 de tartrazina. ... 37
Figura 14. (A)Espectro UV/Vis de 1x10-5 mol L-1 do corante amarelo tartrazina em meio
aquoso (pH=6,0) antes (a) e após (b) 15, (c) 30 e (d) 240 minutos de oxidação fotolítica sob luz 125 W.(B) Cromatogramas CLAE-DAD obtidos para a fotólise desta mesma solução, utilizando as condições cromatográficas do método otimizado, após (a)0 (b)2 (c)4 (d)6 (e)10 (f)15 (g)30 (h)60 (i)120 (j)180 e (l)240 minutos de tratamento. ... 38
Figura 15. (I) Curva de degradação do corante por fotólise. (II) Curva representativa da velocidade inicial de degradação. ... 39
Figura 16. (I)Descoloração e (II) Velocidades de descoloração, via fotólise, de 1x10-5 mol L-1 de tartrazina em pH (a)2,0 (b)10,0 (c)8,0 (d)6,0, segundo cinética de primeira ordem. ... 40
Figura 17. Mecanismo proposto para a desulfonação hidrolítica da molécula de tartrazina em meio ácido………. ... 41
Figura 18. Efeito da atmosfera terrestre na incidência de radiação solar. ... 42
Figura 19. Degradação de 1x10-5 mol L-1 de solução aquosa de tartrazina em pH=6,0, por irradiação solar. Análises: (A) espectrofotometria UV/Vis, (B) CLAE-DAD, (C) teor carbono orgânico total. ... 43
Figura 20. Distribuição espectral relativa característica da emissão de lâmpadas de xenônio. 44
Figura 21. (A) Dados de absorbância e (B) carbono orgânico total medidos para solução 1x10 -5 mol L-1 de tartrazina irradiada por lâmpada de xenônio. ... 45
Figura 22. Cromatogramas LC-MS obtidos para as soluções de tartrazina submetidas a (A) 0 (B) 2 (C) 4 (D) 6 (E) 10 (F) 15 (G) 30 e (H) 240 minutos de irradiação, em um intervalo de aquisição de 50 a 600 Da, em λ=427 nm. ... 47
Figura 23. Espectros de massas LC-MS/MS dos produtos de degradação fotoquímica da tartrazina…… ... 49
Figura 24. Esquema da rota de degradação do corante tartrazina via fotólise baseado em
estruturas identificadas por LC-MS/MS. ... 52
Figura 25. Placa cromatográfica obtida para a separação das substâncias presentes na tartrzina comercial…… ... 53
Figura 27. Cromatograma e espectro de massas da fração 2 obtida na separação da
tartrazina…... ... 54
Figura 28. Reação covalente entre o corante RG-19 e a fibra celulósica, em meio alcalino, originando o tecido tingido. ... 58
Figura 29. Soluções de suor sintético após o processo de extração (a) 2 horas de extração com
solução pH 8,0, T=42oC e com ensaboamento, (b) 8 horas de extração com solução pH 5,5,
T=42oC e sem ensaboamento, (c) 8 horas de extração com solução pH 5,5, T=42oC e com
ensaboamento, (d) 12 horas de extração com solução pH 5,5, T=37oC e sem ensaboamento. .... 59
Figura 30. (A) Curva de adição de padrão e (B) Cromatograma de cada ponto da curva, para
amostra extraída por 12h a 42oC com solução de suor com pH5,5 e ensaboamento, e do padrão
RG-19……… ... 60
Figura 31. (A) Cromatograma de íons totais para o corante RG-19 comercial,
(B)cromatograma de íons extraídos para o íon de m/z 677 e (C) espectro de massa obtido para o
pico com tempo de retenção de 6,68 minutos. ... 63
Figura 32. Estruturas propostas para os íons fragmentos obtidos na análise co corante
comercial RG-19 por LC-ESI(-)-MS/MS. ... 64
Figura 33. (A) Cromatograma de íons totais obtido para a amostra analisada, (B)
cromatograma de íons extraídos para o íon fragmento m/z 677,5, (C) espectro de massas do pico
com tempo de retenção de 6,69 minutos. ... 65
Figura 34. Placas de sílica gel, observadas sob irradiação UV λ= 254 nm, após eluição dos corantes (A) DV 81 e (B) DA 86. ... 72
Figura 35. Placacromatográfica, sob irradiação UV λ= 254 nm, obtida após eluição do
corante DA 86. ... 73
Figura 36. Placa cromatográfica, sob irradiação UV λ= 254 nm, obtida para a solução de suor pH 8,0, após 24 horas de contato com a fibra de algodão tingida com o corante DA 86, sob temperatura de 42°C. ... 74
Figura 37. (A) Cromatograma de íons totais, (B) Espectro de masssas para a banda com tempo
de retenção 6,79 min e (C) Espectro de absorção no UV- Vís, em 508 nm, obtidos a solução padrão do corante DV 81. ... 75
Figura 39. (A) Cromatograma de íons extraídos, m/z 367,5 e m/z 757,0, da solução padrão do corante DA 86, (B) Espectro de massas da banda em 8,66 minutos refrente ao corante DA86. .. 77
LISTA DE TABELAS
Tabela 1. Composição química aproximada do algodão. ... 11
Tabela 2. Compostos constituintes, e suas concentrações médias, do suor humano. ... 12 Tabela 3. Gradiente utilizado para a eluição do corante RG-19 e da amostra extraída pelo
suor sintético. ... 23
Tabela 4. Fases móveis testadas para a eluição dos corantes DA 86 e DV 81 utilizando sílica gel como fase estacionária. ... 26
Tabela 5. Gradiente utilizado para a eluição dos corantes DA 86, DV 81 e da amostra
extraída pelo suor sintético. ... 27
Tabela 6. Condições cromatográficas testadas para a separação de tartrazina. ... 29
Tabela 7. Condições cromatográficas estudadas para a eluição do corante RG-19. ... 33
Tabela 8. Valores das constantes de velocidade da descoloração de soluções de tartrazina por irradiação UV proveniente de lâmpadas de 80 W e 125 W. ... 36
Tabela 9. Medidas das doses de energia da radição UVA emitida pelo sol, no período entre
10h e 16h na cidade de Araraquara. ... 42
Tabela 10. Resumo do estudo de fragmentação dos produtos de degradação fotoquímica do corante amarelo tartrazina. ... 51
Tabela 11. Resultados de mutagenicidade para o corante (T0) e para as amostras após
diferentes intervalos de exposição à irradiação UV, para as cepas TA98, com e sem S9. ... 56
Tabela 12. Resultados de mutagenicidade para o corante (T0) e para as amostras após
diferentes intervalos de exposição à irradiação UV, para as cepas TA100, com e sem S9. ... 57
Tabela 13. Concentrações de corante RG19 encontradas nas soluções de suor sintético em várias condições de pH, temperatura e tempo de contato, obtidas por adição de padrão. ... 61
Tabela 14. Resultados do teste de pré-incubação Salmonella/microssoma para o corante RG-19…………... 66
Tabela 15. Resultados do teste de pré-incubação Salmonella/microssoma para as soluções de suor sintético, pH 5,0, após extração do corante RG-19 do tecido de algodão. ... 67
Tabela 17. Concentração de corante DV 81 nas diferentes soluções de suor sintético e na
água, após 2, 8 e 24 horas de contato e sob temperaturas de 37 e 42°C. ... 69
Tabela 18. Concentração de corante DA 86 nas diferentes soluções de suor sintético e na água, após 2, 8 e 24 horas de contato e sob temperaturas de 37 e 42°C. ... 70
Tabela 19. Efeito da histidina, Na2HPO4.12H2O and NaCl, componentes da solução de suor
SUMÁRIO
Introdução... 1
1.1. Corantes Alimentícios ... 3
1.1.1. Regulamentação ... 4
1.1.2. A radiação UV ... 5
1.1.3. Potencial tóxico do corante tartrazina ... 6
1.1.4. O teste de Ames (Salmonella/ microssoma) ... 6
1.2. Corantes têxteis... 7
1.2.1. Corantes Reativos ... 8
1.2.2. Tingimento com corantes reativos ... 9
1.2.3. Corantes diretos ... 9
1.2.4. A fibra de algodão ... 10
1.2.5. O suor humano e Toxicidade dos corantes têxteis ... 11
Objetivos ... 14
Materiais e Métodos ... 15
3.1. Reagentes e soluções ... 15
3.2. CLAE-DAD ... 15
3.3. Fotólise do corante tartrazina ... 15
3.4. Monitoramento da fotodegradação da Tartrazina ... 17
3.5. Determinação dos produtos de degradação do corante Tartrazina por LC-MS/MS... 18
3.6. Purificação da tartrazina ... 19
3.7. O teste da Salmonella/ microssoma ... 19
3.8. Tingimento das fibras de algodão utilizando o corante têxtil RG19 ... 21
3.8.2. Tingimento completo (com adição de álcali e ensaboamento) ... 22
3.8.3. Extração do corante RG 19 pelas soluções de suor sintético ... 22
3.8.4. Determinação dos possíveis produtos de degradaçãodo corante RG-19 por LC-MS/MS ... 23
3.8.5. O teste da pré-incubação da Salmonella/microssoma ... 23
3.9. Tingimento das fibras de algodão utilizando os corantes Direto Azul 86 e Direto Vermelho 81 ... 25
Resultados e discussão ... 28
Conclusão ... 79
1
Introdução
O fascínio do homem pela luz e pela cor existe desde os primórdios da humanidade. A adoração de deuses, como o Deus sol e o Deus fogo, é um exemplo de como diversas fontes de luz eram associadas a cores. O homem faz uso das cores a mais de 20 mil anos e a prática de colorir os produtos alimentícios e tecidos nos remete aos tempos mais antigos onde os únicos corantes disponíveis eram os de origem natural, provenientes de matéria prima animal, mineral ou vegetal [1]. As cores, conferidas pelos corantes e pigmentos, exerciam em todas as culturas funções específicas: na Idade da Pedra, por exemplo, o vermelho simbolizava o sangue estando presente em ritos funerários. No Egito antigo, esta fascinação por corpos emissores de luz deu origem à cromoterapia e às diversas teorias sobre os efeitos da cor no corpo humano. Finalmente, a presença de cor em amostras de tecidos, tumbas egípcias e antigos hieróglifos comprova a prática de coloração utilizando corantes naturais, e como exemplo de sua importância na época, pode-se citar o fato de que apenas os nobres usavam roupas coloridas, com a cor púrpura, como sinal de poder.
Em 1856, o cientista William H. Perkin sintetizou, de maneira acidental, o primeiro corante orgânico conhecido como mauve ou púrpura de tiro. Durante o estudo da oxidação da fenilamina com dicromato de potássio, Perkin observou que após descartar o precipitado resultande da reação e lavar os resíduos do frasco com álcool, havia o aparecimento de uma coloração avermelhada. Após esta descoberta, outros químicos começaram a sintetizar diversos corantes e em 1915, a Alemanha monopolizava a produção de corantes sintéticos. Este monopólio durou até a Segunda Guerra Mundial. Hoje, os maiores exportadores de corantes são China e Índia, responsáveis por 80% dos corantes disponíveis comercialmente. O Brasil, embora seja um fabricante de corantes com exportação anual crescente ao redor de 40% ao ano [2], ainda não é auto-suficiente e importa este material significativamente.
A maior parte dos corantes importados é utilizada pelas indústria têxtil e alimentícia. Na indústria têxtil, os corantes podem, de modo geral, ser divididos em grupos que se distinguem pela maneira de fixação à fibra, e são classificados como: reativos, diretos, azóicos, ácido, à cuba, de enxofre, dispersivos, pré-metalizados e branqueadores [3].
2
escala mundial, passando de 76,3 milhões de libras em 1985 para 100,6 milhões em 2004, distribuídos principalmente entre países do continente americano, China, Índia, Pasquistão e Turquia. É importante mencionar também que o algodão é tingido particularmente por corantes do tipo reativo, direto e corantes vat, usando diferentes metodologias.
De modo geral o tecido de algodão possui grupos hidroxilas (provenientes da celulose) que lhe proporcionam uma grande capacidade de absorver água (cerca de 50% de seu peso) [5] e, consequentemente, alta capacidade de absorver o suor. Um dos grandes problemas do uso destes corantes está associado aos riscos toxicológicos à saúde humana, intrinsecamente relacionados ao modo e tempo de exposição e ainda à sensibilização da pele e/ou das vias respiratórias quando expostas ao suor [6]. Os efeitos mais acentuados no caso da exposição da pele a estes compostos, concernem em processos de dermatites causadas por certos corantes não incorporados totalmente ao tecido no processo de tingimento, que podem comprometer principalmente os consumidores que mantém grande proximidade entre o tecido e zonas da pele sujeitas à transpiração. Deste modo a avaliação da lixiviação destes corantes presentes em tecidos tingidos quando submetidos à ação do suor seria bastante pertinente.
O suor humano é composto por histidina, entre outras substâncias. Este composto apresentou importante influência no desbotamento de tecido derivado da celulose, tingido com azo corante e exposto à ação de suor e luz [7]. No trabalho publicado por Okada et al [8], evidenciou-se que a transpiração pode aumentar a taxa de migração e penetração de corantes devido ao contato da pele com fibras tingidas. Após a lixiviação do corante para o suor, podem ainda ocorrer reações de oxidação ou redução gerando subprodutos algumas vezes mais tóxicos que o próprio corante.
Um outro problema de grande importância no universo dos corantes esta relacionado ao uso de corantes alimentícios sintéticos, uma vez que a partir de meados do século XIX os pigmentos naturais foram sendo gradativamente substituídos por corantes sintéticos que apresentam menores custos de produção e fornecem uma ampla gama de cores proporcionando praticamente todas as tonalidades do espectro visível de cor [9].
3
corantes sintéticos, o que equivale a um consumo anual mundial de cerca de 700.000toneladas,
sendo 26.500 toneladas somente no Brasil [11].
Em função da inerente importância dos corantes como aditivos alimentares, estes vem sendo alvo de pesquisas devido ao risco em potencial causado à saúde humana, especialmente quando consumidos em excesso. Em 1906 surgiram as primeiras suspeitas da ação cancerígena dos corantes, e em 1924 experiências realizadas com camundongos mostraram que a ingestão de corantes poderia provocar a formação de adenomas hepáticos [12].
Por esta razão dados referentes a estudos de toxicidade tem sido utilizados por organizações governamentais para criar legislações que limitam a quantidade máxima diária permitida para a ingestão de tais aditivos. Conforme Resolução ANVISA n° 387, de 05/8/1999 [13], no Brasil, é permitido o uso de apenas onze corantes alimentícios.
Além disso, estes corantes podem sofrer fotodecomposição em ambientes aquáticos naturais devido à exposição a luz, por exemplo, o que pode alterar profundamente a estabilidade do corante ou sua fórmula estrutural e, portanto, o monitoramento e avaliação toxicológica destes subprodutos é imprescindível para proteção da população.
Deste modo, o desenvolvimento de métodos analíticos capazes de identificar, por meio de técnicas cromatográficas e espectrofotométricas, corantes têxteis, do tipo reativo e direto, e corantes alimentícios seria de grande importância para monitorar as possíveis reações de degradação dos mesmos.
1.1. Corantes Alimentícios
4
Os corantes também são utilizados para conferir, restaurar ou intensificar a cor dos alimentos, de tal modo que haja garantia de que os produtos industrializados tenham uma aparência próxima a do produto natural, um aspecto padronizado e seu número e variedade possam ser aumentados [1].
As moléculas de corantes são contituídas por auxocromos (por exemplo, CO, NO2,
OCH3) definidos como grupos substituintes que afetam e alteram a cor da base do cromóforo
(intensidade, comprimento de onda de absorção máxima e mínima, etc), por grupos reativos, doadores ou receptores de elétrons que promovem a fixação do corante ao substrato, e por cromóforos, responsáveis pela cor e caracterizados pela presença de sistemas com duplas ligações conjugadas, sendo as mais comuns -N=N-, >C=N-, >C=O, -N=N-. Os corantes podem ser classificados, de acordo com sua estrutura química e com o tipo de interação com o substrato em: azóicos, triarilmetanos, triazínicos, nitrofenólicos, nitrosofenólicos, antraquinônicos, ftalocianínicos, vinilsulfônicos e piramidinicos [14]. Dentre estes, os azo compostos são de grande importância na indústria de corantes por conferirem coloração intensa, alta estabilidade e a possibilidade de síntese a partir de substâncias de baixo custo. Os derivados de azo-benzeno mais simples apresentam, normalmente, uma coloração amarela ou amarelo-alaranjada, em virtude da conjugação na ligação formada pelo grupo azo, —N = N— e os dois anéis aromáticos e possuem, pelo menos, um grupo sulfonato para aumentar a solubilidade em água [15].
1.1.1. Regulamentação
5
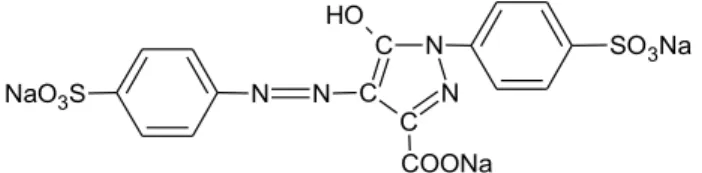
Mercosul para o uso de corantes em alimentos. A Resolução GMC nº 50/98 trata dessa harmonização, bem como a Resolução GMC nº 52/98 que trata dos critérios para determinar funções de aditivos, aditivos e seus limites máximos para todas as categorias de alimentos[16]. Sendo assim, o interesse deste trabalho é estudar o corante amarelo tartrazina (CI 19140), Figura 1, como modelo de azo corante, devido à controvérsia existente em relação ao seu potencial mutagênico, conforme discussão do item 1.1.3.
Figura 1. Estrutura química do azo corante amarelo Tartrazina.
N N N
C N C
C
COONa
SO3Na O
H
NaO3S
1.1.2. A radiação UV
Sabe-se que os corantes podem sofrer interferência da luz solar gerando produtos com propriedades químicas, reativas ou tóxico/genotóxicas diferentes do corante original [17]. A luz solar consiste em um espectro contínuo, composto pelo infravermelho, pelo visível e pelo ultravioleta. O Sol também emite raios cósmicos, raios gama, raios-X e radiações de radiofreqüência, mas estes últimos chegam em quantidades muito pequenas na superfície terrestre.
Uma parcela da radiação emitida pelo sol, ao atravessar a camada atmosférica terrestre, sofre fenômenos de espalhamento (radiação difusa). A parcela da radiação que não sofre desvio, pela atmosfera, é conhecida como radiação direta. A soma das radiações difusa e direta é a chamada radiação global. A radiação que penetra na atmosfera terrestre é composta da seguinte maneira: 3% de UV, 42% de radiação visível e 55% de radiação infravermelha. A radiação UV, embora em menor proporção, é a fração mais perigosa para a maioria dos seres vivos. Seu espectro abrange de 100 até 400nm, sendo esta faixa de comprimento de onda assim classificada: UV-C: 100 - 290nm, UV-B: 290 - 320nm,UV-A: 320 - 400nm. .
6
maior proporção) e do UV-B, sendo as duas últimas as responsáveis por graves lesões no ser humano, e outras formas de vida, sendo também responsáveis pela quebra de ligações instáveis em corantes, devido a suficiente energia que possuem [18].
1.1.3. Potencial tóxico do corante tartrazina
Em função da inerente importância dos corantes como aditivos alimentares, estes tem sido alvo de inúmeras pesquisas devido ao risco em potencial causado à saúde humana, especialmente quando consumidos em excesso. Existe uma controvérsia em relação ao potencial genotóxico e outros efeitos adversos da tartrazina [19,20,21]. Watabe et al [22] mostraram que o mecanismo primário da metabolização da tatrazina, quando ingerida pelo homem, é a redução do
grupamento azo, gerando principalmente ácido sulfanílico. Amin et al [23] observaram que ratos
expostos à altas dosagens deste corante (500 mg/kg peso corporal) exibiram dano hepatocelular. O estudo de citotoxicidade, relatado por Mpountoukas et al [24], indicou que a ingestão de altas
concentrações do corante (4 e 8 mmol L-1) tem um significante efeito tóxico na qualidade dos
cromossomos, provavelmente por afetar a condensação destes cromossomos durante a mitose.
Em adição, resultados obtidos pelo teste do Cometa in vivo, mostraram que a exposição oral
aguda à tartrazina é capaz de induzir danos no DNA de ratos [25].
Alguns estudos indicaram também, que o corante induziu aberrações cromossomais em
fibroblastos de Muntiacus muntjac [26], em células da medula óssea de ratos e camundongos
[27] e em cromossomos de Allium cepa [28]. Entretanto, há também relatos na literatura de
resultados negativos para testes de genotoxicidade/carcinogenicidade envolvendo a tartrazina [29,30,31]. Fica claro, portanto, que a discussão sobre o potencial tóxico deste corante começou há muito tempo e, como pode ser visto nos estudos citados anteriormente, atualmente ainda não há um consenso sobre o assunto.
1.1.4. O teste de Ames (Salmonella/ microssoma)
7
Desta maneira, avaliações toxicicológicas/mutagênicas exigem uma análise estratégica elaborada.
Dentre os vários testes existentes, o teste da Salmonella/microssoma, também conhecido
como teste de Ames, utiliza cepas de S. typhimurium [32]. Neste teste, as linhagens utilizadas
sofrem mutações nos genes responsáveis pela biossítense da histidina e por isso não são capazes de produzir este aminoácido e, consequentemente, de crescer e formar colônias.
As cepas utilizadas têm como características: (1) determinar o tipo de lesão no DNA; (2)
possuir um gene que confere aumento na permeabilidade da membrana (rfa) facilitando a entrada
da substância teste pela célula bacteriana; (3) apresentar mutação do tipo deleção no gene (uvrB)
que confere reparo à luz UV evitando que a célula conserte o dano induzido pelo agente teste; (4) apresentar em plasmídeos, marcadores de resistência a antibióticos de forma seletiva evitando contaminação por outras bactérias.
As linhagens TA98 e TA100 são geralmente utilizadas para estudos de triagem, mostrando eficiência na detecção de grande número de agentes mutagênicos. A TA98 detecta agentes mutagênicos que induzem uma mutação que altera o quadro de leitura. Estes mutágenos geralmente atuam em unidades repetitivas do DNA fazendo com que haja uma restauração do quadro correto da leitura envolvida na síntese de histidina. Nesta cepa, a reversão para o fenótipo
his+ ocorre pela deleção de um ou dois pares de bases desta seqüência ou, pela adição de um par.
Além disto, a linhagem TA98 possui uma mutação espontânea no gene que codifica a maior
nitroredutase de S. typhimurium .
A linhagem TA98, assim como a TA100, é utilizada para estudar o metabolismo de nitrocarcinógenos que tenham, em comum, o fato de serem nitroredutases-deficientes. Devido a tal propriedade, utiliza-se a TA100 para detecção de agentes que possam induzir metilação e causar substituição de pares de bases (Guanina-Citosina). Sua construção é baseada em uma mutação de ponto, a partir de alteração de base Adenina-Timina por Guanina-Citosina, que codifica numa trinca específica prolina e leucina, respectivamente, obtendo-se a produção da primeira enzima da biossíntese de histina, restaurando o fenótipo original [33] .
1.2. Corantes têxteis
8
existem mais de 8000 de corantes sintéticos disponíveis para a indústria têxtil [34]. Esta diversidade é justificada, uma vez que cada tipo de fibra a ser colorida requer corantes com características próprias e extremamente bem definidas.
Os corantes têxteis apresentam estruturas moleculares complexas que podem envolver, durante o seu processo de síntese, até 500 reações intermediárias.
1.2.1. Corantes Reativos
Os corantes reativos são altamente solúveis em água e são assim chamados devido a sua capacidade de formar ligações covalentes com a fibra. Estas ligações conferem maior estabilidade da cor do tecido, quando lavado, em comparação a corantes que ligam-se à fibra através de ligações mais fracas. Estes corantes podem ser utilizados no tingimento de fibras celulósicas com boas características de tingimento, solidez e estabilidade química.
Os primeiros corantes reativos foram lançados no mercado somente em 1956, obtidos a partir do cloreto cianúrico, e tinham como grupos reativos diclorotriazina e monoclorotriazina. A partir desta descoberta, ocorreu um grande desenvolvimento científico e tecnológico e foram criados inúmeros grupos reativos que possibilitavam ligações relativamente estáveis com a celulose [35].
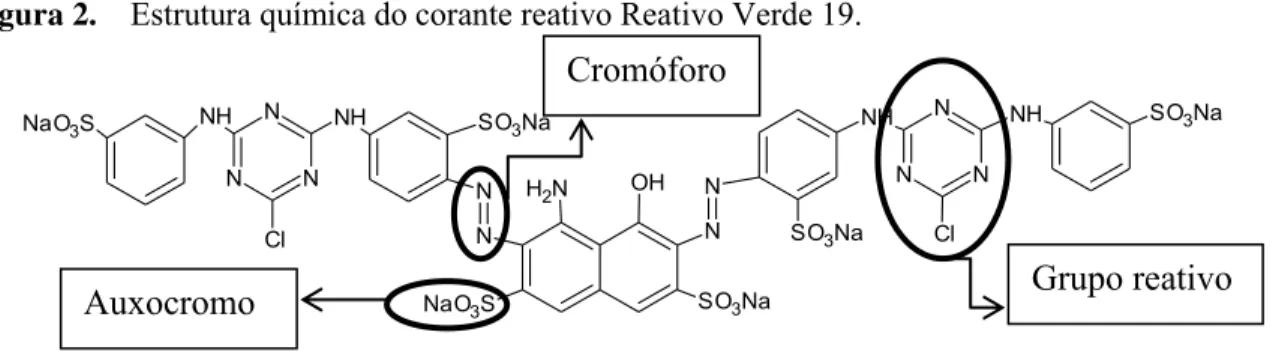
As três principais partes da molécula de um corante reativo estão representadas na Figura 2, que mostra a estrutura química do corante Reativo Verde 19, tembém conhecido como Procion Green HE-4BD, utilizado neste estudo como modelo de azo corante reativo. Neste caso, o grupo azo é o cromóforo e o grupo clorotriazinila o reativo.
Figura 2. Estrutura química do corante reativo Reativo Verde 19.
N N
N
Cl
SO3Na
N N
NaO3S
OH N H2
SO3Na N N
SO3Na NH
N N
N
Cl
NH SO3Na
NH NH
NaO3S
m/z 1418,93
Cromóforo
9
O grupo reativo destes corantes é nucleofílico sendo capaz de formar ligações covalentes com o grupo hidroxila das fibras celulósicas, com grupos amino, hidroxila e tióis das fibras protéicas e também com grupos amino das poliamidas.
1.2.2. Tingimento com corantes reativos
A fixação do corante à fibra pode ser feita através da solubilização do corante ou dos produtos gerados, ou ainda por meio de reações químicas, podendo envolver quatro tipos de interações: Iônicas, Van der Walls, Ligações de Hidrogênio e Covalentes [3]. No caso do tingimento com corantes reativos é imprescindível a presença de um eletrólito, que tem a função de reduzir ou neutralizar a carga negativa que as fibras celulósicas apresentam em solução.
Três etapas são importantes durante o processo de tingimento: a montagem, a fixação e o tratamento final do tecido. Durante a etapa de montagem, o corante é transferido da solução para a superfície da fibra através de um processo contínuo (impregnação) ou descontínuo (esgotamento). Na etapa seguinte, ocorre a reação química entre o corante e o tecido o que promove a fixação. Finalmente, o ensaboamento é realizado para retirar o excesso de corante original ou corante hidrolisado não fixado à fibra nas etapas anteriores [3,5].
1.2.3. Corantes diretos
Antes de 1884, as fibras celulósicas poderiam somente ser tingidas utilizando um mordante ou corantes índigos e uma quantidade limitada de outros corantes à cuba de ocorrência natural, o que tornava o processo de tingimento bastante complicado e caro. A descoberta dos corantes diretos tornou este processo mais fácil e barato [36]. De todos os íons presentes somente os ânions são especificamente adsorvidos na interface celulose/água. A distribuição de todos os
outros ânions é determinada pela neutralidade elétrica necessária em solução [37].
10
Figura 3. Estrutura dos corantes (A) Direto Azul 86 e (B) Direto Vermelho 81.
1.2.4. A fibra de algodão
As fibras têxteis existentes podem ser classificadas em naturais e não-naturais. As naturais podem ser de origem animal (lã e seda), vegetal (algodão, linho, etc) ou mineral (amianto), enquanto as não naturais podem ser artificiais, obtidas a partir da modificação química da celulose (viscose), ou sintéticas, fabricadas utilizando matéria-prima petroquímica (elastano, poliéster, etc) [5].
As fibras naturais de origem vegetal são fibras essencialmente constituídas por celulose que, na natureza, é sempre encontrada combinada com substâncias como lignina, ceras, gorduras e gomas. Estas fibras celolósicas têm regiões amorfas que caracterizam-se por não possuírem um ordenamento das moléculas. No tingimento de fibras celulósicas, o corante penetra na fibra através destas regiões amorfas.
A composição aproximada da fibra de algodão está representada na Tabela 1. Depois da celulose, o composto mais importante na fibra é a cera, pois é responsável pelo controle de absorção de água e funciona como lubrificante entre as fibras durante o processo de fiação [35]. A Figura 4 mostra a estrutura da cadeia celulósica.
11
Tabela 1. Composição química aproximada do algodão.
Composição Conteúdo (%)
Celulose 94,0
Proteínas 1,3
Cinzas 1,2
Pectinas 0,9
Ácidos Orgânicos 0,8
Ceras 0,6
Açucares Totais 0,3
Outros 0,9
Fonte: Ferrari (2007) [35]
Figura 4. Representação da estrutura da cadeia celulósica.
Fonte: : Ferrari (2007) [35]
1.2.5. O suor humano e Toxicidade dos corantes têxteis
O corpo humano tem entre 3.000.000 e 4.000.000 glândulas sudoríparas, sendo as do tipo
écrina e apócrina as mais conhecidas. A densidade média de suor proveniente destas glândulas varia entre diferentes pessoas e partes do corpo. Os locais de maior distribuição destas glândulas
são palmas das mãos, solas dos pés, axilas e testa. Por exemplo, existem 64 glândulas/cm2
localizadas nas costas, 108 glândulas/cm2 no antebraço e entre 600 e 700 glândulas/cm2 nas
12
Sabe-se que o suor humano contém pelo menos 61 diferentes substâncias em várias concentrações. A Tabela 2 mostra os principais constituintes e o intervalo médio de concentrações destes no suor humano, medidos considerando fatores endógenos e exógenos.
Tabela 2. Compostos constituintes, e suas concentrações médias, do suor humano.
Constituinte Concentração Média(mol L-1)
Concentração Mínima (mol L-1)
Concentração Máxima (mol L-1)
Sódio 3,1x10-2 1,1x10-4 3,9x10-1
Cloreto 2,3x10-2 1,7x10-5 2,8x10-1
Ácido Lático 1,4x10-2 3,7x10-3 5,0x10-2
Glucose 1,7x10-4 5,6x10-6 2,2x10-3
Alanina 3,6x10-4 NR NR
Histidina 5,2x10-4 2,7x10-4 1,3x10-2
Uréia 1,0x10-2 1,8x10-3 4,6x10-2
Creatina 1,5x10-5 NR NR
Ácido Pantotênico 1,1x10-1 6,8x10-8 3,6x100
Ácido Fólico 1,6x10-8 1,2x10-8 2,0x10-8
NR= não relatado na literatura
Fonte: Adaptado de Harvey (2010) [39]
O suor quando em contato com o tecido tingido, pode causar o desbotamento da cor e até considerável influência na descoloração de um tecido celulósico tingido com um azo corante e submetido à ação do suor e luz [40]. Após a extração do corante pelo suor, podem ainda ocorrer reações de oxidação ou redução gerando subprodutos algumas vezes mais tóxicos que o próprio corante.
Anteriormente, a preocupação com o fato de que os corantes poderiam penetrar na pele era focada apenas em casos de alergias e dermatites. Contudo, uma vez que um corante tóxico entra no corpo humano, este pode induzir outros efeitos danosos nas células expostas e um possível efeito degenerativo inclui danos no DNA, o que está relacionado à várias doenças, inclusive câncer [41].
13
14
Objetivos
O objetivo deste trabalho foi desenvolver métodos analíticos baseados em técnicas de espectrofotometria na região do UV-Vis, cromatografia líquida e espectrometria de massas para avaliar a degradação do corante tartrazina (alimentício), submetido à irradiação UV e solar, bem como avaliar a lixiviação dos corantes têxteis Reativo Verde 19, Direto Azul 86 e Direto Vermelho 81 de fibras de algodão quando expostos a suor sintético, com a finalidade de monitorar a estabilidade de corantes em situações adversas. Para isto, os seguintes objetivos específicos foram definidos:
Desenvolver métodos cromatográficos de CLAE-DAD e LC-MS/MS para monitorar
corantes alimentícios e têxteis em meio aquoso;
Avaliar o efeito de pH, fonte de irradiação e tempo de exposição no processo de fotólise
do corante Tartrazina;
Avaliar as condições de temperatura, tempo de contato, presença de ensaboamento
durante o processo de tingimento, que proporcionariam a transferência do corante RG-19 to tecido tingido para as soluções de suor sintético;
Avaliar as condições de temperatura, tempo de contato durante o processo de tingimento,
que proporcionariam a transferência dos corantes diretos do tecido tingido para as soluções de suor sintético;
Avaliar a mutagenicidade do corante Tartrazina e de seus subprodutos de fotólise ,
utilizando o ensaio de mutagenicidade com Salmonella typhimurium, na presença e
ausência de S9;
Avaliar a mutagenicidade do corante RG-19 e das soluções geradas após lixiviação do
15
Materiais e Métodos
3.1. Reagentes e soluções
Os solventes metanol e acetonitrila (Tedia) utilizados tem grau cromatográfico. A água utilizada no preparo das soluções e da fase móvel foi purificada no sistema Milli-Q (Millipore). Os corantes Tartrazina (> 85%) (C.I.19140), RG- 19 grau analítico (CAS 61931-49-5, 65%) [Sigma Aldrich], Direto Vermelho 81 e Direto Azul 86, também adquiridos da Sigma Aldrich, não sofreram qualquer tipo de purificação para as análises químicas.
3.2. CLAE-DAD
Foram otimizadas as melhores condições de separação cromatográfica utilizando um cromatógrafo líquido Shimadzu modelo SCL-10AVP com injeção automática, acoplado a um detector de arranjo de diodos com medidas em 427nm (absorbância máxima para o corante tartrazina) e 623 nm (para o corante reativo). Como fase estacionária foi utilizada uma coluna
C18 Phenomenex de 250 x 4,6 mm d.i., 5 µm, e como fase móvel foram testadas as soluções
aquosas: 0,08 mol L-1 NH4OAc (JT Baker) e concentrações entre 30 e 50 mmol L-1 de soluções
do líquido iônico (LI) 1-butyl-3-metilimidazol tetrafluoborato (BMIm-BF4), adquirido da Sigma
Aldrich, combinados com diferentes proporções dos solventes metanol e acetonitrila. Todas as amostras foram filtradas em membrana 0,45 µm antes da injeção no cromatógrafo e o volume injetado foi de 10 µL .
3.3. Fotólise do corante tartrazina
16
O aproveitamento do espectro ultravioleta é limitado, na prática, por três tipos de fonte disponíveis comercialmente: lâmpadas de xenônio, deutério e vapor de mercúrio. O espectro de emissão das lâmpadas de vapor de mercúrio de alta e média pressão é caracterizado por linhas mais alargadas que cobrem toda a região do UV e têm incursão na região do visível (200 - 600 nm), emitindo também calor. Já as lâmpadas de xenônio são utilizadas muitas vezes como simuladoras da irradiação solar pois emitem em uma faixa mais ampla de comprimentos de onda (200-1100 nm) abrangendo as regiões UV, visível e infravermelho do espectro luminoso [42].
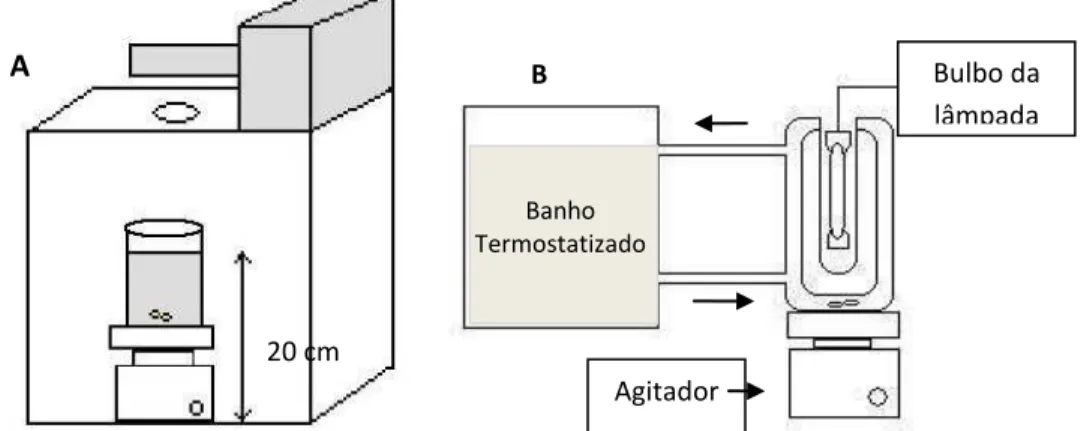
Foram utilizados três tipos diferentes de reatores, todos localizados no Instituto de Química da Unesp Araraquara: quando a lâmpada de xenônio foi utilizada, os estudos foram realizados no simulator solar (Figura 5A) do Laboratório Interdisciplinar de Eletroquímica e Cerâmica (LIEC). O sol simulado é o do meio-dia, quando o ângulo de incidência dos raios
solares é de 90o e intensidade da radiação é máxima. Este simulador é composto por uma caixa
preta, de madeira, com um orifício na parte superior por onde entra a luz roveniente da lâmpada localizada na caixa cinza mostrada na figura. Neste caso, 225 mL da amostra foram alocados em um béquer sob agitação. Já para os experimentos com a lâmpada de vapor de mercúrio, utilizou-se o reator fotoquímico (Figura 5B) que foi deutilizou-senvolvido no laboratório de Eletroquímica e Eletroanalítica, e é formado por uma célula de vidro com capacidade para 350 mL, um tubo de quartzo no qual é inserido um filamento de lâmpada e um banho termostatizado para refrigerar o sistema através da circulação de água. Finalmente, nos experimentos utilizando o sol como fonte de radiação, o reator fotoquímico solar (Figura 6) desenvolvido no Laboratório de Processos Oxidativos Avançados (LaPOA) foi usado. O reservatório, Figura 6, é composto por um vidro âmbar com capacidade para 1 L de solução; com o auxílio de uma bomba , a solução é levada até os tubos de vidro onde é irradiada pelo sol, e retorna ao reservatório. Os tubos de vidro, têm 3,6 cm de diâmetro e 49,5 cm de comprimento e ficam à uma distância de 3 cm de uma estrutura de madeira, que forma um ângulo de 22º com a superfície plana sobre a qual localiza-se. Os ensaios
foram realizados na cidade de Araraquara (22ºS 48oO), em dias ensolarados, céu com algumas,
17
Figura 5. Representação esquemática (A) do simulador solar e do (B) reator fotoquímico, utilizados para degradação fotolítica da tartrazina 1x10-5 mol L-1 .
Figura 6. Representação esquemática do reator fotoquímico utilizado para a degradação solar da solução 1x10-5 mol L-1 de tartrazina: vista lateral.
Fonte: Trovó (2008)[43]
Para os ensaios utilizando radiação solar (Figura 6) e irradiação pela lâmpada de xenônio (Figura 5 A), recolheram-se aliquotas de 10 mL após 0, 1, 2, 3, 4, 5 e 6 horas de irradiação. Para o reator fotoquímico mostrado na Figura 5 B, foram recolhidas aliquotas de 15 mL, após 0, 2, 4, 6, 10, 15, 30, 60, 120, 180 e 240 min de tratamento.
As medidas de intensidade luminosa e dose de energia foram executadas com o auxílio de um radiômetro PMA 2100 (Solar Light CO) na região UV-A (320-400nm).
3.4. Monitoramento da fotodegradação da Tartrazina
Além das análises cromatográficas citadas no item 3.2., a degradação foi acompanhada também através de análises de carbobo orgânico total (COT) e medidas espectrofotométricas. As
Agitador Banho
Termostatizado
Bulbo da lâmpada
20 cm
A B
Tubo de vidro
Bomba
Radiômetro Superfície Refletora
18
medidas espectrofotométricas foram realizadas em um equipamento UV-VIS HP modelo 8453, sendo as soluções inseridas em cubetas de quartzo de caminho óptico de 1 cm e analisadas no intervalo de comprimento de onda entre 200 e 800 nm. A mineralização da matéria orgânica presente na solução durante o processo de fotólise foi monitorada por análises de carbono orgânico total em um Analisador de Carbono Orgânico Total Shimadzu 5050 A.
3.5. Determinação dos produtos de degradação do corante Tartrazina por LC-MS/MS
Para a elucidação dos produtos formados no processo de fotólise da tartrazina foram
feitas análises por espectrometria de massas utilizando um sistema LC-MS/MS Q Trap. O
espectrômetro utilizado foi do tipo ion trap linear (Applied Biosystems 3200 QTrap) equipado
com um TurboIonSpray acoplado ao sistema de cromatografia líquida, sendo as condições
experimentais descritas a seguir: temperatura da fonte de íons igual a 550 ºC, voltagem no TurbolonSpray de -4,5 kV no modo de ionização negativo, potencial de dessolvatação ajustado
para -50 V e N2 ultra puro como gás de colisão.
No método desenvolvido, primeiramente foi realizada uma varredura total (EMS- Enhanced Mass Spectrometry) para obter uma visão geral de todas as espécies presentes na amostra. Em seguida utilizou-se a ferramenta enhanced resolution (ER), para determinar as
razões isotópicas presentes, com velocidade de varredura de 250 uma s-1 por 50 ms. Finalmente,
foi feita a quebra dos íons desprotonados (ferramenta enhanced product íon-EPI) para a
elucidação estrutural, com velocidade de varredura de 4000 uma s-1, 400 ms para a realização
dos experimentos de EPI e energia de colisão de 10, 30 e 50 V. O potencial de entrada de 8 V e
trapeamento em Q0 foi comum a todos os experimentos sendo a faixa de trabalho de 50 a 600
m/z . As amostras foram diluídas com solução 50:50 MeOH/H2O + 1 mmol L-1 NH4 OAc e
filtradas em membrana 0,22 µm antes da injeção no cromatógrafo. O cromatógrafo aclopado é Agilent 1200, sendo a fase estacionária uma coluna Agilent Zorbax C-18 150 x 4,6 mm d.i., 5
µm, a fase móvel 70:30 MeOH/H2O + 1 mmol L-1 NH4OAc, o modo de eluição isocrático e a
19
3.6. Purificação da tartrazina
Para a caracterização do corante, primeiramente foi utilizada Cromatografia em Camada Delgada (CCD) analítica. Um béquer de 250 mL (9,5 cm de altura x 6,5 cm de diâmetro) foi usado como câmara de eluição. As placas são compostas por sílica gel (Whatman) com 250 µm de espessura, cortadas em tiras de 10 cm de comprimento x 5 cm de largura. A câmara foi
saturada com 20 mL da mistura de solventes 1-butanol (Synth)/ Etanol (Quemis) / H2O/ NH4OH
(JT Baker) (50:25:25:10) [44] por 2 horas. Filtro de papel foi adicionado à câmera para melhorar o processo de saturação. Aproximadamente 4 mg do corante tartrazina foram dissolvidos em 0,8
mL de NaOH (Quemis) 0,5 mol L-1. A amostra foi aplicada à placa, com o auxílio de um capilar,
e a revelação ocorreu em uma câmara UV.
Para a separação em coluna a fase móvel utilizada foi a mesma mistura de solventes utilizada como eluente na CCD. Como fase estacionária utilizou-se 1,1400 g de sílica dissolvidos em 100 mL de fase móvel e empacotados, formando uma coluna com 8,5 cm de altura e 1 cm de diâmetro. Neste caso, 3,2 mg do corante foram solubilizados em 0,7 mL da fase móvel antes da aplicação na coluna.
3.7. O teste da Salmonella/ microssoma
A mutagenicidade tanto do corante tartrazina quanto dos seus subprodutos, obtidos após
exposição à irradiação UV, foi avaliada utilizando o teste da Salmonella/microssoma de acordo
com a ISO 16240:2005 [45] com cepas de Salmonella typhimurium TA98 (hisD3052, rfa, Δbio,
ΔuvrB, and pKM101) e TA100 (hisG46, rfa, Δbio, ΔuvrB, pKM101) com e sem ativação
metabólica exógena. O parâmetro his é referente à mutação responsável pela síntese da histidina,
rfa representa a permeabilidade da membrana de lipopolissacarídeos, Δbio a dependência à
biotina, ΔuvrB refere-se à deleção do gene uvrB e pKM101 significa ampicilina resistente.
20
fígado de rato pré-tratado com Aroclor-1254 (mistura S9). Assim, as substâncias que exercem sua atividade mutagênica após metabolização via citocromo P450 serão detectadas pela adição de S9 e os mutágenos que não precisam ser metabolizados por essa via para exercerem seu efeito mutagênico, serão identificados sem S9. A mistura S9 foi preparada em uma concentração de 4% (v/v), da seguinte maneira: cada 100 mL de mistura S9 é composto por 39,5 mL de água destilada estéril, 50 mL de tampão fosfato (0,2 M), 4 mL de NADP (0,1 M), 0,5 mL de glicose-6-fosfato (1,0 M), 2 mL da solução de sais (KCl 1,65 M e MgCl2 0,4 M) e 4 mL de fração S9. A fração S9, por sua vez, é um reagente é adquirido liofilizado, armazenado a -20°C e ressuspendido com 2,1 mL de água destilada estéril no momento do uso. É preparada a partir de microssomas de células de fígado de rato, tratado com o indutor enzimático Aroclor 1254 e separado por centrifugação a 9000g. Essa solução sempre foi preparada assepticamente, seguindo a ordem dada na adição dos reagentes. Após 3 horas a solução excedente foi descartada.
Para TA98 e TA100, os controles positivos foram 1-óxido-4-notriquinolina (4NQO)
(Sigma Aldrich) a 0,5 µg.placa-1 e 2-aminoantraceno (2AA) (Sigma Aldrich) a 2,5 µg.placa-1,
ambos solubilizados em dimetilsulfóxido. Água esterelizada foi utilizada como controla negativo. O teste foi conduzido utilizando uma única dose pra cada tratamento. Pra cada placa, 0,5 mL de solução de fosfato de sódio ou da mistura S9 e 1 mL da amostra foram adicionados. As amostras foram esterilizadas por filtração em membrana 0,45 μm.
O teste foi realizado utilizando doses únicas de 5,34 µg de amostra por placa, em duplicata. Depois de 66 horas de incubação a 37°C, as colônias foram contadas manualmente utilizando um estereoscópio. Antes de cada teste, as amostras foram analisadas, para certificar-se que não estavam contaminadas, usando placas com o nutriente agar.
A toxicidade foi também avaliada através da observação das placas utilizando um
estereoscópio. Resultados estão expressos como números de revertentes.µg-1. A proporção
21
3.8. Tingimento das fibras de algodão utilizando o corante têxtil RG19
O tingimento das fibras de algodão e a extração pelo suor sintético foram realizados na Faculdade de Ciências Farmacêuticas da USP- Ribeirão Preto, em colaboração com a pós-doutoranda Daniela Morais Leme. O processo de tingimento foi realizado de acordo com Neves et al [46], por dois métodos diferentes e com algumas modificações.
3.8.1. Tingimento com adição de álcali e sem ensaboamento
Inicialmente, pedaços de tecidos de algodão, com dimensões 3x6 cm2, foram pesados
para calcular o volume de água do banho de tingimento e as quantidades necessárias de corante,
cloreto de sódio (NaCl) e carbonato de sódio (Na2CO3), que deveriam ser adicionados ao banho
durante este processo. Para estes cálculos as seguintes relações foram adotadas: - volume do banho: 1 kg fibra têxtil : 30 L de água
- massa corante: 2% do peso da fibra têxtil (288 mg para o tingimento com ensaboamento e 244 mg pra o sem ensaboamento)
- massa de NaCl: 70 g/L
- massa de Na2CO3: 15 g/L
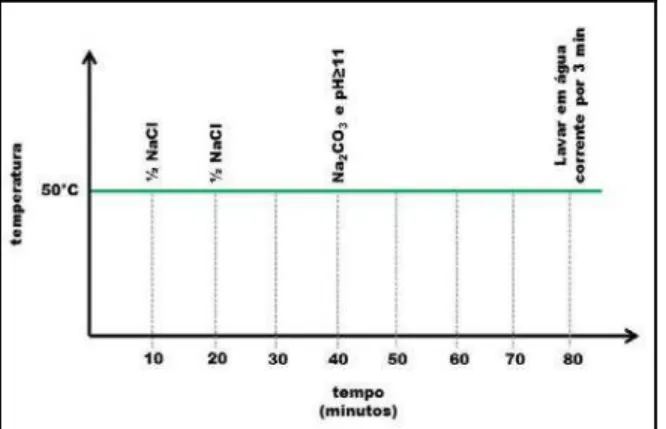
Em um recipiente de vidro disposto em banho-maria a 50°C, adicionou-se a água do banho de tingimento. Após a estabilização da temperatura a 50°C, o corante e o tecido têxtil foram adicionados com agitação suave e os demais reagentes foram posteriormente adicionados conforme o gráfico de tingimento ilustrado na Figura 7.
Figura 7. Etapas do processo de tingimento de fibra de algodão por corante reativo.
22
Após a adição do Na2CO3 e ajuste do pH≥11, os tecidos foram mantidos no banho de
tingimento por mais 40 minutos, sendo em seguida lavados em água fria corrente por 3 minutos.
3.8.2. Tingimento completo (com adição de álcali e ensaboamento)
Todas as etapas descritas acima foram igualmente realizadas para o tingimento completo. O que difere neste procedimento é a realização do ensaboamento após a lavagem do tecido em
água corrente. Para isso, utilizou Resiwash AC® (Resinac, Jandira-SP), que é categorizado como
um sistema coloidal com alto sistema dispersante. Desta forma, após a realização do tingimento anteriormente descrito, os tecidos foram lavados por 5 minutos em água à 60ºC e colocados no
banho de Resiwash AC® (0.6 g/L) por 15 minutos à temperatura de fervura. Decorrido este
tempo, os tecidos foram novamente lavados por 3 minutos em água a 60ºC e por mais 3 minutos em água fria corrente.
3.8.3. Extração do corante RG 19 pelas soluções de suor sintético
A lixiviação dos corantes das fibras de algodão tingidas foi realizada utilizando suor
sintético como extrator, segundo Meinke et al. [47].
23 3.8.4. Determinação dos possíveis produtos de degradaçãodo corante RG-19 por LC-MS/MS
Para a investigação da formação de possíveis subprodutos oriundos da degradação promovida pelas soluções de suor sintético, utilizaram-se análises em um sistema LC-MS/MS Q
Trap. O espectrômetro utilizado foi o mesmo descrito no item 3.5. As amostras foram diluídas
com solução 50:50 MeOH/H2O + 1 mmol L-1 NH4 OAc e filtradas em membrana 0,22 µm antes
da injeção no cromatógrafo. A fase estacionária utilizada foi uma coluna Agilent Eclipse XDB
C18 (150 x 4,6 mm d.i.) 5 µm, a fase móvel ACN/H2O seguindo o gradiente mostrado na Tabela
3 e a vazão de 1,0 mL min-1. O volume de injeção foi de 20 µL e a temperatura do forno de
40°C.
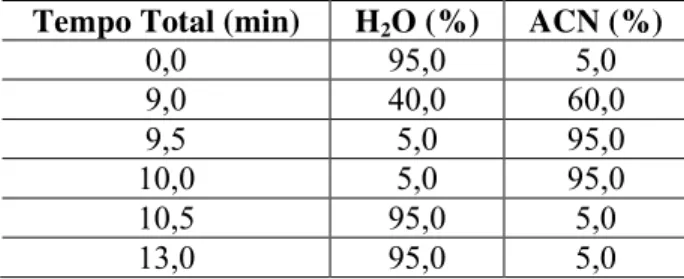
Tabela 3. Gradiente utilizado para a eluição do corante RG-19 e da amostra extraída pelo suor sintético.
Tempo Total (min) H2O (%) ACN (%)
0,0 95,0 5,0
9,0 40,0 60,0
9,5 5,0 95,0
10,0 5,0 95,0
10,5 95,0 5,0
13,0 95,0 5,0
O espectrômetro utilizado foi do tipo ion trap linear (Applied Biosystems 3200 QTrap)
equipado com um TurboIonSpray acoplado ao sistema de cromatografia líquida, sendo as
condições experimentais descritas a seguir: temperatura da fonte de íons igual a 550 ºC, voltagem no TurbolonSpray de -4,5 kV no modo de ionização negativo, potencial de
dessolvatação ajustado para -60 V e N2 ultra puro como gás de colisão. O potencial de entrada de
-4,5 V e trapeamento em Q0 foi comum a todos os experimentos sendo a faixa de trabalho de 150
a 1500 Da.
3.8.5. O teste da pré-incubação da Salmonella/microssoma
A avaliação da mutagenecidade do corante RG-19 e das amostras extraídas pelo suor
sintético foi realizada utilizando o teste de Ames padrão, com as linhagens TA98 (hisD3052,
rfa, Δbio, ΔuvrB, pKM101, detector por deslocamento do quadro de leitura) e T100 (hisG46, rfa,
24
e YG1042, que apresentam uma super produção de nitroredutase e o-acetiltransferase. O processo de pré-incubação é considerado mais seletivo na detecção de mutações que o método de incorporação da placa, uma vez que metabólicos mutagênicos de vida-curta têm uma maior chance de reagir com as cepas teste no pequeno volume da mistura de pré-incubação.
Os experimentos foram realizados utilizando cinco doses e em triplicata, na presença e na ausência do metabólito de ativação exógena S9 e utilizando 30 minutos de pré-incubação a 37°C. Para o corante comercial, a maioria dos experimentos foi realizada utilizando um intervalo de dosagem entre 5 e 5000 µg/placa. Para as amostras extraídas pelo suor, a maior dose testada baseou-se na maior concentração de corante encontrada pelas análises de CLAE-DAD. Foi utilizado como branco uma amostra de suor sem corante. Além disso, uma vez que a histidina presente no suor poderia ter influenciado o teste de mutagenicidade, este branco de solução de suor sintético foi preparado sem a adição deste aminoácido. Todos os resultados positivos foram confirmados através de um segundo experimento.
Em resumo, 100 µL de culturas de cada linhagem de S. typhimurium, cerca de 109
células/mL, 500 µL de tampão fosfato de sódio 0,2 mol L-1 ou mistura S9 e 100 µL do corante
foram incubados a 37°C por 30 minutos, sem agitação. Depois da incubação, 2 mL de agar foram adicionados e a mistura foi transferida para uma placa agar e estas placas foram, então, incubadas a 37°C por 66 horas. As colônias foram contadas manualmente. As amostras foram consideradas positivas quando significantes ANOVA e doses-resposta foram obtidos do modelo de Bernstein [41]. Os resultados foram expressos como a média do número de revertentes por placa ± desvio padrão.
25
3.9. Tingimento das fibras de algodão utilizando os corantes Direto Azul 86 e Direto Vermelho 81
Uma máquina de tingimento (Texomat), Figura 8, foi utilizada no tingimento do algodão, seguindo procedimento descrito na literatura [49]. Cada béquer continha 10 g do tecido de algodão imerso no banho de tingimento composto por 100 mL de uma solução estoque do
corante, em uma concentração de 4 g L-1, 20 mL de solução estoque 100 g L-1 Na
2SO4 e 280
mL de água para um total de 400 mL de banho de tingimento (proporção de 1:40 mg de tecido/mL de solução). A temperatura foi mantida em 32°C por 20 min e depois de resfriada, o tecido foi apenas levemente enxaguado para simular o pior dos casos
26 3.9.1. Lixiviação dos corantes diretos da fibra de algodão
A extração dos corantes das fibras de algodão tingidas e o preparo das soluções de suor sintético foram realizados da maneira descrita no item 3.8.3. Após o preparo, volumes das soluções de suor sintético, previamente calculados com base na proporção 1:50 (mg de tecido/mL de solução de suor), foram adicionados a recipientes de vidro dispostos em banho-maria a 37°C e 42°C. Após a estabilização da temperatura, os tecidos tingidos foram colocados nos frascos contendo as diferentes soluções de suor sintético e amostras foram coletadas após 2, 8 e 24 horas do tempo inicial. A concentração dos corantes nos extratos foi determinada através de análises espectrofotométricas no UV-Vís (sendo os espectros obtidos no comprimento de onda máximo de cada corante 508 nm para o DV 81 e 615 nm para o DA 86) utilizando diferentes curvas de calibração para cada solução de suor.
3.9.2. Análise por Cromatografia em Camada Delgada
Soluções-padrão dos corantes e as soluções de suor após lixiviação dos corantes foram analisadas por CCD. Diversas fases móveis foram testadas, Tabela 4, para obter a melhor condição de eluição.
Tabela 4. Fases móveis testadas para a eluição dos corantes DA 86 e DV 81 utilizando sílica gel como fase estacionária.
Composição da Fase móvel Referência
i-propanol/metiletilcetona/NH4OH 25% (4:3:3) 50
n-butanol/NH4OH/ piridina/ metanol (4:3:2:1) 51
2-propanol/ NH4OH 25% (7:3) 52
butanol/etanol/H2O (9:1:1)(7:3:3)(6:4:4) 53
butanol/etanol/ 25% NH4OH/piridina/ H2O (8:3:4:4:3) 54
butanol/DMF/ NH4OH (8:4:7) 55
Uma câmara de eluição ( 29 x 9,5 x 27 cm) foi utilizada, sendo a fase estacionária placas de sílica gel para CCD preparativa, Partisil® PLK5F, 150 A, nas dimensões 20 x 20 cm, com espessura de 1000 µm. A câmara de eluição foi saturada com a fase móvel que proporcionou a
melhor separação das frações, butanol/DMF/NH4OH (8:4:7) (300 mL),por 2 horas. As soluções
de suor sintético contendo os corantes tiveram a água evaporada e o sólido resultante foi