UNIVERSIDADE ESTADUAL PAULISTA
FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS
CAMPUS DE JABOTICABAL
SULFATO DE GLUCOSAMINA E DE CONDROITINA SOBRE O
DESEMPENHO, CARTILAGEM ARTICULAR E DENSIDADE
MINERAL ÓSSEA EM FRANGOS DE CORTE.
Giuliana Milan de Andrade Rocha Garcia
Orientadora: Profa. Dra. Silvana Matinez Baraldi Artoni
Dissertação apresentada à Faculdade de Ciências Agrárias e Veterinárias - Unesp, Campus de Jaboticabal, como parte das exigências para a obtenção do título de Mestre em Zootecnia
SUMÁRIO
1. RESUMO...3
2. INTRODUÇÃO ... 5
3. REVISÃO DA LITERATURA ... 7
3.1MORFOFISIOLOGIA ÓSSEA. ... 7
3.2ENFERMIDADES DO SISTEMA LOCOMOTOR ... 8
3.3CARTILAGEM ARTICULAR ... 12
3.4SULFATO DE GLUCOSAMINA E SULFATO DE CONDROITINA. ... 13
4. OBJETIVOS ... 15
5. MATERIAL E MÉTODOS ... 15
5.1.LOCAL, PERÍODO, INSTALAÇÕES, ANIMAIS E MANEJO. ... 15
5.2DELINEAMENTO EXPERIMENTAL ... 16
5.3TRATAMENTOS EXPERIMENTAIS ... 16
5.4VARIÁVEIS AVALIADAS ... 17
5.4.1 Desempenho ... 18
5.4.2 Rendimento de carcaça e cortes... 18
5.4.3 Morfometria Hepática ... 18
5.4.4 Avaliação histológica da cartilagem articular ... 19
5.4.5 Análise densitométrica do osso... 20
6. Resultados e Discussão ... 20
6.1DESEMPENHO ... 20
6.2RENDIMENTO DE CARCAÇA E DE PARTES ... 23
6.3AVALIAÇÃO DA MORFOMETRIA HEPÁTICA ... 24
6.4HISTOLOGIA DA CARTILAGEM ARTICULAR ... 25
6.5DENSITOMETRIA MINERAL ÓSSEA ... 28
7. Conclusões ... 30
Sulfato de glucosamina e de condroitina sobre o desempenho, rendimento de carcaça e fisiologia de cartilagem em frangos de corte.
RESUMO - Este estudo teve como objetivo avaliar os efeitos do sulfato de glucosamina, de condroitina e da associação de ambos no sistema locomotor e no desempenho de frangos de corte de 1 a 42 dias de idade. Foram utilizados 900 pintos de corte machos de um dia, da linhagem Cobb-500®, distribuídos em delineamento inteiramente casualizado, com seis tratamentos e cinco repetições de 30 aves cada. Os tratamentos utilizados foram: T1 - controle negativo, T2 - 25% sulfato de glucosamina e 75% condroitina, T3 – 50% sulfato de glucosamina e 50% condroitina, T4 – 75% sulfato de glucosamina e 25% condroitina, T5 – 100% sulfato de 100% glucosamina e T6 – 100% sulfato de condroitina. As rações experimentais para fase de criação foram formuladas à base de milho e farelo de soja, seguindo-se as recomendações de Rostagno et al. (2011), para as respectivas fases de criação: inicial (1-21 dias) e crescimento (22-42 dias). Foram avaliados os parâmetros de desempenho zootécnico, rendimento de carcaça e partes, densitometria óssea dos tibiotarsos, histoquímica das cartilagens das tíbias localizadas nas epífises proximais e morfometria hepática, analisadas aos 21 e 42 dias. As análises estatísticas dos dados foram realizadas pela análise de variância com o auxílio do procedimento General Linear Model do SAS (2002) e em caso de significância estatística, as médias foram comparadas pelo teste de Tukey, ao nível de 5% de probabilidade. Os diferentes níveis de sulfato de glucosamina e de condroitina não determinaram efeito significativo sobre os parâmetros de desempenho das aves, rendimento de carcaça e partes e morfometria hepática. Entretanto, foi observado que o tratamento com o nível de 100% de sulfato de glucosamina proporcionou maior número de condrócitos nas cartilagens articulares de aves com 21 e 42 dias de idade. Para os parâmetros de densitometria, o nível de 100% de sulfato de glucosamina proporcionou maior densidade mineral óssea aos 21 dias, porém aos 42 dias de idade, o nível de 100% de sulfato de condroitina proporcionou maior resultado de densitometria, melhorando as características do sistema locomotor.
Effect of glucosamine sulfate and chondroitin sulfate on performance, carcass yield and physiology of cartilage in broiler chickens.
Summary – This study aimed to evaluate the effects of glucosamine sulfate, chondroitin and combination of both in the locomotor system and the performance of broiler chickens during 1-42 days of age. It was 900 Cobb - 500 ® line chicks, in a completely randomized design with six treatments and five replicates of 30 birds each design. The treatments were: T1 - negative control, T2 - 25 % glucosamine sulfate and 75% chondroitin, T3 - 50 % glucosamine sulfate and 50% chondroitin, T4 - 75 % glucosamine sulfate and 25 % chondroitin, T5 - 100 % of glucosamine sulfate and T6 - 100% chondroitin sulfate. The experimental diets for creation phase were formulated based on corn and soybean meal, following the recommendations of Rostagno et al. (2011), for the respective phases of creation: initial (1-21 days ) and grower ( 22-42 days). Parameters of growth performance, carcass and parts, bone densitometry of tibiotarsos, staining of cartilage located in the proximal tibia epiphysis and liver morphology, analyzed at 21 and 42 days were evaluated. Statistical analyzes of the data were performed by analysis of variance method with the aid of the General Linear Model of SAS (2002 ) and in case of statistical significance, the
means were compared by Tukey test at 5 % probability. The different levels of glucosamine and chondroitin sulfate did not cause significant effect on the parameters of broiler performance, carcass yield and liver parts and morphometry. However, it was observed that the treatment with the level of 100% glucosamine sulfate yielded a greater number of chondrocytes in articular cartilage in birds 21 and 42 days of age. For the parameters of densitometry, the level of 100 % of glucosamine sulfate provided greater bone mineral density at 21 days, but at 42 days of age, the level of 100 % of chondroitin sulfate provided higher income densitometry, outperforming the locomotors system.
2. INTRODUÇÃO
Devido à vertiginosa velocidade de crescimento do frango de corte e grande capacidade de deposição de carne, originaram-se alguns distúrbios metabólicos que acarretam, na maioria das vezes, prejuízos ponderáveis na criação. Fazem parte destes distúrbios metabólicos a síndrome ascítica ou síndrome da hipertensão pulmonar; síndrome da morte súbita e as deformidades ou problemas de pernas, também denominadas de fraquezas das pernas e desordens dos locomotores, entre outros distúrbios. (SU et al., 2003).
A disfunção do sistema locomotor em frangos de corte possui uma relação direta com o aumento do ganho de peso, um parâmetro que é buscado como o maior objetivo da criação. A ocorrência desta enfermidade é responsável por perdas relevantes na avicultura de corte mundial. Pesquisas recentes estimam que estes transtornos do esqueleto das aves resultem em taxas de mortalidade entre 2 a 8% em frangos de corte, sendo que a incidência maior ocorre em machos (JUNIOR, 2009).
Membros do Comitê Científico da Comissão de Saúde e Bem-estar de Animal (SCAHAW, 2006) descreveram que, pelo fato de causarem significativas claudicações nas aves, tais doenças são motivo de sérias preocupações com bem estar animal. O problema no sistema locomotor é considerado como uma das quatro principais causas de redução no bem-estar dos frangos de corte criados em condições comerciais, sendo que os outros três tópicos são: condições de cama, densidade populacional e manutenção e aquisição de equipamentos, como ventiladores e aquecedores.
Neste contexto, os efeitos do sulfato de glucosamina e de condritina têm sido estudados há alguns anos nos tratamentos de osteoartrite humana, equina e também canina. Sendo promissores os resultados encontrados no restabelecimento dos movimentos articulares e na possível regeneração da cartilagem que protege as extremidades dos ossos.
A glucosamina é uma substância sintetizada pelo organismo encontrada na cartilagem e é composta de glicose e aminoácido. É o precursor para a síntese de várias macromoléculas importantes como: glicoproteínas, glicolipídeos, glico-aminoglicano (mucopolissacarídeos). Desempenha um importante papel no reparo e na manutenção da cartilagem articular (MOSBY, 2002).
Os tecidos contendo estas macromoléculas incluem: fluido sinovial nas articulações, tendões, ligamentos, cartilagem, membranas basais, membranas mucosas (da traqueia e do sistema digestório), várias estruturas no olho, vasos sanguíneos e válvulas do coração. A deficiência de glucosamina pode reduzir o índice de produção destas importantes macromoléculas causando o enfraquecimento de certos tecidos envolvidos. Nos casos de traumas nestes tecidos, a quantidade de glucosamina normalmente sintetizada pelo corpo é insuficiente para o reparo do trauma (MARTINDALE, 2002).
Neste sentido, o sulfato de glucosamina, um sal da glucosamina, que pode ser sintetizado artificialmente, e as macromoléculas quando associadas, ajudam o fluido sinovial a ficar resistente e elástico, proporcionando assim uma tentativa do reestabelecimento do sistema locomotor, pois alguns dos mecanismos da ação anti-inflamatória da glucosamina podem estar relacionados com o estímulo da biossíntese dos proteoglicanos. Tem sido sugerido que os recém-sintetizados proteoglicanos podem estabilizar membranas celulares, resultando assim, em um efeito anti-inflamatório.
O sulfato de condroitina tem sido pesquisado em função de suas ações condroprotetoras, principalmente na inibição de enzimas que atuam na degradação cartilaginosa (DIAZ et al., 1996), além das ações condroestimuladoras como o aumento da síntese de proteoglicanas (BEALE et.al., 1990).
Os índices relativamente altos de ocorrência desta patologia, bem como os significativos prejuízos para a atividade, motivaram uma revisão e pesquisa bibliográfica acerca de um conhecimento científico mais recente.
Tendo em vista a importância do bem-estar e do melhor desenvolvimento dos frangos de corte, é imprescindível a realização de novos estudos, possibilitando a diminuição de problemas locomotores nas aves, melhorando assim seu desempenho e bem estar.
3. REVISÃO DA LITERATURA
3.1 Morfofisiologia óssea.
O osso é um tecido multifuncional, metabolicamente muito ativo, constituído de uma população heterogênea de células, em diferentes estágios de diferenciação celular que, através de uma intrincada e muito bem coordenada sequência de eventos, regula a mobilização e a deposição mineral durante a vida do animal. O balanço entre esses dois processos pode levar a um ganho ou diminuição na massa óssea e, possivelmente no tamanho do sistema esquelético. Além disso, o osso também é o responsável pela sustentação da musculatura, e seu crescimento e desenvolvimento estão intimamente associados com o crescimento do resto do corpo. Tentativas no sentido de aumentar a taxa de crescimento e o desenvolvimento do resto do corpo sem um aumento compensatório do crescimento do tecido ósseo pode levar ao desenvolvimento de doenças esqueléticas (ATTUR et. al., 2002).
O osso é um tipo de tecido conectivo dinâmico, constituído de aproximadamente 70% de mineral, 22% de proteína e 8% de água. Colágeno do tipo I, constitui, aproximadamente 95% da matriz orgânica; os 5% restantes são constituídos de proteoglicanas e várias outras proteínas do tipo não colágeno. A forma do sal cristalino depositado sobre a matriz orgânica do osso está sob controle celular, e é constituída principalmente de fósforo e de cálcio na forma de hidroxiapatita (SHARMA et. al., 2006).
representem apenas 2% do tecido ósseo, elas são as responsáveis pela sua formação e manutenção ao longo da vida. Os osteoblastos, osteócitos e as células osteogênicas são responsáveis pela formação do tecido ósseo, já os osteoclastos pela reabsorção óssea (LAWRENCE et. al., 1998).
Dois sistemas fisiológicos, o hematopoiético e o estroma fibroblástico, estão envolvidos na produção das células do tecido ósseo. Enquanto os osteoclastos são derivados do sistema hematopoiético, os osteoblastos, os osteócitos, os condroblastos, e os condrócitos são derivados do sistema do estroma fibroblástico (PIZZAURO et.al.,1998).
A formação do esqueleto ou ossificação ocorre ou por um processo indireto chamado endocondral ou por um processo direto denominado intramembranoso. Os termos endocondral e intramembranoso referem-se aos locais ou ambientes nos quais a formação e a ossificação ocorrem. O termo endocondral refere-se àquele crescimento que ocorre na cartilagem, e o termo intramembranoso refere-se ao crescimento que acontece na membrana chamada periósteo (DIEPPE et.al., 2005).
A maioria dos ossos do corpo é formada, inicialmente, como a cartilagem hialina e, posteriormente, substituída por osso, através da ossificação endocondral. Nesse tipo de ossificação, a cartilagem hialina funciona como um molde do osso a ser formado (MICHEL et. al.,2005).
3.2 Enfermidades do sistema locomotor
As principais funções do esqueleto são: proteger os tecidos moles, servir de apoio para a fixação dos músculos, facilitando, assim, sua ação e o movimento corporal e constituir reserva de 99% do cálcio e 90% do fósforo do organismo (HOCHBERG, 2006).
muscular alterada pode produzir cargas anormais sobre os ossos, predispondo os animais a deformidades ósseas (SILVA et. al., 2006).
Alguns autores acreditam, no entanto, que o peso corporal por si próprio não desencadearia a ocorrência das desordens esqueléticas, a taxa de crescimento seria sim o principal fator envolvido. A diminuição do ritmo de crescimento da ave causaria redução dramática na incidência das deformidades das pernas. No entanto, esta prática nem sempre é economicamente viável (KRAUS, 1997).
O objetivo principal da avicultura de corte é maximizar a massa muscular das aves em curto espaço de tempo mediante a combinação adequada da seleção genética, da nutrição e do manejo. O geneticista e o nutricionista, ao realizarem o aprimoramento genético das linhagens e estabelecerem suas necessidades nutricionais, respectivamente, não podem jamais esquecer da integridade do esqueleto e de sua função. Sabe-se que inúmeros fatores nutricionais, como as vitaminas, os minerais, a proteína e os aminoácidos, além do balanço eletrolítico, estão envolvidos no desempenho normal do osso.
Edwards (2000) destaca que oito vitaminas, 13 elementos minerais e seis aminoácidos, além da proteína e da energia alimentar, estão diretamente envolvidos na etiologia dos problemas esqueléticos das aves. No relativo aos aminoácidos, tem sido verificado que as desordens locomotoras dos frangos de corte estão associadas as dietas deficientes em arginina ou contendo elevados teores de lisina. O desequilíbrio entre estes aminoácidos interfere diretamente no metabolismo do osso, principalmente durante a fase de desenvolvimento. Na prática, falhas de nutrição e manejo associados ao rápido crescimento das aves, resultam em disfunções locomotoras traduzidas, inicialmente, por alterações dos hábitos alimentares (ingestão de cama), conversão alimentar ruim, aumento do número de refugos que terminam em elevada condenação no abate, e acarretam expressivas perdas econômicas.
Neste contexto, devido ao processo de mineralização se encontrar diminuído ou até ausente na discondroplasia, resultados contraditórios tem sido descritos em relação a concentração da fosfatase alcalina na discondroplasia tibial (THORP, 1998) enquanto Wuthier et al. (1985) admitem que atividade da fosfatase alcalina diminui durante o processo de discondroplasia.
A discondroplasia tibial é um defeito no processo de formação endocondral, caracterizada por um cartilagem branca, opaca, não vascularizada, desmineralizada, em metáfase que geralmente apresenta um necrose (HARGEST et al., 1985). Devido ao processo de desmineralização se encontrar diminuído ou até ausente na discondroplasia (HARGEST et al., 1985), parece ser de extrema importância a determinação dos níveis de fosfatase alcalina na cartilagem de crescimento de aves acometidas.
Várias hipóteses tem sido propostas para explicar patogeneidade da discondroplasia tibial. Alguns autores admitem que a discondroplasia poderia ser atribuída à síntese de matriz óssea cartilaginosa anormal, que resiste a invasão vascular, devido a um defeito nos condrócitos no processo de ossificação endocondral (POULOS et al., 1978).
De acordo com Rowland (1987), as enfermidades do aparelho locomotor com origem das alterações da placa de crescimento (cartilagem de conjugação ou disco epifisário) acontecem quando ocorrem os erros na matriz cartilaginosa (raquitismo, discondroplasia e condrodistrofia) ou quando ocorre a necrose da cabeça do fêmur.
Desde sua descoberta, a incidência da discondroplasia tibial em populações de frango de corte vem aumentando acentuadamente, acompanhando o melhoramento genético das linhagens modernas ao ritmo de crescimento. A discondroplasia tibial foi primeiramente descrita em frangos de corte por Leach & Neshein (1985), em seguida em perus por McCapes (1967) e em patos por Wise & Jennigs (1972).
Esta é uma doença do tecido ósseo, com predisposição genética, que determina transtornos do aparelho locomotor, atingindo as aves ao redor de três semanas de idade. É caracterizada pela persistência da cartilagem pré-hipertrófica que não sofreu calcificação durante o processo de crescimento do osso e que se apresenta de forma amorfa, avascular e de tamanho variável no disco epifisário, principalmente da epífise proximal do tibiotarso (LEESON, 1988)
uma camada de condrócitos pré-hipertróficos e de uma cartilagem na tíbia proximal que não é calcificada, e resistente à invasão vascular. Além disso, tem sido proposto por Pizzauro et. al., (1998) que, na discondroplasia tíbial, a etapa final do processo de calcificação não ocorre devido ao fato de que os efetores de alguns genes, relacionados com o mecanismo de calcificação do disco de crescimento podem apresentar algumas de suas propriedades químicas ou biológicas alteradas e/ou não serem expressos.
Apesar da discondroplasia tibial merecer atualmente a atenção de inúmeros pesquisadores, os eventos químicos e biológicos envolvidos nesse processo ainda não estão perfeitamente elucidados. Na tentativa de explicar esse mecanismo, alguns autores admitem que o estímulo mecânico juntamente com o genótipo e alterações nos constituintes da dieta podem interromper os eventos envolvidos no processo de diferenciação dos condrócitos e desencadear o processo de formação da lesão (REDDI, 2000).
De fato, estudos realizados por vários pesquisadores mostraram que a interrupção do processo de diferenciação dos condrócitos leva à formação de uma camada de condrócitos pré-hipertróficos e de uma matriz óssea que não é calcificada e resistente à invasão vascular (EDWARDS, 2000). Como os condrócitos continuam a proliferar-se normalmente, ocorre um acúmulo de condrócitos pré-hipertróficos e a lesão aumenta em tamanho. Nessas condições, o fornecimento de nutrientes e de oxigênio aos condrócitos localizados no interior da lesão é inadequado, o que resultaria em maior morte celular por apoptose (PRAUL et.al.,2000).
Alguns autores admitem ainda, que a etapa final do processo de calcificação não acontece, devido ao fato de que os efetores de alguns genes relacionados com o mecanismo de calcificação do disco de crescimento de aves podem apresentar algumas de suas propriedades alteradas e/ou não serem expressos (PIZZAURO et.al.,1998).
biomecânico para pronto atendimento de suas necessidades locomotoras; em contrapartida, este esqueleto perde em rigidez e força facilitando o aparecimento das deformidades ósseas (EDWADS, 2000). Acrescente-se que o frango de corte, até a idade do abate, encontra-se ainda em fase de crescimento, possuindo ligamentos, tendões e ossos relativamente imaturos, sendo que estes últimos contem muito pouco tecido ósseo compacto (ALMEIDA PAZ et al., 2009).
As perdas se caracterizam por que aves com problemas locomotores ficam mais tempo sentadas, apoiando o peito na cama de aviário, o que pode causar lesões nesta região. No entanto, também se caracterizam por queda no desempenho devido ao retardo do crescimento das aves com claudicações. Isto se deve ao fato de que as aves não conseguem chegar ao comedouro e bebedouro, tornando-se frágeis e mais leves e, consequentemente apresentando piores resultados zootécnicos (BERNALDI, 2011).
3.3 Cartilagem Articular
A alta incidência de anormalidades da cartilagem óssea, por exemplo, a discondroplasia tibial em frangos de corte (CRUICKSHANK & SIM, 1987) é um problema na indústria avícola. No entanto, pouco se conhece sobre a etiologia da desordem ou o metabolismo e composição de cartilagem afetada. Por isso, entender a composição da cartilagem é de importância fundamental para estabelecer os padrões de estudos na cartilagem articular.
A cartilagem é um tecido hipocelular, e os condrócitos representam apenas 1 a 2% de seu volume total. Sua matriz extracelular abundante é altamente hitratada e especialmente diferenciada para adaptar-se às funções biomecânicas do tecido. Mais de 70% do peso da cartilagem é água, e mais de 90% do seu peso seco corresponde aos dois componentes de sua matriz extracelular, o colágeno tipo II e glicosaminoglicanos (GOLDRING et.al.,2005). A matriz extracelular da cartilagem articular apresenta não apenas um papel estrutural, mas seus elementos interagem com receptores da superfície dos condrócitos, regulando as funções dos mesmos.
3.4 Sulfato de Glucosamina e Sulfato de Condroitina.
A glicosamina e a condroitina são substâncias atualmente empregadas no arsenal terapêutico da osteoartrose devido a seus efeitos biológicos sobre a cartilagem articular, promovendo aumento da síntese de matriz cartilaginosa, aumento da produção de ácido hialurônico pelos sinoviócitos e inibindo enzimas responsáveis pela degradação da cartilagem (TOFFOLETTO et al.,2005).
Lipiello et al. (2010) demostraram o sinergismo entre condroprotetores (sulfato de condroitina e glucosamina) no controle da progressão da doença articular degenerativa em coelhos. A associação dos compostos foi eficaz em retardar as lesões cartilaginosas de joelhos de cães com instabilidade articular experimental (SOUZA et al., 1999).
O efeito condroprotetor dos glicosaminoglicanos polissulfatados já foi demonstrado experimentalmente também por Hannan et al., 1987. O sulfato de condroitina (glicosaminoglicano monossulfatado) tem sido investigado em estudos bioquímicos graças ao seu papel na fisiologia da cartilagem articular (PIPITONE, 1991).
A glucosamina é uma hexosamina (monossacarídeo aminado), componente de quase todos os glicosaminoglicanos e glicoproteínas de tecidos animais, incluindo a cartilagem articular. É um dos glicolipídeos e componente de oligossacarídeos O-ligados e N-O-ligados das glicoproteínas dos glicosaminoglicanos (PIZZAURO et.la., 1998).
Os glicosaminoglicanos são heteropolissacarídeos lineares formados por unidades dissacarídicas repetitivas, em que um dos açucares é uma hexosamina (α- D-glucosamina, β-D-glucosamina ou β-D-galactosamina) e o outro é um açúcar não-nitrogenado, que pode ser um acido urônico ou um açúcar neutro (β-D-galactose), unidos por ligações glicosídicas. Estes compostos apresentam alta densidade de carga aniônica devido à presença de grupamentos sulfato em diferentes números e posições e ainda grupamentos carboxila dos resíduos de acido urônico (JACKSON et. al.,1991).
Estudos utilizando cromatografia líquida de alta performance (HPLC) mostraram que a biodisponibilidade da glucosamina é de 21% em humanos e 12% em cães, após administração oral (ADEBOWALE et. al.,2000). Estudos independentes mostraram que a biodisponibilidade do medicamento oral em equinos é de 6% (OKE;WEESE, 2006). Além disso, concluiu-se que o nível de glucosamina no líquido sinovial é de 10% do nível de glucosamina no soro, indicando que a glucosamina não é rapidamente difundida da circulação para o líquido sinovial (OKE; WEESE, 2006).A maioria dos estudos clínicos em humanos é conduzida com glucosamina sulfato, uma vez que também o sulfato pode ser componente limitante para a síntese dos glicosaminoglicanos sulfatados (LAVERTY et.al., 2005).
Não há relatos de efeitos colaterais do uso de glucosamina e condroitina em animais (OKE; WEESE, 2006). Além dos efeitos da associação no metabolismo da cartilagem, efeitos anti-inflamatórios têm sido descritos como, por exemplo, em modelos experimentais em ratos. Inicialmente a atividade anti-inflamatória da glucosamina foi relacionada a mecanismos substancialmente diferentes daqueles utilizados pelos dos AINESs (anti-inflamatórios não esteroidais), que atuam principalmente por inibição das cicloxigenases, ou seja, não sendo um inibidor das ciclooxigenases, seus efeitos seriam prostaglandinas-independentes (SETNIKAR et.al., 1991). Porém alguns dos mecanismos da ação anti-inflamatória da glucosamina podem estar relacionados com o estimulo da biossíntese dos proteoglicanos. Tem sido sugerido que os recém-sintetizados proteoglicanos podem estabilizar membranas celulares, resultando em um efeito anti-inflamatório (VERBRUGGEN et.al., 1997).
A glucosamina também reduz a geração de radicais superóxido por macrófagos e inibe enzimas lisosomais. Estudos com equinos em que a glucosamina foi administrada em associações com AINEs, como diclofenaco, indometacina ou piroxicam, mostraram que esta associação permite a diminuição na dose de AINEs (ZUPANETS et. al., 1991).
relatado como sendo uma importante molécula envolvida na ossificação endocondral, ou seja, um processo de crescimento dos ossos longos (HUNTER, 1991). Além do sulfato condroitina, sabe-se que a cartilagem de mamíferos contêm quantidades relativamente pequenas de outros GAG, incluindo sulfato de queratano, sulfato de dermatano, e ácido hialurónico. No entanto, há poucas informações disponíveis sobre dados quantitativos para esses menores GAG na cartilagem de frangos de corte.
Estes potenciais mecanismos de ação tornam a associação de sulfato de glucosamina e condroitina uma opção atraente para o tratamento de patologias locomotoras (PELLETIER et.al.,1997).
Nesse sentido, a compreensão do mecanismo de ação e o papel das biomoléculas e dos minerais relacionados com a discondroplasia tibial poderão contribuir para o conhecimento de doenças do tecido ósseo e estabelecer estratégias de prevenção e tratamento.
4. OBJETIVOS
Avaliar o efeito da administração do sulfato de glucosamina, sulfato de condroitina e a associação de ambos sobre o desempenho, rendimento de carcaça e partes, morfometria hepática, avaliação das cartilagens da articulação tibiotársica e análise densitométrica dos tibiotarsos de frangos de corte.
5. MATERIAL E MÉTODOS
5.1. Local, período, instalações, animais e manejo.
arame até uma altura de 1,80 m. Foram utilizados 900 pintos de corte, machos, da linhagem Cobb - 900 ® de um dia, com peso médio inicial de 48 gramas, criados até 42 dias de idade e distribuídas em 30 boxes com 30 aves cada. As pesagens foram realizadas aos 21 e 42 dias de idade das aves, para determinação dos parâmetros de produção. O consumo de ração foi calculado considerando-se a ração fornecida e as sobras dos comedouros.
Na primeira semana de idade das aves, foram utilizados comedouros tubulares infantis, os quais foram substituídos gradativamente por comedouros tubulares com capacidade para 20 kg de ração e os bebedouros lineares pendulares suspensos durante todo o período experimental. O aquecimento inicial foi feito através de lâmpadas incandescentes de 250 watts, para manter a temperatura ambiente durante a primeira semana de vida. Os pintos foram vacinados contra a doença de Marek, Gumboro e Bouba Aviária, no próprio incubatório, seguindo-se a vacinação no (7° e 21° dias) contra a Doença de Gumboro e no 14° dia contra a Doença de Newcastle, via água.
A cama foi composta de maravalha e na quantidade de 1,2 kg de matéria seca/ave alojada em cada boxe, de modo que todos os boxes apresentassem a mesma quantidade deste material. O programa de luz adotado foi de 18 horas/dia, durante todo o período experimental. A ração e a água foram fornecidas ad libitum durante todo o período experimental.
5.2 Delineamento experimental e Análises Estatísticas
As aves foram distribuídas em um delineamento inteiramente casualizado, com seis tratamentos e cinco repetições cada, totalizando 30 parcelas de 30 aves cada. Os dados obtidos foram submetidos ao procedimento General Linear Model do SAS (SAS Institute, 2002) e em caso de significância estatística, as médias foram comparadas pelo teste de Tukey, ao nível de 5% de probabilidade.
5.3 Tratamentos experimentais
Tabela 1. Composição percentual da ração basal inicial e de crescimento, para as fases de 1 a 21 e 22 a 42 dias de idade, respectivamente, segundo as médias das recomendações de ROSTAGNO et al. (2011).
* Enriquecido por quilograma do produto: Vit. A 5.500.000 UI/kg, Vit D3 1.000.000 UI/kg, Vit. E 6500 mg, Vit. K3 1250 mg, Vit. B1 500 mg. Vit B2 2500 mg, Vit. B6 750 mg, Vit. B12 7500 mcg, pantotenato de cálcio 6500 mg, ácido fólico 250 mg, niacina 17.500 mg, Biotina 25 mg, cobre 3000 mg, cobalto 50 mg, iodo 500 mg, selênio 100 mg, manganês 32.500 mg, zinco 22.500 mg, ferro 25.000 mg, antioxidante 2000 mg.
** A porção variável foi constituída de sulfato de glucosamine e/ou sulfato de condroitina de acordo com os tratamentos e as fases de criação, nas seguintes proporções. Fase inicial: tratamento 1 :0/0; tratamento 2: 0,40/1,00; tratamento 3:0,80 /0,60; tratamento 4: 1,20/0,40; tratamento 5: 1,63/0; tratamento 6: 0/1,28, respectivamente. Fase crescimento: tratamento 1 :0/0; tratamento 2: 0,47/1,13; tratamento 3: 0,94/0,75; tratamento 4: 1,41/0,38; tratamento 5: 1,88/0; tratamento 6: 0/0,15, respectivamente de glucosamina e condroitina. O inerte utilizado para completar os espaços da porção variável foi o caulim.
Nesta ração basal foi adicionado o sulfato de glucosamina e o sulfato de condroitina de acordo com os níveis de cada tratamento. Nos tratamentos que se fez uso dos sulfatos, adicionou-se a quantidade proporcional indicada de 25mg/kg de
Ingredientes Quantidade em kg
1 – 21 22 – 42
Milho 56,94 64,54
Farelo de soja 35,20 27,40
Óleo de soja 2,20 3,4
Fosfato bicálcico 1,80 1,50
Calcário calcítico 1,00 0,10
DL- metionina 0,30 0,24
L-lisina HCl 0,13 0,27
Cloridrato de colina (60%)
Treonina 0,10 0,10 0,05 0,07
Suplemento mineral + vitamina* 0,20 0,20
Porção variável** 1,63 1,88
Sal 0,40 0,35
Total 100,00 100,00
Proteína bruta (%) 21,05 18,10
Energia metabolizável (kcal/kg) 3.000 3.170
Ca (%) 0,96 0,85
Na (%) 0,20 0,18
Fósforo total (%) 0,70 0,62
Fósforo disponível (%) 0,45 0,39
Metionina + cistina digestível (%) 0,89 0,75
Metionina total (%) 0,64 0,52
Metionina digestível (%) 0,61 0,50
Lisina total (%) 1,23 1,14
Lisina digestível (%) 1,12 1,04
Treonina total (%) 0,92 0,78
Treonina digestível (%) 0,81 0,68
Triptofano total (%) 0,26 0,22
ração de sulfato de glucosamina e 20mg/kg de ração de sulfato de condroitina na ração de fase inicial e de crescimento.
5.4 Variáveis avaliadas
5.4.1 Desempenho
Foram avaliadas como características de desempenho, o ganho de peso médio (g), o consumo de ração, e a conversão alimentar (g ração/ganho de peso), todos com relação à fase inicial das aves (1 a 21 dias de idade) e à fase de crescimento (22 a 42 dias de idade). Tanto o consumo de ração como a conversão alimentar foram corrigidos pela mortalidade do período.
5.4.2 Rendimento de carcaça e cortes
Aos 42 dias de idade foram separadas duas aves por repetição para a realização do abate. As aves foram identificadas, pesadas individualmente e separadas. Após o jejum alimentar de oito horas, as aves foram insensibilizadas com gás carbônico posteriormente sacrificadas. Foi obtido o peso individual de cada ave após o jejum de 8 horas, antes do abate, para efetuar o cálculo do rendimento de carcaça.
Os cálculos de rendimento de carcaça e das partes foram realizados com base no peso vivo e no peso da carcaça. O peso vivo foi determinado individualmente na plataforma, antes do abate, e o peso de carcaça, pela pesagem da ave eviscerada, sem pescoço, pernas e gordura abdominal. Foram avaliados os pesos de peito, pernas (coxa e sobrecoxa), dorso e asas, segundo metodologia descrita por Mendes et al. (1993).
5.4.3 Morfometria Hepática
5.4.4 Avaliação histológica da cartilagem articular
As análises de histologia da cartilagem articular (número de condrócitos/campo) foram realizadas no Departamento de Morfologia e Fisiologia Animal da FCAV – UNESP, Jaboticabal.
Após o abate, as cartilagens articulares do tibiotarso foram extraídas com o auxílio de bisturi e fixadas em formol a 10% por 24 horas, e, então, descalcificadas em uma solução de ácido fórmico a 10% por 14 dias.
A estrutura morfológica da cartilagem foi realizada pela técnica de coloração Hematoxilina-Eosina (HE) de Lillie (1954), que permite uma análise da morfologia geral da cartilagem e assim quantificar os condrócitos nela presentes.
Para a confecção da lâmina, a amostra de cartilagem foi fixada em Bouin (solução saturada de ácido pícrico, ácido acético e formol), por 24 horas à temperatura ambiente. Após as 24 horas, as amostras foram lavadas em água para retirada do excesso de fixador, mantidas em etanol 70% e, posteriormente, processadas pelo método de rotina para microscopia de luz com inclusão em histosec. Para isso, as amostras foram desidratadas em série de concentração crescente de etanol [(80%, 90%, 95% e etanol absoluto (3x)], diafanizadas em solução de álcool mais xilol (1:1) e em xilol (3x), infiltrados com parafina (3x) e incluídos com histosec (40 minutos para cada solução). Foram realizados quatro cortes histológicos transversais semi-seriados (6µm) por cartilagem por ave, os quais foram desparafinizados e corados com HE e, em seguida, foram novamente desidratados e diafanizados para montagem final com Entellan, para a mensuração dos condrócitos por campo.
5.4.5 Análise densitométrica do osso
Aos 21 e 42 dias de vida, seis aves de cada tratamento foram insensibilizadas com gás carbônico, sacrificadas, e os tibiotarsos direitos e esquerdos coletados. Os ossos de todos os tratamentos foram destinados à análise densitométrica dos frangos de corte, nos respectivos períodos.
Para esta análise, os ossos foram posicionados com vista dorsoventral sobre um chasi metálico de 20x20 cm². Nesta plataforma foram inseridos seis ossos (um osso por tratamento), de cada vez, para a realização das medidas densitométricas, as quais foram registradas com um auxílio de um software do próprio aparelho densitométrico.
A análise densitométrica foi realizada no aparelho Lunar DPXα alpha dual energy x- Ray Bone Densitometer, do Laboratório de Biofísica da UNESP de Araçatuba. As imagens do aparelho foram analisadas com o auxílio de um software para pequenos animais do próprio maquinário, de acordo com a metodologia de Louzada, 1994. As análises densitométricas composição de massa óssea (g), área óssea (cm) e densidade mineral óssea (g/cm²) foram realizadas nos tibiotarsos das aves dos respectivos tratamentos.
6. Resultados e Discussão
6.1 Desempenho
Tabela 2: Consumo de ração (CR), ganho de peso (GP) e conversão alimentar (CA) de frangos de corte aos 21 dias de idade alimentados com dietas com ou sem adição de sulfato de glucosamina e sulfato de condroitina.
Dietas CR (kg) GP (kg) CA (kg/kg)
0%Glucosamina + 0%Condroitina 0,84 0,53 1,52
25%Glucosamina + 75%Condroitina 0,83 0,56 1,56
50%Glucosamina + 50%Condroitina 0,85 0,58 1,46
75%Glucosamina + 25%Condroitina 0,83 0,57 1,49
100%Glucosamina 0,81 0,55 1,48
100%Condroitina 0,84 0,57 1,49
CV (%)¹ 8,36 5,46 6,85
Probabiliade <0,9533 <0,4255 <0,7476
Caracteristicas de Desempenho
1Coeficiente de variação
Dentre os aditivos avaliados, observou-se, que as aves alimentadas com ração contendo apenas sulfato de glucosamina apresentaram menor ganho de peso corporal. No entanto, as aves que receberam dietas com 50% de sufato de glucosamina e 50% de sulfato de condroitina apresentaram um maior ganho de peso corporal. Porém, tais resultados não se refletiram em melhora na conversão alimentar, uma vez que o ganho de peso das aves foi proporcional ao consumo destas.
Na fase de crescimento, foi possível verificar efeito não significativo de todas as variáveis avaliadas, assim como na fase inicial (Tabela 3).
Tabela 3: Consumo de ração (CR), ganho de peso (GP) e conversão alimentar (CA) de frangos de corte aos 42 dias de idade alimentados com dietas com ou sem adição de sulfato de glucosamina e sulfato de condroitina.
Dietas CR (kg) GP (kg) CA (kg/kg)
0%Glucosamina + 0%Condroitina 3,04 1,88 1,60
25%Glucosamina + 75%Condroitina 3,03 1,93 1,58
50%Glucosamina + 50%Condroitina 3,06 1,94 1,58
75%Glucosamina + 25%Condroitina 2,99 1,90 1,57
100%Glucosamina 3,07 1,98 1,54
100%Condroitina 3,11 2,02 1,52
CV (%)¹ 5,41 6,41 2,47
Probabiliade <0,9089 <0,8040 <0,6229
Caracteristicas de Desempenho
Neste contexto, as aves tratadas com dieta contendo apenas sulfato de condroitina apresentaram melhores resultados para ganho de peso e conversão alimentar.
Com relação aos demais níveis, constatou-se que, assim como na fase inicial, a utilização dos aditivos melhorou o consumo de ração, o peso médio e o ganho de peso corporal das aves em relação àquelas alimentadas com a dieta controle (sem aditivos). Porém, tais incrementos não proporcionaram diferenças significativas entre as aves dos tratamentos contendo níveis dos aditivos e as aves do tratamento controle.
De acordo com Velleman (2000) os problemas ósseos são reconhecidamente um dos quatro maiores fatores limitantes do desempenho de frangos de corte. Portanto, é difícil determinar acuradamente os prejuízos devido à natureza dessas perdas, assim como o animal não desenvolver adequadamente sua capacidade de desempenho zootécnico determinado pela linhagem.
Morris (2004), em seus estudos sobre os problemas de perna, avaliou o aumento da mortalidade, o número de animais refugos, a condenação da carcaça e a consequente piora no desempenho zootécnico sem o auxílio de protetores do sistema locomotor, assim como no presente estudo. No entanto, com o uso de aditivos que previnem estes problemas, o desempenho de um modo geral, é expresso de acordo com o preconizado pela linhagem.
Gonzalez et al. (2006), avaliaram em seus estudos o sulfato de cobre e o sulfato de potássio, utilizados nas rações de aves para satisfazer a exigência mineral e também para suplementar a dieta contribuindo assim como o sulfato de glucosamina e de condroitina, para a mineralização óssea. Como resultado, obteve, assim como neste estudo, que os tratamentos que continham os sulfatos não melhoraram estatisticamente as variáveis ganho de peso conversão alimentar e consumo de ração aos 21 dias do frango de corte, porém seus resultados de desempenho foram numericamente maiores nos tratamentos que continham os aditivos que melhoravam morfométrica e histologicamente os ossos.
Tabela 4. Desempenho de frangos de corte na fase de 1 a 42 dias de idade alimentados com dietas com ou sem adição de sulfato de glucosamina e sulfato de condroitina.
Dietas CR(kg) GP (Kg) CA (kg/kg)
0%Glucosamina + 0%Condroitina 3,88 2,50 1,55
25%Glucosamina + 75%Condroitina 3,87 2,46 1,57
50%Glucosamina + 50%Condroitina 3,91 2,51 1,54
75%Glucosamina + 25%Condroitina 3,83 2,48 1,52
100%Glucosamina 3,88 2,54 1,51
100%Condroitina 3,96 2,56 1,50
CV (%)1 4,91 5,26 3,97
Probabiliade <0,9259 <0,8191 <0,7077
1 - 42 DIAS Caracteristicas de Desempenho
1Coeficiente de variação
6.2 Rendimento de carcaça e de partes
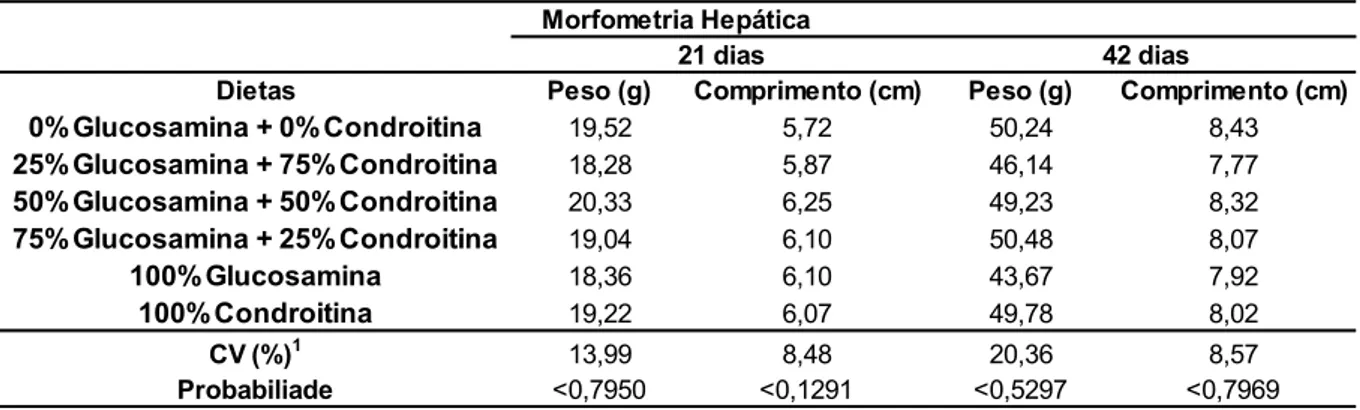
Os efeitos dos diferentes níveis dos aditivos sobre as características de rendimento de carcaça e partes avaliadas não apresentaram efeitos significativos (P>0,05) (Tabela 5).
Tabela 5: Rendimento de carcaça e partes de frangos de corte aos 42 dias de idade alimentados com dietas com ou sem adição de sulfato de glucosamina e sulfato de condroitina.
Dietas CARCAÇA COXA+SOBRECOXA PEITO DORSO ASA
0%Glucosamina + 0%Condroitina 73,73 31,26 39,61 22,52 9,27
25%Glucosamina + 75%Condroitina 73,82 31,74 43,70 24,18 10,70
50%Glucosamina + 50%Condroitina 74,10 30,68 40,49 22,18 10,14
75%Glucosamina + 25%Condroitina 72,80 30,73 43,85 23,05 11,09
100%Glucosamina 73,89 30,79 43,76 23,86 11,43
100%Condroitina 75,55 32,16 41,00 22,78 10,98
CV (%)1 4,09 9,83 10,73 10,98 11,25
Probabiliade <0,9578 <0,9968 <0,3741 <0,5009 <0,2694
Rendimento de carcaça e partes
1Coeficiente de variação
de carne de frango de maior interesse comercial (rendimento de peito e coxa e sobrecoxa.
Concordando com o presente estudo, Loddi et al.(2000), avaliando diferentes níveis de colágeno do tipo I (1,0%, 1,2%, 1,25%, 1,31% e 1,38%), uma substância também responsável no metabolismo animal pela modelagem óssea, e consequentemente pela matriz óssea orgânica, observou em seu estudo que não houve interação estatística significativa para rendimento de carcaça entre os níveis da substancia avaliada (P<0,05). Pode-se observar numericamente um rendimento maior, quando do uso do colágeno na fase de crescimento (22 a 42 dias de idade) dos frangos de corte (P<0,01).
6.3 Avaliação da Morfometria Hepática
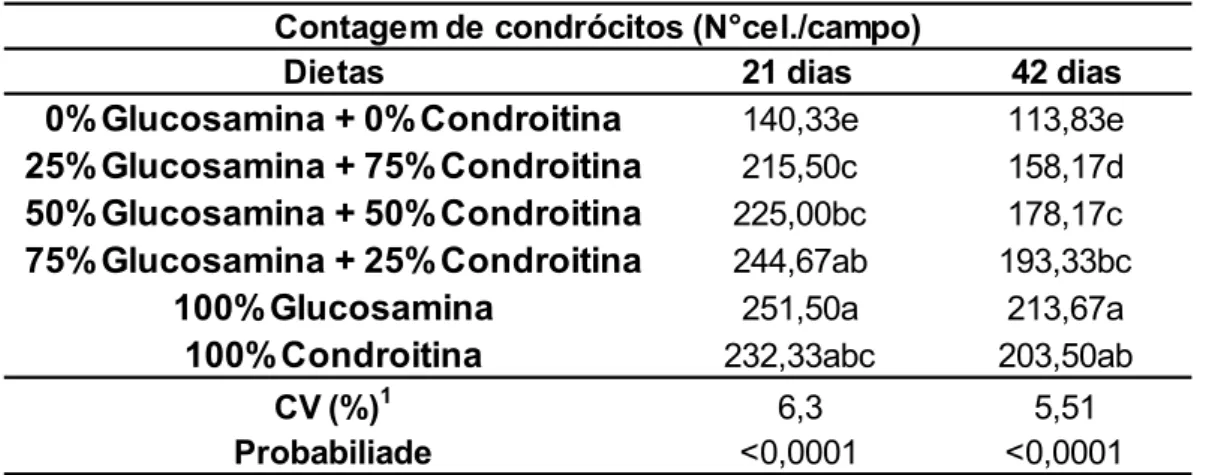
Os diferentes níveis de glucosamina e condroitina na dieta não apresentaram efeito significativo (P>0,05) para os parâmetros de morfometria avaliados aos 21 e 42 dias de idade das aves (Tabela 6).
Tabela 6. Avaliação morfométrica do fígado de frangos de corte aos 21 e 42 dias de idade alimentados com rações contendo níveis diferentes de sulfato de glucosamina e sulfato de condroitina.
Dietas Peso (g) Comprimento (cm) Peso (g) Comprimento (cm)
0%Glucosamina + 0%Condroitina 19,52 5,72 50,24 8,43
25%Glucosamina + 75%Condroitina 18,28 5,87 46,14 7,77
50%Glucosamina + 50%Condroitina 20,33 6,25 49,23 8,32
75%Glucosamina + 25%Condroitina 19,04 6,10 50,48 8,07
100%Glucosamina 18,36 6,10 43,67 7,92
100%Condroitina 19,22 6,07 49,78 8,02
CV (%)1 13,99 8,48 20,36 8,57
Probabiliade <0,7950 <0,1291 <0,5297 <0,7969
21 dias 42 dias
Morfometria Hepática
1Coeficiente de variação
A resposta estatística não significativa desta variável pode estar relacionada à relação não prejudicial dos aditivos ao processo morfométrico hepático do animal.
6.4 Histologia da cartilagem articular
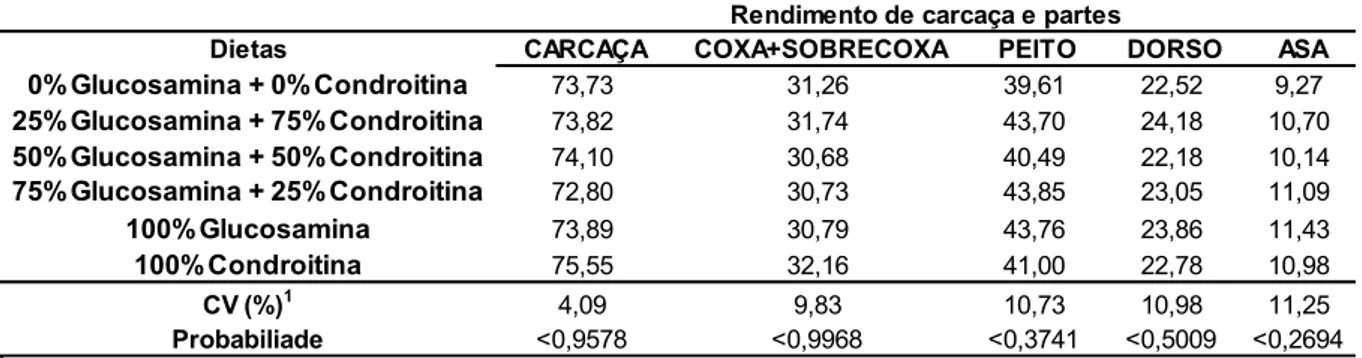
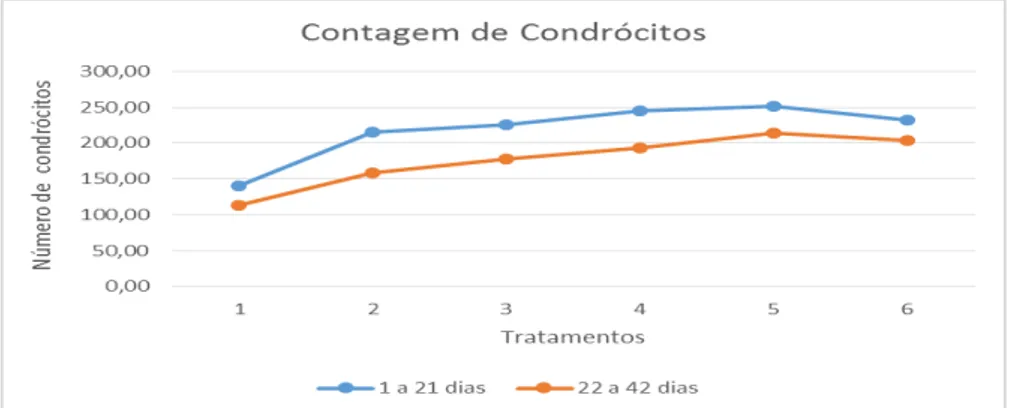
Os resultados da contagem dos condrócitos da cartilagem articular dos animais nas fases iniciais e de crescimento são apresentados na tabela 7. Pode-se observar que os valores dos tratamentos com 75%glucosamina + 25%condroitina, 100% glucosamina e 100% condroitina na dieta foram diferentes estatisticamente dos demais tratamentos, podendo-se observar que estes foram maiores que os do tratamento controle com 0% de ambos aditivos, no período de 1 a 21 e 22 a 42 dias de idade dos frangos de corte (Tabela 7).
Tabela 7. Número médio de condrócitos da cartilagem articular dos animais controle e dos animais que receberam os diferentes níveis de sulfato de glucosamina e sulfato de condroitina, na ração.
Dietas 21 dias 42 dias
0%Glucosamina + 0%Condroitina 140,33e 113,83e
25%Glucosamina + 75%Condroitina 215,50c 158,17d
50%Glucosamina + 50%Condroitina 225,00bc 178,17c
75%Glucosamina + 25%Condroitina 244,67ab 193,33bc
100%Glucosamina 251,50a 213,67a
100%Condroitina 232,33abc 203,50ab
CV (%)1 6,3 5,51
Probabiliade <0,0001 <0,0001
Contagem de condrócitos (N°cel./campo)
1Coeficiente de variação
Médias com letras iguais na coluna não diferem estatisticamente entre si (P>0.05) pelo teste de Tukey.
Figura 1. Apresentação do número médio de condrócitos da cartilagem dos animais aos 21 e 42 dias de idade, que receberam os diferentes níveis de sulfato de glucosamina e sulfato de condroitina.
Figura 2. Ilustração das imagens em que foram obtidos os números médios de condrócitos da cartilagem artucular dos animais aos 21 dias de idade, que receberam os diferentes níveis de sulfato de glucosamina e sulfato de condroitina, respetivamente tratamentos 1, 2, 3, 4, 5 e 6.
Uma inferência exemplar sobre o frango de corte geneticamente melhorado para velocidade de crescimento refere-se a zona de crescimento ósseo mais irregular e mais espesso na fase de crescimento (GREENBAUM, 1993).
Alguns estudos relatam que na cartilagem articular, indicado como um tecido de sustentação de peso, o colágeno proporciona ao tecido, a força de tração e o sulfato de condroitina contribui para a rigidez de compressão do tecido (MOW et al., 1992).
Howllet (2009) trabalhando com a administração oral de glucosamina e condroitina associados ao acido hialurônico em cavalos com osteoartrite observou que apesar dos proteoglicanos de condroitina serem os principais constituintes das cartilagens, esperava-se que fornecendo o sulfato de condroitina, houvesse uma melhora das condições biológicas do tecido. Entretanto, há controvérsias quanto a proposta sobre os beneficios do tratamento com condroitina nos cavalos com osteoartite (OWENS et al., 2004)
Estudos in vitro demonstraram a capacidade do sulfato de condroitina em diminuir a perda de componentes da cartilagem articular, e de inibir enzimas condrolíticas (BASSLEER et al., 1998).Em estudo clínico realizado em humanos com osteoatrite e idade acima de 50 anos, observou-se significativa redução do uso de anti-infalmatorios não esteroidais no grupo de pacientes tratados com doses de 2g/dia de sulfato de condroitina (MAZIÉRES et al., 1992).
Em modelos experimentais utilizando coelhos com osteoartrite induzida experimentalmente, o sulfato de condroitina conferiu proteção a cartilagem em relação a sua degradação. Demonstrou-se que os animais que receberam suplementação com 20% de sulfato de condroitina apresentaram menor perda de proteoglicanos da cartilagem em relação aos que não receberam a suplementação (TAYLOR et al., 1996)
Resumidamente, existem artigos cientificos mostrando a atividade imunológica, antioxidante e os efeitos sobre o metabolismo celular in vitro do sulfato de condroitina e glucosamina (VOLPI, 2006). Bem como, estudos clínicos que comprovam sua eficácia clínica em diminuir os sintomas da osteoartite tanto em humanos como em equinos.
Foram observados alguns resultados de estudos que utilizaram a glucosamina e condroitina em outras espécies animais, diferindo deste estudo. Entretanto, é escasso ou ausente observações experimentais destes aditivos em aves, demostrando assim a necessidade do aperfeiçoamento e continuidade deste estudo.
6.5 Densitometria mineral óssea
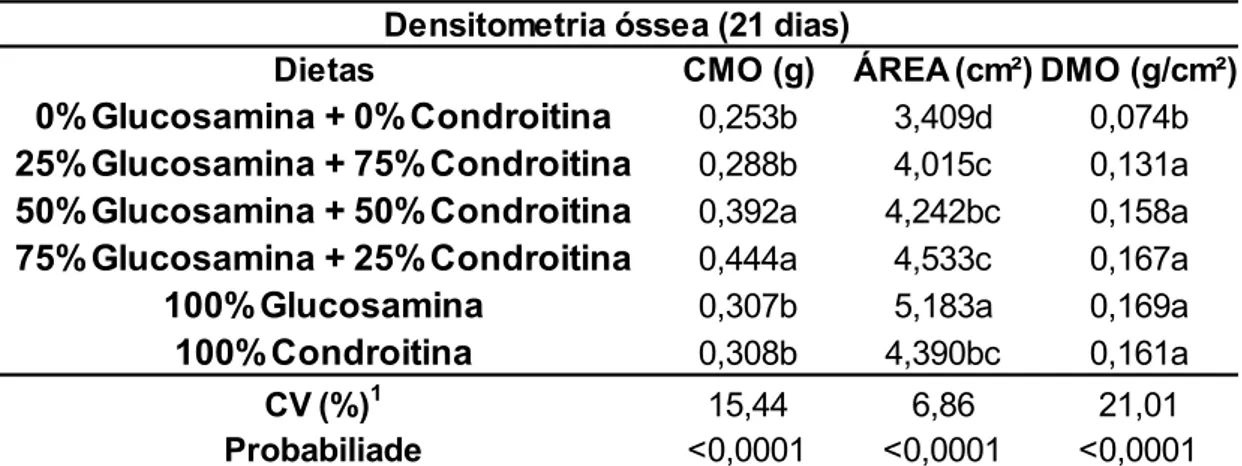
De acordo com os resultados demonstrados na tabela 8, os tratamentos com os aditivos na ração apresentaram melhores resultados de composição de massa óssea (CMO), principalmente os tratamentos associativos de 50% de glucosamina + 50% de condroitina e 75% de glucosamina e 25% de condroitina que não apresentaram diferença significativa (P<0,05) entre ambos. É possível observar ainda nesta tabela, que todos os tratamentos que foram adicionados os aditivos proporcionaram melhores resultados de densitometria mineral óssea (DMO),quando comparados ao controle, não diferindo estatisticamente entre estes resultados.
Tabela 8. Avaliação densitométrica do tibiotarso de frangos de corte aos 21 dias de idade alimentados com rações contendo níveis diferentes de sulfato de glucosamina e sulfato de condroitina.
Dietas CMO (g) ÁREA (cm²) DMO (g/cm²)
0%Glucosamina + 0%Condroitina 0,253b 3,409d 0,074b
25%Glucosamina + 75%Condroitina 0,288b 4,015c 0,131a
50%Glucosamina + 50%Condroitina 0,392a 4,242bc 0,158a
75%Glucosamina + 25%Condroitina 0,444a 4,533c 0,167a
100%Glucosamina 0,307b 5,183a 0,169a
100%Condroitina 0,308b 4,390bc 0,161a
CV (%)1 15,44 6,86 21,01
Probabiliade <0,0001 <0,0001 <0,0001
Densitometria óssea (21 dias)
1Coeficiente de variação
Médias com letras iguais na coluna não diferem estatisticamente entre si (P>0.05) pelo teste de Tukey. *CMO: Composição da massa óssea; **DMO: densidade mineral óssea
al. realizaram um estudo usando 14 cavalos com idades entre 5 e 15 anos com claudicações progressivas de membro torácico, em que foi administrado composto contendo glucosamina e condroitina por dois meses. As avaliações clínicas foram realizadas no dia 0, 28 e 56. Obteve-se melhora significante dos graus de claudicações tanto no dia 28 quanto no dia 56 em relação ao grupo placebo.
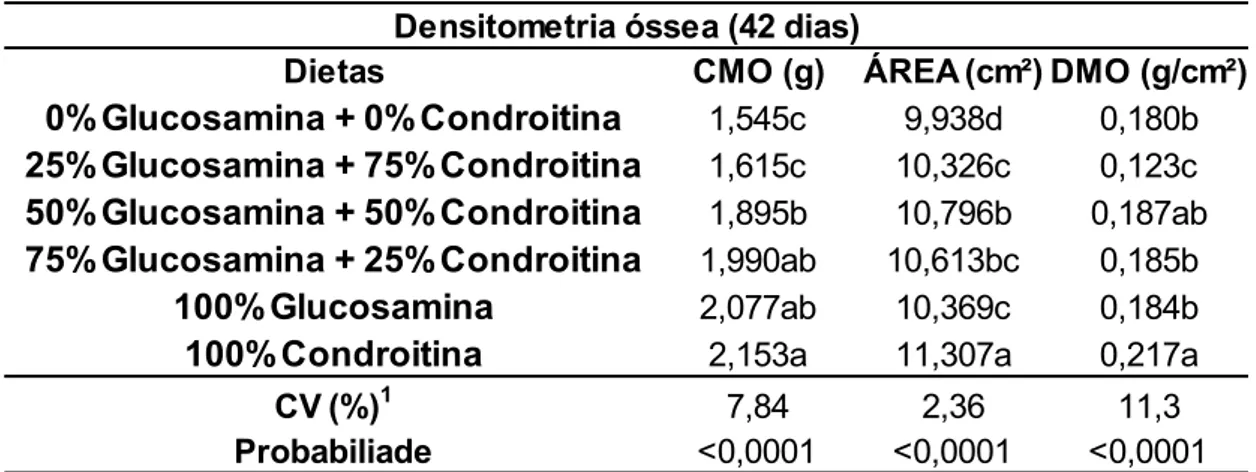
Com relação à melhora da densidade mineral óssea proporcionada pelos aditivos aos 42 dias de idade (Tabela 9) foi possível verificar que o melhor resultado, (P<0,05), de CMO(g), área(cm²) e DMO(g/cm²) é observado quando adicionado 100% de sulfato de condroitina na dieta dos animais. Ainda nesta tabela, é possível observar que os tratamentos que continham 50% de sulfato de condroitina também apresentou resultado estatisticamente significativo igual ao tratamento com 100% de sulfato de condroitina, que obteve o resultado de melhor densidade mineral óssea.
Tabela 9. Avaliação densitométrica do tibiotarso de frangos de corte aos 42 dias de idade alimentados com rações contendo níveis diferentes de sulfato de glucosamina e sulfato de condroitina.
Dietas CMO (g) ÁREA (cm²) DMO (g/cm²)
0%Glucosamina + 0%Condroitina 1,545c 9,938d 0,180b
25%Glucosamina + 75%Condroitina 1,615c 10,326c 0,123c
50%Glucosamina + 50%Condroitina 1,895b 10,796b 0,187ab
75%Glucosamina + 25%Condroitina 1,990ab 10,613bc 0,185b
100%Glucosamina 2,077ab 10,369c 0,184b
100%Condroitina 2,153a 11,307a 0,217a
CV (%)1 7,84 2,36 11,3
Probabiliade <0,0001 <0,0001 <0,0001
Densitometria óssea (42 dias)
1Coeficiente de variação
Médias com letras iguais na coluna não diferem estatisticamente entre si (P>0.05) pelo teste de Tukey.
formação de um molde cartilaginoso inicial, foi realizado este estudo empregando a condroitina e a glicosamina, drogas atualmente aceitas como capazes de estimular a síntese de matriz cartilaginosa, em uma tentativa de com isso incentivar o processo de cicatrização óssea.
O processo de ossificação endocondral no reparo ósseo assemelha-se ao que ocorre nas placas de crescimento ósseo. Nesses locais, primeiramente, os condrócitos proliferam e produzem uma matriz cartilaginosa não mineralizada. Então, os condrócitos hipertrofiados sofrem apoptose e inicia-se a mineralização da matriz. Osteoblastos depositam osso novo nos remanescentes mineralizados da matriz cartilaginosa para produzir osso trabecular (GREENBAUM, 1993). Então, a fase de remodelação se inicia, caracterizando-se por reabsorção pelos osteoclastos seguida pelo depósito de osso lamelar novo. Apesar da semelhança com as placas de crescimento, o processo de consolidação óssea é menos ordenado, com áreas de calo sofrendo remodelação entremeadas por áreas que ainda estão na fase cartilaginosa (SCHENK, 2003).
Todos esses fatores e a frequente dependência da consolidação óssea de uma fase cartilaginosa foram estímulos a realizar este trabalho.
7. Conclusões
Pode-se concluir que o tratamento associativo de sulfato de glucosamina + sulfato de condroitina na fase inicial é fundamental para o desenvolvimento do sistema ósseo e articular, enquanto que na fase final o tratamento com sulfato de condroitina apresentou um efeito protetor e sinérgico, favorecendo melhores características do sistema locomotor.
8. Referências
ALMEIDA, PICL. Problemas locomotores e técnicas de mensuração. Pages 128-137 in Proc. Conferência APINCO 2009 de Ciência e Tecnologia Avícolas. FACTA, Santos, Brasil.
ATTUR, MG, DAVE M, AKAMATSU M, KATOH M, AMIN AR. Osteoarthritis or osteoarthrosis: the definition of inflammation becomes a semantic issue era of molecular medicine. Osteoarthritis Cartilage. 2002; 10;1-4.
BASSLEER, S. B., O. GENINA, I. LAVELIN, R. M. LEACH, and M. PINES, 1998. Parathyroid receptor gene expression by epiphyseal growth plates in rickets and tibial dyschondroplasia. Mol. Cell. Endocrinol. 149:185–195.
BEALE, B.S.; GORING, R.L.; CLEMMONS, R.M. et al. Effect of semi-synthetic polysulfated glycosaminoglycan on the hemostatic mechanism in the dog. Vet. Surg., v.19, p.57, 1990.
BEATY, N. B., and R. J. MELLO, 1987. Review. Extracellular mammalian polysaccharides: glycosaminoglycans and proteoglycans. J. Chromatogr. 418: 187-222.
BERNALDI, R. Problemas locomotores em frangos de corte. Dourados, MS ; UFGD, 2011. 62f.
BORGES, A.B.; REZENDE, C.M.; ASSIS, C.B. et al. Composição do líquido sinovial de cães com ruptura do ligamento cruzado cranial. Ciên. Rural, v.29, p.285-289, 2003.
BROOKE, K. E., M. B. AYDELOTTE, and E.J.-M.A. THONAR, 1973. Articular cartilage matrix and structure: A mini review. J. Rheumatol. 18(Suppl. 27):46-48.
CASTRO RR, CUNHA FQ, SILVA Jr FS, ROCHA FAC. A qualitative approach o measure joint pain in experimental ostearthritis. Osteoarthritis Cartilage 2006; 14:769-76.
CRUICKSHANK, J. J., and J. S. SIM, 1987. Effects of excess vitamin D3 and cage density on the incidence of leg abnormalities in broiler chickens. Avian Dis. 31:332-338.
DEAL,C.L.;MOSKOWITZ,R.W. Nutraceuticals as therapeutic agents in osteosthritis. The role of glucosamine, chondroitin sulfate, and collagen hydrolysate.
Rheumatic Disease Clinics of North America, v.25,n.2,p.380-381,1999.
DIEPPE P. What is the relationship between pain and osteoarthritis
Rheumatology in Europe. 2005; 27:55.-6
EDWARDS, J.H.M. Nutrition and skeletal problems in poultry. Poultry Science
2000; 79:1018-1023.
FARQUHARSON C, BERRY JL, MAWER EB, SEAWRIGHT E, WHITEHEAD CC. Ascorbic acid-induced chondrocyte terminal diferentiation: the role of the extracellular matrix and 1,25-dihydroxyvitamin D. European Journal of Cell Biology 2000; 6: 110-118.
GAY, and R. M. LEACH, 1985. Avian tibial dyschondroplasia: 1. Ultrastructure.
Am. J. Pathol. 119:175–190.
GREENBAUM MA, KANAT, IO. Current concepts in bone healing. Review of the literature. J Am Podiatr Med Assoc. 1993;83(3):123-9.
GOLDRING,S.R.; GOLDRING, M.B. biology oy the normal joint. In: Harris Jr ED, Budd RC, Genovese MC, Firestein GS, Sargent JS, Sledge CB, editors Kelley’s Textbook of Rheumatology, 7ª ed. Philadelphia: WB Saunders Co, 2005.
GONZALES E,; MENDOÇA JR. CX. Problemas locomotores em frangos de corte. VII Simpósio Brasil Sul de Avicultura. Chapecó, SC – Brasil. Anais. 79-94, 2006.
GUARNIERO R, CINAGAVA MY, SANTANA PJ, BATISTA MA, OLIVEIRA LAA, RODRIGUES CJ, CINAGAVA FT. Influência do componente protéico na consolidação de fraturas: trabalho experimental em ratos. Acta Ortop Bras. 2007; 11(4):206-10.
HANNAN, N.; GHOSH, P.; BELLENGER, C. et al. Systemic administration of glycosaminoglycan polysulphate (Arteparon) provides partial protection of articular cartilage from damage produced by meniscectomy in the canine. J. Orthop. Res., v.5, p.47-59, 1987.
HANSON RR, SMALLEY LR, HUFF GK, WHITE S, HAMAD TA. Oral treatment with a glucosamine-chondroitin sulfate compound for degenerative joint disease in horses: 25 cases. Equine Pract. 2001;19:16-22.
HARDINGHAM, T. E., and A. J. FOSANG, 1992. Proteoglycans: many forms and many functions. FASEB J. 6:861-870.
HARGEST, T. E., C. V. GAY, and R. M. LEACH, 1985. Avian tibial dyschondroplasia: 1. Ultrastructure. Am. J. Pathol. 119:175–190.
HOWLLET,R.L.;BUSCH,S.J.; CARDIN, A.D. Glycosaminoglycans: molecular properties, protein interection, and role in physiological processes. Physiological Reviews, v.2, p. 481-539, 2009.
HUNTER, G. K., 1991. Role of proteoglycan in the provisional calcification of cartilage. A review and reinterpretation. Clin. Orthop. Relat. Res. 262:256-280.
JEFFEREIS D, HOUSTON B, LESTER D, WITHEHEAD CC, THORP BH, BOTMAN M, FARQUHARSON C. Expression patterns of chondrocyte genes cloned by differential display in tibial dyschondroplasia. Biochimica et Biophysica Acta
2000;1501 (2-3):180-188.
JULIAN RJ. Patologias ósseas em aves. Conferência APINCO 2005 de Ciência e Tecnologia Avícolas; 2005; Campinas, São Paulo. Brasil. p. 107-122.
JUNIOR, C.X. Deformidades das pernas em frangos de corte. Conferência APINCO de Ciência e Tecnologia Avícolas; 2009; Campinas, São Paulo. Brasil. p. 29-41.
KRAUS VB. Pathogenesis and treatment of osteoarthritis. Rheum Dis Clin North Am 1997; 81: 85-112.
LAVERTY,S.;SANDY,J.D.;CELESTE,C.;VACHAON,P.;MARIER,J.F.;PLAAS, H. Synivial fluid levels and serum pharmacokinetics in a large animal model following treatment with oral glucosamine at clinically relevant doses. Arthritis Rheumatology, v.52, n.1,p.181-191,2005.
LAWRENCE RC, HELMICK CG, ARNETT FC, DEYO RA, FELSON DT, GIANNINI EH. Estimates of the prevalence of arthritis and selected musculoskeletal disorders in the United States. Arthritis Rheum 1998; 41:778-99.
LEACH RM JR, BURDETTE JH. The influence of ascorbic acid on the occurrence of tibial dyschondroplasia in young broiler chickens. Poultry Science 1985; 64 (6):1188-91.
LEESON, S.; SUMMERS,J.D. Some nutritional implications of leg problems with poultry. British Veterinary Journal 1988; 144:81-91.
LILLIE, R. D., 1954. Histopathologic Technic and Practical Histochemistry. 3rd ed. McGraw Hill Book Co., New York, NY.
LIPPIELLO L. WOODWARD J, KARPMAN R, HAMMAD TA. In vivo chondroprotection and metabolic synergy of glucosamine and chondroitin sulfate.
Clin Orthop Relat Res. 2010;(381):229-40.
LODDI M. M. Uso de aditivos sobre o desempenho, Rendimento e a Qualidade de carcaça de Frangos de corte. Revista Brasileira de Zootecnia.,29(4):1124-1131, 2000.
LOINAZ N C, HUFF WE, BAYARI GR, BALOG JM. Cell death in avian tibial dyschondroplasia. Avian Diseases 2007; 42: 72-79.
LOUZADA, M.J.Q. Otimização da tecnica de densitometria optica em imagens radiograficas de peças osseas : estudo "in vitro".Biblioteca Digital da UNICAMP, 1993.
MARTINDALE; the complete drag reference, 33 ed. Londres; PhP, p. 1616. 2002. MAZIÉRES, L.; LINDAHL, U. Proteoglycans: structures and interections. Annual
Review of Biochemistry, v. 60, p.443-475, 1992.
McCAPES, R. H. Lameness in turkeys due to faulty bone formation. Animal Nutrition Health, 22: 17-20. 1967.
MENDES, A. A. et al. Efeito de linhagem e idade de abate sobre o rendimento de carcaça de frangos de corte.Revista da Sociedade Brasileira de Zootecnia, v.22, n.3, p.466-472, 1993.
MICHEL BA, STCKI G, FREY D, DE VATHAIRE F, VIGNON E, BRUEHLMANN P, UEBELHART D.Chondroitins 4 and 6 in osteoarthritis of the knee: a randomizad, controlled trail. Artthritis Rheum, 2005; 52:779-86.
MORRIS, M.P. National survey of leg problems. Broiler Industry, May, pp. 20-24,1993.
MOSBY’S GenRx; a comphehensive reference of generic and brand drongs. St Lonis; Mosby, 2002 p.IV 26.
MOW, V. C, A. RATCLIFFE, and A. R. POOLE, 1992. Cartilage and diarthrodial joints as paradigms for hierarchial materials and structures. Biomaterials 13:67-97.
OKE,S.L.;WEESE,J.S. review of Glucosamine-Containing Oral Joint Supplements: Are they effective in the horse? In; Annual convention of the american association of equine practitioners, 52.,2006, san Antonio, Texas, USA,
Proceedings…2006.
PACK, M.; HOEHLER, D.; LEMME, A. Economic assessment of amino acid responses in growing poultry. In: D’Mello J.P.F. Amino Acids in Animal Nutrition, 2nd edition, CABI Publishing. p.459-483, 2003.
PELLETIER,J.P.; MARTEL-PELLETIER,J; HOWELL D.S. Etiopathogenesis of osteoarthritis. In: KOOPMAN, W. Arthritis and allied conditions: a textbook of rheumatology, 13. Ed. Baltimore: Willians & Wilkins, 1997, p. 1969-1983.
PINES, M., and S. HURWITZ, 1991. The role of the growth plate in longitudinal bone growth. Poultry Sci. 70:1806-1814.
PIPITONE, V.R. Chondroprotection withchondroitin sulfate. Drugs Exp. Clin. Res., v.17, p.3-7, 1991.
PIZZAURO JM, DEMENIS MA, CIANCAGLINI P, LEONE FA. Kinetic characterization of a membrane-specific ATPase from rat osseous plate and its possible significance on endochondral ossification. Biochimica et Biophysica Acta
1998; 1368: 108-114.
PRAUL CA, FORD BC, GAY CV, PINES M, LEACH RM. Gene expression and tibial dyschondroplasia. Poultry Science 2000; 79 (7): 1009-1013.
POULOS, P. W., 1978. Tibial dyschondroplasia (osteochondrosis) in the turkey.
Acta Radiol. Suppl. 358:197–227.
REDDI, A.H. Initiation and promotion of endochrondral bone formation by bone morphogenetic proteins: potential implications for avian tibial dyschondroplasia.
Poultry Science 2000; 9 (7): 978-981.
RODGERS, L., 2006. Structure and metabolism of connective tissue proteoglycans. Pages 267-371 in: The Biochemistry of Glycoproteins and Proteoglycans. W. J. Lennarz, ed. Plenum Press, New York, NY.
ROSTAGNO, H. S. et al. Tabelas brasileiras para aves e suínos: Composição de alimentos e exigências nutricionais. 2. ed. Viçosa: UFV, Departamento de Zootecnia, 2005, 186 p.
SAS INSTITUTE. SAS System for Microsoft Windows, Release 6.12. Cary. NC. USA, 2002.
SCHENK RK. Biology of fracture repair. In: Browner BD, editor. Skeletal trauma: basic science, management and reconstruction. 3rd ed. Philadelphia: Saunders; 2003. v.2, p. 29-73.
SETNIKAR,I.;PACINI,M.A.REVEL,L. Antiarthritic effects os glucosamine sulfate estudied in animal models. Arzneim Forsch, v. 41, p. 542-545, 1991.
SILVA Jr FS, ROCHA FAC, Zymosan induced arthritis in rats – mechanisms involved in hypernociception. Acta Reumatol Port 2006; 31: 143-9.
SHARMA L, KAPOOR D, ISSA S. Epidemiology of osteoarthritis : an update.
Curr Opin Rheumatol. 2006; 18:147-56.
SOUZA, R.L.; RAISER, A.G.; GUIMARÃES, L.D. et al. Precursores de glicosaminoglicanos na reparação articular após trauma iatrogênico no joelho de cães. Clin. Vet., v.23, p.33-38, 1999.
SU, G., SORENSEN, P., KESTIN, S. C. Meal feeding is more effective than early feed restriction at reducing the prevalence of leg weakness in broiler chickens.
Poultry Science, 78:949-955, 2003.
TAYLOR, H., and T. E. HARDINGHAM, 1996. Structure of proteoglycans. Pages 153-222 in: MTP International Review of Science. Biochemistry of Carbohydrate. Biochemistry Series Vol. 5. W. J. Whelan, ed. Butterworths, London, England.
TOFFOLETTO O, TAVARES A, CASARINI DE, REDUBLO BM, RIBEIRO AB. Farmacocinética da associação da glucosamina e sulfato de condroitina em humanos sadios do sexo masculino. Acta Ortop Bras. 2005;13(5):235-7.
THORP, B. H., S. B. JAKOWLEW, and C. GODDARD, 1994. Avian tibial dyschondroplasia: Local deficiences in growth factors are integral to the aetiopathogenesis. Avian Pathol. 24:135–148.
VELLEMAN SG. The role of the extracellular matrix in skeletal development.
Poultry Science 2000; 79(7): 985-989.
VERBRUGGEN, G.GOEMAERE,S.,VEYS,E.Chondroitin sulfate S/DMOAD (Structure/ Disease Modifying Osteoarthritis (OA)Drug) in the treatment of OA of the fingers joints. Osteoarthritis Cartilage, v.5,p.70, 1997.
VOLPI, C, 2006. Skeletal deformities in poultry. Adv. Vet. Sci. Comp. Med. 25:277-310.
WISE JENNINGS, B.S. Broillers suffer from dyschondroplasia and femoral necrosis. World Poultry – misset 10 (10):109-111, 1972.