UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
Meningoencefalomielites de Origem Desconhecida no cão
Dissertação de Mestrado Integrado em Medicina Veterinária
Rui Félix Oliveira de Almeida
Orientador: Prof. Dr. Luís Miguel Viana Maltez da Costa Coorientadora: Drª Maria Amorim Martins de Oliveira
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
Meningoencefalomielites de Origem Desconhecida no cão
Dissertação de Mestrado Integrado em Medicina Veterinária
Rui Félix Oliveira de Almeida
Orientador: Prof. Dr. Luís Miguel Viana Maltez da Costa Coorientadora: Drª Maria Amorim Martins de Oliveira
i
Stay hungry, stay foolish
ii
iii Primeiro gostaria de agradecer às equipas do Hospital Veterinário do Baixo Vouga e do Hospital Ars Veterinária de Barcelona por me terem acolhido durante o estágio curricular, pelo bom ambiente de trabalho que me proporcionaram e por todos os ensinamentos e conselhos que certamente me serão muito úteis a nível profissional.
Gostaria também de agradecer aos meus professores da Universidade de Trás-os-Montes e Alto Douro, ao meu orientador Prof. Luis Maltez e à minha coorientadora Maria Oliveira, pela disponibilidade e espírito crítico que demonstraram.
Gostaria de agradecer à minha família, especialmente aos meus pais, pelo apoio moral e económico que me proporcionaram ao longo de toda a realização deste trabalho.
E por fim, um agradecimento aos meus amigos Elisabete, José Pedro, Luís, Rita e Sara pelos incentivos e auxílio no desenvolvimento da minha dissertação de mestrado.
iv O Sistema Nervoso Central (SNC) é composto pelo encéfalo e pela medula espinhal, encontrando-se ambas estruturas revestidas pelas meninges.
A inflamação pode afetar o encéfalo (encefalite), a medula espinhal (mielite) ou as meninges (meningite), individualmente, ou atingir mais do que uma estrutura como no caso de uma meningoencefalite (meninges e encéfalo) ou de uma meningoencefalomielite (meninges, encéfalo e medula espinhal).
As Meningoencefalomielites de Origem Desconhecida (MOD) são um conjunto de doenças inflamatórias, idiopáticas, não infecciosas do Sistema Nervoso Central (SNC). Este termo está relacionado com um diagnóstico presuntivo/antemortem mas sem um exame histopatológico associado. Podem atingir qualquer cão mas afetam principalmente cães de raça pequena, fêmeas, entre os 3 e os 7 anos de idade e os sinais neurológicos refletem a localização das lesões no SNC. Dividem-se em Meningoencefalomielite Granulomatosa (MEG) e em Encefalites Necrosantes (EN) sendo que estas se subdividem em Meningoencefalite Necrosante (MEN) e Leucoencefalite Necrosante (LEN). O diagnóstico definitivo destas subdivisões é conseguido apenas através de uma confirmação histopatológica seja por biópsia antemortem ou por necrópsia. Nesta dissertação, serão abordadas as características gerais, imagiológicas e histopatológicas de cada elemento que compõe as MOD passando também pela abordagem diagnóstica e terapêutica, relativas ao cão, descritas na literatura mais atual.
A componente prática desta dissertação vai incidir na descrição e discussão de 3 casos clínicos relativos a cães diagnosticados com MOD que se apresentaram no Serviço de Neurologia do Hospital Ars veterinária, Barcelona, no decorrer do meu estágio curricular.
Palavras chave: Sistema nervoso central; cão; inflamação; meningoencefalomielite de
v The Central Nervous System comprises the brain and the spinal cord and both are surrounded by the meninges.
Inflammation can affect the brain (encephalitis), the spinal cord (myelitis) or the meninges (meningitis), individually, or can reach more than one structure as in meningoencephalitis (meninges and brain) or meningoencephalomyelitis (meninges, brain and spinal cord).
Meningoencephalomyelitis of Unknown Origin (MUO) are a group of inflammatory, idiopathic, noninfectious diseases of the Central Nervous System (CNS). This classification is related to a presumptive/antemortem diagnosis where a histopathological examination is lacking. These diseases can affect any dog but primarily affect small breed dogs, females, between 3 and 7 years old and the neurological signs reflect the location of the lesions in the CNS. MUO can be divided into Granulomatous Meningoencephalomyelitis and Necrotizing Encephalitis and these last are subdivided into Necrotizing Meningoencephalitis and Necrotizing Leukoencephalitis. The definitive diagnosis of these subdivisions is achieved only through a histopathological confirmation either by an antemortem biopsy or by necropsy. This dissertation will discuss the general features, imaging and histopathologic characteristics of each element that comprises the MUO discussing also the diagnostic and therapeutic approaches for the dog which are described in the current literature.
The practical component of this dissertation will focus on the description and discussion of three clinical cases involving dogs diagnosed with MUO presented at the Neurology Department of the Ars veterinaria hospital, Barcelona, in the course of my internship.
Keywords: central nervous system; dog; inflammation; meningoencephalomyelitis of
vi
CAPÍTULO I – REVISÃO BIBLIOGRÁFICA
1. Introdução ... 1
2. Neuroanatomia do Sistema Nervoso do cão ... 2
2.1. Sistema Nervoso Central ... 2
2.2. Sistema Nervoso Periférico ... 7
2.3. Sistema Nervoso Autónomo ... 7
3. Doenças inflamatórias do Sistema Nervoso Central do cão ... 7
3.1. Classificação ... 7
3.2. Inflamação no SNC ... 9
4. Meningoencefalomielites de Origem Desconhecida ... 10
4.1. Meningoencefalomielite granulomatosa ... 10 4.1.1. Características clínicas ... 10 4.1.2. Características imagiológicas ... 12 4.1.3. Características histológicas ... 15 4.2. Encefalites Necrosantes ... 16 4.2.1. Meningoencefalite necrosante ... 16 4.2.1.1. Características imagiológicas ... 16 4.2.1.2. Características histológicas ... 18 4.2.2. Leucoencefalite necrosante ... 19 4.2.2.1. Características imagiológicas ... 19 4.2.2.2. Características histológicas ... 20 5. Abordagem diagnóstica ... 22
5.1. Deteção de causas infecciosas ... 23
5.2. Provas avançadas de imagem ... 23
5.3. Líquido cefalorraquidiniano (LCR) ... 25
5.4. Biomarcador GFAP sérica (glial fibrillary acidic protein) ... 26
5.5. Biópsia cerebral ... 27
6. Abordagem terapêutica ... 28
vii
Caso clínico nº1 ... 34
Caso clínico nº2 ... 39
Caso clínico nº3 ... 45
Discussão e conclusões ... 49
CAPÍTULO III – BIBLIOGRAFIA Bibliografia ... 56
viii Figura 1 – Representação esquemática do cérebro de um mamífero, vista lateral, com os lobos
cerebrais em evidência. ... 3
Figura 2 – Representação esquemática do encéfalo, vista ventral, com evidenciação do local de origem dos Nervos Cranianos (II-XII). ... 4
Figura 3 – Representação esquemática do cerebelo, corte transversal, com evidenciação dos núcleos cerebelares. ... 5
Figura 4 – Representação esquemática do sistema ventricular. ... 5
Figura 5 – Representação esquemática do SNC com evidenciação do sistema ventricular, espaço subaracnóideo e meninges. ... 6
Figura 6 – Doenças inflamatórias, não infecciosas, do SNC. ... 8
Figura 7 – Imagens de RM da forma focal de MEG. Imagens A e B.. ... 12
Figura 8 – Corte transversal ao mesmo nível que as imagens na Fig. 7. Imagem C.. ... 13
Figura 9 – Imagens de Ressonância Magnética da forma ocular da MEG. ... 14
Figura 10 – Imagem de um corte histológico ao nível do tronco encefálico em que se evidencia um infiltrado perivascular. Forma focal da MEG . ... 15
Figura 11 – Imagens de Ressonância Magnética, cortes transversais, ao nível do mesencéfalo de um Pug com MEN. ... 17
Figura 12 – Imagens de Ressonância Magnética, cortes transversais, ao nível do núcleo caudado de um Pug com MEN. ... 18
Figura 13 – Imagem de um corte histológico do lobo frontal de um cão de raça Pug com MEN. ... 19
Figura 14 – Imagens de Ressonância Magnética, cortes transversais, de um cão com LEN. .. 20
ix Figura 17 – Imagem de Tomografia Computorizada do encéfalo de um cão de raça Yorkshire Terrier com LEN. Corte transversal. ... 24 Figura 18 – Imagens da monitorização por espetroscopia protónica por Ressonância Magnética, antes do tratamento por radiação (A e B) e imediatamente após o tratamento (C e D) relativas a um cão de raça Weimaraner com MOD. ... 31 Figura 19 – Imagens de cortes transversais de RM, em T2 (A), no FLAIR (B), em T1 pré (C) e pós contraste (D) do encéfalo da cadela “Vela” de raça Chiuhuahua ao nível do tálamo. ... 37 Figura 20 – Imagens de cortes transversais de RM, em T2 (A), no FLAIR (B), em T1 pré (C) e pós contraste (D) do encéfalo da cadela “Lupe” de raça Chihuahua ao nível do lobo temporal. ... 42 Figura 21 – Imagens de cortes transversais de RM, em T2 (A), no FLAIR (B), em T1 pré (C) e pós contraste (D) do encéfalo da cadela “Betty” de raça Pug a nível temporo-occipital. ... 47
x Tabela 1 – Orientações propostas por Granger et al. para a realização do diagnóstico clínico/presuntivo de MOD, na ausência de histopatologia. ... 23 Tabela 2 – Diagnósticos diferenciais de lesões multifocais intracranianas. ... 25 Tabela 3 – Valores normais de referência da análise do Líquido cefalorraquídeo ... 26 Tabela 4 – Modalidades terapêuticas, respetivas doses utilizadas no tratamento das MOD e tempo médio de sobrevivência (dias) para os cães tratados com os respectivos protocolos. .. 29 Tabela 5 – Exame neurológico da cadela “Vela”, caso clínico nº1, respetivo ao dia seguinte à consulta. ... 35 Tabela 6 – Exame neurológico da cadela “Lupe”, caso clínico nº2, no momento da consulta de referência. ... 41 Tabela 7 – Tabela relativa às várias análises efetuadas ao LCR da cadela “Lupe”, caso clínico nº2. ... 43
xi BID – bis in die (admnistração duas vezes ao dia)
Cho – Colina
COP (protocolo) – Ciclofosfamida, Vincristina e Prednisona Cr – Creatina
DAMP´s – Danger-associated molecular patterns EN – Encefalites Necrosantes
FLAIR – Fluid Attenuation Inversion Recovery GFAP – Glial Fibrillary Acidic Protein
HE – Hematoxilina Eosina Htc – Hematócrito IR – Intrarretal IV – Intravenoso Lac – Lactato LCR – Líquido Cefalorraquidiano LEN – Leucoencefalite Necrosante Lip – Lípidos
MARC – Meningite Arterite Responsiva a Corticoesteróides MEE – Meningoencefalite Eosinofílica
MEG – Meningoencefalomielite Granulomatosa MEN – Meningoencefalite Necrosante
MOD – Meningoencefalomielite de Origem Desconhecida NAA – N-acetil-aspartato
NC – Nervos Cranianos NH3 – Amoníaco O2 – Oxigénio
OD – oculus dexter (globo ocular direito) OS – oculus sinister (globo ocular esquerdo) PAMP´s – Pathogen-associated molecular patterns PAS – Pressão Arterial Sistólica
PCR – Polymerase Chain Reaction (reação em cadeia da polimerase) PO – per os (admnistração por via oral)
xii RPL – Reflexo Pupilar à Luz
SC – Subcutâneo
SID – semel in die (admnistração uma vez ao dia) SN – Sistema Nervoso
SNA – Sistema Nervoso Autonómico SNC – Sistema Nervoso Central SNP – Sistema Nervoso Periférico STI – Síndrome Idiopática de Tremores T1 – Imagem ponderada em T1
T2 – Imagem ponderada em T2 TC – Tomografia Computorizada
TID – ter in die (admnistração três vezes ao dia) TMS – Tempo Médio de Sobrevivência
1
CAPÍTULO I – REVISÃO BIBLIOGRÁFICA
1. Introdução
Esta dissertação de mestrado foi elaborada no âmbito do estágio curricular do 6º ano do Mestrado Integrado em Medicina Veterinária da Universidade de Trás-os-Montes e Alto Douro (UTAD) que foi realizado no Hospital Ars Veterinária, Barcelona, com a duração de 3 meses. O estágio incluiu várias áreas clínicas como Medicina Interna, Oftalmologia, Dermatologia, Unidade de Cuidados Intensivos e Cirurgia mas foi, sobretudo, através do acompanhamento da equipa de Neurologia que foi possível a recolha de informação e de casos clínicos de Meningoencefalomielites de Origem Desconhecida (MOD) em cães. O tema foi sugerido pela minha coorientadora no decorrer do estágio e, mediante a disponibilidade de casos clínicos, considerei o tema pertinente, atual e ainda pouco estudado, fazendo com que valesse a pena a realização deste trabalho cujo objetivo foi de resumir e agrupar a informação importante relativa às MOD.
As publicações clínicas relacionadas com o tema “Meningoencefalomielites de Origem Desconhecida” foram pesquisadas em “http://www.ncbi.nlm.nih.gov/pubmed”. As palavras-chave que foram utilizadas foram "meningoencephalitis unknown etiology", “meningoencephalitis unknown origin”, “granulomatous meningoencephalomyelitis dog”, “meningoencephalitis dog therapy”, “meningoencephalitis dog”, “pug dog encephalitis” e “necrotising encephalitis dog”. Realizou-se uma análise adequada de cada publicação para a elaboração deste trabalho, dando especial interesse aos artigos publicados após o ano de 2005. A presente dissertação foi dividida em dois capítulos principais, o primeiro, a revisão bibliográfica e o segundo onde se faz a descrição e a discussão dos casos clínicos recolhidos.
2
2. Neuroanatomia do Sistema Nervoso do cão
O Sistema Nervoso (SN) do cão é composto por três principais sistemas, o Sistema Nervoso Central (SNC), o Sistema Nervoso Periférico (SNP) e o Sistema Nervoso Autonómico (SNA) (Thompson & Hahn, 2012). É formado por um número elevado de neurónios, as unidades funcionais do SN, cuja função é a transmissão da informação aferente para centros integradores e destes para outros neurónios ou orgãos efetores. Um neurónio é formado por uma zona dendrítica (porção recetora), um axónio (composto por neurofilamentos que vão desde a zona dendrítica até ao telodendro), um corpo celular (contém o núcleo e outros organelos intracelulares) e o telodendro (zona onde o impulso nervoso deixa esse neurónio) (Chrisman et al., 2002; Lahunta et al., 2008; Thompson & Hahn, 2012).
2.1. Sistema Nervoso Central
O SNC é formado por duas estrututras principais, o encéfalo e a medula espinhal. Encontram-se ambos revestidos externamente por três camadas de tecido conjuntivo, as meninges. Internamente, ao nível do encéfalo, existe um conjunto de espaços por onde circula o líquido cefalorraquidiano (LCR), o sistema ventricular (figura 4), que se extende caudalmente pelo canal central e espaço subaracnoideo. O encéfalo está protegido no interior de uma estrutura óssea, o neurocrânio, que é formado pelos ossos frontal, parietal, occipital, temporal, etmóide e o esfenóide. Anatomicamente, divide-se em prosencéfalo, que se subdivide em telencéfalo (hemisférios cerebrais) e em diencéfalo (tálamo, hipotálamo, subtálamo, metatálamo e epitálamo); em mesencéfalo e em rombencéfalo que, por sua vez, se subdivide em metencéfalo (ponte e cerebelo) e mielencéfalo (medula oblonga). Do ponto de vista funcional, está dividido em prosencéfalo, tronco encefálico (mesencéfalo, ponte e medula oblonga) e cerebelo (Lahunta et al., 2008; Gandini, G. et al., 2010; Thompson & Hahn, 2012).
O telencéfalo é formado por dois hemisférios cerebrais que estão separados pela fissura longitudinal e unidos pelo corpo caloso, dividindo-se em vários lobos (figura 1), nomeadamente, lobo frontal, parietal, temporal, occipital e rinencéfalo (com a sua componente olfatória e límbica) e possui, por exemplo, funções associadas ao comportamento, à receção e integração de informação aferente como informação acústica, visual ou olfativa, ao controlo da função motora voluntária e à aprendizagem e memória
3 (Gandini, G. et al., 2010; Thomson & Hahn, 2012). É composto pela substância cinzenta e pela substância branca. A primeira encontra-se maioritariamente a um nível mais externo e forma o córtex cerebral, existindo também a nível subcortical sob a forma de hipocampo, núcleos basais e núcleos septais. Por sua vez, a substância branca encontra-se mais internamente nos hemisférios cerebrais e é composta por vários tipos de fibras nervosas, as fibras de associação que se projetam através de um dos hemisférios, fibras de projeção que conectam informação entre os hemisférios e o tronco encefálico e, por fim, fibras comissurais que se projetam de um hemisfério para o outro através do corpo caloso. Já o diencéfalo é formado pelo tálamo, metatálamo, epitálamo, hipotálamo e subtálamo e está disposto simetricamente em redor do 3º ventrículo. Tem funções ligadas ao estado de vigilância, à regulação da atividade endócrina da hipófise e ao ritmo circadiano (a cargo da glândula pineal) (Lahunta et al., 2008; Gandini, G. et al., 2010; Thompson & Hahn, 2012).
Figura 1 – Representação esquemática do cérebro de um mamífero, vista lateral, com os lobos cerebrais em
evidência. Adaptado de (Thompson & Hahn, 2012).
O tronco encefálico é formado pelo mesencéfalo, ponte e medula oblonga e funciona como ligação entre a medula espinhal e o córtex cerebral. Ao contrário do telencéfalo, no tronco encefálico a substância branca encontra-se a um nível mais superficial em relação à substância cinzenta. A maior parte dos Nervos Cranianos (NC) têm a sua origem ao nível do tronco encefálico (III-XII) sendo que existem duas excepções (I e II) que se originam fora do mesmo (figura 2). Contem os centros reguladores da função cardíaca e respiratória (a cargo da formação reticular), do estado de consciência (a cargo do Sistema Reticular Ativante Ascendente), da defecação, micção, vómito e deglutição, estando também envolvido, por
4 exemplo, em funções associadas ao equilíbrio, à audição e à proprioceção (Lahunta et al., 2008; Steffen, F. et al., 2010; Thompson & Hahn, 2012; Garosi, L., 2013).
O cerebelo localiza-se dorsalmente à ponte e está separado do cérebro pelo tentório ósseo do cerebelo. A conexão com o tronco encefálico é realizada através de três pedúnculos, o rostral, o médio e o caudal. Está dividido pela fissura uvulonodular em duas partes principais, o lobo floculonodular e o corpo do cerebelo em que este, por sua vez, é formado por uma área central, o vérmis, localizada entre dois hemisférios cerebelares. O cerebelo é formado por uma extensa área central de substância branca onde se localizam, a nível bilateral, os três núcleos cerebelares, o fastigial, o interposital e o dentado (figura 3). É ainda composto por três camadas de córtex cerebelar que envolvem a substância branca. Assume um papel fundamental no controlo da atividade motora sem, no entanto, estar envolvido no início dos movimentos (a cargo dos centros do Neurónio Motor Superior) desempenhando também outras funções relacionadas com a manutenção do equilíbrio e do tónus muscular, por exemplo (Lahunta et al., 2008; Cizinauskas, S. & Jaggy, A., 2010).
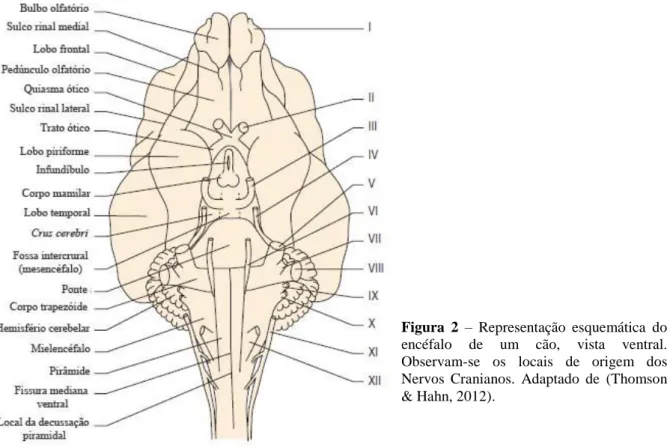
Figura 2 – Representação esquemática do
encéfalo de um cão, vista ventral. Observam-se os locais de origem dos Nervos Cranianos. Adaptado de (Thomson & Hahn, 2012).
5
Figura 3 – Representação esquemática do cerebelo, corte transversal, com evidenciação dos núcleos cerebelares,
Dentado (D), Interposital (I) e Fastigial (F) e do lobo floculonodular (N), Vérmis (V) e os dos dois hemisférios cerebelares (H). Adaptado de (Cizinauskas, S. & Jaggy, A., 2010).
O LCR é um líquido transparente, ultrafiltrado do plasma sanguíneo, que é produzido maioritarimente no sistema ventricular pelos plexos coróides e assume um papel crucial na proteção, suporte e nutrição do SNC. O sistema ventricular é formado pelos ventrículos laterais, terceiro ventrículo, aqueduto mesencefálico e 4º ventrículo (figura 4).
Figura 4 – Representação esquemática do sistema ventricular, em cima uma vista dorsal e em baixo uma vista
6 O LCR circula caudalmente para o exterior dos ventriculos pelo canal central (na medula espinhal) e flui para o espaço subaracnoideo através das aberturas laterais do quarto ventrículo (figura 5) (Lahunta et al., 2008).
O SNC está revestido por três camadas de tecido conjuntivo, as meninges (figura 5). As duas mais internas e mais finas são as leptomeninges, nomeadamente, a pia-máter que está aderida intimamente ao parênquima (tanto do encéfalo como da medula espinhal) e a membrana aracnóide. Entre estas duas membranas está o espaço subaracnoideo por onde circula o LCR. Mais externamente às leptomeninges encontra-se uma camada mais espessa, a paquimeninge ou dura-máter, que no crânio está aderida intimamente ao osso e na medula espinhal está afastada do canal vertebral pelo espaço epidural (Lahunta et al., 2008; Vandevelde, Higgins, & Oevermann, 2012).
Figura 5 – Representação esquemática do SNC onde estão evidenciados o sistema ventricular e as meninges.
Em cima à direita vê-se um corte transversal da medula espinhal onde se observa a relação entre as várias meninges e o espaço subaracnóideo. Adaptado de (Lahunta et al., 2008).
Quanto à medula espinhal pode-se afirmar que se encontra protegida pela coluna vertebral dentro do canal medular. Inicia-se ao nível do forâmen magno e vai terminar como cone medular ao nível da sexta vertebra lombar na maior parte dos cães. A medula pode ser dividida em cinco regiões, tanto do ponto de vista anatómico (C1-C8, T1-T13, L1-L7, S1-S3, Cd1-Cd5) como do ponto de vista funcional (C1-C5, C6-T2, T3-L3, L4-S3, Cd1-Cd5). Em corte transversal, divide-se em substância branca na periferia e em substância cinzenta a nível central (Thompson & Hahn, 2012; Garosi, L., 2013).
7
2.2. Sistema Nervoso Periférico
É o componente do SN que faz a ligação entre o SNC e os músculos, glândulas e recetores sensitivos. É composto por 12 nervos cranianos no cão e por um número variável de nervos espinhais que emergem da medula espinhal através dos forâmens vertebrais. Ao nível dos membros, os segmentos medulares que os inervam são maiores em diâmetro e denominam-se de intumescência cervicotorácica (C6-T2) e intumescência lombosagrada (L4-S3) e estas são a origem dos plexos braquial e lombosagrado, respetivamente (Lahunta et al., 2008; Faissler, D et al., 2010; Thomson & Hahn, 2012).
2.3. Sistema Nervoso Autónomo
É formado por componentes centrais (hipotálamo, mesencéfalo, ponte, medula oblonga e medula espinhal) e periféricos (fibras nervosas aferentes e eferentes que inervam o músculo cardíaco e o músculo liso das vísceras e glândulas). Do ponto de vista funcional, pode ser dividido em componente parassimpática e simpática. A primeira, encarrega-se de funções como a digestão e outras atividades que têm como objetivo a homeostase. A segunda, por sua vez, encarrega-se de atividades por parte do organismo em que há necessidade de lidar com situações de stress, como aumentar a frequência cardíaca e respiratória, a dilatação das pupilas e a canalização do fluxo sanguíneo para os principais músculos esqueléticos, entre outras (Lahunta et al., 2008; Strenk, P. et al., 2010; Thomson & Hahn, 2012).
3. Doenças inflamatórias do Sistema Nervoso Central do cão
3.1. Classificação
Os processos inflamatórios ao nível do SNC podem ser classificados em dois grupos principais, os de etiologia infecciosa e os de etiologia não infecciosa. É de referir que a infeção por parte de agentes patogénicos (ou infestação no caso de parasitas), por via sanguínea, é relativamente pouco frequente no caso do cão devido à proteção da barreira hematoencefálica (Gandini, G. et al., 2010).
Por outro lado, estes agentes podem entrar no SNC por outras vias para além da hematógena, como através de nervos periféricos, por transporte axonal, como o que ocorre com o vírus do Herpes e com a bactéria Listeria e ainda através do próprio LCR (Vandevelde et al., 2012).
8 Estes agentes infecciosos podem ter como origem vírus (esgana, raiva, herpes, etc.), bactérias (aeróbias e anaeróbias), rickettsias (ehrlichia spp., anaplasma spp., rickettsia
rickettsii, etc.), protozoários (toxoplasma spp., neospora spp., babesia spp., etc), fungos
(criptococos, blastomyces, histoplasma, aspergillus, etc) e parasitas (dirofilaria spp.,
toxocara canis, ancylostoma caninum, cuterebra, etc) (Gandini, G. et al., 2010).
O grupo de etiologia não infecciosa está dividido principalmente com base na neurolocalização da lesão e das respetivas características histopatológicas em vários subtipos. Estes são: a meningite-arterite responsiva a corticosteróides (MARC), a meningoencefalite eosinofílica (MEE), o síndrome de tremores idiopático (STI), a meningoencefalomielite granulomatosa (MEG), as encefalites necrosantes (EN), em que estas se subdividem em meningoencefalite necrosante (MEN) e leucoencefalite necrosante (LEN). Tanto as MEG como as EN fazem parte de um leque de doenças idiopáticas, inflamatórias e não infecciosas em que não se consegue precisar um diagnóstico definitivo por falta de um resultado histopatológico concreto. A este grupo de doenças dá-se o nome de Meningoencefalomielites de Origem Desconhecida (MOD) (Coates & Jeffery, 2014).
Figura 6 – Doenças inflamatórias, não infecciosas, do SNC. As meningoencefalomielites de origem
desconhecida (MOD) englobam a meningoencefalomielite granulomatosa (MEG) e as encefalites necrosantes (EN) que, por sua vez, englobam a meningoencefalite necrosante (MEN) e a leucoencefalite necrosante (LEN). À parte das MOD encontram-se a meningite-arterite responsiva a córticos (MARC), a meningoencefalite eosinofílica e a Síndrome idiopática de tremores que se distinguem das MOD pelas suas caracteristicas diferenciadas em termos de sinais clinicos, análise ao LCR e histopatologia. Adaptado de (Coates & Jeffery, 2014).
9
3.2. Inflamação no SNC
A inflamação pode afetar várias áreas do SNC, nomeadamente, o encéfalo (encefalite), a medula espinhal (mielite), as meninges (meningite) e, por vezes, mais do que uma destas áreas, como no caso de uma meningoencefalite (meninges e encéfalo) ou de uma meningoencefalomielite (meninges, encéfalo e medula) (William B. Thomas, 1998).
A inflamação é um processo que tem em vista a resposta a um estímulo (ex: infeção viral ou bacteriana) que envolve vários mecanismos diferentes como, por exemplo, a recrutação celular, a fagocitose e a apoptose fazendo com que haja possibilidade de haver regeneração tecidular. A neuroinflamação, por sua vez, é um conjunto de respostas imunitárias por parte do SNC que difere do SNP, principalmente, devido ao tipo de células envolvidas, sendo a microglia e os astrócitos as mais importantes (Lyman, Lloyd, Ji, Vizcaychipi, & Ma, 2014). Apesar das MOD serem um grupo de doenças inflamatórias cuja etiopatogénese permanece ainda por desvendar na totalidade, pensa-se que tenha como base uma resposta imunitária anormal contra o SNC. Esta suposição tem como base, por um lado, o facto de se tratarem de anomalias inflamatórias em que até ao momento não foi possível detetar nenhum agente patogénico associado e, por outro lado, por serem um grupo de doenças que responde favoravelmente aos corticosteróides e aos fármacos imunomoduladores de 2ª linha (Talarico & Schatzberg, 2010; Vandevelde et al., 2012).
Após haver um estímulo, seja ele infeccioso (ex:vírus ou bactérias) ou não infeccioso (ex: dano mecânico), o organismo dispõe de dois tipos de resposta imunitária, uma a cargo do sistema imune inato e a outra uma resposta imune adaptativa. A imunidade inata está associada a respostas não específicas, mais rápidas e que, no caso de um estímulo infeccioso, são desencadeadas por moléculas denominadas de padrões moleculares associados aos patogéneos (PAMP´s) e no caso de um estímulo não infeccioso, padrões moleculares associados ao perigo (DAMP´s) (Vandevelde et al., 2012; Coates & Jeffery, 2014; Lyman et al., 2014;). Quando há o reconhecimento desse estímulo há a libertação de moléculas tóxicas e o recrutamento de células como neutrófilos, macrófagos e células natural killer (Vandevelde et al., 2012).
Por sua vez, a resposta imune adaptativa está associada à imunidade humoral (esta relacionada com a produção de anticorpos) e à imunidade celular. Ao contrário da resposta inapta, a adaptativa é uma resposta a mais longo prazo e altamente específica (Coates & Jeffery, 2014).
10 Existe um conjunto de moléculas controladoras da inflamação ao nível do SNC como as moléculas de adesão, metaloproteinases, quimoquinas e as citoquinas (ex: interleucinas, interferões, fatores de necrose tumoral, etc) que são produzidas em baixas concentrações mas que desempenham um papel crucial na modulação da inflamação e da homeostase (Vandevelde et al., 2012; Coates & Jeffery, 2014). Estas últimas, podem ter um papel pro-inflamatório ou anti-pro-inflamatório levando a stress oxidativo, neurotoxicidade, apoptose, astrogliose e a ativação da microglia. Do ponto de vista das MOD, a cadeia de reações desencadeadas pelas citoquinas permanece desconhecida até ao momento e carece mais investigação e estudos no futuro (Spitzbarth, Baumgärtner, & Beineke, 2012).
4. Meningoencefalomielites de Origem Desconhecida
As MOD podem-se definir como um grupo de doenças inflamatórias, idiopáticas, não infecciosas do SNC, sendo esta terminologia associada a um diagnóstico presuntivo e
antemortem. Apesar de não se saber ao certo a sua etiopatogénese pensa-se que esteja
associada a um processo autoimune e genético. Englobam as MEG, as MEN e as LEN que, do ponto de vista clínico, são muito similares entre si e entre outras doenças inflamatórias do SNC (com base em resultados do exame neurológico, da análise do LCR e dos resultados da Ressonância Magnética e da Tomografia Computorizada) sendo que só se efetua um diagnóstico definitivo por histopatologia, seja por biópsia antemortem ou aquando da necrópsia (Talarico & Schatzberg, 2010; Coates & Jeffery, 2014). As MOD afetam principalmente cães de raça pequena, fêmeas, entre os 3 e os 7 anos de idade e estão associadas a maior parte das vezes a sinais neurológicos multifocais (combinação de sinais de várias regiões como prosencéfalo, tronco encefálico, cerebelo e medula espinhal) sendo que o quadro neurológico neste tipo de doenças inflamatórias do SNC reflete a localização anatómica das lesões (Granger et al., 2010; Talarico & Schatzberg, 2010; Coates & Jeffery, 2014).
4.1.
Meningoencefalomielite granulomatosa
4.1.1. Características clínicas
A MEG representa uma das doenças mais diagnosticadas por histopatologia em termos de meningoencefalomielites não infecciosas e pode representar até 25% de todas as doenças
11 inflamatórias do SNC do cão (Koestner and Zeman, 1962; Fankhauser et al., 1972; Braund et al., 1978; Andrea Tipold, 1995; Granger, Smith, & Jeffery, 2010). A sua etiopatogénese permanece ainda por desvendar totalmente embora várias teorias tenham sido sugeridas. Os sinais clínicos costumam aparecer após os 6 meses de idade e podem aparecer em animais de qualquer raça ou sexo, embora o mais típico seja encontrar-se MEG em fêmeas de raça pequena (Muñana & Luttgen, 1998; Talarico & Schatzberg, 2010). Do ponto de vista clínico, pode ser dividida em 3 formas diferentes: a multifocal, a focal e a ocular (Cuddon & Smith-Maxie, 1984; Talarico & Schatzberg, 2010).
A forma multifocal é a mais frequente e caracteriza-se por um aparecimento agudo dos sinais neurológicos e uma progressão rápida dos mesmos (Muñana & Luttgen, 1998; Talarico & Schatzberg, 2010; Coates & Jeffery, 2014). Estes sinais neurológicos podem indicar uma neurolocalização ao nível de várias divisões funcionais do SNC (prosencéfalo, tronco encefálico, cerebelo ou medula espinhal) sendo que na forma multifocal o mais frequente é haver a afetação do prosencéfalo e tronco encefálico (Sorjonen, 1990a; Coates & Jeffery, 2014). Os sinais caracteristicos de prosencéfalo são por exemplo convulsões, alterações comportamentais, pleurotótonus, giro da cabeça, head pressing, cegueira contralateral à lesão com reflexos pupilares à luz normais e com resposta à ameaça diminuida a ausente, síndrome de heminegligência, entre outros. Por sua vez, os sinais típicos de tronco encefálico são: estado mental alterado (estupor ou coma), possível alteração ipsilateral dos NC, do III ao XII, tetraparésia/tetraplégia ou hemiparésia/hemiplégia ipsilateral à lesão e alterações a nível cardíaco e respiratório também podem ocorrer, entre outros (William B. Thomas, 2010; Garosi, L., 2013).
Relativamente à forma focal, o mais frequente é haver apenas a afetação do prosencéfalo, manifestando-se, então, principalmente por sinais neurológicos correspondentes a essa neurolocalização. Esta forma focal caracteriza-se por uma progressão mais lenta dos sinais neurológicos e consequentemente menos grave a nivel prognóstico. Como se trata de uma lesão singular, ocupadora de espaço passível de provocar efeito massa e como tem uma evolução clínica mais lenta pode-se confundir com um quadro neoplásico. Neste tipo de MEG, a substância branca é a que costuma estar mais severamente afetada ao contrário do que ocorre na forma multifocal em que a substância branca e a cinzenta estão igualmente afetadas (Sorjonen, 1990a; Coates & Jeffery, 2014).
Por fim, a forma ocular, a menos estudada, caracteriza-se por uma disfunção visual por neurite ótica, alterações das pupilas (normalmente dilatadas e não-responsivas) e, por vezes,
12 por edema do disco ótico, coriorretinite e uveíte anterior e posterior. Esta forma ocular pode surgir concomitantemente com a forma multifocal (Smith, de Lahunta, & Riis, 1977; Garmer, Naeser, & Bergman, 1981; Braund, 1985; Nuhsbaum et al., 2002; Kitagawa et al., 2009; Talarico & Schatzberg, 2010; Coates & Jeffery, 2014).
4.1.2. Características imagiológicas
Antes de haver a disponibilidade atual de Ressonância Magnética (RM), usava-se a Tomografia Computorizada (TC), para que em conjunto com a análise ao LCR, se pudesse chegar a um diagnóstico presuntivo de doença inflamatória do SNC (Plummer et al., 1992a; Coates & Jeffery, 2014).
Segundo um estudo de Cherubini et al., as imagens de RM, dos encéfalos e medula espinhal de cães com MEG, confirmada por histopatologia, foram todas associadas a zonas de margens irregulares, hiperintensas (sugestivas de edema e inflamação), tanto na sequência T2 como no FLAIR (fluid attenuation inversion recovery), enquanto que em T1 as imagens variavam entre áreas hipointensas, isointensas e mistas. As Fig. 7 e 8 são exemplos de imagens de RM de lesões de MEG (Cherubini et al., 2006).
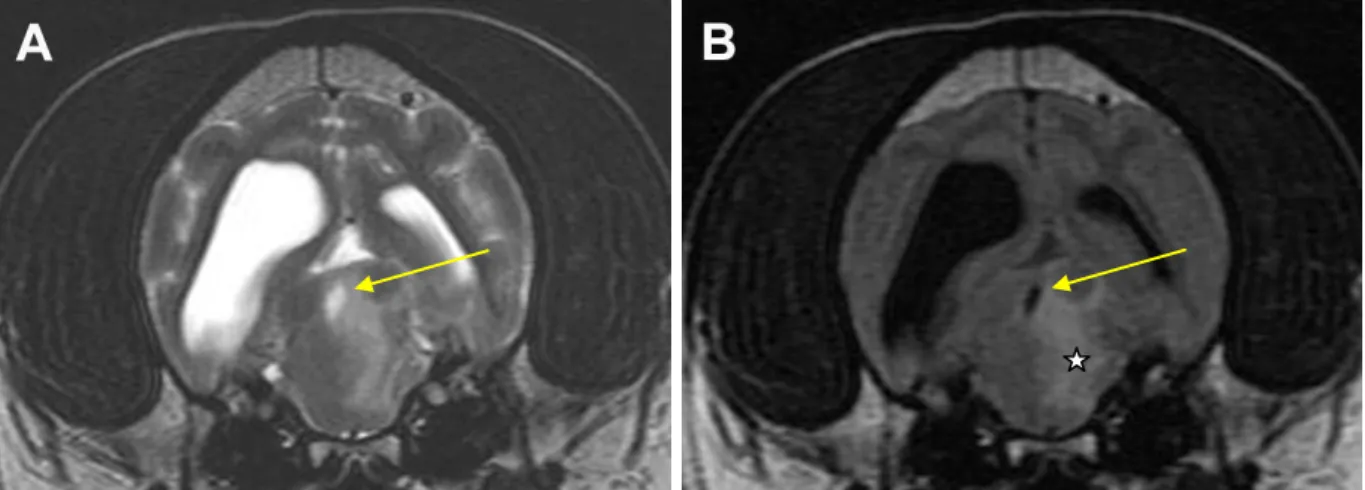
Figura 7 – Imagens de RM da forma focal de MEG. Em A: um corte transversal em T2 ao nível do mesencéfalo,
colículo caudal e córtex cerebral. Está evidenciada uma área hiperintensa mais centralizada à direita, ao nível da substância cinzenta, colículo caudal, formação reticular e lemnisco medial. Presença de efeito massa evidenciada pelo desvio da linha média e do aqueduto mesencefálico para a esquerda (seta amarela). Em B: um corte transversal, num FLAIR, ao mesmo nível que a imagem A. Está evidenciada uma área hiperintensa ao nivel do mesencéfalo direito compatível com edema que está bem visível porque contrasta com a hipointensidade, por supressão de sinal, do aqueduto mesencefálico (estrela branca). É de notar também a existência de ventriculomegália. Adaptado de (Coates & Jeffery, 2014).
13 Apesar das lesões a nível histopatológico serem distribuidas principalmente pela substância branca, os sinais de lesão na RM manifestaram-se tanto na substância branca como na cinzenta. Tanto no FLAIR como em T1 pós-contraste não houve evidência de qualquer anomalia a nível meníngeo apesar de haver, no entanto, confirmação histológica de lesões meníngeas na maior parte dos cães (9/11). Relativamente à captação de contraste por parte das leptomeninges sabe-se que não é uma característica típica das MEG. Pode ainda ser observada a presença de efeito massa, através de, por exemplo, desvio da linha média e compressão dos ventrículos (Cherubini et al., 2006).
Num caso clínico apresentado por Kitagawa et al em 2009, relativo a um cão com forma ocular de MEG (a forma menos estudada), os dois nervos óticos apresentaram-se em imagens de RM (figura 9) sem um aumento evidente de tamanho e isointensos tanto em T1 como em T2. Em relação ao quiasma ótico observou-se aumento de tamanho, isointensidade em T1, com captação de contraste associada, uma ligeira hiperintensidade em T2 e uma massa adjacente ao quiasma ótico em T1 pós-contraste. O lobo temporal e o tálamo foram observados como hipointensos em T1 e hiperintensos em T2 e ainda se observou captação de contraste entre o 3º e o 5º segmento medular (Kitagawa et al., 2009).
Figura 8 – Corte transversal ao mesmo nível que as imagens na Fig. 7, em T1 pós-contraste. Observa-se captação
14
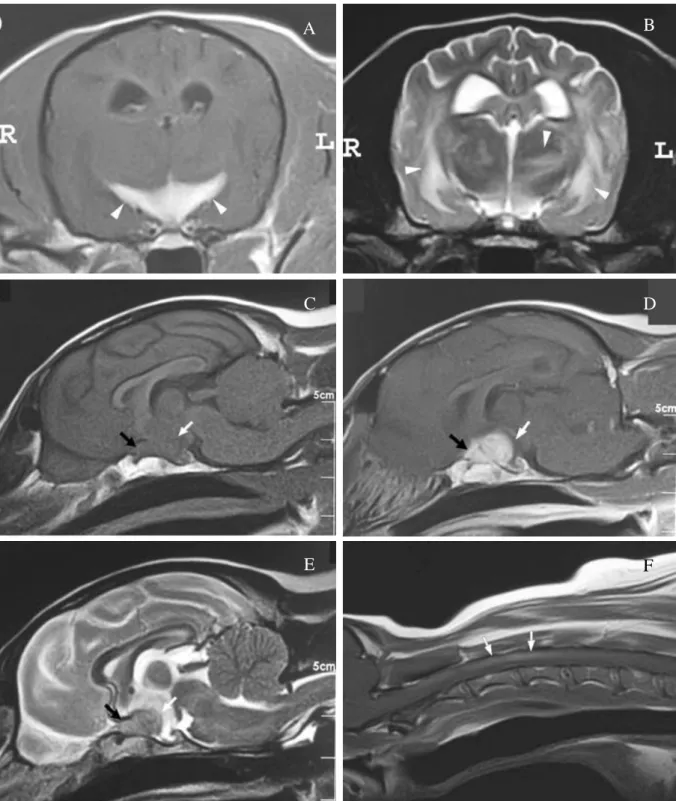
Figura 9 – Imagens de RM da forma ocular da MEG de uma cadela de raça Dashund de 4 anos de idade. A:
corte transversal, em T1-pós contraste, onde se observa captação de contraste na zona de passagem dos nervos óticos (setas brancas). B: corte transversal, em T2, onde se observam áreas evidentes de hiperintensidade ao nível dos lobos temporais e do tálamo (setas brancas). As imagens C, D e E são relativas a cortes sagitais, em T1, T1 pós-contraste e T2, respetivamente. O quiasma ótico (seta preta) e a massa (seta branca) manifestam isointensidade em T1 (C), captação de contraste e ligeiro aumento de tamanho em T1 pós-contraste (D) e ligeira hiperintensidade em T2 (E). F: corte sagital, T1 pós-contraste, onde se observa uma ligeira captação de contraste entre o 3º e o 5º segmento medular (setas brancas). Adaptado de (Kitagawa et al., 2009).
A B
C D
15
4.1.3. Características histológicas
No exame histopatológico do encéfalo, medula espinhal e meninges de cães com MEG é tipico observarem-se densos infiltrados perivasculares, em espiral, de células mononucleares (ex: linfócitos, plasmócitos, monócitos). As lesões agudas (típicas da forma multifocal) tendem a aparecer tanto ao nível da substância branca como da cinzenta enquanto que as lesões mais crónicas (típicas da forma focal) tendem a aparecer apenas ao nível da substância branca (Braund et al., 1978; Cordy, 1979; Sorjonen, 1990b; Coates & Jeffery, 2014).
Relativamente à forma focal sabe-se que é uma lesão resultante de vários infiltrados perivasculares que coalescem para formar uma só massa, com vários vasos sanguíneos associados. A forma ocular varia apenas na localização desses infiltrados, nomeadamente, ao nível da retina, nervos óticos e quiasma ótico. Podem também aparecer, por vezes, em qualquer forma de MEG, neutrófilos e células gigantes multinucleadas (Nuhsbaum et al. 2002; Talarico & Schatzberg, 2010 citando Summers et al.1995; Vandevelde et al., 2012).
Figura 10 – Imagem de um corte histológico ao nível do tronco encefálico em que se evidencia um infiltrado
perivascular (seta) composto na sua maioria por linfócitos, no entanto, associado também a um infiltrado excêntrico de macrófagos. Quando estes infiltrados perivasculares coalescem entre si podem formar uma massa única como na forma focal da MEG. Adaptado de (Vandevelde et al., 2012) .
16
4.2.
Encefalites Necrosantes
As EN englobam as meningoencefalites necrosantes (MEN) e as leucoencefalites necrosantes (LEN), diferenciando-se das MEG sobretudo devido às suas características histopatológicas específicas. A etiopatogénese de ambas as EN continua ainda por desvendar na sua totalidade tal como o que ocorre na MEG. São doenças típicas dos cães jovens sendo que os sinais neurológicos aparecem na média dos 2 anos e meio (variando entre 6 meses e 7 anos) (Cordy & Holliday, 1989; Levine, Fosgate, Porter, Schatzberg, & Greer, 2008; Talarico & Schatzberg, 2010). Costuma haver uma progressão rápida dos sinais neurológicos. O sinal mais importante são as convulsões, podendo surgir outros como o estado mental alterado, sinais vestibulares centrais, disfunção central da visão, head pressing, evoluindo por fim para a morte do animal (Coates & Jeffery, 2014).
Quanto à MEN pode se afirmar que se trata de uma doença característica de raças miniatura e foi descrita pela 1ª vez em cães de raça Pug e mais tarde em Bichon Maltês, Chihuahua, Pequinês, West Highland White Terrier, entre outras. Manifesta-se principalmente por sinais prosencefálicos (Cordy & Holliday, 1989; A. Tipold et al., 1993; Stalis et al., 1995; Cantile et al., 2001; Aresu et al., 2007; Higgins & LeCouteur, 2007; Timmann et al., 2007; Lahunta & Glass, 2008; Talarico & Schatzberg, 2010). Após o estudo de Cooper et al. ficou demonstrado que a MEN não é uma doença específica de um leque restrito de raças e que deve ser incluida no diferencial de cães com sinais clínicos compatíveis. Foram ainda descritas 4 novas raças, nomeadamente, Papillon, Shih Tzu, Coton de Tulear e Brussels Griffon (Cooper et al., 2014). Por sua vez, a LEN é também comum em raças miniatura, nomeadamente, Yorkshire Terrier (o primeiro a ser referido na literatura) e também em Bulldog francês, entre outras. Manifesta-se tanto por sinais de prosencéfalo como de tronco encefálico, nomeadamente, convulsões, disfunção da visão, sinais vestibulares centrais, entre outros (Tipold, A. et al., 1993; Ducoté et al., 1999a; Kuwamura et al., 2002a; Timmann et al., 2007; Coates & Jeffery, 2014).
4.2.1. Meningoencefalite necrosante
4.2.1.1. Características imagiológicas
Segundo Flegel et al. num estudo de RM com 4 cães de raça Pug com EN confirmada histologicamente, detetaram-se características comuns a todos os animais envolvidos,
17 nomeadamente, lesões de margens irregulares, assimétricas, multifocais, somente no prosencéfalo, tanto ao nível da substância branca como da cinzenta, com perda de diferenciação entre os limites das duas anteriores e ainda desvio da linha média (Flegel, T. et al., 2008). Tanto Flegel et al. como Young et al. obtiveram resultados comuns nos seus estudos, que incluiam Pugs com MEN histologicamente confirmada, nomeadamente, lesões que se manifestaram por hiperintensidade ao nível da sequência T2 e do FLAIR e por isointensidade a hipointensidade em T1, com vários graus de captação de contraste (Flegel, T. et al., 2008; Young et al., 2009).
Figura 11 – Imagens de RM, cortes transversais ao nível do mesencéfalo de um Pug com MEN. Estão
evidenciadas várias sequências, nomeadamente, T1 pré-contraste (A) e pós-contraste (B), T2 (C) e FLAIR (D). As lesões são bilaterais, assimétricas, isointensas em T1 pré-contraste, hiperintensas em T2 e no FLAIR e captam contraste nos dois hemisférios em T1 pós-contraste (setas brancas). Adaptado de (Young et al., 2009).
18
Figura 12 – Imagens de RM, cortes transversais ao nível do núcleo caudado de um Pug com MEN. Estão
evidenciadas 2 sequências, nomeadamente, T1 pré-contraste (A) e pós-contraste (B). Observa-se uma lesão hipointensa em A (asterisco) com captação de contraste observável em B. É visível também a captação de contraste pelas leptomeninges em B (cabeças das setas). É de notar o ligeiro desvio da linha média para o lado contrário à lesão e a compressão do ventrículo lateral adjacente à mesma. Adaptado de (Young et al., 2009).
4.2.1.2. Características histológicas
As lesões a nível histológico caracterizam-se sobretudo por necrose que varia desde necrose neuronal e gliose, numa fase precoce, até ocorrer, numa fase mais avançada, cavitação do parênquima. Dividem-se em 3 fases distintas: a aguda, que se caracteriza apenas por um infiltrado inflamatório ligeiro; a subaguda, em que já existem alterações necróticas moderadas e uma severa inflamação sobretudo a nível meníngeo; e a fase crónica em que já existe malácia severa do tecido (Cordy & Holliday, 1989; Summers et al., 1995; Higgins et al., 2008; Vandevelde et al., 2012; Coates & Jeffery, 2014). Estas lesões costumam estar invadidas por linfócitos, plasmócitos e histiócitos e manifestam-se mais severamente ao nível do prosencéfalo, nomeadamente, hemisférios cerebrais, substância branca subcortical, leptomeninges, córtex cerebral e corona radiata. É comum também haver perda da diferenciação entre substância branca e cinzenta que é bem visível à apreciação macroscópica (Lahunta et al., 2008; Talarico & Schatzberg, 2010 citando Summers et al., 1995).
19
Figura 13 – Imagem de um corte histológico (HE) do lobo frontal de um cão de raça Pug com MEN. Intensa
inflamação linfocítica a nível meníngeo com necrose e inflamação evidente da substância branca subcortical. Adaptado de (Vandevelde et al., 2012).
4.2.2. Leucoencefalite necrosante
4.2.2.1. Características imagiológicas
As lesões na LEN encontram-se tipicamente como entidades múltiplas, assimétricas, bilaterais, prosencefálicas, sobretudo ao nível da substância branca subcortical mas também ao nível do tronco encefálico. Observam-se como áreas hipointensas a isointensas em T1, com captação variável de contraste, e em T2 e no FLAIR como hiperintensas (Lotti, Capucchio, Gaidolfi, & Merlo, 1999; Von Praun, Matiasek, Grevel, Alef, & Flegel, 2006). Pode também, por vezes, ocorrer ventriculomegália (Kuwamura et al., 2002).
20
4.2.2.2. Características histológicas
Quanto à LEN, sabe-se que se trata de uma leucoencefalite, não supurativa, multifocal, assimétrica, com extensas lesões necróticas e de cavitação (Tipold, A. et al., 1993; Lotti et al., 1999; Kuwamura et al., 2002b; Lezmi et al., 2007; Timmann et al., 2007; Coates & Jeffery, 2014). Estas áreas de necrose costumam ser mais severas e extensas do que na MEN. Mais frequentemente afetam a substância branca periventricular, nomeadamente, centro semi oval, fibras talamocorticais, cápsula interna e tálamo, podendo também atingir o tronco encefálico. Alterações a nível meníngeo e cortéx cerebral são achados aberrantes. Na LEN, podem-se ainda encontrar axónios tumefactos, astrócitos gemistocíticos (segundo Şovrea & Boşca, num trabalho de 2013, são astrócitos que proliferam e que estão aumentados de tamanho, têm frequentemente o núcleo excêntrico, o citoplasma eosinófilo, o corpo celular oval e dilatado, e
Figura 14 – Imagens de RM de um cão com LEN.
Cortes transversais em várias sequências de RM, nomeadamente, em T2 (A), FLAIR (B) e T1 pós-contraste (C). Em A, a imagem é ao nível do núcleo caudado e córtex cerebral. Observa-se uma área hiperintensa sobretudo na substância branca do hemisfério direito (seta amarela). Em B, a imagem é ao nível do tálamo e observa-se uma zona de hiperintensidade no tálamo direito (seta laranja) e também ao nível do centro semi oval e cápsula interna no hemisfério direito (setas azuis). Zona bastante evidente devido à supressão de sinal nos ventrículos laterais, compatível com edema. Em C, a imagem é ao mesmo nível que A e observa-se uma lesão hipointensa de bordos irregulares no hemisfério direito (estrela branca) com captação ligeira de contraste perilesional, compatível com malácia. Adaptado de (Coates & Jeffery, 2014).
21 são o resultado de uma agressão ao SNC como uma infeção bacteriana ou vírica), microglia reativa, macrófagos e por vezes infiltrados perivasculares (Lezmi et al., 2007; Talarico & Schatzberg, 2010 citando Summers et al., 1995).
Figura 15 – Imagem de um corte histológico (HE). Leucoencefalite necrosante num cão de raça Yorkshire
Terrier. Está evidenciado um infiltrado inflamatório de distribuição difusa no parênquima da substância branca subcortical com uma área adjacente de malácia. Adaptado de (Vandevelde et al., 2012).
Figura 16 – A imagem da esquerda representa um corte histológico (HE) referente a um cão de
raça Yorkshire Terrier com LEN, onde está evidenciada a proliferação de astrócitos gemistocíticos (setas pretas) e onde é possível observar também um intenso infiltrado linfocítico perivascular (seta amarela). Adaptado de (Vandevelde et al., 2012). A imagem da direita mostra em pormenor os astrócitos gemistocíticos. Adaptado de (Talarico & Schatzberg, 2010).
22
5. Abordagem diagnóstica
Segundo Thomas, uma doença inflamatória do SNC deve ser sempre tomada em conta no caso de animais com sinais clínicos que sugiram lesões multifocais como no caso de um animal com convulsões (cérebro) e paraparésia (medula espinhal) em simultâneo e ainda no caso de cães em que os sinais neurológicos sejam persistentes ou ainda que apresentem sinais sistémicos de doença como febre ou perda de peso (William B. Thomas, 1998). O diagnóstico
antemortem das MOD é clínico/presuntivo e é possível através da análise dos dados
epidemiológicos, dos sinais neurológicos, da localização neuroanatómica, da análise do LCR, das provas de imagem e ainda através da exclusão de causas infecciosas. Para um diagnóstico
antemortem/definitivo, é necessário a obtenção de uma biópsia da lesão e da respetiva
confirmação histopatológica (Zarfoss et al., 2006a; Adamo et al. , 2007a; Talarico & Schatzberg, 2010).
Granger et al. elaboraram um conjunto de orientações para que fosse possível fazer um diagnóstico clínico/presuntivo sem que houvesse uma confirmação histopatológica positiva que estão descritas na tabela 1.
As MOD caracterizam-se principalmente por sinais multifocais, progressivos e que apareçam de forma aguda. Com base nisto, pode ser elaborada uma lista de diagnósticos diferenciais onde se podem incluir anomalias genéticas, anomalias metabólicas, meningoencefalites idiopáticas, infecciosas e não infecciosas, neoplasias e ainda intoxicações. A abordagem inicial inclui a realização de um exame físico geral, um exame neurológico, um hemograma, um painel bioquímico sérico, análise de urina, testes serológicos para despiste de doenças infecciosas, radiografias de tórax e ultrassonografia abdominal. Posteriormente, procede-se à realização de provas de diagnóstico avançadas como provas de imagem (TC ou RM), recolha e análise de LCR e ainda biópsia cerebral (Thomas, 1998; Ducoté et al., 1999b; Talarico & Schatzberg, 2010).
23
5.1.
Deteção de causas infecciosas
Como já foi referido anteriormente, os agentes patogénicos podem invadir o SNC não só por via hematógena como também através dos nervos periféricos (por transporte axonal) e através do próprio LCR (Vandevelde et al., 2012). Assim, o ideal é fazer o despiste destes agentes através da Reação em Cadeia da Polimerase (PCR) tanto do soro sanguíneo como do LCR. Com base nos estudos de vários autores, existe um padrão na escolha de doenças a pesquisar, nomeadamente, esgana, toxoplasmose, neosporose e erliquiose (Gnirs, 2006; Jung et al., 2007a; Menaut, Landart, Behr, Lanore, & Trumel, 2008a; Flegel et al., 2011a). Menos frequentemente, pesquisam-se microorganismos dos géneros Anaplasma, Rickettsia, Bartonella e Borrelia apesar da improbabilidade de estarem associados a meningoencefalomielites (Barber et al., 2010).
5.2.
Provas avançadas de imagem
Nos dias de hoje, a RM é o padrão de excelência das provas de imagem na identificação de lesões típicas de doenças inflamatórias do SNC (Plummer, Wheeler, Thrall, & Kornegay, 1992b; Wolff et al., 2012). Segundo Wolff et al., a RM, apresenta especificidade e sensibilidade suficientes para a deteção de lesões a nível encefálico e na distinção entre uma anomalia inflamatória e uma neoplásica (Wolff et al., 2012). Por outro lado, Plummer et al., concluiram que a TC é útil na identificação de processos inflamatórios primários do encéfalo
Cães com idade superior a 6 meses;
Evidência de doença multifocal do SNC;
À RM apresenta-se com lesões múltiplas, focais ou
difusas, intra-axiais, hiperintensas em T2;
LCR deve apresentar pleocitose mononuclear (>50%
linfócitos/monócitos)
Exclusão de causas de doenças infecciosas endémicas.
Tabela 1 – Orientações propostas por Granger et al. para a realização do
diagnóstico clínico/presuntivo de MOD, na ausência de histopatologia. Adaptado de (Granger et al., 2010).
24 mas não na distinção entre uma anomalia neoplásica e uma não neoplásica (Plummer et al., 1992b).
Quanto às imagens de TC, constatou-se que, nas EN, se costumam observar lesões multifocais de hipoatenuação, ventriculomegália assimétrica e ocorrência de efeito massa e captação de contraste variáveis. Já as MEG estão associadas a lesões de radiodensidade variável, focais ou multifocais, a possível edema e efeito massa e a captação de contraste variável (ausente, heterogéneo, mal definido ou até perilesional) (Plummer et al., 1992b; Ducoté et al., 1999; Schwarz & Saunders, 2011; Wisner & Zwingenberger, 2015).
Anteriormente neste trabalho foram referidas, individualmente, as características de RM das MOD. Pode-se, no entanto, generalizar para as MOD, como estando associadas a imagens cujas lesões são multifocais (tabela 2), hiperintensas em T2 e no FLAIR, de hipointensas a isointensas em T1 e com captação de contraste variável (Cherubini et al., 2006; Young et al., 2009; Wisner & Zwingenberger, 2015). Relativamente à captação de contraste, sabe-se que é variável e que depende de vários fatores pelo que se trata de um achado imagiológico sem especificidade em relação à distinção das várias doenças do SNC, como por exemplo, entre uma MEG e uma neoplasia (Mellema, Samii, Vernau, & Lecouteur, 2002).
Segundo um estudo de Keenihan et.al., a RM apresenta baixa sensibilidade na deteção de uma anomalia meníngea. No entanto, apesar de não ser visível a captação de contraste ao nível das menínges na RM, não se pode descartar a possibilidade de afetação das mesmas porque as lesões podem ser apenas detetáveis por análise histopatológica (Keenihan et al., 2013).
Figura 17 – Imagem de TC do encéfalo de um cão de
raça Yorkshire Terrier com LEN. Corte transversal. Conseguem-se observar várias lesões hipodensas (setas brancas) nos dois hemisférios cerebrais, compatíveis com áreas de necrose, onde se observa também captação moderada de contraste a nível perilesional. Adptado de (Schwarz & Saunders, 2011).
25 Segundo um estudo de Lamb et al., cerca de 75% das imagens de RM de cães com LCR inflamatório apresentam anomalias, sobrando 25% em que as imagens se apresentam normais, daí que não se possa descartar uma doença inflamatória do SNC só pelos achados imagiológicos (Lamb et al., 2005a).
5.3.
Líquido cefalorraquidiniano (LCR)
Para a recolha de LCR é necessário que o animal esteja sob anestesia geral e a colheita pode ser efetuada tanto na cisterna magna como na região lombar (no cão preferencialmente entre L5-L6). A eleição do local da colheita do LCR depende do local da lesão e deve ser realizada de acordo com a maior proximidade à mesma (Fitzmaurice & Nind, 2010; Lorenz, D., et al. 2011). Então, se a lesão for intracraniana/cervical a colheita deverá ser cisternal e se a lesão estiver localizada a nível toracolombar deverá ser realizada a nível lombar (Jaggy, A., 2010; Lorenz, D. et al., 2011). Como o fluxo do LCR é de cranial para caudal, uma colheita realizada num ponto caudal à lesão provavelmente dará mais informação diagnóstica já que é mais provável encontrar um LCR alterado nessa zona (Sharp, J. H. & Wheeler, J., 2004).
A análise do LCR envolve diversos parâmetros, nomeadamente, características macroscópicas, concentração de proteína, avaliação citológica, contagem total de eritrócitos e leucócitos e contagem diferencial de leucócitos. Os valores normais de referência encontram-se na tabela 3 (Wamsley, H., 2013).
Diagnósticos diferenciais de lesões multifocais intracranianas SNC:
Meningoencefalites infecciosas
Lesões vasculares
Linfossarcoma do SNC
Neoplasia glial ou metastásica
Tabela 2 – Diagnósticos diferenciais de lesões multifocais intracranianas (achado típico
26
Tabela 3 – Valores normais de referência da análise do LCR. Adaptado de (Wamsley, H., 2013).
Parâmetros Valores/Descrição Concentração de proteína: Cisterna magna Região lombar <0.25 mg/dl <0.40 mg/dl Leucócitos <5células/µl
Eritrócitos Ausência de eritrócitos
Características macroscópicas Sem cor, transparente
Lamb et al., consideraram num estudo, que o LCR para ser inflamatório teria que que ter uma concentração de proteína superior a 0.25 mg/dl e contagem de leucócitos superior a 5 células/µL (Lamb et al., 2005b).
Segundo a meta-análise por Granger et al., existem casos de MOD em que ocorre dissociação albumino-citológica, ou seja, em que a contagem celular se encontra normal mas que a concentração de proteína está elevada. Refere também que, quanto ao tipo celular predominante, 42% das MEG e 71% das MOD exibem uma pleocitose linfocítica, que nas EN os linfócitos e os monócitos se encontram em igualdade e ainda que os neutrófilos predominam em menos de 10% dos casos (Snyder et al., 2006; Granger et al., 2010).
Relativamente às MOD pode-se então dizer que frequentemente estão associadas a uma pleocitose mononuclear e a uma elevação da concentração de proteína (Stalis et al., 1995; Granger et al., 2010; Munana, K. R., 2013).
5.4.
Biomarcador GFAP sérica (glial fibrillary acidic protein)
Têm sido investigados vários biomarcadores na tentativa de auxiliar no diagnóstico clínico/antemortem das MOD. São exemplos a deteção de auto-anticorpos contra as GFAP e a determinação da concentração da GFAP no LCR, em relação às MEN (Uchida, Hasegawa, Ikeda, Yamaguchi, & Tateyama, 1999; Matsuki et al., 2004; Toda et al., 2007).
Segundo Miyake et al., estes marcadores têm falta de especificidade para as MEN uma vez que se podem detetar auto-anticorpos noutras doenças do SNC como neoplasias e que em relação à determinação da concentração da GFAP no LCR se constatou que os cães de raça Pug saudáveis também possuíam concentrações elevadas no seu LCR. Concluiram, por sua
27 vez, no seu estudo, que a deteção de elevadas concentrações da GFAP no soro sanguíneo é um biomarcador altamente específico para cães de raça Pug com MEN, com 67% de sensibilidade e 100% de especificidade e que pode ser usado em qualquer fase da doença para a realização do seu diagnóstico clínico (Miyake et al., 2013).
5.5.
Biópsia cerebral
Como já foi referido anteriormente, só se obtem um diagnóstico definitivo dos vários subtipos das MOD através de uma análise histopatológica, daí que se possa recorrer a uma biópsia de tecido encefálico na tentativa de conseguir um diagnóstico antemortem (Coates & Jeffery, 2014).
As biópsias encefálicas realizam-se por vários motivos, tais como: o facto de possibilitarem a escolha terapêutica mais adequada a usar, por oferecerem um prognóstico mais preciso e, por vezes, também por servirem como uma forma de tratamento no caso de uma biópsia excisional, por exemplo. Relativamente às MOD, a forma focal da MEG é a mais indicada para ser alvo de biópsia, ao contrário da forma multifocal em que se tornaria difícil escolher uma amostra representativa da lesão impossibilitando assim o seu diagnóstico. Existem duas abordagens principais, a craniectomia aberta e a biópsia por agulha. A primeira é uma abordagem mais invasiva e pode ser usada para a excisão da lesão ou parte dela, para a descompressão intracraniana (no caso de animais com agravamento do estado neurológico) e oferece acesso apenas às lesões mais superficiais. Por outro lado, a biópsia por agulha é uma abordagem minimamente invasiva que permite, no entanto, obter amostras de lesões mais profundas no encéfalo, como por exemplo, ao nível do tálamo e medula oblonga (Long, S. & Anderson, T. J., 2013; Sturges, B. K. & Dickinson, P. J., 2013).
Este tipo de biópsias pode ser realizado através de técnicas “mãos livres” guiadas por ultrassonografia, endoscopia, TC e RM ou através de técnicas estereotáticas guiadas por TC ou RM (Harari et al., 1993; Thomas et al., 1993; Koblik et al., 1999; Klopp & Ridgway, 2009; Flegel et al., 2012; Chen et al., 2012; Coates & Jeffery, 2014).
Segundo um estudo de Flegel et al., em que 17 cães com suspeita de encefalite foram submetidos a uma técnica de biópsia “mãos livres” guiada por RM, foi constatada uma eficácia de diagnóstico definitivo de 82%. Apesar de não ter havido nenhuma morte associada diretamente ao procedimento em si, a taxa de mortalidade foi de 6% e a de morbilidade de 29% (esta associada a estupor, convulsões, tetraparésia, hemiparésia, atáxia e défices proprioceptivos). Concluiram, por fim, que a biópsia minimamente invasiva de encéfalo de
28 cães com suspeita de encefalite conduz a um diagnóstico definitivo na maior parte dos cães, sendo que as suas vantagens se sobrepõem às suas taxas de mortalidade e morbilidade (Flegel et al., 2012).
6. Abordagem terapêutica
A imunossupressão é a pedra basilar do tratamento das MOD e reside primariamente no uso de corticosteróides e ainda de outros agentes imunomoduladores de 2ª linha (ciclosporina, arabinosídeo de citosina, azatioprina, micofenolato de mofetil, leflunomide, entre outros) (Coates & Jeffery, 2014). A lógica do uso de imunossupressores reside no facto de estes atuarem como anti-inflamatórios através de vários processos como, por exemplo, através da inibição da ciclooxigenase 2 e da fosfolipase A2 e também de atuarem como moduladores da ação linfocitária ao inibirem a sua função e promoverem a apoptose dos linfócitos (Ashwell, Lu, & Vacchio, 2000; Zen et al., 2011). A primeira abordagem a um animal que se apresente à consulta, com suspeita de MOD, deve passar pela sua estabilização e, dependendo do seu quadro clínico, pode ser necessário controlar as convulsões com fármacos anticonvulsivos (ex: benzodiazepinas, propofol, fenobarbital, brometo de potássio, zonisamida, levetiracetam, entre outros), suplementação com O2, fluidoterapia com cristalóides e/ou colóides, terapia osmótica, entre outros procedimentos (Coates & Jeffery, 2014; Risio, L. D., 2014).
O objectivo principal da terapia com corticosteróides é conseguir, com a dose mínima eficaz, a remissão total dos sinais clínicos, sem que haja efeitos adversos do seu uso. Estes costumam ser vários, tais como, Hiperadrenocorticismo iatrogénico (este inclui mais frequentemente sinais como poliúria, polidípsia, polifagia e ganho de peso, entre outros), ulceração gastrointestinal, resistência à insulina e Diabetes Mellitus secundária, catabolismo muscular, tempo de cicatrização aumentado, infeções oportunistas, etc. (Viviano, 2013; Hill, K., 2014). Os imunossupressores de 2ª linha, tal como os anteriores, também têm efeitos adversos que incluem, entre outros, mielossupressão, hepatotoxicidade e sinais gastrointestinais (vómitos, diarreias, etc.) (Houston & Taylor, 1991; Robson, 2003). No caso das MOD, os protocolos terapêuticos podem consistir numa monoterapia com corticosteróides como a prednisona e a prednisolona, ou então, na combinação de um corticosteróide e outro agente imunomodulador, tais como, arabinosídeo de citosina e prednisolona/prednisona, ciclosporina e prednisolona, lomustina e prednisolona, azatioprina e prednisona, procarbazina
29 e prednisona, micofenolato de mofetil como monoterapia ou adjunto à prednisolona e ainda monoterapia com leflunomide (Gregory et al., 1998; Zarfoss et al., 2006b; Jung et al., 2007b; Feliu-Pascual et al., 2007; Menaut et al. 2008b; Granger et al., 2010; Wong et al., 2010; Flegel et al., 2011b).
Está ainda descrita por Adamo et al., uma terapia múltipla que conjuga ciclosporina, um corticosteróide e ainda cetoconazol e por Smith et al., uma que conjuga ciclofosfamida, vincristina e prednisolona (protocolo COP) (Adamo et al., 2007b; Smith et al., 2009). Estas terapias são utilizadas para tratar as MOD no seu conjunto, ou seja, são iguais quer para as MEG quer para as EN sendo difícil a avaliação da eficácia diferenciada de cada uma (Talarico & Schatzberg, 2010). Na tabela 4 estão incluídos os diferentes protocolos terapêuticos das MOD.
Tabela 4 – Modalidades terapêuticas e respetivas doses utilizadas no tratamento das MOD. Tempo médio de
sobrevivência (dias) para os cães tratados com os respectivos protocolos. O tratamento com corticosteróides é variável quanto aos valores das doses e duração da terapia de protocolo para protocolo. Adaptado de (Adamo et al., 2007b; Coates et al., 2007; Coates & Jeffery, 2014; Feliu-Pascual et al., 2007; Flegel et al., 2011b; Granger et al., 2010; Gregory et al., 1998; Munana, K. R., 2013; Smith et al., 2009b; Wong et al., 2010; Zarfoss et al., 2006b;Beckmann et al., 2015). Fármacos Doses Tempo médio de sobrevivência (dias) Azatioprina + Prednisona (Wong et al., 2010)
2 mg/kg PO, cada 24h, por 2 semanas, depois diminuir para 2 mg/kg, cada 48h (continuar indefinidamente), o objetivo é alternar com a prednisona, um dia um, outro dia outro.
1834 (intervalo: 50 – 2469)
Ciclosporina +/- prednisona +/- cetoconazol
(Adamo et al., 2007b)
3-15 mg/kg PO, cada 12h, (ciclosporina ou ciclosporina+prednisona) ou 5-12 mg/kg PO, SID, quando combinado com 8 mg/kg PO, SID de cetoconazol. A dose de prednisona não está referida.
930 (intervalo: 60 – 1290) Arabinosídeo de citosina + Prednisona (Zarfoss et al., 2006b)
50 mg/m², SC, BID, por 2 dias, repetir o mesmo processo de três em três semanas durante 4 meses, depois a cada 4 meses o intervalo entre tratamentos aumenta uma semana; prednisona: 1-2 mg/kg, BID, por 3 semanas e discontinuada quando possível.
531 (intervalo: 46 – 1025)
Lomustina + Prednisolona Nota: casos de MEG apenas
( Flegel et al., 2011b)
60 mg/m² (44-88), PO, cada 6 semanas; prednisolona inicia-se a 2 mg/kg/dia, diminuida quando possível.
457 (intervalo: 107 – 709)