UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
ESTUDO E PREVISÃO DA PRESENÇA DE ANTICORPOS ANTI-BRUCELLA EM JAVALIS (Sus scrofa) NA REGIÃO DE TRÁS-OS-MONTES
Dissertação de Mestrado em Biologia Clínica Laboratorial
OCTÁVIA FERREIRA VELOSO
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
ESTUDO E PREVISÃO DA PRESENÇA DE ANTICORPOS ANTI-BRUCELLA EM JAVALIS (Sus scrofa) NA REGIÃO DE TRÁS-OS-MONTES
Dissertação de Mestrado em Biologia Clínica Laboratorial
OCTÁVIA FERREIRA VELOSO
Orientador: Profª. Doutora Maria das Neves Mitelo Morão de Paiva Cardoso
Universidade de Trás-os-Montes e Alto Douro, Escola de Ciências Agrárias e Veterinárias, Departamento de Ciências Veterinárias, Vila Real, Portugal
Co-Orientador: Prof. Doutor João Alexandre Cabral
Universidade de Trás-os-Montes e Alto Douro, Escola de Ciências da Vida e do Ambiente, Departamento de Biologia e Ambiente, Vila Real, Portugal
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
ESTUDO E PREVISÃO DA PRESENÇA DE ANTICORPOS ANTI-BRUCELLA EM JAVALIS (Sus scrofa) NA REGIÃO DE TRÁS-OS-MONTES
Dissertação de Mestrado em Biologia Clínica Laboratorial
OCTÁVIA FERREIRA VELOSO
Orientador: Profª. Doutora Maria das Neves Mitelo Morão de Paiva Cardoso
Universidade de Trás-os-Montes e Alto Douro, Escola de Ciências Agrárias e Veterinárias, Departamento de Ciências Veterinárias, Vila Real, Portugal
Co-Orientador: Prof. Doutor João Alexandre Cabral
Universidade de Trás-os-Montes e Alto Douro, Escola de Ciências da Vida e do Ambiente, Departamento de Biologia e Ambiente, Vila Real, Portugal
Composição do Júri:
_______________________________________________________ _______________________________________________________ _______________________________________________________
i
AGRADECIMENTOS
Não foi fácil chegar aqui, e sempre tive consciência que não o ia conseguir sem o apoio de muitos. Mas cheguei e é a todos que se seguem que com muito carinho e com um especial obrigada agradeço a disponibilidade e dedicação, assim sendo:
Ao magnífico reitor da Universidade de Trás-os-Montes e Alto Douro, Exmo. Senhor António Fontainhas Fernandes.
Á Direção do Mestrado de Biologia Clínica Laboratorial pelo apoio prestado durante estes dois anos.
Aos meus orientadores, Professora Maria das Neves pela supra paciência e supra dedicação. Ao Professor João Cabral, que sempre se demonstrou disponível e paciente.
Hélia do Vale-Gonçalves, Ana Sofia Faria e Catarina Coelho que sem o tamanho esforço e boa disposição não seria possível a recolha do material base dos nossos trabalhos.
Ritinha, ajuda preciosa e sempre com bons conselhos o meu muito obrigada. A toda a equipa do LEA.
Às Técnicas do Laboratório de Microbiologia Médica do Departamento de Ciências Veterinárias da UTAD.
Á Professora Madalena, Professor Mário Santos e Professor Aranha pela colaboração.
A todos os caçadores pela ajuda oferecida durante a recolha e a todos os organizadores das montarias pela disponibilidade e informação cedida.
Aos três pilares da minha vida, que sem eles não era aquilo que sou e o que muito alcancei, PAI, MÃE E MANO.
Novamente, a ti Hélia agradeço toda a paciência e carinho sem a tua ajuda não sei se teria concluído esta etapa. Aos teus pais que me acolheram como uma filha. E a ti Eduardo pelas palavras de encorajamento.
A toda á minha família e amigos pelas palavras de conforto e coragem, em especial para a minha titia Graça. Fica aqui um pedido de desculpas por dois anos de ausência.
ii
Às duas pessoas que me facultaram a possibilidade de concluir o meu mestrado, um muito obrigada, Eng.º Alfredo Mendonça e Eng.º Domingos Pinto.
Por fim, mas o primeiro, á Pessoa que me ensinou que “As velas ardem até ao fim”. MC muito obrigada.
iii
RESUMO
A brucelose é uma doença infeciosa que afeta principalmente animais domésticos e selvagens, sendo considerada a zoonose humana mais comum. Das dez espécies conhecidas da bactéria, Brucella melitensis, Brucella abortus, Brucella suis e Brucella canis, são as quatro espécies que apresentam maior patogenicidade para o homem.
Diferentes espécies selvagens atuam como hospedeiros e reservatórios da Brucella spp. constituindo uma potencial fonte de infeção para animais e humanos. As infeções são adquiridas pelos animais ou pelo homem principalmente pelo contacto direto com urina, secreções, fetos abortados e outros anexos placentários, ou consumo de produtos lácteos não-pasteurizados e de carne mal confecionada de animais infetados.
Espécie cinegética de caça maior, o javali tem um relevante valor económico em Portugal pela prática da caça. Considerado um importante reservatório de brucelas, o javali tem sido identificado como fonte de infeção para o homem e suínos domésticos. A intensa atividade cinegética na região de Trás-os-Montes e o prévio isolamento de B. suis biovar 2 em alguns exemplares de javali na região, tornam imperativo compreender a importância da brucelose neste reservatório animal. O conhecimento do papel do javali no ciclo epidemiológico da brucelose na região, permitirá obter bases mais sólidas com vista à elaboração de programas de controlo desta zoonose, minimizando as implicações na Saúde Pública, pecuária e espécies selvagens.
De outubro a fevereiro, nas épocas venatórias de 2011/2012 e 2012/2013, foram recolhidas amostras de 115 de javalis (Sus scrofa) em 27 montarias realizadas na região de Trás-os-Montes.
Foram testadas amostras séricas correspondentes a 101 javalis. Para a deteção de anticorpos anti-Brucella utilizaram-se dois testes imunológicos, o teste Rosa de Bengala (RBT) (geralmente usado como prova de rastreio no serodiagnóstico da brucelose) e a técnica c-ELISA (teste reconhecidamente com elevada especificidade). Observou-se uma taxa de seropositividade de 42% com o primeiro teste (RBT) e de 19% com o método c-ELISA.
Complementarmente, os resultados obtidos na serologia e o levantamento das características dos cobertos/usos do solo da área de estudo permitiram o desenvolvimento de
iv
uma abordagem em modelação dinâmico-espacial, com base na Metodologia Estocástico-Dinâmica (StDM), com o objetivo de tentar explicar a abundância relativa do javali e a ocorrência de casos positivos de brucelose em função dos principais usos/cobertos do solo e outras métricas de paisagem e climáticas da região de Trás-os-Montes.
A patogenia e sequelas da brucelose nos suínos domésticos são bem conhecidas no ciclo reprodutivo dos animais, cujas perdas produtivas por aborto e infertilidade acarretam gravíssimos prejuízos económicos. No javali, dado ser uma espécie selvagem de grande porte, nunca se conseguiu estudar o real efeito patogénico da doença e suas implicações na fertilidade e prolificidade. Assim, o efeito da brucelose na dinâmica de populações desta espécie selvagem é totalmente desconhecido. No entanto, o seu papel como reservatório selvagem de Brucella levanta sérias preocupações em termos de controlo desta zoonose nos animais domésticos, principalmente nos criados em regime extensivo, bem como relativamente às implicações de Saúde Pública, nomeadamente nos agentes ligados à prática da caça.
Palavras-chave: Zoonose, Brucelose, Javali, Rosa de Bengala, c-ELISA, Modelação Ecológica.
v
ABSTRACT
Brucellosis is an infectious disease which primarily affects domestic and wild animals, being considered the most common zoonosis in humans. Of the ten known bacteria species,
Brucella melitensis, Brucella abortus, Brucella suis and Brucella canis, are the four main
species with higher pathogenicity for man.
Different wildlife species act as hosts and reservoirs of Brucella spp., providing a potential source of infection for humans and animals. Infections are acquired by direct contact with urine, secretions, aborted fetuses and other placental attachments, or consumption of unpasteurized dairy products and undercooked meat of infected animals. The intense hunting activities in Trás-os-Montes region and the previous isolation of B. suis biovar 2 in some wild boars in the region make it imperative to understand the importance of brucellosis in this animal reservoir.
The wild boar represents an important hunting species with high economic value in Portugal due to hunting activities. Considered an important reservoir of Brucella spp., the wild boar has been identified as a source of infection for humans and domestic swines. Knowledge of its role on the epidemiological cycle of brucellosis in the region will provide a more solid base for the elaboration of control programs for this zoonosis, minimizing the implications on public health, livestock and wildlife.
In the hunting seasons of 2011/2012 and 2012/2013, from October to February, 115 samples from wild boar (Sus scrofa) were collected in 27 hunting bags in the Trás-os-Montes region.
For the detection of anti-Brucella antibodies, 101 sera were tested by Rose Bengal test (RBT) and c-ELISA technique. A seropositivity rate of 42% was observed with the RBT test and 19% with the c-ELISA.
The results obtained with the land covers in the study area allowed the development of an approach based on the Stochastic-Dynamic Methodology (StDM), with the aim of explaining the relative abundance of the wild boar and the occurrence of brucellosis in relation to the main land covers and other landscape metrics and climatic in the Trás-os-Montes region.
vi
The pathogenesis of brucellosis in domestic pigs is well known for its effects on the reproductive cycle of animals, whose productive losses through abortion and infertility cause very serious economic harm. In the case of wild boar, because it is a large wild animal, researchers were never able to study the actual pathogenic effect of the disease and its implications on fertility and prolificity. So the effect of brucellosis in wildlife population dynamics of this species is completely unknown. Nevertheless, their role as wild reservoir of
Brucella raises serious concerns in terms of controlling this zoonotic disease in domestic
animals, bred in extensive farming conditions, as well as on the implications in Public Health, including agents linked to hunting practices.
Keywords: Zoonosis, brucellosis, Wild boar, Rose Bengal, c-ELISA, Ecological Modelling.
vii
ÍNDICE GERAL
AGRADECIMENTOS ... I RESUMO ... III ABSTRACT... V ÍNDICE GERAL ... VII ÍNDICE DE FIGURAS ... IX ÍNDICE DE TABELAS ... XI ABREVIATURAS E SÍMBOLOS ... XII
1. INTRODUÇÃO ... 1
1.1. CONSIDERAÇÕES GERAIS ... 1
1.2. OBJETIVOS ... 3
2. REVISÃO DA LITERATURA ... 4
2.1. ESPÉCIE EM ESTUDO:OJAVALI ... 4
2.2. ZOONOSE EM ESTUDO:ABRUCELOSE ... 9
3 - METODOLOGIA... 20
3.1-ÁREA DE ESTUDO ... 20
3.2-RECOLHA DE DADOS ... 21
3.3-RECOLHA DE SANGUE ... 22
3.4–DIAGNÓSTICO IMUNOLÓGICO DA BRUCELOSE NOS JAVALIS AMOSTRADOS ... 22
3.5- MODELAÇÃO DINÂMICO-ESPACIAL ... 27
3.6-ANÁLISE ESTATÍSTICA DOS DADOS ... 29
3.7-CONCEPTUALIZAÇÃO DO MODELO ESTOCÁSTICO - DINÂMICO ... 32
3.8-PROJEÇÕES DINÂMICO-ESPACIAIS ... 32
4. APRESENTAÇÃO DOS RESULTADOS ... 35
4.1CARACTERIZAÇÃO DA POPULAÇÃO EM ESTUDO ... 35
4.2. RESULTADOS ROSA DE BENGALA ... 36
4.3. RESULTADOS C-ELISA ... 37
4.4. RESULTADOS DA MODELAÇÃO DINÂMICO-ESPACIAL ... 38
4.5. CONCEPTUALIZAÇÃO DO MODELO ESTOCÁSTICO DINÂMICO ... 41
4.6. PROJECÇÕES DINÂMICO-ESPACIAIS ... 45
5. DISCUSSÃO DOS RESULTADOS ... 48
viii
7. BIBLIOGRAFIA ... 56
8. ANEXOS ... 66
ANEXO I– FICHA DE CAMPO ... 66
ANEXO II- BULA KIT C-ELISA... 69
ix
ÍNDICE DE FIGURAS
FIGURA 1 - DISTRIBUIÇÃO MUNDIAL DA ESPÉCIE SUS SCROFA – A FAIXA PRETA REPRESENTA A DISTRIBUIÇÃO NATIVA DA ESPÉCIE E A CINZA A ÁREA ONDE FOI INTRODUZIDA. OS CÍRCULOS DE COR CINZA INDICAM AS ILHAS ONDE S. SCROFA FOI INTRODUZIDO E (?) DESIGNA A ÁREA ONDE A PRESENÇA DA ESPÉCIE É DESCONHECIDA. ADAPTADO DE: BARRIOS-GARCIA & BALLARI 2012. ... 5 FIGURA 2 - BRUCELLA SUIS. ADAPTADO
DE:HTTP://WWW.LOOKFORDIAGNOSIS.COM/MESH_INFO.PHP?TERM=BRUCELLA+SUIS&LA NG=5 ... 9 FIGURA 3 – ÁREA DE ESTUDO – NORTE DE PORTUGAL, REGIÃO DE TRÁS-OS-MONTES. ... 20 FIGURA 4 – RECOLHA DE SANGUE A PARTIR DO CORAÇÃO. FONTE: CÂMARA MUNICIPAL DE MONDIM DE BASTO ... 22 FIGURA 5 – REALIZAÇÃO DA PROVA C-ELISA ... 24 FIGURA 6 – LEITURA DAS PLACAS NO FOTÓMETRO DE MICROPLACA. ... 25 FIGURA 7 – EXEMPLO DE BUFFER, CÁLCULO DO CENTRÓIDE A PARTIR DA RESPETIVA MANCHA DA MONTARIA E CLASSIFICAÇÃO DO HABITAT PELO CLC2006 ... 29 FIGURA 8 – ESQUEMA RESUMO DA METODOLOGIA DO MODELO STDM – A)
CARACTERIZAÇÃO DA ÁREA DE ESTUDO; B) ANÁLISE ESTATÍSTICA; C) E D) SIMULAÇÕES DINÂMICAS STDM PARA WBINDEX E OPB A NÍVEL LOCAL; E) E F) PROJEÇÕES DINÂMICO-ESPACIAIS PARA WBINDEX E OPB A NÍVEL REGIONAL. SISTEMA DE COORDENADAS
DATUM LISBOA, HAYFORD-GAUSS IGOE. ... 34 FIGURA 9 – AMOSTRA POSITIVA NA PROVA RBT ... 36 FIGURA 10 - LOCALIZAÇÃO E CARACTERIZAÇÃO DOS BUFFERS DAS MONTARIA
AMOSTRADA (A) E ADICIONAIS (B) CONSIDERADAS PARA A MATRIZ BASE DO MODELO STDM. ... 39 FIGURA 11 – CONVERSOR STDM PARA A PREVISÃO DO WBINDEX E DA OPB ... 41 FIGURA 12 – DIAGRAMA CONCEPTUAL DO MODELO DINÂMICO USADO PARA A
ESTIMATIVA STDM DO WBINDEX E PARA A OPB PARA A REGIÃO DE TRÁS-OS-MONTES: DINÂMICA DOS COBERTOS DOS USOS DO SOLO. AS EQUAÇÕES E PARÂMETROS USADOS NA CONSTRUÇÃO DESTE MODELO DESCRIÇÃO ESTÃO DISPONÍVEIS NO ANEXO II. ... 44 FIGURA 13 – (A) ÍNDICE DE ABUNDÂNCIA RELATIVA DO JAVALI (WBINDEX) E (B)
x
FIGURA 14 – ÍNDICE DE ABUNDÂNCIA RELATIVA DE JAVALI (WBINDEX) E VARIÁVEIS ESTRUTURAIS DO HABITAT (A) ESTRADAS DE ELEVADO TRÁFEGO, MASSAS E CURSOS DE ÁGUA; (B) ÁREA URBANA E FLORESTA DE CONÍFERAS. ... 46 FIGURA 15 – OCORRÊNCIA DE CASOS POSITIVOS PARA A BRUCELOSE (%) E VARIÁVEIS ESTRUTURANTES DO HABITAT, (A) POVOAMENTOS FLORESTAIS DE FOLHOSAS,
RESINOSAS E MISTAS; (B) ÁREA URBANA E ESTRADAS DE ELEVADO TRÁFEGO; (C) ÁREA AGRÍCOLA. ... 47
xi
ÍNDICE DE TABELAS
TABELA 1 – HOSPEDEIROS PREFERENCIAIS E PATOGENICIDADE NOS HUMANOS DAS ESPÉCIES DE BRUCELLA. ADAPTADO DE: GODFROID ET AL. (2010). ... 10 TABELA 2 - ESTUDOS SEROLÓGICOS DA BRUCELOSE NO JAVALI (SUS SCROFA) EM VÁRIOS PAÍSES. ... 19 TABELA 3 – CLASSIFICAÇÃO DA IDADE DA ESPÉCIE SUS SCROFA. ... 21 TABELA 4 – DESCRIÇÃO DOS CÓDIGOS E CATEGORIAS GERAIS DAS CLASSES DE HABITATS DE ACORDO COM O CORINE LAND COVER (CLC 2006). ... 28 TABELA 5 - CARACTERIZAÇÃO DAS VARIÁVEIS DEPENDENTES E INDEPENDENTES,
RESPETIVAS UNIDADES E CÓDIGOS UTILIZADOS NO MODELO EM ESTUDO. ... 31 TABELA 6 - CARACTERIZAÇÃO DA POPULAÇÃO POR DISTRITO, SEXO E IDADE. ... 35 TABELA 7 – RESULTADOS DA SEROPOSITIVIDADE OBTIDOS PELOS TESTES ROSA DE
BENGALA E C-ELISA. ... 35 TABELA 8 – RESULTADOS DA ANÁLISE ESTATÍSTICA DA SEROPOSITIVIDADE DO TESTE RBT NOS DIFERENTES FATORES DE RISCO. ... 36 TABELA 9 - RESULTADOS DA ANÁLISE ESTATÍSTICA DA SEROPOSITIVIDADE DO TESTE C-ELISA NOS DIFERENTES FATORES DE RISCO. ... 37 TABELA 10 – EQUAÇÕES DE REGRESSÃO DAS VARIÁVEIS DEPENDENTES WBINDEX E OPB, GRAUS DE LIBERDADE (GL), AKAIKE INFORMATION CRITERION (AIC), COEFICIENTE DE DETERMINAÇÃO (R2 AJUSTADO), VALOR DE F E NÍVEL DE SIGNIFICÂNCIA F(P) ... 40 TABELA 11- DESCRIÇÃO DAS VARIÁVEIS INDEPENDENTES CONSIDERADAS NO ESTUDO. (*) PARA O CÁLCULO DA OPB O WBINDEX FOI TAMBÉM CONSIDERADO NO LOTE DAS
xii
ABREVIATURAS E SÍMBOLOS
AIC - Critério de Informação de Akaike
c-ELISA – Enzyme linked immunosorbent assay competitive
CLC2006 – Corine de Land Cover 2006
IC – Intervalo de confiança
ICNF - Instituto da Conservação da Natureza e das Florestas
IGEOE - Instituto Geográfico do Exército
Ig – Imunoglobulina
IgG – Imunoglobulina tipo G
IgM – Imunoglobulina tipo M
WBindex – Índice de abundancia relativa de javalis
LPS – Lipopolissacáridos
OR – Razão de probabilidades (“odds ratio”)
OPB – Ocorrência de casos positivos para a brucelose
P – Probabilidade de significância
PBS – Tampão fosfato salino (“Phophate Buffer Solution”) PEA - Agência Portuguesa do Ambiente
RBT – Teste rosa bengala (Rose Bengal test)
X 2 – Qui-quadrado
SIG - Sistemas de Informação Geográfica
StDM – Modelo Estocástico – Dinâmico
UTM - Universal Transversa de Mercator
1
1. INTRODUÇÃO
1.1. CONSIDERAÇÕES GERAIS
A brucelose é uma infeção zoonótica com grande distribuição mundial e que conduz a graves problemas de saúde para o homem e animais (Godfroid et al. 2010). No homem são necessários longos períodos de antibioterapia, não sendo raros os casos que evoluem para a cronicidade com o desenvolvimento de diversos graus de incapacidade motora (Musa et al. 2012). São reconhecidas dez espécies do género Brucella, das quais oito afetam hospedeiros preferenciais: Brucella melitensis (ovinos e caprinos), Brucella suis (suínos), Brucella abortus (bovinos), Brucella ceti (golfinhos), Brucella pinnipedialis (focas), Brucella neotone (rato do deserto), Brucella canis (cães) e Brucella ovis (ovinos) (Meng et al. 2009). Brucella abortus,
B. melitensis e B. suis possuem a capacidade de infetar vários hospedeiros secundários como
animais domésticos, fauna selvagem e seres humanos (Musa et al. 2012). Da infeção resultam como principais consequências a infertilidade e o aborto nos animais, enquanto nos humanos ocorrem febres intermitentes (Woldemeskel, 2013). Considerado um importante reservatório da doença, o javali tem sido identificado em várias partes da Europa, América do Norte, América do Sul, Ásia, África e Austrália como portador de Brucella suis (Galindo et al. 2010; Godfroid et al. 2010; De Massis et al. 2012; Ferreira et al. 2012; Praude et al. 2012; Ridoutt
et al. 2013).
A perda direta de habitat das espécies selvagens devido à rápida expansão das áreas urbanas, tem conduzido à criação de zonas de contato entre animais selvagens e animais domésticos que habitam as áreas urbanas, bem como com os humanos residentes, facto que tem despertado especial atenção para a ecologia da vida selvagem (Chahill et al. 2012). Na sua maioria, as espécies selvagens são afetadas pela urbanização das áreas em que habitam, por outro lado, existem espécies generalistas que se adaptam com sucesso a habitats de interface urbano-florestal (Chahill et al. 2012). A coabitação no mesmo ecossistema de espécies selvagens com o homem é gerador de conflitos, tais como acidentes de trânsito, ataques a humanos ou seus animais domésticos, bem como implicações na sanidade animal e saúde pública devido à transmissão de doenças infeciosas (Hebeisen 2007; Chahill et al. 2012).
As populações de javalis (Sus scrofa) encontram-se em expansão por todo o mundo, resultado da sua elevada capacidade de adaptação a diferentes habitats e, recentemente, a
2
áreas urbanas (Rosvolde & Andersen 2008; Chahill et al. 2012; Sarasa & Sarasa 2013). A sua dinâmica populacional é definida pela disponibilidade de recursos alimentares, perda de predadores naturais, intensificação das práticas agrícolas, pressão cinegética e até mesmo pelas alterações climáticas, fatores que contribuem para o seu crescimento populacional e da área geográfica ocupada (Chahill et al. 2012; Colin-Rabanal et al. 2012).
Em diversas doenças infeciosas é reconhecido o papel de múltiplas espécies da fauna selvagem como reservatórios e componentes vitais no ciclo epidemiológico de doenças em humanos e animais domésticos (Pappas 2010; Peñuela et al. 2011). O javali é conhecido como uma das espécies que facilmente abandona o seu habitat natural e entra em contato com animais domésticos, transformando-se numa potencial fonte de doenças infeciosas para aqueles que partilham as mesmas áreas (Ebani et al. 2003; Wu et al. 2012). Da relação Javali/Pecuária/Homem resultam ambientes favoráveis à circulação de vários agentes patogénicos comuns aos três (García-Presedo et al. 2013).
O javali como espécie cinegética de caça maior, apresenta um importante valor económico em Portugal, quer pela prática da caça como pela carne do animal (Calado 2009). Por outro lado, em vários países Europeus causam graves problemas económicos, resultado da destruição de culturas agrícolas e no aumento do risco de transmissão de doenças infeciosas ao homem e animais domésticos (Hebeisen 2007; Barrios-Garcia & Ballari 2012; Prévot & Licoppe 2013; Keuling et al. 2013). Em várias doenças virais tem-se vindo a estabelecer uma associação epidemiológica entre a sua ocorrência no javali e nos animais domésticos, sendo que a livre circulação da espécie pode resultar na disseminação dos agentes etiológicos de diversas patologias (Acevedo et al. 2007; Albayrak et al. 2013). São várias as doenças infeciosas, incluindo zoonoses (virais, bacterianas e parasitárias), que o javali pode transmitir através do contato direto com o homem ou pelo consumo humano da carne contaminada. As principais doenças transmitidas pelo javali com impacte na saúde pública são a brucelose, leptospirose (Ebani et al. 2003), triquinose (Boadella et al. 2012), colibacilose, tuberculose e a toxoplasmose (Barrios-Garcia & Ballari 2012).
Na região de Trás-os-Montes, ainda não existe informação acerca da prevalência e distribuição da brucelose no javali, pelo que é crucial a obtenção de informação epidemiológica sobre a doença nesta espécie e possíveis implicações na transmissão aos agentes da caça.
3
É também fundamental a avaliação e monitorização de indicadores ecológicos relevantes para esta problemática, como, entre outros, o enquadramento dos usos do solo, o tipo de coberto vegetal, efeito de barreira e/ou corredor e a fragmentação dos habitats (Gaston & Blackburn, 2000) que condicionem a distribuição do javali e da infeção. Toda a informação pertinente pode gerar bases de dados que possibilitem a construção de modelos dinâmico-espaciais (Bastos, 2012) que revertam em ferramentas de apoio à decisão capazes de suportar, com base nas relações de causa-efeito analisadas, a previsão das tendências de expansão ou retração da infeção.
1.2. OBJETIVOS
Os principais objetivos do presente trabalho centraram-se no estudo serológico de amostras sanguíneas de javalis abatidos na região de Trás-os-Montes através do processo de caça designado de montaria, o estudo das variáveis que poderão constituir fatores de risco para o desenvolvimento da doença nesta espécie animal e a construção de modelos matemáticos que ajudem a prever alterações na magnitude da dispersão da doença com base em alterações do meio ambiente ao longo do tempo.
Para a concretização dos objetivos propostos será utilizada a seguinte metodologia: a) Deteção de anticorpos anti-Brucella através do teste Rosa de Bengala
b) Confirmação da presença de imunoglobulinas específicas anti-Brucella pelo teste c- ELISA (Enzyme linked immunosorbent assay competitive)
c) Determinação das variáveis que poderão constituir fatores de risco para a presença de aglutininas anti-Brucella em javalis abatidos em Trás-os-Montes
d) Construção do modelo estocástico-dinâmico através do programa STELLA 9.0.3 para permitir estabelecer previsões da ocorrência de infeções por Brucella nas populações de javalis da região, em anos futuros.
Compreender a importância da brucelose neste reservatório animal é de fundamental importância para a elaboração de ferramentas de controlo e erradicação desta zoonose na região de Trás-os-Montes, minimizando as implicações na Saúde Pública, sanidade dos animais domésticos e na fauna selvagem.
4
2. REVISÃO DA LITERATURA
2.1. ESPÉCIE EM ESTUDO: O JAVALI
2.2.1 Distribuição Geográfica
O javali (Sus scrofa Linnaeus, 1758) é um mamífero de estatura média com dimorfismo sexual acentuado (Fernández-Llário 2008), pertence à família Suidae e Ordem Artiodactyla (Calado 2009). Nativo da Eurásia (Barrios-Garcia & Ballari 2012), a sua ampla distribuição geográfica abrange vários continentes, tais com a Europa, Norte de Africa e Ásia (Santos et
al. 2006; Calado 2009), sendo a Antártica e algumas ilhas Oceânicas a exceção
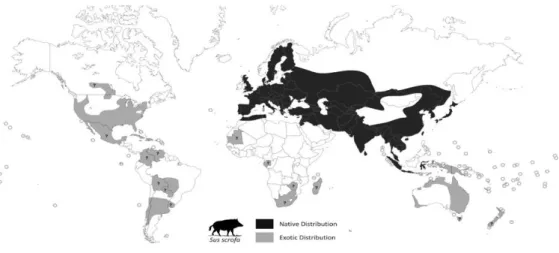
(Barrios-Garcia & Ballari 2012). A sua introdução ocorreu praticamente em todo o mundo, no continente americano, Austrália, Suécia e Grã-Bretanha (Witold et al. 2012), tendo-se verificado um significativo aumento populacional na Europa desde a década de 70 (Thurfjell 2011). Identificado como o principal ungulado selvagem da Península Ibérica, de rápida expansão e crescimento populacional (Acevedo et al. 2007), esta espécie possui a capacidade de adaptação a diferentes tipos de habitats, dos quais ecossistemas de montanha, floresta, semi-desertos e húmidos (Figura 1) (Fernandez-Llario & Mateos-Quesada 2005, Rosvolde & Andersen 2008, Barrios-Garcia & Ballari 2012, Belda et al. 2012). Em Portugal, a sua presença ocorre em todo o país, sendo classificado no Livro Vermelho de Vertebrados de Portugal como espécie “Pouco Preocupante” (LP) (Cabral et al., 2005). Como no resto da Europa, também em Portugal se tem vindo a notar o aumento do número de animais e de área de ocupação pela espécie (Fonseca et al. 2011).
5
Figura 1 - Distribuição Mundial da Espécie Sus Scrofa – A faixa preta representa a distribuição nativa da espécie e a cinza a área onde foi introduzida. Os círculos de cor cinza indicam as ilhas onde S. scrofa foi introduzido e (?) designa a área onde a presença da espécie é desconhecida. Adaptado de: Barrios-Garcia & Ballari 2012.
2.1.2 Dieta
De hábitos alimentares abrangentes, o javali é uma espécie omnívora, que obtém os alimentos de acordo com a sua disponibilidade espacial e temporal (Herrero et al. 2006, Rosvolde & Andersen 2008). Na sua dieta encontram-se incluídos bolbos, tubérculos, castanha, bolotas, milho, batata e outros produtos agrícolas (Calado 2009), mas podem consumir alimentos de origem animal como suplemento proteico (Rosvolde & Andersen 2008). Estudos comprovam que a matéria vegetal é predominante na dieta do javali (Herrero
et al. 2006). O seu tipo de alimentação implica na maioria das vezes revirar extensas áreas de
vegetação do solo para obter invertebrados e fungos (Barrios-Garcia & Ballari 2012). A conjugação de habitat florestal com áreas agrícolas, direciona a dieta do javali para as colheitas da época (Thurfjell 2011). Na ausência de habitats agrícolas ou durante o inverno (menor produção de culturas), a sua dieta é constituída por lagartos, insetos, roedores, musaranhos, aves e ungulados recém-nascidos (Fonseca 2008).
6
2.1.3. Reprodução
Segundo Keuling (2009), de todos os ungulados, o javali é a espécie com maior sucesso reprodutivo devido à sua maturação sexual precoce e ao elevado número de crias por ninhada. Em condições favoráveis podem ocorrer três períodos de reprodução em dois anos (Calado 2009). A maturidade sexual das fêmeas ocorre geralmente quando estas atingem o peso mínimo de 30kg, podendo este ser atingido, em épocas favoráveis, quatro meses antes do período habitual. Os machos são sexualmente ativos aos dez meses idade (Thurfjell 2011). A disponibilidade de alimento é um dos fatores de grande importância na reprodução da espécie, a cronologia e a frequência dos nascimentos são os mais influenciados. A capacidade de não entrarem no cio em épocas de escassez alimentar ou quando o peso necessário para ficar gestante não é atingido são algumas das razões do seu sucesso reprodutivo, podendo mesmo ocorrer sincronização reprodutiva entre fêmeas (Santos et al. 2006). O seu período de cio é longo e irregular, e o seu período de gestação é curto (120 dias) comparativamente com outras espécies (Calado 2009). O cio em geral ocorre no final de outubro e início de novembro, podendo ocorrer novamente nos meses de verão se as condições ambientais forem favoráveis (Fernández-Llario 2008). A maioria dos nascimentos ocorre entre fevereiro e abril (Fernández-Llario 2008) com a possibilidade de ocorrerem novamente em setembro (Thurfjell 2011). O número de crias depende de vários fatores, tais como o tamanho da fêmea e as condições ambientais na região. Nas zonas Mediterrânicas, o número varia entre as 3 e 5 crias por fêmea. Apesar da sobrevivência destas fêmeas poder chegar até aos onze anos de idade, a maioria não sobrevive para além dos três anos de idade (Fernández-Llario 2008).
Os fatores considerados de maior importância na biologia de reprodução do javali são: o fotoperíodo, disponibilidade alimentar, comportamento da fêmea e a densidade populacional (Fonseca et al. 2004, Santos et al. 2006).
2.1.4. Organização Social
De organização social matriarcal, a relação entre mães e filhas após-desmame pode durar vários anos, enquanto a dispersão natal ocorre principalmente nos machos quando atingem um ano de idade (Rosvolde & Andersen 2008, Keuling 2009, Casas-Díaz et al. 2013). A organização dos grupos pode variar em tamanho e composição. Na época de cio, os machos adultos e sub-adultos regressam para junto do grupo das fêmeas para que ocorra a
7
reprodução, nesta fase os machos adultos expulsam os machos jovens do grupo (Fernández-Llario 2008).
2.1.5. Comportamento
O comportamento espacial do javali tem como referência as estações do ano, o clima e a atividade do homem. As suas deslocações são mais frequentes na primavera e verão, preferindo fazê-lo mais durante a noite do que de dia (Thurfjell 2011). Quando se encontra perante situações de stresse, como acontece durante a época venatória, a sua área vital tende a aumentar com a procura de habitats de floresta seguros e os seus movimentos diurnos tendem a diminuir (Fonseca et al. 2004, Franzetti et al. 2011, Thurfjell 2011, Ohashi et al. 2012). Conhecida como a espécie que muda o seu padrão de atividade de acordo com atividade exercida pelo homem, em ambientes imperturbados são maioritariamente diurnos (Ohashi et
al. 2012). Existem diferenças entre machos e fêmeas no que diz respeito às áreas vitais, o
“home range” dos machos adultos situa-se entre os 1.000 e 2.500 ha, enquanto o das fêmeas adultas varia entre os 200 e 1.500 ha (Calado 2009). A amplitude de variação destas áreas demonstra a capacidade do javali em reagir de forma adaptativa e individual a inúmeros fatores, tais como a disponibilidade de recursos (alimento, abrigo e água), parâmetros estruturais da população (densidade e idade) e distúrbios antrópicos como a silvicultura, caça ou lazer (Keuling et al. 2008).
2.1.6. Principais Parasitas e Doenças
Ancestral do porco doméstico, o javali partilha com ele a maioria dos agentes patogénicos virais e bacterianos (Boadella et al. 2011), bem como parasitas internos, tais como protozoários, nemátodes, tremátodes e cestodes (Calado 2009). Infeções provocadas pela bactéria Mycobacterium bovis que dão origem à tuberculose são bastante frequentes na espécie. Existem outras bactérias capazes de provocar doenças no javali, como a leptospirose, brucelose e salmonelose (Ridoutt et al. 2013, Salajpal et al. 2013). Como parasitas gastrintestinais mais comuns temos os do género Ascaris e Tricuris (Fernández-Llario 2008). O protozoário Cryptosporidium, parasita com potencial zoonótico, foi identificado em javalis num estudo realizado em Espanha (García-Presedo et al. 2013). Vários estudos relacionam a
8
ocorrência de Triquinella sp. (fase larvar do parasita encontra-se nos músculos) no javali com o potencial zoonótico que representa a ingestão, pelo homem, da sua carne não adequadamente confecionada (Calado 2009, Boadella et al., 2012, Pappas 2013,). O protozoário Toxoplasma gondii é responsável pela toxoplasmose, doença especialmente grave nas mulheres grávidas e indivíduos imunodeprimidos (Salajpal et al. 2013). Estudos realizados em Espanha, identificaram no javali um elevado número de parasitas, entre os quais: Taenia hydatigena, Cysticercus, Ascarops strongylina, Physocephalus sexalatus,
Ascaris suum, Metastrongylus sp. (Garcia-Gonzáles et al. 2012), Capillaria sp. e Macracanthorhynchus hirudinaceus, Capillaria garfiai, Trichinella spiralis e T. britovi
(Fernández-Llario 2008). As doenças virais mais comuns no javali são a doença de Aujesky, Parvovirose suína (Albayrak et al. 2013) e Circovirose suína (Boadella et al. 2012).
9
Figura 2 - Brucella suis. Adaptado de:http://www.lookfordiagn osis.com/mesh_info.php?ter m=Brucella+Suis&lang=5 2.2. ZOONOSE EM ESTUDO: A BRUCELOSE
Endémica em regiões como África, América Latina, Médio Oriente, Ásia e bacia do Mediterrâneo, a brucelose é uma zoonose que afeta anualmente 500.000 pessoas em todo o mundo (Avila-Calderón et al. 2013). Desde a sua descoberta em 1887 por Bruce (Smirnova et
al. 2013), a brucelose tem estado em permanente evolução. As alterações epidemiológicas que
tem vindo a ser observadas encontram-se relacionadas em grande medida com a grande interdependência do homem face aos animais, que são fonte de alimentação e de companhia, bem com geradores de desenvolvimento socioeconómico das regiões.
2.2.1. Etiologia e Hospedeiros
As espécies pertencentes ao género Brucella são classificadas filogeneticamente como pertencentes à família Brucellaceae, ordem Rhizobiales e classe Alphaproteobacteria (Godfroid et al. 2011, Labbé & Garcia
2013). Os agentes etiológicos da brucelose são pequenos cocobacilos gram-negativos, não capsulados, imóveis e não-esporoláveis (Figura 2) (Seleem et al. 2010, Kock et al. 2012). Estritamente aeróbios (Al-Anazi & Al-Jasser 2013) preferem o habitat intracelular (Woldemeskel 2013). O tamanho das bactérias varia entre 0,6-1,5μm de comprimento e os 0,5-0,7μm de largura (Godfroid et al. 2010).
Com base no hospedeiro preferencial, patogenicidade e características fenotípicas foram inicialmente reconhecidas
seis espécies do género Brucella: Brucella abortus, B. melitensis, B. suis, B. ovis, B. canis e
B. neotone. Desde 2007, foram incluídas mais quatro espécies no género. Duas isoladas a
partir de mamíferos marinhos foram denominadas de B. ceti e B. pinnipedialis. Em 2008, B.
microti foi isolada de uma ratazana e mais tarde a partir de raposas e do solo (Labbé & Garcia
2013). A espécie B. inopinata foi isolada recentemente de um implante de mama (Pappas 2010, Godfroid et al. 2011). Das espécies B. abortus, B. melitensis e B. suis são conhecidos vários biovares, sete, três e cinco, respetivamente (Godfroid et al. 2010, Pappas 2010, Seleem
10
B. abortus, B. melitensis, B. suis e B. canis são consideradas as principais espécies
transmitidas pelos animais ao homem e, simultaneamente, as que apresentam o maior grau de patogenicidade para a espécie humana (Seleem et al. 2010). A maioria dos casos de doença encontra-se associada a grupos ocupacionais com contato direto com animais e seus subprodutos, tais como: trabalhadores agrícolas, médicos veterinários, trabalhadores de matadouro, criadores de gado e técnicos de laboratório (Barakat et al. 2011, Meirelles-Bartoli
et al. 2012). O consumo de produtos lácteos não-pasteurizados ou carne não confecionada é
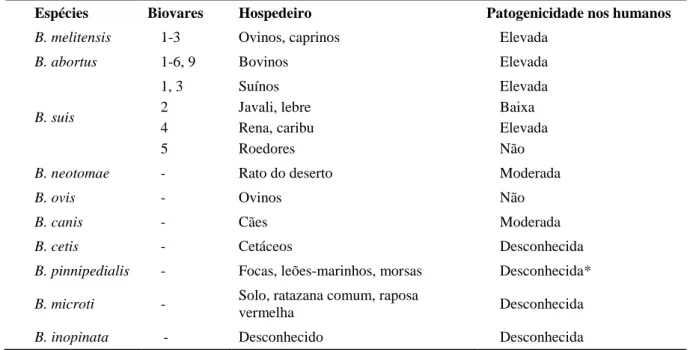
uma das vias de infeção, com particular incidência em países onde a doença é endémica (Avila-Calderón et al. 2013). Na Tabela 1 estão presentes as dez espécies de Brucella conhecidas, o grau de patogenicidade e os hospedeiros preferenciais da espécie.
Tabela 1 – Hospedeiros preferenciais e patogenicidade nos humanos das espécies de Brucella. Adaptado de: Godfroid et al. (2010).
Espécies Biovares Hospedeiro Patogenicidade nos humanos
B. melitensis 1-3 Ovinos, caprinos Elevada
B. abortus 1-6, 9 Bovinos Elevada
B. suis 1, 3 2 4 5 Suínos Javali, lebre Rena, caribu Roedores Elevada Baixa Elevada Não
B. neotomae - Rato do deserto Moderada
B. ovis - Ovinos Não
B. canis - Cães Moderada
B. cetis - Cetáceos Desconhecida
B. pinnipedialis - Focas, leões-marinhos, morsas Desconhecida* B. microti - Solo, ratazana comum, raposa
vermelha Desconhecida
B. inopinata - Desconhecido Desconhecida
*Existência de alguns casos humanos, com atual patogenicidade desconhecida.
2.2.2. Epidemiologia
A evolução da epidemiologia da brucelose, nos últimos 15 anos, mostrou novos focos de infeção em humanos, com particular incidência na Ásia Central (Smirnova et al. 2013). As principais razões inerentes às mudanças observadas na epidemiologia da doença nos humanos, prendem-se com fatores sanitários, socioeconómicos, políticos e aumento das
11
viagens internacionais, entre outros fatores (Seleem et al. 2010). Com novos focos emergentes ou (re) emergentes, a epidemiologia da brucelose encontra-se em constante mudança ao longo do tempo dentro das mesmas áreas geográficas (Saleem et al. 2010). A brucelose humana tem maior incidência na Arábia Saudita, Palestina, Irão, Omã, Jordânia e Síria (Godfroid et al. 2011).
Os programas de erradicação têm apresentado resultados positivos no combate à brucelose, contudo existem regiões onde a infeção ainda se encontra presente em animais domésticos, que constituem fonte de transmissão à população humana (Smirnova et al. 2013). Nos últimos dez anos têm sido reportados, em países desenvolvidos, casos positivos à brucelose no gado, com valores de seroprevalência na ordem dos 3 a 15% (Godfroid et al. 2011).
A sua ampla distribuição global está associada a um elevado grau de morbidade e baixa mortalidade (Angel et al. 2012). Taxas de prevalência superiores a 10 casos por cada 100.000 habitantes observam-se em países onde a brucelose é considerada endémica (Godfroid et al. 2012). A gravidade da infeção em humanos varia de acordo com a estirpe infetante, sendo a espécie de maior patogenicidade e causadora de graves problemas B. melitensis, seguindo-se por ordem decrescente B. suis, B. abortus e B. canis. Recentemente foram também identificadas espécies marinhas, portadoras de Brucella, como fontes de infeção para humanos (Woldemeskle 2013).
A infeção por B. suis em humanos e suínos domésticos ainda é um dos maiores flagelos em todo o mundo. Subdividida em cinco biovares, três são responsáveis pela infeção em suínos, B. suis biovares 1 e 3 responsáveis pela ocorrência da zoonose em todo o mundo com elevada patogenicidade em humanos, comparativamente com B. suis biovar 2 conhecido como o principal responsável pela brucelose suína na Europa (Galindo et al. 2010, Munoz et
al. 2010; Stoffregen et al. 2013), nomeadamente em Portugal (Ferreira et al. 2012). O
isolamento de B. suis biovar 2 na Europa, em espécies selvagens como o javali (Sus scrofa) e lebre europeia (Lepus europaeus) fazem destas espécies cinegéticas os principais reservatórios conhecidos da infeção envolvidos na transmissão do agente etiológico a suínos domésticos (Galindo et al. 2010, Munoz et al. 2010, De Massis et al. 2012, Ferreira et al. 2012). Nas regiões do Ártico ocorre a infeção em renas e caribus pela B. suis biovar 4, podendo transmitir a doença aos bovinos e canídeos. B. suis biovar 5 foi isolada a partir de
12
roedores na Europa Ocidental. Ambos os biovares (4 e 5) podem causar ocasionalmente doença no homem (Galindo et al. 2010)
Segundo Grégoire et al. (2012), desde 1994 que tem sido comprovada a circulação da bactéria B. suis biovar 2 nas populações de javali por toda a Europa e considerada endémica nesta espécie no sul da Bélgica. Vários são os países onde B. suis biovar 2 tem sido isolada, França (Praude et al. 2011), Itália (De Massis et al. 2012), Suíça (Leuenberger et al. 2007), Espanha (Munoz et al. 2010), Alemanha (Melzer et al. 2007), Croácia (Cvetnic et al. 2004) e em países da Europa Central e Ocidental (Hubálek et al. 2002).
Cada biovar desempenha o seu papel na infeção suína consoante as diferentes áreas geográficas (Woldemeskle 2013), B. suis biovar 1 encontra-se no continente americano, Ásia e Oceânia. B. suis biovar 3 está presente na China, Estados Unidos e Europa. O isolamento da bactéria B. suis biovar 3 em suínos, javalis e cavalos na Croácia demonstra a propagação da zoonose por toda a Europa (Grégoire et al. 2012). A patogenicidade dos biovares 1, 2 e 3 de
B. suis são semelhantes, o que os diferencia são fatores como a idade, espécie, tipo de
exposição e a dose infetante (Woldemeskle 2013).
Apesar de raramente B. suis biovar 2 infetar humanos, na Europa têm sido relatados casos de infeção em caçadores devido ao consumo de carne de javali (Meng et al. 2009, Pappas 2010). Não só na Europa têm sido citados casos de brucelose em humanos, estudos serológicos realizados nos Estados Unidos detetaram em dez estados dos EUA. Em 2008 foram reportados dez casos de brucelose, dos quais sete estavam associados a caçadores expostos ao contacto/consumo de javalis infetados (Woldemeskle 2013).
Apesar do hospedeiro natural de B. suis ser o suíno, a ocorrência em hospedeiros não naturais tem sido observada com maior frequência. As espécies animais mais frequentemente infetadas são os bovinos, cães, cavalos, ovelhas, renas, caribus, lebres, cabras e o homem (Valeris-Chacin et al. 2012, Woldemeskle 2013). A transmissão da infeção ocorre através da ingestão alimentos contaminados ou pela coabitação com animais infetados. A presença de anticorpos anti- B. suis em canídeos tem vindo a ser demonstrada em animais que participam em caçadas ao javali (Woldemeskle 2013).
A brucelose suína não é frequente e apenas ocorre esporadicamente na Europa, Ásia e Oceânia. Países como a Finlândia, Noruega, Canadá e Grã-Bretanha não têm apresentado
13
notificações da doença. É na América Latina que a brucelose suína apresenta maior prevalência a nível mundial (Woldemeskle 2013).
2.2.3 Transmissão
A capacidade de sobrevivência do agente etiológico às condições ambientais determina o seu sucesso no processo de transmissão a animais suscetíveis. Com taxas de sobrevivência similares a outras bactérias gram-negativas não esporuláveis, as brucelas podem sobreviver na matéria orgânica a temperaturas ≤ 0 ºC durante cerca de 2 anos (Labbé & Garcia 2013). Os períodos de sobrevivência no meio ambiente variam de acordo com o meio em que se encontram, no solo, estrume e água podem resistir durante 180, 240 e 150 dias, respetivamente (Dahouk et al. 2013). A bactéria é eliminada pela pasteurização ou pela exposição direta ao sol durante 2 a 4 horas, a utilização de determinados desinfetantes pode suprimir o risco de transmissão (Labbé & Garcia 2013).
A transmissão raramente ocorre de pessoa para pessoa, apesar de possível através de transfusões sanguíneas ou transplante de órgãos. A infeção pelas espécies B. abortus e B. suis têm, na sua maioria, origem no contato com animais infetados (urina e fetos abortados). B.
melitensis ocorre na população em geral devido ao consumo de leite cru ou produtos lácteos
contaminados de origem ovina ou caprina (Olsen et al. 2010, Seleem et al. 2010, Meirelles-Bartoli et al. 2012, Woldemeskle 2013). A inalação não é considerada uma via de infeção muito comum, contudo infeções por vias respiratória por Brucella são geralmente graves (Ergönül et al. 2006, Seleem et al. 2010).
A transmissão de B. suis nos suínos ocorre principalmente por via venérea, através do sêmen durante o acasalamento, e pela inalação ou ingestão da bactéria a partir de tecidos (placenta ou fetos abortados), urina e leite contaminados (Cvetnic et al. 2004, Labbé & Garcia 2013, Salajpal et al. 2013, Woldemeskle 2013).
2.2.4 Patogenicidade e Sinais Clínicos
O período de incubação da bactéria é geralmente de uma a três semanas, podendo no entanto durar meses antes que ocorram as primeiras manifestações da doença (Seleem et al. 2010, Godfroid et al. 2011). Os sinais clínicos variam de espécie para espécie, ocorrendo
14
também diferenças entre os sexos. Fatores como a idade do animal, a exposição anterior ao agente e o tipo de órgão afetado dão origem a diferentes manifestações clínicas (Smirnova et
al. 2013 Woldemeskle 2013).
As brucelas têm a capacidade de se replicar e persistir nas células do sistema mononuclear fagocitário, mostrando especial afinidade pelos macrófagos (Seleem et al. 2010, Godfroid et al. 2011). As infeções não ocorrem apenas em células fagocitárias, diferentes células e tecidos tais como, as epiteliais, trofoblastos da placenta, neurónios, e tecidos do sistema respiratório e reprodutor também são afetados. A capacidade de controlar a resposta do sistema imunitário do hospedeiro tem como consequência a infeção intracelular a longo prazo (Galindo et al. 2010). As brucelas necessitam de passar por etapas como adesão, invasão, criação e disseminação no hospedeiro para ter sucesso como agente infecioso (Christopher et al. 2010).
Em todas as espécies de animais, o sinal clínico mais evidente é o aborto prematuro e comprometimento do sistema reprodutor, com a consequente diminuição da fertilidade (Woldemeskle 2013, Stoffregen et al., 2013). No homem, os sintomas da brucelose são inespecíficos, podendo ser confundida com outras doenças, como a malária e a tuberculose (Seleem et al. 2010, Woldemeskle 2013). O aparecimento de febre de origem desconhecida é o principal sinal de infeção por Brucella (Angel et al. 2012). O diagnóstico é complicado devido ao longo período de incubação. A doença desenvolve-se progressivamente passando por diferentes fases, aguda, crónica e assintomática (Smirnova et al. 2013). Os sinais e sintomas mais comuns na fase aguda são a febre intermitente, mal-estar, insónias, anorexia, cefaleia, constipação, impotência sexual, nervosismo e depressão. São múltiplas as complicações que ocorrem a nível dos órgãos internos, de acordo com o local de infeção podem provocar espondilites, artrites, endocardites, orquites, encefalites, meningites e prostatites (Woldemeskle 2013). Pode ocorrer a perda total ou parcial da eficiência física (Smirnova et al. 2013).
As principais lesões provocadas por B. suis nos suínos são o aborto e infertilidade nas fêmeas, e orquites nos machos (Grégoire et al. 2012). Sintomas como artrites, paralisia dos membros posteriores e espondilites também são frequentes (Woldemeskle 2013). De todas as espécies de Brucella, apenas B. suis é reconhecida como originadora de infeções sistémicas causadoras de graves complicações na reprodução dos suínos. As lesões, na sua maioria, são
15
abcessos de variáveis dimensões que atingem diferentes órgãos e tecidos (Woldemeskle 2013).
O isolamento de B. suis biovar 2 em javalis ocorre frequentemente na ausência de lesões macroscópicas, curiosamente detetadas em suínos domésticos quando portadores destas brucelas (Grégoire et al. 2012). Infeções crónicas em javalis provocam a diminuição da fertilidade resultado de lesões nos testículos, epidídimo, vesículas seminais e na próstata (Stoffregen et al. 2013). Segundo Stoffregren et al. (2007), estudos realizados em javalis adultos, demonstraram através de culturas bacteriológicas o isolamento de B. suis biovar 1, revelando que os machos são mais propensos à infeção, comprovado também pela elevada seropositividade à infeção nestes relativamente às fêmeas. Quando infetados com outras espécies de Brucella que não B. suis, os suínos apresentam brucelas localizadas nos gânglios linfáticos e o caráter da doença é subclínico e auto-limitante. (Woldemeskle 2013).
2.2.5 Diagnóstico Laboratorial
O diagnóstico laboratorial da brucelose pode ser obtido pelo isolamento da bactéria, deteção de antigénios ou material genético ou pela exibição de anticorpos específicos (Fernandes 2012).
2.2.5.1 – Métodos diretos de diagnóstico
As técnicas de diagnóstico direto visam detetar a presença do agente etiológico ou componentes do mesmo, as principais técnicas utilizadas são: os métodos bacteriológicos (isolamento em cultura) e os métodos moleculares, através da deteção de DNA a partir de material biológico (Godfroid et al. 2010).
As técnicas de diagnóstico laboratorial para a brucelose considerada o “gold standard” para o seu diagnóstico (Fernandes 2012) é o isolamento da bactéria a partir de amostras de sangue, tecidos, medula óssea e outros fluídos ou excreções (Al-Anazi & Al-Jasser 2013).
As técnicas moleculares, como por exemplo a PCR (“Polymerase Chain Reaction”- reação em cadeia da polimerase) são procedimentos rápidos de elevada sensibilidade comparativamente aos métodos tradicionais, contudo dispendiosos (Christopher et al. 2010).
16
2.2.5.2 - Métodos indiretos de diagnóstico
Os métodos indiretos de diagnóstico da brucelose baseiam-se essencialmente na pesquisa de anticorpos anti-Brucella ou dirigidos para outras frações da bactéria. As técnicas utilizadas são: o teste de Wright (SAT), o teste do Rosa de Bengala (RBT), o teste fixação do complemento (CFT), os teste Enzyme-Linked Immunosorbent Assays (iELISA e cELISA), o ensaio com fluorescência polarizada (FPA), o teste de Coombs e o teste alérgico cutâneo (Smirnova et al. 2013).
Nenhum método serológico apresenta 100% de sensibilidade e de especificidade no diagnóstico imunológico, por isso torna-se essencial a utilização de mais de um método. O primeiro teste a utilizar deverá apresentar uma elevada sensibilidade, para que o número de falsos negativos seja reduzido ao máximo, e subsequentemente deveremos utilizar um método de elevada especificidade por forma a eliminarmos o maior número de falsos positivos, que positivaram na técnica de rastreio, inicialmente utilizada. A multiplicidade de testes sorológicos existentes para o diagnóstico da brucelose não são 100% confiáveis quando usados isoladamente. Por outro lado, e não menos importantes, todos os resultados dos testes devem ser interpretados em conjunto com o historial e manifestações clínicas do paciente (Al-Anazi & Al-Jasser 2013). Os organismos infetados por Brucella produzem anticorpos (AC) específicos. As imunoglobulinas classe M (IgM) aparecem no final da primeira semana após a infeção. O seu pico máximo é atingido no espaço de três meses, podendo permanecer no sangue durante semanas a meses. Seguidamente dá-se a produção das imunoglobulinas da classe G (IgG) três semanas após a infeção e atingem o seu valor máximo da sexta à oitava semana. As IgG permanecem, ainda que em reduzidas quantidades, durante meses a anos após a recuperação do paciente (Al-Anazi & Al-Jasser 2013). As imunoglobulinas (IgG) são as mais comuns e úteis no diagnóstico laboratorial da brucelose (Seleem et al. 2010) dado o carácter iminentemente crónico desta patologia infeciosa.
A maioria dos testes que existem disponíveis no mercado foram desenvolvidos para detetarem anticorpos anti-Brucella abortus (Olsen et al. 2010, Seleem et al. 2010), pelo que o seu uso no diagnóstico de B. suis, consubstancia de forma geral uma redução dos valores de sensibilidade e especificidade do teste utilizado.
Com base nos testes para a brucelose bovina, o diagnóstico serológico da brucelose suína utiliza como principais testes, o teste do Rosa de Bengala (RBT), o teste de Fixação de Complemento (CFT) e os testes ELISAs (Enzyme-Linked Immunosorbent Assays) de ensaios
17
competitivos ou indiretos (c-ELISA e i-ELISA). A falta de especificidade dos testes acima mencionados prende-se com a ocorrência de reações cruzadas com outras bactérias, tais como
Yersinia enterocolitica O:9 (Godfroid et al. 2010, Muñoz et al., 2012), Esherichia coli O:157
e Francisella tularensis (Christopher et al. 2010). A ocorrência de falsos positivos resultantes de reações cruzadas deve-se às semelhanças que existem no antigénio O, na cadeia lateral do lipopolissacárideo (LPS) da Brucella (Christopher et al. 2010; Di Febo et al. 2012). A maioria das espécies de Brucella partilha os mesmos antigénios imunodominantes presentes no LPS dos biovares B. abortus, B. militensis, B. suis, B. neotomae, B. ceti, B. pinnipedialis, e B.
microti. O diagnóstico da brucelose em espécies selvagens tem sido efetuado pelos métodos
serológicos aplicados a animais domésticos, nomeadamente a bovinos, sem qualquer validação dos mesmos (Godfroid et al. 2011).
Os principais testes utilizados no diagnóstico de B. suis referenciados na maioria das publicações são: o teste do Rosa de Bengala e o teste de ELISA (Ebani et al. 2003, Cvetnic et
al. 2004, Grégoire et al. 2012, Muñoz et al. 2012). Outros testes utilizados no diagnóstico da
brucelose no javali são: o teste de Coombs, o Ensaio de Fluorescência Polarizada (FPA), Ensaio de Fluxo Lateral (LFA), teste Dipstick, o teste Brucella Capt (BCAP) (Anazi & Al-Jasser 2013), e o teste de microaglutinação em placa (“Microagglutination test” (MAT) (Hubálek et al., 2002).
2.2.5.3. Teste do Rosa de Bengala
Usado como teste de rastreio, o teste Rosa de Bengala á uma prova de aglutinação baseada na reatividade de anticorpos contra o LPS liso da bácteria. Os resultados positivos são confirmados pela aglutinação do soro (Christopher et al. 2010). O teste apresenta menor sensibilidade em casos crónicos e baixa especificidade em áreas endémicas. Deve ser ponderada a utilidade da utilização do teste em indivíduos com antecedentes de infeção por
Brucella ou em zonas endémicas, devido à sua elevada sensibilidade (Al-Anazi & Al-Jesser
18
2.2.5.4. ELISA
Considerado o teste serológico padrão para o diagnóstico da brucelose, os testes ELISAs têm como princípio a deteção de anticorpos contra o LPS liso. Estão capacitados na identificação de IgG, IgA, e IgM, e os resultados obtidos apresentam-se mais consentâneos com a situação clínica dos pacientes (Godfroid et al. 2010). A i-ELISA é um método de elevada sensibilidade que deteta principalmente IgG, úteis no diagnóstico da infeção crónica ou na monitorização de recidiva da doença (Godfroid et al. 2010, Al-Anazi & Al-Jesser 2013). Reações não-específicas (ou cruzadas) ocorrem sobretudo em infeções provocadas por
Yersinia enterocolitica O:9 (YO9) (Godfroid et al. 2010). O c-ELISA foi desenvolvido na
tentativa de evitar o aparecimento de reações cruzadas, verificadas com frequência nas provas RBT e CFT. Existem epítopos específicos na cadeia O do LPS liso de Brucella que não são partilhados com o LPS da bactéria YO9, a c-ELISA passa assim a utilizar Ac monoclonais contra epítopos específicos do LPS da Brucella, tornando maior a especificidade da prova (Godfroid et al. 2010). Enquanto o i-ELISA requer um único anticorpo dirigido a um antigénio específico, o c-ELISA necessita de um par de anticorpos para a captura e deteção de um antigénio específico em substratos definidos, deste modo o c-ELISA torna-se mais sensível que o i-ELISA (Hnasko et al. 2011).
Um estudo realizado por Perrett et al. (2011), teve por objetivo a avaliação da prova c-ELISA na deteção de anticorpos para a Brucella em animais domésticos infetados, os resultados revelaram que o c-ELISA possui uma maior especificidade comparativamente com os testes RBT ou CFT em amostras de suínos. Em comparação aos restantes animais domésticos foi apenas ligeiramente mais específico que o i-Elisa.
As vantagens deste teste comparativamente aos restantes testes de aglutinação passam pela capacidade de triagem em grandes populações e na diferenciação entre as fases aguda e crónica da doença (Al-Anazi &Al-Jesser 2013), para além de robustos e de fácil execução (Corbel 2006), e portanto de grande valia no diagnóstico da brucelose em zonas endémicas (Al-Anazi &Al-Jesser 2013).
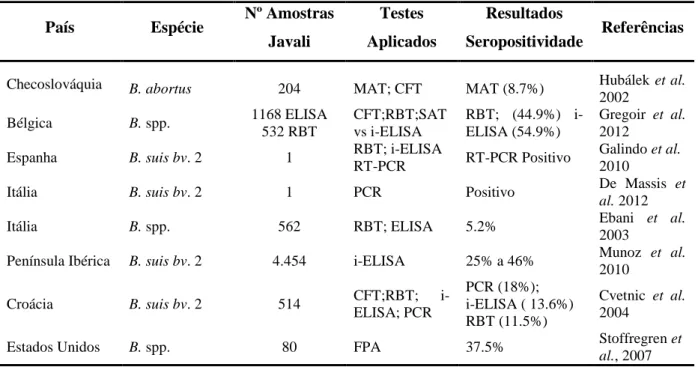
A Tabela 2 descreve estudos serológicos da brucelose efetuados em amostras de javali (Sus Scrofa) em vários países.
19
Tabela 2 - Estudos serológicos da brucelose no javali (Sus scrofa) em vários países.
País Espécie Nº Amostras Javali
Testes Aplicados
Resultados
Seropositividade Referências Checoslováquia B. abortus 204 MAT; CFT MAT (8.7%) Hubálek et al.
2002 Bélgica B. spp. 1168 ELISA 532 RBT CFT;RBT;SAT vs i-ELISA RBT; (44.9%) i-ELISA (54.9%) Gregoir et al. 2012
Espanha B. suis bv. 2 1 RBT; i-ELISA
RT-PCR RT-PCR Positivo
Galindo et al. 2010
Itália B. suis bv. 2 1 PCR Positivo De Massis et al. 2012
Itália B. spp. 562 RBT; ELISA 5.2% Ebani et al.
2003
Península Ibérica B. suis bv. 2 4.454 i-ELISA 25% a 46% Munoz et al. 2010 Croácia B. suis bv. 2 514 CFT;RBT; i-ELISA; PCR PCR (18%); i-ELISA ( 13.6%) RBT (11.5%) Cvetnic et al. 2004
Estados Unidos B. spp. 80 FPA 37.5% Stoffregren et al., 2007
20
3 - METODOLOGIA
3.1 - ÁREA DE ESTUDO
Localizada a norte de Portugal, a área de estudo (Figura 3) compreende os distritos de Vila Real e Bragança perfazendo uma área de 10.907,3 km2. As temperaturas médias anuais da região são de 13,1 ºC e os valores médios de precipitação variam entre os 361 a 2.012mm (Fonseca et al. 2004).
A paisagem caracteriza-se por ser bastante heterogénea relativamente à vegetação e ao clima. Os usos do solo passam pela agricultura tradicional, floresta e pastagens. A floresta ocupa a maioria da área de estudo com espécies características da região, das quais se destacam: os carvalhos (Quercus pyrenaica, Q. robur e Q. faginea), o pinheiro bravo (Pinus
pinaster) e o castanheiro (Castanea sativa). A Azinheira (Quercus rotundifólia) e o sobreiro (Quercus suber) estão presentes em menor quantidade. As zonas de ripícolas possuem
predominantemente o amieiro (Alnus glutinosa), o freixo (Fraxinus sp.) e o salgueiro (Salix
sp.) (Fonseca et al. 2004). A composição dos matos é feita por várias espécies de arbustos,
com maior frequência encontram-se a carqueja (Pterospartum tridentatum), sargaços (Halimium lasianthum), giestas (Cytisus multiflorus), o tojo (Ulex minor), as urzes (Erica
spp.) e o medronheiro (Arbutus unedo) (Godinho-Ferreira et al. 2005).
Figura 3 – Área de Estudo – Norte de Portugal, região de Trás-os-Montes.
21
3.2 - RECOLHA DE DADOS
A recolha das amostras foi realizada durante as épocas venatórias de 2011/2012 e 2012/2013, nos meses de outubro a fim de fevereiro, referentes ao processo de caça montarias, de acordo com a Portaria Nº 147/2011 de 7 de abril publicada no Diário da República, Nº 69 Série I, 2011. Durante as duas épocas venatórias foram selecionadas as montarias por forma a obter uma amostragem representativa da área de estudo.
As montarias são um processo de caça utilizado na correção de densidades da espécie (javali). São selecionadas manchas florestais com indícios da presença de javalis e durante um período de tempo antes de se realizar a montaria, são colocados cevadouros na tentativa de atrair ou manter os indivíduos dentro da mancha da zona de caça. A sua composição é variada sendo o milho e a castanha os alimentos mais utilizados. No dia da caçada são atribuídas “portas” (posições dos atiradores no terreno) nos limites da mancha, onde se colocam os caçadores que aguardam a passagem do animal. Os batedores (também designados de matilheiros) que se fazem acompanhar pelas matilhas de cães tentam expulsar os javalis do interior da mancha para a periferia da mesma.
A primeira fase do trabalho de campo foi atribuir um número a cada animal identificado no tubo de recolha do sangue, bem como a respetiva data de colheita. Na ficha de campo (Anexo I) foram registadas informações como a localidade, área da mancha, número de animais abatidos e amostrados, sexo, idade, estado reprodutivo das fêmeas, hora do abate e evisceração do animal, número de caçadores e cães. Foi também registado o tipo de alimentação utilizada em cevadouros e se foi feito repovoamento da espécie na mancha.
Para definir a idade da população amostrada foi utilizada a tabela de idades descrita por Saenz de Buraga et al. (1991) (Tabela 3).
Tabela 3 – Classificação da idade da espécie Sus scrofa.
Classe Idades
Juvenil Dos 6 aos 14 meses Sub-adultos Dos 14 meses aos 23 meses Adultos Com mais de 23 meses
22
3.3 - RECOLHA DE SANGUE
As amostras de sangue foram recolhidas a partir da cavidade torácica e coração, durante as necropsias de campo. Os animais eram colocados em decúbito dorsal e seguidamente foi feita uma incisão desde a traqueia até próximo da genitália externa. A recolha do sangue foi efetuada com pipetas descartáveis a partir da cavidade torácica ou diretamente do coração (Figura 4). Em algumas montarias surgiram dificuldades na recolha das amostras, especialmente em montarias com um grande número de animais mortos, devido ao consequente prolongamento do período de tempo que mediou o abate e a evisceração, que nalguns casos excedeu as 2-3 horas. Posteriormente, o soro foi obtido por centrifugação durante 15 minutos a 1.500 G e armazenado a -20 Cº até à realização das provas serológicas. A centrifugação foi efetuada o mais breve possível após a colheita do sangue a fim de impedir a degradação do material biológico. Em anexo (Anexo 1) encontra-se a ficha de campo utilizada na recolha de informação para cada animal amostrado.
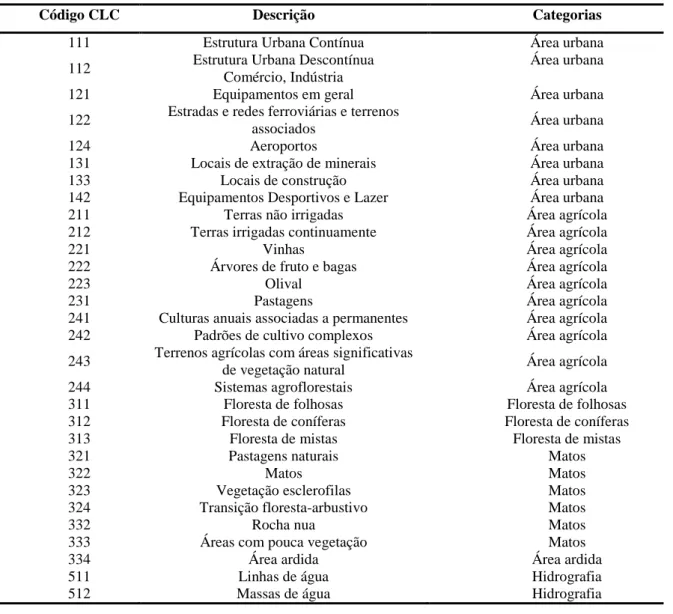
3.4 – DIAGNÓSTICO IMUNOLÓGICO DA BRUCELOSE NOS JAVALIS AMOSTRADOS
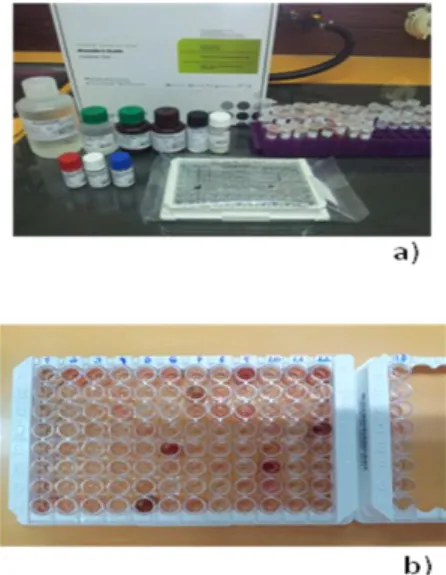
A análise imunológica das amostras foi efetuada utilizando dois testes serológicos diferentes: O teste do Rosa de Bengala e o teste de C-ELISA.
23
3.4.1 - Deteção de anticorpos anti-Brucella pelo Teste Rosa Bengala
Inicialmente foi aplicado o teste Rosa Bengala (RBT) como prova de rastreio das amostras de soro de javali com o reagente BENGATEST® (NOVAVET).
A prova foi realizada com base no protocolo de Imunologia, “Aglutinação rápida com o antigénio de Brucella corado com Rosa de Bengala” (suspensão de Brucella abortus, estirpe 99, Weibridge) ou mais vulgarmente designado de teste do Rosa de Bengala (Pires et al. 2010).
Os soros e o regente foram deixados uma hora à temperatura ambiente (18-21 ºC) antes da análise ser efetuada. Primeiramente, foram efetuados os controlos da prova (positivo e negativo). O controlo positivo foi efetuado pela adição de 30μL de soro positivo de referência a 30μL do reagente, ambas as quantidades foram depositadas numa lâmina escavada e homogeneizadas com uma vareta de vidro. Seguiu-se a agitação da lâmina durante 4 minutos, em movimentos circulares suaves, e leitura da prova a olho nu e com o auxílio de uma lupa. O controlo positivo apresentou aglutinação visível. O controlo negativo foi efetuado de forma em tudo idêntica, excetuando que em vez da adição do soro, este foi substituído por PBS. Não se verificou qualquer grau de aglutinação visível a olho nu.
Todas as amostras de soro de javali sofreram o mesmo procedimento, adicionadas na lâmina 30μL de soro problema e 30μL gota de reagente. Na análise das amostras foi tido em consideração a presença de três observadores diferentes.
A positividade dos soros foi considerada quando pelo menos dois operadores registaram qualquer grau de aglutinação visível a olho nu.
3.4.2 - Deteção de anticorpos anti-Brucella pelo teste c-ELISA
O teste de Elisa utilizado na deteção de anticorpos anti-Brucella foi o teste SVANOVIR® Brucella-Ab c-ELISA (Anexo II), comercializado pela empresa Sueca SAVANOVA. Este teste baseia-se nos antigénios s-LPS e deteta anticorpos de B. abortus, B.
suis e B. melitensis. O kit não é apenas aplicável a animais domésticos, sendo referenciado
também para utilização em animais selvagens, tais como javalis, bisontes e renas (Munoz et