UNIVERSIDADE FEDERAL DO CEARÁ
FACULDADE DE FARMÁCIA, ODONTOLOGIA E ENFERMAGEM PROGRAMA DE PÓS-GRADUAÇÃO EM ODONTOLOGIA
MESTRADO EM ODONTOLOGIA
FELIPE AUGUSTO RAMIREZ DE PAULA
EFEITO DE ANTIOXIDANTES NA RESISTÊNCIA DE UNIÃO DE UM SISTEMA ADESIVO AO ESMALTE BOVINO TRATADO COM PERÓXIDO DE
HIDROGÊNIO 35%
EFEITO DE ANTIOXIDANTES NA RESISTÊNCIA DE UNIÃO DE UM SISTEMA ADESIVO AO ESMALTE BOVINO TRATADO COM PERÓXIDO DE
HIDROGÊNIO 35%
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Odontologia da Faculdade de Farmácia, Odontologia e Enfermagem da Universidade Federal do Ceará, como requisito parcial para a obtenção do Título de Mestre em Odontologia.
Área de Concentração: Clínica Odontológica.
Orientador: Prof. Dr. Juliano Sartori Mendonça.
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Odontologia da Faculdade de Farmácia, Odontologia e Enfermagem da Universidade Federal do Ceará, como requisito parcial para a obtenção do Título de Mestre em Odontologia.
Aprovada em __________ / __________ / __________.
BANCA EXAMINADORA
__________________________________________ Prof. Dr. Juliano Sartori Mendonça
Universidade Federal do Ceará - UFC Orientador
_________________________________________ Prof Dra Marina Studart Alencar Borges
Centro Universitário Christus 1º Examinador
_________________________________________ Prof. Dr Emanuel Arraes de Alencar Júnior
A minha mãe, Isolda Ramirez, minha melhor amiga, companheira e exemplo de dignidade, caráter e de ser humano. A cada dia desejo ser mais parecido com a senhora, pois assim sei que serei um ser humano melhor.
Ao meu pai, Omar Ramirez, por me ensinar o valor dos estudos e do trabalho. O senhor que trabalha tanto para me proporcionar sempre o melhor. Uma frase sua que levo comigo é: “Estude! Pois é a única herança que posso deixar a você é a sua educação”.
Ao meu irmão, Fernando Ramirez, e à minha cunhada, Ana Priscilla, por todos os momentos de felicidade e descontração e por me apresentarem uma nova forma de amar que eu até então desconhecia. Obrigado por me darem a honra de ser tio e padrinho do nosso Murilo Ramirez.
Às minhas amigas, Flávia Jucá e Maria Elisa por todas as conversas, desabafos e puxões de orelha. Sem vocês essa caminhada teria sido ainda mais árdua.
Ao meu orientador, Prof. Dr. Juliano Sartori Mendonça, por sempre estar disponível para conversas, dúvidas e ajudas. Obrigado por ser um orientador que conduz tudo com muita leveza.
À doutoranda Jacqueline Santiago e à mestranda Talita Arrais por me ajudarem em todos os momentos durante a trajetória do mestrado. A ajuda de você foi crucial para meu aprendizado.
Aos alunos de iniciação científica, Lorena Macêdo, Marcelo Lemos, Vanessa Nepomuceno, Paula Regina e Emanuel Alcantara que me ajudaram em diversas etapas da pesquisa. Muito obrigado!
trabalho.
Quando a restauração adesiva é imediata ao clareamento dentário, o oxigênio residual oriundo da degradação do peróxido de hidrogênio inibe a polimerização dos compostos resinosos, diminuindo a resistência de união. Portanto, o objetivo do estudo foi avaliar a influência da aplicação de substâncias antioxidantes, ascorbato de sódio 10%, glutationa 5% e glutationa 10%, na resistência de união de um sistema adesivo ao esmalte bovino previamente tratado com peróxido de hidrogênio 35%. O teste de atividade antioxidante pelo radical livre DPPH foi realizado para mensurar o poder antioxidante das substâncias experimentais, usando a água destilada como controle negativo. Blocos de esmalte obtidos a partir de 111 incisivos bovinos hígidos foram aleatoriamente divididos em cinco grupos: sem (C+) ou com clareamento (C-), com clareamento e aplicação de soluções de ascorbato de sódio 10% (ASC-10), glutationa 5% (GLUT-5) ou glutationa 10% (GLUT-(ASC-10), por cinco minutos, e resina nanohíbrida Filtek Z350 foi aplicada em incrementos de 1 mm. No teste do grau de conversão dos monômeros do sistema adesivo, foram utilizadas fatias (1 mm) de dois espécimes de cada grupo para comparação com o sistema adesivo nos estados polimerizado e não polimerizado por eletroscopia Micro-Raman, operando com laser HeNe a 532 nm. No teste de resistência de união, os blocos foram seccionados até obtenção de palitos de 1 mm2. Os palitos foram submetidos a tração de 0,5 mm/min em uma máquina de ensaios universais. O modo de fratura foi analisado e classificado. Os testes ANOVA one-way e Kruskal-Wallis adotando nível de significância de 5% foram realizados para análise estatística. O ASC-10 apresentou melhor atividade antioxidante (p<0,05). A aplicação das substâncias antioxidantes não influenciou no grau de conversão dos monômeros adesivos (p>0,05). No grau de conversão, o grupo C- foi estatisticamente inferior aos demais grupos (p<0,05). No teste de resistência de união, GLUT-5 e GLUT-10 foram estatisticamente superiores (p<0,0GLUT-5) ao C+. Os grupos ASC-10 e C+ não apresentaram diferenças estatísticas. Apesar de o ASC-10 ter apresentado melhor atividade antioxidante e ter recuperado os valores de resistência de união, GLUT-10 foi mais eficiente que o ASC-10 em reverter o efeito de redução da resistência de união após uso de agentes clareadores. Houve prevalência de falhas do tipo adesiva em todos os grupos.
When restoration is placed immediately after dental bleaching, the residual oxygen from the hydrogen peroxide degradation inhibits the polymerization of the resinous compounds, reducing the bond strength. Therefore, the objective of this study was to evaluate the influence of the application of antioxidant substances, 10% sodium ascorbate, 5% glutathione and 10% glutathione, on the bond strength of an adhesive system on the bovine enamel previously treated with 35% hydrogen peroxide. The antioxidant activity test by the DPPH free radical was performed to measure the antioxidant power of the experimental substances, using distilled water as a negative control. Enamel blocks of 111 healthy bovine incisors were randomly divided into five groups: without (C+) or with (C-) bleaching, with bleaching and application of solutions of 10% sodium ascorbate (ASC-10), 5% glutathione (GLUT-5) or 10% glutathione (GLU-10), for five minutes, and Filtek Z350 nanohybrid resin was applied in 1mm increments. In the monomers’ degree conversion test of the adhesive system, slices (1mm) of two specimens of each group were used for comparison with the adhesive system in the polymerized and non-polymerized states by Micro-Raman eletroscopy, operating with HeNe laser at 532nm. In the bond strength test, the blocks were sectioned until obtaining sticks of 1.0 mm2. The sticks were subjected to a traction of 0.5 mm/min in an universal testing machine. The fracture mode was analyzed and classified. The one-way ANOVA and Kruskal-Wallis tests, adopting a significance level of 5%, were performed for statistical analysis. ASC-10 showed better antioxidant activity (p<0.05). The application of the antioxidant substances did not influence the degree of conversion of the adhesive monomers (p>0.05). In the test of degree conversion, the C- group statistically inferior to others groups (p<0.05). In the bond strength test, GLUT-5 and GLUT-10 were statistically superior (p<0.05) than the C+. The ASC-10 and C+ groups did not show any statistical differences. Although ASC-10 showed better antioxidant activity and recovered the values of bond strength, GLUT-10 was more efficient than ASC-10 in reversing the effect of decrease of bond strength after the use of bleaching agents. There was prevalence of adhesive failure in all groups.
1. INTRODUÇÃO...11
2. PROPOSIÇÃO...15
Objetivo Geral...15
Objetivos Específicos...15
3. CAPÍTULO...17
4. CONCLUSÃO...34
5. REFERÊNCIAS...36
6. ANEXOS...41
Anexo A -Artigo 46 do Regimento Interno do Programa de Pós-Graduação em Odontologia da Universidade Federal do Ceará...41
Anexo B - Instruções aos autores para submissão de manuscrito ao periodico Journal of Applie Oral Science...42
Anexo C - Gráfico 1: Médias e desvios padrão do grau de conversão dos monômeros adesivos...46
1. INTRODUÇÃO GERAL
Devido à grande quantidade de produtos industrializados, a pigmentação dos dentes anteriores tem sido cada vez mais comum (KHOROUSHI; AGHELINEJAD, 2011) aumentando, dessa forma, a busca por soluções estéticas. A causa da pigmentação dos dentes pode ser categorizada em dois principais grupos: manchas intrínsecas e extrínsecas (CAREY, 2014). Manchas intrínsecas, também chamadas de internas, ocorrem quando agentes cromógenos são depositados no interior da estrutura dentária (MINOUX; SERFATY, 2008, SULIEMAN, 2008) e podem ser atribuídas a fatores como genética e idade, uso de antibióticos e, antes da erupção dos dentes, altos níveis de flúor e desordens de desenvolvimento (CAREY, 2014). Manchas extrínsecas, algumas vezes chamadas de externas, surgem quando agentes cromógenos são depositados na superfície dos dentes (MINOUX; SERFATY, 2008, SULIEMAN, 2008) e, em geral, são devido a fatores ambientais como a fumaça do cigarro, pigmentos provenientes de bebidas, comidas e/ou metais (CAREY, 2014). Dentre as formas de tratamento disponíveis, encontra-se o clareamento dentário, considerado como conservador, eficaz e seguro (PERDIGÃO et al., 2004, KHIN, 2007, KWON; WERTZ, 2015).
O clareamento dentário pode ser realizado em dentes vitais e não vitais, e as técnicas empregadas envolvem a aplicação do agente clareador no interior ou no exterior das coroas dentárias, podendo, em alguns casos, ser realizada a associação dessas duas técnicas. (CADENARO et al, 2006, MINOUX; SERFATY, 2008, KHOROUSHI; AGHELINEJAD, 2011). Independente da técnica de clareamento utilizada, o mecanismo do clareamento se dá pela degradação dos componentes cromógenos. O agente ativo mais utilizado é o peróxido de hidrogênio (CAREY, 2014) que, devido à sua característica de ser um forte agente oxidante (FÉLIZ-MATOS et al., 2014), é capaz de reduzir ou clivar as ligações duplas de moléculas dos pigmentos em moléculas menores (KHIN, 2007, JOINER, 2006, JOINER, 2007, SULIEMAN, 2008). Uma vez que esses pigmentos apresentam seu tamanho reduzido, podem ser eliminados por meio da estrutura dentária ou, então, passam a absorver uma menor quantidade de luz, aparentando mais claros (KIHN, 2007).
polimerização dos materiais resinosos (BARGUI; GODWIN, 1994, CADENARO et al., 2006, TORRES et al., 2006, MURAGUCHI et al, 2007, KHOROUSHI; AGHELINEJAD, 2011, BERGER et al., 2013, GULER et al., 2013, BRISO, et al., 2014, HANSEN et al., 2014 WHANG; SHIN, 2015). Como consequência, a resistência de união é reduzida, prejudicando, assim, o selamento marginal e propiciando microinfiltração marginal (ATTIN et al, 2004).
O oxigênio residual é capaz de se difundir através da estrutura dentária e, dessa forma, o decréscimo da resistência de união apresenta caráter temporário (GÖKÇE et al., 2008). Como abordagem geral, recomenda-se a postergação do procedimento restaurador por um período entre 24 horas a quatro semanas (BARGUI; GODWIN, 1994, CADENARO et al., 2006, TORRES et al., 2006, MURAGUCHI et al, 2007, KHOROUSHI; AGHELINEJAD, 2011, BERGER et al., 2013, GULER et al., 2013, BRISO, et al., 2014, HANSEN et al., 2014 WHANG; SHIN, 2015) após a realização do procedimento clareador.
Algumas técnicas foram propostas para reduzir esse efeito deletério do clareamento causado pela liberação do oxigênio residual (GÖKÇE et al., 2008). Civtko et al, em 1991, propuseram realizar um polimento no esmalte entre os procedimentos clareador e restaurador. Bargui e Gordwin, em 1994, trataram o esmalte clareado com álcool antes do procedimento restaurador. Em busca de mais alternativas para minimizar o tempo de espera entre os procedimentos clareador e restaurador, pensou-se em utilizar os agentes antioxidantes. Antioxidantes são moléculas que podem neutralizar radicais livres, produtos da reação de clareamento, por meio de aceitação ou doação de elétrons eliminando a condição de instabilidade do radical livre (LÜ et al., 2010). Estudos foram realizados com diversos agentes antioxidantes, dentre eles o ascorbato de sódio (MURAGUCHI et al., 2007, KHOROUSHI; AGHELINEJAD, BERGER et al., 2013, GULER et al., 2013, BRISO et al., 2014, HANSEN et al., 2014), o alfa-tocoferol (WHANG; SHIN, 2015) e o bicarbonato de sódio (TORRES et al., 2006, TOSTES et al., 2012, ALENCAR et al., 2016, SVIZERO et al., 2017).
Nesse contexto, outra substância antioxidante vem sendo testada, a glutationa (TORRES et al., 2006, NASSAR et al, 2014a, NASSAR et al., 2014b). A glutationa é o mais prevalente e importante tampão-redox de dissulfeto em células animais (NASSAR et al., 2014a, NASSAR et al., 2014b) e é importante no sistema de defesa enzimático contra o aumento de radicais livres (JÚNIOR et al., 2001) e injúrias oxidativas (HUBER; ALMEIDA; FÁTIMA, 2008, THOMPSON; FRANKLIN, 2010). No organismo, a glutationa se apresenta em duas formas: a glutationa (GSH) e a glutationa oxidada (GSSH) (JÚNIOR et al., 2001, NASSAR et al., 2014a, NASSAR et al., 2014b). Um fato interessante é que o principal substrato da glutationa é o peróxido de hidrogênio (JÚNIOR et al., 2001).
2. PROPOSIÇÃO
2.1 Objetivo Geral
O objetivo desse estudo “in vitro” foi avaliar a influência da aplicação de agentes antioxidantes na resistência de união de um sistema adesivo ao esmalte bovino previamente tratado com peróxido de hidrogênio 35%.
2.2 Objetivos Específicos
- avaliar o potencial de atividade antioxidante das concentrações de ascorbato de sódio 10%, glutationa 5% e glutationa 10% por meio do teste de atividade antioxidante pelo radical livre DPPH;
- avaliar a influência dos agentes antioxidantes no grau de conversão dos monômeros do sistema ao esmalte por meio de eletroscospia micro-Raman;
- avaliar a influência dos agentes antioxidantes sobre a resistência de união de um sistema adesivo ao esmalte bovino previamente tratado com peróxido de hidrogênio 35%;
3. CAPÍTULO
Esta dissertação está baseada no Artigo 46 do Regimento Interno do Programa de Pós-Graduação em Odontologia da Universidade Federal do Ceará, que regulamenta o formato alternativo para dissertações de Mestrado e teses de Doutorado, e permite a inserção de artigos científicos de autoria e coautoria do candidato (Anexo A). Assim sendo, esta dissertação contém o artigo intitulado “Análise do potencial antioxidante da glutationa e seu efeito na adesão ao esmalte bovino tratado com peróxido de hidrogênio 35%”, que será submetido à publicação no periódico Journal of Applied Oral Science (Anexo B).
ANÁLISE DO POTENCIAL ANTIOXIDANTE DA GLUTATIONA E SEU EFEITO NA ADESÃO AO ESMALTE BOVINO TRATADO COM PERÓXIDO DE
HIDROGÊNIO 35%
RESUMO
Quando a restauração adesiva é imediata ao clareamento dentário, o oxigênio residual oriundo da degradação do peróxido de hidrogênio inibe a polimerização dos compostos resinosos, diminuindo a resistência de união. Este estudo “in vitro” teve como objetivo avaliar a influência da aplicação de agentes antioxidantes na resistência de união de um sistema adesivo ao esmalte bovino tratado com peróxido de hidrogênio a 35%. O teste de atividade antioxidante pelo radical livre DPPH também foi realizado avaliando o poder antioxidante da água destilada, ascorbato de sódio 10%, glutationa 5% e glutationa 10%. Para os testes de grau de conversão e resistência de união, blocos de esmalte obtidos a partir de 111 incisivos bovinos hígidos (4x4 mm) foram aleatoriamente divididos em cinco grupos: com (C-) ou sem clareamento (C+), com clareamento e aplicação de soluções de ascorbato de sódio 10% (ASC-10), glutationa 5% (GLUT-5) ou glutationa 10% (GLUT-10), por cinco minutos. No teste do grau de conversão dos monômeros, foram usadas três fatias de dois espécimes de cada grupo para comparação com o sistema adesivo em união ou isolado, polimerizado ou não, por eletroscopia Micro-Raman, operando com laser HeNe a 532 nm. No teste de resistência de união, os blocos foram seccionados para a obtenção de espécimes em forma de palitos de 1 mm2 de área de secção transversal e foram testados sob tração de 0,5 mm/min, em uma máquina de ensaios universais. Por lupa estereoscópica, a análise e a classificação de acordo com o tipo de fratura foram realizadas. Os dados obtidos foram submetidos a análise estatística paramétrica (análise de variância a um critério e Teste de Tukey) para os testes de atividade antioxidante, grau de conversão e resistência de união, e a análise estatística não-paramétrica (Kruskal-Wallis e teste de Dunn) para o modo de fratura, ambas com nível de significância de 5%. ASC-10 mostrou ter maior atividade antioxidante em comparação às diferentes concentrações de glutationa. No teste de grau de conversão, C- foi estatisticamente inferior aos demais grupos, que foram semelhantes entre si e ao sistema adesivo. GLUT-5 e GLUT-10 proporcionaram valores de resistência de união semelhantes entre si e superiores aos obtidos nos demais grupos. Não houve diferenças estatisticamente significantes entre os grupos C+ e ASC-10. Os agentes antioxidantes não influenciaram negativamente no grau de conversão dos monômeros. Apesar da maior atividade antioxidante do ASC-10 e da capacidade de recuperar a resistência de união, a GLUT-10 foi mais eficaz que o ASC-10 em reverter o efeito de redução da resistência de união do esmalte bovino ao sistema adesivo. Houve prevalência de falhas do tipo adesiva em todos os grupos.
ABSTRACT
When the adhesive restoration is placed immediately after the dental bleaching, the residual oxygen from hydrogen peroxide degradation inhibits the polymerization of the resinous compounds, reducing the bond strength. This “in vitro” study aimed to evaluate the influence of the application of antioxidant agents in the bond strength of an adhesive system on bovine enamel treated with 35% hydrogen peroxide. The antioxidant activity test by the DPPH free radical was performed by evaluating the antioxidant power of distilled water, 10% sodium ascorbate, 5% glutathione and 10% glutathione. For the tests of conversion degree and bond strength, enamel obtained from 111 healthy bovine incisors were randomly divided into 5 groups: with (C-) and without (C+) bleaching, with bleaching and application of solutions of 10% sodium ascorbate (ASC-10), 5% glutathione (GLUT-5) and 10% glutathione (GLUT-10), for 5 minutes. In the monomer conversion test, three slices of two specimens of each group were used for comparison with the adhesive system, in bonds or insulated, polymerized or not, by Micro-Raman electroscopy, operating with HeNe laser at 532 nm. In the bond strength test, the blocks were sectioned to obtain 1.0 mm2 cross sectional area and were tested under traction of 0.5 mm/min in an universal test machine. The analysis and classification according to the type of fracture was performed by stereoscopic loupe. The obtained data was submitted to parametric statistical analysis (variance analysis of one criterion and Tukey’s test) for the tests of antioxidant activity, conversion degree and bond strength, (Kruskal-Wallis and Dunn’s test) for the fracture mode, adopting a significance level of 5%. ASC-10 showed to have higher antioxidant activity compared to both concentrations of glutathione. In the conversion degree test, the C- group was statistically inferior to the others groups, which were similar to each other and to the adhesive system. The GLUT-5 and GLUT-10 groups provided bond strength values similar to each other and higher than those obtained in the other groups. There were no statistically significant differences between the C+ and ASC-10 groups. The antioxidant agents did not negatively influence the conversion degree of monomers. Despite the higher antioxidant activity of ASC-10 and the ability to recover the bond strength, GLUT-10 was more effective than ASC-10 in reversing the effect of bond strength decrease of the bovine enamel to the adhesive system. There was a prevalence of adhesive failures in all groups.
INTRODUÇÃO
O clareamento dental é considerado o método mais conservador, eficaz e seguro1 para tratamento de descolorações dentárias2. A técnica é relativamente simples e pode ser realizada em dentes vitais e não vitais3. O clareamento é definido como a degradação dos componentes cromógenos4 e, apesar de vários métodos terem sido descritos a respeito do clareamento, todos eles são baseados no uso direto do peróxido de hidrogênio (H2O2), ou seu precursor, peróxido de carbamida5. O mecanismo de ação dos agentes clareadores é baseado na complexa reação de óxido-redução, com a liberação dos radicais livres de oxigênio que penetram através dos poros dos prismas de esmalte e, via processo químico, causam a ruptura das moléculas orgânicas que pigmentam os substratos dentários, convertendo essas moléculas em dióxido de carbono e água6.
Porém, um dos efeitos adversos dos agentes clareadores é a redução da resistência de união a compósitos resinosos7-9. É necessária uma maior atenção uma vez que o clareamento é frequentemente considerado um tratamento estético preliminar à realização de procedimentos adesivos10. Agentes clareadores contendo 10–35% de peróxido de carbamida ou hidrogênio afetam adversamente a resistência de união do compósito resinoso ao esmalte clareado quando a adesão é realizada imediatamente após o procedimento clareador11. Acredita-se que o oxigênio gerado na reação do peróxido, na superfície ou no interior da estrutura dentária, iniba a polimerização dos monômeros resinosos, causando, assim, a redução da resistência de união 12-14. No entanto, essa redução se apresenta em caráter temporário15. Então, como abordagem geral, recomenda-se a postergação dos procedimentos adesivos, sendo que o tempo de espera pode variar de 24 horas a três semanas9, 12, 13, 16.
Com o objetivo de diminuir esse tempo de espera entre os procedimentos clareador e restaurador, vários estudos envolvendo resistência de união têm sido realizados6, 9,11-13, 15-22. Uma abordagem bastante estudada é a utilização de agentes antioxidantes após o clareamento dentário11. Agentes antioxidantes são moléculas capazes de reagir com radicais livres de oxigênio e neutralizar os efeitos do peróxido de hidrogênio8, 20. Dentre as substâncias antioxidantes já estudadas, tem-se o ascorbato de sódio9,11,13,16, 17, o alfa-tocoferol6 e o bicarbonato de sódio14 ,20-22.
glutationa (GSH) e a glutationa oxidada (GSSH)23. Devido à sua capacidade de doação de elétrons, a glutationa (GSH) é considerada um bom agente antioxidante25, 26. Soma-se a isso o fato de o principal substrato da glutationa ser o peróxido de hidrogênio27. O objetivo deste estudo in vitro foi avaliar o potencial antioxidante da glutationa e sua ação na adesão ao esmalte bovino tratado com peróxido de hidrogênio 35%. A hipótese nula de estudo é que a glutationa, apesar de sua propriedade antioxidante, não é capaz reverter o efeito de redução da resistência de união do esmalte bovino ao sistema adesivo após o tratamento com peróxido de hidrogênio 35%.
MATERIAIS E MÉTODOS
Delineamento experimental
O estudo foi realizado em quatro etapas, sendo elas: 1) Avaliação do potencial antioxidante, com quatro níveis (I - água destilada; II – ascorbato de sódio 10%; III – glutationa 5% e IV – glutationa 10%); 2) Teste de resistência de união por microtração, com cinco níveis (I – controle positivo; II – controle negativo; III – ascorbato de sódio 10%; IV – glutationa 5% e V – glutationa 10%); 3) Teste de grau de conversão dos monômeros adesivos, com cinco níveis (I – controle positivo; II – controle negativo; III – ascorbato de sódio 10%; IV – glutationa 5% e V – glutationa 10%) e 4) Análise do modo de fratura, com o fator tratamento em quatro níveis (I – fratura adesiva; II – fratura coesiva em esmalte; III – fratura coesiva em resina e IV – fratura mista).
Teste de Atividade Antioxidante
O percentual de atividade antioxidante (AA%) de cada substância foi avaliado pelo ensaio do radical livre DPPH (2,2-difenil-1-picrihidrazil). As substâncias utilizadas como amostra foram: água destilada, ascorbato de sódio 10%, glutationa 5% e glutationa 10%. As amostras foram preparadas com o radical estável DPPH em solução de etanol. A mistura de reação consistiu de 0.5 mL da amostra, 3 mL de etanol absoluto e 0.3 mL da solução de DPPH 0.5 mM em etanol. A mistura branca consistiu de 3.3 mL de etanol e 0.5 mL da amostra. A mistura controle consistiu de 3.5 mL de etanol e 0.3 mL da solução de DPPH 0.5 mM em etanol28.
em uma leitora de Elisa (Synergy, HT, BioTek, Winooski, VT, EUA). O percentual de atividade antioxidante foi determinado através da seguinte fórmula:
Preparo dos Espécimes
Cento e onze coroas de incisivos bovinos foram selecionadas e mantidas em solução de timol 0,1% até serem utilizadas. Dentes com trincas, rachaduras ou fissuras na superfície foram excluídos. As coroas foram fixadas com cera pegajosa (Kota, São Paulo, SP, Brasil) em um dispositivo para adaptação em uma máquina de corte manual Isomet Low Speed Saw (South Bay Technology Inc., Buehler, Lake Bluff, IL, EUA) e, então, seccionadas nos sentidos mésio-distal e inciso-cervical com disco de corte diamantado dupla face (mod 13 127 mm x 0,4 mm, 12,7 mm) (Buehler, Joinville, SC, Brasil) em baixa velocidade e sob refrigeração contínua, até a obtenção de um bloco quadrangular de 4 x 4 mm. Os blocos que apresentaram rachaduras ou defeitos estruturais foram descartados, bem como a face palatina excluída. Em seguida, os blocos foram fixados com cera pegajosa no centro de um disco de acrílico com as faces de dentina expostas e foram planificadas com disco de lixa d’água de granulação 320 em uma politriz metalográfica (Aropol 2V, Arotec S.A. Indústria e Comércio – Coita, SP, Brasil) em baixa velocidade e com refrigeração constante. Ao final, os blocos foram fixados, porém com a face de esmalte exposta, para serem planificados com discos de lixa d’água de granulações 320 e 400 e polidos com discos de carbeto de silício de granulações 600 e 1200 em politriz metalográfica em baixa velocidade e com refrigeração constante. Foram excluídos os blocos em que, após planificação e polimento, houvesse exposição de dentina. Ao final desse processo, os blocos foram inseridos no ultrassom (Ultracleaner 1400, Unique, Indaiatuba, SP, Brasil) por cinco minutos, lavados em água corrente e secos com gaze. Por fim, foram aleatoriamente divididos entre os grupos, conforme o Quadro 1.
Quadro 1: Delineamento experimental
GRUPOS TRATAMENTOS
CONT-P Sem clareamento prévio ao procedimento adesivo
CONT-N Clareamento com Peróxido de Hidrogênio 35% seguido de procedimento
adesivo imediato
ASCS-10 Clareamento com Peróxido de Hidrogênio 35%, aplicação de ascorbato de
sódio 10% por 5 min e procedimento adesivo imediato
GLUT-5 Clareamento com Peróxido de Hidrogênio 35%, aplicação de glutationa
5% por 5 min e procedimento adesivo imediato
GLUT-10 Clareamento com Peróxido de Hidrogênio 35% e aplicação de glutationa
10% por 5 min e procedimento adesivo imediato
O gel clareador utilizado foi o HP Maxx (FGM, Joinville, SC, Brasil), à base de peróxido de hidrogênio 35%. O agente clareador foi manipulado de acordo com as recomendações do fabricante, sendo três gotas de peróxido para uma gota do espessante e aplicado na superfície de esmalte dos blocos (1 mm), com exceção do grupo-controle positivo, durante 15 minutos. O gel foi aplicado três vezes, totalizando 45 minutos de ação do gel clareador sobre a superfície de esmalte. Ao fim do clareamento, os espécimes foram lavados com água destilada e imersos em saliva artificial (Quadro 2) e armazenados em estufa (Olidef CZ, Ribeirão Preto, SP, Brasil) a 37ºC durante uma semana.
Quadro 2: Composição da saliva artificial
SUBSTÂNCIAS FÓRMULA
MOLECULAR CONCENTRAÇÃO (g) Cloreto de cálcio dihidratado CaCl2.2H2O 1,5 mM (0,354g)
Fosfato de sódio dibásico
heptahidratado Na2HPO4. 7H2O 0,9 mM (0,241g) Cloreto de potássio KCl 0,15M (11,1825g)
Fluoreto de sódio NaF 0,05 ppm (500µl)
Água destilada Q.S.P
pH 7,0
Após uma semana, foi realizada uma segunda sessão do procedimento clareador, seguindo o mesmo protocolo. Ao final do clareamento, os espécimes foram lavados com água destilada e tiveram as soluções antioxidantes aplicadas. As soluções de ascorbato de sódio 10%, glutationa 5% e glutationa 10% foram aplicadas de forma passiva com pincéis descartáveis nas superfícies de esmalte previamente clareadas de acordo com os grupos ASCS-10, GLUT-5 e GLUT-10, respectivamente, durante cinco minutos8.
Procedimento Adesivo
Como o esmalte é o substrato em questão, optou-se por aplicar o sistema adesivo Adper Single Bond Universal (3M ESPE, Sumaré, SP, Brasil) através da técnica de condicionamento ácido do substrato. Dessa forma, seguindo as recomendações do fabricante, realizou-se o procedimento adesivo com condicionamento das superfícies de esmalte com ácido fosfórico 37% (Maquira, Maringá, PR, Brasil) durante 15 segundos, seguido de lavagem abundante por 15 segundos. As superfícies foram secas com jatos de ar e, então, uma única camada do sistema adesivo foi aplicada de forma ativa durante 15 segundos, com um leve jato de ar por cinco segundos, e fotoativação do adesivo por dez segundos. Utilizou-se a resina composta nanohíbrida Filtek Z350XT, cor A2B (3M, ESPE, Sumaré, SP, Brasil) em incrementos de 1 mm até a obtenção de uma camada de resina de 4 mm de espessura. Cada incremento foi fotoativado por 20 segundos, com exceção do último, que foi fotoativado por 40 segundos. Os espécimes foram imersos em saliva artificial e armazenados em estufa a 37ºC por 24 horas.
Teste de Grau de Conversão
foi analisada a média dos três pontos da interface adesiva; o espectro foi obtido sob a região de 1580-1660 cm-1, verificando a altura dos picos 1608 cm-1 e 1637 cm-1; o espectro do adesivo não polimerizado também foi utilizado como referência.
Teste de Resistência de União
Os espécimes foram seccionados em forma de palitos com áreas de secção transversal de aproximadamente 1 mm2, usando uma máquina de corte manual Isomet Low Saw (South Bay Technology Inc., Buehler, Lake Bluff, IL, EUA). Os palitos foram fixados pelas extremidades, em dispositivos apropriados para o ensaio, com adesivo à base de cianoacrilato (Super Bonder Flex Gel Control, Loctite, São Paulo, SP, Brasil) e testados sob força de tração, a uma velocidade de 0.5 mm/min, utilizando uma célula de carga de 500N, em uma máquina de ensaios universais EMIC (EMIC, São José dos Campos, SP, Brasil). As áreas de secção transversal de cada um dos espécimes foram mensuradas com o auxílio de um paquímetro digital (Mitutoyu, Suzano, SP, Brasil), e os valores individuais de resistência de união foram determinados em MPa. Falhas prematuras dos espécimes foram contabilizadas e utilizadas para a análise estatística dos dados.
Teste de Análise de Fratura
Os espécimes fraturados foram levados à lupa esterioscópica (Leica,Wetzlar, Alemanha) e as fraturas foram classificadas em: 1- adesiva: fratura na interface adesiva; 2- coesiva em esmalte: fratura totalmente em esmalte; 3- coesiva em resina: fratura totalmente em resina; e 4- mista: fratura parcialmente na interface adesiva e parcialmente coesiva em esmalte ou em resina.
Análise Estatística
RESULTADOS
Teste de Atividade Antioxidante
Os valores de médias e seus respectivos desvios-padrão estão descritos na Tabela 1.
Tabela 1: Médias e desvios-padrão dos grupos para o teste de atividade antioxidante por radical livre DPPH (%).
Grupos Média ± d.p. Comparações entre grupos
Água Destilada 1,8751 ± 0,2368 A
Ascorbato de Sódio 10% 0,2060 ± 0,0236 B
Glutationa 5% 0,9542 ± 0,1420 C
Glutationa 10% 0,8910 ± 0,0662 C
* Letras maiúsculas semelhantes entre si em uma mesma coluna representam a ausência de diferenças estatisticamente significantes entre si (p > 0,05).
Teste de Grau de Conversão
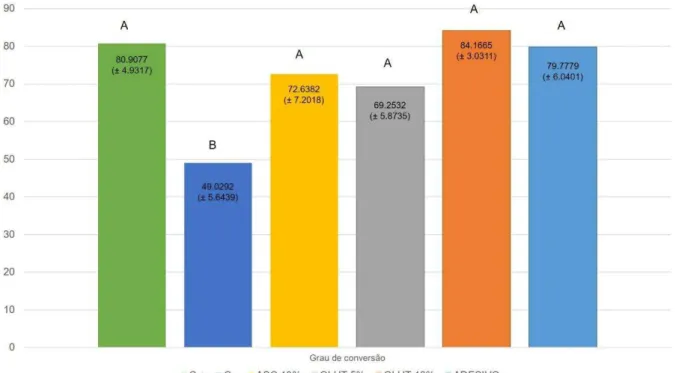
Os valores de médias e desvios-padrão estão expressos em % no Gráfico 1.
Gráfico 1: Médias e desvios-padrão do grau de conversão (%) dos monômeros adesivos.
Teste de Resistência de União
As médias dos valores de resistência de união, obtidas por meio dos ensaios de microtração para os diferentes grupos experimentais, e seus respectivos desvios-padrão estão expressos na Tabela 2.
Tabela 2: Médias e desvios-padrão dos grupos experimentais para o teste de resistência de união por microtração (MPa).
Grupos Média ± d.p. (n) Comparações entre grupos
C - 13,35 ± 7,18 (20) A
C + 24,44 ± 8,37 (18) B
ASC 10% 31,48 ± 14,37 (22) B C
GLUT 5% 40,76 ± 13,76 (21) C D
GLUT 10% 45,12 ± 8,00 (20) D
* Letras maiúsculas semelhantes entre si em uma mesma coluna representam a ausência de diferenças estatisticamente significantes entre si (p > 0,05).
Teste de Análise de Fratura
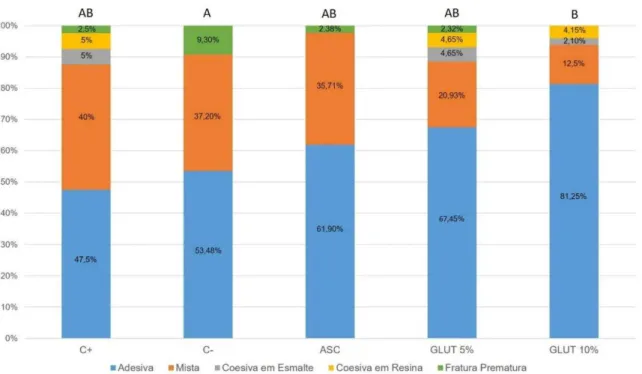
Os percentuais de modos de fratura em cada grupo encontram-se no Gráfico 2.
Gráfico 2: Percentual de cada tipo de fratura por grupo experimental.
DISCUSSÃO
A redução da resistência de união, após o clareamento dentário, é causada pela liberação de oxigênio residual e por radicais livres, oriundos da reação do agente clareador com as moléculas cromógenas, que interferem na infiltração do sistema adesivo ao esmalte tratado11, 18. Radicais livres são átomos, moléculas ou íons com elétrons não emparelhados que são altamente instáveis e reativos com outras moléculas24, 29. Esses radicais livres ficam retidos no interior e na superfície da estrutura dentária. Estudos9, 11, 12, 13, 15-19 mostram que esses radicais livres e o oxigênio residual inibem a polimerização da resina composta. Dessa forma, se o procedimento adesivo for realizado imediatamente após a aplicação do agente clareador, a interface adesiva pode ser prejudicada9.
Com o objetivo de diminuir o tempo de espera entre os processos de clareamento e restauração dentários, o uso de antioxidantes vem sendo estudado6, 9,11-13, 15, 16-22. Antioxidantes são moléculas com a capacidade de neutralizar radicais livres por aceitação ou doação de elétrons, eliminando a instabilidade do radical livre29. Dentre as substâncias antioxidantes já estudadas, tem-se o ascorbato de sódio9,11,13,16,17, o alfa-tocoferol6 e o bicarbonato de sódio 14,20-22. O ascorbato de sódio apresentou bons resultados8,12,15,17 para reverter os efeitos negativos dos agentes clareadores na resistência de união. No entanto, as soluções de ascorbato de sódio são instáveis, precisam ser estocadas em temperaturas entre 2-8ºC e estão sujeitas a rápida oxidação quando em contato com o ar22. Propôs-se a glutationa como uma alternativa de antioxidante, pois é o mais abundante tampão-redox em células mamíferas23 e, portanto, estável em solução aquosa.
O teste de atividade antioxidante pelo radical livre DPPH é baseado na premissa que um doador de hidrogênio é um antioxidante. Esse ensaio colorimétrico utiliza o radical livre DPPH, alterando a cor de roxa para amarelo claro na presença de um antioxidante24,28. Os resultados apontam que o ascorbato de sódio a 10% mostrou ter maior atividade antioxidante em comparação com ambas as concentrações de glutationa (5% e 10%). Acredita-se que seja devido ao principal substrato da glutationa ser o peróxido de hidrogênio27, enquanto o ascorbato de sódio é um eficiente limpador de ânions radicais superóxido, radicais peroxil e oxigênio isolado24. Dessa forma, acredita-se que a maior atividade antioxidante do ascorbato de sódio 10% se deve à sua melhor reação com radicais livres, como o DPPH.
estatisticamente semelhantes ao sistema adesivo isolado, levando a acreditar que as substâncias antioxidantes empregadas após a utilização do peróxido de hidrogênio a 35% possibilitaram adequada conversão dos monômeros presentes no sistema adesivo, diante da remoção do oxigênio residual.
Estudos testando resistência de união por microtração após aplicação de substâncias antioxidantes6, 8, 11, 17, 22 encontraram resultados semelhantes aos aqui apresentados. O ascorbato de sódio a 10% conseguiu reverter os efeitos deletérios dos agentes clareadores7 de forma que os valores de resistência de união retornassem a valores estatisticamente iguais ao grupo-controle positivo (C+). O tratamento do esmalte clareado com antioxidantes promove um aumento na resistência de união como resultado de uma efetiva reação do peróxido de hidrogênio 35% e o sal de ascorbato de sódio22. Na literatura, vários tempos de aplicação da solução de ascorbato de sódio foram testados, tais como períodos de 60 segundos6, cinco minutos16, dez minutos17, 15 minutos22 e seis horas12. Estudos recentes8, 22 demonstram que o tempo de aplicação de cinco minutos é suficiente para reduzir o agente clareador, pois o peróxido de hidrogênio reage rapidamente com o ascorbato de sódio.
As concentrações de glutationa estudadas (5% e 10%) mostraram recuperar a resistência de união do esmalte bovino tratado com peróxido de hidrogênio 35% a valores até superiores ao controle positivo (C+), descartando a hipótese nula do estudo que dizia que a glutationa, apesar de sua propriedade antioxidante, não seria capaz de recuperar a resistência de união do esmalte bovino ao compósito resinoso após o clareamento com peróxido de hidrogênio 35%. A glutationa tem como principal substrato o próprio peróxido de hidrogênio27, e acredita-se que foi capaz de neutralizar o agente clareador de forma a eliminar seu efeito deletério na resistência de união. Esses resultados não corroboram com o estudo de Nassar et al23, que mostra que a concentração de glutationa a 5% apresentou melhor resultado em recuperar os valores de resistência de união em comparação com a concentração de 10%.
Estudos de resistência de união confirmam que, em esmalte tratado com agente clareador, ocorrem predominantemente falhas do tipo adesiva18, 20, 21. No presente estudo, houve predominância de falhas do tipo adesiva em todos os grupos estudados, seguidas de falhas mistas. Ferreira et al30, em seu estudo, mostram que espécimes em formato de palitos distribuem as tensões da periferia e depois as direcionam para o centro da interface adesiva, aumentando a chance da ocorrência de falhas do tipo adesivas.
É importante ressaltar que, sempre que possível, deve-se postergar o procedimento adesivo pelo período de uma ou duas semanas após o clareamento13, visto que a resistência de união retorna a valores normais após esse período16. Outra razão para o adiamento do procedimento adesivo é permitir que haja tempo para a estabilização da cor, que pode alterar os resultados estéticos18. Porém, há situações em que procedimentos adesivos necessitam ser realizados imediatamente após o tratamento clareador21,22. Nesses casos, o uso da solução de glutationa 10% torna-se uma alternativa para que se possam realizar esses procedimentos imediatamente após o tratamento com agentes clareadores sem que haja prejuízo na resistência de união.
CONCLUSÕES
Com base na metodologia empregada e nos dados obtidos, pode-se concluir que:
1. o ascorbato de sódio 10% apresentou melhor atividade antioxidante em comparação com as concentrações de glutationa 5% e 10%;
2. a utilização de agentes antioxidantes após o tratamento de esmalte bovino clareado com peróxido de hidrogênio 35% mostrou não alterar o grau de conversão dos monômeros adesivos, inclusive apresentando valores estatisticamente iguais aos do sistema adesivo em união ou isoladamente;
3. a glutationa 10% proporcionou, no teste de resistência de união por microtração, médias estatisticamente superiores ao grupo-controle positivo (C+). Glutationa 5% mostrou-se estatisticamente igual ao ascorbato de sódio 10%. E o ascorbato de sódio 10% mostrou-se estatisticamente igual ao grupo-controle positivo (C+);
4. houve predominância de falhas do tipo adesiva em todos os grupos.
AGRADECIMENTOS
REFERÊNCIAS
1. Kwon SR, Wertz PW. Review of the mechanism of tooth whitening. Journal of Esthetic and Restorative Dentistry. 2015; 27(5): 240–257.
2. Kihn PW. Vital tooth whitening. Dent Clin N Am. 2007; 51(2): 319–331.
3. Sulieman MAM. An overview of tooth-bleaching techniques: chemistry, safety and efficacy. Periodontology 2000. 2008; 48(1): 148–169.
4. Carey CM. Tooth Whitening: What We Now Know. Journal of Evidence Based Dental Practice. 2014; 14:70–76.
5. Minoux M, Serfaty R. Vital tooth bleaching: Biologic adverse effects – A review. Quintessence International. 2008; 39(8): 645–659.
6. Sasaki RT, Flório FM, Basting RT. Effect of 10% Sodium Ascorbate and 10% α-tocopherol in Different Formulations on the Shear Bond Strength of Enamel and Dentin Submitted to a Home-use Bleaching Treatment. Operative Dentistry. 2009; 34(6): 746–752.
7. Alqahtani MQ. Tooth-bleaching procedures and their controversial effects: A literature review. The Saudi Dental Journal. 2014; 26: 33–46.
8. Freire A, Souza EM, Caldas DBM, Rosa EAR, Bordin CFW, Carvalho RM, et al. Reaction kinects of sodium ascorbate and dental bleaching gel. Journal of Dentistry. 2009; 37: 932– 936.
9. Whang HJ, Shin DH. Effects of applying antioxidants on bond strength of bleached bovine dentin. Restorative Dentistry & Endodontics. 2015; 40(1): 37–43.
10.Perdigão J. Baratieri LN, Arcari GM. Contemporary Trends and Techniques in Tooth Whitening: A Review. Pract Proced Aesthet Dent. 2004; 16(3): 185–192.
11.Berger SD, De Souza Carneiro RP, Guiraldo RD, Lopez MB, Pavan S, Giannini M, et al. Can green tea be used to reverse compromised bond strength after bleaching? European Journal of Oral Sciences. 2013; 121: 377–381.
12.Khoroushi M, Aghelinejad S. Effect of postbleaching application of an antioxidant on enamel bond strength of three different adhesives. Med Oral Patol Oral Cir Bucal. 2011; 16(7):e990–6.
13.Muraguchi K, Shigenobu S, Suzuki S, Tanaka T. Improvement of Bonding to Bleached Bovine Tooth Surfaces by Ascorbic Acid Treatment. Dental Materials Journal. 2007; 26(6): 875–881.
14.Torres CRG, Koga AF, Borges, AB. The effects of anti-oxidant agentes as neutralizers of bleaching agents on enamel bond strength. Braz J Oral Sci. 2006; 5(16): 971–976
15.Gökçe B, Çömlekoğlu ME, Özpinar B, Türkün M, Kaya AD. Effect of antioxidant treatment on bond strength of a luting resin to bleached enamel. Journal of Dentistry. 2008; 36(10): 780–785.
17.Güler E, Gönülol N, Özyilmaz ÖY, Yücel AÇ. Effect of sodium ascorbate on the bond strength of silorane and methacrylate composites after vital bleaching. Braz Oral Res. 2013; 27(4): 299–304.
18.Briso ALF, Rahal V, Sundfeld RH, dos Santos PH, Alexandre RS.Effect os Sodium Ascorbate on Dentin Bonding After Two Bleaching Techniques. Operative Dentistry. 2014; 39(2): 195–203.
19.Arcari GM, Araújo É, Baratieri LN, Lopes GC. Microtensile Bond Strength of a Nanofilled Composite Resin to Human Dentin after Nonvital Tooth Bleaching. The Journal of Adhesive Dentistry. 2007; 9(3): 333–340.
20.Tostes BO, Mondelli RFL, Lima-Arsati YBO, Rodrigues JÁ, Costa LC. The effect of baking soda when applied to bleached enamel prior to restorative treatment. General Dentistry. 2013; 61(5): e5–9.
21.Alencar MS, Bombonatti JFS, Maensono RM, Soares AFS, Wang L, Mondelli RFL. Effect of Two Antioxidants Agents on Microtensile Bond Strength to Bleached Enamel. Braz Dental Journal. 2016; 27(5): 532–536.
22.Svizero NR, Romani lac, Soares IBL, Moraes JE, Agulhari MAS, et al. Effects of neutralizing or antixodant agents on the consequences induced by enamel bleaching agents in immediate resin composite restorations. Journal of Adhesion Science and Technology. 2017; 31(9): 965–976.
23.Nassar M, Hiraishi N, Islam MS, Tamura Y, Otsuki M, et al. The effect of glutathione on 2-hydroxyethylmethacrylate cytotoxicity and resin-dentine bond strength. International Endodontic Journal. 2014; 47(7): 652–658.
24.Carocho M, Ferreira ICFR. A review on antioxidants, prooxidants and related controversy: Natural and synthetic compound, screening and analysis methodologies and future perspectives. Food and Chemical Toxicology. 2013; 51: 15–25.
25.Huber PC, Almeida WP, Fátima Â. Glutationa e enzimas relacionadas: papel biológico e importância em processos patológicos. Quim Nova. 2008; 31(5): 1170–1179.
26.Thompson JA, Franklin CC. Enhanced glutathione biosynthetic capacity promotes resistence to As3+-induced apoptosis. Toxicology Letters. 2010; 193(1): 33–40.
27.Júnior LR, Höehr, Vellasco AP, Kobuta LT. Sistema antioxidante envolvendo o ciclo metabólico da glutationa associado a métodos eletroanalíticos na avaliação do estresse oxidativo. Quim Nova. 2001; 24(1): 112–119.
28. Garcia EJ, Oldoni TLC, Alencar SM, Reis A, D. Loguercio A, Grande RHM. Antioxidant Activity by DDPH Assay of Potencial Solutions to be Applied on Bleached Teeth. Braz Dent J. 2012; 23(1): 22–27.
29. Lü JM, Lin PH, Yao Q, Chen C. Chemical and molecular mechanisms of antioxidant: experimental approaches and model systems. J Cell Mol Med. 2010; 14(4): 840–860.
CONCLUSÃO
ALENCAR MS, BOMBONATTI JFS, MAENSONO RM, SOARES AFS, WANG L, MONDELLI RFL. Effect of Two Antioxidants Agents on Microtensile Bond Strength to Bleached Enamel. Braz Dental Journal. v.27, n.5, p. 532–536, 2016.
ATTIN T, HANNIG C, WIEGAND A, ATTIN R. Effect of bleaching on restorative materials and restorations – a systematic review. Dental Materials. v.20, p. 852 – 861, 2004.
BAGHEL SS, SHRIVASTAVA N, BAGHEL RG, AGRAWAL P, RAJPUT S. A review of quercetin: antioxidant and anticancer properties. World Journal of Pharmacy and Pharmaceutical Sciences. v.1, n.1, p. 146-160, 2012.
BARGHI N, GODWIN JM. Reducing the adverse effect of bleaching on composite-enamel bond. J Esthet Dent. v.6, n.4, p. 157-61,1994
BERGER SB, CARREIRA RPS, GUIRALDO RD, LOPES MB, PAVAN S, GIANINNI M, BEDRAN-RUSSO AK. Can green te abe used to reserve compromised bond strength after bleaching? Eur J Oral Sci. v. 121, p. 377-381, 2013.
BRISO ALF, RAHAL V, SUNDFELD RH, DOS SANTOS PH, ALEXANDRE RS. Effect of sodium ascorbate on dentin bonding after two bleaching techniques. Operative Dentristy. v.39, n.2, p. 195-203, 2014.
CADENARO M, BRESCHI L, ANTONIOLLI F, MAZZONI A, LENARDA R. Influence of whitening on the degree of conversion dental adhesives on dentin. Eur J Oral Sci. v.114, p. 257-262, 2006.
CAREY CM. Tooth whitening: What we now know. J Evid Base Dent Pract. v.14, n.1, p. 70-76, 2014.
FÉLIZ-MATOS L, HERNÁNDEZ LM, ABREU N. Dental bleaching techniques; hydrogen-carbamide peroxides and light sources for activation, an update. Mini review article. The Open Dentistry Journal. v. 8, p. 264-268, 2014.
GÖKÇE B, COMLEKOGLU ME, OZPINAR B, TURKUN M, KAYA AD. Effect of antioxidant treatment on bond strength of a luting resin to bleached enamel. J Dent. v.36, n.10, p. 780-5, 2008.
GÜLER E, GÖNÜLOL N, ÖZYILMAZ ÖY, YÜCEL AÇ. Effect of sodium ascorbate on the bond strength of silorane and metacrylate coposites after vital bleaching. Braz Oral Res. v.27, n.4, p. 299-304, 2013.
HANSEN JR, FRICK KJ, WLAKER MP. Effect of 35% sodium ascorbate treatment on microtensile bond strength ofter nonvital bleaching. JOE. v.40, n.10, p. 1668-1670, 2014.
HUBER PC, ALMEIDA WP, FÁTIMA Â. Glutationa e enzimas relacionadas: papel biológico e importância em processos patológicos. Quim Nova. v.31, n.5, p. 1170–1179, 2008.
JOINER A. Review of the effects of peroxide on enamel and dentine properties. J Dent.v.35, n.12, p.889-96, 2007.
JOINER A. The bleaching of teeth: a review of the literature. J Dent. v.34 , n.7, p. 412-9, 2006.
JÚNIOR LV, HÖEHR NF, VELLASCO AP. Sistema antioxidante envolvendo o ciclo metabólico da glutationa associado a métodos eletroanalíticos na avaliação do estresse oxidativo. Quim Nova. v.24, n.1, p. 112-119, 2001.
KHIN P. Vital tooth whitening. Dent Clin N Am. v.57, p.319-331, 2007.
KWON SR, WERTZ PW. Review of the mechanism of tooth whitening. Journal of Esthetic and Restorative Dentistry. v.27, n.5, p. 240-257, 2015.
MINOUX M, SERFATY R. Vital tooth bleaching: Biologic adverse effects – A review. Quintessence International. v.39, n.8, p. 645–659, 2008.
MURAGUCHI K, SHIGENOBU S, SUZUKI S, TANAKA T. Improvement of bonding to bleached bovine tooth surfaces by ascorbic acid treatment. Dent Mater. v.26, n.6, p. 875-81, 2007.
NASSAR M, HIRAISHI N, ISLAM MS, OTSUKI M, KASUGAI S, OHYA K, TAGAMI J, TAY FR. The effect of gluthatione on 2-hydroxyethylmetaxcrylate cytotoxicity and on resin-dentine bond strength. Internacional Endodontic Journal. v.47, p. 652-658, 2014.
NASSAR M, HIRAISHI N, SHIMOKAWA H, TAMURA Y, OTSUKI M, KASUGAI S, OHYA K, TAGAMI J. The inhibition effect of non-protein thiols on dentinal matrix metallopoteinases activity and HEMA citotoxiticy. Journal of Dentistry. v.42, p. 312-318, 2014.
PERDIGÃO J, BARATIERI LN, ARCARI GM. Contemporary trends and techniques in tooth whitining: a review. Pract Proced Aesthet Dent. v. 16, n.3, p. 185-192, 2004.
SULIEMAN MA. An overview of tooth-bleaching techniques: chemistry, safety and efficacy. Periodontol 2000. v.48, p.148-69, 2008.
THOMPSON JA, FRANKLIN CC. Enhanced gluthatione biosynthetic capacity promotes resistance to As3+ - induced apoptosis. Toxicology Letters. v.193, p. 33-40, 2010.
TITLEY KC, TORNECK CD, RUSE ND. The effect of carbamide-peroxide gel on the shear bond strength of a microfil resin to bovine enamel. J Dent Res. v.71, n.1, p. 20-4, 1992.
ANEXO A – Artigo 46 do Regimento Interno do Programa de Pós-Graduação em Odontologia da Universidade Federal do Ceará
Art. 46 – As dissertações e as teses apresentadas ao Programa de Pós-Graduação em Odontologia da Universidade Federal do Ceará poderão ser produzidas em formato alternativo ou tradicional. O formato alternativo estabelece: a critério do orientador e com a aprovação da Coordenação do Programa, que os capítulos poderão conter cópias de artigos e/ou relatórios de patentes de autoria ou coautoria do candidato, publicados ou submetidos para publicação em revistas científicas, escritos no idioma exigido pelo veículo de divulgação.
§1º - O orientador e o candidato deverão verificar junto às editoras a possibilidade de inclusão dos artigos na dissertação ou tese, em atendimento à legislação que rege o direito autoral, obtendo, se necessária, a competente autorização, deverão assinar declaração de que não estão infringindo o direito autoral transferido à editora.
§2º - A dissertação e a tese em formatos tradicionais ou formatos alternativos deverão seguir as normas preconizadas pelo Guia para Normalização de Trabalhos Acadêmicos da Biblioteca Universitária disponível no sítio http://www.biblioteca.ufc.br. As partes específicas do formato alternativo deverão ser feitas em concordância com o Manual de Normalização para Defesa de dissertação de Mestrado e tese de Doutorado no formato Alternativo do PPGO, disponível no sítio http://www.ppgo.ufc.br.
§3º - As dissertações defendidas no formato alternativo deverão constar de, no mínimo, 01(um) capítulo, enquanto que as teses no mesmo formato deverão constar de, no mínimo, 02 (dois) capítulos.
ANEXO B - instruções aos autores para submissão de manuscrito ao periodico Journal of Applie Oral Science.
Form and preparation of manuscripts 1. Presentation of the Manuscript 1.1 Structure of the manuscript
Cover page (must be submitted as a supplementary file through the online submission system) which should contain only:
Title of the manuscript in English.
Names of the authors in direct order with their respective degrees and affiliations in English.
Full address of the corresponding author, to whom all correspondence should be addressed, including fax and phone number as well as e-mail address.
1.2 Text
The paper must be previously translated or reviewed by professional or company responsible for English language. The costs of this service will be under the authors’ responsibility. Authors with English as native language must submit as supplementary file a signed letter taking responsibility for the quality of the English language and editing of the text.
Title of the manuscript and subtitle, if necessary, in English.
Abstract: should comprise at most 300 words, highlighting a little introduction, objective, material and methods, results and conclusions.
Key words: (words or expressions that identify the contents of the manuscript). The authors are referred to the list of subjects of the "lndex Medicus" and DeCS (Health Sciences Descriptors available at http://decs.bvs.br/I/homepagei.htm/). Authors must use periods to separate the key words, which must have the first letter of the first word in capital letters. Ex: Dental implants. Fixed prosthesis. Photoelasticity. Passive fit. Introduction: summary of the rationale and proposal of the study including only proper
references. It should clearly state the hypothesis of the study.
Material and Methods: the material and the methods are presented with enough detail to allow confirmation of the findings. Include city, state and country of all manufacturers right after the first appearance of the products, reagents or equipments. Published methods should be referred to and briefly discussed, except if modifications were made. Indicate the statistical methods employed, if applicable. Please refer to item 3 for ethical principals and registration of clinical trials.
Results: presents the outcomes in a logical sequence in the text, tables and illustrations. Data contained in tables and illustrations should not be repeated in the text, and only important findings should be highlighted.
Acknowledgments (when appropriate). Acknowledge those who have contributed to the work. Specify sponsors, grants, scholarships and fellowships with respective names and identification numbers.
References (please refer to item 2.3)
2. Technical normalization
The manuscript should be typed as follows: 1.5 spacing in 11 pt Arial font, with 3-cm margins at each side, on an A4 page, adding up to at most 15 pages, including the illustrations (graphs, photographs, tables, etc). The authors should keep a copy of the manuscript for possible requests.
2.1 Illustrations and Tables
2.1.1 The illustrations (photographs, graphs, drawings, charts, etc.), regarded as figures, should be limited to the least amount possible and should be uploaded in separate files, consecutively numbered with Arabic numbers according to the order they appear in the text.
2.1.2 Photographs should be sent in original colors and digitized in .jpg or tif formats with at least 10 cm width and at least 300 dpi. These illustrations should be provided in supplementary files and not inserted in the Word document.
2.1.3 The corresponding legends for figures should be clear, concise and typed at the end of the manuscript as a separate list preceded by the corresponding number.
2.1.4 The tables should be logically arranged, consecutively numbered with Arabic numbers. The legend shall be placed on the top of the tables. Tables should be open in the right and left laterals.
2.1.5 Footnotes should be indicated by asterisks and restricted to the least amount possible.
2.2 Citation of the Authors
Citation of the authors in the text may be performed in two manners:
1) Just numeric: " and interfere with the bacterial system and tissue system 3,4,7-10". References must be cited in a numeric ascending order within the paragraph.
2) or alphanumeric
one author - Silva23 (1986)
two authors - Silva and Carvalho25 (1987)
three authors - Ferreira, Silva and Martins27 (1987)
more than three authors- Silva, et al.28 (1988)
2.3 References
The references must follow the "Uniform requirements for manuscripts submitted to Biomedical Journals - Vancouver" available
at: http://www.nlm.nih.gov/bsd/uniform_requirements.html.
2.3.1 All references must be cited in the text. They should be alphabetically ordered by the last name of the author and numbered in increasing order accordingly. The order of citation in the text should follow these numbers. Abbreviations of the titles of the international journals cited should follow the Index Medicus/MEDLINE.
2.3.2 Personal communications and unpublished data with no publication date must not be included in the reference list.
2.3.3 Abstracts, monographs, dissertations and theses will not be accepted as references.
2.3.4 The names of all authors should be cited up to 6 authors; in case there are more authors, the 6 first authors should be cited, followed by the expression ", et al.", which must be followed by "period" and should not be written in italics. Ex: Uhl, et al.
2.3.5 At most 30 references may be cited, except for invited reviews by the Editor-in-Chief.
Examples of references:
Book
Melberg JR, Ripa LW, Leske GS. Fluoride in preventive dentistry: theory and clinical applications. Chicago: Quintessence; 1983.
Book chapter
Verbeeck RMH. Minerals in human enamel and dentin. ln: Driessens FCM, Woltgens JHM, editors. Tooth development and caries. Boca Raton : CRC Press; 1986. p.95-152.
Papers published in journals
Wenzel A, Fejerskov O. Validity of diagnosis of questionable caries lesions in occlusal surfaces of extracted third molars. Caries Res. 1992;26:188-93.
Papers with more than 6 authors
The first 6 authors are cited, followed by the expression ", et al."
Parkin DM, Clayton D, Black RJ, Masuyer E, Friedl HP, Ivanov E, et al. Childhood - leukemia in Europe after Chernobyl : 5 years follow-up. Br J Cancer.
1996;73:1006-12.
Seeing nature through the lens of gender. Science. 1993;260:428-9.
Volume with supplement and/or Special Issue
Davisdson CL. Advances in glass-ionomer cements. J Appl Oral Sci. 2006;14(sp. Issue):3-9.
Entire issue
Dental Update. Guildford 1991;18(1).
ANEXO C - Gráfico 1: Médias e desvios padrão do grau de conversão dos monômeros adesivos.