UFOP - CETEC - UEMG
REDEMAT
R
EDET
EMÁTICA EME
NGENHARIA DEM
ATERIAISUFOP – CETEC – UEMG
Dissertação de Mestrado
"Estudo Experimental da Difusão do Manganês em
Óxido de Cromo Sintético e em Óxido de Cromo
formado por Oxidação”
Autor: Luís Carlos Borges
Orientador: Prof. Dr. Antônio Claret Soares Sabioni
Co-Orientadora: Prof
aDra. Anne-Marie Huntz
UFOP - CETEC - UEMG
REDEMAT
R
EDET
EMÁTICA EME
NGENHARIA DEM
ATERIAISUFOP – CETEC – UEMG
Luís Carlos Borges
"Estudo Experimental da Difusão do Manganês em Óxido de
Cromo Sintético e em
Óxido de Cromo formado por Oxidação”
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Engenharia de Materiais da REDEMAT, como parte integrante dos requisitos para a obtenção do título de Mestre em Engenharia de Materiais.
Área de concentração: Caracterização e Seleção de Materiais
Orientador:
Prof. Dr.
Antônio Claret Soares Sabioni
Co-Orientadora: Profa. Dra. Anne-Marie Huntz
ii
SUMÁRIO
AGRADECIMENTOS
v
LISTA DE FIGURAS
vi
LISTA DE TABELAS
x
RESUMO
xi
ABSTRACT
xii
CAPÍTULO 1 - INTRODUÇÃO
1CAPÍTULO 2 - OBJETIVOS
4CAPÍTULO 3 - REVISÃO BIBLIOGRÁFICA
53.1 - Defeitos Pontuais em óxidos 5
3.1.1- Reações de formação de defeitos Pontuais 7 3.1.2 - Concentração de Defeitos em Equilíbrio 8
3.2 - Teoria da Difusão em Sólidos 9
3.2.1 - Descrição Macroscópica da Difusão – Leis de Fick 10 3.2.2 - Relação entre Defeitos Pontuais e Difusão 13 3.2.3 - Influência da Temperatura e da pO2 sobre o Coeficiente de Difusão 15
3.2.4 -Tipos de Difusão 18
3.2.5 - Auto difusão e Heterodifusão 18
iii
3.3 - Difusão em Contornos de Grão 24
3.3.1 - Tipos de Cinética de Difusão Intergranular 25 3.3.2 - Determinação do Coeficiente de Difusão Intergranular 27
3.4 - Propriedades do Cr2O3 33
3.5 - Defeitos Pontuais e Difusão no Cr2O3 34
3.6 - Formação de Filme de Cr2O3 por oxidação 35
3.7 - Relação da Difusão Atômica com a oxidação 36
3.8 - Análise dos Perfis de Difusão por SIMS 38
3.9 - Estado da arte sobre a auto e heterodifusão catiônica e aniônica no Cr2O3 42
3.9.1 - Difusão do manganês no Cr2O3 45
CAPÍTULO 4 - MATERIAIS E MÉTODOS
484.1 - Materiais 48
4.1.1 - Preparação das Amostras 48
4.2 - Corte e Polimento das Amostras 49
4.3 - Caracterização Microestrutural do Cr2O3 50
4.4 - Experiências de Difusão 52
4.4.1 - Preparação do filme metálico 52
4.4.2 - Tratamento Térmico de Difusão 53
iv
CAPÍTULO 5 - RESULTADOS E DISCUSSÃO
555.1 – Det erminação dos Coeficientes de Difusão do Manganês no Cr2O3 55
i) Introdução 55
ii) Determinação dos coeficientes de difusão em volume 66 iii) Determinação dos coeficientes de difusão em contornos de grão 75 5.2 - Efeito da microestrutura e da temperatura sobre a difusividade do Manganês 84
5.3 - Dificuldades encontradas nas análises SIMS 84
5.4 -Comparação dos coeficientes de difusão obtidos com os de trabalhos anteriores 85
CAPÍTULO 6 - CONCLUSÕES
956.1 – Sugestões para trabalhos futuros 96
v
AGRADECIMENTOS
Desejo expressar os mais sinceros agradecimentos às pessoas que me ajudaram na concretização deste trabalho, em particular:
Ao orientador Prof. Dr. Antônio Claret Soares Sabioni, que me iniciou e propiciou conhecimentos na área de difusão em sólidos, tornando possível à realização desse trabalho.
À Profa. Dra. Maria Auxiliadora Neves Nogueira e ao Prof. Dr. André Cota pelo apoio, incentivo e colaboração nas discussões técnicas.
Aos profissionais da Universidade de Paris, que colaboraram na realização das análises pela técnica de Espectrometria de Massa de Íons Secundários (SIMS), sem os quais não seria possível a realização desse trabalho.
Aos professores, colegas e funcionários da REDEMAT.
Aos amigos do Laboratório de Difusão em Materiais.
Ao Vanderley e a sua equipe de trabalho de Departamento de Microscopia do DEGEO/UFOP pela realização das análises de microestruturas das amostras por MEV.
Ao pessoal do CDTN, pelo apoio e disponibilidade de seus laboratórios, em especial a Dra. Ana Maria e ao Dr. Wilmar.
vi
LISTA DE FIGURAS
Figura 3.1 - Defeito Schottky em um cristal iônico 6
Figura 3.2 - Defeito Frenkel em um cristal iônico 6
Figura 3.3 - Difusão unidimensional em regime transitório 12 Figura 3.4 - Energia Potencial associada ao salto de um átomo 16
Figura 3.5 - Mecanismos de Difusão 20
Figura 3.6 - Cinética de difusão no regime do tipo A 26
Figura 3.7 - Cinética de difusão no regime do tipo B 26
Figura 3.8 - Cinética de difusão no regime do tipo C 27
Figura 3.9 - Modelo de Fisher para contorno de grão 29
Figura 3.10 - Modelo de contornos de grãos (Suzuoka) 31 Figura 3.11 - Curva de cinética de oxidação do filme de Cr2O3 38
Figura 3.12 - Esquema de um SIMS CAMECA 4F 40
Figura 4.1 - Politriz Phoenix utilizada no polimento das amostras 50 Figura 4.2 - Microscopia óptica do Cr2O3 sintético 51 Figura 4.3 - Micrografia do filme de Cr2O3 obtida por MEV 52 Figura 4.4 - Evaporadora Edwards utilizada na preparação do filme metálico 54 Figura 4.5 - Forno programável com atmosfera controlada utilizado nos
experimentos de difusão
54
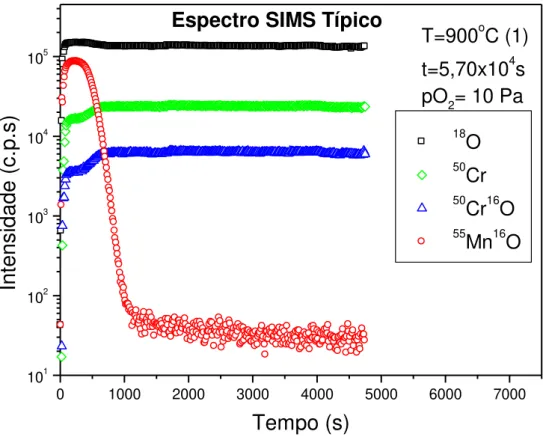
Figura 5.1 - Espectro SIMS típico de uma amostra sintético de Cr2O3 sintética, após a difusão do manganês à 900oC
56
Figura 5.2 - Perfil de difusão do 55Mn em amostra de Cr2O3 sintético, após a difusão à 900oC(amostra 1)
59
Figura 5.3 - Perfil de difusão do 55Mn em amostra de Cr2O3 sintético, após a difusão à 900oC(amostra 2)
59
Figura 5.4 - Perfil de difusão do 55Mn no Cr2O3 sintético após a difusão à 1000oC 60 Figura 5.5 - Perfil de difusão do 55Mn no Cr2O3 sintético após a difusão à 1100oC
(amostra 1)
61
Figura 5.6 - Perfil de difusão do 55Mn no Cr2O3 sintético após a difusão à 1100oC (amostra 2)
vii
Figura 5.7 Perfil de difusão do 55Mn em amostra de filme de Cr2O3, após a difusão à 700oC (amostra 1).
62
Figura 5.8 Perfil de difusão do 55Mn em amostra de filme de Cr2O3, após a difusão à 700oC (amostra 2).
62
Figura 5.9 Perfil de difusão do 55Mn em amostra de filme de Cr2O3, após a difusão à 766oC (amostra 1).
63
Figura 5.10 Perfil de difusão do 55Mn em amostra de filme de Cr2O3, após a difusão à 766oC (amostra 2).
63
Figura 5.11 Perfil de difusão do 55Mn em amostra de filme de Cr2O3, após a difusão à 832oC (amostra 1).
64
Figura 5.12 Perfil de difusão do 55Mn em amostra de filme de Cr2O3, após a difusão à 832oC (amostra 2).
64
Figura 5.13 Perfil de difusão do 55Mn em amostra de filme de Cr2O3, após a difusão à 900oC (amostra 1).
65
Figura 5.14 Perfil de difusão do 55Mn em amostra de filme de Cr2O3, após a difusão à 900oC (amostra 2).
65
Figura 5.15 - Perfil de difusão (lnC versus x2), com ajuste linear, para o cálculo do coeficiente de difusão em volume D, após difusão à 900oC (amostra 1)
67
Figura 5.16 - Perfil de difusão (lnC versus x2), com ajuste linear, para o cálculo do coeficiente de difusão em volume D, após difusão à 900oC (amostra 2)
67
Figura 5.17 - Perfil de difusão (lnCversus x2), com ajuste linear, para o cálculo do coeficiente de difusão em volume D, após difusão à 1000oC
68
Figura 5.18 - Perfil de difusão (lnC versus x2), com ajuste linear, para o cálculo do coeficiente de difusão em volume D, após difusão à 1100oC (amostra 1)
69
Figura 5.19 - Perfil de difusão (lnC versus x2), com ajuste linear, para o cálculo do coeficiente de difusão em volume D, após difusão à 1100oC (amostra 2)
69
Figura 5.20 - Perfil de difusão (lnC versus x2), com ajuste linear, para o cálculo do coeficiente de difusão em volume D, após difusão à 700oC (amostra 1)
70
Figura 5.21 - Perfil de difusão (lnC x versus 2), com ajuste linear, para o cálculo do coeficiente de difusão em volume D, após difusão à 700oC (amostra 2
70
Figura 5.22 - Perfil de difusão (lnC versus x2), com ajuste linear, para o cálculo do coeficiente de difusão em volume D, após difusão à 766oC (amostra 1)
viii
Figura 5.23 - Perfil de difusão (lnC versus x2), com ajuste linear, para o cálculo do coeficiente de difusão em volume D, após difusão à 766oC (amostra 2)
71
Figura 5.24 - Perfil de difusão (lnC versus x2), com ajuste linear, para o cálculo do coeficiente de difusão em volume D, após difusão à 832oC (amostra 1)
72
Figura 5.25 - Perfil de difusão (lnC versus x2), com ajuste linear, para o cálculo do coeficiente de difusão em volume D, após difusão à 832oC (amostra 2)
72
Figura 5.26 - Perfil de difusão (lnC versus x6/5), com ajuste linear, do 55Mn no Cr2O3 sintético, após difusão à 900oC (amostra 1)
73
Figura 5.27 - Perfil de difusão (lnC versus x6/5), com ajuste linear, do 55Mn no Cr2O3 sintético, após difusão à 900oC (amostra 2)
73
Figura 5.28 - Perfil de difusão (lnC versus x6/5), com ajuste linear, do 55Mn no Cr2O3 sintético, após difusão à 900oC (amostra 1)
76
Figura 5.29 - Perfil de difusão (lnC versus x6/5), com ajuste linear, do 55Mn no Cr2O3 sintético, após difusão à 900oC (amostra 2)
76
Figura 5.30 - Perfil de difusão (lnC versus x6/5), com ajuste linear, do 55Mn no Cr2O3 sintético, após difusão à 1000oC
77
Figura 5.31 - Perfil de difusão (lnC versus x6/5), com ajuste linear, do 55Mn em filmes de Cr2O3, após difusão à 1100oC (amostra 1)
78
Figura 5.32 - Perfil de difusão (lnC versus x6/5), com ajuste linear, do 55Mn em filmes de Cr2O3, após difusão à 1100oC (amostra 2)
78
Figura 5.33 - Perfil de difusão (lnC versus x6/5), com ajuste linear, do 55Mn em filmes de Cr2O3, após difusão à 700oC (amostra 1)
79
Figura 5.34 - Perfil de difusão (lnC versus x6/5), com ajuste linear, do 55Mn em filmes de Cr2O3, após difusão à 700oC (amostra 2)
79
Figura 5.35 - Perfil de difusão (lnC versus x6/5), com ajuste linear, do 55Mn em filmes de Cr2O3, após difusão à 766oC (amostra 1)
80
Figura 5.36 - Perfil de difusão (lnC versus x6/5), com ajuste linear, do 55Mn em filmes de Cr2O3, após difusão à 766oC (amostra 2)
80
Figura 5.37 - Perfil de difusão (lnC versus x6/5), com ajuste linear, do 55Mn em filmes de Cr2O3, após difusão à 832oC (amostra 1)
81
Figura 5.38 - Perfil de difusão (lnC versus x6/5), com ajuste linear, do 55Mn em filmes de Cr2O3, após difusão à 832oC (amostra 2)
ix
Figura 5.39 - Perfil de difusão (lnC versus x6/5), com ajuste linear, do 55Mn em filmes de Cr2O3, após difusão à 900oC (amostra 1)
82
Figura 5.40 - Perfil de difusão (lnC versus x6/5), com ajuste linear, do 55Mn em filmes de Cr2O3, após difusão à 900oC (amostra 2)
82
Figura 5.41 - Diagrama de Arrhenius mostrando a comparação entre coeficientes de difusão em Volume para 55Mn no Cr2O3
88
Figura 5.42 - Diagrama de Arrhenius mostrando a comparação entre coeficientes de difusão em Contornos de grão para 55Mn no Cr2O3
88
Figura 5.43 - Comparação entre a difusão em volume para os cátions de Mn, Cr e Fe no Cr2O3 sintético.
89
Figura 5.44 - Comparação entre a difusão contornos de grão para os cátions de Mn, Cr e Fe no Cr2O sintético.
89
Figura 5.45 - Comparação entre a difusão em volume para os cátions de Mn, Cr e Fe no Cr2O3 sintético.
90
Figura 5.46 - Comparação entre a difusão em contornos de grão para os cátions de Mn, Cr e Fe no Cr2O3 (Filme).
90
Figura 5.47 - Comparação entre a difusão em volume dos cátions Mn e Fe no Cr2O3 em três temperaturas (900, 1000 e 1100oC).
91
Figura 5.48 - Comparação entre a difusão em contornos de grão para os cátions Mn e Fe no Cr2O3 em três temperaturas (900, 1000 e 1100oC).
91
Figura 5.49 - Comparação entre a difusão em volume dos cátions Mn e Fe no Cr2O3 (FILME)
92
Figura 5.50 - Comparação entre a difusão em Contornos de Grão dos cátions Mn e Fe no Cr2O3 (FILME)
92
Figura 5.51 - Comparação entre os coeficientes de difusão em volume e em contornos de grão medidos em amostras sintéticas de Cr2O3.
93
Figura 5.52 - Comparação entre os coeficientes de difusão em volume e em contornos de grão medidos em filmes de Cr2O3.
93
Figura 5.53 - Comparação entre os coeficientes de difusão em volume medidos no Cr2O3 sintético e em filmes de Cr2O3.
94
Figura 5.54 - Comparação entre os coeficientes de difusão em contornos de grão medidos no Cr2O3 sintético e em filmes de Cr2O3.
x
LISTA DE TABELAS
Tabela 5.1 - Dados para os cálculos da taxa de erosão nas amostras sintéticas policristalinas de Cr2O3
57
Tabela 5.2 - Dados para os cálculos da taxa de erosão nas amostras de filmes de Cr2O3 obtidos por oxidação
57
Tabela 5.3 - Coeficientes de difusão em volume do manganês nas amostras sintéticas de Cr2O3 policristalino
74
Tabela 5.4 - Coeficientes de difusão em volume do manganês nas amostras de filmes de Cr2O3 obtidos por oxidação da liga 70%Ni-30%Cr
74
Tabela 5.5 - Coeficientes de difusão em contornos de grão do manganês nas amostras sintéticas de Cr2O3 policristalino
83
Tabela 5.6 - Coeficientes de difusão em contornos de grão do manganês nas amostras de filmes de Cr2O3 obtidos por oxidação da liga 70%Ni-30%Cr
83
xi
RESUMO
Neste trabalho foi feita a determinação experimental da difusão do manganês no Cr2O3 sintético policristalino de alta densidade, obtido por prensagem a quente, e em filmes de Cr2O3 crescidos sobre a liga 70%Ni-30%Cr. A difusão do manganês foi realizada a partir de um filme superficial fino em um meio semi-infinito e, os perfis de difusão foram determinados por espectrometria de massa de íons secundários (SIMS).
As experiências de difusão foram realizadas na faixa de 800-1100 oC para amostras policristalinas sintéticas e entre 700-900oC para amostras na forma de filmes obtidos por oxidação, sob pressão parcial de oxigênio 10Pa 10-4 atm.
Através da comparação direta entre os valores das difusividades dos cátions manganês e ferro obtidos, rigorosamente sob as mesmas condições experimentais, verificou-se que difusividade em volume do manganês nas amostras policristalinas de Cr2O3 foi maior, em torno de uma ordem de grandeza, quando comparada com a difusividade do Fe. Já para as amostras de Cr2O3 na forma de filmes essa diferença variou de uma até quatro ordens de grandeza, tanto no volume como nos contornos de grão.
A difusividade do manganês tanto nas amostras policristalinas como nas de filme, foi quatro ordens de grandeza maior nas regiões de contornos de grão do que no volume. Essa grande diferença entre esses dois tipos de difusividades indica que provavelmente os contornos de grão constituem uma via preferencial para a difusão do manganês nessas amostras.
xii
ABSTRACT
In this work it was made the experimental determination of the diffusion of the manganese in Cr2O3 synthetic polycrystals of high density, obtained by hot pressing, and in films of grown Cr2O3 on the alloy 70%Ni-30%Cr. The diffusion of the manganese was accomplished starting from a fine superficial film in a semi-infinite middle and, the diffusion profiles were certain for secondary ion mass spectrometry (SIMS).
The diffusion experiences were accomplished in the temperature range 800-1100 0C for samples synthetic polycrystals in the temperature range 700-900 0C for samples in the
form of films obtained by oxidation, under partial pressure of oxygen equal to 10Pa 10-4 atm.
Through the direct comparison between the values of the diffusion coefficient of the cations manganese and iron obtained, strictly under the same experimental conditions, it was verified that in bulk diffusion coefficient of the manganese in the samples polycrystals of Cr2O3 was larger, around an order of greatness, when compared with the diffusion coefficient of the cation iron. Already for the samples of Cr2O3 in the form of films that difference varied from one to four orders of greatness, in bulk and in the grain boundaries.
The diffusion cofficient of the so much manganese in the samples polycrystals as in the one of film, it was four orders of larger greatness in the areas of grain boundaries than in bulk. That great difference among those two diffusion types indicates that the grain boundaries probably constitute a preferential road for the diffusion of the manganese in those samples.
1
CAPÍTULO 1 - INTRODUÇÃO
Uma das principais causas de degradação de materiais e de equipamentos na área industrial é, sem dúvida, a corrosão por oxidação à altas temperaturas. Portanto ligas metálicas utilizadas em altas temperaturas devem ser projetadas objetivando essa resistência à oxidação.
A maioria dessas ligas industriais contem o elemento cromo, que se oxida de forma preferencial, formando um filme protetor de Cr2O3 que comporta como uma barreira de proteção contra a corrosão do material em um ambiente oxidante (Kofstad,1988). Como exemplos dessas ligas formadoras de filmes de Cr2O3 , podemos citar as ligas à base de Ni-Cr (Li et al.,1997) e os aços inoxidáveis de uma forma geral (Sabioni at al., 2003a), entre outras.
O entendimento dos mecanismos de formação e das propriedades físico-químicas desses filmes protetores é de fundamental importância para a elaboração e desenvolvimento de ligas resistentes à processos de corrosão em altas temperaturas. Por razões diversas de natureza tecnológica, científica e também econômica esse tipo de estudo é realizado de forma bastante intensa nos países mais industrializados. No caso específico do Brasil, observa-se uma certa carência de pesquisas sobre esse tema, sendo praticamente inexistentes quando se trata do estudo dos processos de oxidação sob uma ótica mais atomística.
O entendimento dos mecanismos de formação e de crescimento desses filmes protetores de Cr2O3, demanda o conhecimento prévio de processos difusionais tais como de autodifusões catiônicas e aniônicas e também de difusão de impurezas que podem acontecer nesse material durante esses processos de oxidação.
Na área de oxidação é bastante comum a utilização de dados de difusão obtidos em amostras sintéticas de Cr2O3 objetivando o entendimento dos mecanismos de oxidação nessas ligas, que formam esse tipo de óxido, devido ao grande interesse prático exercido pelas mesmas. Através da utilização desses óxidos sintéticos torna possível a determinação com uma boa precisão, dos coeficientes de difusão em volume, que representam a difusão na rede cristalina do material, e também dos coeficientes de difusão nos contornos de grão.
2
Para se ter uma idéia desse interesse, apenas esses três artigos já tiveram dezenas de citações na literatura internacional, de acordo com o Institute for Scientific Information (ISI), o que demonstra de maneira clara o grande interesse científico pelas propriedades de transporte no Cr2O3 .
A partir dos resultados obtidos nesses trabalhos, tornou-se possível a criação de um modelo capaz de interpretar o mecanismo de crescimento de filmes de Cr2O3 durante os processos de oxidação. Através da teoria de Wagner (Kofstad,1988) para a oxidação de metais, (Sabioni et al., 1992) mostraram a impossibilidade de se fundamentar o crescimento do filme de Cr2O3 , baseando-se somente nas difusões do cromo e do oxigênio em volume e em contornos de grãos, como era sugerido por diversos autores. Foi então sugerido que outros mecanismos de difusão do cromo e do oxigênio deveriam intervir, tais como difusão via poros, trincas e outras imperfeições.
O entendimento das propriedades do filme de Cr2O3, requer o conhecimento sobre as características de difusividade de outros elementos que constituem essas ligas metálicas de interesse, tais como o ferro, manganês, níquel entre outros, além das difusividades do cromo e do oxigênio nesses materiais. A difusão desses elementos através do filme de Cr2O3 afeta de forma importante as suas propriedades, podendo, inclusive, para certas ligas, propiciar a formação de outras fases, dentro do filme , ou na sua superfície externa. Um exemplo clássico desse fato é a formação de uma estrutura do tipo espinélio na superfície externa de filmes de Cr2O3 formado sobre aços FeCrNi, acima de determinados valores de temperatura (Lobnig et al.,1992). Esses fatos demonstram que o conhecimento da difusão de cátions através desse filme é de grande interesse na área de oxidação.
Estudos confiáveis sobre a difusão de cátions em filmes de Cr2O3 são bastante raros na literatura em função das dificuldades experimentais que esse tipo de estudo demanda, devido, principalmente, a baixa difusividade e a problemas de evaporação que esse material apresenta em altas temperaturas.
Neste trabalho, fez-se o estudo experimental da difusão do manganês no óxido de cromo sintético e no óxido de cromo obtido pela oxidação da liga 70%Ni-30%Cr. Determinou-se como ocorre a difusão do manganês na rede cristalina e nos contornos de grão do óxido de cromo. Verificou-se também como as condições ambientais, tais como a temperatura e a pressão parcial de oxigênio afetam a mobilidade do íon manganês no filme de óxido de cromo.
3
coeficientes de difusão medidos no óxido de cromo sintético (material-modelo) com os medidos no óxido de cromo formado por oxidação.
No óxido sintético, a difusão ocorre essencialmente em volume e em contornos de grão. No filme de óxido formado pela oxidação, outros mecanismos podem intervir devido à presença de poros, trincas e de outras imperfeições próprias do material (Atkinson,1985; Sabioni,1992; Tsai et al.,1996a, 1996b e 1997).
Por tudo isso, os coeficientes de difusão medidos nos filmes de óxido de cromo podem representar coeficientes de difusões efetivos ou aparentes, que representam a soma das difusões em volume, em contornos de grão, em poros, em trincas, etc. Para esses casos, foi utilizada metodologia apropriada para identificar e quantificar os diferentes tipos de difusão. Os filmes de óxido de cromo utilizados neste trabalho foram produzidos através da oxidação de uma liga industrial 70%Ni-30%Cr, fornecida pela empresa Imphy (França). Essa liga foi escolhida porque permite a obtenção de um filme de óxido de cromo relativamente limpo, isto é, isento de impurezas metálicas e que pode ser crescido em condições controladas e é relativamente denso(Tsai et al.,1996a).
Portanto, ao fazermos a determinação de coeficientes de difusão do manganês nesse filme, as diferenças observadas em relação aos resultados obtidos no óxido de cromo sintético serão devidas apenas às diferenças microestruturais desses óxidos.
4
CAPÍTULO 2 - OBJETIVOS
Este trabalho foi desenvolvido, tendo os seguintes objetivos:
Estabelecer o estado da arte da difusão do manganês em óxido de cromo sintético e em óxido de cromo na forma de filmes obtido pela oxidação da liga industrial 70%Ni-30% Cr;
Desenvolvimento de metodologia para a determinação experimental de coeficientes de difusão do manganês em óxido de cromo sintético e em filmes de óxido de cromo, formado pela oxidação da liga industrial 70%Ni-30%Cr, por Espectrometria de Massa de Íons Secundários (SIMS);
Determinar, através da utilização dessa metodologia, coeficientes de difusão em volume e em contornos de grão do manganês no óxido de cromo sintético e no óxido de cromo na forma de filmes obtidos pela oxidação da liga industrial 70%Ni-30%Cr, em função da temperatura;
5
CAPÍTULO 3 - REVISÃO BIBLIOGRÁFICA
3.1 - Defeitos Pontuais em Óxidos
Defeitos pontuais estão presentes em todos os sólidos cristalinos e podem ser entendidos como desvios que os arranjos atômicos desses sólidos apresentam em relação aos seus arranjos atômicos perfeitos. A descrição qualitativa e quantitativa deles depende principalmente da estrutura cristalina do sólido, da composição química, das ligações químicas e da temperatura em que está sendo realizado o estudo.
Os principais defeitos pontuais presentes na estrutura cristalina dos óxidos podem ser agrupados em duas classes principais, sendo elas: a dos defeitos atômicos que são aqueles que ocupam uma posição atômica no reticulado cristalino (lacunas, átomos intersticiais e substitucionais) e a dos defeitos eletrônicos que são aqueles formados por um desvio da configuração eletrônica padrão do cristal (buraco eletrônico, elétron excitado). Outros tipos de defeitos mais complexos podem ser gerados dentro do cristal através da interação entre defeitos eletricamente carregados (Chiang et al.,1997).
A notação padrão utilizada para descrever os defeitos pontuais é a notação de (Kröger-Vink,1974), em que o defeito é descrito por três partes, como, por exemplo:
" M
V representa uma lacuna metálica formada pela ausência de um íon M2 (em um sítio
regular) na rede cristalina de um óxido do tipo MO, ou seja, dizemos que essa notação representa uma lacuna de M ionizada negativamente duas vezes. Para um óxido do tipo MO,
os cátions nas posições regulares da rede são escritos como X M
M e os íons de oxigênio nos
sítios normais da rede são descritos por OX 0
6
Figura 3.1 – Defeito Schottky em um cristal iônico.
7
3.1.1 - Reações de formação de defeitos pontuais
Defeitos pontuais como VM'', VO e Mi , presentes em um óxido simples do tipo MO
podem ser formados por diferentes mecanismos como mostram, por exemplo, as equações abaixo, que representam as reações de formação de defeitos.
i) Defeitos de Schottky:
O
M
V
V
'' (3.1)onde indica a formação de defeitos a partir de um cristal perfeito.
ii) Defeitos de Frenkel:
i M X
M V M
M '' (3.2)
iii) Defeitos Anti-Frenkel:
O i x
o O V
O '' (3.3)
iv) Reações de Oxidação e de Redução:
x o
M h O
V g
O ( ) '' 2
2 2
1 (3.4)
) ( 2e' 12O2 g
V
Ox O
o (3.5)
Defeitos pontuais atômicos podem também ser formados pela incorporação de impurezas heterovalentes.
Em algumas reações de formação de defeitos podem aparecer defeitos do tipo eletrônico, criados por excitação térmica, conforme a reação:
h
8
3.1.2 - Concentração de Defeitos em Equilíbrio
A determinação da concentração de defeitos em equilíbrio, presentes na rede cristalina dos óxidos, pode ser feita com base no princípio da neutralidade elétrica (Van Bueren, 1960; Flynn, 1972; Kofstad, 1972; Bar et al.,1974; Gupta, 1990 e Chiang, 1997), e através de equações para a formação de defeitos, similares aquelas utilizadas para estudar equilíbrio químico.
Considerando, como exemplo, a equação 3.4, de oxidação de um óxido do tipo MO, a constante de equilíbrio k é dada por:
2 1 2 '' 2 ) ( ] [ ] [ pO V h
K M (3.7)
Considerando a condição de eletroneutralidade, vem:
] [ 2 ]
[h VM'' (3.8)
Substituindo a equação (3.8) na (3.7), teremos:
2 1 2 ' ' 2 ' ' ] [ ] [ 4 pO V V
K M M (3.9)
2 1 2 3 ' ' ] [ 4 pO V
K M (3.10)
A constante k pode ser relacionada à variação da energia livre de Gibbs da reação dada pela equação:
K RT
Gf ln ou
RT G
K exp f (3.11)
onde Gf , representa a energia livre da reação (tabelado para cada material); R é a constante
dos gases ideais e T é a temperatura absoluta.
Substituindo a equação 3.11 na 3.10, a concentração de lacunas será dada por:
RT G pO V f M 3 exp 2
1 16
2 3 2 '
' ou
RT G pO
VM f
~ exp 2
1 16
2 3 2 '
' (3.12)
9 onde,
3
~ f
f
G
G representa a energia livre de Gibbs aparente de formação de defeito.
A expressão 3.12, mostra a dependência da concentração de lacunas com a pressão parcial de oxigênio pO2 e com a temperatura T, podendo, ainda, ser generalizada para os
defeitos pontuais.
Assim para um defeito genérico d, teremos:
RT G p
A
d O n f
~ exp
2 (3.13)
Portanto, a concentração de defeitos pontuais em um óxido é função tanto dapO2,
bem como da temperatura T, ou seja: d f T,pO2
3.2 - TEORIA DA DIFUSÃO EM SÓLIDOS
A compreensão de numerosos fenômenos físico-químicos, tais como, sinterização, corrosão, fluência, etc, está diretamente relacionada à interpretação dos valores obtidos para uma variável física contida nessa teoria, denominada de coeficiente de difusão.
A origem dos estudos de difusão (Barr,1997 e Koiwa,1998), apontam como precursor da teoria de difusão no estado sólido, o renomado médico fisiologista alemão Adolph Fick, que iniciou os estudos fenomenológicos e qualitativos sobre difusão em 1855. Alguns anos mais tarde, em 1896, o professor de metalurgia e químico, Roberts-Austen, anunciou as primeiras medidas de difusividade. Entretanto, Barr, em seu artigo “The origin ofquantitative
measurements in solids: A centenary review”, escreve que Boyle (séc.XVIII) já havia observado reações no estado sólido entre cobre e enxofre e cobre e arsênio, mas que, por razões relativas à época de sua descoberta, não as teria anunciado.
Difusão é o processo pelo qual a matéria é transportada, de uma parte do sistema para outra, como resultado de movimentos atômicos ou moleculares ao acaso. A difusão de átomos é necessária para que ocorram mudanças na microestrutura como densificação durante o processo de sinterização, deformação por fluência à altas temperaturas, crescimento de grão e a formação de produtos por reações de estado sólido.
10
podem apresentar uma grande variedade de defeitos, cujas concentrações podem variar de acordo com a composição, temperatura, atmosfera, em muitas ordens de grandeza.
Objetivando uma melhor compreensão das teorias que descrevem os princípios básicos dos mecanismos de difusão, dividiremos este estudo em duas abordagens distintas, a saber: uma abordagem macroscópica, utilizando as leis de Fick, e uma abordagem microscópica, para mostrar a relação entre difusão e defeitos nos óxidos.
3.2.1 - Descrição Macroscópica da Difusão – Leis de Fick
O estudo qualitativo da difusão em materiais começou em 1855, quando Adolf Fick (Barr, 1977 e Koiwa, 1998) observou uma similaridade matemática dessa teoria com as equações de transferência de calor, por condução, e propôs duas leis para a difusão, análogas às aplicadas para condutividade térmica, que permitem descrever o transporte atômico em meios contínuos.
i) Primeira Lei de Fick:
A primeira Lei de Fick estabelece que a quantidade de material que passa por unidade de tempo através de uma área normal à direção de difusão, é proporcional ao seu gradiente de concentração e é expressa por, (Chiang et al.,1997):
x C D
J (3.14)
A constante de proporcionalidade D é conhecida como coeficiente de difusão ou difusividade e é expressa em centímetros quadrados por segundo (cm2/s). J é o fluxo de partículas que atravessa um plano imaginário de área unitária por unidade de tempo; C é a
concentração do traçador que se difunde através desse plano e x C
é o gradiente de
concentração normal ao plano.
11
A equação (3.14) pode ser escrita na forma vetorial:
J DgradC (3.15)
A equação 3.15 estabelece que a difusão ocorre no sentido oposto ao gradiente de
concentração, gradC, sendo proporcional ao seu valor absoluto. Numa análise tridimensional,
genericamente, teremos:
J D C (3.16)
onde: D é um tensor de segunda ordem.
Para determinar o coeficiente de difusão, através das equações apresentadas acima, tem-se que encontrar um arranjo onde, J e C x , sejam acessíveis às medidas experimentais.
Neste caso, a Primeira Lei de Fick, tem que satisfazer às condições de estado estacionário, ou seja, onde não existe variação da composição com o tempo. Entretanto, experiências desse tipo são limitadas, e as que apresentam interesses científicos são aquelas que ocorrem no estado não estacionário.
ii) Segunda Lei de Fick:
Um sistema não estacionário é caracterizado pela variação da concentração da espécie difusora em qualquer ponto com o tempo.
A segunda Lei de Fick, aplicada a esses sistemas, permite determinar tal variação através da diferença entre o fluxo que entra e o fluxo que sai de um dado elemento de volume (Chiang at al.,1997)
12
Figura 3.3 – Difusão unidimensional em regime transitório.
Analisando a figura acima, é fácil observar que o fluxo através do primeiro plano que corta a barra é dado por:
x C D
J1 (3.17)
e o fluxo através do segundo plano será:
dx x C D x x C D dx x J J
J2 1 (3.18)
A quantidade de matéria acumulada, por unidade de tempo, por unidade de volume, é igual ao fluxo que entra J(x) menos o que sai J(x dx), ou seja:
x C D x x
J (3.19)
Como a diferença de fluxo, J/ x, corresponde à variação de concentração no interior
do volume delimitado pelos planos que cortam a barra,
t t x
C , , temos:
x J t
t x
C , (3.20)
ou x t x C D x t t x
C , , (3.21)
A equação 3.21 é chamada equação da continuidade e é conhecida como Segunda Lei de Fick.
13
As equações 3.21 e 3.22 acima, descrevem a difusão em regime permanente.
A solução da equação 3.22, C(x,t), corresponde ao perfil de difusão teórico, e sua
expressão analítica é determinada pelas condições iniciais e de contorno associadas ao experimento.
3.2.2 - Relação entre Defeitos Pontuais e Difusão
Para evidenciar a relação entre defeitos pontuais e difusão, consideremos a ocorrência da difusão por um mecanismo lacunar. Para esse tipo de mecanismo, a cada salto atômico corresponde o salto de uma lacuna.
Se o movimento de lacunas for considerado como aleatório, o seu coeficiente de difusão será dado pela equação: (Philibert ,1991 e Chiang at al.,1997).
V V
D 2 (3.23)
onde:
V
D coeficiente de difusão lacunar;
fator geométrico que depende da estrutura cristalina do material;
espaçamento interplanar ou distância de salto, representa a distância entre um sítio
regular e outro (distância entre a posição inicial e final);
V freqüência de salto da lacuna (no de saltos por segundo).
Como a cada salto de uma lacuna corresponde ao salto de um átomo e, como este só ocorre se houver uma lacuna na vizinhança do átomo, sua freqüência de salto será inferior à de uma lacuna, ou seja:
V
V (3.24)
onde:
V concentração de lacunas;
freqüência de salto do átomo;
V freqüência de salto da lacuna.
14
Definindo-se o coeficiente de difusão do átomo pela equação 3.23, teremos:
V
D 2 V ou
V D
D V (3.25)
A equação 3.25 mostra que o coeficiente de difusão atômica, D , é proporcional à concentração de lacunas, V , que, neste caso, é o defeito responsável pela difusão.
A equação 3.25 pode ser generalizada na forma:
d D
D d (3.26)
sendo d , a concentração do defeito responsável pela difusão.
Nas experiências em que se utiliza traçador deve-se considerar, na equação 3.26, um fator [ fd], denominado fator de correlação, que depende do mecanismo de difusão que ocorre
na estrutura.
Se vários mecanismos contribuírem de maneira independente, porém na mesma sub-rede, é preciso somar a contribuição de cada mecanismo, ou seja:
d d d f
D
15
3.2.3 - Influência da Temperatura e da Pressão Parcial do Oxigênio sobre o Coeficiente de Difusão
Para demonstrar a influência da temperatura T, e da pressão parcial de oxigênio pO2
na difusão do manganês, utilizaremos o mesmo caso anterior, ou seja, da difusão lacunar (Philibert, 1991 e Chiang et al.,1997).
O salto de um átomo, para um sítio vazio (lacuna), requer uma certa quantidade de energia que está relacionada com a barreira de energia potencial, oriunda dos átomos vizinhos, figura 3.4. Somente uma certa quantidade de átomos da rede possui energia suficiente para vencer essa barreira.
A probabilidade P de um átomo possuir essa energia suficiente para saltar é dada por:
T R
G
P exp m (3.28)
Onde: Gm é a energia livre de Gibbs de migração.
Sendo a freqüência de vibração de um átomo em torno de sua posição de equilíbrio vizinha a uma lacuna, a freqüência de salto de uma lacuna será:
P
V (3.29)
ou
RT Gm
V exp (3.30)
Substituindo a equação 3.30 na equação 3.23, teremos:
RT G
16
Figura 3.4 – Energia Potencial associada ao salto de um átomo.
Sendo: Gm Hm T Sm
onde: Gm energia livre de Gibbs; H entalpia; S entropia e T temperatura
absoluta.
Fazendo o mesmo com as equações 3.31 e 3.25, teremos:
V RT
G
D 2 exp m (3.32)
onde: Gm representa a barreira de energia que o íon tem que vencer para que possa
17
Mostramos no item 3.1, que a concentração de defeitos é, em geral, uma função de T e de pO2, ou seja, para lacunas teremos:
RT G pO
A
V n f
~ exp
2 (3.33)
Substituindo a equação 3.33 na equação 3.32, teremos:
RT G RT G pO A
D n f exp m
~
exp 2
2
Agora, generalizando para outros defeitos, vem:
RT G pO
A
d n f
~ exp
2 (3.34)
onde [d] representa a concentração do defeito responsável pela difusão, A é uma constante,
2
pO é a pressão parcial de oxigênio, n é um parâmetro adimensional que depende da natureza
e da carga do defeito pontual, G~f é a variação da energia livre efetiva da reação de formação
do defeito.
d RT
G
D 2 exp m (3.35)
de modo que:
T R G G pO A
D n f m
~ exp 2
2 (3.36)
ou: T R H H pO R S S A
D m f n f m
~ ~
exp 2
2 (3.37)
Fazendo:
R S S A
Do m f
~ exp
2 e lembrando que:
f
m H
H
Q ~ ,
então:
RT Q pO
D
D o 2 n exp (3.38)
Essa equação, representa uma equação de Arrhenius, ou seja, D f T e mostra a
18
o
D fator pré-exponencial que é definido através de fatores microscópicos e entrópicos do
material, tais como: energia de salto, freqüência, etc;
Q energia ou entalpia de ativação que corresponde à soma das entalpias de migração e de formação do defeito responsável pela difusão;
n parâmetro adimensional positivo,negativo ou nulo que caracteriza o tipo e a carga do defeito.
A equação 3.38 é denominada de equação de Arrhenius e mostra a dependência da difusão com a temperatura e a pressão parcial de oxigênio.
Em geral, as experiências de difusão são realizadas a uma dada pressão de oxigênio, com temperatura variável. Nesse caso, a equação 3.38 é utilizada na forma usual:
T R
Q D
D o exp (3.38a)
3.2.4 - Tipos de Difusão
Segundo o meio em que ocorre, podemos distinguir três tipos de difusão: a) Difusão em volume: é o caso em que a difusão ocorre no reticulado cristalino
(tridimensional), através da movimentação de defeitos pontuais, no interior do reticulado cristalino. A presença de diferentes tipos de defeitos dá origem aos diferentes mecanismos de difusão ilustrados na seqüência, Figura 3.5, (Manning,1968 e Flynn, 1974);
b) Difusão interfacial: é o caso em que a difusão ocorre em meios bidimensionais, como contornos de grãos, interfaces, superfícies e subcontornos de grão;
c) Difusão ao longo de discordâncias: é o caso em que a difusão ocorre ao longo das linhas de discordâncias (unidimensional).
Neste trabalho, consideraremos a difusão do manganês em volume e em contornos de grão do Cr2O3.
3.2.5 - Autodifusão e Heterodifusão
De acordo com a espécie atômica que se difunde em um óxido, podemos classificar a difusão em autodifusão e heterodifusão.
19
Já a heterodifusão acontece quando ocorre a difusão de um átomo estranho (impureza), como, por exemplo, a difusão de átomos B num sólido AM. Para a heterodifusão consideraremos apenas o caso em que a impureza que se difunde está presente em baixa concentração, de modo que o material no qual ocorre a difusão possa ser considerado homogêneo.
Neste trabalho abordaremos a heterodifusão do manganês no Cr2O3 .
3.2.6 - Mecanismos de Difusão
Existem vários mecanismos de difusão, mas os principais são os mecanismos de lacunas e de intersticiais. A figura 3.5 representa os mecanismos de difusão possíveis.
i) Mecanismo de Troca Direta
Consiste do movimento de um átomo que simplesmente muda sua posição inicial no sítio do reticulado com um vizinho imediato. Entretanto segundo (Philibert, 1991), este mecanismo é muito improvável, principalmente em estruturas de empacotamento fechado, onde a repulsão atômica é muito forte devido à pequena distância entre os átomos.
ii) Mecanismo em Anel
Neste caso, o movimento dos átomos ocorre através da rotação de três ou mais átomos. As forças repulsivas desenvolvem um papel favorável neste caso, pois cada átomo é empurrado pelo seu vizinho durante uma troca circular de sítios. A dificuldade deste mecanismo é que ele sugere a coordenação de vários saltos atômicos, o que também o torna menos provável de ocorrer (Philibert, 1991).
iii) Mecanismo Lacunar
20 iv) Mecanismo Intersticial
Diz-se que um átomo se difunde por mecanismo intersticial quando ele passa de um sítio intersticial para outro mais próximo, sem deslocar permanentemente qualquer dos átomos da matriz. Logo este mecanismo é provável somente quando o átomo intersticial é menor que os átomos normais da rede;
v) Mecanismo Intersticial Indireto
Este mecanismo é uma variante do mecanismo intersticial e pode ocorrer quando um átomo de um sítio regular da rede troca sua posição por uma posição intersticial;
21 vi) Mecanismo Intersticial Estendido ou de Cordão
Este mecanismo corresponde ao deslocamento atômico ao longo de uma fila de átomos, em que os átomos extras são alocados na direção de empacotamento fechado, deslocando, assim, vários átomos de suas posições de equilíbrio.
Os dois principais mecanismos de difusão são respectivamente, o lacunar e o intersticial. Esses mecanismos dão origem às duas principais classes de defeitos presentes nos óxidos do tipo MO, tipo Frenkele tipo Schottky.
3.2.7 - Alguns Exemplos de Soluções Para a Equação de Difusão
Em estudos de autodifusão e heterodifusão, em uma dimensão, a evolução da
concentração do traçador, em função da posição e do tempo, pode ser prevista pela “equação da difusão” ou 2a lei de Fick, escrita na forma (Philibert, 1994):
2
2 ( , )
) , (
x t x C D t
t x C
(3.39a)
onde C(x,t) é a concentração do traçador a uma distância x da superfície, t é o tempo de tratamento térmico de difusão e D é o coeficiente de difusão ou difusividade do traçador.
A solução da equação (3.39a), C(x,t), corresponde ao perfil de difusão teórico, e sua expressão analítica depende da distribuição inicial do traçador (condições iniciais) e da distribuição do traçador nos contornos da amostra (condições de contorno) durante o tratamento térmico de difusão, ou seja, a solução depende das condições experimentais.
A determinação do coeficiente de difusão D, nos métodos diretos, consiste no ajustamento de uma solução adequada da equação (3.39a), C(x,t), ao perfil de difusão experimental, sendo D um dos parâmetros ajustáveis.
22
i) Difusão a partir de um filme fino em um meio semi- infinito
A priori, o filme é considerado fino quando a profundidade alcançada pelo traçador no interior da amostra for maior que a espessura desse filme depositado sobre a mesma e, o termo semi-infinito, significa que o traçador se difundirá preferencialmente em uma única direção através da amostra.
Para estudos de autodifusão e heterodifusão, o traçador (radiativo ou não-radioativo) é, geralmente, aplicado na forma de um filme fino sobre uma superfície plana e polida da amostra. A difusão a partir de um filme fino é de grande interesse prático por sua simplicidade. Para esse caso, a solução da equação da difusão prevê uma linha reta no gráfico de logC versus x2 para a difusão em volume. Eventuais desvios da linearidade indicam influências de curtos-circuitos. Então, a espécie que se difunde é, inicialmente, depositada sob a forma de um filme fino na superfície da amostra, ou seja, toda a substância que se difunde está concentrada no plano x = 0, no tempo t = 0.
Normalmente coloca-se duas amostras com as superfícies, contendo o filme fino em contato, formando um sanduíche.
Considerando que Q é a quantidade de traçador por unidade de área depositado sobre à superfície da amostra no plano x = 0, em t = 0,
A condição inicial será:
t = 0, C(x,0) = Q (x) (3.39b)
onde indica a função delta de Dirac, assim definida:
(x) = 0, x 0 e
t, C dx Q (3.39c)
Pode-se prever para esse tipo de difusão que a concentração vai apresentar uma distribuição gaussiana (Philibert, 1990):
t D x t
A C
4 exp
2 2
1 (3.40)
23 dv e D A dx t D x t A
Q v2
2 4 exp 2 2 1 (3.41)
Lembrando que : e v2dv posto isso resulta então, que: Q 2A D
Essa expressão mostra que a quantidade de substância que se difunde permanece constante e igual à quantidade originalmente depositada no plano x = 0.
Então: t D x t D Q t x C 4 exp 2 ) , ( 2 (3.42)
Para a difusão a partir de uma fonte planar infinitamente fina em uma amostra semi-infinita, a solução dada pela equação 3.42 é multiplicada por dois, sendo utilizada na forma:
t D x t D Q t x C 4 exp ) , ( 2 (3.43)
onde Q é a quantidade de traçador por unidade de área, D é o coeficiente de difusão em volume, C(x) é a concentração à profundidade x e t é o tempo de difusão. A equação 3.43
pode ser escrita de forma simplificada, do seguinte modo:
t D x K t x C 4 exp ) , ( 2 onde t D Q
K . Agora, se calcularmos o logaritmo neperiano nos dois membros da equação
anterior, teremos uma reta do tipo (y a bx), ou seja:
t D x K t x C 4 ln ) , ( ln 2
sendo b o coeficiente angular dessa reta igual que para este caso valerá:
t D b
4 1
Se o experimento for bem sucedido o trecho inicial do gráfico (lnC, x2) que corresponde a difusão em volume, deverá assemelhar-se a uma reta
ii) Difusão em um meio Semi-Infinito com Concentração Superficial Constante
Para exemplificar, vamos mostrar uma outra solução da equação de difusão de grande interesse prático, amplamente utilizada na área tecnológica, que é a difusão em meio semi-infinito com concentração superficial constante.
24 b) para t > 0, x = 0, C (0,t ) = Cs
A solução da equação da difusão será dada por:
t D x erf C
C x C C
s s
2 )
(
0
(3.44)
Para obtermos o D na função acima 3.44, devemos ajustá-la ao perfil experimental de difusão. Temos, respectivamente que:
Cs concentração do traçador na superfície;
C(x) concentração em uma dada posição;
C0 abundância natural do traçador no material estudado;
x profundidade;
D coeficiente de difusão;
t tempo do tratamento térmico de difusão; erf função erro; (que é na realidade uma integral).
O valor dessa função é dado por : erf z ze u du
0 2
2 ) (
Existem portanto, infinitas soluções para a Equação da Difusão, cada uma dependendo das condições iniciais e de contorno que dependem das condições experimentais.
3.3 - DIFUSÃO EM CONTORNOS DE GRÃO
i) Regimes de Difusão
Tomando com referência os inúmeros trabalhos já realizados (Fisher, 1951; Gupta et al., 1985; Le Claire,1963; Sabioni et al., 1998 e Tuller, 1999), relacionados a difusão em contornos de grão, observa-se que a difusividade nessa região é, em geral, muito mais alta do que a que acontece no interior da rede cristalina (difusão em volume).
25
Geralmente, a cinética de difusão em contornos de grão é estudada segundo três regimes designados pelas letras A, B e C (Philibert, 1991) conhecidos como condições de (Harrison, 1961). Na prática, quando colocamos um traçador sobre a superfície de uma amostra a ser analisada, podemos ter três possibilidades de difusão, a saber: i) Difusão através do grão (em volume); ii) Difusão através do contorno de grão e finalmente iii) quando o traçador se difunde através do contorno de grão e se espalha lateralmente atingindo partes do interior do mesmo.
3.3.1 - Tipos de Cinética de Difusão Intergranular
i) Cinética de Difusão do Tipo A
A cinética do tipo A é definida pela seguinte relação:
2 1
t
D (3.45)
onde: D t 12 é o deslocamento médio quadrático, que corresponde, na verdade, a difusão
em volume e, D e t têm seus significados usuais, qual seja, coeficiente de difusão em volume e tempo de difusão, e é o diâmetro médio dos grãos. O esquema representando a cinética do
tipo A é apresentado na Figura 3.6. As linhas da parte inferior da região pontilhada dessa figura são contornos de isoconcentrações.
Os perfis de concentração normalmente seguem a solução da equação de Fick para um sistema homogêneo, dando origem a uma gaussiana como no caso de um filme fino, mas o coeficiente de difusão medido é, de fato, um coeficiente de difusão aparente ou efetivo, dado pela equação de (Hart, 1957):
'
1 f D f D
Defetivo (3.46)
onde: f é a fração volumétrica de sítios atômicos situados nos contornos de grãos e D’ é o coeficiente de difusão em contornos de grãos. Para um policristal, f 3 / , sendo a
26
Figura 3.6 – Cinética de difusão no regime do tipo A .
ii) Cinética de Difusão do Tipo B
Este é o caso de maior interesse prático para estudos de difusão em contornos de grão. Nesse tipo, há difusão simultânea em volume, partindo da superfície, difusão ao longo do contorno de grão e difusão lateral para dentro dos grãos, a partir do contorno.
A cinética do tipo B, Figura 3.7, é definida da seguinte forma (Harrison, 1961):
2
2 1
t
D (3.47)
Através de experiências de difusão do tipo B é possível determinar o produto D’ .
27 iii) Cinética de Difusão do Tipo C
Ocorre quando as amostras são submetidas a tratamentos térmicos de difusão, em um curto intervalo de tempo e/ou quando as espécies que se difundem apresentam coeficientes de difusão em volume desprezíveis, quando comparados aos de difusão intergranular, ou seja, quando a difusão ocorre essencialmente nos contornos de grão.
A cinética do tipo C é definida por:
2 1
t
D (3.48)
Esse tipo de cinética tem grande interesse prático, uma vez que ele permite a medida
direta do coeficiente de difusão intergranular D’ e não do produto D’ como no regime B. Entretanto, é muito difícil obter as condições experimentais para tal regime devido à baixíssima penetração e pequena quantidade de traçador nos contornos de grão.
Nesse trabalho, levaremos em consideração apenas a cinética de difusão do tipo B.
Figura 3.8 - Cinética de difusão no regime tipo C.
3.3.2 - Determinação do Coeficiente de Difusão Intergranular
As principais equações para o estudo da difusão intergranular foram obtidas por (Fisher, 1951;Whipple, 1954; Le Claire, 1963 e Suzuoka, 1964).
28
As expressões da concentração, C(x,t), contêm três componentes: - CI devido à difusão em volume a partir da superfície;
- CII devido à difusão lateral em volume a partir do contorno de grão; - CIII devido à difusão no próprio contorno de grão.
Normalmente, a contribuição de CIII é desprezível. Após um longo período de difusão, além de uma certa profundidade, CI torna-se desprezível em relação a CII .
Portanto, levando-se em consideração o caso mais simples, podemos decompor o perfil de difusão em duas partes, a saber:
- Primeira parte: pequenas penetrações que produzem D (ou Defetivo em amostras policristalinas);
- Segunda parte: grandes penetrações (cauda da curva), de onde se obtém o produto
D’ .
Podemos separar estas duas partes através da representação gráfica apropriada da concentração versus profundidade, baseando-nos na solução analítica do problema.
i) Modelo de Fisher
O modelo de Fisher (Fisher, 1951) permite-nos analisar a difusividade em contornos de grão para experimentos que ocorram em condições que caracterizem o regime B de difusão intergranular.
Atribuindo-se um valor à largura do contorno de grão, Figura 3.9, a equação segundo esse modelo é dada por:
2 :
, 2 '
'
2 2
x onde x
C D z
C D t C
(3.49)
O termo ' 22
z C
D está relacionado com a divergência do fluxo na direção de penetração
z. O outro,
x C D
2
, expressa a difusão lateral a partir dos contornos de grão.
29
Figura 3.9 – Modelo de Fisher para contorno de grão através de uma curva de isoconcentração (Philibert,1991).
ii) Modelo de Whipple
Whipple, em seu modelo, realiza soluções exatas para difusão intergranular do tipo B com concentração superficial constante C0 através da equação:
III II C C erfc
C t z C
2 2 2 )
,
( 0 (3.50)
onde: C é a concentração na profundidade (z), com as seguintes variáveis adimensionais:
2 1
t D
x e 12
2 D t
Esse modelo apresenta uma solução analítica muito complexa e, por isso, tem pouca utilização prática.
iii) Modelo de Whipple-Le Claire
Trata-se de um modelo simplificado em relação ao anterior devido às modificações introduzidas por Le Claire, tornando-o mais interessante do ponto de vista prático (Le Claire, 1963).
30
Em sua abordagem para regime de difusão do tipo B, Le Claire introduz o parâmetro diretamente relacionado com a forma do perfil de difusão. Este parâmetro pode ser calculado por: 2 1 2 1 2 ' 2 ' t D D D t D D D D (3.51)
Para distinguir as concentrações CI e CII sobre o perfil de concentração, tem que suficientemente grande; de acordo com a teoria de Le Claire, a condição para que isso ocorra é > 10.
Desse modo, a determinação do coeficiente de difusão em contornos de grão pode ser calculado pela relação abaixo:
3 5 5 6 2 1 2 1 3 5 5 6 ln 4 ln ' C t D x C
D (3.52)
Considerando-se que o terceiro termo dessa equação seja igual a 0,78, chegaremos a:
3 5 5 6 2 1 ln 4 661 , 0 ' x C t D
D (3.53)
O gradiente ln65 x
C
da equação 3.53 é determinado a partir de um gráfico do tipo lnC versus
5 6
x e representa o coeficiente angular da cauda da curva obtida quando se traça esse gráfico. O sinal negativo desse gradiente, significa que ele é decrescente.
iv) Modelo de Suzuoka
31
Figura 3.10 - Modelo de contornos de grão(Suzuoka,1964).
A solução analítica exata, para a equação de difusão proposta por Suzuoka, é, sob o ponto de vista matemático, complexa e exige integrações numéricas. Nesta solução, a concentração é a soma de dois termos:
, ,
II
I C
C
C (3.54) onde: 4 exp 2 2 1 t D Q CI e 2 1 2 1 2 1 2 1 2 1 4 exp 2 1 4 d erfc CII onde:
- C = a concentração média em uma seção à profundidade [y];
- CI = a contribuição da difusão direta em volume a partir da superfície;
- CII = a contribuição da difusão ao longo do contorno e lateralmente a partir do mesmo.
Os parâmetros , , , e são definidos através das expressões (Kaur, I. e Gust, 1998):
2 1 t D y ; 2 1 2 / t D
x ;
2 1 2 / 1 t
32
D D'
Suzuoka demonstrou que próximo da superfície, C C e lnC y2
I . A partir de uma certa profundidade, a contribuição do contorno torna-se preponderante e constata-se que
II
C C ln
ln é proporcional a y65
.
O modelo de Suzuoka permite o cálculo de D’ , através de diferentes expressões que dependem do valor do parâmetro .
Para <100, temos:
3 5 018 , 0 3 5 5 6 2
1 ln / 0,70
/ 2
' D t C y
D (3.55)
Para 102< <104
3 5 008 , 0 3 5 5 6 2
1 ln / 0,72
/ 2
' D t C y
D (3.56)
O valor de , que aparece nas expressões acima 3.55 e 3.56, pode ser determinado através da expressão (Kaur, I. e Gust,1998):
582 , 0 1 5 3 5 6 1 ln 70 ,
0 Dt
y
C (3.57)
O gráfico de lnC versus y65 permite a determinação do gradiente 5 6 ln
y
C com o qual é
possível determinar o produto D’ .
33 3.4 - PROPRIEDADES DO Cr2O3
O óxido Cr2O3 tem a estrutura do coríndon, isto é, a mesma do Al2O3. Nessa estrutura os íons oxigênio formam uma estrutura hexagonal compacta, com os cátions trivalentes ocupando 2/3 dos sítios intersticiais octaédricos (Hoshino et al.,1983).
Possui uma densidade teórica de aproximadamente 5,21 g/cm3 (Samsonov,1982). O Cr2O3 é o único óxido sólido formado pela oxidação térmica do cromo (Atkison et al.,1985).
O Cr2O3 é um óxido extremamente importante sob o ponto de vista tecnológico, por ser o constituinte majoritário dos filmes protetores que crescem sobre os aços inoxidáveis e em muitas ligas resistentes à oxidação em altas temperaturas (Marasco, 1992). Em função de tudo isso, a literatura contém muitos estudos relacionados às propriedades do Cr2O3 (Atkinson, 1984, 1985; Kofstad,1988, 1989 e 1995 e Huntz, 1994, 1997)
Esse óxido pode ser um semicondutor tanto do tipo p, quanto do tipo n, dependendo da temperatura e da pressão parcial de oxigênio. Os defeitos atômicos majoritários são lacuna
de cromo ionizada três vezes negativamente [VCr''' ] (Sabioni, 1992a), à alta pressão parcial de
oxigênio e cromo intersticial ionizado três vezes positivamente [Cri ] à baixa pressão parcial
de oxigênio (Sabioni,1992a).
Entende-se por semicondutor do tipo p, os óxidos não estequiométricos deficientes em metal que conduzem eletricidade através do movimento de buracos eletrônicos, que possuem uma carga efetiva positiva. Por sua vez, os semicondutores do tipo n são definidos como óxidos não estequiométricos com excesso metálico. Os óxidos com essas características, conduzem a eletricidade através do movimento de elétrons livres.
Como regra geral, considera-se que o Cr2O3 é um semicondutor do tipo p à altas pressões parciais de oxigênio (Hay et al., 1970; Atkinson et al.,1985; Sabioni et al.,1992a) tendo como defeito atômico majoritário, lacunas de cromo com carga efetiva (-3). A partir da utilização da notação de (Kröger e Vink, 1956), a formação desses defeitos no Cr2O3 é descrita pela equação:
h V O
O 3 X 2 Cr 6 2
3 '''
0
2 (3.58)
onde [ '''
Cr
V ] é a lacuna de cromo ionizada três vezes negativamente e [h ]representa o buraco eletrônico. Nesse caso a condição de eletroneutralidade é dada por:
] [ ] [