PROGRAMA INTERINSTITUCIONAL DE PÓS-GRADUAÇÃO EM CIÊNCIAS FISIOLÓGICAS - UFSCar/UNESP
PARTICIPAÇÃO DA NEUROTRANSMISSÃO
OREXINÉRGICA NAS RESPOSTAS RESPIRATÓRIAS À
HIPERCARBIA E HIPÓXIA EM SAPOS
Elisa Maioqui Fonseca
Orientadora: Profa. Dra. Luciane Helena Gargaglioni Batalhão
Co-orientadora: Profa. Dra. Kênia Cardoso Bícego
PROGRAMA INTERINSTITUCIONAL DE PÓS-GRADUAÇÃO
EM CIÊNCIAS FISIOLÓGICAS - UFSCar/UNESP
PARTICIPAÇÃO DA NEUROTRANSMISSÃO OREXINÉRGICA
NAS RESPOSTAS RESPIRATÓRIAS À HIPERCARBIA E HIPÓXIA
EM SAPOS
Dissertação apresentada ao Programa Interinstitucional de Pós-Graduação em Ciências Fisiológicas – UFSCar/UNESP como parte dos requisitos para obtenção do título de Mestre em Ciências Fisiológicas
Orientadora: Profa. Dra. Luciane Helena Gargaglioni Batalhão
Ficha catalográfica elaborada pelo DePT da Biblioteca Comunitária da UFSCar
F676pn
Fonseca, Elisa Maioqui.
Participação da neurotransmissão orexinérgica nas respostas respiratórias à hipercarbia e hipóxia em sapos / Elisa Maioqui Fonseca. -- São Carlos : UFSCar, 2014. 81 f.
Dissertação (Mestrado) -- Universidade Federal de São Carlos, 2014.
1. Fisiologia. 2. Orexina. 3. Hipercarbia. 4. Hipóxia. 5. Ventilação pulmonar. 6. Anfíbio. I. Título.
AGRADECIMENTOS
Agradeço à professora Luciane pela orientação e pelo aprendizado. Por ser um
exemplo profissional e pelos ensinamentos pessoais. Obrigada pela paciência, pela
confiança, por ter sempre uma palavra de incentivo, pelo seu entusiasmo e por nunca
me deixar desistir! Sempre serei grata.
À co-orientadora Kênia, por também estar presente na realização desse
trabalho, pelas ideias e sugestões.
Ao Programa de Pós-Graduação em Ciências Fisiológicas da UFSCar/UNESP,
aos professores e todos os ensinamentos, e ao Alexandre pela competência
profissional na secretaria do programa.
À CAPES pela bolsa concedida e à FAPESP pelo auxílio financeiro (número do
processo 2010/16793-1).
Aos amigos do laboratório, Camila, Lango, Migalha, Carol, Lucas, Jumela,
Débora, Luana, Victor, Baiana, Vart, Jolene, Gabi, Carol Silva, Lays, Lara, Lívia,
Aretuza, Paula, Bruno, Nikito, Carlos e Jayme, agradeço pela convivência durante o
dia-a-dia, fazendo meus dias sempre muito mais divertidos. Agradeço pela ajuda, por
estarem sempre prontos nos momentos de desânimo e por se alegrarem comigo nos
momentos felizes. Em especial, ao Lucas por me ensinar o manejo dos animais e a
cirurgia estereotáxica e pela convivência em Dayton. Por compartilharmos os
experimentos, pelas brincadeiras, jantares e pelo apoio sempre. Agradeço à Jumela
pelas coletas sem fim e por me acolher tão bem em sua casa, fazendo coxinhas e
nhoque! Obrigada ao Lango por sempre me socorrer e “quebrar um galho” quando eu
madrugada. Obrigada Lays e Pi, por também me acolherem no apartamento de vocês
e realmente fazerem me sentir em casa! Carol e Victor, obrigada pelo carinho e por
me levarem a São carlos para a qualificação. Obrigada a todos que me ajudaram na
manutenção dos animais (em especial Euclides e Damares) e às tantas pessoas que
me auxiliaram nas coletas e até mesmo trouxeram sapos pra mim.
À Lynn, pelo acolhimento tão especial e por ter me dado a oportunidade de
conhecer técnicas de Eletrofisiologia e ao Joe por ter tanta paciência em me ensinar.
Não poderia deixar de agradecer também às pessoas mais importantes da
minha vida. Meus pais Leila e Lorinho e meu irmão Dedé. Obrigada pelo amor e apoio
incondicional que sempre me deram, por me darem forças e me incentivarem em
todos os momentos. Obrigada também à minha avó Dida e à minha tia Tata por
sempre estarem presentes.
Ao meu namorado Augusto, que, apesar do pouco tempo que estamos juntos,
não mede esforços pra me ajudar em tudo que preciso: de numeração de páginas e
ajeitar figuras a desabafos de madrugada. Lindo, obrigada por todo seu amor e apoio.
Amo você.
Às amigas de longe, porém sempre presentes, Paula e Érika, pela amizade e
apoio em todos os momentos!
E à Deus, claro, a quem devo tudo que sou. Obrigada por cuidar de cada
RESUMO
A orexina ou hipocretina exerce uma importante modulação no controle
respiratório em mamíferos, mas nenhum estudo verificou a participação das
orexinas na quimiorrecepção central e periférica em vertebrados não-mamíferos.
Em vista disso, o objetivo do presente estudo foi avaliar a imunorreatividade para
orexina para localização dos neurônios orexinérgicos no encéfalo de sapos
(Rhinella schneideri) e investigar se o sistema orexinérgico desta espécie participa
nas respostas respiratórias à hipóxia (5% O2 e N2 balanço) e à hipercarbia (5%
CO2, 21%O2 e N2 balanço). A participação da neurotransmissão orexinérgica na
regulação respiratória em sapos (Rhinella schneideri) foi avaliada por meio de
microinjeções intracerebroventriculares (i.c.v.) de SB-334867 (antagonista de
receptores OX1R) em duas doses (5 mM e 10mM) no ventrículo lateral durante as
fases clara e escura desses animais. Nossos resultados mostram que os
neurônios orixinérgicos de sapos Rhinella schneideri estão localizados no núcleo
supraquiasmático no diencéfalo. Adicionalmente, a injeção do antagonista
orexinérgico atenua a resposta ventilatória à hipercarbia na fase escura, devido
tanto à diminuição do volume corrente quanto da frequência respiratória,
enquanto, na fase clara, atenua a resposta ventilatória à hipóxia devido a uma
redução no volume corrente. Concluímos, portanto, que a Orexina A participa na
modulação dos quimiorreflexos central e periférico em sapos Rhinella schneideri.
Palavras-chave: orexina, hipercarbia, hipóxia, quimiorrecepção, ventilação,
ABSTRACT
The hypocretin or orexin A plays an important role in the modulation of
respiratory control in mammals, but there are no data available for the role of
Orexins in the peripheral and central chemoreception of non-mammalian
vertebrates. Thus, the present study was designed to evaluate the location of
orexinergic neurons in toads (Rhinella schneideri). In addition, we investigate if the
orexinergic system of this species is important to hypoxic (5% O2 and N2 for
balance) and hypercarbic (5% CO2, 21% O2 and N2 for balance) drive to breath.
We assessed the role of the orexinergic system on respiratory responses by using
intracerebroventricular injection of SB-334867 (orexin A receptor antagonist)
during the light and the dark phase. Our results demonstrated that orexinergic
neurons of Rhinella schneideri are located in the suprachiasmatic nucleus of
diencephalon. Additionally, the injection of the orexin antagonist attenuated the
ventilatory response to hypercarbia during the dark phase by acting on tidal volume
and breathing frequency, while in the light phase, there was an attenuation in the
ventilatory response to hypoxia by acting just in the tidal volume. We conclude that
central orexin A contributes to hypercarbic and to hypoxic chemoreflex in toads
Rhinella schneideri.
Keywords: orexin, hypercarbia, hypoxia, chemoreception, ventilation,
SUMÁRIO
1. LISTA DE FIGURAS ... 10
2. INTRODUÇÃO ... 13
2.1. Padrão respiratório ... 14
2.2. Respiração em anfíbios ... 15
2.3. Transição da respiração aquática para a aérea ... 16
2.4. Quimiorrecepção em vertebrados ... 18
2.4.1. Quimiorreceptores de O2 ... 18
2.4.2. Quimiorreceptores de CO2 ... 20
2.5. As orexinas ... 22
2.5.1. Orexinas e quimiorrecepção ... 25
2.5.2. Orexinas em anfíbios ... 26
3. OBJETIVO ... 28
4. MATERIAL E MÉTODOS ... 29
4.1. Animais ... 29
4.2. Drogas e misturas gasosas utilizadas ... 29
4.3. Procedimentos ... 30
4.3.1. Imunohistoquímica ... 30
4.3.2. Cirurgia estereotáxica ... 31
4.3.3. Cirurgia para implantação de cânula na artéria ilíaca ... 33
4.3.4. Fixação da máscara para medida de ventilação ... 34
4.4.1. Protocolo 1. Fase clara ... 36
4.4.2. Protocolo 2. Fase escura ... 37
4.5. Medidas de ventilação ... 37
4.6. Análise dos dados ... 38
5. RESULTADOS ... 40
5.1. Localização dos neurônios orexinérgicos no encéfalo de Rhinella schneideri 40 5.2. Ventilação ... 42
5.2.1. Protocolo 1 - Fase clara ... 42
5.2.2. Protocolo 2 - Fase escura ... 48
5.3. Gasometria ... 55
6. DISCUSSÃO ... 59
6.1. Localização dos neurônios orexinérgicos no encéfalo de Rhinella schneideri 59 6.2. Parâmetros ventilatórios basais ... 61
6.3. Orexina e o quimiorreflexo central ... 62
6.4. Orexina e o quimiorreflexo periférico ... 66
1. LISTA DE FIGURAS
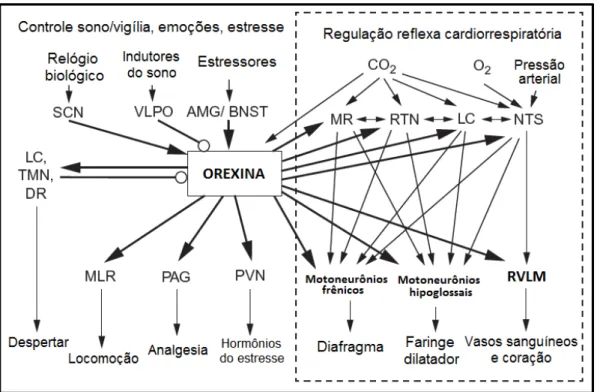
Figura 1. Desenho esquemático mostrando as conexões dos neurônios orexinérgicos. A figura ilustra como as orexinas modulam a regulação
estado-dependente do comportamento e as respostas ao estresse (lado esquerdo) e a
regulação cardiorrespiratória (lado direito) (adaptado de Kuwaki et al., 2010).
Figura 2. Estereotaxia para implantação de cânula-guia no ventrículo lateral de Rhinella schneideri.
Figura 3. Cirurgia para implantação de cânula na artéria ilíaca de Rhinella schneideri.
Figura 4. Detalhe da máscara para medida de ventilação com pneumotacógrafo acoplado. Foto: Carolina Noronha de Souza.
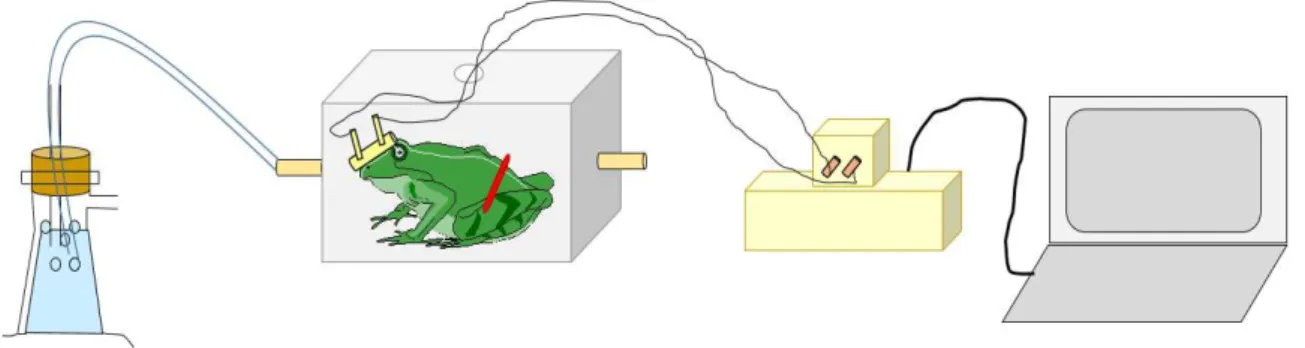
Figura 5. Desenho esquemático do aparato experimental utilizado para a realização dos experimentos.
Figura 6. A. Desenho esquemático do encéfalo de anuro mostrando o nível da transecção; B. Fotomicrografia de corte transversal do diencéfalo de Rhinella
Figura 7. Efeito da injeção i.c.v. de veículo, SB-334867 (5 mM e 10 mM) na VE, fR e VT de sapos Rhinella schneideri em normóxia durante a fase clara.
Figura 8. Efeito da injeção i.c.v. de veículo ou SB-334867 (5 e 10 mM) na VE, VT e fR de sapos Rhinella schneideri submetidos à hipercarbia durante a fase clara.
A seta indica o momento da microinjeção. Dados apresentados em porcentagem
do basal.
Figura 9. Efeito da injeção i.c.v. de SB-334867 5 mM, SB-334867 10mM ou veículo na VE, VT e fR de sapos Rhinella schneideri submetidos à hipóxia durante
a fase clara. A seta indica o momento da microinjeção. Dados apresentados em
porcentagem do basal. * e + indicam diferença significativa de SB-334867 5 e
10mM, respectivamente, em relação ao grupo veículo.
Figura 10. Efeito da injeção i.c.v. de veículo, SB-334867 (5 mM e 10 mM) na VE, fR e VT de sapos Rhinella schneideri em normóxia durante a fase escura.
Figura 11. Efeito da injeção i.c.v. de SB-334867 5 mM, SB-334867 10 mM ou veículo na VE, VT e fR de sapos Rhinella schneideri submetidos à hipercarbia
durante a fase escura. A seta indica o momento da microinjeção. Dados
apresentados em porcentagem. * e + indicam diferença significativa de
Figura 12. Efeito da injeção i.c.v. de SB-334867 5 mM, SB-334867 10 mM ou veículo na VE, VT e fR de sapos Rhinella schneideri submetidos à hipóxia durante
a fase escura. A seta indica o momento da microinjeção. Dados apresentados em
forma de porcentagem.
Tabela 1. Média com erro padrão dos valores de VE, VT e fR da fase clara dos animais microinjetados com veículo, SB-334867 5 mM ou SB-334867 10 mM após
microinjeção, hipercarbia e hipóxia.
Tabela 2. Média com erro padrão dos valores de VE, VT e fR da fase escura dos animais microinjetados com veículo, SB-334867 5 mM ou SB-334867 10mM após
microinjeção, hipercarbia e hipóxia.
Tabela 3. Valores de pHa, PaCO2, PaO2 e HCO3- dos animais microinjetados com veículo, SB-334867 5 mM ou SB-334867 10mM na fase clara.
13
2. INTRODUÇÃO
O presente estudo trata da orexina A e seu papel na modulação das
respostas respiratórias à hipercarbia e hipóxia em sapos Rhinella schneideri.
O sistema respiratório tem como função básica fornecer O2 (gás oxigênio)
aos tecidos e retirar o CO2 (dióxido de carbono) produzido pelo metabolismo
celular, regulando o processo de troca gasosa para manter as pressões parciais
desses gases no sangue arterial (PaCO2 e PaO2) relativamente constantes.
Dessa maneira, as trocas gasosas são equilibradas em função da demanda do
metabolismo.
A atividade respiratória é gerada no sistema nervoso central (SNC) e é
dependente de aferências que trazem ao SNC informações sobre as pressões
parciais dos gases sanguíneos, o pH dos líquidos corporais, os gases inspirados
e o estado de estiramento pulmonar, informações essas detectadas por químio e
mecanorreceptores. A integração destas aferências no SNC resulta na modulação
das eferências aos músculos respiratórios (Wang et al., 1999). Aumentando ou
diminuindo-se essa atividade respiratória é possível manter os gases sanguíneos
do meio interno dentro de valores fisiológicos adequados para cada estado de
atividade.
É conhecido que o ritmo respiratório de anfíbios é gerado espontaneamente
no bulbo (Torgerson et al., 2001) e depende muito pouco de aferências dos
quimiorreceptores para ocorrer (Kinkead e Milsom, 1994; Smatresk e Smits,
1991), ou seja, se dá por meio de neurônios que se auto despolarizam. Wilson et
14 ritmogênica na preparação in vitro do tronco encefálico de Lithobates
catesbeianus e classificaram essas regiões como sendo os osciladores bucal e pulmonar. De acordo com esses autores, essas regiões são espacialmente
distintas (oscilador bucal: mais caudal no bulbo; oscilador pulmonar: mais rostral)
mas se interconectam. Adicionalmente, dados deste estudo suportam a hipótese
de osciladores distintos, já que manipulações farmacológicas tem efeito
diferenciado sobre os ritmos bucal e pulmonar.
2.1. Padrão respiratório
A ventilação em anuros é dependente das aferências aos músculos
respiratórios, narinas e glote. A interação destes resulta em uma variedade de
tipos de eventos e padrões ventilatórios, que podem produzir um fluxo de água
através das brânquias (girinos) ou de ar para os pulmões (anuro adulto). Larvas
de anuros utilizam a bomba bucal e faríngea para produzir um fluxo unidirecional
de água pelas brânquias (Gargaglioni e Milsom, 2007). A bomba bucal é
conservada nos adultos para ventilação dos pulmões e gera dois ritmos
ventilatórios distintos: um bucal contínuo e um pulmonar intermitente. O padrão
pulmonar intermitente se dá pelo fato de a grande maioria dos anuros adultos
terem uma taxa metabólica baixa. Em geral, em condições basais, anuros
apresentam um padrão ventilatório intermitente, no qual as ventilações
pulmonares ocorrem em eventos únicos (single breaths) separados por períodos
de apneia ou em eventos consecutivos (episódio) seguidos por longos períodos
15 A expansão do assoalho bucal permite a entrada de ar para a cavidade
bucal pelas narinas. No momento da compressão, a posição da glote e das
narinas irá determinar se o ar será encaminhado para fora ou para os pulmões. A
deflação pulmonar em situação basal é puramente passiva e ocorre no meio do
ciclo bucal (entre a expansão e contração do assoalho bucal) enquanto a glote
permanece aberta, com o ar do pulmão misturando‐se ao ar puro da cavidade
bucal (Gargaglioni e Milsom, 2007). O aumento do drive respiratório pode causar
um aumento do volume corrente (VT) e da frequência respiratória (fR), podendo
produzir um padrão de respiração contínua (Gargaglioni e Milsom, 2007).
2.2. Respiração em anfíbios
Os primeiros anfíbios surgiram no período devoniano, na Era Paleozóica,
há cerca de 350-400 milhões de anos. A classe Amphibia é representada pelas
ordens Urodela (salamandras), Gyminophiona (cecílias) e Anura (sapos, rãs e
pererecas). Mesmo apresentando várias similaridades esses grupos são muito
diferentes no que se refere à estrutura esquelética e aos modos de vida. São
animais que ocupam vários ecossistemas, tais como: florestas tropicais
equatoriais, ambientes gelados, montanhas, pântanos, cavernas, desertos, entre
outros.
Os anfíbios possuem a fase larval totalmente aquática e, na sua maioria,
fase adulta terrestre. Portanto, esse grupo é um modelo bastante interessante
para o estudo de controle da ventilação em vertebrados. Esta compreensão pode
revelar algumas propriedades fundamentais que estão associadas à emergência
16 metamorfose antes de se tornarem adultos, que prepara a larva aquática para a
vida terrestre. Logo após o nascimento, as trocas gasosas são realizadas através
da pele, passando a ocorrer em três locais concomitantemente durante a
metamorfose (pele, brânquias e pulmões) para, no adulto, ocorrer através da pele
e pulmões (Burggren e West, 1982).
Em rãs adultas da espécie Lithobates catesbeianus, os pulmões são
responsáveis por cerca de 80% da captação de O2, mas por apenas 20% da
excreção de CO2 durante o repouso a 20°C (Burggren e West, 1982). Em
Anaxyrus americanus (Bufo americanus), o pulmão capta 59% do O2 e excreta 21% do CO2 (Hutchison, 1966 apud Ultsch, 1996).
Conforme já mencionado, os anfíbios, assim como os outros tetrápodes,
apresentam quimiorreceptores periféricos e centrais que detectam as alterações
nos gases sanguíneos, levando a ajustes ventilatórios para a manutenção das
pressões de CO2 e O2 no sangue arterial e do equilíbrio ácido-base.
2.3. Transição da respiração aquática para a aérea
A conquista do ambiente terrestre veio acompanhada da transição do modo
de ventilação bimodal (água e ar) para o modo unimodal (ar), que foi de suma
importância na história evolutiva dos vertebrados. Segundo Gans (1970), a
respiração aérea provavelmente surgiu de forma acidental em peixes que
nadavam rente à superfície durante épocas com baixa disponibilidade de O2
durante o período Cambriano. Essa transição afetou diretamente diversos
sistemas e seus mecanismos de controle devido às diferenças das propriedades
17 Devido à baixa capacitância da água ao oxigênio, os vertebrados de
respiração aquática produzem uma taxa elevada de fluxo de água pelas
brânquias, a fim de se obter O2 suficiente para suprir as demandas metabólicas
(Milsom, 2002). Como consequência, o CO2 produzido metabolicamente é
rapidamente excretado pelas brânquias, resultando em uma baixa pressão parcial
arterial de CO2 (Milsom, 2002).
A concentração de O2 no ar atmosférico nos dias de hoje é cerca de 30
vezes maior do que na água à 15°C, e a água é 800 vezes mais densa e 50 vezes
mais viscosa que o ar atmosférico (Schmidt‐Nielsen, 2002), possibilitando aos
animais de respiração aérea uma menor taxa ventilatória da superfície respiratória
(Rahn, 1966 apud Ultsch, 1996). Essa menor ventilação nos animais de
respiração aérea está associada à uma menor eliminação de CO2 comparada aos
animais que respiram água, sendo que os animais de respiração aérea são
considerados retentores de CO2. Desta forma, a transição do ambiente aquático
para o terrestre resultou em maiores valores de PCO2 (Nattie e Li, 2012). Este
fato, associado à perda das brânquias como local primário de eliminação do CO2,
gerou um novo desafio aos vertebrados terrestres: a eliminação do CO2 e
regulação do pH (Ultsch, 1996).
Juntamente com essa mudança, uma grande transformação ocorreu nos
mecanismos de controle da ventilação nos vertebrados: em animais de respiração
aquática o O2 exerce o papel dominante no controle químico da ventilação
(Dejours, 1973 apud Milson, 2002). Contudo, com o aumento da PaCO2 em
animais de respiração aérea, aumentou‐se a sensibilidade a esse gás, que passa
18 regulação do CO2 é essencial, já que ele está associado ao pH e os organismos
costumam ser pouco tolerantes a alterações no pH dos líquidos corporais.
2.4. Quimiorrecepção em vertebrados
A manutenção em concentrações adequadas da pressão parcial arterial de
O2 (PaO2), da pressão parcial arterial de CO2 (PaCO2) e do pH é realizada por
células especializadas chamadas de quimiorreceptores, que podem ser
classificados como periféricos e centrais. A hipercarbia é caracterizada por um
aumento da pressão parcial de CO2 no ar inspirado e a hipóxia, pela queda na
pressão parcial de O2 no ar inspirado. A hipercapnia é o aumento da PaCO2 nos
líquidos corporais e pode ser causada por hipercarbia.
2.4.1. Quimiorreceptores de O2
Estão localizados na periferia, mas existem evidências de que existem
receptores centrais de O2, porém, sua participação na resposta sistêmica ainda
não foi estudada (Neubauer e Sunderram, 2004; Winmill et al., 2005). Em peixes,
os quimiorreceptores de O2 estão presentes nas brânquias e respondem a
diferentes concentrações desse gás tanto no ambiente quanto no sangue arterial
(Milsom e Burleson, 2007; Perry et al., 2009). Também há evidências de sítios
receptores fora do aparato branquial, incluindo os receptores venosos de O2
(Barrett e Taylor, 1984) e receptores extrabranquiais (Butler et al., 1977). Em
19 bifurcação das artérias carótidas interna e externa, no arco aórtico e na artéria
pulmocutânea (Gargaglioni e Milsom, 2007).
Em anfíbios, a hipóxia induz um aumento da ventilação, que ocorre
principalmente pela estimulação dos quimiorreceptores localizados no labirinto
carotídeo (Boutilier e Toews, 1977; Van Vliet e West, de 1992; Wang et al., 1994).
O labirinto carotídeo é um leito vascular em forma de labirinto que surge a partir
da artéria carótida (Toews et al, 1982; Kusakabe, 2002, 2009). É considerado
homólogo aos quimiorreceptores presentes no primeiro arco branquial de peixes
e ao corpo carotídeo de mamíferos, com base na sua origem embrionária e
inervação por ramos do IXº e Xº pares de nervos cranianos (Adams, 1958; Ishii et
al., 1966; Van Vliet e West, 1987; West e Van Vliet, 1992; Kusakabe, 2002, 2009; Milsom e Burleson, 2007). Contudo, a denervação bilateral do labirinto carotídeo
não abole completamente a resposta ventilatória à redução da PO2 (Van Vliet e
West, 1986). Duas outras áreas, o arco aórtico e a artéria pulmocutânea também
são considerados sítios quimiossensíveis em anfíbios (Lillo, 1980; Hoffmann e de
Souza, 1982; Ishii et al., 1985; Wang et al., 2004). Estudo recente de Reyes et al.,
(2014) demonstrou a presença de células imunorreativas para tirosina hidroxilase
e serotonina no labirinto carotídeo, no arco aórtico e na artéria pulmocutânea de
rãs (Lithobates catesbianus) e uma subpopulação de células imunorreactivas para
ambos no labirinto da artéria carótida. Com base na distribuição, morfologia
celular, inervação, e conteúdo neuroquímico, os autores sugeriram que os três
tipos de células acima mencionados, podem funcionar potencialmente como
20 Os quimiorreceptores dos tetrápodes adultos são considerados homólogos
aos dos peixes - localizados no primeiro e segundo arco branquiais - (Milsom e
Burleson, 2007). Existe uma possível redução na distribuição dos
quimiorreceptores periféricos de O2 de múltiplos e dispersos sítios em peixes e
anfíbios para um único e dominante em aves e mamíferos. Essa redução estaria
associada à transição da respiração aquática para a respiração aérea exclusiva,
já que no ar o O2 é mais abundante e menos variável que na água (Milsom e
Burleson, 2007).A resposta frente à hipóxia ambiental ou arterial nos vertebrados
adultos é, em geral, uma hiperventilação.
2.4.2. Quimiorreceptores de CO2
Os quimiorreceptores de CO2 em peixes são encontrados nas brânquias,
sendo ativados apenas quando aumenta-se a concentração desse gás no
ambiente (Perry e Mckendry, 2001; Perry et al., 2009; Reid et al., 2000), o que
está de acordo com o fato da PaCO2 destes animais ser muito baixa - a PCO2 da
água em condições normais é em torno de 1mmHg e a PaCO2 dos peixes de
respiração aquática é de 2 a 3mmHg (Howell, 1970; Cameron e Randall, 1972).
Já nos tetrápodes, os quimiorreceptores de CO2/pH no sistema vascular
encontram‐se geralmente em congruência com os de O2 e sua estimulação gera
uma resposta hiperventilatória (Milsom, 2002). Esses receptores também são
encontrados nas vias aéreas no caso de anfíbios e répteis: são os chamados
quimiorreceptores olfatórios. Ainda existem os receptores de estiramento
pulmonar (PSR), encontrados nos pulmões (Milsom et al., 2004). Os receptores
21 periféricos primários em todos os demais vertebrados (Milsom, 2002). Em
mamíferos e aves os quimiorreceptores periféricos para CO2/pH estão localizados
nos corpos carotídeos e arco aórtico. Associado à redução dos sítios de
quimiossensibilidade periférica ao CO2/pH está o surgimento dos
quimiorreceptores centrais. Uma vez que surgiram na história evolutiva, sua
atividade predomina sobre a dos demais receptores no controle da ventilação em
condições basais (Milsom, 2002).
Os quimiorreceptores centrais já foram encontrados em todos os grupos de
tetrápodes (Milsom, 2002). Estes receptores são banhados pelo líquor e isolados
do sistema circulatório pela barreira hematoencefálica, que é pouco permeável ao
íon H+, protegendo o encéfalo de variações no pH sistêmico, porém, altamente
permeável ao CO2 (Hlastala e Berger, 2001).
Em mamíferos e anfíbios, em um primeiro momento foram demonstradas
áreas quimiossensíveis na superfície ventro-lateral do bulbo, sendo banhadas
pelo quarto ventrículo encefálico (Coates et al., 1993; Togerson et al., 2001). A
contribuição relativa de cada uma dessas áreas para o controle respiratório em
mamíferos vem sendo amplamente debatida (Nattie e Li, 2005; Guyenet et al.,
2008). Contudo, com os estudos em mamíferos, várias evidências começaram a
indicar que os quimiorreceptores centrais estão amplamente distribuídos no SNC,
e não somente no bulbo, e seriam áreas quimiossensíveis o núcleo do trato
solitário (NTS), o núcleo fastigial, o núcleo retrotrapezóide (Mulkey et al. 2004;
Guyenet et al. 2005), a rafe rostral bulbar, o locus coeruleus (Nattie, 2001;
22 2009; Dias et al., 2010; Williams e Burdakov, 2008; Kuwaki et al., 2010; Williams
et al., 2007).
O mesmo vem acontecendo para os anfíbios. Estudos evidenciaram
algumas áreas quimiossensíveis no SNC desses animais que não pertencem à
superfície ventro-lateral do bulbo, como o locus coeruleus (Noronha-de-Souza et
al., 2006; Santin e Hartzler, 2013). Novos estudos apontam ainda que o locus
coeruleus parece ser uma região quimiossensível também em lagartos monitores (Varanus exanthematicus) (Zena et al., em preparação).
2.5. As orexinas
Como citado anteriormente, os neurônios orexinérgicos em mamíferos são
considerados quimiossensíveis ao CO2/pH. As orexinas, também conhecidas
como hipocretinas, são pequenos neuropeptídios produzidos por neurônios no
hipotálamo. Existem dois subtipos desses neuroptídeos: a orexina A e a orexina
B (hipocretina-1 e hipocretina-2, respectivamente) ambas clivadas a partir de um
precursor comum, a prepro-orexina (De Lecea et al., 1998; Sakurai et al., 1998),
e ligam-se a dois tipos de receptores acoplados à proteína G: receptor-1 de
orexina (OX1R) e receptor-2 de orexina (OX2R) (Smart et al. 1999, 2001). Ainda
não estão claras as diferentes funções de cada orexina. O receptor do tipo OX1R
é altamente seletivo à orexina A, enquanto o OX2R comporta-se como um receptor
não seletivo, ligando-se aos dois subtipos de orexina (de Lecea et al. 1998;
Sakurai et al. 1998).
Os corpos celulares dos neurônios orexinérgicos encontram-se somente no
23 seus axônios por todo o encéfalo, exceto para o cerebelo (Peyron et al., 1998;
Nambu et al., 1999). Esta propriedade anatômica explica a grande multiplicidade
de funções que são moduladas pela orexina como, por exemplo: a sensação de
fome, o estado de sono-vigília, resposta ao estresse, nocicepção, bem como o
controle cardiovascular e respiratório (Dube et al., 1998; Sakurai et al., 1998;
Haynes et al., 2000; Bingham et al., 2001; Duxon et al., 2001).
Esse neurotransmissor está envolvido com uma ampla gama de processos
fisiológicos como o ciclo sono-vigília, a alimentação, estresse, homeostase
energética, dor, metabolismo, sistema de busca-e-recompensa, situações de
luta-e-fuga e até mesmo com a secreção hormonal (de Lecea et al., 1998; Sakurai et
al., 1998).
A regulação do sono/vigília é a que mais vem sendo estudada.
Anatomicamente, neurônios orexinérgicos estão situados entre neurônios
promotores do sono na VLPO (núcleo pré-óptico ventro-lateral) e neurônios
estimuladores da vigília localizados no tronco encefálico. Neurônios da VLPO tem
um papel crucial na iniciação do sono NREM (não-rem) e na manutenção dos
sonos NREM e REM (Sherin et al., 1998). Esses neurônios apresentam uma alta
taxa de disparo durante o sono, e tem sua taxa de disparo diminuída durante a
fase de vigília. Por outro lado, neurônios monoaminérgicos do TMN (núcleo motor
do trigêmeo), LC (locus coeruleus) e DR (rafe dorsal) desempenham importante
papel na manutenção da vigília. Esses neurônios disparam tonicamente durante
a vigília e se silenciam durante o sono REM (Sherin et al., 1998; Vanni-Mercier et
24 relacionadas ao despertar durante a vigília e prevenindo indesejáveis transições
entre o sono e a vigília.
As concentrações de orexina no líquido cefalorraquidiano variam durante o
ciclo diurno, sendo que os níveis mais altos em roedores ocorrem durante o
período escuro-ativo e os níveis mais baixos durante o período claro-inativo
(Desarnaud et al., 2004). Em contraste, a taxa de disparo dos neurônios
orexinérgicos está correlacionada com o estado de vigília, sendo maior nos
estados de maior alerta (Lee et al., 2005; Mileykovskiy et al., 2005).
Além disso, tem sido demonstrado que as orexinas exercem um importante
papel na modulação de funções cardiorrespiratórias em mamíferos – Figura 1
(Nattie e Li, 2012).
25 2.5.1. Orexinas e quimiorrecepção
Recentemente, foi demonstrado que os neurônios orexinérgicos do
hipotálamo de ratos são profundamente afetados por alterações no CO2 e pH,
estimulam a ventilação e são altamente sensíveis a variações mínimas no pH.
(Williams et al., 2007).
O papel das orexinas na modulação da respiração é conhecido por ter
evidências anatômicas e funcionais. Os axônios orexinérgicos se projetam para
áreas envolvidas no controle respiratório, como neurônios simpato-excitatórios do
RVLM (bulbo ventro-lateral rostral), complexo Pré-Botzinger, NTS (núcleo do trato
solitário), RTN (núcleo retrotrapezóide), rafe, LC (locus coeruleus), núcleo frênico
e núcleo hipoglossal, e seus receptores são expressos em todas essas áreas
(Fung et al., 2001; Krout et al., 2003; Machado et al., 2002; Rosin et al., 2006;
Volgin et al., 2002; Young et al., 2005; Dias et al., 2009).
Evidências fisiológicas indicam que as orexinas afetam a ventilação.
Injeções i.c.v. de orexina aumentam a fR e o VT de ratos (Zhang et al., 2005).
Adicionalmente, a microinjeção de orexina A no Complexo Pré-Botzinger e a
microperfusão nos motoneurônios frênicos resultam em um aumento na atividade
do diafragma (Young et al., 2005).
A orexina tem papel importante no controle da ventilação nos estados de
vigília (Nakamura et al. 2007; Williams e Burdakov, 2008). Recentemente, estudos
com ratos transgênicos indicam que a orexina tem função crucial na
quimiossensibilidade a CO2/pH. Ratos knockout para prepo-orexina (o precursor
orexinérgico) sofrem uma atenuação no quimiorreflexo à hipercapnia durante a
26 com a administração das orexinas A e B (Deng et al. 2007; Nakamura et al. 2007).
Além disso, administrações intracerebroventriculares de um antagonista do
receptor-1 de orexina (SB-334867), diminuíram o quimiorreflexo respiratório em
ratos (Deng et al. 2007). O disparo dos neurônios orexinérgicos são extremamente
sensíveis a mudanças fisiológicas na concentração de CO2 e pH extracelulares in
vitro (Williams et al. 2007). Dias et al. (2008) demonstrou em ratos que a diálise com o antagonista de OX1R, SB-334867, especificamente na região do RTN,
causou uma atenuação da resposta ventilatória à hipercapnia, que foi
substancialmente maior durante a vigília do que durante o sono NREM. Este
resultado suporta a hipótese de que um dos mecanismos pelos quais os neurônios
orexinérgicos modulam a respiração é pelos seus efeitos nos OX1Rs do RTN.
2.5.2. Orexinas em anfíbios
Curiosamente, as sequências de aminoácidos das orexinas A e B foram
altamente conservadas nos diferentes grupos de vertebrados (Alvarez, 2002,
Peyron et al., 2000). As orexinas tem sido descritas em todas as classes dos
vertebrados e os neurônios orexinérgicos estão localizados, em sua grande
maioria, no hipotálamo, embora em vários núcleos. Adicionalmente, as fibras
orexinérgicas estão espalhadas pelo sistema nervoso central inervando áreas
similares.
Em anfíbios, Singletary et al. (2005) e Galas et al. (2001) encontraram uma
população de neurônios orexinérgicos no núcleo supraquiasmático em Hyla
27 orexinérgicos estão restritos ao hipotálamo ventral. Isso mostra que distribuição
dos neurônios imunorreativos para orexina no SNC é bem semelhante à de
mamífero.
Em mais um estudo em Pelophylax ridibundus foi realizada
imunohistoquímica para os neurônios orexinérgicos e estes foram localizadas em
vários núcleos diencefálicos, sendo que a população predominante desses
neurônios se encontra nos núcleos supraquiasmáticos (López et al., 2009).
Contudo, as fibras orexinérgicas estão amplamente distribuídas no SNC,
sugerindo que este peptídeo pode estar envolvido em várias funções (López et
al., 2009).
Não existem estudos sobre a participação do sistema orexinérgico no
controle cardiorrespiratório em anfíbios e nem a localização exata desses
neurônios em sapos Rhinella schneideri, sendo portanto o objetivo do presente
28
3. OBJETIVO
A proposta do presente trabalho foi avaliar a localização dos neurônios
orexinérgicos em sapos Rhinella schneideri e verificar se a neurotransmissão
orexinérgica está envolvida na modulação central das respostas à hipercarbia e
hipóxia nas fases clara e escura, uma vez que pelo menos em mamíferos, as
concentrações de orexina no líquor variam de acordo com a fase clara/escura
(Desarnaud et al., 2004). Desta forma, nosso estudo foi dividido nos seguintes
experimentos:
1) Imunorreatividade para orexina para localização dos neurônios
orexinérgicos no encéfalo da espécie;
2) Comparar as respostas respiratórias antes e após a injeção i.c.v. de
SB-334867 durante situações de normoxia normocárbica, hipercarbia e hipóxia na
fase clara;
3) Comparar as respostas respiratórias antes e após a injeção i.c.v. de
SB-334867 durante situações de normoxia normocárbica, hipercarbia e hipóxia na
fase escura.
29
4. MATERIAL E MÉTODOS
4.1. Animais
Foram utilizados 50 sapos da espécie Rhinella schneideri (Werner, 1894)
adultos machos e fêmeas, pesando entre 100 e 220g, coletados nos arredores da
cidade de Jaboticabal, SP em áreas urbanas, locais alagados, próximo a lagoas
e em pesqueiros.
Os animais foram capturados, transportados e mantidos no laboratório sob
a Licença do ICMBio 28160-1 e todos os procedimentos foram conduzidos sob
aprovação do Comitê de Ética da Faculdade de Ciências Agrárias Veterinárias de
Jaboticabal (Protocolo: 006731/12) e sob as normas do Colégio Brasileiro de
Experimentação Animal (COBEA).
Os animais foram mantidos em tanques de 50 litros com livre acesso à água
livre de cloro e área seca à temperatura de 25C e submetidos a um ciclo
claro/escuro de 12/12h (iluminação artificial). Foram alimentados três vezes por
semana com ração, grilos, tenébrios e larvas de mariposa. Os animais utilizados
nos experimentos foram mantidos no laboratório por, no mínimo, dez dias antes
da realização dos procedimentos.
4.2. Drogas e misturas gasosas utilizadas
As misturas gasosas utilizadas foram:
1) Mistura hipercárbica - 5% CO2, 21% O2 e N2 balanço (White Martins)
30 Anticorpos, fármacos e doses utilizadas:
1) Orexin A (C-19) Goat IgG (Interprise USA Corporation)
2) Anticorpo secundário: anti-goat biotinilado produzido em coelho (Vector
Laboratories)
3) SB-334867 (Tocris Bioscience): antagonista de receptores OX1R
Doses: 5 e 10mM
4) Veículo para SB-334687: 4% DMSO e 35% 2-hydroxypropyl)-β
-cyclodextrin (2-HβC, Sigma, EUA) em líquor artificial.
O SB-334867 foi preparado conforme previamente descrito por Deng et al.
(2007). O volume injetado das drogas foi de 1 microlitro, à velocidade de 1,5
μL/min e as microinjeções foram feitas no ventrículo lateral encefálico.
4.3. Procedimentos
4.3.1. Imunohistoquímica
Foram utilizados 3 animais intactos para a análise histológica a fim de se
identificar os neurônios orexinérgicos na espécie. Os sapos foram anestesiados
por imersão em solução de MS-222 0,3% (ácido etil éster 3-aminobenzóico;
Sigma, EUA) e perfundidos através do coração com tampão fosfato salina (PBS
0,01 M, pH de 7,4), seguido por solução de tampão fosfato (PB 0,1 M, pH de 7,4)
com 4% de paraformaldeído (PFA). Os encéfalos foram armazenados no mesmo
fixador a 4°C por 4 horas e posteriormente mantidos em solução de sacarose 30%
dissolvida em PBS à 4°C por 48 horas. O tecido foi embebido em Tissue Tek
31 Os cortes de cada encéfalo foram coletados em placas e lavados com PBS 0,01M,
e então foi realizada a imunohistoquímica para orexina A pelo método
free-floating.
Foram feitas duas diluições do anticorpo primário (1:200 e 1:500). Todas
as soluções foram preparadas em PBS 0,01M (pH 7,4), com exceção da última
etapa, em que o reagente foi diluído em tampão Tris. O bloqueio das peroxidases
endógenas fez-se por meio de uma lavagem de 15 minutos em solução contendo
1% de peróxido de hidrogênio (H2O2). Os cortes foram incubados em solução
contendo o anticorpo primário desenvolvido em carneiro por 48h a 4°C em um
agitador. Foi feita então a incubação em anticorpo secundário biotinilado
produzido em coelho por 1 hora seguida da incubação com o kit ABC da
Vectastain (Vector Laboratories) por mais 1 hora. O complexo formado foi
visualizado após lavagem com solução contendo tetracloridrato de
3,3-diaminobenzidina (DAB 0,5 mg/mL; Vector Laboratories) intensificada com 0,04%
de sulfato de níquel e 0,01% de H2O2 em tampão Tris por cerca de 2 minutos.
Entre as etapas, todos os cortes foram completamente lavados em PBS. Após
montagem em lâminas gelatinizadas, secagem, desidratação em bateria de álcool
(70, 90, 100 e 100%), xilol, e colocação das lamínulas os cortes puderam ser
observados em microscópio ótico e algumas delas serão mostradas a seguir.
4.3.2. Cirurgia estereotáxica
Todos os animais foram anestesiados por imersão em solução aquosa de
MS-222 0,3% (ácido etil éster 3-aminobenzóico; Sigma, EUA) e fixados em um
32 EUA). A pele que recobre o crânio foi removida e foi feita uma pequena abertura
acima da região do telencéfalo, com o auxílio de um motor de baixa rotação (LBC,
Beltec, Araraquara). Uma cânula guia preparada a partir de uma agulha
hipodérmica, com 14 mm de comprimento e 0,70 mm de diâmetro externo foi
fixada ao topo do aparelho estereotáxico e inserida no ventrículo lateral encefálico
de cada animal. As coordenadas para a inserção da cânula guia foram adaptadas
de um atlas de encéfalo de anuros (Donkelaar, 1998). O deslocamento da coluna
do líquor artificial em um manômetro indicava a posição correta da cânula no
ventrículo lateral. O orifício ao redor da cânula foi preenchido com uma pasta
constituída por uma mistura em partes iguais de parafina e glicerina. As cânulas
foram fixadas ao crânio por meio de parafusos e cimento acrílico e um mandril foi
introduzido no interior de cada cânula-guia com o objetivo de prevenir oclusão e
infecção. Ao final da cirurgia os animais receberam profilaxia com antibiótico de
amplo espectro (Enrofloxacina, Schering-Plough) e um hiperalgésico e
anti-inflamatório (Flunixina Meglumina, Schering-Plough) nas doses corrigidas para
33
Figura 2. Estereotaxia para implantação de cânula-guia no ventrículo lateral de Rhinella schneideri
4.3.3. Cirurgia para implantação de cânula na artéria ilíaca
Cinco dias após a implantação da cânula-guia no ventrículo lateral
encefálico, os animais foram novamente anestesiados com MS-222 e submetidos
à inserção de um segmento de tubo de polietileno (um segmento de PE-50,
Intramedic Polyethylene Tubing, Clay Adams) na artéria ilíaca direita, de diâmetro
externo de 1,5 mM, para coleta do sangue para a realização das medidas de
gasometria (determinação do pH e pressão parcial dos gases sanguíneos).
Para a análise do sangue foi utilizado um analisador manual portátil (i-STAT
System, Abbot) onde era inserido um cartucho (EG7+, i-STAT System, Abbot) com
34
Figura 3. Cirurgia para implantação de cânula na artéria ilíaca de Rhinella schneideri
4.3.4. Fixação da máscara para medida de ventilação
Previamente, foram feitos moldes da cabeça dos animais em alginato. A
partir do contramolde, feito em gesso, construíram-se máscaras em silicone nas
quais foram acoplados pneumotacógrafos. As máscaras se encaixavam ao redor
das narinas dos animais, e o ar passava por dentro do pneumotacógrafo durante
a inspiração e a expiração.
Após a cirurgia para a implantação da cânula na artéria ilíaca do animal,
quando o animal estava ainda se recuperando do efeito do anestésico, colava-se
35
Figura 4. Detalhe da máscara para medida de ventilação com pneumotacógrafo acoplado. Foto: Carolina Noronha de Souza.
4.4. Protocolo experimental
Todos os experimentos foram realizados com os animais não
anestesiados, à temperatura de 25°C, sete dias após a cirurgia estereotáxica. Os
sapos foram colocados individualmente nas câmaras experimentais pelo menos 8
horas antes do início do experimento para habituação. As câmaras experimentais
eram ventiladas com ar atmosférico (normoxia normocárbica) por meio de uma
bomba de aquário com fluxo de 1,5L/min. O ar atmosférico foi administrado por
30 min (ou mais até o animal se acalmar), em que foram realizadas as medidas
controle de ventilação e análise sanguínea. Realizou-se, então, a microinjeção do
36 submetidos à primeira mistura gasosa (hipercarbia ou hipóxia) por 30 minutos,
seguidos de 1 hora de recuperação (ar atmosférico) e então foi administrada a
segunda mistura gasosa (hipóxia ou hipercarbia) também por 30 minutos. A ordem
das misturas foi escolhida aleatoriamente e o fluxo foi mantido em 1,5L/min. As
medidas de ventilação foram realizadas nos seguintes tempos: final da normóxia
normocárbica (medida controle), 5, 10, 15 e 20 min após a microinjeção (efeito
somente da microinjeção em normóxia normocárbica) e 5, 10, 20 e 30 min após
cada mistura (hipóxia ou hipercarbia). A análise do pH e gases sanguíneos foi
realizada somente no final de cada condição experimental.
Os experimentos foram divididos em dois grupos: o grupo do dia, no qual
os experimentos foram realizados durante a fase de não-atividade da espécie,
dado que é uma espécie de hábito noturno; e o grupo da noite, no qual os
experimentos foram realizados durante a fase de atividade dos sapos. Os
experimentos do dia foram efetuados aleatoriamente, de manhã, tendo início às
8h, ou à tarde, tendo início às 13h e foram realizados experimentos com o
antagonista SB-334867 (5 e 10mM) ou veículo. Os experimentos da noite tiveram
início às 19h e foram realizados experimentos com as mesmas doses do
antagonista SB-334867 (5 e 10mM) e veículo.
Para simplificar as análises e facilitar o entendimento, dividimos os
experimentos nos seguintes protocolos:
4.4.1. Protocolo 1. Fase clara
37 Protocolo 1.2. Efeito da injeção i.c.v. de SB-334867 A sobre a ventilação durante a hipercarbia
Protocolo 1.3. Efeito da injeção i.c.v. de SB-334867 sobre a ventilação durante a hipóxia
4.4.2. Protocolo 2. Fase escura
Protocolo 2.1. Efeito da injeção i.c.v. de SB-334867 sobre a ventilação durante a normocarbia
Protocolo 2.2. Efeito da injeção i.c.v. de SB-334867 sobre a ventilação durante a hipercarbia
Protocolo 2.3. Efeito da injeção i.c.v. de SB-334867 sobre a ventilação durante a hipóxia
4.5. Medidas de ventilação
A ventilação pulmonar foi diretamente medida pelo método
pneumotacográfico (Glass et al., 1978) já utilizado anteriormente em Rhinella
schneideri (Branco et al., 1992; Gargaglioni et al., 2002; Noronha-de-Souza et al., 2006; Wang et al., 1994).
O pneumotacógrafo é formado por um conjunto de tubos paralelos, que
garantem o fluxo laminar de ar durante a respiração. De acordo com o princípio
de Poiselle, o fluxo laminar ao longo do tubo é proporcional ao gradiente de
pressão nas extremidades desse tubo. A diferença de pressão no
38 foi transmitido a de um conversor analógico-digital, digitalizados em um
computador equipado com um software de aquisição de dados e então analisados
com o mesmo software (MLT141 Spirometer, PowerLab System,
ADInstruments/LabChart Software, version 7.3, Sydney, Australia). Tubos fizeram
a conexão entre o pneumotacógrafo e o transdutor diferencial de pressão.
Figura 5. Desenho esquemático do aparato experimental utilizado para a realização dos experimentos.
4.6. Análise dos dados
A frequência respiratória (fR) foi quantificada pela análise do número de
eventos ventilatórios por minuto (eventos/min). O volume corrente (VT) foi obtido
a partir da integral (área do pico) do sinal do fluxo inspiratório (mL.Kg-1). A
ventilação expirada (VE) de cada animal foi calculada a partir da fórmula VE = FR .
VT (mL.Kg-1.min-1).
Conforme já citado anteriormente, as medidas de ventilação foram
efetuadas nos tempos: fim da normóxia normocárbica, 5, 10, 15 e 20 min após a
39 análise do pH e gases sanguíneos foi realizada somente no final de cada condição
experimental.
Os dados foram analisados com o programa LabChart versão 7.3 de acordo
com os protocolos propostos. Para os protocolos 1.1 e 2.1 (Efeito da injeção i.c.v.
de SB-334867 sobre a ventilação durante a normocarbia nas fases clara e Efeito
da injeção i.c.v. de SB-334867 sobre a ventilação durante a normocarbia na fase
escura), foram utilizados o tempo final (20 minutos) após a microinjeção e foram
comparados os parâmetros ventilatórios da fase clara e escura por análise de
variância (ANOVA) de uma via com teste de comparação múltipla de Tuckey.
Para os protocolos restantes (1.2, 1.3, 2.2 e 2.3), foi utilizada análise de
variância (ANOVA) de duas vias com pós-teste de Bonferroni. Todos os dados
apresentados nos gráficos de ventilação estão apresentados em forma de
porcentagem em relação ao basal (normóxia normocárbica antes da microinjeção)
devido à grande variabilidade individual existente em animais silvestres.
Para a análise dos dados de gasometria foi utilizada análise de variância
(ANOVA) de duas vias com pós-teste de Bonferroni e posterior comparação entre
os grupos por meio de análise de variância (ANOVA) de uma via com pós-teste
de comparação múltipla de Tuckey.
Além disso, também foi realiza a comparação de todos os parâmetros entre
as duas fases do ciclo diurno dos animais, ou seja, a fase clara e a fase escura.
Para tal, foi utilizado teste t não pareado, utilizando os dados brutos.
Foram consideradas significativas diferenças em que o valor de P era
menor que 0,05. As análises estatísticas e os gráficos foram realizados com o
40
5. RESULTADOS
5.1. Localização dos neurônios orexinérgicos no encéfalo de Rhinella
schneideri
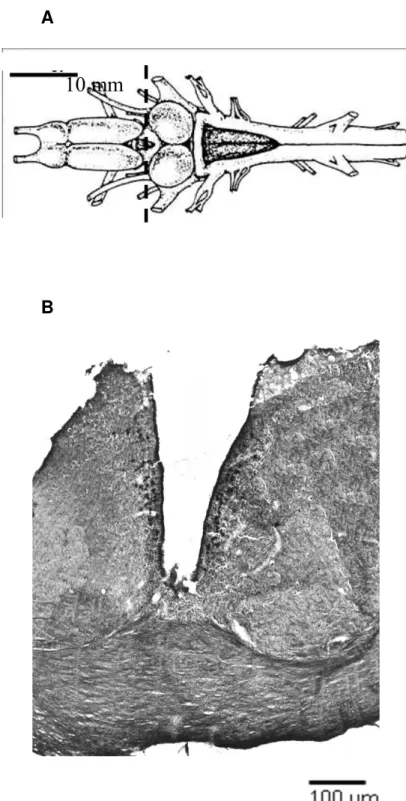
A figura 6 a seguir mostra as marcações de orexina A no encéfalo de
Rhinella schneideri. O grupo de células mais proeminente foi localizado no núcleo supraquiasmático no diencéfalo como mostra o desenho esquemático (Figura 6A).
Estas células apresentam tamanho médio ou pequeno e foram localizadas perto
do terceiro ventrículo ao longo da extensão da rostro-caudal deste núcleo (Figura
41
A
B
Figura 6. A. Desenho esquemático do encéfalo de anuro mostrando o nível da transecção; B. Fotomicrografia de corte transversal do diencéfalo de Rhinella schneideri mostrando a marcação em preto dos corpos celulares dos neurônios orexinérgicos (diluição de 1:500).
42 5.2. Ventilação
Os resultados serão dispostos de acordo com os protocolos já previamente
citados.
5.2.1. Protocolo 1 - Fase clara
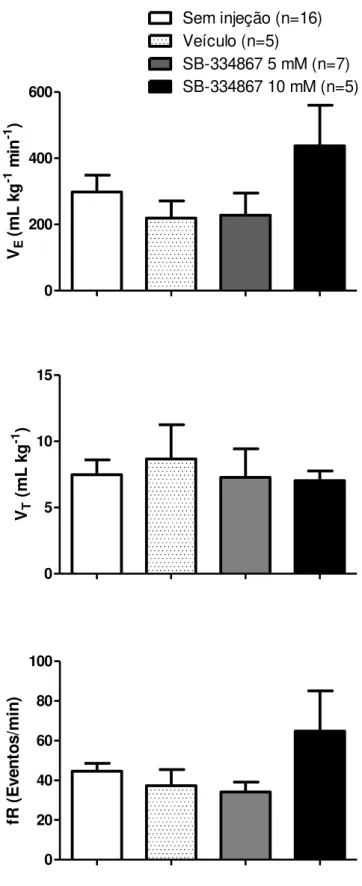
Protocolo 1.1. Efeito da injeção i.c.v. de SB-334867 sobre a ventilação durante a normocarbia
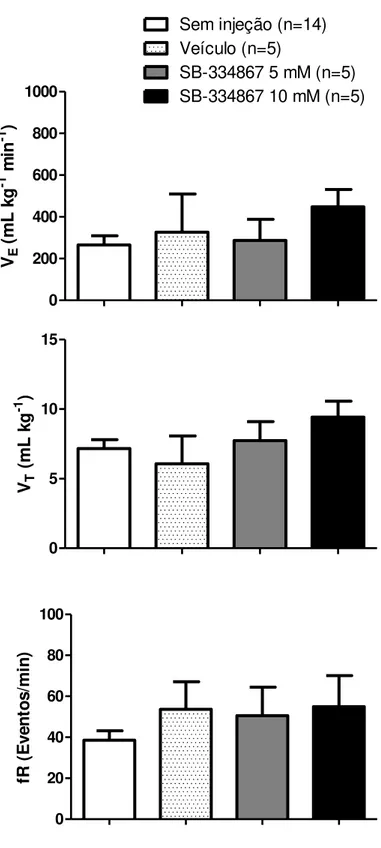
Como pode-se observar na figura 7, a injeção de SB-334867 nas doses de
5 e 10 mM não promoveram nenhuma alteração na ventilação dos animais em
condições de normóxia normocárbica. Adicionalmente, a injeção do veículo não
43 Norm oxia Vehi cle SB-3 3486
7 5m
M
SB-3
3486
7 10
mM
0 200 400 600
Sem injeção (n=16) Veículo (n=5)
SB-334867 5 mM (n=7) SB-334867 10 mM (n=5)
VE
(m
L
kg
-1 m
in -1 ) Norm oxia Vehi cle SB-3 3486
7 5m
M
SB-3
3486
7 10
mM 0 5 10 15 VT ( m L k g -1 ) 0 20 40 60 80 100 fR ( E ve n to s/ m in )
44 Protocolo 1.2. Efeito da injeção i.c.v. de SB-334867 sobre a ventilação durante a hipercarbia
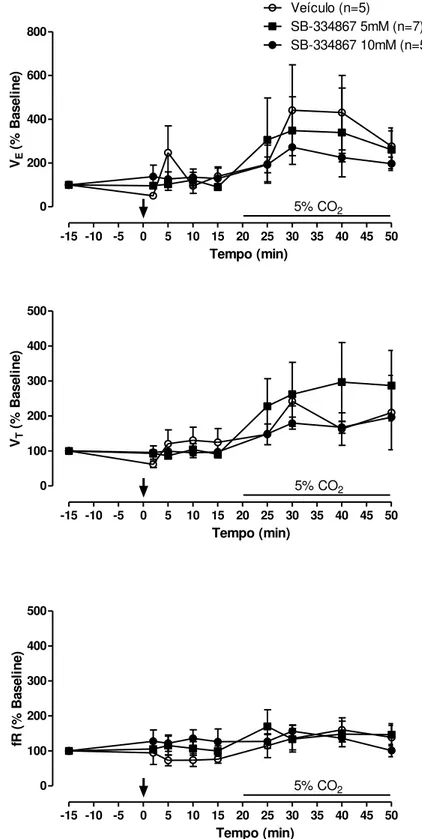
A hipercarbia promoveu aumento na ventilação em todos os grupos (efeito
do tempo: P = 0,0065; F(2,14) = 2,845, sem interação: P = 0,9952) (Figura 8), devido
a um aumento no VT (efeito do tempo: P = 0,0054; F(2,14) = 2,928, sem interação:
P = 0,3726) e não na fR.
A injeção de SB-334867 nas doses de 5 e 10 mM não promoveu alterações
na ventilação dos animais quando expostos à hipercarbia na fase clara (efeito do
45
-15 -10 -5 0 5 10 15 20 25 30 35 40 45 50
0 200 400 600 800 Tempo (min)
5% CO2 Veículo (n=5)
SB-334867 5mM (n=7) SB-334867 10mM (n=5)
VE (% B as el in e)
-15 -10 -5 0 5 10 15 20 25 30 35 40 45 50
0 100 200 300 400 500 Tempo (min)
5% CO2 VT (% B as el in e)
-15 -10 -5 0 5 10 15 20 25 30 35 40 45 50
0 100 200 300 400 500 Tempo (min)
5% CO2
fR (% B as el in e)
46 Protocolo 1.3. Efeito da injeção i.c.v. de SB-334867 sobre a ventilação durante a hipóxia
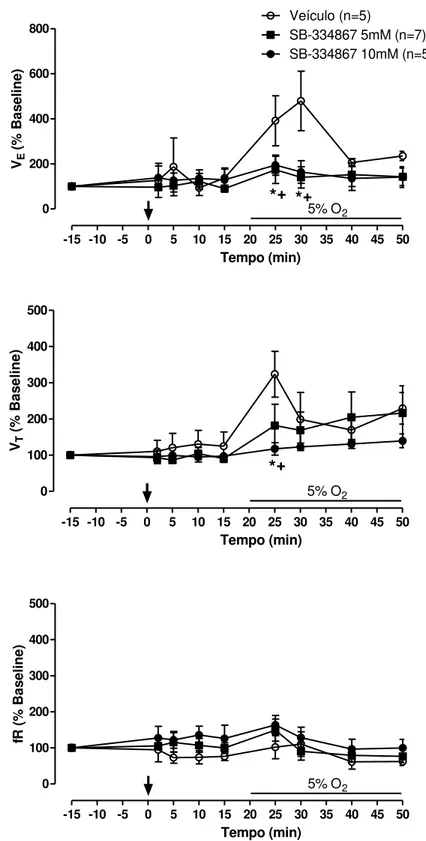
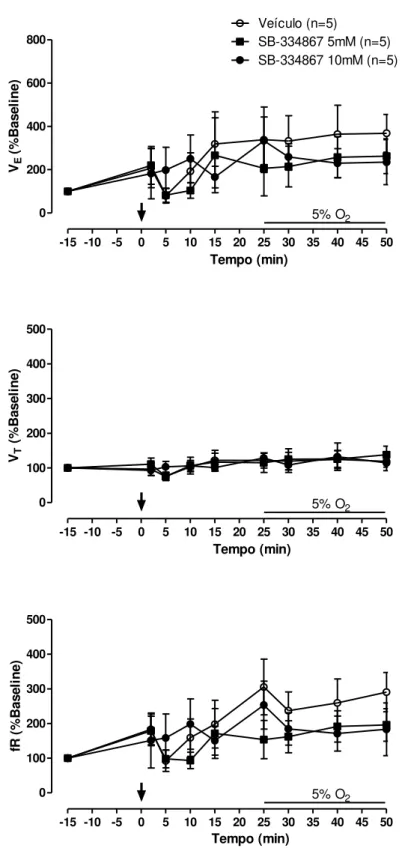
A hipóxia promoveu aumento na ventilação no grupo veículo (efeito do
tempo: P = 0,0015; F(2,14) = 3,412, sem interação: P = 0,1162) (Figura 9), devido a
um aumento no VT (efeito do tempo: P = 0,0060; F(2,14) = 0,4963, sem interação:
P = 0,3726) e não na fR (Figura 9).
A injeção de SB-334867 promoveu uma atenuação da resposta ventilatória
à hipóxia nas duas doses utilizadas (efeito do tratamento: P = 0,0007; F(2,14) =
7,756, sem interação: P = 1,487) (Figura 9). A diferença ocorreu nos tempos 10 e
15 minutos após o início do estímulo (P < 0,05) e foi devido à uma redução no VT
47
-15 -10 -5 0 5 10 15 20 25 30 35 40 45 50
0 200 400 600 800 Tempo (min)
5% O2
*+ *+
Veículo (n=5)
SB-334867 5mM (n=7) SB-334867 10mM (n=5)
VE (% B as el in e)
-15 -10 -5 0 5 10 15 20 25 30 35 40 45 50
0 100 200 300 400 500 Tempo (min)
5% O2
*+ VT (% Ba se line )
-15 -10 -5 0 5 10 15 20 25 30 35 40 45 50
0 100 200 300 400 500 Tempo (min)
5% O2
fR (% B as el in e)
48 5.2.2. Protocolo 2 - Fase escura
Protocolo 2.1. Efeito da injeção i.c.v. de SB-334867 sobre a ventilação durante a normocarbia
Como pode-se observar na figura 10, a injeção de SB-334867 nas doses
de 5 e 10 mM não promoveram nenhuma alteração na ventilação dos animais em
condições de normóxia normocárbica. Adicionalmente, a injeção do veículo não
49 0 200 400 600 800 1000 Veículo (n=5)
SB-334867 5 mM (n=5) SB-334867 10 mM (n=5) Sem injeção (n=14)
VE
(m
L
k
g
-1 m
in -1 ) 0 5 10 15 VT ( m L k g -1 ) 0 20 40 60 80 100 fR ( E ve n to s/ m in )
50 Protocolo 2.2. Efeito da injeção i.c.v. de SB-334867 sobre a ventilação durante a hipercarbia
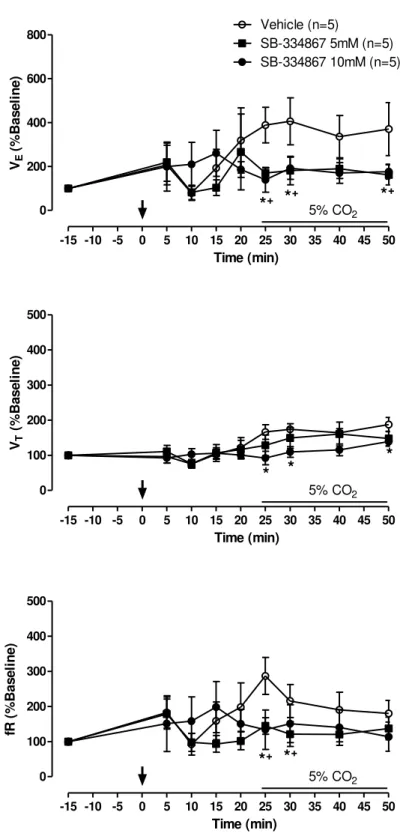
A injeção das duas doses de SB-334867 (5 e 10mM) promoveu uma
atenuação da resposta ventilatória à hipercarbia na fase escura (efeito do
tratamento: P = 0,0230; F(2, 12) = 3,924, sem interação: P = 0,6398) (Figura 11). A
diferença ocorreu nos tempos 10 e 15 minutos após o início do estímulo (P < 0,05)
51
-15 -10 -5 0 5 10 15 20 25 30 35 40 45 50
0 200 400 600 800 Time (min)
5% CO2
Vehicle (n=5)
SB-334867 5mM (n=5) SB-334867 10mM (n=5)
*+ *+ *+ VE (%B as el in e)
-15 -10 -5 0 5 10 15 20 25 30 35 40 45 50
0 100 200 300 400 500 Time (min)
5% CO2
* * * VT ( %B as el in e)
-15 -10 -5 0 5 10 15 20 25 30 35 40 45 50
0 100 200 300 400 500 Time (min)
5% CO2
*+ *+ fR (%B as el in e)
52 Protocolo 2.3. Efeito da injeção i.c.v. de SB-334867 sobre a ventilação durante a hipóxia
A hipóxia promoveu aumento na ventilação em todos os grupos (efeito do
tempo: P = 0,00120; F(2,12) = 3,550, sem interação: P = 0,07600) (Figura 12),
devido a um aumento na fR (efeito do tempo: P = 0,0206; F(2,14) = 3,144, sem
interação: P = 0,4189).A injeção das duas doses de SB-334867 (5 e 10mM) não
causou alterações ventilatórias durante a hipóxia na fase escura (efeito do
tratamento: P = 0,3509; F(2,14) = 1,058, sem interação: P = 0,4189).
53
-15 -10 -5 0 5 10 15 20 25 30 35 40 45 50
0 200 400 600 800 Tempo (min)
5% O2 Veículo (n=5)
SB-334867 5mM (n=5) SB-334867 10mM (n=5)
VE (% B as el in e)
-15 -10 -5 0 5 10 15 20 25 30 35 40 45 50
0 100 200 300 400 500 Tempo (min)
5% O2 VT ( % B as el in e)
-15 -10 -5 0 5 10 15 20 25 30 35 40 45 50
0 100 200 300 400 500 Tempo (min)
5% O2
fR (% B as el in e)
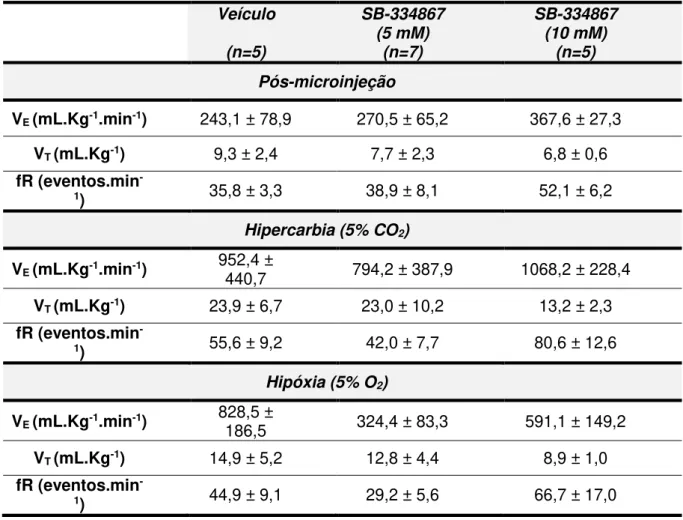
54 Nas tabelas 1 e 2 estão demonstradas as médias com erro padrão dos
valores brutos de VE, VT e fR da fase clara e da fase escura, respectivamente, dos
animais após a microinjeção em normóxia normocárbica (média dos 5, 10, 15 e
20 min) com veículo ou SB-334867 (5 ou 10mM) em hipercabia (tempo de 30 min
após o início do estímulo) e hipóxia (tempo de 30 min após o início do estímulo).
Comparando os valores das fases clara e escura, não houve diferença
entre os valores de VE, VT e fR em nenhuma das condições.
Tabela 1. Média com erro padrão dos valores de VE, VT e fR da fase clara dos animais microinjetados com veículo, SB-334867 5 mM ou SB-334867 10 mM após microinjeção, hipercarbia e hipóxia.
Veículo (n=5) SB-334867 (5 mM) (n=7) SB-334867 (10 mM) (n=5) Pós-microinjeção
VE (mL.Kg-1.min-1) 243,1 ± 78,9 270,5 ± 65,2 367,6 ± 27,3
VT (mL.Kg-1) 9,3 ± 2,4 7,7 ± 2,3 6,8 ± 0,6 fR (eventos.min
-1) 35,8 ± 3,3 38,9 ± 8,1 52,1 ± 6,2
Hipercarbia (5% CO2)
VE (mL.Kg-1.min-1) 952,4 ± 440,7 794,2 ± 387,9 1068,2 ± 228,4
VT (mL.Kg-1) 23,9 ± 6,7 23,0 ± 10,2 13,2 ± 2,3 fR (eventos.min
-1) 55,6 ± 9,2 42,0 ± 7,7 80,6 ± 12,6
Hipóxia (5% O2)
VE (mL.Kg-1.min-1) 828,5 ± 186,5 324,4 ± 83,3 591,1 ± 149,2
VT (mL.Kg-1) 14,9 ± 5,2 12,8 ± 4,4 8,9 ± 1,0 fR (eventos.min
55
Tabela 2. Média com erro padrão dos valores de VE, VT e fR da fase escura dos animais microinjetados com veículo, SB-334867 5 mM ou SB-334867 10mM após microinjeção, hipercarbia e hipóxia.
Veículo
(n=5)
SB-334867 (5 mM)
(n=5)
SB-334867 (10 mM)
(n=5) Pós-microinjeção
VE (mL.Kg-1.min-1) 334.5 ± 110.6 347.2 ± 109.5 475.3 ± 146.8
VT (mL.Kg-1) 6.0 ± 1.2 7.1 ± 1.0 9.6 ± 1.5
fR (eventos.min-1) 45.6 ± 6.2 42.2 ± 8.2 53.3 ± 13.0
Hipercarbia (5% CO2)
VE (mL.Kg-1.min-1) 621.2 ± 83.0 359.1 ± 154.7 498.1 ± 120.7
VT (mL.Kg-1) 11.5 ± 0.7 9.9 ± 2.3 10.9 ± 2.0
fR (eventos.min-1) 53.7 ± 6.3 43.1 ± 9.4 40.2 ± 16.5
Hipóxia (5% O2)
VE (mL.Kg-1.min-1) 647.8 ± 152.7 498.2 ± 179.3 698.4 ± 28.2
VT (mL.Kg-1) 8.6 ± 1.5 8.9 ± 1.9 9.8 ± 0.9
fR (eventos.min-1) 68.8 ± 7.0 52.7 ± 14.7 65.6 ± 7.40
5.3. Gasometria
5.3.1. Fase clara
A tabela 3 mostra os valores de pHa, PaCO2, PaO2 e HCO3- dos animais
microinjetados com veículo ou SB-334867 (5 ou 10mM) na fase clara.
Em relação aos animais em que os experimentos foram realizados na fase
clara, não houve diferença dos parâmetros gasométricos entre os grupos durante a
normóxia normocápnica. Adicionalmente, a microinjeção de SB-334867 (5 ou 10mM)
56 A hipercarbia promoveu queda no pHa em todos os grupos (efeito do tempo: P
< 0,0001; F(2,12) = 55,14, sem interação: P = 0,1325), aumento da PaO2 (efeito do tempo: P < 0,0001; F(2,12) = 18,68, sem interação: P = 0,5725) e da PaCO2 (efeito do
tempo: P < 0,0001; F(2,12) = 15,24, sem interação: P = 0,6669) e não alterou o HCO3-.
A microinjeção de SB-334867 (5 ou 10mM) não promoveu diferença nos parâmetros
sanguíneos.
A hipóxia promoveu um aumento do pHa em todos os grupos (efeito do tempo:
P < 0,0001; F(2,12) = 55,14, sem interação: P = 0,1325) e queda da PaO2 (efeito do tempo: P < 0,0001; F(2,12) = 18,68, sem interação: P = 0,5725). Contudo, PaCO2 e
HCO3- não foram alterados. A microinjeção de SB-334867 (5 mM) promoveu um maior
aumento do pH na hipóxia comparado ao veículo (efeito do tratamento: P = 0,0003;
F(2,12) = 12,70, sem interação: P = 0,1325).
5.3.2. Fase escura
A tabela 4 mostra os valores de pHa, PaCO2, PaO2 e HCO3- dos animais
microinjetados com veículo ou SB-334867 (5 ou 10mM) na fase escura.
Não houve diferença dos parâmetros gasométricos entre os grupos durante a
normóxia normocápnica. Adicionalmente, a microinjeção de SB-334867 (5 ou 10mM)
não promoveu diferença nos parâmetros sanguíneos.
A hipercarbia promoveu queda no pHa (efeito do tempo: P < 0,0001; F(2,12) =
49,50, sem interação: P = 0,9040), aumento da PO2 (efeito do tempo: P < 0,0001;
F(2,12) = 26,22, sem interação: P = 0,9689) e da PCO2 (efeito do tempo: P < 0,0001;
F(2,12) = 233,7, sem interação: P = 0,3363). Os valores de HCO3- na normóxia
57 P = 0,0378; F(2,12) = 4,177, com interação: P = 0,0064). A microinjeção de SB-334867 (5 ou 10mM) não promoveu diferença nos parâmetros sanguíneos durante a
exposição ao CO2.
A hipóxia promoveu um aumento do pHa em todos os grupos (efeito do tempo:
P < 0,0001; F(2,12) = 49,50, sem interação: P = 0,9040), queda da PaO2 (efeito do tempo: P < 0,0001; F(2,12) = 26,22, sem interação: P = 0,9689) e da PaCO2 (efeito do
tempo: P < 0,0001; F(2,12) = P<0.0001, sem interação: P = 0,3363). O HCO3- foi maior
em normóxia normocárbica no grupo veículo comparado com a hipóxia (efeito do
tempo: P = 0,0378; F(2,12) = 4,177, com interação: P = 0,0064). A microinjeção de
SB-334867 (5 ou 10mM) não promoveu diferença nos parâmetros sanguíneos durante a
exposição ao CO2.
Comparando os valores das fases clara e escura, não houve diferença