UFOP - CETEC - UEMG
REDEMAT
R
EDET
EMÁTICA EME
NGENHARIA DEM
ATERIAISUFOP – CETEC – UEMG
DISSERTAÇÃO DE MESTRADO
"Estudo da Oxidação de Ligas
Fe-Cr a Altas Temperaturas"
Autora: Jussara Fernandes Carneiro
Orientador: Prof. Dr. Antônio Claret Soares Sabioni
Co-Orientador: Prof. Dr. Vincent Ji
–
Université Paris-Süd 11
Co-Orientador: Eng. Dr. Vicente Braz da Trindade Filho
–
UFOP
ii
UFOP - CETEC - UEMG
REDEMAT
R
EDET
EMÁTICA EME
NGENHARIA DEM
ATERIAISUFOP – CETEC – UEMG
Jussara Fernandes Carneiro
"Estudo da Oxidação de Ligas
Fe-Cr a Altas Temperaturas"
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Engenharia de Materiais da REDEMAT, como parte integrante dos requisitos para obtenção do título de Mestre em Engenharia de Materiais.
Área de concentração: Análise e Seleção de Materiais
Orientador: Prof. Dr. Antônio Claret Soares Sabioni
Co-Orientador: Prof. Dr. Vincent Ji
–
Université Paris-Süd 11
–
França
Co-Orientador: Eng. Dr. Vicente Braz da Trindade Filho
–
UFOP
v
“Há mais mistérios entre o Céu e a Terra
do que sonha a nossa vã filosofia”
vi
AGRADECIMENTOS
Agradeço primeiramente a Deus por ter me permitido chegar aqui, com saúde e sem fraquejar pelo caminho.
Aos meus pais Flávio e Marta que sempre me apoiaram e mesmo de longe estiveram sempre presentes com suas orações e todo amor. A meus irmãos Vinicíus e Flávia pelo carinho.
Ao meu orientador Professor Doutor Antônio Claret Soares Sabioni, pela paciência, seriedade e orientação.
Ao Professor Doutor Vincent Ji, da Université Paris-Sud 11, pela execução dos ensaios de oxidação e pela co-orientação.
Ao Engenheiro Doutor Vicente Braz da Trindade Filho, por fornecer as amostras utilizadas neste trabalho e pela co-orientação.
Aos antigos e atuais alunos do Laboratório de Difusão em Materiais pela amizade, troca de experiências e incentivo durante os últimos dois anos.
Aos professores e funcionários da REDEMAT, pela dedicação e competência. À CAPES pelo apoio financeiro.
Ao Laboratório Nacional de Luz Síncrotron (LNLS) pela oportunidade de análise. A república BICHO DO MATO por ter se tornada a minha casa em Ouro Preto. E a todas as irmãs Selvagens pela amizade e momentos de descontração.
A meus companheiros de batalha, que me apoiaram e sempre acreditaram em um final feliz: Lázaro, Kisla, Tacia, Karla e Débora.
vii
SUMÁRIO
AGRADECIMENTOS ... vi
LISTA DE FIGURAS ... x
LISTA DE TABELAS ... xii
LISTA DE NOTAÇÕES ... xiv
RESUMO ... xvi
ABSTRACT ... xviii
1 – INTRODUÇÃO ... 1
2 - OBJETIVOS ... 3
3 - REVISÃO BIBLIOGRAFICA ... 4
3.1 – PRINCÍPIOS DE PROTEÇÃO À CORROSÃO ... 4
3.1.1 – Efeito da Adição do Cromo ... 5
3.1.2 – Passividade dos Aços e das Ligas Metálicas ... 7
3.2 – OXIDAÇÃO A ALTA TEMPERATURA ... 8
3.3 - MECANISMO DE CRESCIMENTO DA PELÍCULA DE OXIDAÇÃO ... 10
3.4 - CINÉTICAS DE OXIDAÇÃO A ALTA TEMPERATURA ... 11
3.4.1 – Cinética de Oxidação Linear ... 11
3.4.2 – Cinética de Oxidação Logarítmica ... 12
3.4.3 – Cinética de Oxidação Parabólica ... 12
3.4.4 – Variação da Constante Parabólica de Oxidação com a Temperatura ... 14
3.5 – TERMODINÂMICA DA OXIDAÇÃO DOS METAIS ... 14
3.6 – ÓXIDO DE CROMO ... 17
3.6.1 – Estrutura e Propriedades ... 17
3.6.2 – Defeitos Pontuais no Óxido de Cromo ... 18
3.7 – TEORIA DE WAGNER DA OXIDAÇÃO DE METAIS ... 19
viii
3.9 – ESTUDOS RECENTES DA OXIDAÇÃO DE LIGAS FERRO-CROMO ... 24
3.10 – TÉCNICAS EXPERIMENTAIS UTILIZADAS NA CARACTERIZAÇÃO MICROESTRUTURAL E QUÍMICA DAS SUPERFÍCIES ... 27
3.10.1 – Microscopia Eletrônica de Varredura – MEV ... 27
3.10.2 – Espectroscopia Dispersiva de Energia – EDS ... 27
3.10.3 – Difração de Raios X – DRX ... 28
3.10.4 – Espectrometria de Massa de Íons Secundários - SIMS ... 31
4 – PARTE EXPERIMENTAL ... 33
4.1 – MATERIAIS ... 33
4.2 – PREPARAÇÃO DAS AMOSTRAS ... 33
4.3 – CARACTERIZAÇÃO MICROESTRUTURAL DAS LIGAS Fe-Cr ... 34
4.4 – OXIDAÇÃO DAS AMOSTRAS ... 35
4.5 – ESTIMATIVA DA ESPESSURA DOS FILMES DE ÓXIDO ... 37
4.6 – IDENTIFICAÇÃO DA CINÉTICA DE OXIDAÇÃO E CÁLCULO DA CONSTANTE DE OXIDAÇÃO DAS LIGAS ... 37
4.7 – CARACTERIZAÇÃO MICROESTRUTURAL E MICROANÁLISE QUÍMICA DOS FILMES DE ÓXIDOS ... 37
4.8 – CARACTERIZAÇÃO QUÍMICA DOS FILMES DE ÓXIDOS ... 38
4.8.1 – Difração de Raios X ... 38
4.8.2 – Espectrometria de Massa de Íons Secundários ... 41
5 – RESULTADOS E DISCUSSÕES ... 42
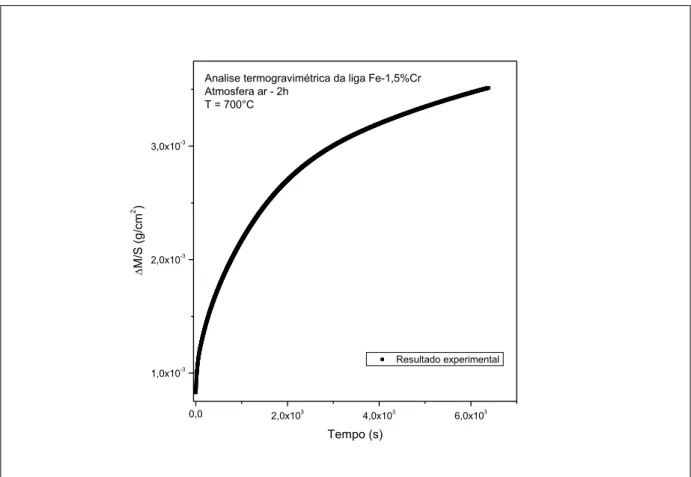
5.1 – OXIDAÇÃO DAS LIGAS Fe-1,5%Cr E Fe-5,0%Cr EM AR SINTÉTICO ... 42
5.1.1 – Análise termogravimétrica das ligas Fe-1,5%Cr e Fe-5,0%Cr em atmosfera de ar seco ... 42
5.1.2 – Determinação das constantes de oxidação ... 43
5.1.3 – Determinação das espessuras dos filmes de óxidos ... 45
ix
5.1.5 – Análise química dos filmes de óxidos formados sobre as ligas Fe-1,5%Cr e Fe-5,0%Cr
em ar a 700°C ... 49
5.2 – OXIDAÇÃO DA LIGA Fe-10%Cr EM AR SINTÉTICO ... 57
5.2.1 – Análise termogravimétrica da liga Fe-10%Cr em atmosfera de ar seco ... 57
5.2.2 – Determinação das constantes de oxidação ... 60
5.2.3 – Determinação das espessuras dos filmes de óxidos ... 64
5.2.4 – Análise microestrutural dos filmes de óxidos formados sobre a liga Fe-10%Cr em ar 65 5.2.5 – Análise química do filme de óxido formado sobre a liga Fe-10%Cr em ar ... 68
5.3 – OXIDAÇÃO DA LIGA Fe-15%Cr EM AR SINTÉTICO ... 77
5.3.1 – Análise termogravimétrica da liga Fe-15%Cr em atmosfera de ar seco ... 77
5.3.2 – Determinação das constantes de oxidação ... 80
5.3.3 – Determinação das espessuras dos filmes de óxidos ... 84
5.3.4 – Análise microestrutural dos filmes de óxidos formados sobre a liga Fe-15%Cr em ar 85 5.3.5 – Análise química dos filmes de óxidos formados sobre a liga Fe-15%Cr em ar ... 87
5.4 – AVALIAÇÃO DAS AMOSTRAS Fe-Cr PARA FINS DE ESTUDO DE DIFUSÃO .. 96
5.5 – COMPARAÇÃO DO COMPORTAMENTO DE OXIDAÇÃO DAS LIGAS Fe/Cr COM DADOS DA LITERATURA ... 97
6 – CONCLUSÕES ... 100
x
LISTA DE FIGURAS
Figura 3.1 – Efeito do cromo na resistência dos aços a oxidação a altas temperaturas. A curva
mostra a penetração da oxidação em cubos de 1/2” aquecidos durante 48 horas a 1000°C no
ar[12]. ... 5
Figura 3.2 – Diagrama de constituição da liga Fe-Cr[12]. ... 6
Figura 3.3 – Diagrama de Ellingham[24]. ... 16
Figura 3.4 – Natureza das camadas de óxidos formados sobre o aço cromo após 10-20h de oxidação em ar[28]. ... 21
Figura 3.5 – Seção isotérmica do diagrama de fases Fe-Cr-O a 1200°C[21]. ... 22
Figura 3.6 – Diagramas esquemáticos da camada morfológica em (a) 5%Cr, (b) Fe-10%Cr, e (c) Fe-15%Cr[21]. ... 23
Figura 3.7 – Espalhamento de raios X por planos cristalinos... 29
Figura 3.8 – Linha XRD-1 do Laboratório Nacional de Luz Síncrotron, Campinas - SP. ... 31
Figura 4.1 – (a) Cortadeira ISOMET 1000; (b) Amostra padrão com orifício para suspensão na termobalança. ... 33
Figura 4.2 – Politriz Phoenix utilizada no polimento. ... 34
Figura 4.3 – Esquema da termobalança utilizada nos ensaios de oxidação das amostras. ... 36
Figura 4.4 – Sistema MEV-EDS localizado no Departamento de Geologia (DEGEO) da UFOP. ... 38
Figura 4.5 – Difratômetro Huber. ... 40
Figura 4.6 – Amostra oxidada da liga Fe/Cr presa ao cilindro. ... 40
Figura 5.1 – Evolução do ganho de massa por unidade de área em função do tempo de oxidação para a liga Fe-1,5%Cr. ... 42
Figura 5.2 – Evolução do ganho de massa por unidade de área em função do tempo de oxidação para a liga Fe-5,0%Cr. ... 43
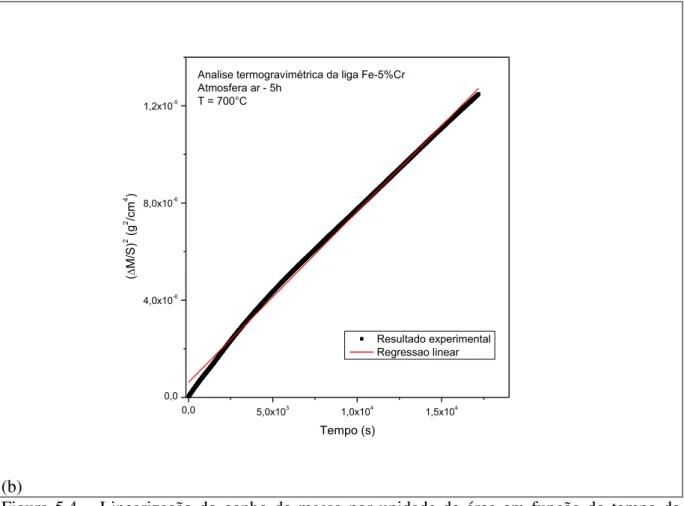
Figura 5.3 – Linearização do ganho de massa por unidade de área em função do tempo de oxidação para a liga Fe-1,5%Cr. ... 44
xi
Figura 5.5 – Seção transversal do filme de óxido formado sobre a liga Fe-1,5%Cr com a respectiva espessura, à 700°C. ... 46
Figura 5.6 – Seção transversal do filme de óxido formado sobre a liga Fe-5,0%Cr com a respectiva espessura, à 700°C. ... 47
Figura 5.7 – Microestrutura do filme de óxido formado sobre a liga Fe-1,5%Cr, oxidada em atmosfera de ar sintético, a 700°C, por 2 horas. ... 48
Figura 5.8 – Microestrutura do filme de óxido formado sobre a liga Fe-5%Cr, oxidada em atmosfera de ar sintético, a 700°C, por 5 horas. ... 49
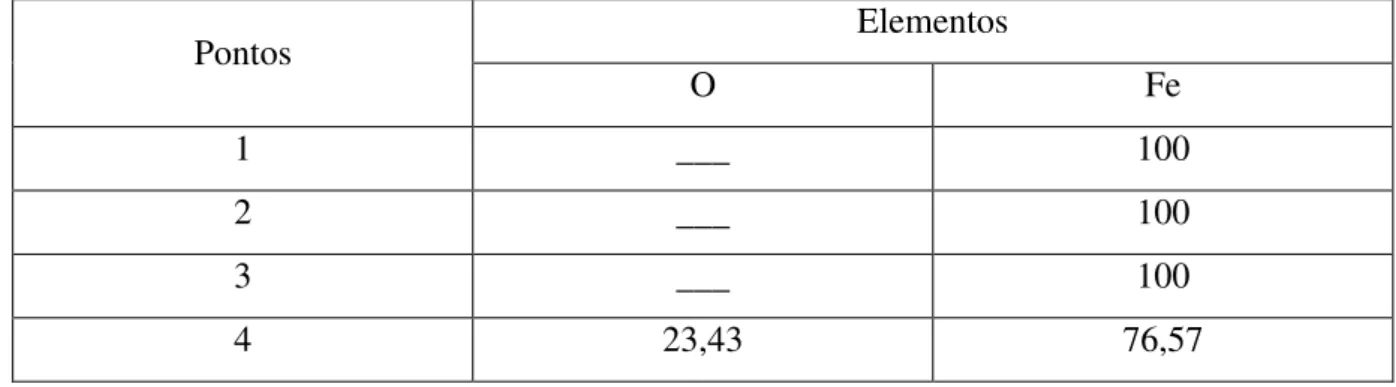
Figura 5.9 – Análise EDS do filme de óxidos formado sobre a liga Fe-1,5%Cr oxidada em ar sintético por 2 horas na temperatura de 700ºC. ... 51
Figura 5.10 – Análise EDS do filme de óxidos formado sobre a liga Fe-5,0%Cr oxidada em ar sintético por 5 horas na temperatura de 700ºC. ... 52
Figura 5.11 – Espectro de difração de raios X com ângulo de incidência rasante do filme de óxido formado sobre a liga Fe-1,5%Cr, oxidada em atmosfera de ar sintético, a 700°C, por 2 horas. ... 54
Figura 5.12 – Espectro de difração de raios X com ângulo de incidência rasante do filme de óxido formado sobre a liga Fe-5,0%Cr, oxidada em atmosfera de ar sintético, a 700°C, por 5 horas. ... 55
Figura 5.13 – Perfis de difusão de isótopos no filme de óxido formado sobre a liga Fe- 5,0%Cr oxidada em ar sintético, a 700°C, por 5h30min. ... 56
Figura 5.14 – Evolução do ganho de massa por unidade de área em função do tempo de oxidação para a liga Fe-10%Cr (a) 700°C; (b) 750°C; (c) 800°C; (d) 850°C. ... 59
Figura 5.15 – Linearização do ganho de massa por unidade de área em função do tempo de oxidação para a liga Fe-10%Cr (a) 700°C; (b) 750°C; (c) 800°C; (d) 850°C. ... 62
Figura 5.16 – Diagrama de Arrhenius para a liga Fe-10%Cr, oxidada em ar sintético, nas temperaturas de 700°C, 750°C, 800°C e 850°C. ... 64
Figura 5.17 – Microestrutura do filme de óxido formado sobre a liga Fe-10%Cr, oxidado em atmosfera de ar sintético, a 700°C, por 48 horas. ... 66
Figura 5.18 – Microestrutura do filme de óxido formado sobre a liga Fe-10%Cr, oxidado em atmosfera de ar sintético, a 850°C, por 48 horas. ... 66
xii
Figura 5.20 – Análise EDS do filme de óxido formado sobre a liga Fe-10%Cr, oxidada em atmosfera de ar sintético, a 700ºC, por 48 horas. ... 69
Figura 5.21 – Análise EDS do filme de óxido formado sobre a liga Fe-10%Cr, oxidada em atmosfera de ar sintético, a 850ºC, por 48 horas. ... 70
Figura 5.22 – Análise EDS da superfície descamada após oxidação da liga Fe-10%Cr em atmosfera de ar sintético, a 850°C, por 48 horas. ... 71
Figura 5.23 – Espectro de difração de raios X com ângulo de incidência rasante do filme de óxido formado sobre a liga Fe-10%Cr, oxidada em atmosfera de ar sintético, a 700°C, por 48 horas. ... 73
Figura 5.24 – Espectro de difração de raios X com ângulo de incidência rasante do filme de óxido formado sobre a liga Fe-10%Cr, oxidada em atmosfera de ar sintético, a 750°C, por 48 horas. ... 74
Figura 5.25 – Espectro de difração de raios X com ângulo de incidência rasante do filme de óxido formado sobre a liga Fe-10%Cr, oxidada em atmosfera de ar sintético, a 800°C, por 48 horas. ... 75
Figura 5.26 – Espectro de difração de raios X com ângulo de incidência rasante do filme de óxido formado sobre a liga Fe-10%Cr, oxidada em atmosfera de ar sintético, a 850°C, por 48 horas. ... 76
Figura 5.27 – Perfis de difusão de isótopos no filme de óxido formado sobre a liga Fe- 10%Cr oxidada em ar sintético, a 750°C, por 48 horas. ... 77
Figura 5.28 – Evolução do ganho de massa por unidade de área em função do tempo de oxidação para a liga Fe-15%Cr (a) 700°C; (b) 750°C; (c) 800°C; (d) 850°C. ... 80
Figura 5.29 – Linearização do ganho de massa por unidade de área em função do tempo de oxidação para a liga Fe-15%Cr (a) 700°C; (b) 750°C; (c) 800°C; (d) 850°C. ... 82
Figura 5.30 – Diagrama de Arrhenius para a liga Fe-15%Cr, oxidada em ar sintético, nas temperaturas de 700°C, 750°C, 800°C e 850°C. ... 84
Figura 5.31 – Microestrutura do filme de óxido formado sobre a liga Fe-15%Cr, oxidado em atmosfera de ar sintético, a 700°C, por 48 horas. ... 86
Figura 5.32 – Microestrutura do filme de óxido formado sobre a liga Fe-15%Cr, oxidado em atmosfera de ar sintético, a 850°C, por 48 horas. ... 86
xiii
Figura 5.34 – Análise EDS do filme de óxido formado sobre a liga Fe-15%Cr, oxidada em atmosfera de ar sintético, a 850ºC, por 48 horas. ... 89
Figura 5.35 – Espectro de difração de raios X com ângulo de incidência rasante do filme de óxido formado sobre a liga Fe-15%Cr, oxidada em atmosfera de ar sintético, a 700°C, por 48 horas. ... 91
Figura 5.36 – Espectro de difração de raios X com ângulo de incidência rasante do filme de óxido formado sobre a liga Fe-15%Cr, oxidada em atmosfera de ar sintético, a 750°C, por 48 horas. ... 92
Figura 5.37 – Espectro de difração de raios X com ângulo de incidência rasante do filme de óxido formado sobre a liga Fe-15%Cr, oxidada em atmosfera de ar sintético, a 800°C, por 48 horas. ... 93
Figura 5.38 – Espectro de difração de raios X com ângulo de incidência rasante do filme de óxido formado sobre a liga Fe-15%Cr, oxidada em atmosfera de ar sintético, a 850°C, por 48 horas. ... 94
Figura 5.39 – Perfis de difusão de isótopos no filme de óxido formado sobre a liga Fe- 15%Cr oxidada em ar sintético, a 750°C, por 48 horas. ... 95
Figura 5.40 – Perfis de difusão de isótopos no filme de óxido formado sobre a liga Fe- 15%Cr oxidada em ar sintético, a 850°C, por 48 horas. ... 96
xii
LISTA DE TABELAS
Tabela 3.1 – Dados estruturais e constantes físicas do Cr2O[26]. ... 17
Tabela 4.1 – Composição química para as ligas Fe-Cr. ... 33 Tabela 5.1 – Valores das constantes parabólicas de oxidação para as ligas 1,5%Cr e Fe-5,0%Cr oxidadas à 700°C durante 2 e 5 horas, respectivamente. ... 45
Tabela 5.2 – Estimativa das espessuras dos filmes de óxidos formados para as ligas Fe-1,5%Cr e Fe-5,0%Cr oxidadas à 700°C durante 2 e 5 horas, respectivamente. ... 46
Tabela 5.3 – Valor médio da espessura medida a partir da seção transversal das ligas Fe-1,5%Cr e Fe-5,0%Cr oxidadas à 700°C durante 2 e 5 horas, respectivamente. ... 47
Tabela 5.4 – Composição química (% em peso) dos pontos referentes a análises EDS da Figura 5.9. ... 51
Tabela 5.5 – Composição química (% em peso) dos pontos referentes a análises EDS da Figura 5.10. ... 52
Tabela 5.6 – Fases cristalinas identificadas. ... 52 Tabela 5.7 – Valores das constantes parabólicas de oxidação para a liga Fe-10%Cr oxidada por 48 horas em atmosfera de ar sintético. ... 63
Tabela 5.8 – Estimativa das espessuras dos filmes de óxidos formados sobre a liga Fe-10%Cr após 48 horas de oxidação. ... 65 Tabela 5.9 – Composição química (% em peso) dos pontos referentes a análises EDS da Figura 5.20. ... 69
Tabela 5.10 – Composição química (% em peso) dos pontos referentes a análises EDS da Figura 5.21. ... 70
Tabela 5.11 – Composição química (% em peso) dos pontos referentes a análises EDS da Figura 5.22. ... 71 Tabela 5.12 – Valores das constantes parabólicas de oxidação para a liga Fe-15%Cr oxidada por 48 horas em atmosfera de ar sintético. ... 83
Tabela 5.13 – Estimativa das espessuras dos filmes de óxidos formados sobre a liga Fe-15%Cr após 48 horas de oxidação. ... 85
xiii
xiv
LISTA DE NOTAÇÕES
ΔM/S - Ganho de massa por unidade de área kL - Constante linear de oxidação
ke - Constante logarítmica de oxidação
kp - Constante parabólica de oxidação, expressa em mg2/cm4.s
kc - Constante parabólica de oxidação, expressa em cm2/s
a b
M O - Representação genérica de um óxido de um metal M Mox - Massa molar do óxido
ρox - Massa específica do óxido
Mo – massa de um mol de oxigênio
ΔG - Energia livre
Gº - Energia livre padrão
R - Constante universal dos gases (8,314 J/mol.K) T - Temperatura absoluta (K)
K - Constante de equilíbrio da reação Q – Energia de ativação da reação
X O
O - Ânion O2 em seu sítio regular '''
Cr
V - Lacuna de cromo ionizada três vezes negativamente
h - Buraco eletrônico '
e - elétron
d – Representação de defeito pontual i
Cr - Íon de cromo num sítio intersticial com carga efetiva +3
PO2(e) - Pressão parcial de oxigênio na interface óxido/gás
PO2(i) - Pressão parcial de oxigênio na interface metal/óxido
ef Cr
D - Coeficiente de difusão efetivos do cromo
ef O
D - Coeficiente de difusão efetivos do oxigênio D - Coeficiente de difusão em volume
D’- Coeficiente de difusão intergranular
f - Fração de sítios atômicos associados aos contornos de grão () - Largura do contorno de grão
xv
I( ) – Intensidade iônica secundária
MEV – Microscópio Eletrônico de Varredura EDS - Espectroscopia de Energia Dispersiva DRX - Difração de raios X
LNLS - Laboratório Nacional de Luz Sincroon
SIMS – Secondary íon mass spectrometry (Espectrometria de Massa de Íons Secundários) SOFC – Célula a Combustível de Óxido Sólido do tipo Planar
AISI – American Iron and Steel Institute
MPIE – Max-Planck Institute fuer Eisenforschung
xvi
RESUMO
xvii
para a liga Fe-15%Cr a resistência à oxidação é satisfatória em toda a faixa de temperatura utilizada neste trabalho, sendo similar, a 850°C, a do aço inoxidável austenítico AISI 304 e intermediaria a dos aços inoxidáveis ferríticos AISI 444 e AISI 439.
xviii
ABSTRACT
xix
range used in this work, being similar at 850°C, to the AISI 304 austenitic stainless steel and intermediate to AISI 444 and AISI 439 ferritic stainless steels.
1
1
–
INTRODUÇÃO
Nas indústrias de geração de energia, petroquímica, naval, aeronáutica, automobilística e outras, componentes de equipamentos construídos com ligas metálicas à base de Fe/Cr são colocados em contato com atmosferas agressivas, em ampla faixa de pressão parcial de oxigênio, à altas temperaturas. O desempenho e o tempo de vida útil desses componentes são dependentes de sua resistência a oxidação, pois a formação de camadas de óxidos causa a redução da espessura de suas paredes.
O cromo contido nestas ligas reage com o oxigênio do ar formando uma fina camada superficial de óxido de cromo (Cr2O3). Apesar de muito fina, esta camada age como barreira
física entre a superfície da liga e o meio em que se encontra, bloqueando assim a ação do meio corrosivo[1].
A taxa de oxidação destas ligas depende fortemente do seu teor de cromo, visto que este elemento possui elevada afinidade por oxigênio, formando o Cr2O3 que possui alta
estabilidade termodinâmica[2,3]. A baixa concentração de defeitos pontuais deste composto resulta em baixa taxa de crescimento do filme de óxido e em boa aderência do mesmo ao substrato metálico fazendo com que o Cr2O3 atue como excelente camada protetora contra a
oxidação[2].
Um teor mínimo de Cr de aproximadamente 20%, em peso, é necessário para formar uma camada continua e densa de Cr2O3, a qual protege o material metálico contra novos
ataques[4]. Entretanto, a maioria das ligas utilizadas à altas temperaturas contém uma quantidade inferior de Cr por razões de custo e em menor extensão devido às propriedades mecânicas. Para ligas com baixos teores de Cr, uma camada complexa de óxido composta por hematita (Fe2O3), magnetita (Fe3O4), wustita (FeO), Cr2O3 e espinélio Fe(Fe,Cr)2O3 pode ser
formada[5].
A estabilidade das diferentes fases formadas após oxidação das ligas metálicas pode ser avaliada por meio de suas propriedades termodinâmicas. Além dos aspectos termodinâmicos, deve-se avaliar o aspecto cinético do processo de corrosão[6]. Quando a cinética de crescimento dos filmes de óxidos é parabólica, a taxa de oxidação das ligas é controlada pela difusão de cátions do substrato metálico para a interface óxido/atmosfera e/ou pela difusão do oxigênio da atmosfera em direção ao substrato metálico[7].
2
literatura sobre a oxidação destas ligas. Devido à falta de informações sobre a oxidação de ligas com menos de 15%Cr, investigamos no presente estudo o comportamento de oxidação de ligas modelo com teores de cromo iguais a 1,5; 5,0; 10 e 15% em peso, na faixa de temperaturas de 700°C a 850°C, em atmosfera de ar sintético. Para cada liga, é feita a descrição da cinética de oxidação e as caracterizações microestrutural e química dos filmes de óxidos formados.
Este trabalho é parte de um projeto financiado pelo CNPq e intitulado: “Estudo da
difusão do oxigênio e de cátions em filmes de espinélios formados pela oxidação térmica de ligas metálicas, e aplicação dos resultados em simulação computacional do desempenho de ligas metálicas oxidadas à altas temperaturas”, cujos objetivos são determinar, sobre os filmes
de óxidos formados no presente estudo, os coeficientes de difusão do oxigênio, do ferro e do cromo, tanto em volume quanto nos contornos de grãos. Estes coeficientes de difusão serão utilizados na simulação computacional do desempenho de ligas metálicas sujeitas à oxidação em altas temperaturas.
3
2 - OBJETIVOS
Estudar o comportamento de oxidação de ligas modelo Fe-Cr com diferentes composições químicas de Cr - 1,5; 5,0; 10 e 15% - em atmosfera de ar sintético, em uma faixa de temperatura entre 700°C a 850°C e em intervalos de tempo de até 48 horas.
4
3 - REVISÃO BIBLIOGRAFICA
3.1 – PRINCÍPIOS DE PROTEÇÃO À CORROSÃO
A perda de peças metálicas por ação da corrosão tem preocupado engenheiros e metalurgistas que procuram constantemente não só aperfeiçoar ou desenvolver novos métodos de proteção, como também aperfeiçoar ou criar novas ligas que apresentam o característico de resistência à corrosão.
A corrosão pode ser considerada como um ataque gradual e contínuo de metal por parte do meio circunvizinho, que pode ser a atmosfera mais ou menos contaminada das cidades, ou em meio químico, líquido ou gasoso. Como resultado de reações químicas entre os metais e elementos não-metálicos contidos nesses meios, tem-se mudança gradual do metal num composto ou em vários compostos químicos, que são geralmente óxidos ou sais[12].
Geralmente a proteção contra a corrosão é feita criando-se sobre a superfície do metal uma película protetora que separa o metal-base do meio corrosivo. Essa película protetora pode ser criada artificialmente, mediante depósito de outra substância – metálica ou orgânica
– sobre a superfície do metal a proteger, ou naturalmente, isto é, pela produção espontânea da película superficial, através da formação de um composto químico, mantido sobre a superfície metálica por forças atômicas, como se mencionou, composto esse que resulta da reação de certos elementos de liga introduzidos no metal com o meio circunvizinho[12].
Chama-se “passividade” a propriedade típica de certos metais e ligas metálicas de permanecerem inalterados no meio circunvizinho.
A presença de uma película superficial de cromo – de espessura inferior a dois centésimos de mícron – é indispensável para conferir resistência à corrosão. A concentração de cromo nesta película é maior que a do metal e tanto a espessura da película como o seu teor de cromo aumentam à medida que se melhora o polimento superficial[12].
O ferro ou aço-carbono não se caracterizam normalmente por serem “passivos”,
entretanto, a condição de passividade pode ser-lhes conferida, em grau maior ou menor, pela introdução de elementos de liga.
5
3.1.1 – Efeito da Adição do Cromo
O cromo é, de fato, o elemento mais importante e quando usado em elevados teores –
acima de 10% – é o mais eficiente de todos, na maioria das condições, embora os aços ao cromo e ao cromo-níquel não sejam resistentes em certos meios, como ácido clorídrico[12].
O cromo é o elemento essencial, podendo-se dizer que a ciência dos aços inoxidáveis é a ciência do cromo como elemento de liga do ferro[12].
O papel do cromo como elemento protetor a corrosão, a temperaturas elevadas, está ilustrado no gráfico da Figura 3.1[12], onde se observa que, à medida que aumenta o teor de cromo, diminui a tendência à oxidação. Este gráfico ilustra o efeito do cromo na resistência do aço à oxidação a altas temperaturas. Verifica-se que o efeito mais positivo do cromo, neste caso, se desenvolve quando o seu teor está acima de 20%.
Figura 3.1 – Efeito do cromo na resistência dos aços a oxidação a altas temperaturas. A curva
mostra a penetração da oxidação em cubos de 1/2” aquecidos durante 48 horas a 1000°C no
ar[12].
6
Presença da chamada “lupa austenítica”, a qual indica que todas as ligas de composição à direita da lupa, mais ou menos além de 12% ou 13% de cromo, solidificam na forma de ferrita e como tal permanecem até a temperatura ambiente;
A presença de uma fase quebradiça Fe-Cr, denominada “fase sigma”, entre 42% e 48% de cromo. À esquerda do campo em que está presente somente a fase sigma, nota-se um campo em que estão presentes duas fases: ferrita ou ferro alfa e sigma. Assim sendo, os aços inoxidáveis ferríticos com teor de cromo acima de cerca de 23% já podem apresentar essa fase quebradiça. A desvantagem da sua presença reside no fato de que a mesma afeta as propriedades mecânicas do aço e sua resistência à corrosão. De fato, sendo a fase sigma dura e quebradiça, sua presença tende a reduzir a ductilidade e principalmente a tenacidade do aço.
7
3.1.2 – Passividade dos Aços e das Ligas Metálicas
A passividade dos aços e das ligas metálicas resistentes à corrosão depende essencialmente dos seguintes fatores[12]: a) composição química; b) condições de oxidação; c)
suscetibilidade à corrosão localizada (“pitting”); d) suscetibilidade à corrosão intergranular; e)
outros.
Composição Química
O cromo é o elemento mais importante, um teor mínimo de 10% é exigido para atingir a necessária passividade que é, por assim dizer, completa com 20% a 30% de cromo.
O níquel segue ao cromo em importância, sua atuação faz-se sentir não só na melhora da resistência à corrosão dos aços inoxidáveis ao cromo em soluções neutras de cloreto e em ácidos de baixa capacidade de oxidação, como igualmente no sentido de melhorar suas propriedades mecânicas. Essa influência é particularmente grande quando o teor de níquel é superior a 6% ou 7%[12].
O carbono, forçosamente presente em todos os tipos de aços, diminui ligeiramente a corrosão dos aços inoxidáveis quando no estado dissolvido, decresce-a apreciavelmente quando na forma de carbonetos livres e uniformemente distribuídos e pode causar completa desintegração dos aços inoxidáveis ao cromo-níquel quando precipitado na forma de carbonetos nos contornos dos grãos[12].
Condições de Oxidação
É evidente que a velocidade e a extensão do ataque dependem da capacidade oxidante do meio circundante. Nesse sentido, podem ser classificados todos os meios corrosivos, quer líquidos, quer gasosos, em dois grupos: oxidantes, que tendem a tornar passiva uma determinada liga; redutores, que tendem a diminuir sua passividade[12].
Suscetibilidade à Corrosão Localizada
8
A corrosão localizada pode ser, às vezes, mais prejudicial do que a corrosão generalizada, visto que cria pontos de concentração de tensões que levarão o metal à ruptura por fadiga.
Suscetibilidade à Corrosão Intergranular
Os aços inoxidáveis cromo-níquel (tipos austeníticos) estão sujeitos, quando tratados termicamente ou aquecidos para trabalho a quente ou para soldagem numa certa faixa de temperatura, a uma precipitação de um constituinte de contorno de grão que pode provocar
um dos tipos mais danosos da corrosão, a chamada “corrosão intergranular”. A faixa de temperatura crítica é 400°C-900°C, e quando o aço for aquecido dentro dessa faixa ainda que por um tempo muito curto pode sofrer uma quase completa desintegração após algumas horas de exposição numa solução corrosiva[12].
A suscetibilidade desses aços à corrosão intergranular depende de uma série de fatores, entre os quais podem ser enumerados os seguintes[12]:
Tempo de permanência dentro da faixa de temperaturas consideradas críticas; Teor de carbono;
Granulação do aço; Deformação a frio;
Presença de determinados elementos de liga.
Outros Fatores
A resistência à corrosão dos aços e das ligas metálicas pode ainda ser afetada pelos seguintes fatores adicionais[12]:
Condições da superfície;
Fissuras;
Fenômenos de natureza galvânica;
Tensões.
3.2 – OXIDAÇÃO A ALTA TEMPERATURA
9
(ou liga) e gases como ar, oxigênio, dióxido de carbono, vapor de água ou atmosferas industriais mais complexas, contendo quantidades significativas destes gases, produzindo óxidos.
Um material metálico em uma atmosfera oxidante oxida-se quimicamente pela transferência direta de elétrons do metal ao oxidante. Dessa oxidação resulta o aparecimento de uma película, que dependentemente de suas características, terá caráter protetor ou não quanto à continuação da oxidação.
Considerando o oxigênio (O2) como oxidante e o metal (M), resultam da reação íons
Mn+ e O2-, que passam a constituir um óxido (M2On) que recobre o metal.
Os materiais metálicos, mesmo com atividades equivalentes, não apresentam a mesma atividade com o oxidante e, portanto, não se oxidam à mesma velocidade. O comportamento de corrosão é determinado pelas leis da termodinâmica e pela cinética das reações. No caso da oxidação, a formação dos óxidos depende[13]:
da atividade (concentração) dos elementos de liga; da pressão parcial de oxigênio;
da estabilidade termodinâmica dos óxidos; da temperatura;
do tempo de oxidação.
De acordo com Luz[14] e Huntz et al[15].a maior afinidade dos elementos de uma liga frente ao oxigênio normalmente provoca oxidação seletiva, de modo que o elemento mais oxidável é o único que passa à película oxidada ou é aquele que forma a maior parte desta película.
A oxidação dos metais e ligas resulta do fato de que estas reações são exotérmicas, o que as torna termodinamicamente possíveis em temperaturas elevadas, onde a variação da energia livre de Gibbs é mais negativa, a reação é mais favorecida cineticamente e a velocidade de oxidação é consideravelmente maior[16].
10
O processo de oxidação é controlado pela difusão de vários íons metálicos, cada um com uma diferente concentração inicial e variação da energia livre de Gibbs de oxidação[17]. Nos momentos iniciais de oxidação, há nucleação de todos os óxidos possíveis, assim que estes óxidos são nucleados, ocorre o crescimento daqueles que são mais estáveis termodinamicamente.
Em se tratando de aços inoxidáveis, o cromo é oxidado preferencialmente ao ferro, em função da sua energia livre de Gibbs mais negativa para a formação do óxido, dessa oxidação surge uma fina camada superficial. Apesar de muito fina, esta camada de óxido de cromo funciona como uma barreira de proteção, impedindo que haja contato entre a superfície metálica e a atmosfera. Logo, a presença desta película, previne a corrosão do aço provocada pelo ambiente[18].
Quando estes aços são submetidos a temperaturas maiores que 1000ºC, a camada de óxido de cromo tende a volatilizar[19], reduzindo assim a função protetora do filme, logo, para maior eficiência, estes aços devem ser aplicados em temperaturas abaixo de 1000ºC.
Os mecanismos de oxidação dos aços e ligas, embora mais complexos, apresentam certa semelhança com a oxidação dos metais puros. A difusão em volume e nos contornos dos grãos no metal ou na camada de óxido constitui os mecanismos de transporte preponderantes.
3.3 - MECANISMO DE CRESCIMENTO DA PELÍCULA DE OXIDAÇÃO
Quando um material metálico é submetido à atmosfera oxidante, há formação de óxidos. Essa película, dita, de acordo com suas características, se o processo de oxidação prosseguirá e com que rapidez.
Quando se forma uma camada compacta de óxido numa superfície metálica exposta a uma atmosfera oxidante, é necessário que ocorra difusão através da película de óxido para que possa ocorrer crescimento da película. A oxidação vai prosseguir com uma velocidade que será função da velocidade com que os reagentes se difundem através da película[16].
Considera-se que este processo envolve o transporte de íons e de elétrons através da película. Assim, o crescimento desta película, depende da condução iônica e eletrônica.
A condução iônica pode ocorrer da seguinte maneira[16]:
pela difusão do ânion (O2-) para o interior da película;
11
3.4 - CINÉTICAS DE OXIDAÇÃO A ALTA TEMPERATURA
Uma vez que o produto da oxidação de metais permanece sobre o substrato, a taxa em que a reação se processa pode ser determinada medindo-se o ganho de massa por unidade de área em função do tempo de oxidação[20].
Para tal, é comum realizar ensaios de oxidação, sendo a termogravimetria o método mais utilizado no estudo da cinética de oxidação a temperaturas elevadas. O corpo de prova, com massa e dimensões conhecidas, é colocado em um forno, sob atmosfera controlada, suspenso em uma microbalança que registra, continuamente, as variações de sua massa com
uma sensibilidade que pode chegar a 1μg.
A formação de um óxido de um metal M pode ser descrita pela seguinte reação: (3.1) e pode ser investigada por diversos métodos, sendo que a quantificação da reação pode ser realizada por:
Quantidade de metal consumido; Quantidade de oxigênio consumido; Quantidade de óxido produzido.
As leis das cinéticas de oxidação, em condições isotérmicas e sob pressão de gás constante, variam de acordo com as condições experimentais. Diversas leis de crescimento podem ser identificadas, sendo que as principais são:
Lei linear; Lei parabólica; Lei logarítmica.
Sob certas condições, alguns sistemas podem mostrar cinéticas compostas[21].
12
A cinética de oxidação linear é característica de metais nos quais se forma uma película porosa ou trincada, sob essas circunstâncias, o oxigênio está sempre disponível para a reação com a superfície metálica, pois o óxido não atua como barreira à reação[20].
O crescimento da película de óxido é controlado por reações interfaciais rápidas e independe da espessura do mesmo, que pode ser expresso pela seguinte equação[21]:
(3.2)
onde significa o ganho de massa por unidade de área; e é a constante linear de oxidação expressa em e é o tempo de oxidação expresso em .
3.4.2 – Cinética de Oxidação Logarítmica
Ocorre, geralmente, na oxidação inicial de muitos metais, que se oxidam rapidamente no início e depois lentamente, tornando a espessura da película praticamente constante com o tempo[16]. É observada em camadas finas de óxidos comumente formados à temperatura ambiente, como no caso do alumínio, ferro, cromo e cobre.
Os filmes extrafinos (espessura entre 2 e 4nm) crescem de acordo com a lei logarítmica[21], descrita pela equação:
(3.3)
onde é o ganho de massa por unidade de área; é a constante logarítmica e e são constantes.
3.4.3 – Cinética de Oxidação Parabólica
A difusão de íons através da camada de óxido conduz a uma lei parabólica, na qual a velocidade de crescimento do filme decresce com o tempo. É o caso mais frequente de óxidos protetores. Assim, após a formação do óxido inicial, a “oxidação posterior” pode ser separada
13
reações nas interfaces metal/óxido e óxido/oxigênio, que controla a velocidade inicial; transporte de material na forma de cátions metálicos, ânions de oxigênio e elétrons
através do óxido.
A cinética de oxidação parabólica é descrita pela seguinte expressão[23]:
(3.4)
onde significa o quadrado do ganho de massa por unidade de área; é uma constante de oxidação que depende de cada material; é a constante parabólica de oxidação, expressa em e é o tempo de oxidação expresso em .
A constante parabólica permite uma comparação simples e rápida da taxa de oxidação para diferentes óxidos.
A lei parabólica também pode ser expressa em função da espessura do filme pela relação[22]:
(3.5)
onde é o quadrado da espessura do filme formado; é a constante parabólica de oxidação, expressa em e é o tempo de oxidação expresso em .
Pelas equações 3.4 e 3.5, verifica-se que os gráficos de ou , em função do tempo, fornecem uma relação linear de coeficiente angular igual a e , respectivamente.
A relação entre e para um óxido é dada por meio da seguinte expressão[22]:
(3.6)
14
As leis de cinéticas apresentadas acima não são as únicas. Além disso, tais leis podem sofrer desvios durante os ensaios devido à presença de impurezas, inclusões, aparecimento de porosidades ou fissuras nos filmes de corrosão. O processo limitante da velocidade de corrosão também pode mudar durante o ensaio, ocasionando, em consequência, uma mudança na cinética de corrosão.
Pode-se dizer que, a baixas temperaturas, a cinética de oxidação obedece a leis logarítmicas. Em temperaturas intermediárias, a cinética situa-se entre as leis logarítmica e parabólica. Já em elevadas temperaturas, dependendo da estrutura e composição das camadas formadas, são mais comuns as leis linear ou parabólica[13].
3.4.4 – Variação da Constante Parabólica de Oxidação com a Temperatura
De acordo com Gentil[16] e Kofstad[7], o valor da constante de oxidação parabólica varia de um metal para outro, pois as constantes parabólicas dependem da energia de ligação dos cátions no óxido, assim como da estrutura do óxido. Além disso, as constantes de oxidação dependem da temperatura e em certos casos da pressão de oxigênio.
Para um dado metal e uma pressão fixa, a constante parabólica de oxidação varia com a temperatura segundo a lei de Arrhenius, dada pela equação:
(3.7)
onde é a energia de ativação da reação de oxidação; é a constante universal dos gases; a temperatura absoluta e é uma constante relacionada ao material.
3.5 – TERMODINÂMICA DA OXIDAÇÃO DOS METAIS
A tendência de um metal reagir com o oxigênio na formação de um óxido é definida pela variação na energia livre de Gibbs durante o processo de oxidação, que pode ser determinada pela seguinte expressão:
15
Sendo:
: variação da energia livre de Gibbs; : energia livre padrão;
: constante universal dos gases (8,314 J/mol.K); : temperatura (K);
: constante de equilíbrio da reação.
Para que uma reação possa ocorrer espontaneamente, é preciso que a energia livre do sistema seja menor que zero e no equilíbrio químico igual a zero Dessa forma, pode se relacionar a energia livre padrão com a constante de equilíbrio k.
(3.9)
De acordo com a Equação 3.1, onde: , considerando que a atividade do gás oxigênio é igual à sua pressão parcial e a atividade de sólidos puros, na forma estável, é unitária, a constante de equilíbrio assume a forma:
(3.10)
Assim, a energia livre padrão de formação do óxido depende da temperatura e da pressão parcial de oxigênio:
ou (3.11)
16
Figura 3.3 – Diagrama de Ellingham[24].
17
desvios de estequiometria elevados dos óxidos também são indicados sobre os diagramas de equilíbrio.
Dependendo da pressão parcial de oxigênio, alguns metais podem formar diferentes camadas de óxidos com diferentes composições. A camada oxidada pode ser composta por uma sequência de óxidos metálicos. O óxido mais rico em metal e mais estável forma-se em contato com o metal, enquanto o óxido mais rico em oxigênio, menos estável, se forma em contato com o gás oxidante.
No caso das ligas Fe/Cr, o cromo, devido à sua energia livre mais negativa para a formação de óxido, oxida-se preferencialmente ao ferro, formando um filme de óxido superficial de Cr2O3, o qual protege a liga contra corrosão adicional. O Cr2O3 é o único óxido
sólido que se forma por oxidação térmica do cromo[25].
3.6 – ÓXIDO DE CROMO
3.6.1 – Estrutura e Propriedades
O óxido de cromo, Cr2O3, tem uma estrutura cristalina isoestrutural ao Al2O3 e ao
Fe2O3, ou seja, tem a estrutura do coríndon. Nessa estrutura, os íons de oxigênio formam uma
estrutura hexagonal compacta com os íons trivalentes, ocupando 2/3 dos sítios intersticiais octaédricos[13]. A Tabela 3.1 mostra alguns dados relativos à estrutura do Cr2O3, assim como
as constantes físicas.
Tabela 3.1 – Dados estruturais e constantes físicas do Cr2O[26].
Sistema Cristalino Grupo Espacial Tipo Estrutural Parâmetros da Rede (Å)
Volume Atômico (cm3)
Peso Molecular
Densidade
( g3
cm ) Ponto de Fusão (°C) Ponto de Ebulição (°C) Hexagonal Compacto
R3c Coríndon a = 4,9607
c = 13,599
289,82 x10-24
151,99 5,21-5,22 2266
25
18
3.6.2 – Defeitos Pontuais no Óxido de Cromo
Dependendo da pressão parcial de oxigênio, o Cr2O3 pode comportar como um
semicondutor do tipo “n” ou do tipo “p”. Em geral, considera-se que o Cr2O3 é um
semicondutor do tipo “p” a altas pressões parciais de oxigênio[19,25], tendo como defeito
atômico majoritário lacunas de cromo com carga efetiva –3. Utilizando-se a notação de Kröger e Vink, a formação desse defeito é descrita pela equação[19]:
(3.12)
onde é o íon de oxigênio em um sítio regular; é a lacuna de cromo ionizada três vezes negativamente e representa o buraco eletrônico.
Nesse caso, a condição de eletroneutralidade é dada por .
O Cr2O3, à baixa pressão parcial de oxigênio, é considerado um semicondutor do tipo
“n”, tendo como defeito atômico majoritário o , formado pela equação[19]:
(3.13)
onde representa o íon de cromo num sítio intersticial com carga efetiva +3 e representa o elétron.
A condição de eletroneutralidade é dada por .
Pode-se demonstrar que a concentração dos defeitos pontuais em função da temperatura e da pressão de oxigênio é dada por uma equação geral do tipo[19]:
(3.14)
19
3.7 – TEORIA DE WAGNER DA OXIDAÇÃO DE METAIS
Na oxidação de ligas Fe-Cr, considera-se que o crescimento do filme de Cr2O3 ocorre
pela difusão do cromo do substrato metálico em direção ao exterior e pela difusão do oxigênio da atmosfera em direção ao substrato através do filme de óxido. Como essa cinética é controlada pela difusão do cromo e do oxigênio, ela depende fundamentalmente dos defeitos pontuais atômicos presentes no filme.
Pode-se demonstrar que a difusão catiônica, ou aniônica, é proporcional à concentração dos defeitos atômicos responsáveis pela difusão, ou seja, , onde representa a concentração do defeito.
Para óxidos puros e não-estequiométricos, a concentração de defeitos, e consequentemente a difusão, pode depender não só da temperatura, mas também da pressão de oxigênio. Como no caso geral , vem .
Pela teoria da oxidação de Wagner, podemos relacionar a constante parabólica de oxidação, , aos coeficientes de difusão das espécies atômicas que asseguram o crescimento de um filme de óxido[23], através da equação:
(3.15)
onde é a pressão parcial de oxigênio na interface óxido/gás; é a pressão parcial de oxigênio na interface metal/óxido; e e são os coeficientes de difusão efetivos do cromo e do oxigênio, respectivamente.
O coeficiente de difusão efetivo é dado pela expressão[27]:
(3.16)
onde é o coeficiente de difusão em volume; é o coeficiente de difusão intergranular e é a fração de sítios atômicos associados aos contornos de grão.
20
(3.17)
Dentre os objetivos do presente trabalho, tem-se a caracterização microestrutural e a determinação da composição química dos filmes formados sobre as ligas Fe-Cr para o posterior planejamento de experiências de difusão visando correlacionar as difusividades catiônica e aniônica com a taxa de crescimento dos filmes. Portanto, é de suma importância a compreensão dos defeitos pontuais atômicos presentes nos filmes os quais são responsáveis pela difusão.
3.8 – OXIDAÇÃO DE LIGAS FERRO-CROMO
21
0 5 10 15 20 25 30
500 600 700 800 900 1000 1100 1200 1.mg.cm -2.dia -1 10.mg.cm -2.dia -1
B
A
* * * * * s s s # # # # # s s s s s s * * * * * + + + + + + s * * * * * s s s s ss + + + + + + # FeOs - Espinélio + Cr2O3 * Fe2O3
T (
o C)
Teor de Cromo (%)
Figura 3.4 – Natureza das camadas de óxidos formados sobre o aço cromo após 10-20h de oxidação em ar[28].
22
Figura 3.5 – Seção isotérmica do diagrama de fases Fe-Cr-O a 1200°C[21].
Sobre a superfície em baixos teores de Cr, formam-se óxidos ricos em cromo e em ferro. Certa quantidade de Cr entra em solução na fase FeO mas devido a estabilidade do espinélio a solubilidade é limitada. Sob o aumento do teor de Cr, íons Fe2+ são progressivamente bloqueados pelos aglomerados de FeCr2O4, e a camada de FeO,
correspondentemente, torna-se mais fina em relação à espessura da camada de Fe3O4, Figura
3.6. Nestas fases a taxa de reação ainda é bastante elevada e típica de ferro puro. Quando o teor de Cr é aumentado, uma camada de espinélio misto, Fe(Fe,Cr)2O4, é formada e a
23
24
3.9 – ESTUDOS RECENTES DA OXIDAÇÃO DE LIGAS FERRO-CROMO
A oxidação de aços baixo Cr (1,5 e 2,25% em peso) e aços alto Cr (9, 12 e 18% em peso) foi investigada por Trindade et al.[5] em temperaturas entre 550°C-830°C, em ar. Os
resultados mostraram que a oxidação interna dos aços Cr é governada pela difusão em contornos de grãos. Foram observadas diferentes tendências relativas aos tamanhos de grãos da liga sobre a oxidação interna. Para os aços de baixo Cr (menor do que 2,25% em peso), um aumento dos tamanhos de grãos melhorou a resistência à oxidação, enquanto que para aços com alto teor de Cr (18% em peso), forma mais facilmente uma camada superficial fina e protetora de cromia sobre o substrato que possui tamanhos de grãos mais finos.
Ligas binárias a base de ferro, contendo 3, 9, 12 e 18%, em peso, de cromo foram oxidadas em ar a temperaturas elevadas. Espectroscopia Raman foi usada para determinar a composição química dos filmes de óxidos formados sobre as ligas. O filme de óxido formado sobre a liga Fe-3,0%Cr, em diferentes temperaturas, consiste principalmente de ferro. Entretanto, para teores de Cr acima de 12% o filme de óxido formado a 400°C consiste de Fe2O3, Fe3O4 e espinélio. Com o aumento da temperatura de oxidação para 850°C, a camada
de óxido consiste apenas de Cr2O3 e espinélio[33].
O comportamento de oxidação e a microestrutura do filme de óxido formado sobre a liga Fe-3,0%Cr, em ar, a 800°C e em um intervalos de tempo de até 7 horas, foi estuda por Kahveci et al.[34]. A cinética de oxidação desta liga apresentou dois estágios: oxidação aproximadamente parabólica, seguida por uma oxidação não-parabólica. A mudança da cinética de oxidação foi causada pela evolução microestrutural e mudança química do filme de óxido.
Liu et al.[35] investigaram a microestrutura dos óxidos formados após oxidação por 168
horas e 336 horas, à 600ºC, em aço 11%Cr. Para os tempos investigados, foi encontrada uma fina e protetora camada rica em Cr nas amostras oxidadas em oxigênio seco. Neste estudo, assim como nos trabalhos realizados por Tjong[33] e Kahveci et al.[34], não foram fornecidos
dados sobre o valor da taxa de oxidação das ligas e aço.
Para obter informações sobre o comportamento da liga Fe-16%Cr, Brylewski et al.[8]
realizaram o estudo da cinética de oxidação e da microestrutura da camada de óxido, formado sobre a liga Fe-16Cr, em atmosfera constituída de uma mistura de gases, em baixa pressão de oxigênio (5,2 x 10-22atm) e temperatura de 800°C. A energia de ativação encontrada foi Ea = 202,3 kJ.mol-1 e a constante parabólica de oxidação, em ar, foi kp = 8,5x10-14 g2.cm-4.s-1. A
25
aderência ao substrato. O Cr2O3 foi predominante, no entanto, outras fases foram encontradas
na forma de espinélio do tipo MnCr2O4.
Uma densa camada de Cr2O3 incluindo MnCr2O4 e uma pequena quantidade de
FeCr2O4 foi observada na superfície da liga Fe-16Cr após oxidação em ar e em uma mistura
de gases Ar-H2-H2O, a 800°C, ou seja, sob as condições de simulação da célula a combustível
de óxido sólido do tipo planar (SOFC). A constante parabólica de oxidação da liga, em ar, foi de 7,7x10-15 g2.cm-4.s-1. A dependência da pressão parcial de oxigênio com a constante parabólica de oxidação revelou que a taxa de crescimento da camada Cr2O3 é praticamente a
mesma em diferentes pressões parciais de oxigênio ( = 4,1x10-7 a 2,1x104 Pa). A microestrutura da camada de óxido formada sob o potencial de hidrogênio em ambas as atmosferas, foi similar a formada pela oxidação nas atmosferas separadamente sem o potencial de hidrogênio[9].
A estabilidade química das ligas Fe-16Cr e Fe-22Cr foi examinada em vapores gasosos de CH4, a 800°C, para simular a atmosfera do ânodo na operação da SOFC. Os
principais óxidos formados, sobre a superfície de ambas as ligas, foram o Cr2O3 e o espinélio
Mn-Cr-Fe. A exposição das ligas em atmosfera CH4-H2O fez com que o filme de óxido se
tornasse mais espesso durante o tempo de exposição. A cinética de crescimento do filme de óxido obedeceu a taxa parabólica, obtendo-se kp=6,25x10-6m2/s para SUS430 e kp=4,42x10 -6m2/s para ZMG232[10].
Horita et al.[11] estudaram a formação da película de óxido na liga Fe-22Cr e a difusão
do oxigênio nesta película. O óxido formado sobre esta liga em atmosferas de H2/H2O e
CH4/H2O, a 800°C, foi investigado por SIMS. Da superfície do óxido à interface com a liga,
foi encontrado espinélio Mn/Fe, Cr2O3, SiO2 e Al2O3. As análises de distribuição de
elementos sugerem que a difusão em contornos de grãos possui importante papel no crescimento da película de óxido. Foi encontrado que o crescimento da película segue uma lei parabólica.
26
teoria de Wagner, confirmando o papel dos processos difusionais no crescimento de cromia nos aços inoxidáveis. Não foi observada influência da atmosfera quanto ao comportamento de oxidação e quanto à composição química do filme para oxidação do aço AISI 439 (ferrítico estabilizado com Nb e Ti). As análises de superfície detectaram que o filme protetor é composto majoritariamente por óxido de cromo, com presença de óxidos mistos (Cr, Fe)2O3,
(Mn1,5Cr1,5O4). Mostrou ainda que a perda da integridade da camada de óxido pode não ser
devida à volatilização desta, pois mesmo em oxigênio seco, houve um segundo estágio de oxidação com um valor maior de . Atribuindo essa perda de proteção à presença de trincas através da camada.
Análises da oxidação em atmosfera de ar seco, com temperatura variando entre 850ºC e 1050ºC, mostraram que a camada de óxido produzida no aço AISI 444 é mais aderente do que no aço AISI 439, na faixa de temperatura de 850ºC a 950ºC. Nesta faixa, o aço AISI 444 é mais resistente à oxidação do que o aço AISI 439. Acima de 950ºC, o aço AISI 444 apresenta diminuição de sua resistência à oxidação, intensificando a descamação na camada de óxido formada e tornando seu comportamento similar ao do aço AISI 439, a 1050°C. Em todas as temperaturas verificou-se crescimento parabólico dos filmes de óxido formados, com teor majoritário de cromo. Nas regiões com expressiva descamação no filme de óxido, detectou-se elevado teor de ferro[36].
27
3.10 – TÉCNICAS EXPERIMENTAIS UTILIZADAS NA CARACTERIZAÇÃO MICROESTRUTURAL E QUÍMICA DAS SUPERFÍCIES
3.10.1 – Microscopia Eletrônica de Varredura – MEV
O microscópio eletrônico de varredura é um equipamento que permite a obtenção de informações estruturais de amostras diversas e imagens de alta ampliação (teórica) 300.000X, resolução de até 2,0nm e diferença de potencial que pode variar de 0.5 à 30KV[29]. Devido à sua potencialidade e versatilidade de uso, esse microscópio possui, acoplado em sua câmara de vácuo, um espectrômetro por energia dispersiva, possibilitando, assim, que a microanálise se realize juntamente com a observação da imagem do filme de óxido que aparece no monitor do computador ao ser captada pelo microscópio.
A técnica de microscopia eletrônica de varredura detecta e analisa os elétrons secundários e os elétrons retroespalhados emitidos. Esses elétrons são projetados sobre uma tela de televisão e reproduzem, por contraste, a imagem da amostra.
As imagens com elétrons secundários apresentam um contraste devido à topografia da amostra, graças à grande profundidade do campo do microscópio. Nas partes mais salientes do material, a energia de ionização é maior e, portanto, maior é a intensidade de elétrons absorvida pelo detector. Esses pontos aparecem mais claros sobre a tela de imagem, ao contrário dos pontos mais profundos.
Com os elétrons retroespalhados, o sinal obtido mostra essencialmente um contraste de composição química; as fases aparecem mais claras, ou menos, de acordo com a média dos números atômicos dos elementos presentes. Quanto maior o número atômico do elemento químico, maior é a energia elástica dos elétrons retroespalhados e, portanto, mais intenso é o sinal. Assim, quanto maior o número atômico médio de uma fase, mais clara é a imagem sobre a tela. Com esse tipo de imagem fica mais fácil observar as fases presentes, e eventuais precipitados na camada de óxido formado sobre aços e ligas.
3.10.2 – Espectroscopia Dispersiva de Energia – EDS
28
detectores, os quais estão instalados na câmara de vácuo do MEV, baseados na medida de energia são os mais usados, cuja grande vantagem é a rapidez na avaliação dos elementos.
Na espectrometria por dispersão de energia, o detector é constituído de um diodo de silício ou germânio e de um analisador multicanal que permitem contar e discriminar os espectros em função de suas energias. Comparando a energia dos espectros obtidos com a energia dos elementos químicos armazenados na memória, o analisador consegue identificar os elementos químicos da amostra.
Os resultados são apresentados em forma de gráficos, em função da intensidade de cada espectro e de suas energias. Um elemento químico pode apresentar vários picos, visto que a energia dos fótons emitidos por ele depende da transição eletrônica entre as camadas dos átomos.
O analisador separa, então, os diferentes espectros de cada elemento químico. Além da representação gráfica dos resultados, a composição química de cada elemento presente no volume de interação é calculada e apresentada em paralelo.
O detector não consegue analisar corretamente os elementos químicos de número atômico igual ou inferior a 10 porque esses elementos apresentam baixo peso atômico e, portanto, emitem sinais de baixa energia. A dosagem semiquantitativa apresentará um valor superestimado da concentração dos elementos químicos da amostra em análise, quando a mesma possuir qualquer elemento ou impureza que emita sinais de baixa energia, isto é, abaixo do limite de detecção ou da precisão do equipamento[13].
3.10.3 – Difração de Raios X – DRX
A difração de raios X é uma importante e não destrutiva técnica de investigação de propriedades estruturais de materiais cristalinos. Padrões de difração são produzidos quando um material cristalino é irradiado com um feixe colimado de raios X.
Os raios X constituem uma radiação eletromagnética de comprimento de onda curto produzida pela aceleração ou desaceleração de elétrons de alta energia ou pelas transições de elétrons dos orbitais internos dos átomos[30].
Na difração de raios X, a radiação incidente na amostra a ser analisada induz um movimento acelerado nos elétrons. Esse movimento gera uma onda com o mesmo comprimento de onda da radiação incidente, processo denominado espalhamento coerente.
29
devido aos efeitos de interferência. A radiação resultante dos efeitos de interferência construtiva traz importantes informações sobre a estrutura da amostra cristalina.
Seja uma dada família de planos cristalinos, descritos pelos índices de Miller [h k l], como é mostrado na Figura 3.7. Um feixe de raios X espalhado pela família [h k l] interferirá de forma construtiva se as distâncias ABC e DEF forem iguais a um número inteiro de
comprimento de onda (λ). A partir da Figura 3.7, pode-se concluir que ABC = 2dsenθ, onde d
é a distância entre os planos cristalinos. Quando a interferência construtiva (difração) ocorrer, temos ABC = nλ, onde n é um número inteiro. Portanto, obtem-se a equação de Bragg:
nλ = 2dsenθ (3.18)
A partir da determinação experimental do ângulo θ, pode-se obter o espaçamento entre os planos cristalinos, d, que é característico da família de planos (hkl).
Figura 3.7 – Espalhamento de raios X por planos cristalinos.
Os métodos de raios X estão baseados no fato de que o padrão de difração de raios X é único para cada substância cristalina. Assim, se é encontrada uma concordância exata entre o padrão produzido pela amostra desconhecida e o de uma amostra conhecida, então a identidade química da amostra desconhecida pode ser atribuída[30].
30
óxidos obtidos no presente trabalho foi utilizada a técnica de difração de raios X com ângulo de incidência rasante nas dependências do Laboratório Nacional de Luz Síncrotron – LNLS.
Estudos realizados com luz síncrotron proporcionam resoluções instrumentais e/ou estatísticas de contagens superiores àquelas obtidas com fontes convencionais. Essas características contribuem na solução de problemas que, muitas vezes, não podem ser estudados em laboratório, tais como medidas em alta resolução, onde é possível minimizar a sobreposição de picos de difração, levando a um ganho na extração de informações estruturais; alta intensidade, em que o alto fluxo de fótons permite que se tomem medidas de perfis de difração, em intervalos de tempo muito menores do que em equipamentos que utilizam tubos de raios X[31].
Radiação síncrotron é a radiação emitida pela deflexão de um feixe de partículas carregadas por um campo magnético ou elétrico. Com o objetivo de se obter alta intensidade e um largo espectro de energia, é indispensável que essas partículas sejam altamente relativísticas. Elétrons ou pósitrons são adequados a serem empregados nesse empreendimento. Na prática, são usados nas fontes de radiação Síncrotron feixes de elétrons defletidos por campos magnéticos[31].
A fonte de luz síncrotron do LNLS consiste, basicamente, em um acelerador linear de elétrons, um acelerador circular e um anel de armazenamento. O acelerador linear de elétrons é usado para injetar elétrons no anel. O acelerador circular é composto por câmara de vácuo e ímãs que mantêm os elétrons em órbita circular e cavidades de radiofreqüência que aceleram progressivamente os elétrons até que atinjam certa energia. O anel de armazenamento consiste em uma câmara de ultra vácuo (< 10Torr), onde os elétrons estão confinados em órbitas circulares de energia constante, sendo esta a forma mais comum de fonte de radiação síncrotron. Esta radiação é transportada por meio das linhas de vácuo, que são chamadas linhas de luz, e chegam até a estação experimental onde está montado o experimento[31].
31
Figura 3.8 – Linha XRD-1 do Laboratório Nacional de Luz Síncrotron, Campinas - SP.
3.10.4 – Espectrometria de Massa de Íons Secundários - SIMS
A espectrometria de massa de íons secundários baseia-se na análise dos íons secundários, emitidos por um sólido irradiado com um feixe iônico primário de energia entre 0,5 e 10KeV[32].
Algumas características desta técnica[32]:
Capacidade de analisar todos os elementos da tabela periódica; Limite de detecção varia na faixa de ppm a ppb;
32
Essas características possibilitam a utilização de SIMS para identificar os isótopos de um mesmo elemento químico. Tal resolução serve para se estudar os mecanismos difusionais responsáveis pelo crescimento dos filmes de óxido, utilizando, então, os isótopos como identificadores das partículas difusantes.
O Princípio de Funcionamento do SIMS consiste em bombardear a superfície da amostra com íons primários, de alguns KeV. Estes íons penetram no sólido e entram em colisão com os átomos localizados nas primeiras camadas atômicas da amostra. Os átomos da superfície entram em movimento e iniciam colisões em cascata com os átomos vizinhos, provocando a ejeção de espécies atômicas e moleculares por meio do processo denominado
sputtering. Uma pequena parte das partículas ejetadas são íons que constituem a emissão
iônica secundária. A Espectrometria de Massa de Íons Secundários analisa os íons secundários, fornecendo informações sobre a composição da superfície ou do volume da amostra[32].
33
4
–
PARTE EXPERIMENTAL
4.1 – MATERIAIS
As amostras de Fe-Cr, utilizadas neste trabalho, foram elaboradas com alto grau de pureza no Max-Planck Institute fuer Eisenforschung (MPIE) em Dusseldorf/Alemanha. Na Tabela 4.1, é apresentada a composição química das ligas utilizadas nesta pesquisa.
Tabela 4.1 – Composição química para as ligas Fe-Cr. % Fe % Cr
98,5 1,5 95 5 90 10 85 15
4.2 – PREPARAÇÃO DAS AMOSTRAS
As amostras foram cortadas, em uma máquina de corte ISOMET 1000, na forma de placas com as dimensões de 10mm x 10mm x 0,6mm, conforme mostra a Figura 4.1. Um orifício medindo 0,8mm de diâmetro foi perfurado próximo ao ponto médio de uma de suas arestas. Esse orifício foi utilizado para suspender a amostra por meio de um fio de platina, acoplado na balança registradora da termobalança.
(a) (b)
34
Para o devido polimento, as amostras foram embutidas em resina acrílica. Após o lixamento com carbeto de silício, de granas 1000 e 1200, fez-se o polimento com suspensões de diamante de granulometrias 3 e 1m, em uma politriz automática Phoenix-4000 da Buhler, Figura 4.2, obtendo-se uma superfície polida plana, com acabamento especular. Após o polimento de uma face, a amostra foi removida da resina, por dissolução em acetona e, a seguir, re-embutida para o polimento da segunda face.
A limpeza final das amostras, depois de polidas, foi feita com acetona, em um aparelho de ultrassom Bandelin SONOREX super RX106
Figura 4.2 – Politriz Phoenix utilizada no polimento.
4.3 – CARACTERIZAÇÃO MICROESTRUTURAL DAS LIGAS Fe-Cr
Após os procedimentos de polimento das amostras, foram realizados os ataques químicos com o reativo villela (95% CH3CH2OH, 5% HCl e 1 g de ácido pícrico) e com água
régia (solução de 60% HCl e 40% HNO3). Além destes ataques, procedeu-se o ataque
![Figura 3.4 – Natureza das camadas de óxidos formados sobre o aço cromo após 10-20h de oxidação em ar [28]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15748812.637639/42.892.102.794.101.643/figura-natureza-camadas-óxidos-formados-sobre-cromo-oxidação.webp)