NATHÁLIA AKEMI YOSHIOKA
ESTUDO DAS PROPRIEDADES ÓPTICA E ELÉTRICA DA
CLOROFILINA CÚPRICA DE SÓDIO PARA APLICAÇÃO EM
DISPOSITIVOS CONVERSORES DE ENERGIA
Universidade Federal de Ouro Preto
Departamento de Física
NATHÁLIA AKEMI YOSHIOKA
ESTUDO DAS PROPRIEDADES ÓPTICAS E ELETRÔNICAS DA
CLOROFILINA CÚPRICA DE SÓDIO (SCC) PARA APLICAÇÃO EM
DISPOSITIVOS CONVERSORES DE ENERGIA
Universidade Federal de Ouro Preto
Departamento de Física
Ouro Preto, Fevereiro de 2014.
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Ciências de Materiais do Departamento de Física da Universidade Federal de Ouro Preto como requisito para obtenção do título de Mestre em Ciência de Materiais.
Catalogação: sisbin@sisbin.ufop.br Y657e Yoshioka, Nathália Akemi.
Estudo das propriedades ótica e elétrica da clorofilina cúprica de sódio para aplicação em dispositivos conversores de energia [manuscrito]. / Nathália Akemi Yoshioka. – 2014.
91 f.: il. color., grafs., tabs.
Orientador: Prof. Dr. Thiago Cazati.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Departamento de Física.
Área de concentração:Física de materiais
1.Células solares - Teses. 2. Semicondutores orgânicos - Teses. I. Cazati, Thiago. II. Universidade Federal de Ouro Preto. III. Título.
DEDICATÓRIA
AGRADECIMENTOS
À FAPEMIG, pela bolsa de estudos concedida;
Ao professor Thiago Cazati, pela orientação, seriedade e dedicação a este trabalho;
À professora Bruna Postacchini, pelo apoio e sugestões durante a realização deste trabalho;
Aos alunos Tomás Nogueira Ribeiro, Marcus Henrique de Araújo e Luiza de Lazari Ferreira, pelo auxílio prestado e pela colaboração;
Ao Laboratório de Materiais Optoeletrônicos (LAMOe) do Departamento de Física da Universidade Federal de Ouro Preto, onde a maior parte deste trabalho foi desenvolvida;
Ao Grupo de Polímeros Bernhard Gross do Instituto de Física de São Carlos, pela concessão do espaço para realização de partes deste trabalho;
Ao Programa de Pós-Graduação em Ciências de Materias da Universidade Federal de Ouro Preto e ao coordenador prof. Dr. Genivaldo Júlio Perpétuo por toda a assistência prestada;
À secretária Mariana Cristina Moreira Souza, pela atenção e solicitude;
Aos amigos e colegas de turma, em especial à Larissa, ao Márcio e ao João Paulo pela amizade e pelo convívio;
RESUMO
ABSTRACT
LISTA DE FIGURAS
Figura 1: Exemplos de aplicação de materiais orgânicos semicondutores em OLEDs e
em OPVs ... 15
Figura 2: Estrutura molecular da porfirina de base livre ... 17
Figura 3: Espectro de absorção na região visível típico de uma porfirina ... 18
Figura 4: Orbitais HOMO (abaixo) e LUMO (acima) das porfirinas ... 19
Figura 5: a) Diagrama de orbitais mostrando as transições possível para as porfirinas; b) Diagrama de estados mostrando os possíveis estados excitados para as porfirinas. 19 Figura 6: Espectro de absorção das porfirinas contendo os principais níveis de energia, sendo que a banda Soret corresponde a uma transição π-π* e a banda Q corresponde a uma transição n-π*. ... 20
Figura 7: Exemplos de metaloporfirinas: (a) clorofila, (b) heme, (c) ftalocianina de cobre e (d) ftalocianina de manganês. ... 22
Figura 8: Estrutura molecular da clorofila (a) e da clorofilina cúprica de sódio (SCC) (b) ... 23
Figura 9: Diagrama de Jablonski adaptado [29] ... 24
Figura 10: Dispositivo fotovoltaico orgânico com estrutura tipo sanduíche. Nessa arquitetura exemplificada, o dispositivo é composto por uma camada fotoativa (material orgânico) depositada entre o eletrodo Cátodo (Al) e o Ânodo (ITO) semitransparente ... 27
Figura 11: Estrutura química da clorofilina cúprica de sódio (SCC) e do hidrocloreto de polialilamina (PAH) ... 29
Figura 12: Ilustração do ciclo de deposição de bicamadas de clorofilina cúprica de sódio pela técnica de automontagem ... 31
Figura 13: Curva de crescimento dos filmes de (PAH/SCC) obtidos em soluções com diferentes pHs em função do tempo de imersão ... 32
Figura 14: Filmes de (PAH/SCC)80 fabricados utilizando soluções de PAH com pH ácido (à esquerda) e pH básico (à direita)... 33
Figura 15: Solução de SCC (a) a direita, em pH 7,05; (b) a esquerda, em pH 3,48 [74]. ... 33
Figura 16: Etapas do procedimento adotado para a remoção da camada de ITO da superfície do substrato: (a) lâmina de ITO,(b) proteção (fita adesiva) sobre a região da lâmina da qual não se deseja remover o ITO, (c) remoção do ITO por meio do ataque químico e (d) obtenção do eletrodo de ITO na configuração desejada. ... 34
Figura 17: Medidas (em mm) da máscara utilizada na metalização dos eletrodos dos dispositivos fotovoltaicos. ... 35
tensão direta. ΦITO / ΦAl: função trabalho dos eletrodos, Ip: potencial de ionização e χ:
afinidade eletrônica da camada ativa. ... 38 Figura 20: Curva característica de um dispositivo fotovoltaico, tanto no escuro quanto iluminado. A Figura mostra a tensão de circuito aberto (VOC) e a corrente de curto
circuito para o dispositivo iluminado. O ponto A representa a corrente do dispositivo durante a tensão reversa (negativa), o ponto B é conhecido como corrente de curto-circuito, o ponto C é a tensão de circuito aberto e o ponto D a corrente no modo direto para V>VOC. ... 40
Figura 21: Representação de um dispositivo fotovoltaico de monocamada com estrutura tipo sanduíche durante a caracterização de condutividade DC, com incidência de luz através do eletrodo de ITO ... 42 Figura 22: Espectro de impedância de um RC paralelo [] ... 46 Figura 23: Espectro de impedância pelo diagrama de Argand [79] ... 47 Figura 24: Espectro de absorção da solução de SCC 0,05 mg/mL em água e de filmes de PAH/SCC com diferentes números de bicamadas ... 49 Figura 25: Curvas de crescimento baseada nos máximos de absorção da banda Soret (406 nm) e da banda Q (638 nm) dos filmes de (PAH/SCC)n automontados em função
do número de bicamadas. A linha tracejada é guia para os olhos. ... 50 Figura 26: Espectros de absorção das soluções de SCC em diferentes solventes com concentração de 0,05 mg/mL (em detalhe o gráfico do coeficiente de absorção molar em função do momento dipolar do solvente) ... 51 Figura 27: Espectros de absorção das soluções de SCC em diferentes solventes a 0,05 mg/mL, normalizados em relação às principais bandas (a) Soret e (b) Q. ... 53 Figura 28: Espectros de fluorescência de soluções de SCC em diferentes solventes à concentração de 0,05 mg/mL excitadas no comprimento de onda de suas respectivas bandas Soret ... 54 Figura 29: Diagrama de energias evidenciando o efeito da relaxação do solvente. As esferas centrais representam as moléculas do soluto e as periféricas representam as moléculas do solvente, demonstrando a mudança do momento dipolar do estado excitado µe com relação ao do estado fundamental µf [29] ... 55
Figura 34: Espectro de absorção da solução de SCC em etanol com concentração de 0,05 mg/mL (em preto) e seus espectros de fluorescência quando excitada em 405 nm (azul escuro) e em 625 nm (azul claro) ... 60 Figura 35: Espectro de absorção da solução de SCC em água com concentração de 0,05 mg/mL (em preto) e seus espectros de fluorescência quando excitada em 404 nm (azul escuro) e em 627 nm (azul claro) ... 60 Figura 36: Espectros de fluorescência dos filmes de SCC com diferentes número de bicamadas excitados nos máximos de absorção das bandas Soret e Q ... 61 Figura 37: Espectros de impedância e seus respectivos diagramas de Argand para os dispositivos ITO/(PAH/SCC)8/Al ... 62
Figura 38: Espectros de impedância e seus respectivos diagramas de Argand para os dispositivos ITO/(PAH/SCC)16/Al ... 63
Figura 39: Espectros de impedância e seus respectivos diagramas de Argand para os dispositivos ITO/(PAH/SCC)24/Al ... 63
Figura 40: Espectros de impedância e seus respectivos diagramas de Argand para os dispositivos ITO/(PAH/SCC)32/Al ... 63
Figura 41: Gráficos da condutividade em função da frequência de oscilação do campo aplicado para os dispositivos ITO/(PAH/SCC)n/Al, com n = 8, 16, 24 e 32 ... 65
Figura 42: Componente real da capacitância (C') em função da frequência para os dispositivos (PAH/SCC)n ... 66
Figura 43: Curvas J-V para o dispositivo ITO/(PAH/SCC)80/Ca/Al no escuro e sob
iluminação de 100 mW/cm² ... 67 Figura 44: Quarto quadrante das curvas J-V para o dispositivo ITO/(PAH/SCC)80/Ca/Al no escuro e sob iluminação de 100 mW/cm² ... 68
Figura 45: Curvas J-V para o dispositivo ITO/(PAH/SCC)80/Al no escuro e sob
iluminação de 100 mW/cm² ... 69 Figura 46: Quarto quadrante das curvas J-V para o dispositivo ITO/(PAH/SCC)80/Al
no escuro e sob iluminação de 100 mW/cm² ... 69 Figura 47: Circuito simplificado equivalente a um dispositivo fotovoltaico ideal. A resistência em paralelo RP representa todas as perdas na corrente enquanto a
resistência em série RS representa a resistividade do circuito, resistividade nos contatos
elétricos e a resistividade da camada ativa [52] ... 70 Figura 48: Quarto quadrante das curvas J-V características de um dispositivo fotovoltaico no caso ideal (RP = ∞ e RS = 0) e em casos onde existe variações em RS ou
em RP [52] ... 70
Figura 49: Representação esquemática das bandas de energia da CuTsPc [83] comparadas às funções trabalho dos eletrodos utilizados neste trabalho ... 72 Figura 50: Curva J-t para o dispositivo ITO/(PAH/SCC)80/Ca/Al obtida alternando-se
entre a incidência de luz branca (100 mW/cm²) e o escuro ... 73 Figura 51: Curva J-t para o dispositivo ITO/(PAH/SCC)80/Al obtida alternando-se
entre a incidência de luz branca (100 mW/cm²) e o escuro ... 73 Figura 52: Ajustes das curvas (αhν)²-hν em energias próximas aos máximos de
das bandas Soret e Q para a solução aquosa de SCC com concentração de 0,05 mg/mL ... 75 Figura 53: Ajustes das curvas (αhν)²-hν em energias próximas aos máximos de
absorção, a fim de se calcular o gap energético envolvido em cada uma das transições das bandas Soret e Q para o filme de (PAH/SCC)80 ... 76
Figura 54: Ajuste das curvas ln(α)-hν em energias próximas ao início da absorção
óptica nas bandas Q e Soret para a solução aquosa de SCC com concentração de 0,05 mg/mL ... 77 Figura 55: Ajuste das curvas ln(α)-hν em energias próximas ao início da absorção
óptica nas bandas Soret e Q para o filme (PAH/SCC)80 ... 78
Figura 56: Ajustes das curvas J-t dos dispositivos ITO/(PAH/SCC)80/Ca/Al de acordo
com a Equação 31, a fim de investigar aspectos da fotocondutividade persistente ... 81 Figura 57: Ajustes das curvas J-t dos dispositivos ITO/(PAH/SCC)80/Ca/Al de acordo
LISTA DE TABELAS
Tabela 1: Relação entre o número de bicamadas e a espessura do filme de (PAH/SCC)n medida por perfilometria ... 50 Tabela 2: Momento dipolar dos solventes utilizados nas soluções de SCC. ... 52 Tabela 3: Máximos de absorção da banda Soret dos espectros de absorção da SCC em diferentes solventes e seus respectivos coeficientes de absorção molar obtidos através da Equação 4, sendo L = 1 cm o caminho óptico ... 53 Tabela 4: Cálculo da resistividade, da condutividade e da constante dielétrica dos filmes de (PAH/SCC)n a partir dos valores de impedância e capacitância obtidos
através da espectroscopia de impedância. A constante dielétrica foi calculada a partir da Equação 16 ... 66 Tabela 5: Valores das correntes de curto circuito, das tensões de circuito aberto, dos fatores de preenchimento e dos rendimentos para os dispositivos ITO/(PAH/SCC)80/Ca/Al e ITO/(PAH/SCC)80/Al ... 71
Tabela 6: Cálculo do Et das bandas Soret e Q para os filmes (PAH/SCC)n ... 78
Tabela 7: Valores obtidos para os parâmetros τ e β (Equação 31) do ajuste das curvas
J-t do dispositivo ITO/(PAH/SCC)80/Ca/Al ... 81
Tabela 8: Valores obtidos para os parâmetros τ e β (Equação 31) do ajuste das curvas
ÍNDICE
1. Introdução... 15
1.1. Moléculas orgânicas conjugadas ... 16
1.2. Porfirinas ... 17
1.2.1. Metaloporfirinas ... 21
1.2.2. Clorofila e Clorofilina cúprica de sódio (SCC) ... 23
1.3. Processos Radiativos e não-radiativos em Moléculas Conjugadas ... 24
1.4. Células solares orgânicas... 25
1.5. Dispositivo fotovoltaico ... 26
1.5.1. Estrutura e funcionamento... 26
2. Método experimental... 29
2.1. Fabricação dos dispositivos: ... 29
2.1.1. Materiais: ... 29
2.1.2. Processamento dos filmes: ... 30
2.1.3. Limpeza e preparação do substrato: ... 33
2.1.4. Metalização dos eletrodos: ... 34
3. Técnicas de caracterização ... 36
3.1. Espectroscopia de absorção: ... 36
3.2. Espectroscopia de fluorescência:... 37
3.3. Condutividade DC ... 38
3.4. Condutividade persistente ... 42
3.5. Espectroscopia de impedância: ... 42
4. Resultados e Discussões ... 48
4.1. Medidas Ópticas. ... 48
4.1.1. Espectroscopia de Absorção:... 48
4.1.2. Espectroscopia de fluorescência:... 54
4.2. Caracterizações elétricas (dc) ... 62
4.2.1. Espectroscopia de impedância... 62
4.2.2. Medidas elétricas de tensão-corrente (J-V): ... 66
4.2.3. Condutividade persistente ... 72
5. Análise dos resultados ... 74
5.1. Determinação do gap de energia da SCC ... 74
5.2. Grau de desordem do material ... 76
5.3. Tempo de relaxação dos portadores de cargas ... 79
15
1. Introdução
A indústria eletrônica é um dos principais pilares da sociedade moderna, estando presente de diversas formas na sociedade. Os principais elementos nos quais se baseiam a indústria eletrônica são dispositivos eletrônicos à base de materiais semicondutores inorgânicos (como o arseneto de gálio, o germano e o silício), tais como diodos, transistores e dispositivos fotovoltaicos [1,2,3]. Entretanto, materiais orgânicos estão sendo cada vez mais aplicados em dispositivos eletrônicos, sendo uma nova perspectiva para o cenário tecnológico e dando origem a uma outra classe dentro da eletrônica: a eletrônica orgânica. A eletrônica orgânica é um ramo da nanociência que permite que materiais orgânicos semicondutores, principalmente as moléculas orgânicas conjugadas, sejam utilizados em circuitos eletrônicos substituindo os tradicionais materiais inorgânicos. Uma das grandes vantagens que os materiais orgânicos possuem sobre os inorgânicos é a maior facilidade de processamento em substratos flexíveis, resultando em inúmeras inovações tecnológicas. Alguns exemplos de aplicações, como em displays de diodos orgânicos emissores de luz (OLEDs, do inglês organic light-emitting diode) e dispositivos orgânicos fotovoltaicos (OPVs, do inglês organic photovoltaics), são mostrados na Figura 1.
16 1.1.Moléculas orgânicas conjugadas
Moléculas orgânicas conjugadas possuem em sua estrutura uma alternância entre ligações simples e duplas na cadeia de carbono, o que as tornam materiais semicondutores. Os elétrons de valência de um átomo de carbono são os elétrons presentes nos orbitais 2s e 2p. Orbitais híbridos são obtidos pela sobreposição das funções de onda dos orbitais 2s e 2p, sendo do tipo sp³, sp² e sp [4]. A estrutura eletrônica de moléculas conjugadas é determinada basicamente pelas ligações entre carbonos chamadas de ligações σ, formadas pela sobreposição de orbitais híbridos
sp²ao longo do plano da molécula. Em adição, existem as ligações π formadas pela
sobreposição lateral dos orbitais atômicos pz entre carbonos adjacentes,
perpendicular ao plano da molécula [ 5 ]. Os elétrons das ligações π são
deslocalizados, isto é, não estão presos a uma região específica da molécula, podendo transitar livremente pela conjugação da molécula. A superposição dos orbitais pz formam orbitais do tipo π (ligantes) e π* (anti-ligantes) e as interações
entre os orbitais π ligantes (ocupados) equivalem à banda de valência e as
interações entre os orbitais π* anti-ligantes (desocupados) equivalem à banda de
condução, análogo ao que ocorre em semicondutores inorgânicos [6,7]. A diferença entre a energia que separa o orbital molecular preenchido mais alto energeticamente (Highest Occupied Molecular Orbital – HOMO) e o orbital molecular vazio mais baixo energeticamente (Lowest Unoccupied Molecular Orbital – LUMO) resulta na energia de banda proibida do material (Eg). Nos semicondutores inorgânicos, a Eg é definida como a diferença de energia entre o máximo da banda de valência e o mínimo da banda de condução [8], enquanto em semicondutores orgânicos não são observadas bandas definidas.
17 1.2.Porfirinas
Dentre as moléculas orgânicas conjugadas, as porfirinas (do grego porphura, que significa cor púrpura) compreendem uma importante classe de moléculas presentes na natureza, exercendo diversas funções biológicas e de grande interesse em diversas áreas como oncologia, física de materiais, entre outros [18]. São compostos orgânicos e organometálicos formadas por quatro anéis pirrólicos ligados por pontes de metil, formando uma estrutura planar e caráter aromático. A porfirina de base livre é mostrada na Figura 2. O macrociclo pode sofrer substituição dos seus doze hidrogênios por grupos funcionais, e, dependendo dos grupos substituintes, o comportamento das porfirinas pode ser alterado, como por exemplo, a solubilidade em determinados solventes. No centro desta estrutura, é possível inserir prótons ou íons metálicos substituindo os dois hidrogênios centrais, alterando de forma significativa suas propriedades estruturais e eletrônicas [19,20,21].
Figura 2:Estrutura molecular da porfirina de base livre
O anel porfírico possui dezoito elétrons π deslocalizados em sua estrutura, e
esta extensa conjugação é responsável pela alta absorção de radiação na luz visível, podendo ainda transmitir tal energia a moléculas vizinhas.
18
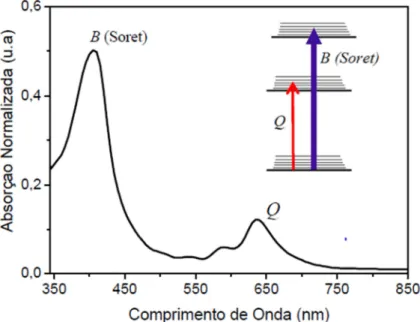
Em geral, as porfirinas e seus derivados possuem duas principais transições eletrônicas quando excitadas com radiação visível, verificadas através de duas principais bandas no espectro de absorção: banda Soret (B), na região de menores comprimentos de onda e banda Q, em maiores comprimentos de onda (Figura 3).
Figura 3:Espectro de absorção na região visível típico de uma porfirina
19 Figura 4:Orbitais HOMO (abaixo) e LUMO (acima) das porfirinas
Figura 5:a) Diagrama de orbitais mostrando as transições possíveis para as porfirinas; b) Diagrama de estados mostrando os possíveis estados excitados para as porfirinas.
Neste modelo, ambas as transições ocorrem entre os orbitais ligantes (π) e
20
Soret é observada no espectro de absorção UV-visível em torno de 350-500 e bandas Q em torno de 500-750 nm [26].
Há uma outra teoria que explica as duas principais transições eletrônicas observadas no espectro de absorção das porfirinas que considera, além da transição do tipo π-π*, uma outra transição do tipo n-π*. A presença de um orbital n é devida
à presença de pares eletrônicos não ligantes dos heteroátomos (neste caso, o nitrogênio), sendo n um orbital molecular não ligante [27,28,29]. A transição π-π* é
mais energética, sendo corresponde a banda Soret, enquanto a transição n-π*,
menos energética, caracteriza a banda Q. As transições estão ilustradas na Figura 6.
Figura 6: Espectro de absorção das porfirinas contendo os principais níveis de energia, sendo que a banda Soret corresponde a uma transição π-π* e a banda Q corresponde a
uma transição n-π*.
21
1.2.1.Metaloporfirinas
22 Figura 7:Exemplos de metaloporfirinas: (a) clorofila, (b) heme, (c) ftalocianina de
cobre e (d) ftalocianina de manganês.
23
metaloporfirinas é a clorofilina cúprica de sódio (SCC, do inglês Sodium Copper Chlorophyllin).
1.2.2.Clorofila e Clorofilina cúprica de sódio (SCC)
A clorofila (Chl) é um pigmento verde de origem natural responsável pelo processo de fotossíntese, processo em que a luz solar é convertida na energia necessária às plantas e bactérias clorofiladas. Possui uma ampla absorção de luz na região do visível e possui energia de ativação de semicondutor entre 1,2 e 1,65 eV, característica que torna a clorofila e seus derivados materiais de interesse para a aplicação em células solares [43,44]. As clorofilinas são moléculas sintetizadas a partir da clorofila, obtidas pela saponificação em meio alcoólico-alcalino (etanol contendo NaOH) [40,45,46]. Em particular, a clorofilina cúprica de sódio (SCC) é uma molécula derivada da clorofila obtida através da substituição do átomo central de Mg por um átomo de Cu, passando, posteriormente, pelo processo de saponificação. Tal reação confere à estrutura da molécula de SCC a solubilidade em água, propriedade de interesse neste trabalho. As moléculas de Chl-A e SCC são mostradas na Figura 8.
Figura 8:Estrutura molecular da clorofila (a) e da clorofilina cúprica de sódio (SCC) (b)
24
sistemas eletrônicos como camada fotoativa de dispositivos fotovoltaicos [40,49].
1.3.Processos Radiativos e não-radiativos em Moléculas Conjugadas
Em moléculas orgânicas conjugadas, a energia que separa os orbitais HOMO e LUMO são de alguns elétron-volts (1,8 a 3,1 eV) [50], permitindo a transição de eletrônica entre estes níveis através absorção do fóton. Após a absorção, diversos mecanismos radiativos e não-radiativos ocorrem. O diagrama de Jablonski (Figura 9) analisa de maneira simples os possíveis processos envolvidos de transição energética na molécula: absorção de fótons, conversão interna, fluorescência, cruzamento intersistema, fosforescência, entre outros.
Figura 9:Diagrama de Jablonski adaptado[29]
Como verifica-se no diagrama, S0 (estado fundamental), S1 e S2 são os estados eletrônicos singletos, ou seja, estados com apenas um valor possível de energia, e os estados T1 e T2 são os estados tripletos, com três valores possíveis para energia. A cada um destes níveis energéticos, estão associados diversos estados vibracionais.
25
ainda possuem diversos níveis vibracionais. Como pode-se observar na Figura 9, o elétron pode ser excitado de S0 para S1 ou S2. Do estado S2, o elétron pode decair para S1 através da conversão interna, decaimento não radiativo que ocorre entre dois níveis de mesma multiplicidade de spin. A partir de então, o elétron pode decair para S0 de forma radiativa, ou seja, fluorescendo, ou pode se transferir para o estado tripleto T1 através de um cruzamento intersistema e decair radiativamente em forma de fosforescência ou ainda decair de forma não radiativa por meio de um cruzamento intersistema de T1 a S0. Num cruzamento intersistema o elétron sofre inversão de spin e a necessidade de inverter-se o spin torna o fenômeno de fosforescência significativamente mais lento que o de fluorescência. Outro fenômeno que ainda pode ocorrer após o elétron ser excitado é a relaxação vibracional, já que um elétron pode ser excitado a qualquer um dos níveis vibracionais de S1 ou S2, decaindo então de forma não radiativa entre estes níveis. A excitação do estado S0 para T1 é uma transição proibida, com baixa probabilidade de ocorrência.
Pela análise dos espectros de absorção e fluorescência da Figura 9, pode-se observar que os comprimentos de onda da emissão são maiores que os da absorção, ou seja, a fluorescência ocorre em energias menores que a absorção. Apesar de a emissão de um fóton ocorrer tão rapidamente quando sua absorção (10-15 s), as espécies excitadas permanecem em S1 por um determinado tempo antes de emitirem um fóton ou decaírem de forma não radiativa. Este tempo é suficiente para que o sistema assuma a configuração de equilíbrio do estado excitado e, como este é menos energético, a emissão ocorre em comprimentos de onda maiores que o absorvido [29]. Uma causa comum para que isso ocorra é a rápida relaxação das espécies excitadas para níveis vibracionais abaixo de S1, para que então decaiam radiativamente para S0. O deslocamento entre os máximos de absorção e luminescência é chamado deslocamento de Stokes, estudado pela primeira vez pelo fisico irlandês George G. Stokes em 1852. Em geral, a energia que separa os níveis vibracionais são similares em S0 e S1 e, devido a isto, o espectro de fluorescência é uma imagem especular do espectro de absorção.
1.4.Células solares orgânicas
26
esgotáveis (tais como o petróleo e o carvão mineral), existe a crescente necessidade de buscar fontes renováveis de energia. Neste contexto, a energia solar se mostra uma fonte abundante de energia alternativa, ecologicamente mais limpa e viável tecnicamente [ 51]. Os dispositivos fotovoltaicos (capazes de converter energia luminosa em elétrica) disponíveis no comércio atualmente são constituídos principalmente por silício de alta pureza, apresentando um elevado custo de produção. Como alternativa de baixo custo aos dispositivos de silício, materiais semicondutores orgânicos são considerados candidatos potencialmente promissores para aplicações no campo de dispositivos optoeletrônicos, em particular em células solares. Apesar da atual baixa eficiência de conversão energética, as células fotovoltaicas orgânicas representam uma solução de baixo custo para a necessidade de geração de eletricidade através da radiação solar. Além disso, os dispositivos fotovoltaicos orgânicos apresentam extenso intervalo de absorção luminosa, podem ser fabricados tanto em substratos rígidos quanto em substratos flexíveis e a custo e inferior aos tradicionais fotovoltaicos à base de materiais inorgânicos (Si) [52,53,54].
As porfirinas, devido a suas propriedades semicondutoras, constituem uma classe de moléculas orgânicas conjugadas com potencial de aplicação em células solares à base de moléculas orgânicas pequenas (do inglês Small molecule organic solar cells, SMOSC) [42, 55 , 56 ]. Recentemente, SMOSC alcançaram uma eficiência recorde de conversão energética para este tipo de material de 6,7 % [16]. Entretanto, as propriedades importantes da maioria das porfirinas, tais como características da estrutura molecular, interações com o meio, propriedades fotofísicas, energia de ligação dos éxcitons, mecanismo de geração de portadores de carga e dinâmica do estado excitado são muito recentes ou pouco estudados [42,57,58]. O estudo destas propriedades é de extremo interesse na otimização dos dispositivos eletrônicos à base de porfirinas.
1.5.Dispositivo fotovoltaico
1.5.1.Estrutura e funcionamento
27
incidência de radiação), formando uma estrutura do tipo sanduíche (eletrodo/camada fotoativa/eletrodo), como pode-se verificar na Figura 10. O funcionamento e a eficiência de conversão energética do dispositivo dependem das características dos materiais (incluindo todos os seus elementos – eletrodo e camada fotoativa), da morfologia (incluído a forma de deposição das camadas) e da arquitetura dos dispositivos (monocamada, multicamadas, com heterojunções, etc) [52]. Portanto, os dispositivos fotovoltaicos são sistemas complexos com múltiplos processos ocorrendo simultaneamente e com diversas variáveis a serem ajustadas e otimizadas para garantir um bom desempenho.
Figura 10: Dispositivo fotovoltaico orgânico com estrutura tipo sanduíche. Nessa arquitetura exemplificada, o dispositivo é composto por uma camada fotoativa
(material orgânico) depositada entre o eletrodo Cátodo (Al) e o Ânodo (ITO) semitransparente
O princípio de funcionamento dos dispositivos fotovoltaicos depende do fenômeno físico conhecido como fotocondutividade, associado à variação de condutividade do material semicondutor quando exposto à radiação luminosa. A fotocondutividade se dá quando a densidade de elétrons promovidos à banda de condução por meio da interação com os fótons incidentes é significativamente superior à concentração dos elétrons excitados termicamente. Sua magnitude depende do número de portadores produzidos ou fotogerados (eficiência interna) e da mobilidade desses portadores durante o transporte. O tempo de duração da fotocondutividade depende do tempo de exposição do material à radiação e do tempo de vida das espécies excitadas.
28
origem aos portadores de carga livres de sinais opostos (fotogeração intrínseca) por meio da rápida dissociação dos pares elétron-buraco atraídos por força eletrostática (éxcitons) fotogerados. Em semicondutores orgânicos, há a formação de éxcitons com maior energia de ligação entre eles, sendo que neste caso a dissociação ocorre por processos secundários (fotogeração extrínseca), como por exemplo através da ação do campo elétrico externo, da interação dos pares com as cargas na interface material/eletrodos com defeitos e impurezas do próprio material e transferência de carga entre moléculas doadoras e aceitadoras [59,60,61,62,63].
29
2. Método experimental
Neste capítulo estão descritos os materiais, as etapas e os procedimentos experimentais utilizados na fabricação dos filmes e dos dispositivos fotovoltaicos. As etapas foram realizadas em laboratórios do Departamento de Física da Universidade Federal de Ouro Preto em colaboração com o Grupo de Polímeros "Prof. Bernhard Gross", do Instituto de Física de São Carlos (IFSC).
2.1.Fabricação dos dispositivos:
Os dispositivos de monocamada confeccionados neste trabalho foram preparados de acordo com as seguintes etapas de fabricação: preparação das soluções para confecção da camada fotoativa e deposição da mesma, limpeza e preparação do substrato e metalização dos eletrodos. Os detalhes de cada etapa serão apresentados a seguir.
2.1.1.Materiais:
O material orgânico semicondutor da família das porfirinas e derivado da clorofila utilizado neste trabalho foi a clorofilina cúprica de sódio (SCC) adquirida da Sigma-Aldrich®, sem purificações posteriores. A estrutura química da SCC está mostrada na Figura 11, bem como a estrutura do polieletrólito hidrocloreto de polialilamina (PAH), ambos utilizados na confecção da camada fotoativa.
SCC PAH
30
2.1.2. Processamento dos filmes:
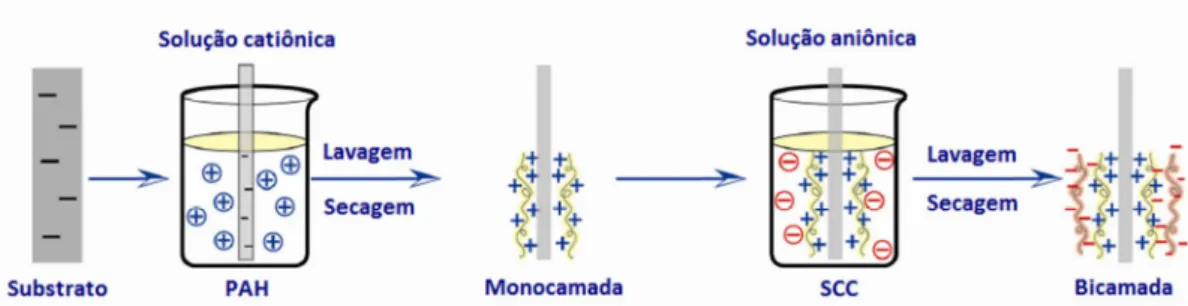
A técnica escolhida para deposição da camada fotoativa do dispositivo foi a automontagem ou camada-por-camada (LBL, do inglês layer-by-layer). É uma técnica que permite controlar a espessura do filme, podendo então serem produzidos filmes ultrafinos (nanométricos). Além disso, é uma técnica na qual os filmes de SCC podem ser depositados a partir de soluções aquosas, já que a água é um solvente pouco volátil, inviabilizando o emprego de outras técnicas de deposição, como espalhamento casting ou spin coating [ 69 ]. A técnica de automontagem é baseada em interações eletrostáticas entre grupos iônicos e permite a adsorção sucessiva de camadas de material aniônico e catiônico sobre um substrato. Um substrato carregado negativamente, quando imerso em uma solução catiônica, adsorve uma certa quantidade de material, formando uma camada de policátions. Em seguida, o sistema substrato/policátions é imerso na solução aniônica, ocasionando adsorção de outra camada. A adsorção de duas camadas de cargas opostas (policátion/poliânion) constitui uma bicamada e a deposição do filme fino é obtida por sucessivos ciclos de imersão. Cada bicamada possui uma espessura bastante definida, permitindo o controle da espessura do filme depositado.
Apesar de a energia de ligação entre esses pares ser baixa, proporcional a kT, sendo k a constante de Boltzmann e T a temperatura, a estabilidade das camadas adsorvidas é grande [ 70 , 71 ] devido a diversos fatores como a supercompensação de cargas, caracterizada pela inversão do sinal da carga líquida inicial do substrato [ 72 ] e a interpenetração das cadeias dos polieletrólitos adsorvidos [73].
31
apenas como contra íon para o processo de deposição, é inerte opticamente e não afeta as propriedades ópticas da SCC.
O substrato de vidro, carregado negativamente após o processo de hidrofilização (ver item 2.1.3) foi primeiramente imerso na solução de PAH durante três minutos. Em seguida, o substrato de vidro com o PAH adsorvido foi imerso na solução de SCC durante três minutos, formando assim uma bicamada. Este ciclo foi repetido a fim de conseguir o número de bicamadas desejado e, entre cada uma das imersões, o substrato com as moléculas adsorvidas foi limpo em água Milli-Q e seco com nitrogênio (N2) 99,9 %. A deposição foi realizada à temperatura ambiente e sem controle da umidade na atmosfera local. Os filmes depositados por esta técnica são referenciados como (PAH/SCC)n, sendo n o número de bicamadas.
Figura 12:Ilustração do ciclo de deposição de bicamadas de clorofilina cúprica de sódio pela técnica de automontagem
32
0 100 200 300 400 500
0,00 0,01 0,02 0,03 0,04 0,05 0,06
A
b
s
o
rb
â
n
c
ia
/(
u
.a
.)
Tempo de imersao/s
PAH(pH 3,5)/SCC(pH 3,7) PAH(pH 7,7)/SCC(pH 7,5) PAH(pH 9,5)/SCC(pH10,0) PAH(pH 4,4)/SCC(pH 7,4)
Figura 13: Curva de crescimento dos filmes de (PAH/SCC) obtidos em soluções com diferentes pHs em função do tempo de imersão
De acordo com a Figura 13, verificou-se que após cerca de 180 segundos (3 minutos), a intensidade da absorção óptica não sofreu variação, o que significa que não há mais material sendo adsorvido, sendo este, então, o tempo ideal de imersão do substrato em cada uma das soluções. Além disso, a influência do pH na adsorção foi verificada nestas curvas de crescimento, já que, quanto mais ácido o pH das soluções, menor a intensidade de absorção dos filmes, o que significa menor adsorção de material ao substrato.
33 Figura 14:Filmes de (PAH/SCC)80 fabricados utilizando soluções de PAH com pH
ácido (à esquerda) e pH básico (à direita)
Além disso, observou-se que, durante a automontagem dos filmes (PAH/SCC) em soluções de pH ácido, pode ocorrer precipitação da clorofilina, conforme pode ser observado na Figura 15 [74]. Isso ocorreu pois a solução de PAH tende a ficar mais ácida devido à formação de ácido clorídrico na diluição em água, na qual o íon Cl- interage com o hidrogênio presente no solvente. Da mesma forma, a solução de SCC tende a ter maior basicidade devido à interação do íon Na+ com o grupo OH- presente no solvente. Neste trabalho, os pHs foram medidos pelo pHmetro PHtek PHS-3B utilizando soluções de NH3 e HCl em água, ambas com concentração de 0,1 M para corrigir o pH das soluções.
Figura 15:Solução de SCC (a) a direita, em pH 7,05; (b) a esquerda, em pH 3,48 [74].
2.1.3. Limpeza e preparação do substrato:
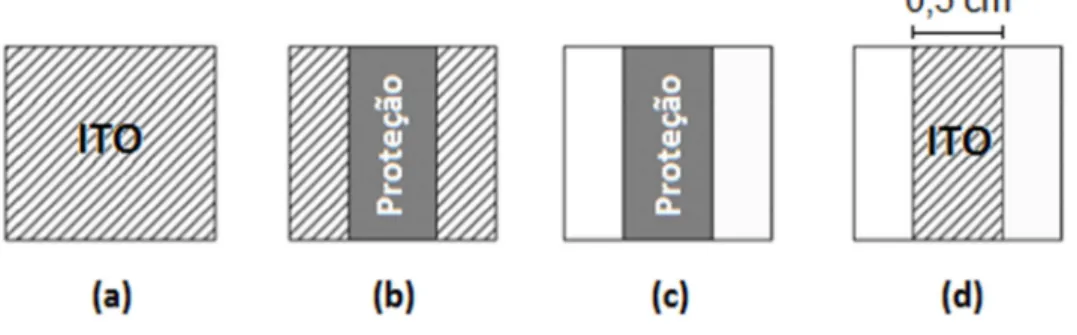
Os substratos utilizados para a fabricação dos dispositivos fotovoltaicos foram lâminas de vidro com uma camada de óxido de estanho índio (ITO) (obtidas comercialmente), cortadas em tamanhos (2,0 x 1,0 x 0,1) cm, de resistividade de 15-22 Ω/□. Em seguida, parte do ITO foi removida através do
34
a geometria do eletrodo ITO e evitar que ocorram curtos circuitos durante o funcionamento do dispositivo fotovoltaico. Neste procedimento, é colocada uma proteção de fita adesiva sobre a parte da lâmina da qual o ITO não deve ser removido (Figura 16-b). Em seguida, a solução aquosa de zinco é espalhada sobre o ITO a ser removido e, em seguida, utilizou-se HCl 6 M para remover completamente a camada de ITO (Figura 16-c). Feito isso, retira-se a proteção ao ataque químico e obtém-se, então, o eletrodo de ITO na geometria desejada (Figura 16-d). Na primeira etapa da limpeza, as lâminas passaram por uma lavagem com sabão e água. Em sequência, as lâminas foram imersas em solução de etanolamina 20%, que foi aquecida até a ebulição. Finalmente, as lâminas foram imersas em acetona a 50°C e secas. Além da limpeza descrita anteriormente, as lâminas passaram por um processo de hidrofilização, etapa necessária para a deposição do filme pela técnica de automontagem, já que o substrato deve conter carga para adsorver o material. Neste processo, as lâminas são imersas em solução de NaOH com concentração de 0,1M em água e levadas ao ultrassom por 15 minutos. Feito isso, as lâminas foram lavadas com água Milli-Q para retirada do excesso de NaOH e estavam prontas para a deposição da camada fotoativa.
Figura 16:Etapas do procedimento adotado para a remoção da camada de ITO da superfície do substrato: (a) lâmina de ITO,(b) proteção (fita adesiva) sobre a região da
lâmina da qual não se deseja remover o ITO, (c) remoção do ITO por meio do ataque químico e (d) obtenção do eletrodo de ITO na configuração desejada.
2.1.4. Metalização dos eletrodos:
35
(Al) e os eletrodos obtidos possuem espessura entre 100 e 110 nm. Para os casos em que o cálcio foi utilizado, metalizou-se uma camada de Al sobre o eletrodo de Ca (Ca_Al) para evitar a rápida oxidação desse, já que o Ca é muito reativo ao oxigênio e à água. O Ca foi utilizado por possuir uma menor função trabalho quando comparado ao Al. A geometria dos eletrodos no dispositivo está mostrada na Figura 18. A etapa de metalização dos eletrodos foi realizada utilizando a evaporadora Edwards, no Instituto de Física de São Carlos, da Universidade de São Paulo, dentro de uma glove box.
Figura 17: Medidas (em mm) da máscara utilizada na metalização dos eletrodos dos dispositivos fotovoltaicos.
Figura 18:Geometria dos eletrodos de ITO sobre substrato de vidro e dos eletrodos metálicos utilizados na confecção do dispositivo.
36
3. Técnicas de caracterização
A seguir, são descritas as técnicas e os instrumentos utilizados na caracterização óptica das soluções e dos filmes e elétrica e dispositivos. Os filmes e as soluções foram caracterizados através da espectroscopia de absorção e espectroscopia de fluorescência. Os dispositivos foram caracterizados por meio de curvas J-V, medidas de condutividade persistente e espectroscopia de impedância,
3.1.Espectroscopia de absorção:
A espectroscopia de absorção no ultravioleta e visível (UV-VIS) envolve a espectroscopia de fótons na faixa de visível e de ultravioleta (UV), em que as moléculas sofrem transições eletrônicas. Neste trabalho, utilizou-se o espectrômetro Hitachi, modelo U-2001 para obter os espectros de absorção dos filmes de PAH/SCC automontados com diferente número de bicamadas e de soluções de SCC em diferentes solventes.
O princípio básico de absorção óptica é bastante simples. Considerando uma molécula absorve luz visível e na região ultravioleta, quando a radiação incide sobre esta molécula, ocorre uma transição eletrônica, na qual um elétron absorve energia do fóton incidente e é promovido do orbital da molécula no seu estado fundamental para um orbital desocupado de maior energia (ver item 1.2).
A luz ao passar através de um material (filme ou solução) sofre uma redução na intensidade, proporcional à intensidade incidente (I0), à espessura (dx)
do material e o coeficiente de absorção (α), podendo ser escrita como:
dx I
dI=−α 0 (Equação 1)
Para obter a intensidade que emerge da amostra de espessura l, soma-se sobre todas as intensidades do lado esquerdo da equação e sobre toda a espessura do lado direito. Integrando a Equação 1, observa-se que a intensidade decai exponencialmente com a espessura.
l
e I
I = 0⋅ −α (Equação 2)
37
l
e I
I = 0⋅10 −ε ou log
( )
I I0 =−ε.l (Equação 3)A constante adimensional T = I / I0 é chamada transmitância e A = ε.l de
absorbância da amostra escrita como:
( )
I I .llog 0 =−ε (Equação 4)
onde ε é chamado coeficiente de absorção molar que depende da molécula e da freqüência da luz em questão e sua unidade é dada pelo inverso da concentração e do comprimento (1/M.m).
No espectro de absorção de uma solução, tem-se que A = ε.l.c, onde c é a concentração da solução, já que o número de partículas presentes no caminho ótico irá influenciar na intensidade da absorção.
3.2.Espectroscopia de fluorescência:
A fluorescência é definida como a relaxação da molécula excitada através da reemissão da energia absorvida. Na espectroscopia de fluorescência (ou luminescência), obtém-se as intensidades de fluorescência em função do comprimento de onda e o espectro é obtido fixando-se o comprimento de onda de excitação. A espectroscopia de fluorescência é uma poderosa técnica de análise química e estrutural, possuindo elevada sensibilidade às vizinhanças da molécula. Sendo assim, efeitos como a polaridade das moléculas e o ordenamento do sistema analisado são possíveis de ser detectados pela espectroscopia de luminescência [29]. A fluorescência, entretanto, pode ser suprimida devido a diversos fatores, como a interação entre o composto fluorescente e outro composto presente na amostra ou mesmo a interação deste composto com impurezas.
38
condições ambientes de pressão e temperatura e foram posicionados de modo que a emissão fosse coletada na mesma face de incidência (front face).
3.3.Condutividade DC
A caracterização elétrica básica dos dispositivos fabricados foi realizada através de medidas de corrente-tensão (J-V) em regime de corrente contínua (DC). Para melhor explicar o comportamento da curva característica tensão-corrente de um dispositivo fotovoltaico sob a ação de diferentes valores de tensão aplicada, considere o esquema dos diagramas de bandas de um dispositivo de monocamada ITO/camada fotoativa/Al sob iluminação, mostrado na Figura 19, sendo que a camada fotoativa é formada por um material orgânico semicondutor.
Figura 19:Diagrama de bandas simplificado para um dispositivo onde os eletrodos são o ITO e o alumínio e a camada fotoativa composta por um material orgânico semicondutor.
(a) materiais antes do contato; (b) materiais após o contato; (c) em tensão reversa aplicada, diodo retificador; (d) tensão direta aplicada igual ao potencial de built-in; (e)
com o aumento da polarização, surge a corrente elétrica em tensão direta. ΦITO / ΦAl:
função trabalho dos eletrodos, Ip: potencial de ionização eχ: afinidade eletrônica da
39
A Figura 19-a mostra a configuração energética de um material semicondutor e dos eletrodos, separadamente, antes de haver um contato. Ao estabelecer o contato entre os materiais (material orgânico e eletrodos), a tendência é haver um balanceamento de cargas entre o material e os eletrodos até que se atinja o equilíbrio. Isso gera uma deflexão das bandas, como se observa na Figura 19-b. Quanto tal equilíbrio é atingido, os níveis de Fermi dos eletrodos se equiparam com o nível de Fermi do material orgânico nas interfaces, formando o contato Schottky [76]. O surgimento de um potencial de contato (VC) ocorre na interface entre o
material orgânico e o eletrodo e a diferença entre esses potenciais de contato é denominada “potencial de built-in” VB, que é a diferença entre as funções trabalho
dos eletrodos em dispositivos de monocamada:
(
)
qV
VB =∆ C = ΦCÁTODO −ΦÂNODO (Equação 5)
onde Φ representa a função trabalho e q é a carga elementar.
O potencial de built-in gera um campo elétrico intrínseco ( ErINT )
perpendicular às superfícies dos eletrodos e é esse campo elétrico que conduz as cargas fotogeradas em um dispositivo fotovoltaico, sendo responsável pelo efeito fotovoltaico. Ao aplicar-se uma tensão externa, o dispositivo pode se polarizar no modo direto ou reverso. No modo reverso, o ITO, polarizado negativamente, será o injetor de elétrons e o Al, polarizado positivamente, será o injetor de buracos (Figura 19-c). Entretanto, a energia necessária para os elétrons e buracos serem injetados através das barreiras dadas pela diferença entre as funções-trabalho dos eletrodos e das energias do HOMO/LUMO do material que constitui a camada fotoativa, nesse caso, são muito altas, resultando em uma densidade de corrente total reduzida devido à baixa densidade de portadores de carga disponíveis. A densidade de corrente total é basicamente constituída pela corrente gerada pelas cargas fotogeradas no interior do material orgânico, que foram conduzidas pelo
campo elétrico resultante (ER
r
), neste caso, devido ao campo aplicado (EAPL
r
)
somado ao campo elétrico intrínseco (ErINT). Na curva J-V mostrada na Figura 20,
40
denominada corrente de curto circuito ou ISC. Ao aplicar uma tensão positiva, o
comportamento do dispositivo depende do valor do potencial aplicado. Para o caso em que a tensão aplicada é menor que o potencial de built-in (V<VB), o
comportamento ainda é o mesmo do dispositivo polarizado no modo reverso. Quando o potencial aplicado equivale ao potencial de built-in (V=VB),ocorrerá a
situação na qual as bandas ficam planas, como representado na Figura 19-d. Neste momento (ponto C da curva da Figura 20), o campo resultante é nulo (
0
=
+ INT
APL E
Er r ), a corrente se torna nula, sendo então a tensão aplicada chamada de
tensão de circuito aberto (VOC). A tensão de circuito aberto em um dispositivo de
monocamada fotoativa é geralmente determinada pela diferença entre os valores das funções trabalho dos eletrodos: VOC =
(
ΦCÁTODO −ΦÂNODO)
q=−VB [66].Entretanto, em dispositivos fotovoltaicos de heterojunção esta relação nem sempre é verificada [77,78]
Para valores de tensão aplicada maiores que o VOC, o dispositivo se polariza
no modo direto, no qual o ITO, agora polarizado positivamente, é o injetor de buracos e o Al, polarizado negativamente, é o injetor de elétrons (Figura 19-e.). Neste caso, a barreira energética necessária para injetar elétrons e buracos é bem menor quando comparada às energias no modo reverso, e as cargas injetadas pelos eletrodos e fotogeradas pelo material orgânico se somam durante a condução pelo campo elétrico aplicado, resultando em correntes consideravelmente maiores. Esta etapa equivale ao ponto D da curva na Figura 20.
Figura 20:Curva característica de um dispositivo fotovoltaico, tanto no escuro quanto iluminado. A Figura mostra a tensão de circuito aberto (VOC) e a corrente de curto circuito
para o dispositivo iluminado. O ponto A representa a corrente do dispositivo durante a tensão reversa (negativa), o ponto B é conhecido como corrente de curto-circuito, o ponto
41
Um outro fator a ser analisado é o FF (fator de preenchimento), que dá a potência máxima na qual o produto J.V atinge seu maior valor e representa a razão entre a potência de entrada e a potência de saída. Graficamente, o FF é a razão entre as áreas do retângulo verde e o retângulo cinza (de lados JSC e VOC), mostrados na Figura 20. Na curva J-V ilustrada na Figura 20, pode-se observar dois retângulos; no menor delimitado pela curva do dispositivo sob iluminação, a área representa o máximo de energia por unidade de tempo (potência) fornecida pelo dispositivo; e no maior retângulo, a área representa a potência nominal. O FF também é um parâmetro de grande importância para análise do rendimento do dispositivo.
O rendimento (η) do dispositivo é definido pela razão da potência de saída pela incidente [8]:
0 ´
I V J FF P
P SC OC
incidente
saída = ⋅ ⋅ =
η
(Equação 6)onde FF é o fator de preenchimento, JSC é a corrente de curto circuito, VOC é a
tensão de circuito aberto e I0 é a irradiância da lâmpada utilizada na caracterização.
42 Figura 21:Representação de um dispositivo fotovoltaico de monocamada com
estrutura tipo sanduíche durante a caracterização de condutividade DC, com incidência de luz através do eletrodo de ITO
3.4.Condutividade persistente
As medidas de condutividade persistente (ou curvas densidade de corrente-tempo J-t) são obtidas alternando entre a incidência de luz branca (100 mW/cm²) proveniente da lâmpada de Xe e o escuro, verificando o comportamento da fotocorrente em função do tempo de iluminação e após a lâmpada ser apagada. Esta medida permite observar o comportamento e o tempo de vida dos portadores de carga fotogerados.
A mesma instrumentação utilizada na caracterização de condutividade DC foi utilizada para verificar a condutividade persistente nos dispositivos. Durante a medida J-t, a tensão aplicada no dispositivo foi nula e o dispositivo estava em curto-circuito.
3.5.Espectroscopia de impedância:
A espectroscopia de impedância permite analisar os processos de condução que ocorrem dentro de um material sólido ou líquido que apresentam certa resistividade elétrica. Ao aplicar uma diferença de potencial V(t) na amostra a ser analisada, sendo que V(t) varia no tempo com frequência ω e amplitude V0:
(Equação 7)
43
dificuldade que os portadores de carga encontram de se deslocarem dentro do material. A corrente será, então, da seguinte forma:
I (Equação 8)
Dessa forma, tem-se a impedância complexa Z*:
∗ (Equação 9)
onde Z* = Z'(ω) - iZ"(ω), sendo que Z'(ω) representa a componente real da
impedância e Z"(ω) representa a componente imaginária.
Na espectroscopia de impedância, ao variar a frequência de oscilação do potencial aplicado, o material também varia sua resposta, ou seja, a cada valor de frequência de oscilação corresponde a um valor da impedância complexa na amostra. O resultado é um espectro que fornece informações sobre os principais processos envolvidos na relaxação dielétrica e sobre os tipos de portadores de cargas no material.
Os resultados obtidos na espectroscopia de impedância também podem ser expressos em termos da admitância complexa:
∗
!∗ (Equação 10) onde Y'(ω) e Y''(ω) são:
!"
!" #$ !"" # (Equação 11)
% !" !#""$ !"" # (Equação 12)
A condutividade complexa difere da admitância complexa apenas por fatores geométricos, sendo L a distância percorrida pelos portadores de carga de um eletrodo a outro (espessura da amostra) e A a área dos eletrodos. Desta forma, tem-se que:
&∗ & & ′ ∗ (
) (Equação 13)
onde &′ )( e &′′ ().
44
*∗ * * +∗ (Equação 14)
sendo que * +" e * +"" .
Substituindo Y*(ω) na Equação 14:
*∗ -% ′′
. ′2 ′′2 01%
-2
. ′2 ′′2 01 (Equação 15)
Numa amostra que se comporta como um dielétrico ideal, pode-se considerar que C'(ω) é constante em todo o intervalo de frequência utilizadas na
medida da espectroscopia de impedância. Portanto, extrapolando-se a curva de C'(ω) obtida para o regime de altas frequências (ω→∞), é possível determinar a
constante dielétrica k do material pela seguinte relação:
* → ∞ 45 )( (Equação 16)
na qual ε0 é a permissividade elétrica no vácuo, A é a área dos eletrodos da amostra e L é a espessura da amostra.
Circuito equivalente
Para um sólido desordenado, a densidade de corrente possui a contribuição da corrente de condução devida ao deslocamento das cargas livres e da corrente de deslocamento, relacionada ao movimento de dipolos e a outros efeitos capacitivos. A corrente total, pelas equações de Maxwell, é dada por:
67
8889 &:;89 <=>89= (Equação 17)
onde ;89 ;89 , σ0 está relacionado à condutividade do material e ϵ é a permissividade do meio. Então:
67
8889 &: < ;89 (Equação 18)
Chamando de σT = σ0 + iωϵ a condutividade total , tem-se que
67
8889 &7;89 (Equação 19)
45
Considerando um material desordenado de comprimento l e área longitudinal A, tem-se para este material que &: ? @A⁄ e < *? A⁄ , sendo R a resistência do material e C sua capacitância. A impedância complexa ∗ ? &⁄ 7A é, então:
∗ C
$ CD (Equação 20)
A Equação 20 é exatamente a que descreve a impedância de um circuito RC em paralelo. A grandeza τ = RC é chamada de tempo de relaxação e é bastante
importante na análise do material, já que para materiais condutores τ→0 e para
isolantes τ→∞. Materiais com alto tempo de relaxação são chamados dielétricos. O
tempo de relaxação descreve o quão rápido as cargas espaciais se deslocam para uma posição de equilíbrio, com menor energia potencial possível. O movimento de dipolos gerados por moléculas polarizadas também contribuem ao tempo de relaxação do material.
Seja ∗ | ∗| , onde ∗ $ CDC # F #⁄ e G tan KC M!LM!∗∗NNO. Re[Z*] e
Im[Z*] são as partes real e imaginária de Z*, respectivamente, e suas expressões são da seguinte forma:
@ M ∗N C
$ CD# (Equação 21)
PM ∗N C#D
$ CD# (Equação 22)
onde Z* = Z' + Z".
De maneira geral, a componente real da impedância complexa está associada a resistência ao movimento das cargas que estão em fase com o campo elétrico oscilante e a componente imaginária está relacionada a resistência à corrente que está fora de fase. A corrente fora de fase com o campo elétrico aplicado é devida a portadores de carga que não acompanham o campo devido a dificuldades encontradas na estrutura do material e a moléculas polarizadas cujos dipolos estejam sob influência do campo elétrico.
Ao analisar as equações 21 e 22 pode-se verificar que no limite em que
ω→0, Z'→R, já que o sistema aproxima-se do regime DC, sendo que R é
denominada resistência DC do material. No mesmo limite, tem-se que Z"→0, pois
46
limite em que ω→∞, Z'→0 e Z"→0, pois neste caso o campo oscila tão rápido que
os portadores de carga se movem muito pouco em relação à sua posição original, sendo desprezível a resistência do meio. Nesta mesma situação, os elementos responsáveis pelos efeitos capacitivos entram em curto-circuito, sendo então a impedância nula.
Desta forma, o comportamento universal dos sólidos desordenados é verificado no espectro da Figura 22. Este comportamento é denominado comportamento Debye e descreve o tempo de relaxação do material, que pode ser de difícil descrição devido a heterogeneidade dos portadores de carga que participam dos processos de condução elétrica. A frequência crítica, representada por ω0, é um importante parâmetro para avaliar a condutividade do material, ou seja, quanto maior a frequência crítica, maior a condutividade.
Figura 22:Espectro de impedância de um RC paralelo [79]
Na Figura 23, é representado o diagrama de Argand, que é útil na identificação e comparação de processos de condução com diferentes tempos de relaxação. Por meio das expressões de Re[Z'] e Im[Z"], tem-se que:
(Equação 23)
que corresponde à equação de um círculo de raio e centrado em e .
48
4. Resultados e Discussões
Neste capítulo são apresentados os resultados experimentais obtidos a partir das caracterizações óticas e elétricas dos filmes e dos dispositivos preparados neste trabalho.
4.1.Medidas Ópticas.
A seguir, são mostrados os resultados obtidos da caracterização das propriedades ópticas dos filmes de (PAH/SCC)n, onde n é o número de bicamadas, e de soluções de SCC em diferentes solventes e concentrações, através da espectroscopia de absorção e de fluorescência. Os resultados da espectroscopia de absorção e fluorescência para soluções de SCC para as concentrações de 0,01 mg/mL, 0,05 mg/mL e 0,1 mg/mL foram bastante similares. Optou-se por apresentar os resultados da caracterização óptica apenas na concentração de 0,05 mg/mL.
4.1.1. Espectroscopia de Absorção:
Na Figura 24, é apresentado o espectro de absorção dos filmes de PAH/SCC com diferentes números de bicamadas e da solução aquosa de SCC. Para os filmes, pode-se verificar a presença das duas principais bandas de absorção da SCC a banda Soret em torno de 408 nm e a banda Q, com máximos próximos de 638 nm. Para a solução aquosa de SCC na concentração de 0,05 mg/mL também são observados os dois máximos de absorção característicos (bandas Q e Soret), entretanto é observado um pequeno deslocamento hipsocrômico (para a região do azul) do máximo das bandas Soret (∆λ = 6 nm) e
Q (∆λ = 12 nm) em relação à bandas Soret e Q do espectro de absorção do filme.
Tal deslocamento da banda Q também foi observado para filmes automontados e solução aquosa de ftalocianina tetrassulfonada de ferro (FeTsPc) e duas hipóteses foram consideradas por Zucolotto et al.: a primeira delas é que o empilhamento colunar das moléculas de ftalocianina quando na forma de filme aumenta a interseção entre os orbitais π das moléculas (π-stacking), diminuindo
49
há a possibilidade do deslocamento hipsocrômico do máximo da banda Q de absorção da solução ser um deslocamento solvatocrômico, em virtude da interação solvente-soluto. O solvatocromismo é um termo utilizado para descrever a mudança na posição da banda de absorção (às vezes na intensidade de absorção) em função de mudanças na polaridade do meio e pode fornecer informações sobre o comportamento do soluto em relação ao meio. Por exemplo, um deslocamento batocrômico (para a região do vermelho) com o aumento da polaridade do solvente indicaria que o estado excitado da molécula é mais polar que o estado fundamental, enquanto um deslocamento hipsocrômico indicaria que o estado fundamental da molécula é mais polar que seu estado excitado [81].
400 500 600 700
0,0 0,2 0,4 0,6 0,8 1,0
A
b
s
o
rb
â
n
c
ia
/(
u
.a
.)
Comprimento de onda/nm
(PAH/SCC)40 (PAH/SCC)36 (PAH/SCC)28 (PAH/SCC)24 (PAH/SCC)20 (PAH/SCC)12
SCC 0,05 mg/mL em agua
∆λ = 6 nm
∆λ = 12 nm
Figura 24: Espectro de absorção da solução de SCC 0,05 mg/mL em água e de filmes de PAH/SCC com diferentes números de bicamadas
50
10 20 30 40
0,3 0,6 0,9 A b s o rb â n c ia /( u .a .)
Numero de bicamadas Banda Soret
10 20 30 40
0,1 0,2 0,3 A b s o rb â n c ia /( u .a .)
Numero de bicamadas
Banda Q
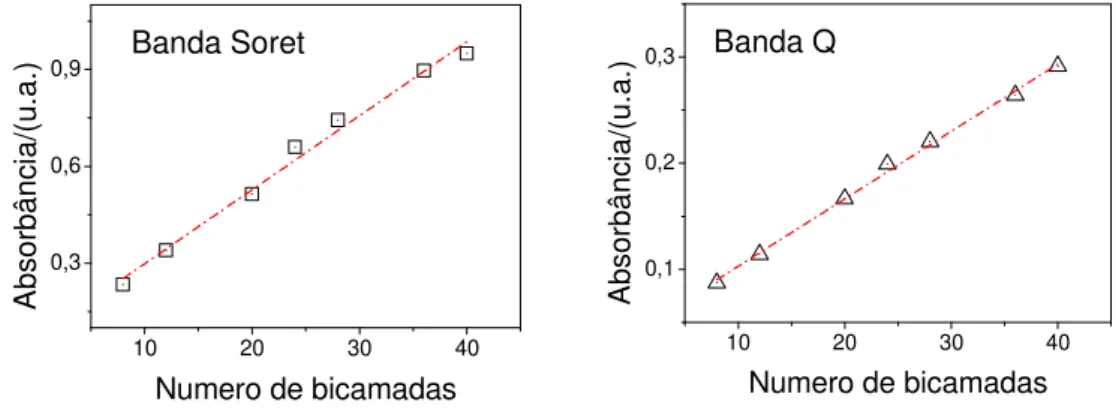
Figura 25: Curvas de crescimento baseada nos máximos de absorção da banda Soret (406 nm) e da banda Q (638 nm) dos filmes de (PAH/SCC)n automontados em função
do número de bicamadas. A linha tracejada é guia para os olhos.
A relação entre o número de bicamadas n dos filmes (PAH/SCC)n e a espessura dos filmes medidas pelo perfilômetro Veeco Dektak 150 está mostrada na Tabela 1. Apesar de os filmes apresentarem um crescimento linear da intensidade de absorção com o número de bicamadas, observou-se que as razões entre as espessuras dos filmes e o número de bicamadas não permaneceram constantes, embora não tenham se desviado de forma significativa. A causa disto podem ser erros nas medidas de espessura devido à baixa precisão do equipamentos para medidas de menores espessura.
Tabela 1:Relação entre o número de bicamadas e a espessura do filme de (PAH/SCC)n medida por perfilometria
Número de bicamadas Espessura (nm) Espessura por bicamada (nm)
8 10,0 1,25
12 17,0 1,42
16 20,0 1,25
20 23,0 1,15
24 40,0 1,67
28 45,0 1,61
36 54,0 1,50
40 62,0 1,55
51
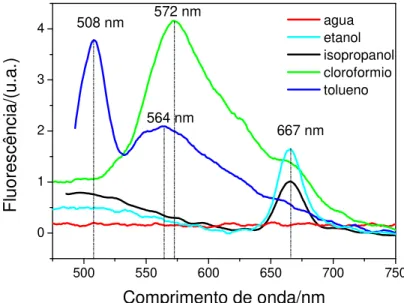
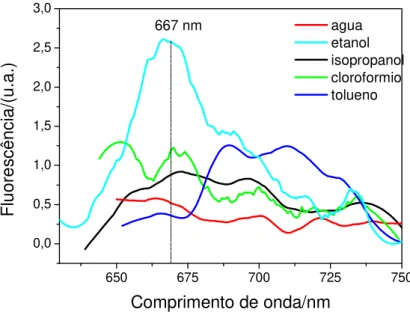
concentração de 0,05 mg/mL. No preparo das soluções, observou-se que os solventes capazes de diluir efetivamente a SCC foram a água e o etanol. No caso do isopropanol, foi formada uma espécie de solução coloidal e para o tolueno e clorofórmio não foi verificada solubilidade ou solubilidade muito baixa. Não houve controle no pH das soluções de SCC nos diferentes solventes.
400 500 600 700
0,0 0,5 1,0 1,5 2,0 2,5
0,0 0,3 0,6 0,9 1,2 1,5 1,8 2,1
0 5 10 15 20 25 30 35 40 45 50 C o e f. A b s . M o la r (L /g .c m )
Momento Dipolar (D) Banda Soret Banda Q
Comprimento de onda/nm
A b s o rb â n c ia /( u .a .) Agua Etanol Isopropanol Tolueno Cloroformio
Figura 26:Espectros de absorção das soluções de SCC em diferentes solventes com concentração de 0,05 mg/mL (em detalhe o gráfico do coeficiente de absorção molar
em função do momento dipolar do solvente)
52 Tabela 2: Momento dipolar dos solventes utilizados nas soluções de SCC [4].
Solvente Fórmula química Momento dipolar (D)
Tolueno C6H5-CH3 0,36
Clorofórmio CHCl3 1,04
Isopropanol CH3-CH(-OH)-CH3 1,66
Etanol CH3-CH2-OH 1,69
Água H2O 1,85
Inserido na Figura 26 está o gráfico dos coeficientes de absorção molar das bandas Q e Soret em função do momento dipolar dos solventes (ver Tabela 2). De acordo com o gráfico, as bandas de absorção Q e Soret tem intensidades similares e baixos valores de coeficiente de absorção molar ε (ver Tabela 3) para
solventes com baixa polaridade (0,36 ≤ D ≤ 1,66), enquanto para os solventes
mais polares (D ≥ 1,69), o coeficiente de absorção molar aumenta (ver Tabela 3)
e a intensidade da banda Soret é superior a banda Q, ou seja, a banda Soret (transição S0-S2) é mais afetada pela polaridade do solvente. Entretanto, verifica-se uma relação entre ε e a solubilidade da SCC nos solventes e visto que nenhum
53 Tabela 3: Máximos de absorção da banda Soret dos espectros de absorção da SCC em
diferentes solventes e seus respectivos coeficientes de absorção molar obtidos através daEquação 4, sendo L = 1 cm o caminho óptico
Água Etanol Isopropanol Clorofórmio Tolueno
B an da So re t Absorbância
(u.a) 2,57 1,22 0,26 0,15 0,11
ε (L/g.cm) 51,13 24,31 5,24 3,01 2,13
B
an
da
Q Absorbância
(u.a) 0,70 0,40 0,12 0,10 0,08
ε (L/g.cm) 14,08 8,08 2,48 1,94 1,67
Os espectros de absorção das soluções em diferentes solventes foram normalizados em relação à banda Soret (Figura 27-a) e à banda Q (Figura 27-b), a fim de se verificar eventuais deslocamentos na posição das bandas de absorção com a mudança dos solventes.
350 400 450 500
0,0 0,2 0,4 0,6 0,8 1,0
1,2 Agua
Etanol Isopropanol Cloroformio Tolueno A b s o rb â n c ia n o rm a liz a d a B a n d a S o re t /( u .a .)
Comprimento de onda/nm
∆λ = 6 nm
(a)
550 600 650 700 750 0,0 0,5 1,0 Agua Etanol Isopropanol Cloroformio Tolueno A b s o rb â n c ia n o rm a liz a d a B a n d a Q / (u .a .)
Comprimento de onda/nm ∆λ = 14 nm
(b)
Figura 27: Espectros de absorção das soluções de SCC em diferentes solventes a 0,05 mg/mL, normalizados em relação às principais bandas (a) Soret e (b) Q.