UNIVERSIDADE DA BEIRA INTERIOR
Ciências
Efeito do Estradiol e do Desregulador Endócrino
Bisfenol-A na Via do Paladar do Plexo Coroide
Maria Duarte Maltez
Dissertação para obtenção do Grau de Mestre em
Bioquímica
(2º ciclo de estudos)
Orientadora: Prof. Doutora Isabel Gonçalves
Coorientadora: Mestre Joana Tomás
ii
O conteúdo desta Dissertação é da exclusiva responsabilidade do autor.
iii
Agradecimentos
Não posso deixar de agradecer a todos os que, direta ou indiretamente, contribuíram para me ajudar na realização deste trabalho, em especial:
À minha orientadora, a Professora Doutora Isabel Gonçalves, pela oportunidade de trabalhar com ela, pelo apoio, disponibilidade, orientação e conhecimentos transmitidos.
À Professora Doutora Cecília Santos, pela disponibilidade e partilha de conhecimentos.
À minha co-orientadora Mestre Joana Tomás por todos os conhecimentos teóricos e práticos transmitidos, pela inteira disponibilidade para me ensinar a trabalhar no laboratório e esclarecer todas as dúvidas, pela confiança que depositou em mim e pela amizade.
Às minhas colegas de laboratório, especialmente à Ana Raquel, Ana Catarina e Marya pelo apoio, ajuda e amizade. Obrigada por vos ter passado a ter como amigas e por terem tornado os dias de trabalho mais alegres.
À Margarida, Patrícia, Helena, Susana e Ângela com quem partilhei algumas dúvidas e se mostraram sempre disponíveis para me ajudar.
Às minhas amigas Su e Fabi, que estiveram sempre a meu lado e com quem partilhei todos os bons e maus momentos ao longo destes cinco anos académicos.
Aos meus amigos, que sempre me apoiaram e se preocuparam comigo. Obrigada Cláudia, Calisto, Paulo, Casaca, Gil, Falagueira, Diogo e Ricardo pela verdadeira amizade.
À Nina, a minha companheira de sempre, por me acalmar nos momentos de maior ansiedade e me dar muitos miminhos.
Ao Bruno, por todo a amizade, apoio, carinho, mimos e paciência para me aturar nos momentos mais difíceis. Obrigada por me deixares partilhar tudo contigo e seres o meu aconchego.
À minha família por todo o apoio e motivação que me deu, especialmente ao meu irmão, às titias Madalena, Monique e Joaninha, à avó Beu e à Edite.
Aos meus pais, os mais importantes, por estarem sempre a meu lado, pela compreensão, conselhos, encorajamento que sempre me deram para nunca desistir e chegar até aqui e por todo o amor. Obrigada por serem meus amigos, o meu porto de abrigo, os melhores pais do Mundo.
iv
Resumo
O plexo coroide (CP) é uma estrutura altamente vascularizada localizada nos ventrículos do cérebro, envolvida numa grande variedade de funções cruciais no sistema nervoso central (SNC), não sendo só responsável pela produção do líquido cefalorraquidiano (CSF) mas também pela vigilância da sua composição química. A via de transdução do paladar deteta alguns tipos de moléculas, avaliando deste modo a composição química de fluidos, não apenas na cavidade oral, mas também em tecidos extra-orais, tais como: trato respiratório, trato gastrointestinal, testículos, queratinócitos, rins, tiroide e cérebro. Numa análise de microarrays de cDNA, o nosso grupo de investigação descreveu recentemente o envolvimento das hormonas sexuais na regulação de diversas vias de sinalização no CP, nomeadamente na via de transdução de sinal do paladar. Os desreguladores endócrinos (DE) são compostos exógenos que estão disseminados no ambiente e influenciam a homeostasia, o desenvolvimento e a proliferação celular, mimetizando ou inibindo a ação das hormonas endógenas ou alterando a regulação do sistema endócrino, causando efeitos adversos para a saúde. No grupo dos DEs que são químicos sintéticos, o composto estrogénico bisfenol A (BPA) é um dos mais abundantes no meio ambiente. O objetivo do presente estudo é analisar o efeito do 17-β-estradiol (E2) na expressão dos genes envolvidos na via de transdução do paladar ex vivo e in vivo, bem como o efeito do BPA nesta via de sinalização. Nos estudos ex vivo utilizaram-se CPs de ratos Wistar Han recém-nascidos e foram aplicados estímulos de: i) E2 (0.1, 1, 10 e 100 nM) durante 6 horas, com e sem um pré-tratamento de 90 minutos com fulvestrant (ICI; 100 nM), um antagonista dos recetores de estrogénio (ERs); ii) BPA (10, 25, 50, 75 e 100 nM) durante 6 horas. O estudo in vivo foi efetuado em ratos Wistar Han fêmeas ovariectomizadas (OVX) com dois meses de idade. O efeito do E2 e do BPA nos níveis de mRNA foi analisado por PCR em tempo real do produto da transcrição reversa (RT-qPCR). Os ensaios ex vivo revelaram que o E2 regula negativamente a expressão de todos os genes analisados e, corroborando estes resultados, os testes in vivo mostraram que existe um aumento da expressão de todos os genes em ratos OVX em comparação com o controlo. No seu conjunto, os nossos resultados comprovam o estudo prévio de microarrays transcritómicos, de que a via do paladar é regulada por hormonas sexuais, e esclarecem o mecanismo molecular envolvido, onde, o pré-tratamento com ICI bloqueia o efeito do E2, indicando o envolvimento dos ERs. Por outro lado, os resultados do efeito do BPA mostram que este DE afeta a expressão dos genes da via de sinalização do paladar, revelando uma curva de expressão génica dose-resposta não monotónica. Os resultados deste estudo sugerem que a via de transdução do paladar no CP é regulada não só por hormonas endógenas mas também por compostos exógenos, tais como o BPA. Assim, podemos afirmar que o
background hormonal e a exposição ambiental ao BPA parecem interferir na expressão dos
componentes da via do paladar no CP, podendo afetar a vigilância química do CSF pelo CP, com possíveis consequências na homeostasia do SNC.
v
Palavras-Chave
vi
Abstract
The choroid plexus (CP) is a highly vascularized structure located in the brain ventricles, involved in a wide variety of crucial functions in the central nervous system (SNC), being not only responsible for cerebrospinal fluid (CSF) production but also for the surveillance of its chemical composition. The taste transduction pathway detects some types of molecules, thereby evaluating the chemical content of fluids, not only in the oral cavity but also in extra-oral tissues, such as: respiratory tract, gastrointestinal tract, testis, keratinocytes, kidneys, thyroid and brain. In a cDNA microarray analysis, our research group recently described the involvement of sex hormones in the regulation of several signaling pathways in CP, namely the taste signal transduction pathway. Endocrine disrupters (DE) are exogenous compounds that are disseminated in the environment and influence homeostasis, development and cell proliferation, mimicking or inhibiting the action of endogenous hormones or altering the regulation of the endocrine system, causing adverse health effects. In the group of DEs that are synthetic chemicals, the estrogenic compound bisphenol A (BPA) is the most abundant in the environment. The aim of the present study is to analyze the effect of 17-β-estradiol (E2) on the expression of genes involved in the taste transduction pathway ex vivo and in vivo, as well as the effect of BPA in this signaling pathway. In ex vivo studies CPs of newborns Wistar Han rats were used and were applied stimuli of: i) E2 (0.1, 1, 10 and 100 nM) for 6 hours, with and without a pre-treatment of 90 minutes with fulvestrant (ICI; 100 nM), an antagonist of estrogen receptors (ERs); ii) BPA (10, 25, 50, 75 and 100 nM) for 6 hours. The in vivo study was carried out in ovariectomized (OVX) female Wistar Han rats with two months of age. The effect of E2 and BPA in mRNA levels was analyzed by real time PCR of the reverse transcription product (RT-qPCR). The ex vivo assays revealed that E2negatively regulates the expression of all genes analyzed and, corroborating these results, the in vivo tests showed that there is an increase of the expression of all genes in OVX rats compared to controls. Taken together, our results prove the previous study of transcriptomic microarrays, that the taste pathway is regulated by sex hormones, and clarify the molecular mechanism involved, where the pre-treatment with ICI blocks the E2 effect, indicating the involvement of the ERs. On the other hand, the results of BPA effect show that this DE affects the expression of taste signaling pathway genes, revealing a non-monotonic dose response curve of gene expression. The results of this study suggest that the taste transduction pathway in CP is regulated not only by endogenous hormones but also by exogenous compounds, such as BPA. Thus, we can affirm that the hormonal background and the environmental exposure to BPA seem to interfere with the expression of the taste pathway components in CP, which may affect the chemical surveillance of the CSF by CP, with possible consequences on SNC homeostasis.
Keywords
vii
Índice
Agradecimentos ... iii Resumo ... iv Abstract ... vi Índice ... vii Lista de Figuras... ix Lista de Tabelas ... xLista de Abreviaturas e Acrónimos ... xi
I. Introdução ... 1
1. Plexo Coroide ... 2
1.1. Estrutura e Morfologia do Plexo Coroide ... 2
1.2. Funções Biológicas ... 3
1.2.1. Produção e Secreção do Líquido Cefalorraquidiano
... 3
1.2.2. Síntese e Secreção de Outras Substâncias
... 5
1.2.3. Proteção
... 5
2. O Paladar ... 6
2.1. A via de sinalização do paladar ... 6
2.1.1. Os estímulos Doce, Amargo e Umami
... 6
2.1.2. Os estímulos Ácido e Salgado
... 8
2.2. A via de sinalização do paladar noutros tecidos ... 9
3. Hormonas Esteroides ... 12
3.1. Síntese de estrogénios ... 12
3.2. Mecanismo de ação dos estrogénios ... 13
3.3. As hormonas esteroides e o plexo coroide ... 15
4. Desreguladores Endócrinos ... 15
4.1. Bisfenol A ... 16
4.1.1. Mecanismo Molecular de Ação do BPA
... 16
4.1.2. Exposição ao BPA
... 17
viii
III. Material e Métodos ... 21
1. Experimentação animal ... 22 1.1. Animais ... 22 1.1.1. Estudos ex vivo
... 22
1.1.1.1. Estímulos... 22
1.1.2. Estudos in vivo... 23
2. RNA total ... 242.1. Extração de RNA total ... 24
2.2. Determinação da integridade do RNA total ... 24
2.3. Quantificação do RNA total ... 25
3. Síntese de DNA complementar ... 25
4. Amplificação enzimática de DNA ... 26
5. PCR em Tempo Real da transcrição reversa ... 27
6. Análise Estatística ... 27
IV. Resultados ... 28
1. Expressão dos genes da via de sinalização do paladar no plexo coroide de rato ... 29
1.1. Amplificação enzimática da transcrição reversa (RT-PCR) ... 29
2. Efeito do E2 e do BPA na expressão dos genes da via de transdução do paladar ... 31
2.1. Otimização das condições de PCR em tempo real do produto da transcrição reversa (RT-qPCR) ... 31
2.2. Efeito do E2 na via de transdução do paladar ... 32
2.3. Efeito do BPA na via de transdução do paladar ... 36
V. Discussão ... 37
VI. Conclusão e Perspetivas Futuras ... 41
ix
Lista de Figuras
Figura 1 - Representação morfológica do plexo coroide ... 2
Figura 2 - Secreção do CSF. ... 4
Figura 3 - Transdução de sinal dos sabores doce, amargo e umami ... 7
Figura 4 - Transdução de sinal dos sabores salgado e ácido ... 9
Figura 5 - Mecanismos de ação dos estrogénios ... 14
Figura 6 – Esquema dos ensaios experimentais realizados ... 23
Figura 7 - Eletroforese em gel de agarose a 2% corada com GreenSafe de 10 µL de cada um dos produtos de PCR, realizado com cDNA de CP, e primers específicos dos genes da via de sinalização do paladar ... 30
Figura 8 - Retas log [cDNA] vs. Ct para o cálculo de eficiência de reação de RT-qPCR(método série de diluição) dos genes em estudo ... 32
Figura 9 – Efeito dos veículos (0.002% DMSO e 0.002% EtOH) na expressão dos genes da via de transdução do paladar, em CP de ratos Wistar Han recém-nascidos ... 32
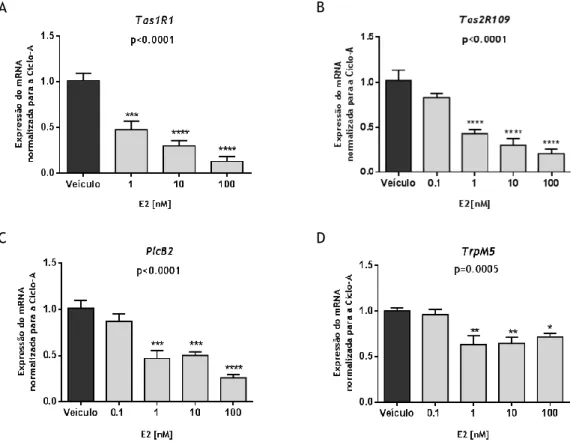
Figura 10 - Efeitos do E2 sobre os níveis de expressão dos genes da via de sinalização do paladar ... 33
Figura 11 – Ensaios com ICI para esclarecimento do mecanismo molecular de atuação do E2 sobre os níveis de expressão dos genes da via de sinalização do paladar ... 34
Figura 12 - Análise dos níveis de expressão do mRNA, por RT-qPCR, dos genes da via de sinalização do paladar, no CP de ratos fêmea Wistar Han com 2 meses de idade Sham (controlo) e OVX ... 35
Figura 13 – Efeito do veículo (1% DMSO), nos níveis de expressão do Tas1R1 e TrpM5, em CP de ratos Wistar Han recém-nascidos ... 36
Figura 14 - Efeitos do BPA sobre os níveis de expressão dos genes da via de sinalização do paladar... 36
x
Lista de Tabelas
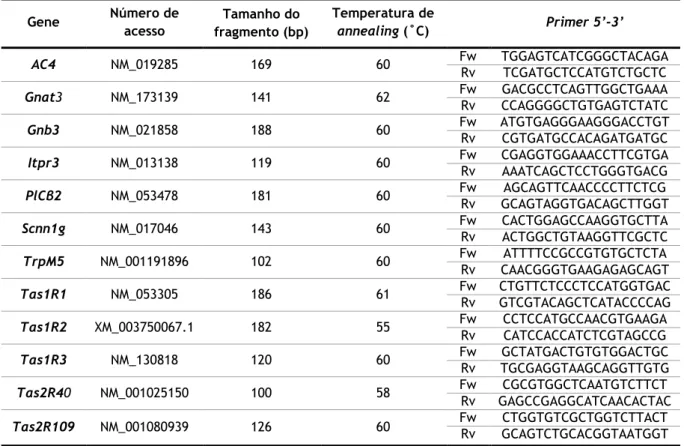
Tabela 1 - Sequências dos primers e condições de amplificação dos genes utilizados neste
estudo ... 26
Tabela 2 – Comparação dos resultados da expressão relativa dos estudos de microarrays
transcritómicos e do RT-qPCR para os genes da via de sinalização do paladar no CP de ratos OVX, quando comparados com os de ratos Sham . ... 35
xi
Lista de Abreviaturas e Acrónimos
AC Adenilato-ciclase
cAMP Cyclic adenosine monophosphate(Monofosfato de adenosina cíclico) AP-1 Proteína ativadora 1
ASICs Canais iónicos de deteção de ácido ATP Adenosina trifosfato
ATPases Proteínas integrais da membrana BPA Bisfenol A
Ca2+ Ião Cálcio
[Ca2+]
i Concentração de cálcio intracelular
cDNA Complementary DNA (DNA complementar)
CIC-4a Canal de Cl
-Cl- Ião Cloro
CP Choroid Plexus (Plexo coroide)
CPEC Choroid Plexus Epithelial Cells (Células epiteliais do plexo coroide)
CSF Cerebrospinal Fluid (Líquido cefalorraquidiano)
CYPs Enzimas do citocromo P450 DAG Diacilglicerol
DE Desreguladores endócrinos DEPC Dietilpirocarbonato
DHEA Desidroepiandrosterona
DMEM Dulbecco’s Modified Eagle Medium – high glucose
DMSO Dimetilsulfóxido
DNA Desoxirribonucleic Acid (Ácido desoxirribonucleico)
dNTP’s Desoxinucleotídeos trifosfato E1 Estrona
E2 17-β-estradiol E3 Estriol
ENaC Canais de Na+ sensíveis à amilorida
ERE Elementos responsivos ao estrogénio ERs Estrogen Receptors (Recetores de estrogénio)
ERα Isoforma α do recetor de estrogénio ERβ Isoforma β do recetor de estrogénio EtOH Etanol
FBS Soro fetal bovino GLP-1 Péptido tipo glucagon 1
GPCRs G protein–coupled receptors (Recetores acoplados à proteína G)
GPERs Recetores de estrogénio acoplados à proteína G GPR30 Recetor de estrogénio 30 acoplado à proteína G H+ Protão
xii
HCO3- Bicarbonato
HSDs Enzimas hidroxiesteroides desidrogenases Hsp90 Heat shock protein 90
ICI Fulvestrant
IP3 Inositol 1,4,5-trifosfato
IP3R3 Recetor inositol-1,4,5-trifosfato tipo 3
K+ Ião Potássio
MAPK Proteína cinase ativada por mitogénio Mg2+ Ião Magnésio
Na+ Ião Sódio
NPPB Canais de Cl- sensíveis ao 5-nitro-2-(3-fenilpropilamina)-ácido Benzóico
OOX Orchidectomized (Orquidectomizados)
OVX Ovariectomized (Ovariectomizadas)
p23 Proteína cochaperone para a Hsp90 PDE Fosfodiesterases
pH Potencial de hidrogénio PI3K Fosfatidilnositol-3-cinase PIP2 Fosfatidilinositol 4,5-bifosfato
PKA Proteína Cinase A
PKD1L3-PKD2L1 Heterodímero 1L3 e 2L1 da doença renal policística 1 PLCβ2 Fosfolipase C β2
PVC Cloreto de polivinilo PYY Péptido YY
RNA Ribonucleic Acid (Ácido ribonucleico)
RNases Ribonucleases
RT-PCR Reverse transcription Polimerase Chain Reaction (Reação em cadeia de polimerase da transcrição reversa)
RT-qPCR PCR em tempo real do produto da transcrição reversa
Sham Controlo
siRNA Pequeno RNA de interferência
SNC Sistema nervoso central Sp1 Proteína de especificidade 1
TrpM5 Canal iónico recetor de potencial transitório M5
1
2
1. Plexo Coroide
No interior do encéfalo localiza-se o sistema ventricular cerebral constituído por quatro cavidades interligadas: dois ventrículos laterais, o terceiro e o quarto ventrículos. Na parede de cada um destes ventrículos encontra-se o plexo coroide (CP), uma estrutura responsável pela produção do líquido cefalorraquidiano (CSF), que constitui uma interface entre o sangue periférico e o CSF (barreira sangue-CSF) (Emerich et al., 2005, Johansson, 2014, Lehtinen et al., 2013, Wolburg and Paulus, 2010).
1.1. Estrutura e Morfologia do Plexo Coroide
O CP consiste numa estrutura convoluta de pequena dimensão, possuindo uma monocamada contínua de células epiteliais cuboides ciliadas [células epiteliais do plexo coroide (CPEC)], derivadas do revestimento ependimário dos ventrículos (Figura 1) (Damkier et al., 2010, Damkier et al., 2013, Emerich et al., 2005, Skipor and Thiery, 2008). Nos ventrículos laterais do cérebro, o CP forma estruturas em forma de folha, enquanto que no terceiro e quarto ventrículos forma estruturas ramificadas, bastante lobuladas e possuindo numerosas vilosidades (Damkier et al., 2010, Skipor and Thiery, 2008, Wolburg and Paulus, 2010).
Figura 1 - Representação morfológica do plexo coroide. Cada plexo coroide possui uma estrutura
ramificada constituída por uma monocamada de células epiteliais unidas por junções apertadas. A membrana apical destas células contém numerosas vilosidades e a membrana basolateral apresenta uma superfície lisa que permite o contacto com os capilares sanguíneos. Adaptado de (Brown et al., 2004).
3
As CPEC são suportadas pela lâmina basal, que delineia o estroma interno do tecido conjuntivo, extremamente vascularizado (Wolburg and Paulus, 2010). A membrana apical possui numerosas vilosidades que diferem em diâmetro e forma, e aumentam a área da superfície celular (Christensen et al., 2013, Emerich et al., 2005, Mortazavi et al., 2014). Enquanto a superfície apical contacta diretamente com o CSF, que preenche o interior dos ventrículos, a superfície basal, de aspeto liso, contacta com o estroma interno e os capilares sanguíneos sendo a responsável pelas trocas entre o sangue e o CP (Brown et al., 2004, Skipor and Thiery, 2008). Os capilares têm paredes endoteliais fenestradas de forma a garantir uma elevada permeabilidade (Wolburg and Paulus, 2010), permitindo que pequenas moléculas hidrófilas passem para o fluido intersticial (Mortazavi et al., 2014). Na superfície lateral das CPEC, existem desmossomas e junções apertadas que são importantes para a união destas células (Mortazavi et al., 2014). As junções apertadas formam a barreira sangue-CSF e permitem regular a passagem de moléculas entre o sangue e o CSF (Johansson et al., 2008, Johansson, 2014, Redzic and Segal, 2004).
Para além disto, intracelularmente, as CPEC contêm um grande núcleo central esférico e um citoplasma abundante com numerosas mitocôndrias, necessárias para manter as elevadas necessidades energéticas e metabólicas; aparelho de Golgi, retículo endoplasmático liso e vesículas lisossomais, o que demonstra a sua capacidade de síntese (Emerich et al., 2005, Mortazavi et al., 2014, Smith et al., 2004).
1.2. Funções Biológicas
O CP está envolvido numa grande variedade de funções cruciais para o sistema nervoso central (SNC), tais como: produção e secreção do CSF, síntese e secreção de substâncias biologicamente ativas e proteção e regulação do ambiente interno do cérebro através da barreira sangue-CSF. Muitas destas funções dependem, principalmente, das CPEC (Emerich et al., 2005, Johansson, 2014, Skipor and Thiery, 2008).
1.2.1. Produção e Secreção do Líquido Cefalorraquidiano
O CSF atua como tampão mecânico do cérebro, protegendo-o contra danos causados por impactos físicos, funciona como uma via de drenagem para o cérebro, em que produtos de metabolismo são removidos, bem como uma via de transporte de nutrientes para o SNC e também como uma via de comunicação dentro do SNC (Brown et al., 2004, Redzic and Segal, 2004).
No SNC adulto humano estima-se que o volume de CSF que circula seja cerca de 150 mL, e que o CSF se renove três a quatro vezes por dia, sugerindo uma produção diária de cerca de 400-600 mL de CSF (Lehtinen et al., 2013, Zappaterra and Lehtinen, 2012). Deste volume total que circula no sistema apenas 25% está localizado nos ventrículos, o restante preenche as cisternas basais, o espaço subaracnoide e flui em torno da medula espinal (Redzic and Segal, 2004, Skipor and Thiery, 2008). O CSF é um líquido claro, ligeiramente viscoso e com uma composição
4
diferente da do plasma sanguíneo. O seu pH é mais baixo do que o do plasma, assim como as concentrações de glucose, proteína, potássio (K+), cálcio (Ca2+) e bicarbonato (HCO
3-). Em
contraste, os níveis de sódio (Na+), cloro (Cl-) e magnésio (Mg2+) são mais elevados, bem como
os níveis de folato que são duas a três vezes maiores no CSF do que no plasma. A proteína tetramérica plasmática humana, transtirretina (TTR), representa 25% do total das proteínas do CSF (Emerich et al., 2005).
A secreção do CSF é uma das principais funções do CP. O CSF flui a partir dos ventrículos laterais para o terceiro ventrículo, através do forame de Monro, depois para o quarto ventrículo, através do aqueduto de Sylvius e, em seguida, para as cisternas basais e para o espaço subaracnoide por meio de aberturas localizadas abaixo do cerebelo, respetivamente forames de Luschka e de Magendie (Figura 2). O retorno à circulação periférica ocorre por reabsorção através das vilosidades aracnoides nos seios venosos do cérebro (Lehtinen et al., 2013, Skipor and Thiery, 2008).
Para a secreção deste fluido, através da monocamada epitelial, é consumida energia na forma de adenosina trifosfato (ATP). ATPases, outro tipo de canais iónicos e aquaporinas, nas faces apical e basolateral das células epiteliais, medeiam o processo ativo de secreção. Este processo envolve o transporte unidirecional de Na+, Cl-, e HCO
3- do sangue para os ventrículos e de K+ na
direção oposta. O movimento de iões cria um gradiente osmótico que leva à secreção de moléculas de água para os ventrículos. O HCO3- pode também ser sintetizado nas células
epiteliais através da enzima anidrase carbónica (Mortazavi et al., 2014).
Figura 2 - Secreção do CSF. Cada hemisfério cerebral possui um ventrículo lateral a partir do qual o CSF
flui para o terceiro ventrículo através do forame de Monro e de seguida para o quarto ventrículo através do aqueduto de Sylvius. Por fim o CSF flui para o espaço subaracnoide através de aberturas localizadas abaixo do cerebelo como o forame de Magendie. Adaptado de (Brown et al., 2004).
5
1.2.2. Síntese e Secreção de Outras Substâncias
O CP tem uma boa localização para a distribuição de moléculas no cérebro. Possui numerosos sistemas de transporte específicos, contém uma grande variedade de recetores e é uma fonte importante de compostos biologicamente ativos, como hormonas, péptidos, citocinas e fatores de crescimento, que são responsáveis pelo desenvolvimento do SNC e pela manutenção da sua homeostasia (Chodobski and Szmydynger-Chodobska, 2001, Emerich et al., 2005, Redzic and Segal, 2004). Uma vez que os recetores para alguns destes polipéptidos estão localizados no CP, podem ocorrer sinalizações autócrinas e parácrinas no tecido coroide. Por outro lado, o CP pode promover efeitos do tipo endócrino, uma vez que os polipeptídeos sintetizados pelo epitélio coroide e libertados no CSF podem exercer efeitos distais sobre as células-alvo no cérebro devido ao grande fluxo deste fluido (Chodobski and Szmydynger-Chodobska, 2001).
1.2.3. Proteção
A barreira sangue-CSF, formada pelas CPEC e pelas junções apertadas, controla a difusão de moléculas entre o sangue e o CSF, sendo a sua integridade estrutural e funcional extremamente importante para a homeostasia do SNC. Além da sua contribuição mecânica para a barreira sangue-CSF, o CP está numa posição ideal para monitorizar o CSF para a presença de compostos nocivos e para a invasão celular potencialmente perigosa (Emerich et al., 2005).
O CP protege o cérebro contra insultos neurotóxicos nocivos, utilizando sistemas de desintoxicação: a glutationa, a cisteína e as metalotioneínas que têm a capacidade de sequestrar os agentes tóxicos que circulam no CSF; a superóxido dismutase, a glutationa-S-transferase, a glutationa peroxidase e a glutationa redutase que são enzimas de proteção contra o stress oxidativo dos radicais livres e os sistemas de transporte de iões orgânicos e proteínas de resistência a múltiplas drogas que retiram os compostos nocivos do CSF (Emerich et al., 2005, Mortazavi et al., 2014).
O CP tem também um papel importante na defesa contra organismos invasores pois é um mediador entre o cérebro e o sistema imunológico periférico. Isto é suportado pela presença de células linfoides, pela capacidade para induzir citocinas pró-inflamatórias, pela expressão de moléculas do complexo maior de histocompatibilidade e de moléculas para a adesão leucocitária (Mortazavi et al., 2014). Estão presentes também outras células que agem como células fagocíticas, as células Kolmer, que expressam moléculas do complexo maior de histocompatibilidade e proliferam quando em contacto com endotoxinas (Emerich et al., 2005). Além disso, o CP tem ainda como função a absorção e remoção de produtos residuais do CSF. Em estudos experimentais, utilizando vários tipos de marcadores, verificou-se que as CPEC são capazes de absorver várias substâncias, incluindo as proteínas do CSF. Utilizam também o transporte ativo para moléculas maiores, e por pinocitose, formam vesículas em que o seu conteúdo sofre digestão intracelular, ou é libertado através da superfície basolateral das células epiteliais para o estroma dos tecidos conjuntivos e vasos sanguíneos (Mortazavi et al., 2014).
6
2. O Paladar
A capacidade de perceber, reconhecer e responder a estímulos é essencial para a sobrevivência dos organismos. O paladar é um dos sentidos básicos, que na cavidade oral tem duas funções principais: o reconhecimento de nutrientes essenciais e a proteção contra compostos que são tóxicos ou nocivos (Cygankiewicz et al., 2014, Roper, 2007, Sugita, 2006). O homem pode detetar e discriminar cinco estímulos diferentes: doce, amargo, umami, ácido e salgado (Chaudhari and Roper, 2010, Cygankiewicz et al., 2014, Niki et al., 2010).
Na cavidade oral, o passo inicial na perceção do sabor é mediado por células epiteliais especializadas, as células recetoras gustativas, que estão organizadas nas papilas gustativas. Já foram identificados recetores membranares para os cinco sabores: recetores acoplados à proteína G (GPCRs) e recetores do tipo canal (Niki et al., 2010, Roper, 2007). Os padrões de expressão destes recetores sugerem que cada sabor pode ser codificado por uma população separada de células da papila gustativa (Niki et al., 2010). Os sinais gerados são processados pelo SNC, resultando na perceção do sabor (Sugita, 2006).
2.1. A via de sinalização do paladar
2.1.1. Os estímulos Doce, Amargo e Umami
As sensações do sabor doce, amargo e umami são iniciadas pela interação da molécula em causa com GPCRs na membrana apical das células recetoras gustativas. Duas famílias de recetores gustativos de mamífero, T1Rs e T2Rs, têm sido implicadas na deteção destes sabores (Niki et al., 2010).
Os sabores doce e umami são reconhecidos pela família T1R (T1R1, T1R2 e T1R3) que pertence à família C dos GPCRs e é caracterizada por possuir uma extremidade N terminal extracelular extensa (Cygankiewicz et al., 2014, Roper, 2007). Os T1Rs organizam-se em complexos heterodiméricos para reconhecer o doce (T1R2-T1R3) ou o umami (T1R1-T1R3) (Niki et al., 2010). O heterodímero T1R2-T1R3 é ativado por uma ampla variedade de substâncias doces: açúcares naturais (sacarose, frutose, glicose, maltose); aminoácidos doces (triptofano, D-fenilalanine, D-serina); edulcorantes (aspartame, ciclamato, sacarina) e proteínas doces (monelina, brazzein, taumatina). O heterodímero T1R1-T1R3 responde exclusivamente ao L-glutamato e L-aspartato no homem e a todos os aminoácidos em roedores (Cygankiewicz et al., 2014, Niki et al., 2010).
As substâncias que causam o sabor amargo são reconhecidas pela família de recetores T2R, que pertence à família A de GPCRs, e possuem uma extremidade N terminal extracelular curta. No ser humano, foram identificados 25 membros desta família enquanto que em ratinhos foram identificados 34 (Roper, 2007, Sugita, 2006). Os recetores T2R são ativados por diversos compostos amargos como as amidas (denatónio) e os alcaloides (estricnina, cafeína e quinino). Contudo, alguns aminoácidos, ureia, ácidos gordos, fenóis, aminas, ésteres e sais de K+, Ca2+ e
7
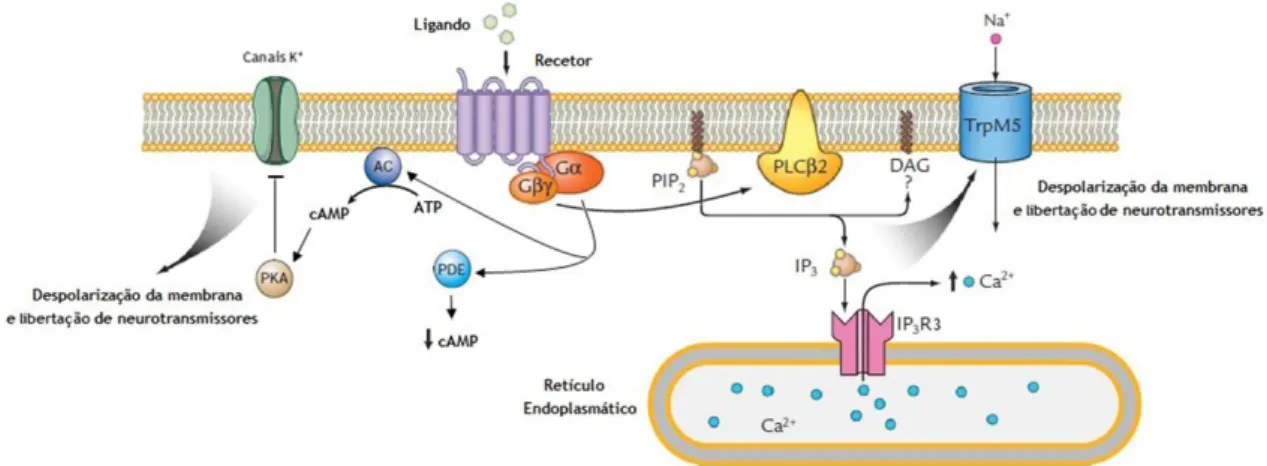
Figura 3 - Transdução de sinal dos sabores doce, amargo e umami. A interação dos compostos com os seus
recetores resulta na ativação de mensageiros secundários que desencadeiam uma cascata de transmissão de sinal intracelular que leva à despolarização da membrana e libertação de neurotransmissores. AC - adenilato-ciclase; ATP - adenosina trifosfato; Ca2+ - ião cálcio; cAMP - monofosfato de adenosina cíclico;
DAG - diacilglicerol; Gα – subunidade α da proteína G; Gβγ – subunidades β e γ da proteína G; IP3 - inositol
1,4,5-trifosfato; IP3R3 - recetor inositol-1,4,5-trifosfato tipo 3; K+ - ião potássio; Na+ - ião sódio; PDE -
fosfodiesterases; PIP2 - fosfatidilinositol 4,5-bifosfato; PKA - proteína cinase A; PLCB2 - fosfolipase C β2;
TrpM5 - canal iónico recetor de potencial transitório M5. Adaptado de (Mennella et al., 2013).
importante para evitar o consumo de alimentos prejudiciais, tendo um limiar de ativação inferior ao dos outros sabores (Roper, 2007). A célula recetora gustativa pode responder a um ou mais compostos amargos mas não a todos, pois as células expressam apenas certas subclasses de T2R e não toda a família de recetores. Os genes para T2R são caracterizados pela ausência de intrões, em contraste com os genes T1R (Cygankiewicz et al., 2014).
A interação das substâncias com os recetores localizados na membrana apical das células recetoras gustativas, resulta num sinal intracelular que se manifesta pela ativação de mensageiros secundários que desencadeiam uma cascata de transmissão de sinal até à membrana basal (Cygankiewicz et al., 2014, Roper, 2007). Ambos os recetores, T1R e T2R, são co-expressos com uma molécula sinalizadora, específica do paladar, a proteína gustducin heterotrimérica (Cygankiewicz et al., 2014, Roper, 2007, Sugita, 2006). A transdução de sinal do sabor doce, amargo e umami ocorre através da ligação do ligando ao recetor, levando à dissociação da proteína G heterotrimérica, podendo ativar uma das duas vias de sinalização: uma que envolve o aumento do monofosfato de adenosina cíclico (cAMP) e outra que envolve a estimulação do inositol 1,4,5-trifosfato (IP3) (Cygankiewicz et al., 2014, Roper, 2007) (Figura
3).
Na via de sinalização do cAMP, a subunidade α pode causar tanto o aumento dos níveis de cAMP, pela ativação da adenilato-ciclase (AC), como a diminuição pela ativação de fosfodiesterases (PDE). Assim, a ligação dos ligandos aos recetores através da proteína G ativa a AC que converte o ATP em cAMP, que por sua vez ativa a proteína cinase A (PKA) que fosforila os canais de K+
presentes na membrana basal fechando-os. Isto leva à despolarização das células recetoras gustativas resultando no influxo de iões de Ca2+ através de canais de Ca2+ dependentes da
8
baixos níveis de cAMP são necessários para manter a sinalização adequada de Ca2+, através da
desinibição de canais de nucleótidos cíclicos inibidos para aumentar o Ca2+ intracelular
(Welcome et al., 2015).
Na outra via de sinalização, as subunidades βγ da proteína G ativam a fosfolipase C β2 (PLCβ2), que hidrolisa o fosfatidilinositol 4,5-bifosfato (PIP2) em diacilglicerol (DAG) e IP3.
Subsequentemente, o IP3 ativa o seu recetor (recetor inositol-1,4,5-trifosfato tipo 3 (IP3R3))
nos reservatórios de Ca2+, levando à libertação de Ca2+ das reservas intracelulares. Aumentos
rápidos nas concentrações de Ca2+ intracelular estimulam o canal iónico recetor de potencial
transitório M5 (TrpM5), localizado na membrana basolateral, levando ao influxo de Na+ e à
despolarização da membrana, e assim à libertação de neurotransmissores (Niki et al., 2010, Sugita, 2006).
2.1.2. Os estímulos Ácido e Salgado
A deteção de compostos ácidos e salgados é mediada por canais iónicos (Figura 4). A perceção de compostos ácidos, na boca, pode funcionar para proteger contra comida estragada, frutos imaturos ou substâncias tóxicas (Sugita, 2006). O principal estímulo do sabor ácido parece ser mediado por protões (H+) que atravessam a membrana celular, através de canais e
permutadores de iões, acidificando o citoplasma e provocando a despolarização da membrana (Roper, 2007). Alternativamente, transportadores de iões regulados pelo pH modulam a concentração intracelular de iões, tais como Na+, K+ e Cl- alterando o equilíbrio iónico e
conduzindo também à despolarização da membrana. Muitos recetores têm sido implicados na deteção deste sabor, tais como: canais iónicos de deteção de ácido (ASICs), canais de Na+
sensíveis à amilorida (ENaC), canais de K+ operados por nucleótidos cíclicos ativados por
hiperpolarização (HCNs), canais de Cl- sensíveis ao 5-nitro-2-(3-fenilpropilamina)-ácido
benzóico (NPPB)e heterodímero 1L3 e 2L1 da doença renal policística 1 (PKD1L3-PKD2L1) (Niki et al., 2010, Roper, 2007). Quanto ao sabor salgado, este tem um papel importante na integração do cloreto de sódio e de outros sais, e na manutenção da homeostasia iónica e da água. O mecanismo descrito para a perceção de compostos salgados envolve uma corrente de iões Na+, que flui para dentro das células gustativas, através de canais catiónicos, ENaC,
presentes na membrana apical. Os iões Na+ também podem atravessar o epitélio através das
junções apertadas e entrar nas células recetoras gustativas através dos canais, insensíveis à amilorida, localizados basolateralmente. O influxo de Na+ provoca diretamente a
despolarização da membrana (Sugita, 2006).
A despolarização da membrana, comum à transdução de sinal dos ácido e salgado, leva à geração de potenciais de ação que envolvem a ativação de canais Na+ e Ca2+ dependentes da
voltagem provocando a entrada destes, e a saída de K+ através da ativação de canais K+
dependentes da voltagem. Os iões Na+ transportados para as células gustativas são extrudidos
por ATPases Na+/K+ localizadas basolateralmente. Esta despolarização, provocada pelo
movimento de iões, leva ao aumento das concentrações de Ca2+ intracelulares e à libertação
9
2.2. A via de sinalização do paladar noutros tecidos
A expressão dos recetores gustativos e das moléculas da via de transdução do paladar foi originalmente descoberta na cavidade oral, mas tem sido demonstrada em outros órgãos tais como, o trato gastrointestinal, os testículos, os espermatozoides, os pulmões, o pâncreas, o coração, os rins, a tiroide, a pele, o cérebro e o CP (Clark et al., 2015, Laffitte et al., 2014, Li, 2013, Liman et al., 2014, Quintela et al., 2013, Wolfle et al., 2015, Yamamoto and Ishimaru, 2013).
A expressão de recetores T2R bem como de subunidades α de proteínas G implicadas na transdução de sinal do paladar (gustducin e transducin) foi demonstrada, por reação em cadeia de polimerase da transcrição reversa (RT-PCR), na mucosa gastrointestinal de rato e ratinho e por RT-PCR, imunohistoquímica e western blotting na linha celular STC-1 (linha celular enteroendócrina). A estimulação das células STC-1 com compostos amargos, promoveu o aumento na concentração intracelular de Ca2+ (Wu et al., 2002). Jang e os seus colaboradores
demonstraram, por RT-PCR e imunofluorescência que os recetores T1R2 e T1R3, a proteína α-
gustducin e outros elementos da via de transdução do paladar, como a PLCβ2 e o TrpM5, são
expressos nas células L duodenais humanas e na linha celular L humana NCI-H716, e que a α-
gustducin também se encontra expressa nas células L intestinais de ratinho. A ingestão de
glucose por ratinhos deficientes em α-gustducin mostrou diminuição na secreção do péptido tipo glucagon 1 (GLP-1) e na regulação de insulina e glucose no plasma. A secreção de GLP-1 a partir das células NCI-H716 foi promovida por estímulos doces e bloqueada pela lactisole, um antagonista do recetor, ou pela diminuição da expressão da α-gustducin por silenciamento com ácido ribonucleico (RNA) de interferência (siRNA). Assim, estes dados indicam que as células L
Figura 4 - Transdução de sinal dos sabores salgado e ácido. Canais iónicos medeiam a deteção de
compostos ácidos e salgados. O influxo de catiões através dos canais induz a despolarização da membrana levando à produção de potenciais de ação, o que resulta na libertação de neurotransmissores nas fibras nervosas aferentes. ASICs - canais iónicos de deteção de ácido; ATPases – proteínas integrais da membrana; Ca2+ - ião cálcio; [Ca2+]
i – concentração de cálcio intracelular; CIC-4a – canal de Cl-; Cl- - ião cloro; ENaC -
canais de Na+ sensíveis à amilorida; H+ - protão; HCN - canal de K+ operado por nucleótidos cíclicos ativados
por hiperpolarização; HCO3- - bicarbonato; K+ - ião potássio; Na+ - ião sódio; pH – potencial de hidrogénio.
10
do intestino funcionam como um sensor de glucose através de uma via de sinalização semelhante à utilizada pelas células gustativas na língua (Jang et al., 2007). Outro estudo, através de RT-PCR, hibridação in situ e imunohistoquímica, também demonstrou que o recetor T1R3 está expresso no duodeno e nas células da mucosa gástrica, tendo um papel importante na deteção de compostos no lúmen e na secreção de grelina (Hass et al., 2010).
Foi criado um ratinho transgénico para investigar a distribuição do recetor T2R5 em secções de testículos, tendo sido observada a sua expressão através de imunohistoquímica e coloração com X-gal. A expressão do recetor T1R3 e de outros componentes da via do paladar (α-gustducin, Ggamma13, PLCβ2) foi demonstrada na espermatogénese, sendo que o canal TrpM5 apenas foi observado na fase de espermatídios mais tardia (Li and Zhou, 2012). A expressão de recetores do sabor amargo (T2Rs) foi identificada em testículos de ratinhos por transcriptase reversa e PCR em tempo real do produto da transcrição reversa (RT-qPCR) e dois recetores (T2R105 e T2R108) foram localizados em células pós-meióticas, por hibridação in situ. Análises funcionais mostraram que os espermatídios e espermatozoides de ratinhos responderam a componentes amargos aumentando as concentrações intracelulares de Ca2+ livre. Estas respostas foram
suprimidas por um bloqueador específico do estímulo amargo ou pelo knockout do gene para a proteína G α-gustducin. Estes dados sugerem que as células germinativas masculinas utilizam os recetores T2R para detetar produtos químicos no ambiente que podem afetar o comportamento do esperma e a fertilização (Xu et al., 2013). Outros estudos mostraram que a
α-gustducin em espermatozoides de mamífero pode desempenhar um papel funcional quer na
transdução de sinal de controlo da quimiotaxia do esperma quer no processo de motilidade do esperma (Fehr et al., 2007). Estudos posteriores mostraram também que os recetores Tas1R1 e Tas1R3 são expressos em espermatozoides humanos e de ratinho, sendo que a sua localização é restrita a segmentos distintos do flagelo e do acrossoma do espermatozoide, e ratinhos
knockout para o recetor Tas1R1 revelaram anomalias na espermatogénese (Meyer et al., 2012).
A expressão de recetores do amargo (T2Rs) e da α-gustducin, da PLCβ2 e do TrpM5 foi detetada no epitélio ciliado das vias respiratórias. Um estímulo amargo, neste tecido, mostrou um aumento na concentração intracelular de Ca2+ e um aumento da frequência do batimento ciliar.
Assim, os cílios do epitélio das vias respiratórias parecem detetar substâncias nocivas e iniciar um mecanismo de defesa para eliminar os compostos prejudiciais inalados (Shah et al., 2009). Outros estudos relataram que as células do músculo liso das vias respiratórias humanas expressam recetores Tas2Rs e, ao aplicar agonistas dos recetores, verificaram um relaxamento das células por um mecanismo que envolve o aumento da concentração de Ca2+ intracelular e
a hiperpolarização da membrana (Deshpande et al., 2010). Um outro estudo em roedores, revelou que os elementos da cascata de transdução do paladar, incluindo os recetores Tas1R e Tas2R, a α-gustducin, a PLCβ2 e o TrpM5, são expressos pelas células quimiosensoriais solitárias distribuídas ao longo das vias respiratórias, consideradas como células quimiorrecetoras que atuam contra agentes irritantes e patogénicos inalados (Tizzano et al., 2011).
A expressão e função dos recetores do doce (Tas1R2-Tas1R3) foram também analisadas em ilhotas pancreáticas de ratinho e na linha celular β pancreática MIN6 demonstrando-se
11
expressão nas células β pancreáticas e secreção de insulina através de mecanismos dependentes de Ca2+ e cAMP após ativação (Nakagawa et al., 2009). Num outro estudo, mostrou-se que os
recetores do umami (Tas1R1-Tas1R3) e a α-gustducin são expressos na linha celular β pancreática de ratinho MIN6, com localização na membrana plasmática. A administração de aminoácidos causou o aumento das concentrações intracelulares livres de IP3 e Ca2+, e um
aumento significativo da libertação de insulina, sendo que estes aumentos diminuíram com a aplicação de um antagonista do recetor Tas1R3, demonstrando-se que o heterodímero Tas1R1-Tas1R3 regula a secreção de insulina (Oya et al., 2011).
A expressão dos recetores Tas2R, Tas1R1 e Tas1R3 foi ainda demonstrada no tecido cardíaco de roedores e humanos, em cardiomiócitos e fibroblastos, e em células cardíacas isoladas, podendo funcionar como sensores de nutrientes no coração (Foster et al., 2013). Num estudo com ratinhos transgénicos, foi demonstrada a expressão dos recetores do sabor amargo Tas2R105 e Tas2R106 e da α-gustducin no tecido renal e a sua importância na manutenção da estrutura dos glomérulos e dos túbulos renais (Liu et al., 2015). A expressão de recetores Tas2Rs e da α-gustducin foi ainda mostrada em células foliculares da tiroide (tireocitos) humanas e de ratinho e na linha de tireocitos humana Nthy-Ori 3-1, com relevância para a função tiroideia (Clark et al., 2015). Recentemente, a expressão dos recetores Tas2R1 e Tas2R38 foi mostrada na pele humana, com co-localização com a proteína α-gustducin nas células HaCaT e nos queratinócitos primários, e demonstrando a sua funcionalidade nos queratinócitos (Wolfle et al., 2015).
A expressão dos genes recetores do paladar Tas1R1, Tas1R2 e Tas1R3 e dos seus genes associados à proteína G (Gnat3, Gnb3 e Gng13) foi descrita no cérebro de mamíferos, particularmente no hipotálamo, hipocampo e córtex, através de hibridação in situ (Ren et al., 2009). Mostrou-se também que os recetores T2Rs (T2R4, T2R107 e T2R38) são expressos em várias regiões do cérebro de rato, tais como no tronco cerebral, cerebelo, córtex e núcleo
accumbens, e estudos funcionais para o recetor T2R4 mostraram um aumento dos níveis
intracelulares de Ca2+ após estímulo com compostos amargos, sugerindo que este recetor é
funcional (Singh et al., 2011). Por hibridação in situ a expressão dos recetores do paladar Tas1R2 e Tas1R3 foi identificada nas CPEC (Ren et al., 2009). Um estudo de microarrays, realizado previamente pelo nosso grupo de investigação, para analisar o efeito das hormonas sexuais no transcritoma do CP de rato, mostrou a existência de várias vias de sinalização reguladas pelas hormonas, entre as quais a via de sinalização do paladar. Estes resultados mostraram um facto até aí desconhecido, a via de transdução de sinal do paladar está presente no CP (Quintela et al., 2013). Mais recentemente, mostrámos a expressão dos recetores Tas1R1, Tas1R3, Tas1R2, Tas2R40 e Tas2R109 e das moléculas PlCβ2, Itpr3, TrpM5, AC4, Scnn1g, Gnb3 e Gnat3 envolvidas na via do paladar quer ao nível de RNA como de proteína, no CP. Por ensaios de imunofluorescência, em explantes de CP, mostrámos também a co-expressão dos recetores do sabor doce (Tas1R2 e Tas1R3) e do sabor umami (Tas1R1 e Tas1R3) e das moléculas da via de sinalização do paladar com um marcador da membrana plasmática. A ativação da via do amargo em culturas primárias de CPEC resultou no aumento dos níveis intracelulares de Ca2+
12
mostrando que a via de transdução de sinal do amargo está funcional (Gonçalves I, comunicação pessoal).
3. Hormonas Esteroides
As hormonas esteroides regulam uma grande variedade de processos fisiológicos, como a promoção do desenvolvimento e a regulação do metabolismo (Miller and Auchus, 2011, Tsai and Beavo, 2011). Vários órgãos, incluindo a glândula adrenal, os testículos, os ovários e a placenta, sintetizam estas hormonas esteroides, sendo denominados por órgãos esteroidogénicos (Sanderson, 2006). Baulieu e os seus colaboradores, na década de 80, observaram que os esteroides, tais como a pregnenolona e a desidroepiandrosterona (DHEA) estavam presentes em concentrações mais elevadas no sistema nervoso do que no plasma, surgindo assim a primeira evidência de que o cérebro é um órgão esteroidogénico (Baulieu, 1998, Mellon and Griffin, 2002). Interferências na biossíntese destas hormonas esteroides podem resultar em alterações na diferenciação, crescimento e desenvolvimento sexual, na reprodução e no desenvolvimento de diversos cancros (Sanderson, 2006).
3.1. Síntese de estrogénios
A biossíntese de hormonas esteroides é designada por esteroidogénese e envolve uma série de reações enzimáticas, através das quais o colesterol é convertido biologicamente em hormonas esteroides ativas, tais como os glucocorticoides, os mineralocorticoides, os androgénios, os estrogénios e a progesterona (Ghayee and Auchus, 2007, Miller and Auchus, 2011, Sanderson, 2006). A síntese das hormonas esteroides é mediada por enzimas do citocromo P450 (CYPs) e das hidroxiesteroides desidrogenases (HSDs) (Tsai and Beavo, 2011). Os estrogénios são um grupo de hormonas esteroides com muitas funções fisiológicas, que regulam o crescimento, diferenciação e funções de diversos tecidos no corpo humano (Bjornstrom and Sjoberg, 2005), e podem existir no organismo sob a forma de estrona (E1), 17-β-estradiol (E2) e estriol (E3), sendo o E2 a forma fisiologicamente ativa do estrogénio (Kumar et al., 2010). As hormonas esteroides que têm como local de síntese o sistema nervoso são designadas neuroesteroides, sendo este processo denominado neuroesteroidogénese (Baulieu et al., 2001). Estes esteroides têm uma grande variedade de funções biológicas, tais como a regulação da mielinização, do crescimento de neurónios e da sinaptogénese no SNC, bem como a neuroprotecção (Wojtal et al., 2006). A síntese destas hormonas esteroides no cérebro tem como percursor inicial o colesterol, sendo também necessário a presença de enzimas esteroidogénicas (Mellon et al., 2001).
13
3.2. Mecanismo de ação dos estrogénios
Foram identificados três tipos de recetores de estrogénio, a partir dos quais os estrogénios podem mediar os seus efeitos fisiológicos: duas isoformas de recetores de estrogénios (ERs), a alfa (ERα) e a beta (ERβ), e o recetor de estrogénio acoplado à proteína G (GPER), especificamente, o recetor de estrogénio 30 acoplado à proteína G (GPR30) (Prossnitz et al., 2008).
Os ERs pertencem à superfamília de recetores nucleares que funcionam como fatores de transcrição quando estão ligados aos seus ligandos (Osborne and Schiff, 2005). No que diz respeito à sua expressão nos diferentes tecidos humanos, cada um dos subtipos de ERs, encontra-se diferencialmente expresso pelo organismo. O ERα encontra-se principalmente nos tecidos associados á reprodução (útero, mamas, vagina), enquanto que o ERβ se encontra principalmente em tecidos não envolvidos na reprodução como os rins, sistema cardiovascular, sistema imunológico, SNC, trato urogenital, trato gastrointestinal e pulmões (Millas and Liquidato, 2009). Estes recetores são também expressos no cérebro, sendo que os ERα estão presentes em maior concentração no hipotálamo e os ERβ no córtex cerebral (Janicki and Schupf, 2010). O GPR30 é uma proteína integral de membrana com domínios transmembranares, em que a sua expressão tem sido detetada em tecidos humanos tais como o coração, fígado, intestino, próstata, ovários, rins, cérebro e pulmões (Micevych and Dominguez, 2009, Olde and Leeb-Lundberg, 2009).
Os estrogénios podem ligar-se aos ERs para modificar a atividade transcricional, produzindo mecanismos de ação genómica, e podem levar a uma ativação rápida de cascatas de sinalização, produzindo assim mecanismos de ação não genómica (Shanle and Xu, 2011).
Mecanismos de ação genómica
Os mecanismos de ação genómica são normalmente lentos, levando horas até que as ações biológicas se manifestem (Silva et al., 2010). Os ERs quando estão no seu estado inativo, localizados nuclearmente ou citoplasmaticamente, apresentam-se ligados a proteínas
chaperones que estabilizam os recetores. Quando o estrogénio se liga ao domínio de ligação do
recetor, o ER torna-se ativo devido a mudanças conformacionais que permitem a sua dissociação das proteínas chaperones, havendo assim a difusão do complexo hormona-recetor para o núcleo da célula. De seguida, ocorre a dimerização deste complexo e a ligação do dímero aos elementos responsivos ao estrogénio (ERE). Após a ligação aos ERE, inicia-se a transcrição génica, que é regulada por co-fatores proteicos (co-ativadores ou co-repressores) que podem influenciar a ação transcricional do recetor (Gruber et al., 2002, Millas and Liquidato, 2009). Os ERs, para além da interação direta com os ERE, também podem regular a transcrição de genes alvo sem se ligarem diretamente ao ácido desoxirribonucleico (DNA), modulando a atividade de outros fatores de transcrição (Gruber et al., 2002). Neste caso o complexo hormona-recetor interage com fatores de transcrição ligados ao DNA (interação
proteína-14
proteína), tais como a proteína de especificidade 1 (Sp1) e a proteína ativadora 1 (AP-1), que ativam a transcrição genética (Figura 5) (Osborne and Schiff, 2005).
Figura 5 - Mecanismos de ação dos estrogénios. Os estrogénios podem desencadear dois tipos distintos de
mecanismos de ação: mecanismos de ação genómica e mecanismos de ação não genómica. A sinalização genómica ocorre quando os ligandos entram na célula e se ligam ao ER tornando-o ativo, o que permite a sua dissociação das proteínas chaperones estabilizadoras (Hsp90 e p23) e consequentemente a sua dimerização. Os dímeros podem ligar-se diretamente ao DNA em ERE ou indiretamente através de outros fatores de transcrição, como Sp1 ou AP-1. A sinalização não genómica ocorre quando os ligandos se ligam a recetores membranares, levando à ativação de cascatas de sinalização. AP-1 - proteína ativadora 1; ER – recetor de estrogénio; GPR30 - recetor de estrogénio 30 acoplado à proteína G; Hsp90 - heat shock
protein 90; p23 – proteína cochaperone para a Hsp90; Sp1 - proteína de especificidade 1. Adaptado de
(Shanle and Xu, 2011).
Mecanismos de ação não genómica
Os mecanismos de ação não genómica envolvem uma sinalização celular rápida (Prossnitz and Barton, 2011). Esta sinalização estrogénica pode ser mediada pela interação dos ligandos com recetores associados à membrana plasmática, ERs ou GPR30 independentes dos ERs, levando assim à ativação de cascatas de sinalização do fosfatidilnositol-3-cinase (PI3K) e da proteína cinase ativada por mitogénio (MAPK), a variações no cálcio intracelular ou à estimulação da produção de cAMP (Shanle and Xu, 2011) (Figura 5).
15
Os neuroesteroides atuam no sistema nervoso por mecanismos autócrinos ou parácrinos, podendo regular a expressão génica através da ligação a recetores nucleares ou afetando a neurotransmissão (Wojtal et al., 2006).
3.3. As hormonas esteroides e o plexo coroide
As hormonas sexuais têm propriedades neuroprotetoras em doenças neurodegenerativas, que são frequentemente relacionadas com a redução dos níveis destas hormonas (Bourque et al., 2009, Carroll and Rosario, 2012, Charalampopoulos et al., 2008). Tem sido demonstrado que o CP expressa uma grande variedade de recetores, incluindo os recetores das hormonas sexuais, como os ERs, sugerindo que é um tecido alvo para estas hormonas, e sintetiza alguns péptidos implicados na neuroprotecção e neurodegeneração que são responsivos às hormonas (Hong-Goka and Chang, 2004, Quintela et al., 2009, Quintela et al., 2011).
O estudo de microarrays realizado pelo nosso grupo de investigação, para além de mostrar que a via de transdução do paladar se encontra expressa no CP de rato, mostrou também que o declínio dos níveis hormonais induz um aumento na expressão dos genes associados à via de transdução do paladar, evidenciando a sua regulação pelas hormonas esteroides sexuais. Estes resultados salientaram a importância do CP como um tecido sensorial no cérebro, fazendo a vigilância da composição química do CSF (Quintela et al., 2013). Assim, é provável que as hormonas sexuais afetem a deteção do sabor não apenas ao nível das papilas gustativas (Faas et al., 2010), mas também no SNC, podendo estes genes serem relevantes como novos potenciais alvos terapêuticos em desordens neurológicas.
4. Desreguladores Endócrinos
Os desreguladores endócrinos (DE) são compostos exógenos que se encontram dispersos no meio ambiente e que influenciam a homeostasia, desenvolvimento e proliferação celular, mimetizando ou inibindo a ação de hormonas endógenas ou alterando a regulação hormonal do sistema endócrino, provocando efeitos adversos na saúde, como anomalias reprodutivas e alteração no desenvolvimento. Podem interferir com a síntese, armazenamento, metabolismo, transporte, libertação e ligação ao recetor de hormonas endógenas (Casals-Casas and Desvergne, 2011, Flint et al., 2012, Yoon et al., 2014).
O grupo de moléculas identificadas como DE é altamente heterogéneo e inclui compostos químicos industriais, compostos utilizados na indústria do plástico e em produtos de consumo, pesticidas, agentes farmacêuticos e metais pesados (Casals-Casas and Desvergne, 2011, De Coster and van Larebeke, 2012, Yoon et al., 2014). A maior parte dos DE são produtos químicos sintéticos e, destes, o bisfenol A (BPA) é um dos mais utilizados e mais estudado (Bhandari et al., 2015, Rogers et al., 2013).
16
4.1. Bisfenol A
O BPA é um monómero utilizado no fabrico de plásticos de policarbonato e de resinas epóxi. Estes são usados em numerosos produtos e aplicações, tais como: revestimento de enlatados, recipientes de armazenamento de alimentos e bebidas, papel térmico, selantes dentários, equipamentos médicos e eletrónicos e materiais de construção. O BPA também é usado como aditivo em outros tipos de plásticos, como o cloreto de polivinilo (PVC) (Bhandari et al., 2015, Casals-Casas and Desvergne, 2011, Geens et al., 2011, Meeker, 2012, Resnik and Elliott, 2015, Rezg et al., 2014). As moléculas do BPA, polimerizadas, estão ligadas por ligações éster e com a hidrólise dos polímeros, por exposição a temperaturas elevadas ou a substâncias básicas ou ácidas, as moléculas podem libertar-se a partir dos recipientes em contacto com as bebidas e alimentos tornando assim possível a ingestão de BPA (Alonso-Magdalena et al., 2012, Fenichel et al., 2013, Geens et al., 2011, Rubin, 2011). A sua libertação também pode ocorrer através dos monómeros não ligados que permanecem depois da polimerização do BPA (Casals-Casas and Desvergne, 2011). A libertação direta do BPA no ambiente para a atmosfera, água e solo ocorre durante as atividades de fabrico e processamento (Mileva et al., 2014).
Devido à sua resistência ao calor e elasticidade, o uso de BPA tem aumentado progressivamente em todo o mundo, com uma produção anual superior a 10 milhões de toneladas (Fenichel et al., 2013). Apesar da meia-vida curta, é ubíquo no ambiente e no contacto com o homem devido à sua libertação contínua e à sua ampla utilização em bens de consumo (Flint et al., 2012, Geens et al., 2011).
4.1.1. Mecanismo Molecular de Ação do BPA
O BPA é considerado um xenoestrogénio, sendo que interfere com a atividade dos estrogénios endógenos, como o E2, ligando-se aos ERs. Os ERs desencadeiam respostas celulares através da transdução de sinal tanto genómica como não-genómica (Mileva et al., 2014, Wetherill et al., 2007). A transdução de sinal genómica é um processo lento através do qual os ERs regulam a transcrição e por sua vez a expressão génica (Mileva et al., 2014). Assim, o BPA exerce efeitos estrogénicos através dos ERs, perturbando principalmente a atividade dos recetores nucleares (Mileva et al., 2014, Wetherill et al., 2007). Liga-se a ambos os ERs nucleares, ERα e ERβ, com uma afinidade 10 vezes maior para este último, induzindo sinais estrogénicos que modificam a expressão dos genes responsivos ao estrogénio (Vandenberg et al., 2013). Apesar de, inicialmente, a desregulação endócrina causada pelo BPA ter sido considerada fraca em comparação com o E2, estudos mais recentes demonstraram que o BPA pode estimular algumas respostas celulares em concentrações muito baixas, abaixo dos níveis esperados para a ligação do BPA aos ERs nucleares (Mileva et al., 2014, Vandenberg et al., 2010).
Alguns dos efeitos do BPA podem ocorrer através da ativação de sistemas de sinalização celular associados a recetores que estão localizados na membrana celular e não no núcleo da célula. Estas ações não-genómicas são rápidas e envolvem a modificação de proteínas reguladoras
17
(Mileva et al., 2014, Welshons et al., 2006). Neste caso a ação do BPA tem a mesma eficácia e potencial que o E2 (Rochester, 2013).
O BPA é geralmente considerado um agonista dos ERs, mas também pode antagonizar as ações dos estrogénios em certos tecidos, incluindo o cérebro e o útero (Bhandari et al., 2015). Para além disto, o BPA exerce outras atividades de desregulador endócrino: efeitos sobre os sistemas de androgénio, perturbação na função hormonal da tiroide, diversos efeitos no desenvolvimento, diferenciação e função do SNC bem como do sistema imunitário (Wetherill et al., 2007).
4.1.2. Exposição ao BPA
A ingestão oral é considerada a principal fonte de exposição do homem ao BPA; no entanto, a absorção dérmica e a inalação de poeiras no ar contaminado são outras vias prováveis (Fenichel et al., 2013, Mileva et al., 2014, Rubin, 2011). Acredita-se assim que os alimentos, em particular a comida enlatada, são a maior fonte de exposição dos humanos ao BPA (Geens et al., 2011, Resnik and Elliott, 2015, Rezg et al., 2014). Num estudo recente no Texas, mediu-se a concentração de BPA em 204 amostras de alimentos frescos, congelados e enlatados. O BPA foi detetado em 73% das amostras de alimentos enlatados, enquanto que nos alimentos não-enlatados foi detetado em apenas 7% e em baixas concentrações. A ingestão diária foi calculada como 12.6 ng/kg-dia, dos quais 12.4 ng/kg-dia foram de alimentos enlatados. Isto ressalta a importância dos alimentos enlatados na exposição global dos adultos ao BPA (Lorber et al., 2015). Depois de ser ingerido, o BPA é rapidamente metabolizado no fígado para formar dois metabolitos principais, BPA glucuronido e BPA sulfato, que são mais solúveis do que o BPA não conjugado, sendo excretados através da urina. Assim, este processo reduz significativamente a concentração de BPA não conjugado circulante no sangue. No entanto, o metabolismo não é completo e algum BPA não conjugado permanece na circulação (Mileva et al., 2014, Vandenberg et al., 2013). Contudo, estudos realizados em amostras de sangue revelaram a presença de metabolitos do BPA (BPA glucuronido), que não são removidos da circulação tão eficientemente (Vandenberg et al., 2013). Em 2006, a Autoridade Europeia para a Segurança dos Alimentos (EFSA) definiu a ingestão diária tolerável de BPA em 0.05 mg/kg de peso corporal/dia (EFSA, 2006, Mileva et al., 2014). Em janeiro de 2015, a EFSA publicou a opinião de um especialista definindo uma quantidade de ingestão diária tolerável temporária de 4 µg/kg de peso corporal/dia. Esta quantidade é 12.5 vezes menor do que a definida em 2006, de 50 µg/kg de peso corporal/dia, aguardando-se o resultado de um estudo, em curso, a longo prazo (EFSA, 2015).
A exposição dérmica foi sugerida através do contacto com papel térmico que é normalmente usado em recibos (Biedermann et al., 2010, Rezg et al., 2014). O BPA existe no papel térmico como um monómero sem ligações químicas, o que facilita a absorção dérmica (Lu et al., 2013). Num estudo realizado na Suíça, analisaram-se 13 amostras de papel de impressão térmico. 11 continham uma concentração média de BPA de 13.3 g/kg de BPA e 2 não continham BPA. Verificou-se também que no contacto com um recibo de papel de impressão térmico durante 5
18
segundos, cerca de 1 µg de BPA é transferida para a pele, se esta estiver bastante seca, sendo transferido cerca de dez vezes mais se a pele estiver molhada ou gordurosa (Biedermann et al., 2010). Num outro estudo realizado na Bélgica, o BPA foi detetado num total de 44 amostras de papel térmico sendo que, 73% das amostras tinham concentrações entre 9-21 mg de BPA/g de papel enquanto que as restantes amostras tinham concentrações abaixo de 0.1 mg de BPA/g de papel (Geens et al., 2012). Lu e os seus colaboradores, verificaram também a presença de BPA num total de 42 recibos de supermercado, na China. O BPA foi detetado em todas as amostras com concentrações entre 2.58-14.7 mg g-1 e a ingestão diária estimada por manipulação dos
recibos de supermercado foi em média 40.4 µg dia-1 para um operador de caixa e 0.69 µg dia-1
para a população em geral (Lu et al., 2013). Como as pessoas colocam os recibos que contêm elevadas concentrações de BPA junto do dinheiro, o BPA pode ser transferido para este e mais amplamente difundido durante o uso do dinheiro contaminado com BPA (Fan et al., 2015). Para além disso, no processo de reciclagem do papel térmico pode ocorrer a contaminação de outros papéis que anteriormente não estavam contaminados (Geens et al., 2012). Os filtros de cigarros também contêm níveis relativamente elevados de BPA, sendo para além das poeiras uma fonte de exposição através da inalação (Vandenberg et al., 2013).
Estudos no homem, têm demonstrado concentrações elevadas de BPA na urina e em outras matrizes biológicas como o soro e plasma (Fan et al., 2015, Mileva et al., 2014). Ensaios de biomonitorização descobriram que 92.6% da população dos EUA tem níveis detetáveis de BPA na urina (Calafat et al., 2008). Zhang e os seus colaboradores, determinaram a concentração de BPA total na urina (livre e conjugado) em 296 amostras de urina recolhidas na população em geral em sete países da Ásia (China, Índia, Japão, Coreia, Kuwait, Malásia e Vietname). O BPA foi detetado em 94.3% das amostras analisadas, em concentrações que variam entre <0.1-30.1 ng/mL (Zhang et al., 2011). Uma revisão de dados publicados, de mais de 80 estudos, sobre a exposição humana ao BPA indicou que a concentração de BPA no sangue humano (soro e plasma) estava entre 0.3-4.4 ng/mL (Vandenberg et al., 2007). Também é encontrado no plasma fetal, placenta e leite materno (Bhandari et al., 2015, Vandenberg et al., 2007). As medições de BPA no soro materno, soro fetal, sangue do cordão umbilical, líquido amniótico e placenta indicam que o feto em desenvolvimento pode estar exposto ao BPA numa gama entre 1-3 ng/mL (Vandenberg et al., 2007). O BPA tem sido detetado também em compartimentos ambientais, como por exemplo, na água, em águas residuais, sedimentos e biota (Geens et al., 2011). Os DE apresentam curvas de dose-resposta não monotónicas (Mileva et al., 2014). No caso do BPA a curva dose-resposta apresenta-se em forma de U ou em forma de U invertido. Nesta curva, são observados efeitos em doses muito baixas e em doses elevadas, mas em doses intermédias não existem efeitos observáveis (Casals-Casas and Desvergne, 2011).
19
20
Um estudo prévio de microarrays transcritómicos realizado para avaliar o efeito das hormonas sexuais no transcritoma do CP de rato, demonstrou que os genes da via de sinalização do paladar são expressos nesta estrutura cerebral, e que são regulados por estas hormonas esteroides. Considerando ainda que o BPA é um desregulador endócrino que mimetiza o efeito das hormonas esteroides, conhecido pela sua exposição contínua ao ser humano, surgiram os objetivos deste trabalho:
A) Validar os resultados obtidos no estudo de microarrays, no que diz respeito à regulação estrogénica dos genes relacionados com a via de transdução do paladar, tendo como objetivos específicos:
A.1) Analisar o efeito do E2 na expressão dos genes da via de sinalização do paladar e esclarecer o seu mecanismo de atuação. Para isso, pretende-se realizar ensaios com CPs de ratos Wistar Han recém-nascidos, e aplicar estímulos de E2 a diferentes concentrações com e sem pré-tratamento com ICI;
A.2) Alargar o estudo da regulação da via de transdução do paladar pelos estrogénios, realizando experiências in vivo, com ratos Wistar Han fêmeas OVX e
Sham com dois meses de idade.
B) Estudar o efeito do BPA na expressão génica da via de transdução do paladar, r