Braz. J. of Develop.,Curitiba, v. 6, n.5, p. 23060-23074 may. 2020. ISSN 2525-8761
Efeito larvicida e ovocida de extratos de Crotalaria pallida sobre o vetor
Aedes aegypti
Larvicidal and ovocidal effects of Crotalaria pallida extracts on the vector
Aedes aegypti
DOI:10.34117/bjdv6n5-019Recebimento dos originais: 15/04/2020 Aceitação para publicação: 04/05/2020
Beatriz Ayumi Takagi
Licenciada em Ciências Biológicas pela Universidade Federal de Mato Grosso do Sul Instituição: Universidade Federal de Mato Grosso do Sul - Campo Grande.
Endereço: Avenida Ranulpho Marque Leal, 3484, Vila Industrial, Três Lagoas-MS, Brasil E-mail: biaayumitakagi@gmail.com
Taiana Gabriela Barbosa de Souza
Acadêmica de Medicina pela Universidade Federal de Mato Grosso do Sul Instituição: Universidade Federal de Mato Grosso do Sul- Campus Três Lagoas Endereço: Avenida Ranulpho Marque Leal, 3484, Vila Industrial, Três Lagoas-MS, Brasil
E-mail: taianatati@hotmail.com
Mirian Daiane de Oliveira
Acadêmica de Medicina pela Universidade Federal de Mato Grosso do Sul Instituição: Universidade Federal de Mato Grosso do Sul- Campus Três Lagoas Endereço: Avenida Ranulpho Marque Leal, 3484, Vila Industrial, Três Lagoas-MS, Brasil
E-mail: mirianoliver2006@hotmail.com
Luís Gustavo Bernardes
Bacharel em Farmácia e Bioquímica pela Universidade Paulista - UNIP Instituição: Universidade Federal de Mato Grosso do Sul- Campus Três Lagoas Endereço: Avenida Ranulpho Marque Leal, 3484, Vila Industrial, Três Lagoas-MS, Brasil
E-mail: gustavo.bernardes@ufms.br
Juliano Yasuo Oda
Doutor em Patologia Experimental pela Universidade Estadual de Londrina - UEL Instituição: Universidade Federal de Mato Grosso do Sul- Campus Três Lagoas Endereço: Avenida Ranulpho Marque Leal, 3484 Vila Industrial Três Lagoas-MS Brasil
E-mail: juliano.yasuo@ufms.br
Aline Rafaela da Silva Rodrigues Machado
Doutora em Clínica Médica- Investigação Biomédica pela Faculdade de Medicina de Ribeirão Preto - Universidade de São Paulo
Instituição: Universidade Federal de Mato Grosso do Sul- Campus Três Lagoas Endereço: Avenida Ranulpho Marque Leal, 3484 Vila Industrial Três Lagoas-MS Brasil
Braz. J. of Develop.,Curitiba, v. 6, n.5, p. 23060-23074 may. 2020. ISSN 2525-8761 Alex Martins Machado
Doutor em Imunologia Básica e Aplicada- Bioagentes Patogênicos pela Faculdade de Medicina de Ribeirão Preto - Universidade de São Paulo
Instituição: Universidade Federal de Mato Grosso do Sul- Campus Três Lagoas Endereço: Avenida Ranulpho Marque Leal, 3484, Vila Industrial, Três Lagoas-MS, Brasil
E-mail: alex.machado@ufms.br
RESUMO
A resistência aos inseticidas tem causado dificuldades no controle do Aedes aegypti estimulando à busca por compostos larvicidas naturais. A Crotalaria pallida, conhecida popularmente por Chique-Chique e por sua ação repelente, ainda carece de dados científicos quanto à suas propriedades. Objetivou-se então verificar o potencial larvicida/ovocida desta planta em A. aegypti. Folhas de C. pallida foram submetidos a extração com solventes: Acetato de Etila (AcEt), Hexano (Hex) Etanol (EtOH) e Metanol (MetOH). A ação larvicida foi determinada com 15 larvas (L2, cepa Rockefeller) através do contato com cada extrato (500, 250; 125; 62,5; 31,25 mg/L diluídos em dimetilsulfóxido (DMSO) por 24 horas (testes em triplicata) com posterior determinação da dose letal (DL90 e DL50). A DL50 foi utilizada para determinação da ação larvicida nos diferentes instars larvais para os extratos com maior letalidade. Para a analise ovocida, ovos foram colocados em contato com os compostos (MetOH e EtOH a 500 mg/L) por 10 minutos e transferidos posteriormente para água limpa para eclosão (Teste de contato). Também foram deixados ovos para eclosão em água contendo 500 mg/L dos extratos (Teste de eclosão). Todos os resultados foram submetidos a análise estatística. Observou-se melhor ação larvicida, com morte de 100% e 88,8%, nos compostos MetOH e EtOH respectivamente na concentração de 500 mg/L. Observou-se ainda uma maior letalidade nos primeiros instars larvais dos compostos MetOH e EtOH comparados aos instar larvais mais maduros. Ambos extratos também inibiram a eclosão dos ovos em 95% e 90% no teste de contato e 100% no teste de eclosão. As análises estatísticas mostraram significância entre a concentração do extrato e a mortalidade das larvas. Conclui-se que se trata de um resultado promissor no combate ao vetor A. aegypti.
Palavras-chave: a) Crotalaria pallida b) Controle vetorial c) Dengue
ABSTRACT
Insecticide resistance has caused difficulties in controlling Aedes aegypti, stimulating the search for natural larvicide compounds. Crotalaria pallida, popularly known as Chique-Chique and for its repellent action, still lacks scientific data regarding its properties. The objective was to verify the larvicidal/ovocidal potential of this plant in A. aegypti. C. pallida leaves were subjected to extraction with solvents: Ethyl Acetate (AcEt), Hexane (Hex) Ethanol (EtOH) and Methanol (MetOH). Larvicidal action was determined with 15 larvae (L2, Rockefeller strain) through contact with each extract (500, 250; 125; 62.5; 31.25 mg/L diluted in dimethyl sulfoxide (DMSO) for 24 hours (triplicate tests)) with subsequent determination of the lethal dose (DL90 and DL50) .The LD50 was used to determine the larvicidal action in the different larval instars for the extracts with greater lethality. at 500 mg/L) for 10 minutes and subsequently transferred to clean water for hatching (Contact Test). Eggs were also hatched in water containing 500 mg/L of the extracts (Hatching test). All results were subjected to statistical analysis, a better larvicidal action was observed, with death of 100% and 88.8%, in the compounds MetOH and EtOH, respectively, at a concentration of 500 mg/L.
Braz. J. of Develop.,Curitiba, v. 6, n.5, p. 23060-23074 may. 2020. ISSN 2525-8761 An even greater lethality was observed in the first larval instars of the compounds MetOH and EtOH c compared to urging more mature larvae. Both extracts also inhibited the hatching of eggs by 95% and 90% in the contact test and 100% in the hatching test. Statistical analyzes showed significance between extract concentration and larval mortality. It is concluded that this is a promising result in the fight against the vector A. aegypti.
Keywords: a) Crotalaria pallida b) Vector control c) Dengue
1 INTRODUÇÃO
Os mosquitos são os principais vetores para a transmissão de muitas doenças vetoriais, incluindo dengue, febre amarela, e outras, causando milhões de mortes todos os anos (Peng et al. 1999).
O Aedes aegypti é geralmente conhecido como vetor para arbovírus responsável pela transmissão da Dengue, Zika e Chikungunya, sendo a dengue endêmica em grande parte do mundo, tornando-se um grave problema de saúde pública. Este mosquito vive em média 30 dias e a fêmea após o repasto sanguíneo, deposita entre 150 a 200 ovos, que, após a eclosão, gera as larvas que passam por quatro fases evolutivas (L1 a L4) e posteriormente transformam-se em pupa que dará origem ao mosquito adulto. Em condições favoráveis a transição ocorre em média de sete a dez dias (Anjolette e Marcoris 2016).
A manutenção dos arbovírus na natureza ocorre através de ciclos silvestres com participação de vertebrados silvestres (roedores, primatas, aves e outros) e invertebrados hematófagos (mosquitos, carrapatos, ácaros, simulídeos e tabanídeos). Outro mecanismo para manutenção dos arbovírus nesses vetores é a transmissão transovariana, como ocorre com os vírus YFV e DENV (Vasconcelos et al. 2005, Figueiredo 2007, Gubler 2007).
As infecções por arbovírus podem apresentar distintas formas clínicas, sendo as mais comuns: a doença febril; doença febril com exantema, febre hemorrágica e encefalite, entretanto, muitos sinais e sintomas inespecíficos podem ser observados, principalmente na fase aguda da doença (Vasconcelos et al. 2005).
Em termos epidemiológicos, os vírus dengue, pertencentes a família Flaviviridae (gênero Flavivirus) são responsáveis por 8 de cada 10 casos de arboviroses no país, podendo produzir surtos epidêmicos esporádicos ou até mesmo, grandes epidemias. Dentro do grupo do vírus Dengue, 4 sorotipos distintos são encontrados: DENV-1, DENV-2, DENV-3 e DENV-4, os quais são antigénica e filogeneticamente distintos. Estes sorotipos possuem o mesmo mecanismo de transmissão e causam doença humana com manifestações clínicas semelhantes (Mackenzie et al. 2004)
Braz. J. of Develop.,Curitiba, v. 6, n.5, p. 23060-23074 may. 2020. ISSN 2525-8761 A febre da dengue tornou-se um importante problema de saúde pública, pois o número de casos notificados continua aumentando, principalmente com formas mais graves da doença (Pancharoen et al. 2002). Possui uma média de 390 milhões de infecções anuais em todo o mundo, causando até 2,7 milhões de mortes. Dessa forma, a doença permanece endêmica em mais de 100 países tropicais em desenvolvimento, e seu controle é um objetivo principal para melhorar a saúde mundial (OPAS 2019)
No Brasil, no ano de 2019, observou-se um aumento de 339,9% dos casos de dengue, quando comparados aos casos ocorridos no ano de 2018, sendo que o estado de Mato Grosso do Sul foi o segundo estado com maior incidência de Dengue no país com 697,9 casos por cada 100 mil habitantes (Brasil, 2019).
Por tratar-se de uma infecção vetorial, muito se tem investido no controle dos mosquitos vetores, porém estas medidas vêm tornando-se cada vez mais difíceis devido ao uso indiscriminado de inseticidas químicos sintéticos, que têm um impacto adverso sobre o ambiente perturbando o equilíbrio ecológico. A maioria destes pesticidas químicos são prejudiciais ao homem e aos animais, alguns dos quais não são facilmente degradáveis no ambiente e podem gerar graves efeitos tóxicos (Oliveira, 2017)
Gosh, já em 1991, demonstrava efeitos irreversíveis de danos renais e hepáticos em animais contaminados com estes pesticidas, além de demonstrar mutação de genes as quais foram observadas somente após algumas gerações. Hoje em dia, inseticidas químicos amplamente utilizados, contém piretróides sintéticos e outros compostos organofosforados que podem causar efeitos colaterais como: problemas respiratórios, irritação ocular, dor de cabeça, asma, coceira e espirros, além de graves efeitos sistêmicos para os usuários (Nicolopoulou-Stamati, 2016; Oliveira, 2017).
Devido a estes efeitos tóxicos e ao constante aumento de mosquitos resistentes aos tratamentos químicos, destaca-se a necessidade do desenvolvimento de novas estratégias para um controle seletivo dos mesmos. Assim, extratos ou óleos essenciais de plantas podem ser fontes alternativas de controle para larvas de mosquitos, uma vez que constituem uma rica fonte de compostos bioativos e biodegradáveis, e de baixa toxicidade, tornando-se potencialmente adequados como bioinseticidas. De fato, observa-se na literatura vários relatos da eficácia de extratos de plantas ou óleos essenciais contra larvas de mosquitos (Amer e Mehlhorn 2006; Govindarajan 2010a).
Eles podem ser obtidos a partir da planta inteira ou parte dela, por meio de extração com diferentes tipos de solventes, podendo ter toxicidade para as formas adultas do mosquito
Braz. J. of Develop.,Curitiba, v. 6, n.5, p. 23060-23074 may. 2020. ISSN 2525-8761 (inseticida), para os estágios larvais (larvicidas), inibindo o crescimento e diferenciação das mesmas, bem como inibindo a maturação e/ou eclosão dos ovos (ovocida). Além disso, podem produzir estímulos olfativos que atuam como repelente de insetos adultos. Assim, os fitoquímicos mostram-se vantajosos devido principalmente à sua especificidade, segurança, baixo desenvolvimento de resistência, redução no número de aplicações, maior aceitabilidade e adequação para áreas rurais (Markouk et al. 2001).
Tendo em vista o crescente interesse no desenvolvimento de inseticidas de origem vegetal como alternativa ao inseticida químico, este estudo foi realizado para avaliar o potencial larvicida e ovicida de extratos brutos de Crotalaria pallida contra o vetor Aedes aegypti. Esta planta, pertencente à família Fabaecae, sendo nativa do Brasil e encontrada em quase todos os estados. Tem porte herbáceo, folhas medianas elípticas com ápice agudo, venação pinada, trifolioladas; flores do tipo flor zigomórfica pentâmera vexilar (flor tipo papilionáceo), alternas-espiraladas em um eixo central, a, possui tom amarelado, podendo ter marcações em tons de marrom-avermelhado; possui em torno de dez estames livres ou soldados (dependendo da variedade), pistilo unicarpelar onde forma o fruto do tipo legume após a fecundação. Apesar de alguns espécimes serem utilizados como alimentação animal, existem controvérsias de sua utilização devido a sua toxicidade em ovinos e bovinos (Peixoto, et al., 2018).
2 MATERIAL E MÉTODOS 2.1 COLETA DAS PLANTAS
Folhas totalmente desenvolvidas de Crotallaria pallida foram coletadas no período matutino, em um terreno a céu aberto, localizado no bairro Jardim Alvorada, no município de Três Lagoas. A espécie da planta foi confirmada através de chaves de identificação botânica. Posteriormente as folhas foram higienizadas com solução de hipoclorito de sódio por cerca de 10 minutos e lavadas com água corrente e água destilada para remoção de qualquer impureza. Após o processo de higienização as folhas foram secas por 3 dias a 40ºC e posteriormente moídas em moinho de facas até virar um pó uniforme.
2.2 EXTRAÇÃO
Foram utilizadas 15 gramas do pó obtido colocado em 225 mL de substância extratora: Acetato de Etila (AcET), Hexano (Hex), Etanol (EtOH) e Metanol (MetOH). A mistura foi agitada 3 vezes ao dia por 7 dias, e após este período filtrada em papel filtro e rotaevaporado
Braz. J. of Develop.,Curitiba, v. 6, n.5, p. 23060-23074 may. 2020. ISSN 2525-8761 com pressão reduzida e em banho-maria à 45ºC. O resíduo obtido foi então armazenado em geladeira a 4ºC e utilizado para obtenção de diferentes concentrações (diluídas em DMSO) para realização dos testes larvicidas e ovicidas.
2.3 ORGANISMO DE TESTE
Os mosquitos Aedes aegypti (linhagem Rockfeller) foram criados no anexo do laboratório de Virologia e Cultura Celular da Universidade Federal de Mato Grosso do Sul (UFMS) campus Três Lagoas. As larvas foram alimentadas com ração para gatos triturada e fermento em pó na proporção 3: 1. Os adultos receberam solução de sacarose a 10% e as fêmeas repasto sanguíneo através de sistema descrito por Anjolette e Marcoris 2016. Mosquitos foram mantidos a 27 ± 2 ° C, 70-85% de umidade relativa, com uma foto período de 12 horas claro e 12 horas escuro.
2.4 BIOENSAIO LARVICIDA
Lotes de 15 larvas (L2), em triplicata, foram transferidos para copos plásticos descartáveis, contendo, cada grupo, diluições do extrato nas concentrações de 500, 250, 125, 62,5 e 32,25 mg/L. Concomitantemente uma triplicata foi realizada como teste negativo, contendo somente água e solução diluente do resíduo (DMSO), na mesma concentração que os testes. O valor de DL50 e DL90 foi calculado após 24 horas por análise probit (Finney 1979). Posteriormente, utilizando-se o valor obtido da DL50, foram testados a letalidade dos compostos frente aos diferentes instars larvais, sendo este realizado somente com os dois compostos com melhor letalidade no teste anterior e utilizando lotes de 50 larvas de cada instar em triplicata (MetOH e EtOH)
2.5 ATIVIDADE OVOCIDA
Os ovos de Aedes aegypti, foram coletados 24 horas após cada repasto sanguíneo. Para a análise ovocida, ovos foram colocados em contato com os compostos (MetOH e EtOH a 500 µg/ml) por 10 minutos e transferidos posteriormente para água limpa para eclosão (Teste de contato). Também foram deixados ovos para eclosão em água contendo 500 µg/ml dos extratos (Teste de eclosão). Cada experimento foi replicado três vezes, juntamente com controle apropriado. As taxas de eclosão foram avaliadas caapós 24 horas pós-tratamento.
Braz. J. of Develop.,Curitiba, v. 6, n.5, p. 23060-23074 may. 2020. ISSN 2525-8761 2.6 ANÁLISE ESTATÍSTICA
Os dados médios de mortalidade larval foram submetidos a análise de probit para determinação da DL50 e DL90 e limites de confiança superior e inferior à 95%. Os valores de significância foram determinados usando o SPSS12.0 (Software - Pacote Estatístico). Resultados com p <0,05 foram considerados estatisticamente significativo.
3 RESULTADOS
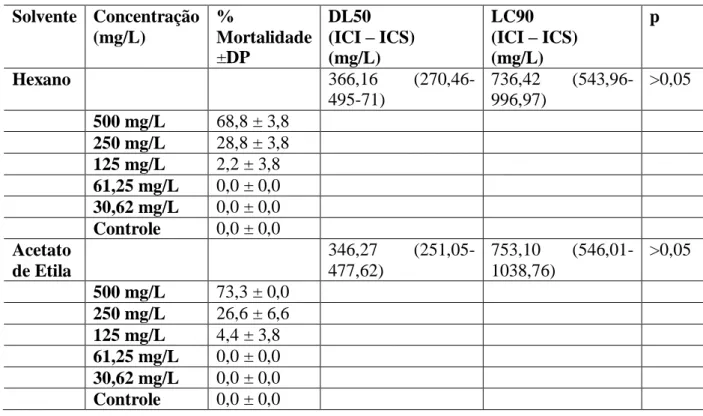
Observamos que o extrato a base de MetOH de C. pallida possui ação larvicida após 24 horas, com morte de 100% das larvas na concentração de 500 mg/L. O extrato EtOH também mostrou alta eficiência na morte das mesmas, com 90% de mortalidade na mesma concentração. As análises estatísticas mostraram significância entre a concentração do extrato, e a mortalidade das larvas (Tabela 1). A DL50 e DL90 foram de 245,79 e 486,52 mg/L respectivamente para MetOH e 262,02 e 615,11 mg/L respectivamente para EtOH.
Os extratos Hex e AcEt mostraram menor ação larvicida, com 68,8% e 73,3% de mortalidade respectivamente na concentração de 500 mg/L. Não foi encontrada significância estatística entre as concentrações e mortalidade.
Tabela 1. Porcentagem de letalidade de extratos de C. pallida sobre larvas de A. aegypti, determinação da DL50 e DL90 e análise estatística da mortalidade.
Solvente Concentração (mg/L) % Mortalidade ±DP DL50 (ICI – ICS) (mg/L) LC90 (ICI – ICS) (mg/L) p Hexano 366,16 (270,46-495-71) 736,42 (543,96-996,97) >0,05 500 mg/L 68,8 ± 3,8 250 mg/L 28,8 ± 3,8 125 mg/L 2,2 ± 3,8 61,25 mg/L 0,0 ± 0,0 30,62 mg/L 0,0 ± 0,0 Controle 0,0 ± 0,0 Acetato de Etila 346,27 (251,05-477,62) 753,10 (546,01-1038,76) >0,05 500 mg/L 73,3 ± 0,0 250 mg/L 26,6 ± 6,6 125 mg/L 4,4 ± 3,8 61,25 mg/L 0,0 ± 0,0 30,62 mg/L 0,0 ± 0,0 Controle 0,0 ± 0,0
Braz. J. of Develop.,Curitiba, v. 6, n.5, p. 23060-23074 may. 2020. ISSN 2525-8761 Etanol 262,02 (189,89-361,55) 615,11 (445,78-848,77) <0,05 500 mg/L 88,8 ± 10,1 250 mg/L 28,8 ± 7,6 125 mg/L 17,7 ± 3,8 61,25 mg/L 0,0 ± 0,0 30,62 mg/L 0,0 ± 0,0 Controle 0,0 ± 0,0 Metanol 245,79 (134,43-449,40) 486,52 (418,03-781,32) <0,05 500 mg/L 100 ± 0,0 250 mg/L 48,8 ± 7,6 125 mg/L 35,5 ± 3,8 61,25 mg/L 17,7 ± 3,8 30,62 mg/L 0,0 ± 0,0 Controle 0,0 ± 0,0
Os extratos, com maior letalidade no teste anterior (MetOH e EtOH) foram utilizados em DL50 para medição da mortalidade sobre os diferentes instars larvais. Observou-se semelhante ação larvicida, entre ambos compostos, sobre os diferentes instars, porém maior letalidade nos instars L1 e L2 comparados aos outros instars larvais (p<0,05) (Figura 1).
Figura 1. Letalidade nos diferentes instars larvais de A. aegypti submetidos a extratos MetOH e EtOH (DL50), mostrando a variação de letalidade em cada instar.
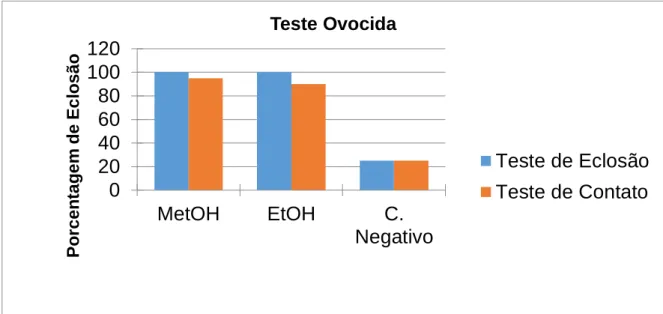
Braz. J. of Develop.,Curitiba, v. 6, n.5, p. 23060-23074 may. 2020. ISSN 2525-8761 Ambos extratos inibiram a eclosão dos ovos em 95% (MetOH), 90% (EtOH) no teste de contato e 100% no teste de eclosão (Figura 2).
Figura 2. Teste ovocida de eclosão e de contato, com extratos MetOH e EtOh (500 mg/L)
4 DISCUSSÃO
Atualmente é de suma importância a segurança ambiental na fabricação e produção de inseticidas, não sendo necessário causar alta mortalidade em organismos-alvo para ser aceitável, porém precisa ser bastante específico ao seu organismo-alvo e possuir baixa toxicidade tanto para animais como humanos (Kabaru e Gichia 2001).
Dessa forma, os fitoquímicos podem servir como alternativas viáveis para inseticidas sintéticos no futuro, pois são considerados relativamente seguros e baratos além de disponíveis em muitas regiões do mundo. Bowers e colaboradores (1995) afirmam que a triagem de plantas medicinais disponíveis localmente para controle de mosquitos, geraria emprego local, reduziria a dependência de produtos importados caros e estimularia os esforços locais para melhorar a saúde pública.
Diferentes partes das plantas podem ser utilizadas na busca por compostos bioativos, já que muitas destas possuem complexos de produtos químicos com atividade biológica única gerados devido a toxinas e metabólitos secundários que podem atuar como agentes anti-larvais (Govindarajan et al. 2010b, Niraimathi et al. 2010). Nosso resultado mostrou que os extratos metanólicos e etanólicos brutos de folhas de Crotalaria pallida (Fabales-Fabaceae) possuem propriedades larvicidas e ovicidas contra um importante vetor arbovirídico, o Aedes aegypti.
0 20 40 60 80 100 120 MetOH EtOH C. Negativo Po rc e n ta g e m d e Ec lo s ã o Teste Ovocida Teste de Eclosão Teste de Contato
Braz. J. of Develop.,Curitiba, v. 6, n.5, p. 23060-23074 may. 2020. ISSN 2525-8761 O resultado obtido neste trabalho também é comparável a relatos presentes na literatura científica que mostram a detecção de substâncias com ações larvicidas e ovicidas em extratos de diferentes plantas. Rajkumar e Jebanesan (2004) analisando a função larvicida de extratos etanólicos de Cassia obtusifolia, uma planta herbácea da família das leguminosas, observou alta letalidade em larvas de Anopheles sp, Aedes aegypti e Aedes togoi, com uma DL50 e DL90 de 52,2 e 2 108,7 mg/L respectivamente. No mesmo ano, Govindarajan (2009) analisando outras espécies de Cassia sp. (Fabales-Fabaceae) mostrou ampla ação larvicida de extratos metanólicos e etanólicos da folha desta planta quando comparado a extratos benzênicos e acetônicos, com uma DL50 de 23,95 mg/L.
Porto e colaboradores (2017) estudando o efeito larvicida de extratos de mais de 40 plantas nativas do Brasil contra Aedes aegypti mostraram que os extratos com maior letalidade eram os obtidos com solventes metanólicos e etanólicos, principalmente quando as extrações dos produtos eram realizadas a partir das folhas das plantas. Destas 40 plantas analisadas, 10 mostraram efeito larvicida, sendo o extrato etanólico de Piper hispidum (Piperales- Piperaceae) Sw. O extrato com maior letalidade e menor DL50 (169 mg/L).
Estudos semelhantes realizados por Cavalheiro e colaboradores (2009) analisando as propriedades de extratos de Caesalpina férrea (Fabales-Fabaceae) também observou atividade larvicida com 85% de eficiência contra vetores A. aegypti.
Observamos níveis de letalidade semelhantes de extratos das plantas mencionadas com os obtidos em nosso trabalho, entretanto, é possível notar que estas, possuem DLs50 menores que as obtidas para C. pallida.
Barbosa e colaboradores (2014), estudando os efeitos antilarvais de plantas do bioma de Caatinga, observaram que extratos aquosos de Crotalaria retusa, uma outra espécie do gênero Crotalaria, apresentavam 100% de letalidade contra larvas de A. aegypti, porém com um DL50 de 14.510 mg/L, sendo esta muito superior à obtida em nossos experimentos. Neste estudo verificou-se 100% letalidade de larvas utilizando o extrato de Myracrodruon urundeuva (Sapindales-Anacardiaceae) com uma DL50 de 330 mg/L, sendo esta concentração semelhante a obtida em nosso trabalho.
Os mesmos autores analisando a capacidade larvicida do extrato aquoso de Crotalaria retusa observaram diferenças significativas entre a mortalidade exercida sobre as larvas L1 quando comparadas as larvas L4, nas quais a porcentagem de letalidade não ultrapassou 26,4%. Muitas das plantas com ação larvicida, diminuíam significativamente sua capacidade
Braz. J. of Develop.,Curitiba, v. 6, n.5, p. 23060-23074 may. 2020. ISSN 2525-8761 letal quanto mais madura tornava-se a larva (L4), sendo necessárias concentrações cada vez mais alta do composto para eliminação destas.
Rahuman e colaboradores (2009) também demonstraram diferença significativa na letalidade de compostos metanólicos de Canna indica (Zingiberales-Cannaceae) em larvas L2 e L4. Assim, a concentração DL50 em larvas do quarto instar foi quatro vezes maior que a DL50 para larvas do segundo instar.
Ensaios larvicidas conduzidos com larvas do primeiro e quarto instar tem mostrado diferentes susceptibilidades dos estágios larvais aos compostos estudados, onde larvas L1 demonstram ser mais susceptíveis que as larvas em instars superiores (Murungan et al. 2007, Coelho et al. 2009, Patil et al. 2011 e Gupta et al. 2011). Em todos estes estudos a mortalidade em larvas L1 foi de 100%, enquanto que em estágios superiores (L4) houve redução para 45% na mesma concentração, não sendo observada atividade letal nas pupas. Interessantemente, Barbosa e colaboradores analisando extratos de Crotalaria retusa (Fabales-Fabaceae), também não detectaram atividade letal do extrato sobre as pupas.
Nossos resultados também demonstram haver diferença na letalidade do extrato de Crotalaria pallida nos diferentes instars larvais, porém com maior letalidade nas larvas L1 e L2. Entretanto, o extrato mostrou menor letalidade sobre larvas L4 e especialmente sobre pupas. Diferentemente a nossos resultados, Souza e colaboradores (2011) relataram atividade pupicida em extratos etanólicos de sementes de A. cearenses, S. brasiliensis, M. urundeuva e P. moniliformis. Ainda, Souza e colaboradores (2011), bem como, Gupta e colaboradores (2011) afirmam que, como as pupas não se alimentam, os compostos com ação pupicida tem mecanismo de ação através da absorção pela superfície corporal ou causam danos nas trompas respiratórias. Assim, hipotetizamos que o composto ativo presente em nossos extratos não possue este tipo de mecanismo ação, e que deve atuar no trato digestivo das larvas e/ou sobre o seu epitélio.
Ainda, observa-se em nossos resultados uma efetiva capacidade ovocida dos compostos MetOH e EtOH de Crotalaria pallida tanto no teste de contato como no teste de eclosão. Todas estas características qualificam estes extratos como bons antilarvais/ovocidas, pois como mencionado por Kabaru e Gichia (2001) estes produtos devem ser capazes de interferir no ciclo de vida do vetor em seus diferentes estágios de maturação.
Finalmente vale destacar que resultados obtidos com extratos de plantas podem variar dependente da planta utilizada, período da coletada, clima (seco ou chuvoso), tipo de solo
Braz. J. of Develop.,Curitiba, v. 6, n.5, p. 23060-23074 may. 2020. ISSN 2525-8761 entre outros e, devido a isso, o isolamento do composto(s) ativo(s) a partir dos extratos é essencial para uma padronização futura como método de controle larval (Gupta et al. 2011).
5 CONCLUSÕES
Os resultados da atividade larvicida dos extratos analisados e suas frações, obtidos neste trabalho, foram significativos para o controle de A. aegypti, quando comparados a outros trabalhos pertinentes da literatura, para a mesma espécie de mosquito, com maior eficiência nos instars larvais L1 e L2. Além disso, os extratos apresentaram função ovocida significativa, diminuindo a capacidade de eclosão dos ovos.
Entretanto, faz-se necessárias análises adicionais com o propósito de isolar o composto ativo para controle larval e estudos que permitam elucidar a atividade ovocida contra esta espécie de mosquito, e o composto ativo responsável por esta atividade. É importante salientar que a flora do cerrado brasileiro tem uma rica diversidade de plantas com potencial para o desenvolvimento de recursos naturais inseticidas para controle de mosquitos e outras pragas. Assim, estes resultados podem incentivar a busca de novos compostos ativos naturais, como alternativa aos repelentes sintéticos e inseticidas.
REFERÊNCIAS
1. Amer A, Mehlhorn H. 2006. Larvicidal effects of various essential oils against Aedes, Anopheles and Culex larvae (Diptera: Culicidae). Parasitol Res 99:466–472.
2. Anjolette AFF, Marcoris MLG. 2016. Técnicas para manutenção de Aedes aegypti em laboratório. Boletim Epidemiológico Paulista 13(156): 19-29.
3. Barbosa PBBM, Oliveira JM, Chagas JM, Rabelo LMA, Medeiros GF, Giodani RB, Silva EA, Uchôa AF, Ximenes MFFM. 2014. Evaluation of seed extracts from plants found in the Caatinga biome for the control of Aedes aegypti. Parasitol Res 113(10): 3565-3580. 4. Brasil. 2019. Ministério da Saúde. Casos de Dengue no Brasil. Nota técnica.
5. Bowers WS, Sener B, Evans PH, Bingol F, Erdogan I. 1995. Activity of Turkish medicinal plants against mosquitoes Aedes aegypti and Anopheles gambiae. Insect Sci Appl 16(3/4): 339–342.
6. Cavalheiro MG, Farias DF, Fernandes GS, Nunes EP, Cavalcanti FS, Vasconcelos IMV, Melo VMM, Carvalho AFU. 2009. Atividades biológicas e enzimáticas do extrato aquoso de sementes de caesalpinia férrea mart. leguminosae. Braz j pharmacog 19: 586-591.
Braz. J. of Develop.,Curitiba, v. 6, n.5, p. 23060-23074 may. 2020. ISSN 2525-8761 7. Coelho JS, Santos NDL, Napoleão TH, Gomes FS, Ferreira RS, Zingali RB, Coelho
LCBB, Leite SP, Navarro DMAF, Paiva PMG. 2009. Effect of Moringa oleifera lectin on development and mortality of Aedes aegypti larvae. Chemosphere 77:934–938.
8. Figueiredo LT. 2007.Emergent arboviruses in Brazil. Rev Soc Bras Med Trop 40: 224-9. 9. Ghosh GK. 1991. Biopesticide and integrated pest management. A.P. H. Publishing
Corporation, New Delhi, p. 145–146.
10. Govindarajan M. 2009. Bioefficacy of Cassia fistula Linn. (Leguminosae) leaf extract against Chikungunya vector, Aedes aegypti (Diptera: Culicidae). Eur Rev Med Pharmacol Sci 13(2): 99–103.
11. Govindarajan M. 2010a. Larvicidal efficacy of Ficus benghalensis L. plant leaf extracts against Culex quinquefasciatus Say, Aedes aegypti L. and Anopheles stephensi L. (Diptera: Culicidae). Eur Rev Med Pharmacol Sci 14:107–111.
12. Govindarajan M. 2010b. Chemical composition and larvicidal activity of leaf essential oil from Clausena anisata (Willd.) Hook. f. ex Benth (Rutaceae) against three mosquito species. Asian Pac J Trop Med 3:874–877.
13. Gubler DJ. 2002. The global emergence/resurgence of arboviral diseases as public health problems. Arch. Med. Res. 33(4): 330-42.
14. Gupta L, Deshpande S, Tare V, Sabharwal S. 2011. Larvicidal activity of the a-amylase inhibitor from the seeds of Macrotyloma uniflorum (Leguminosae) against Aedes aegypti (Diptera: Culicidae). Int J Trop Insect Sci 31:69–74.
15. Kabaru JM, Gichia L. 2001. Insecticidal activity of extracts derived from different parts of the mangrove tree Rhizophora mucronata (Rhizophoraceae) Lam. against three arthropods. Afr J Sci Technol 2(2):44–49.
16. Mackenzie JS, Gubler DJ, Petersen LR. 2004. Emerging flaviviruses: the spread and resurgence of Japanese encephalitis, West Nile and Dengue viruses. Nat med 10(12): 98-109.
17. Markouk M, Bekkouche K, Larhsini M, Bousaid H, Lazrek HB, Jana M. 2001. Evaluation of some Moroccan medicinal plant extracts for larvicidal activity. J Ethnopharmacol 73:293–297.
18. Murugan K, Murugan P, Noortheen A. 2007. Larvicidal and repellent potential of Albizzia amara Boivin and Ocimum basilicum Linn. against dengue vector, Aedes aegypti (Insecta: Diptera: Culicidae). Bioresour Technol 98:198–201.
Braz. J. of Develop.,Curitiba, v. 6, n.5, p. 23060-23074 may. 2020. ISSN 2525-8761 19. Nicolopoupou-Stamati P, Maipas S, Kotampase C, Stamatis P, Hens L. 2016. Chemical
pesticides and human health: the urgent need for a new concept in agriculture. Front Public Health 4(148): 25-32.
20. Niraimathi S, Balaji N, Venkataramanan N, Govindarajan M. 2010. Larvicidal activity of alkaloid from Sida acuta against Anopheles subpictus and Culex tritaeniorhynchus. Int J Curr Res 11:034–038.
21. Oliveira, SR; Caleffe RRT; Conte H. 2017. Chemical control of Aedes aegypti: a review on the enviroment and human health. Revista Eletrônica em Gestão, Educação e Tecnologia Ambiental (REGET) 21(3):240-247.
22. OPAS – Organização Panamericana de Saúde. 2019. Number of reported cases of Dengue & Dengue Hemorrhagic Fever (DHF), region of the americas (by country and subregion). Disponivel em: http://www.paho.org/english/ad/dpc/cd/dengue-cases-2019.htm. Data de acesso: 18/10/2019.
23. Patil CD, Patil SV, Salunke BK, Salunkhe RB. 2011. Bioefficacy of Plumbago zeylanica (Plumbaginaceae) and Cestrum nocturnum (Solanaceae) plant extracts against Aedes aegypti (Diptera: Culicide) and nontarget fish Poecilia reticulate. Parasitol Res 108:1253– 1263
24. Peixoto PG, Fujita AT, Cardoso ACR. 2018. Eventual effectiveness of Crotalaria sp in combat to mosquito Aedes. Acta Biológica Brasiliensis, 1(1): 213-218.
25. Peng Z, Yang J, Wang H, Simons FER. 1999. Production and characterization of monoclonal antibodies to two new mosquito Aedes aegypti salivary proteins. Insect Biochem Mol Biol 29:909–914.
26. Porto KRA, Motti PR, Yano M, Roel AR, Cardoso CAL, Matias R. 2017. Screening of plants extracts and fractions on Aedes aegypti larvae found in the state of Mato Grosso do Sul (Linnaeus, 1762) (Culicidae). An Acad Bras Cienc 89(2): 895-906.
27. Rahuman AA, Bagavan A, Kamaraj C, Saravanan E, Zahir AA, Elango G. 2009. Efficacy of larvicidal botanical extracts against Culex quinquefasciatus Say (Diptera: Culicidae). Parasitol Res 104:1365–1372.
28. Rajkumar S, Jebanesan A. 2004. Mosquitocidal activities of octasane from Moschosma polystachyum Linn. (Lamiaceae). J Ethnopharm 90:87–89.
29. Souza TM, Farias DF, Soares BM, Viana MP, Lima GPG, Machado LKA, Morais SM, Carvalho AFU. 2011. Toxicity of Brazilian plant seed extracts to two strains of Aedes aegypti (Diptera: Culicidae) and nontarget animals. J Med Entomol 48:846–851.
Braz. J. of Develop.,Curitiba, v. 6, n.5, p. 23060-23074 may. 2020. ISSN 2525-8761 30. Vasconcelos PFC, Travassos da Rosa APA, Pinheiro FP, Travassos da Rosa JFS. 2005.
Arboviroses. Veronesi: tratado de infectologia. São Paulo: Atheneu, p. 289-302.