Universidade de Trás-os-Montes e Alto Douro
Implementação de novos protocolos anestésicos em
peixe-zebra
Dissertação de Mestrado Integrado em Medicina Veterinária
Enoque Angelino Cussama Diniz
Orientador: Professor Doutor Luís Miguel Joaquim Marques Antunes
Coorientador: Doutora Tânia Sofia Cordeiro Martins
Coorientador: Doutor Luís Manuel Lourenço Félix
Universidade de Trás-os-Montes e Alto Douro
Implementação de novos protocolos anestésicos em peixe-zebra
Dissertação de Mestrado Integrado em Medicina Veterinária
Enoque Angelino Cussama Diniz
Orientador: Professor Doutor Luís Miguel Joaquim Marques Antunes
Coorientador: Doutora Tânia Sofia Cordeiro Martins
Coorientador: Doutor Luís Manuel Lourenço Félix
Composição do Júri:
___________________________________________
___________________________________________
___________________________________________
ii Esta dissertação de mestrado foi redigida sem o novo acordo ortográfico. “As doutrinas apresentadas nesta dissertação são da inteira
iii
AGRADECIMENTOS e DEDICATÓRIAS
Agradeço à direcção do curso de Mestrado Integrado de Medicina Veterinária, aos Serviços Académicos e aos Serviços de Acção Social da UTAD por todo apoio e por toda a atenção prestada durante a formação.
Agradeço com profundo sentimento e reconhecimento a todos que desde a minha vinda à cidade de Vila Real e particularmente à UTAD, directa ou indirectamente não pouparam esforços em me ajudar e certamente ao longo destes anos partilharam comigo o desejo de alcançar este objectivo.
À Deus, a minha eterna fonte de inspiração, por não me desamparar em momento algum e por sentir sempre a sua presença, ainda não encontrei a palavra que expressa a medida do meu reconhecimento e gratidão, por tudo o que tem feito na minha vida e agora por esta grande bênção concedida.
Em particular e especial agradeço ao Professor Doutor Luís Antunes, meu orientador, por me aceitar como seu orientando mesmo antes de me conhecer e, pela disponibilidade e todos os ensinamentos e conselhos. Uma palavra de apreço e gratidão aos meus coorientadores, Doutora Tânia Martins pela orientação na componente estrutural, análise e interpretação estatística desta dissertação, Doutor Luís Félix pelo apoio incondicional em me acompanhar e orientar nos ensaios experimentais. À todos a minha gratidão pelo apoio e pela amizade.
Cumpre-me uma palavra de agradecimento, a todos os meus professores do curso de Mestrado Integrado de Medicina Veterinária (MIMV) pelos ensinamentos e disponibilidade durante o período de formação e aprendizagem.
A toda a equipa de profissionais em particular o corpo clínico do Hospital Veterinário de Trás-os-Montes e Alto Douro pelo contributo para a minha formação, pela simpatia com que fui recebido e por todos os ensinamentos.
Aos meus colegas e à associação de estudantes pela ajuda prestada durante o tempo de formação.
À minha mãe, por todo o apoio que sempre me deu durante todo o tempo desta formação, pelo acompanhamento sempre presente e todos os sacrifícios feitos em prol de mim ao longo da minha vida.
iv À minha esposa, aos meus queridos filhos por me fazerem sempre acreditar, que seria possível alcançar mais esta conquista que me parecia impossível e, pela grande disponibilidade, paciência e sacrifício durante este longo período de separação.
Finalmente, a toda a minha restante família, em especial aos meus irmãos, sobrinhos, primos e tios e amigos pelo encorajamento.
Dedico esta Dissertação de Mestrado Integrado em Medicina Veterinária, ao meu querido pai in memória, falecido dia 24/01/2015, oito dias após a minha chegada à cidade de Vila Real.
Aos meus filhos, para que façam desta dissertação um bom exemplo.
v
RESUMO
O presente estudo, foi desenvolvido para aplicação em peixe-zebra (Danio rerio), em virtude de existir pouca informação sobre protocolos anestésicos utilizados nesta espécie usada em laboratório. Nesse sentido foram avaliados pelo método de imersão os efeitos de diferentes anestésicos isolados e em combinação, com o objectivo de refinar um protocolo anestésico para uso no peixe-zebra adulto. Foram testados os seguintes protocolos anestésicos: 1,25 µg/mL propofol; 1,25 µg/mL propofol + 100 µg/mL lidocaína; 100 µg/mL cetamina; 100 µg/mL cetamina + 1,25 µg/mL medetomidina; 100 µg/mL cetamina + 1,25 µg/mL medetomidina + 3,125 µg/mL atipamezol; 2 µg/mL etomidato; 2 µg/mL etomidato + 100 µg/mL lidocaína; 100 μg/mL MS-222.
Durante o banho anestésico foram avaliados vários parâmetros tais como, a indução anestésica, a perda de sensibilidade a estímulos suaves e dolorosos, e a frequência respiratória. Foi também avaliada a recuperação dos animais após os banhos anestésicos.
A indução anestésica com os diversos protocolos mostrou inicialmente algumas alterações comportamentais nos animais. Estas alterações foram mais acentuadas quando os animais foram expostos à cetamina. Esta induziu uma actividade comportamental diferente nos peixes, passando por fases de excitação, com movimentos erráticos, acelerados e intensos em quase todas as direções, e com predomínio de movimentos circulares, antes de se atingir a fase de indução anestésica.
Em geral, todos os protocolos utilizados mostraram bons resultados. As formas combinadas de 1,25 µg/mL propofol + 100 µg/mL lidocaína, 100 µg/mL cetamina + 1,25 µg/ mL medetomidina e 2 µg/mL etomidato + 100 µg/mL lidocaína, foram os protocolos que induziram mais rapidamente um estado de anestesia cirúrgica aos peixes. De facto, foi a combinação 1,25 µg/mL propofol + 100 µg/mL lidocaína que produziu um resultado melhor, em proporcionar um bom estado de anestesia aos animais e com menos riscos, uma vez que, não baixou muito a frequência respiratória e proporcionou uma recuperação rápida dos animais após a anestesia, em comparação com a combinação 2 µg/mL etomidato + 100 µg/mL lidocaína. A recuperação pós-anestésica foi observada a partir do momento em que os animais foram transferidos para água sem anestésico, começaram a mover-se e até recuperarem totalmente o equilíbrio; controlando o tempo a cada 10 segundos. O MS-222 embora induza aversão em peixe-zebra, mostrou neste estudo ser o anestésico cuja recuperação foi mais rápida.
A frequência respiratória foi medida durante a avaliação dos reflexos e apresentou resultados mais baixos no momento da perda de equilíbrio e após a perda de reacção ao toque, principalmente nos protocolos com etomidato e etomidato+lidocaína.
vi Dada a importância do uso do peixe-zebra na investigação biomédica, e tendo em conta a existência de pouca informação sobre a adequação de protocolos anestésicos utilizados nesta espécie, o presente trabalho vem dar um contributo para o conhecimento dos efeitos de vários anestésicos isolados e em combinação no peixe-zebra (Danio rerio).
Palavras-chave:
Peixe-zebra, anestesia, propofol, lidocaína, cetamina, medetomidina, etomidato, recuperação.
vii
ABSTRACT
The present study was developed for application in zebrafish (Danio rerio), because there is little information regarding the use of anesthetic protocols in this species. The effects of different anesthetics, used isolated or in combination, were evaluated with the objective to refine anesthetic protocols for use in adult zebrafish. Animals were tested for: 1.25 µg/mL propofol; 1.25 µg/mL propofol + 100 µg/mL lidocaine; 100 µg/mL cetamine; 100 µg/mL cetamine + 1.25 µg/mL medetomidine; 100 µg/mL cetamine + 1.25 µg/mL medeto midine + 3.125 µg/mL atipamezole; 2 µg/mL etomidate; 2 µg/mL etomidate + 100 µg/mL lido caine; 100 µg/mL MS-222. Various parameters such as times for induction, the loss of sensitivity to soft and painful stimuli, recovery and respiratory rate were evaluated. The recovery and the activity of the animals after the anesthetic baths were also evaluated.
The anesthetic induction with the various protocols showed initially some behavioral changes in the animals. These alterations were more accentuated when the animals were exposed to ketamine. This induced a different behavioral activity in fish, going through phases of excitement, with erratic, rapid and intense movements in almost all directions, and with a predominance of circular movements, before reaching the stage of anesthesia induction.
In general, all protocols used showed good results. The combined forms of 1,25 µg/mL propofol + 100 µg/mL lidocaine, 100 µg/mL cetamine + 1.25 µg/mLmedetomidine and 2 µg/mL etomidate + 100 µg/mL lidocaine were protocols that induced fast surgical anesthesia state. However, the propofol+lidocaine combination showed to provide the best state of anesthesia and less dangerous, since the respiratory rate was less affected compared with 2 µg/mL etomidate + 100 µg/mL lidocaine, and provided a quick recovery after anesthesia. The post-anesthetic recovery was observed from the moment that the animals were transferred to water without anesthetic, start to move and to fully recover the balance; controlling the time every 10 seconds. Although the MS-222 induces aversion in zebrafish, it showed in this study that it is the anesthetic for which recovery was faster.
The respiratory rate was measured during the evaluation of the reflections and presented lower results at the time of loss of balance and after the loss of the touch reaction, especially in the protocols with etomidate and etomidate + lidocaine.
This work makes an important contribution to the knowledge of the effects of various single anesthetics and combinations in zebrafish.
Key words:
Zebrafish, anesthesia, propofol, lidocaine, cetamine, medetomidine, etomidate, recovery.
viii
ÍNDICE
ÍNDICE DE FIGURAS ... ix
ÍNDICE DE TABELAS ... xii
LISTA DE SIGLAS E ABREVIATURAS ... xiii
1. INTRODUÇÃO ...14 1.1 Contextualização ...14 1.2 Problema ...15 1.3 A anestesia em peixes ...15 1.4 Tipos de anestésicos ...17 1.4.1 Propofol ...17 1.4.2 Lidocaína ...18 1.4.3 Cetamina ...18 1.4.4 Medetomidina ...19 1.4.5 Etomidato ...21
1.4.6 Tricaína metano sulfonato-222 ...21
1.5 Objectivos do estudo ...22
2.1 Material ...23
2.2 Fármacos utilizados ...25
2.3 Animais ...27
2.4 Método de avaliação dos vários parâmetros ...27
2.5 Análise estatística ...30 3. RESULTADOS ...31 4. DISCUSSÃO ...43 5. CONCLUSÃO ...48 6. PERSPECTIVAS FUTURAS ...49 7. REFERÊNCIAS ...50 8. ANEXOS ...54
8.1 Anexo I: Modelo de ficha utilizada no Estudo. ...54
ix
ÍNDICE DE FIGURAS
Figura 1 Exemplo de peixes-zebra mantidos em aquários. ...23 Figura 2 Copos vidro graduados utilizados na preparação da anestesia por imersão. ...24 Figura 3 Material utilizado na preparação das doses dos anestésicos e na exploração de sensibilidades ao toque suave e à dor: A) micropipetas, B) pipetas de Pasteur e C) pinças.24 Figura 4 Exemplo de A) cronómetros e B) termómetros, utilizados no controlo do tempo e da temperatura da água. ...25 Figura 5 Exemplo dos fármacos usados no estudo. A) Propofol, B) Cetamina, C) Medetomidina, D) Etomidato, E) Atipamezol, e F) Lidocaína. ...26 Figura 6 Fluxograma do estudo e momentos de avaliação. ...28 Figura 7 Exemplo de A) perda de equilíbrio e de (B) estado de indução anestésica. ...29 Figura 8 Exploração da perda de reacção ao toque suave (A) e da perda de reacção à dor (B). ...29 Figura 9 Tempo de perda de equilíbrio no peixe-zebra após exposição a diferentes banhos anestésicos: 1,25 μg/mL Propofol; 1,25 μg/mL Propofol+100 μg/mL Lidocaína; 100 μg/mL Cetamina;100 μg/mL Cetamina+1,25 μg/mL Medetomidina; 2 μg/mL Etomidato; 2 μg/mL Etomidato+100 μg/mL Lidocaína; 100 μg/mL MS-222. Cada ponto representa um animal. Resultados expressos em média ± desvio padrão (n=8). ***p<0.001, diferente do Propofol; #p<0.05, ##p<0.01, ###p<0.001, diferente da Cetamina; §§p<0.01, diferente do Etomidato; $p<0.05, diferente do Etomidato+Lidocaína; αp<0.05, ααp<0.01, αααp<0.001, diferente do MS-222;Teste ANOVA de uma via seguido do teste de Tukey para comparações múltiplas. ...32 Figura 10 Tempo de indução anestésica no peixe-zebra após exposição a diferentes banhos anestésicos: 1,25 μg/mL Propofol; 1,25 μg/mL Propofol+100 μg/mL Lidocaína; 100 μg/mL Cetamina; 100 μg/mL Cetamina+1,25 μg/mL Medetomidina; 2 μg/mL Etomidato; 2 μg/mL Etomidato+100 μg/mL Lidocaína; 100 μg/mL MS-222. Cada ponto representa um animal. Resultados expressos em média ± desvio padrão (n=8). **p<0.01, ***p<0.001, diferente do Propofol; #p<0.01, ###p<0.001, diferente da Cetamina; §§p<0.01, diferente do Etomidato; ααp<0.01, diferente do MS-222; Teste de Kruskal-Wallis seguido do teste de Dunn para comparações múltiplas. ...33 Figura 11 Tempo de perda de reacção ao toque suave no peixe-zebra após exposição a diferentes banhos anestésicos: 1,25 μg/mL Propofol; 1,25 μg/mL Propofol+100 μg/mL Lidocaína; 100 μg/mL Cetamina; 100 μg/mL Cetamina+1,25 μg/mL Medetomidina; 2 μg/mL Etomidato; 2 μg/mL Etomidato+100 μg/mL Lidocaína; 100 μg/mL MS-222. Cada ponto representa um animal. Resultados expressos em média ± desvio padrão (n=8).; *p<0.05, ***p<0.001, diferente do Propofol; ##p<0.01, ###p<0.001, diferente da Cetamina; §p<0.05, §§p<0.01, diferente do Etomidato; Teste de Kruskal-Wallis seguido do teste de Dunn para comparações múltiplas. ...34
x Figura 12 Gráfico do tempo de perda de reacção à dor no peixe-zebra após exposição a diferentes banhos anestésicos: 1,25 μg/mL Propofol; 1,25 μg/mL Propofol+100 μg/mL Lidocaína; 100 μg/mL Cetamina; 100 μg/mL Cetamina+1,25 μg/mL Medetomidina; 2 μg/mL Etomidato; 2 μg/mL Etomidato+100 μg/mL Lidocaína; 100 μg/mL MS-222. Cada ponto representa um animal. Resultados expressos em média ± desvio padrão (n=8).; *p<0.05, **p<0.01, diferente do Propofol; ##p<0.01, diferente da Cetamina; §§p<0.01, diferente do Etomidato; Teste de Kruskal-Wallis seguido do teste de Dunn para comparações múltiplas. ...35 Figura 13 Frequencia respiratória após perda de equilíbrio no peixe-zebra, exposto a diferentes banhos anestésicos: 1,25 μg/mL Propofol; 1,25 μg/mL Propofol+100 μg/mL Lidocaína; 100 μg/mL Cetamina; 100 μg/mL Cetamina+1,25 μg/mL Medetomidina; 2 μg/mL Etomidato; 2 μg/mL Etomidato+100 μg/mL Lidocaína; 100 μg/mL MS-222. Cada ponto representa um animal. Resultados expressos em média ± desvio padrão (n=8). &p<0.05, &&p<0.01, diferente do Propofol+Lidocaína; #p<0.05, diferente da Cetamina; %p<0.05, diferente da Cetamina+medetomidina; αp<0.05, αααp<0.001, diferente do MS-222; Teste de Kruskal-Wallis seguido do teste de Dunn para comparações múltiplas. ...36 Figura 14 Frequência respiratória após perda de reacção ao toque suave no peixe-zebra, depois da exposição a diferentes banhos anestésicos: 1,25 μg/mL Propofol; 1,25 μg/mL Propofol+100 μg/mL Lidocaína; 100 μg/mL Cetamina; 100 μg/mL Cetamina+1,25 μg/mL Medetomidina; 2 μg/mL Etomidato; 2 μg/mL Etomidato+100 μg/mL Lidocaína; 100 μg/mL MS-222. Cada ponto representa um animal. Resultados expressos em média ± desvio padrão (n=8). &p<0.05, &&p<0.01, diferente do Propofol+Lidocaína; #p<0.05, diferente da Cetamina; %%%p<0.001, diferente da Cetamina+medetomidina; αp<0.05, ααp<0.01, diferente do MS-222; Teste de Kruskal-Wallis seguido do teste de Dunn para comparações múltiplas. ...37 Figura 15 Início dos movimentos no peixe-zebra na fase de recuperação após a exposiçãoa diferentes banhos anestésicos: 1,25 μg/mL Propofol; 1,25 μg/mL Propofol+100 μg/mL Lidocaína; 100 μg/mL Cetamina; 100 μg/mL Cetamina+1,25 μg/mL Medetomidina;100 μg/m L Cetamina+1,25 μg/mL Medetomidina/3,125 μg/mL Atipamezol; 2 μg/mL Etomidato; 2 μg/mL Etomidato+100 μg/mL Lidocaína; 100 μg/mL MS-222. Cada ponto representa um animal. Resultados expressos em média ± desvio padrão (n=8). **p<0.01, diferente do Propofol; &&p<0.01, &&&p<0.001, diferente do Propofol+Lidocaína; §p<0.05, diferente do Etomidato; $$p<0.01, diferente do Etomidato+Lidocaína; ααp<0.01, αααp<0.001, diferente do MS-222; Teste de Kruskal-Wallis seguido do teste de Dunn para comparações múltiplas. ...39 Figura 16 Recuperação do equilíbrio no peixe-zebra na fase de recuperação após exposição a diferentes banhos anestésicos: 1,25 μg/mL Propofol; 1,25 μg/mL Propofol+100 μg/mL Lidocaína; 100 μg/mL Cetamina;100 μg/mL Cetamina+1,25 μg/mL Med etomidina; 100 μg/mL Cetamina+1,25 μg/mL Medetomidina/3,125 μg/mL Atipamezol;
2 μg/mL Etomidato; 2 μg/mL Etomidato+100 μg/mL Lidocaína; 100 μg/mL MS-222. Cada ponto representa um animal. Resultados expressos em média ± desvio padrão (n=8). &&p<0.01, &&&p<0.001, diferente do Propofol+Lidocaína; $$p<0.01, diferente do Etomidato+Lidocaína; αααp<0.001, diferente do MS-222; Teste de Kruskal-Wallis seguido do teste de Dunn para comparações múltiplas. ...40
xi Figura 17 Actividade do peixe-zebra na fase de recuperação, 5 h após a exposição a diferentes banhos anestésicos: 1,25 μg/mL Propofol; 1,25 μg/mL Propofol+100 μg/mL Lidoca ína; 100 μg/mL Cetamina; 100 μg/mL Cetamina+1,25 μg/mL Medetomidina; 100 μg/mL Ceta mina+1,25 μg/mL Medetomidina/3,125 μg/mL Atipamezol; 2 μg/mL Etomidato;
2 μg/mL Etomidato+100 μg/mL Lidocaína; 100 μg/mL MS-222. Cada ponto representa um animal. Resultados expressos em média ± desvio padrão (n=4-8). ...41 Figura 18 Actividade do peixe-zebra na fase de recuperação, 24 h após a exposição a diferentes banhos anestésicos: 1,25 μg/mL Propofol; 1,25 μg/mL Propofol+100 μg/mL Lidocaína; 100 μg/mL Cetamina; 100 μg/mL Cetamina+1,25 μg/mL Medetomidina; 100 μg/mL Cetamina+1,25 μg/mL Medetomidina/3,125 μg/mL Atipamezol; 2 μg/mL Etomidato; 2 μg/mL Etomidato+100 μg/mL Lidocaína; 100 μg/mL MS-222. Cada ponto representa um animal. Resultados expressos em média ± desvio padrão (n=4-8). ...42
xii
ÍNDICE DE TABELAS
Tabela 1 Protocolos anestésicos. ...26 Tabela 2 Valores dos protocolos anestésicos relativos ao tempo de perda de equilíbrio (em segundos). Resultados expressos em média ± desvio padrão. ...32 Tabela 3 Valores dos protocolos anestésicos relativos ao tempo de indução (em segundos). Resultados expressos em média ± desvio padrão. ...33 Tabela 4 Valores dos protocolos anestésicos relativos ao tempo de perda de reacção ao toque suave (em segundos). Resultados expressos em média ± desvio padrão. ...34 Tabela 5 Valores dos protocolos anestésicos relativos ao tempo de perda de reacção ao estímulo doloroso (em segundos). Resultados expressos em média ± desvio padrão. ...35 Tabela 6 Valores frequência respiratória, medido em movimentos operculares por minuto (MOp) após a perda de equilíbrio. Resultados expressos em média ± desvio padrão. ...37 Tabela 7 Valores da frequência respiratória medido em movimentos operculares por minuto (MOp) após a perda de reacção ao toque suave. Resultados expressos em média ± desvio padrão. ...38 Tabela 8 Valores dos protocolos anestésicos, na fase de recuperação, relativos ao início dos movimentos, expressos em segundos após colocação na água sem anestésico. Resultados expressos em média ± desvio padrão. ...39 Tabela 9 Valores dos protocolos anestésicos relativos à recuperação do equilíbrio expressos em segundos após colocação na água sem anestésico. Resultados expressos em média ± desvio padrão. ...40 Tabela 10 Valores da actividade medida através do número de passagem numa linha imagínária durante um minuto medidos 5 h após os protocolos anestésicos. Resultados expressos em média ± desvio padrão. ...41 Tabela 11 Valores da actividade medida através do número de passagem numa linha imagínária durante um minuto medidos 24 h após os protocolos anestésicos. Resultados expressos em média ± desvio padrão. ...42
xiii
LISTA DE SIGLAS E ABREVIATURAS
CHCM Concentração de Hemoglobina Corpuscular Média EU Europeia
FDA Food and Drug Administration Hb Hemoglobina
MIMV
Mestrado Integrado de Medicina Veterinária MOp. Movimentos OpercularesNMDA N-Metil-D-Aspartato
14
1. INTRODUÇÃO
1.1 Contextualização
Esta tese de mestrado surge na sequência de em 2014 ter visto aprovado o plano previsional de formação e superação do quadro docente para os cursos de mestrado, tendo nesse mesmo ano concorrido a vaga do curso de Mestrado Integrado de Medicina Veterinária da Universidade de Trás-os-Montes e Alto Douro sendo admitido, estando assim em formação desde o ano de 2015 na UTAD. Esta formação surge após diversos anos de prática em pequenos animais de companhia na clínica veterinária Alvet e docência como assistente estagiário na Faculdade de Medicina Veterinária da Universidade José Eduardo dos Santos de Angola.
A última fase do Mestrado Integrado em Medicina Veterinária decorreu no laboratório de ecotoxicologia da UTAD, onde se encontram alojados os peixes-zebra (Danio rerio), dispostos por idades em diversos aquários. No início tive a oportunidade de observar e acompanhar como eram realizados alguns procedimentos relativos aos cuidados de higienização dos aquários, oxigenação e controlo dos parâmetros da água. Para além disso era feita a observação das actividades vitais dos peixes através dos seus movimentos e garantido o fornecimento de alimentos em quantidade adequada às idades. Acompanhei também a realização de diferentes técnicas utilizadas, como os procedimentos para a postura e recolha de ovos, bem como a selecção e tratamento.
Simultaneamente com estas atividades iniciou-se a realização de ensaios experimentais em peixe-zebra (Danio rerio), usando diversos protocolos anestésicos pelo método de imersão. A participação neste estudo inseriu-se no trabalho “A Pilot Study about
alternatives for adult zebrafish anesthesia”, que permitiu a realização do trabalho publicado
(anexo 2).
Terminada essa etapa, e durante a fase da escrita da dissertação, iniciei no Hospital Veterinário da Universidade de Trás-os-Montes e Alto Douro um estágio voluntário. Nesse estágio tive a oportunidade de aprender novos princípios e técnicas aplicadas em diversos procedimentos, durante a prática clínica veterinária nas áreas de cirurgia de animais de companhia e cuidados intensivos.
15
1.2 Problema
A utilização de peixes como modelos biológicos em experiencias tem aumentado nas últimas décadas, havendo assim a necessidade do desenvolvimento de protocolos anestésicos adequados para a utilização em peixes, particularmente para o peixe-zebra (Danio rerio), que tem despertado cada vez mais a importância como modelo de estudo. O peixe-zebra (Danio rerio) é um excelente organismo modelo para o estudo genético e do desenvolvimento dos vertebrados. Apresenta grandes posturas de ovos, que pode atingir cerca de 200 ovos a cada sete dias. Devido ao facto dos embriões serem pequenos, transparentes e com um rápido desenvolvimento externo, tem permitido realizar trabalhos com este organismo modelo no melhoramento de várias doenças humanas (Tavares e Lopes, 2013).
1.3 A anestesia em peixes
A anestesia como um processo reversível é aplicada em vários procedimentos clínicos, tanto em medicina humana como veterinária. São usadas doses que não coloquem em risco a vida e bem estar humano e animal, obedecendo para isso a protocolos com combinações de vários fármacos, de modo a obter os efeitos anestésicos desejados (Zahl et
al, 2012). Alguns fármacos testados neste estudo têm sido frequentemente utilizados na
rotina em hospitais e clínicas veterinárias e humanas, assim como em laboratórios de investigação. No entanto, existe pouca informação sobre a sua utilização em algumas espécies de peixes como o peixe-zebra (Danio rerio).
O peixe-zebra tem sido cada vez mais importante como um organismo modelo científico, para a investigação de várias doenças humanas, na descoberta de drogas e na identificação da função de genes (Tavares e Lopes, 2013). Vários agentes químicos podem ser usados para a realização de anestesia em peixes. As doses recomendadas variam conforme o agente anestésico utilizado, a via de administração, a espécie do peixe e a qualidade da água. A escolha do anestésico para o estudo acerca da sua aplicação em peixes geralmente está relacionada com a sua eficácia na indução, na recuperação dos animais, na sua disponibilidade no mercado, na segurança durante o seu uso e nos seus possíveis efeitos colaterais quer em peixes assim como em seres humanos e no meio ambiente (Souza et al, 2012).
16 A anestesia nos peixes pode ser administrada por via respiratória (imersão) ou injectável. Durante o processo de anestesia por imersão, os agentes anestésicos chegam à circulação sanguínea através das brânquias, de onde são transportados até ao sistema nervoso central, sendo em seguida excretados através das guelras, fazendo assim o retorno à água. Deprimem o sistema nervoso central, induzindo um efeito calmante seguido de uma perda de equilíbrio, perda de mobilidade, consciência e acção reflexa. Em casos de doses excessivas ou de exposição prolongada pode ocorrer insuficiência respiratória e cardíaca (Gilderhus 1990; Weyl et al, 1996). De facto, a imersão é o método mais aconselhado e utilizado para anestesiar o peixe-zebra (Danio rerio), pois além de ser um animal demasiado pequeno para ser administrado por via intramuscular ou intraperitoneal, o método de imersão permite, num pequeno volume de água com anestésico, anestesiar ao mesmo tempo vários peixes, sem haver necessidade de manipular excessivamente o peixe como no caso da injecção do anestésico(Matthews e Varga 2012).
Na aquacultura, são importantes os agentes químicos que anestesiam o peixe rapidamente com o mínimo de hiperactividade ou stress, e com uma acção prolongada, conduzindo a um plano de anestesia de total perda de equilíbrio permitindo efectuar a maior parte das manipulações do peixe (Chambel et al, 2013).
A anestesia e a sedação são essenciais não apenas para minimizar o stress e danos físicos ao manipular o animal, mas também em operações de rotina na piscicultura, no transporte (Vidal et al, 2008), para facilitar a manipulação em cativeiro sem induzir stress (Façanha e Gomes, 2005). São também importantes para recolher amostras de sangue para testes laboratoriais, cujo procedimento de certa forma submete os animais a uma série de estados de stress (Carreiro et al, 2011). Além disso, a anestesia é também utilizada para fins de desova artificial, pesagem, aplicação de etiquetas para identificação, classificação e procedimentos cirúrgicos (Anderson et al, 1997).
Os anestésicos utilizados em peixes, requerem diferentes concentrações para cada espécie, para se atingir o plano de anestesia desejado. Um anestésico adequado deve demorar até 3 minutos para induzir anestesia e proporcionar um estado de recuperação num tempo máximo de 10 minutos (Park et al, 2003). A resistência e a tolerância à anestesia entre indivíduos variam consoante o tipo de anestésico e a dose, fazendo com que haja diferenças entre espécies quanto à utilização de um determinado anestésico. O tamanho do peixe, o sexo, assim como a idade têm grande influência na eficácia da concentração de um determinado anestésico, variando igualmente com os factores do seu meio ambiente como pH, oxigénio dissolvido, temperatura e salinidade (Zahl et al, 2009). Uma vez que ocorrem
17 variações consideráveis entre espécies de peixe, King e colaboradores (2005) apelaram à necessidade de se determinar dosagens efectivas para um determinado anestésico e para cada espécie de peixe.
1.4 Tipos de anestésicos
1.4.1 Propofol
O propofol (2,6-di-isopropilfenol) é um sedativo hipnótico utilizado em mamíferos, sendo administrado continuamente por via intravenosa para a indução e manutenção da anestesia. Este fármaco é de acção curta, favorecendo uma recuperação rápida e suave. Num estudo em murganhos, a administração de doses sub-hipnóticas de propofol por via intraperitoneal mostrou ter alguma actividade analgésica em comparação com a morfina (Anwar e Abdel-Rahman, 1998).
Num outro estudo realizado em murganhos, verificou-se que a administração intraperitoneal de propofol (50-200 mg/kg), isolado ou em combinação com os opióides fentanil (0,2-0,4 mg/kg), sufentanil (0,05-0,1 mg/kg) ou remifentanil (0,2-1,0 mg/kg), não foi suficiente para permitir que ocorresse um estado de anestesia estável para a realização de procedimentos cirúrgicos. Além do mais, a utilização de doses elevadas induzia estados de depressão fortes e taxas elevadas de mortalidade (Alves et al, 2007). Outro estudo do mesmo autor (Alves et al, 2009), testou várias combinações de propofol com medetomidina e fentanil em murganhos, administrados por via intraperitoneal e revertida com atipamezol 30 minutos após a indução. Esta combinação permitiu uma indução anestésica eficaz e relaxamento muscular, mas só com a adição do fentanil é que se verificou um bom efeito analgésico, permitindo o seu uso em procedimentos cirúrgicos, assim como também a redução da dose de outros fármacos em combinação.
O propofol é um anestésico também utilizado em outras espécies, como em répteis taratarugas (Testudine
s)
e lagarto verde (Iguana iguana), (Knotkova et al, 2005) e em algumas espécies de peixes como esturjão (Acipenser oxyrinchus) e tubarão bambu (Chiloscyllium plagiosum), (Fleming et al, 2003, Miller et al, 2005), porém, a sua eficácia e segurança em pequenos peixes como o peixe-zebra ainda é pouco descrito (Valentim et al, 2016). O propofol é rapidamente metabolizado, podendo ser uma boa alternativa para os anestésicos actuais usados em imersão, permitindo uma indução de anestesia suave e uma recuperação rápida com poucos efeitos cumulativos. Estudos realizados sobre as18 implicações da anestesia com o propofol em alguns valores hematológicos, observaram que a espécie de peixe-vermelho (Carassius auratus), quando exposta ao propofol apresentou uma baixa na hemoglobina (Hb) e na concentração de hemoglobina corpuscular média (CHCM) (GholipourKanani e Ahadizadeh, 2013).
1.4.2 Lidocaína
Os anestésicos locais são muito utilizados na medicina veterinária em vários procedimentos cirúrgicos como adjuvante da anestesia geral para o controlo da dor intra e pós-operatória. Estão destacados nesta modalidade anestésica a lidocaína, a bupivacaína e a ropivacaína (Skarda e Tranquilli, 2007 citados por Cassu et al, 2010). A lidocaína é um bloqueador dos canais de sódio, sendo um anestésico com uma grande margem de segurança quando utilizado em medaca (Oryzias dancena) podendo ser também utilizado como analgésico, especialmente em truta (Oncorhynchus mykiss),
(
Valentim et al, 2016).Para se avaliar a eficácia e segurança da lidocaína, isoflurano, metomidato e MS-222 em peixe-zebra adulto (Danio rerio), foram analisados os parâmetros: perda de equilíbrio, perda dos movimentos operculares, reacção ao estímulo doloroso e a recuperação. A lidocaína, foi utilizada em diferentes concentrações de 300, 325 e 365 mg/L. Observaram, que os animais perderam de forma rápida a sensibilidade dolorosa, havendo porém, registo baixo de morte e um longo período de recuperação dos animais (Collymore et al, 2014).
1.4.3 Cetamina
A cetamina é um poderoso anestésico dissociativo que se encontra sob a forma de pó ou líquido, podendo ser administrada por via oral, inalada ou injectada. A cetamina induz um estado de sedação, imobilidade e analgesia, porém o grau de anestesia produzido é muito variável e em pequenos roedores a administração de doses elevadas pode provocar depressão respiratória. Em humanos, a cetamina como anestésico dissociativo é capaz de, no período pós-operatório, provocar alucinações, alterações psicóticas e défice na actividade cognitiva em indivíduos saudáveis, semelhantes aos observados em pacientes com crises esquizofrénicas (Moghaddam, 2003 citado por Zakhary et al, 2011). No entanto, a administração de cetamina em doses sub-anestésicas em pacientes deprimidos produz efeitos antidepressivos de forma rápida, pois é um antagonista dos receptores N-metil-D-aspartato (NMDA), um dos vários subtipos de receptores do sistema glutamatérgico (Zakhary et al, 2011).
19 Riehl e colaboradores (2011) verificaram que a cetamina administrada em doses sub-anestésicas induz um aumento de locomoção, prejudica a memória e excita movimentos circulares e comportamentos estereotipados em roedores. Porém, em ratos a administração intraperitoneal de cetamina em combinação com agonistas α2-adrenérgicos,
benzodiazepinas ou fenotiazinas, induz estados aceitáveis de analgesia, hipnose e relaxamento muscular (Molina et al, 2015).
De Campos et al, (2015) afirmaram que o uso inadequado da cetamina pode provocar consequências graves na saúde humana, já que os seus efeitos secundários ainda são pouco conhecidos. Para se determinar os seus efeitos anestésicos em peixe-zebra, foram utilizados peixes adultos submetidos a diferentes concentrações de 5 mg/L a 60 mg/L.Os animais expostos a 5 mg/L tiveram um comportamento similar ao grupo controlo não tendo sido observados efeitos. Os esfeitos dos anestésicos foram apenas observados em animais expostos às concentrações de 40 e 60 mg/L. Tendo mostrado um comportamento intermédio os animais submetidos à uma concentração de 20 mg/L.
O peixe-zebra emergiu como um novo modelo animal no estudo dos efeitos psicotrópicos, tendo-se estudado deste modo, os efeitos da cetamina a nível comportamental. Um estudo investigou os efeitos negativos de cetamina na locomoção, comportamento e habituação em peixes-zebra expostos a 20 e 40 mg/L de cetamina durante 20 minutos, verificando-se que além da redução dos níveis de cortisol, a cetamina induziu também movimentos erráticos natatórios e circulares, entre outros (Riehl et
al, 2011).
1.4.4 Medetomidina
A medetomidina é um sedativo do grupo dos agonistas α2-adrenérgicos. Sendo um
composto lipofílico é completamente e rapidamente absorvida após injecção intramuscular. A medetomidina, tal como outros fármacos deste grupo, induzem uma boa sedação, analgesia, relaxamento muscular e ansiólise, reduzindo também a dose necessária dos anestésicos injectáveis e inalatórios administrados em conjunto. Porém, o conhecimento sobre os efeitos da medetomidina em organismos aquáticos é limitado, (Bellas et al, 2006; citados por Lennquist, 2010). Actualmente, a medetomidina tem sido utilizada em alguns estudos como um sedativo em peixes. Estes estudos foram realizados em bacalhau-do-atlântico (Gadus morhua), truta (Oncorhynchus mykiss), salmão (Salmo salar), rodovalho (Psetta maxima); solla (Platichthys flesus), assim como em esgana-gato (Gasterosteus
20
aculeatus), utilizando a medetomidina por via intraperitoneal e por imersão nas
concentrações de 0,5 a 50 nM. Foram analisados os efeitos de toxicidade em células hepáticas, efeitos em hormonas de crescimento, no comportamento, na coloração dos peixes, consumo de oxigénio e na frequência respiratória, verificando-se que a medetomidina a partir de 2 nM, diminuiu a taxa de consumo de oxigénio e a frequência respiratória em lapa (Cyclopterus lumpus) e em rodovalho (Psetta maxima), (Lennquist, 2010). O efeito da descoloração (palidez) embora não sendo letal foi registado estando diretamente relacionado com a concentração utilizada. A função hepática, através da avaliação da actividade de enzimas hepáticas, mostrou-se ser afetada pelo uso da medetomidina em doses acima de 5 nM. Também se verificou efeitos comportamentais tais como uma diminuição na actividade locomotora e no apetite, tendo influência nas interacções peixe predador-presa, (Lennquist, 2010).
A medetomidina é frequentemente utilizada em combinação com a cetamina na anestesia geral em roedores, coelhos, gatos, cães, porcos, ovinos e primatas (Baker et al, 2011), sendo também utilizado o atipamezol para a reversão dos efeitos sedativos, analgesia e relaxamento muscular, induzidos pela medetomidina.
O atipamezol é um antagonista altamente seletivo dos receptores α2-adrenérgicos,
permitindo uma recuperação mais rápida dos animais em comparação com a anestesia com barbitúricos. Segundo o folheto informativo do fabricante (Orion Corporation Orioninte, Espoo, Finlândia), a dose de atipamezol no cão depende da dose de medetomidina administrada, podendo ser administrada uma dose em (µg/kg) 5 vezes maior que a de medetomidina. Williams e colaboradores (2004) realizaram um estudo sobre os efeitos da combinação da cetamina e medetomidina e da reversão do efeito anestésico com o atipamezol, administrados por via intramuscular em bonitos (Euthynnus alleterattus) e em cavala (Scomber japonicus). Este estudo permitiu concluir que esta combinação anestésica pode ser usada com segurança nestes peixes e que os seus efeitos sedativos podem ser revertidos com o atipamezol a uma dose igual a 1 ou 5 vezes maior a dose de medetomidina. De facto, o protocolo do fabricante não é claro quanto ao tempo ideal ao qual se deve administrar o atipamezol para se obter a reversão. Num estudo original realizado em renas, observou-se que a medetomidina era eliminada 76 minutos após a sua administração e o atipamezol após 60 minutos, sugerindo que os efeitos residuais da medetomidina poderiam levar a uma nova sedação. Além disso, constatou-se que cerca de 5% de veterinários observaram efeitos de ressedação após a administração de atipamezol (Baker et al, 2011).
21
1.4.5 Etomidato
O etomidato é um sedativo hipnótico não barbitúrico administrado por via intravenosa para a indução de anestesia geral em seres humanos, assim como em mamíferos domésticos ou de laboratório, sendo também considerado um anestésico potente e seguro para a sua utilização em peixes. Uma dose mínima variável de 2-4 mg/L e outra dose máxima variável de segurança de 7-20 mg/L de etomidato foi utilizada em algumas espécies de peixe de aquário: como carpa dourada (Notemigonus crysoleucas), percas (Lepomis
macrochirus) e peixe-gato (Ictalurus punctatus), (Amend et al, 1982). De uma forma geral,
observou-se que a dose menor de etomidato levava a um maior tempo de indução anestésica, mas também a uma recuperação mais rápida. Os peixes submetidos à dose de 4 mg/L entraram em indução anestésica em 90 segundos e recuperaram em 40 minutos, apresentando assim algumas vantagens sobre outros anestésicos comumente utilizados em peixes (Amend et al, 1982).
Lambooij e colaboradores (2009) testaram os efeitos anestésicos de 2 mL/L de etomidato em carpas (Cyprinus carpio L.), observaram que a carpa perdia equilíbrio aproximadamente após 90 segundos de exposição anestésica. Não houve reacção a estímulos dolorosos e registou-se uma queda da frequência respiratória, assim como da frequência cardíaca.
1.4.6 Tricaína metano sulfonato-222
A tricaína metano sulfonato-222 (MS-222) é um anestésico aprovado pela FDA (Food and Drug Administration, Agência norte-americana reguladora de fármacos e alimentos). Sendo o anestésico mais utilizado em peixes destinado ao consumo humano nos Estados Unidos da América (EUA), sendo também o mais difundido em quase todo o mundo. O MS-222 é bastante solúvel em água e muito ácido, baixando extremamente o pH da água, levando por isso a muitos efeitos fisiológicos indesejáveis quando utilizado em peixes. Quando usado em doses apropriadas, induz uma anestesia rápida num tempo de 1-5 minutos e uma recuperação também rápida entre 3-5 minutos, porém, o uso do dobro da dose recomendada de (100 mg/L) induz mortalidade no peixe-zebra (Roubach e Gomes, 2001). A solução anestésica de MS-222, quando usada em peixes, deve antes ser tamponada (pH 7-7,4) devido à sua natureza extremamente ácida de forma a evitar efeitos nocivos nos peixes, (Readman et al, 2013; Carter et al, 2011; Davis et al; 2008)
22 Ao avaliar a eficácia de MS-222 em peixes de aquário de água doce como peixe- zebra (Danio rerio), guppy (Poecilia reticulata), acará disco (Symphysodon discus) e peixe espada (Xiphophorus helleri) com diferentes concentrações de 75 a 250 mg/L, Chambel e colaboradores (2013) constataram que a dose óptima variou em função da espécie. Collymore et al, (2014) ao testar a eficácia do MS-222, a uma concentração de 150 mg/L em peixe-zebra (Danio rerio) observaram que todos os peixes alcançaram o estado de anestesia desejado para procedimentos cirúrgicos.
No entanto, um estudo recente mostrou que o uso contínuo de MS-222 causa problemas de segurança e higiene no trabalho, nomeadamente problemas na retina dos manuseadores (Roubach e Gomes, 2001). Na actualidade, isto não acontece, pois, quando se prepara o MS-222 este deve ser preparado sob câmara de fluxo laminar (hotte) devido à libertação de vapores.
1.5 Objectivos do estudo
O conhecimento dos anestésicos assim como das técnicas a serem utilizadas para a sua aplicação em peixes, especialmente no peixe-zebra, encontram-se em constante evolução devido às limitações que ainda existem em relação ao uso de determinados fármacos em determinados protocolos anestésicos. Assim, com a finalidade de refinar um protocolo anestésico para uso no peixe-zebra adulto, neste trabalho foram avaliados os efeitos de diferentes anestésicos isolados e em diferentes combinações, nomeadamente: 1,25 µg/mL propofol; 100 µg/mL cetamina; 2 µg/mL etomidato; 1,25 µg/mL propofol + 100 µg /ML lidocaína; 100 µg/mL cetamina + 1,25 µg/mL medetomidina; 100 µg/mL cetamina + 1,25 µg/Ml medetomidina + 3,125 µg/mL atipamezol; 2 µg/mL etomidato+100 µg/mL lidocaína; 100 μg/mL MS-222 com os seguintes objectivos:
Comparar o tempo de indução e de recuperação da anestesia entre os diferentes protocolos estudados.
Avaliar o grau de profundidade de anestesia e analgesia obtidos com as diferentes combinações anestésicas estudadas.
Avaliar a sobrevivência dos peixes depois de serem submetidos a tratamento das diversas combinações anestésicas estudadas.
23
2.
MATERIAL
E
MÉTODOS
Todos os procedimentos experimentais foram executados de acordo com a Directiva Europeia 2010/63/EU e a Legislação Nacional (Decreto-Lei nº 113/2013), para a protecção dos animais usados para fins científicos.
2.1 Material
Para a realização do presente estudo foram utilizados uma grande quantidade e diversidade de materiais baixo explicitados através de imagens recolhidas por mim aquando da implementação do estudo experimental.
Aquários, com a capacidade de ± 5 L, utilizados para a avaliação da recuperação dos animais, e outros com a capacidade de ± 20 L (Fig. 1), onde eram concentrados os animais após 48 h de recuperação. Os aquários estavam equipados com termómetros de submersão para o controlo da temperatura da água e com resistências (aquecedores) para atingir a temperatura ideal. A água era filtrada e fornecida em sistema aberto impedindo a passagem de agentes mecânicos e biológicos, que podessem interferir, de algum modo, com a qualidade da água dando de certa maneira, boa sobrevivência aos peixes.
24 Copos de vidro graduados com a capacidade de 250 mL para as misturas com os anestésicos de forma isolada ou combinada, ou para água pura e esterilizada (Fig. 2).
Figura 2 Copos vidro graduados utilizados na preparação da anestesia por imersão.
Seringas de 1 mL utilizadas para a preparação das doses anestésicas.
Micropipetas de volume variável para a preparação das doses dos anestésicos (Fig. 3A).
Pipetas de Pasteur plásticas e pinças anatómicas sem dentes para a exploração de respostas ao toque suave e a sensibilidades dolorosas (Fig. 3B, C).
Figura 3 Material utilizado na preparação das doses dos anestésicos e na exploração de
sensibilidades ao toque suave e à dor: A) micropipetas, B) pipetas de Pasteur e C) pinças.
Cronómetros para o controlo do tempo durante a avaliação dos parâmetros estudados (Fig. 4A).
25 Termómetro digital para a medição da temperatura da água antes e depois da mistura com o anestésico, assim como no momento da recuperação (Fig. 4B).
Figura 4 Exemplo de A) cronómetros e B) termómetros, utilizados no controlo do tempo e da temperatura da água.
Câmara de vídeo para obtenção de imagens durante a realização dos testes.
Computador como ferramenta essencial na recolha e processamento dos dados obtidos.
2.2 Fármacos utilizados
Propofol Lipuro® a uma concentração de 20 mg/mL, (Fig. 5A; B. Braun VetCare SA, Barcelona, Espanha).
Lidocaína 2% (Fig. 5F, B.Braun Medical, Lda). A substancia activa é o cloridrato de lidocaína 20 mg/mL, podendo ser apresentada também a 1% (10 mg/mL).
Clorketam 1000 a uma concentração de 1g/mL (Fig. 5B; Vetoquinol S.A., Lure, França), é uma solução cuja substância activa é a cetamina.
Domtor® a uma concentração de 1 mg/mL (Fig. 5C; Orion Corporation Orioninte, Espoo Finlândia comercializada pela Esteve Farma Lda), contém como substância activa o cloridrato de medetomidina.
Antisedan® a uma concentração de 5 mg/mL (Fig. 5E; Orion Corporation Orioninte, Espoo, Finlândia, comercializada pela Esteve Farma Lda), contém como substância activa o cloridrato de atipamezol.
Etomidato-Lipuro a uma concentração de 2 mg/mL (Fig. 5D; B. Braun, Melsungen, Alemanha).
26 MS-222 (Sigma-Aldrich, Sintra, Portugal). É preparado a uma solução stock de 1500 mg/L. Ao se adicionar à água para o banho anestésico, o pH deve ser ajustado a 7,2-7,4 com bicarbonato de sódio. Foi utilizado um eléctrodo de pH (VWR 1000L) para calibrar a solução de MS-222.
Figura 5 Exemplo dos fármacos usados no estudo. A) Propofol, B) Cetamina, C) Medetomidina, D) Etomidato, E) Atipamezol, e F) Lidocaína.
Tabela 1 Protocolos anestésicos.
Protocolos anestésicos testados
Anestésicos isolados. Dose /mL Combinação de anestésicos. Doses /mL
Propofol 1,25 µg 1,25 µg Propofol (P) + 100 µg Lidocaína (L)
Lidocaína 100 µg 100 µg Cetamina (K) + 1,25 µg Medetomidina (M)
Cetamina 100 µg
100 µg Cetamina (K) + 1,25 µg Medetomidina (M)/3,125 µg Atipamezol (A)
Medetomidina 1,25 µg 2 µg Etomidato (E) + 100 µg Lidocaína (L)
Atipamezol 3,125 µg
Etomidato 2 µg
MS-222 100 µg
A
B
C
27 A dose dos anestésicos utilizados neste estudo foi escolhida com base em estudos piloto realizados em peixe-zebra, assim como em artigos e outros trabalhos publicados.
2.3 Animais
Neste estudo foram utilizados 60 peixes-zebra adultos, entre machos e fêmeas, que apresentaram um bom estado de saúde. Os peixes foram divididos em 7 grupos experimentais, cada um composto por 8 peixes. Foi utilizado também um grupo controlo, não anestesiado, constituído por 4 peixes.
Os animais foram mantidos em tanques próprios (Fig. 1) em condições adequadas de temperatura (27-28 ºC), arejamento, ciclo de 14 h de luz/10 h de escuridão, pH entre 6,5-8,5 (segundo os resultados do relatório do conselho de Vila Real da qualidade de água fornecida para o consumo humano no 3º trimestre do corrente ano). As condições foram controladas diariamente, sendo que a água utilizada nos tanques foi esterilizada através da radiação ultravioleta. Durante o decurso do estudo, os animais foram alimentados à base de uma dieta comercial (Sera, Heinsberg, Alemanha), fornecida em duas tomas ao dia e suplementada com artemia.
2.4 Método de avaliação dos vários parâmetros
Para cada grupo experimental os animais foram seleccionados aleatoriamente. Os animais foram recolhidos individualmente do tanque que continha a amostra total de peixes, usando uma rede própria. Em seguida, o animal foi colocado num copo com água fresca ou limpa de forma a reduzir o stress. Posteriormente, o animal foi transferido para o copo que continha o anestésico ou a mistura de anestésicos. Para não haver excesso de volume do banho anestésico e de modo a se atingir a concentração correcta, antes de se adicionar os anestésicos, o volume de água correspondente ao volume dos anestésicos foi retirado. Para cada protocolo anestésico utilizou-se uma ficha modelo onde foram registados os dados dos parâmetros avaliados (Anexo I). O investigador não estava cego aos testes em virtude de alguns anestésicos apresentarem colorações distintas nas soluções. O propofol e etomidato apresentaram colorações esbranquiçadas que permitiam a sua fácil identificação em termos de concentrações e fármacos utilizados. A utilização de cetamina, lidocaína e medetomidina não apresentavam colorações. Contudo para permitir uma abordagem igual entre os
28 diferentes fármacos, optou-se pela solução do investigador saber quais os fármacos utilizados durante todos os ensaios.
Neste estudo utilizou-se o método de imersão para a anestesia do peixe-zebra adulto, tendo sido cumpridas sete fases: preparação dos banhos e introdução dos peixes (1ª fase); controlo da indução e da perda de equilíbrio dos peixes (2ª fase); exploração da perda de reacção com um toque suave (3ª fase); exploração da perda de reacção à dor (4ª fase); recuperação dos peixes em reservatório com água limpa (5ª fase); recuperação do equilíbrio (6ª fase); e por último, avaliação da recuperação anestésica dos animais (7ª fase) (Fig. 6).
Figura 6 Fluxograma do estudo e momentos de avaliação.
Após a introdução do animal no recipiente com a mistura anestésica, a contagem do tempo (em segundos) era iniciada, avaliando-se de forma contínua o tempo de perda do equilíbrio (Fig. 7A), o tempo de indução anestésica (Fig. 7B), o tempo de perda da reacção ao toque suave (Fig. 8A), o tempo de perda da reacção à dor (Fig. 8B) e a frequência respiratória controlada através da contagem dos movimentos opérculares (MOp) por minuto, após a perda do equilíbrio e após a perda da reacção ao toque suave.
Banho anestésico Avaliação da indução e perda de equilíbrio Perda de reacção ao toque suave Perda de Reacção à dor Recuperação em água limpa Recuperação do equilíbrio Avaliação da recuperação anestésica
29 Figura 7 Exemplo de A) perda de equilíbrio e de (B) estado de indução anestésica.
A perda de equilíbrio foi a primeira alteração a ocorrer logo após a introdução do peixe e foi avaliada no momento em que ocorreu a mudança de decúbito (ventral para o dorsal), apresentando ainda alguns movimentos operculares (Fig. 7A). Quanto ao tempo de indução anestésica, este foi avaliado igualmente desde a imersão até quando os peixes já não se moviam e se mantinham em desequilíbrio total e permanente (Fig. 7B), fixando-se na base do copo em decúbito dorsal.
A cada 10 segundos, a perda de reacção ao toque suave era avaliada através de um toque na parte lateral do peixe com uma pipeta de Pasteur (Fig. 8A), enquanto a perda de reacção à dor era avaliada através do aperto da barbatana caudal com uma pinça anatómica sem dentes, através da pressão sobre a mesma (Fig. 8B).
Figura 8 Exploração da perda de reacção ao toque suave (A) e da perda de reacção à dor (B).
A
B
30 A frequência respiratória foi avaliada logo após a perda de equilíbrio e logo após a perda de reacção ao toque suave, contabilizando-se visualmente o abrir e fechar do opérculo durante 1 minuto.
A recuperação pode ser observada em segundos ou minutos, em função da concentração e anestésico administrado. A recuperação ocorre quando o peixe é colocado num recipiente ou tanque com água sem o anestésico. Em caso de não haver sinais de recuperação após alguns segundos deve-se colocar o animal num fluxo de água oxigenada (Ross e Ross, 1999). Para a recuperação pós-anestésica dos animais, controlou-se igualmente o tempo a cada 10 segundos. Controlou-se o momento em que os animais começaram a mover-se até recuperarem totalmente o equilíbrio, estado que lhes permitiu manterem-se na sua posição normal. Após 5 h e 24 h de recuperação, foi avaliada a actividade de cada animal através da contagem do número de passagens feitas por minuto numa linha virtual criada nos respectivos tanques. Para o grupo controlo, os animais foram seleccionados de forma aleatória, recolhidos e distribuídos isoladamente em aquários menores e mantidos em repouso durante 5 h para a sua habituação. Só depois foram avaliados contando apenas os movimentos de passagem pela linha virtual durante 1 minuto.
Passado 48 h de recuperação, os animais eram recolhidos individualmente e levados para o tanque maior com a capacidade de 20 L preparado para acolher todos os peixes já submetidos aos protocolos anestésicos.
2.5 Análise estatística
Os resultados estão expressos em média ± desvio padrão (SD).
Para os dados que seguiram uma distribuição Gaussiana, a significância estatística foi avaliada com o teste paramétrico ANOVA de uma via seguido do teste de Tukey de comparações múltiplas, para comparar o efeito dos diferentes protocolos anestésicos.
Para os dados que não seguiram uma distribuição Gaussiana, a significância estatística foi avaliada com o teste não paramétrico Kruskal-Wallis (ANOVA não paramétrica) seguido do teste de Dunn de comparações múltiplas, para comparar o efeito dos diferentes protocolos anestésicos.
Valores de p<0,05 foram considerados estatisticamente significativos.
A análise estatística dos dados foi efectuada utilizando o GraphPad Prism (GraphPad
31
3. RESULTADOS
No estudo realizado foram utilizados 60 peixes-zebra adultos, dos quais 56 animais (93,3%) foram submetidos aos diversos protocolos anestésicos. Por cada protocolo anestésico foram utilizados 8 peixes (13,3%) e para o grupo controlo foram utilizados 4 peixes (6,7%). Os procedimentos experimentais para os diferentes protocolos obedeceram os mesmos passos e critérios.
Depois da preparação da mistura e da introdução dos animais, estes tiveram comportamentos diferentes em função do anestésico utilizado. Por exemplo, durante os testes realizados com a cetamina isolada, os peixes passaram por fases de excitação com movimentos erráticos, acelerados e intensos em quase todas as direcções, com predomínio de movimentos circulares antes de atingirem a fase de indução. Estes comportamentos não foram observados de forma igual com os restantes protocolos anestésicos utilizados.
Em função do protocolo anestésico utilizado, os animais necessitaram de mais ou de menos tempo de exposição até atingirem os vários estados de anestesia.
Os dados obtidos expressos em média±desvio padrão (SD) para os diversos protocolos estudados e analisados estão expostos nas figuras e tabelas respectivamente.
Em relação ao tempo de perda de equilíbrio (Fig. 9, Tabela 2) foram detectadas diferenças estatisticamente significativas entre os vários protocolos. Os protocolos cetamina+medetomidina (61 ± 15 seg), propofol+lidocaína (126 ± 15 seg), etomidato+lidocaí na (147 ± 18 seg), e o etomidato (177 ± 24 seg) foram significativamente mais rápidos a induzir perda de equilíbrio nos peixes em comparação com o propofol (300 ± 96 seg). Em comparação com a cetamina (248 ± 81 seg), as combinações etomidato+lidocaína, propofol+lidocaína e cetamina+medetomidina foram significativamente mais rápidas a induzir perda de equilíbrio. Além disso, a combinação de cetamina+medetomidina foi mais rápida a induzir perda de equilíbrio em comparação com o etomidato+lidocaína e o etomidato isolado. Verificou-se ainda que as combinações de propofol+lidocaína, etomidato+lidocaína e cetamina+medetomidina levaram a uma perda de equilíbrio mais rápida considerando estatisticamente significativa, do que o MS-222 (245 ± 34 seg). Resumidamente, a combinação cetamina+medetomidina foi a mais rápida a induzir a perda de equilíbrio, enquanto que à exposição de forma isolada ao propofol e à cetamina, os peixes levaram mais tempo para que se observasse a perda de equilíbrio. De uma forma geral, independentemente do protocolo anestésico utilizado, a perda de equilíbrio ocorreu a partir de 60 segundos, logo após a introdução dos peixes no banho anestésico.
32
Figura 9 Tempo de perda de equilíbrio no peixe-zebra após exposição a diferentes banhos
anestésicos: 1,25 μg/mL Propofol; 1,25 μg/mL Propofol+100 μg/mL Lidocaína; 100 μg/mL Cetamina;100 μg/mL Cetamina+1,25 μg/mL Medetomidina; 2 μg/mL Etomidato; 2 μg/mL Etomidato+100 μg/mL Lidocaína; 100 μg/mL MS-222. Cada ponto representa um animal. Resultados expressos em média ± desvio padrão (n=8). ***p<0.001, diferente do Propofol; #p<0.05, ##p<0.01, ###p<0.001, diferente da Cetamina; §§p<0.01, diferente do Etomidato; $p<0.05, diferente do Etomidato+Lidocaína; αp<0.05, ααp<0.01, αααp<0.001, diferente do MS-222;Teste ANOVA de uma via seguido do teste de Tukey para comparações múltiplas.
Tabela 2 Valores dos protocolos anestésicos relativos ao tempo de perda de equilíbrio (em
segundos). Resultados expressos em média ± desvio padrão.
Tempo de perda de Equilíbrio (seg)
Protocolos anestésicos Média ± SD
Propofol 300 ± 96 Propofol+Lidocaína 126 ± 15 Cetamina 248 ± 81 Cetamina+Medetomidina 61 ± 15 Etomidato 177 ± 24 Etomidato+Lidocaína 147 ± 18 MS-222 245 ± 34
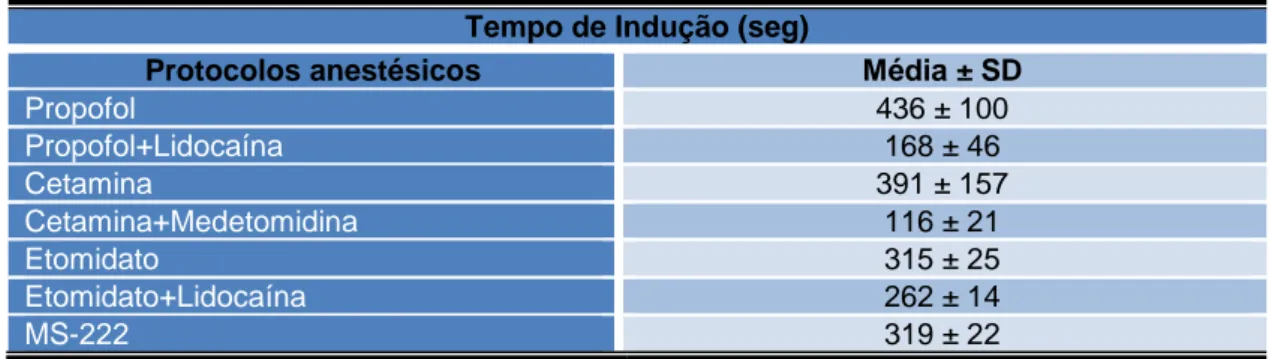
Para o tempo de indução (Fig. 10, Tabela 3), os resultados estatísticos mostraram haver diferenças significativas entre os grupos estudados. A indução anestésica, isto é, quando os peixes já não se moviam e se mantinham em desequilíbrio total e permanente, fixando-se na base do copo em decúbito dorsal, ocorreu mais rápido nos peixes expostos às combinações de cetamina+medetomidina (116 ± 21 seg) e propofol+lidocaína (168 ± 46 seg) em comparação com as exposições ao propofol (436 ± 100 seg) e à cetamina (391 ± 157 seg) na forma simples. Observou-se que o propofol utlizado isoladamente não foi suficiente para produzir um profundo estado de indução anestésica. Já a exposição à cetamina induziu uma actividade comportamental diferente nos peixes, passando por fases de excitação, com movimentos erráticos acelerados e intensos, em
33 quase todas as direções e com predomínio à movimentos circulares, antes de se atingir a fase de indução anestésica. A forma combinada de cetamina+medetomidina mostrou ser significativamente mais rápida para atingir um estado de indução anestésica em comparação com o propofol, a cetamina, o etomidato (315 ± 25 seg) e o MS-222 (319 ± 22 seg). Verificou-se que medetomidina potencializou os efeitos da cetamina, levando a uma indução mais rápida e por isso com menos tempo de exposição, verificando-se também uma diminuição na variabilidade de resposta entre indivíduos do mesmo grupo em comparação com a cetamina isolada.
Figura 10 Tempo de indução anestésica no peixe-zebra após exposição a diferentes banhos
anestésicos: 1,25 μg/mL Propofol; 1,25 μg/mL Propofol+100 μg/mL Lidocaína; 100 μg/mL Cetamina; 100 μg/mL Cetamina+1,25 μg/mL Medetomidina; 2 μg/mL Etomidato; 2 μg/mL Etomidato+100 μg/mL Lidocaína; 100 μg/mL MS-222. Cada ponto representa um animal. Resultados expressos em média ± desvio padrão (n=8). **p<0.01, ***p<0.001, diferente do Propofol; #p<0.01, ###p<0.001, diferente da Cetamina; §§p<0.01, diferente do Etomidato; ααp<0.01, diferente do MS-222; Teste de Kruskal-Wallis seguido do teste de Dunn para comparações múltiplas.
Tabela 3 Valores dos protocolos anestésicos relativos ao tempo de indução (em segundos).
Resultados expressos em média ± desvio padrão.
Tempo de Indução (seg)
Protocolos anestésicos Média ± SD
Propofol 436 ± 100 Propofol+Lidocaína 168 ± 46 Cetamina 391 ± 157 Cetamina+Medetomidina 116 ± 21 Etomidato 315 ± 25 Etomidato+Lidocaína 262 ± 14 MS-222 319 ± 22
Para o tempo de perda de reacção ao toque suave (Fig. 11, Tabela 4), os grupos de peixes estudados mostraram resultados estatísticos significativamente diferentes. Os
34 animais apresentaram perda de reacção ao toque suave de forma rápida e com menos tempo nas formas combinadas de cetamina+medetomidina (214 ± 54 seg), propofol+lidocaína (254 ± 50 seg) e etomidato+lidocaína (352 ± 46 seg) em relação ao propofol (552 ± 109 seg) e à cetamina (557 ± 125 seg) isolados. Verificou-se além disso que o etomidato (400 ± 37 seg) isolado foi menos eficaz, necessitando de mais tempo para abolir a sensibilidade ao toque suave quando comparado ao propofol+lidocaína e cetamina+medetomidina, que mostraram ser mais rápidos e eficazes ao produzir uma resposta ao toque suave em menos tempo.
De forma geral verificou-se que em quase todos os testes o tempo de perda de reacção aos estímulos ocorreu a partir de 250 segundos.
Figura 11 Tempo de perda de reacção ao toque suave no peixe-zebra após exposição a
diferentes banhos anestésicos: 1,25 μg/mL Propofol; 1,25 μg/mL Propofol+100 μg/mL Lidocaína; 100 μg/mL Cetamina; 100 μg/mL Cetamina+1,25 μg/mL Medetomidina; 2 μg/mL Etomidato; 2 μg/mL Etomidato+100 μg/mL Lidocaína; 100 μg/mL MS-222. Cada ponto representa um animal. Resultados expressos em média ± desvio padrão (n=8).; *p<0.05, ***p<0.001, diferente do Propofol; ##p<0.01, ###p<0.001, diferente da Cetamina; §p<0.05, §§p<0.01, diferente do Etomidato; Teste de Kruskal-Wallis seguido do teste de Dunn para comparações múltiplas.
Tabela 4 Valores dos protocolos anestésicos relativos ao tempo de perda de reacção ao
toque suave (em segundos). Resultados expressos em média ± desvio padrão.
Tempo de perda de reacção ao toque suave (seg) Protocolos anestésicos Média ± SD
Propofol 552 ± 109 Propofol+Lidocaína 254 ± 50 Cetamina 557 ± 125 Cetamina+Medetomidina 214 ± 54 Etomidato 400 ± 37 Etomidato+Lidocaína 293 ± 40 MS-222 346 ± 25
Os resultados obtidos nos testes realizados sobre o tempo de perda de reacção ao estímulo doloroso (Fig. 12, Tabela 5) mostraram haver diferenças estatísticas significativas
35 entre os protocolos estudados. A perda de reacção ao estímulo doloroso observou-se com maior rapidez e eficácia nas combinações propofol+lidocaína (339 ± 64 seg), etomidato+lidocaína (352 ± 46 seg), MS-222 (390 ± 22 seg) e cetamina+medetomidina (390 ± 107 seg), em relação ao propofol (762 ± 111 seg). Enquanto que as formas isoladas de cetamina (730 ± 140 seg) e etomidato (724 ± 124 seg) foram mais lentos e menos eficazes em produzir os seus efeitos em relação às combinações propofol+lidocaína e etomidato+lidocaína. Verificou-se que o propofol, a cetamina e o etomidato não foram suficientes a inibir totalmente a sensibilidade dos animais ao estímulo doloroso em todos os indivíduos, enquanto que as combinações propofol+lidocaína, etomidato+lidocaína e cetamina+medetomidina, mostraram ser suficientes em induzir analgesia, verificando-se haver uma ausência de resposta ao estímulo doloroso em menos tempo.
Figura 12 Tempo de perda de reacção à dor no peixe-zebra após exposição a diferentes
banhos anestésicos: 1,25 μg/mL Propofol; 1,25 μg/mL Propofol+100 μg/mL Lidocaína; 100 μg/mL Cetamina; 100 μg/mL Cetamina+1,25 μg/mL Medetomidina; 2 μg/mL Etomidato; 2 μg/mL Etomidato+100 μg/mL Lidocaína; 100 μg/mL MS-222. Cada ponto representa um animal. Resultados expressos em média ± desvio padrão (n=8).; *p<0.05, **p<0.01, diferente do Propofol; ##p<0.01, diferente da Cetamina; §§p<0.01, diferente do Etomidato; Teste de Kruskal-Wallis seguido do teste de Dunn para comparações múltiplas.
Tabela 5 Valores dos protocolos anestésicos relativos ao tempo de perda de reacção ao
estímulo doloroso (em segundos). Resultados expressos em média ± desvio padrão.
Tempo de perda de reacção ao estímulo doloroso (seg) Protocolos anestésicos Média ± SD
Propofol 762 ± 111 Propofol + Lidocaína 339 ± 64 Cetamina 730 ± 140 Cetamina + Medetomidina 390 ± 107 Etomidato 724 ± 135 Etomidato+ Lidocaína 352 ± 46 MS-222 390 ± 22 Cetamina Cetamina
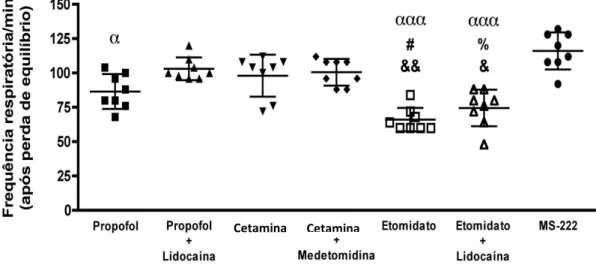
36 A frequência respiratória (Fig. 13, Tabela 6) foi controlada através da contagem dos movimentos opérculares (MOp) por minuto. Foram encontradas diferenças estatísticas significativas entre os grupos nos períodos estudados. Após perda de equilíbrio notou-se um ligeiro aumento da frequência respiratória na forma combinada de propofol+lidocaína (103 ± 8/min) em relação ao etomidato (66 ± 8/min) isolado e etomidato+lidocaína (75 ± 12/min) em que se observou uma pequena depressão. Além disso, o etomidato isolado baixou a frequência respiratória em comparação à cetamina (98 ± 14) na forma simples. Relativamente à forma combinada etomidato+lidocaína obteve-se valores baixos quando compara
dos com
a combinação cetamina+medetomidina (101 ± 9/min). No entanto, o MS-222 (116 ± 13/min) mostrou neste estudo o registo mais alto da frequência respiratória em relação ao propofol e etomidato isolados, e etomidato+lidocaína na forma combinada.Figura 13 Frequencia respiratória após perda de equilíbrio no peixe-zebra, exposto a
diferentes banhos anestésicos: 1,25 μg/mL Propofol; 1,25 μg/mL Propofol+100 μg/mL Lidocaína; 100 μg/mL Cetamina; 100 μg/mL Cetamina+1,25 μg/mL Medetomidina; 2 μg/mL Etomidato; 2 μg/mL Etomidato+100 μg/mL Lidocaína; 100 μg/mL MS-222. Cada ponto representa um animal. Resultados expressos em média ± desvio padrão (n=8). &p<0.05, &&p<0.01, diferente do Propofol+Lidocaína; #p<0.05, diferente da Cetamina; %p<0.05, diferente da Cetamina+medetomidina; αp<0.05, αααp<0.001, diferente do MS-222; Teste de Kruskal-Wallis seguido do teste de Dunn para comparações múltiplas.
Cetamina Cetamina