[2017]
UNIVERSIDADE DE LISBOA
FACULDADE DE CIÊNCIAS
DEPARTAMENTO DE BIOLOGIA ANIMAL
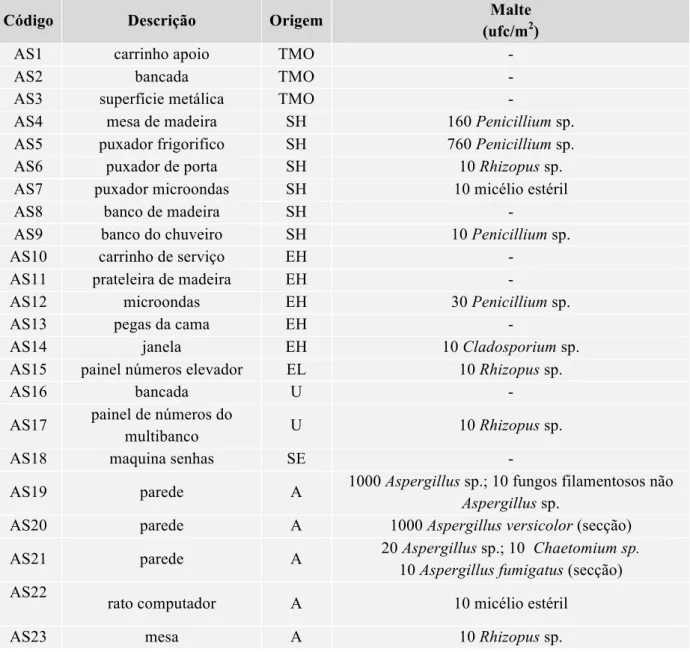
Caracterização de isolados de Aspergillus provenientes de
ambiente hospitalar – identificação molecular e determinação
dos padrões de susceptibilidade aos antifúngicos
Mariana Rato da Conceição Monteiro Francisco
Mestrado Biologia Humana e Ambiente
Versão Final
Dissertação Orientada por:
Doutora Raquel Filipa Pinheiro Sabino
II
Agradecimentos
A conclusão deste mestrado significa imenso para mim. Significa a conclusão desta etapa tão importante e a atribuição do grau de mestre, que não teria sido possível de alcançar sem a ajuda, colaboração, dedicação e carinho de inúmeras pessoas. Quero desta forma agradecer a todos os que contribuíram para que esta etapa fosse possível de alcançar e concluir.
Foi um privilégio enorme ter realizado a tese de mestrado no Instituto Nacional de Saúde Doutor Ricardo Jorge, no laboratório de Micologia.
Quero começar por agradecer à minha orientadora externa, a Doutora Raquel Sabino, por todo o apoio, paciência, dedicação, persistência, amizade, ajuda e confiança que teve para comigo. Muito obrigado por tudo e por todos os ensinamentos, conselhos e aprendizagens transmitidos!
Não poderia deixar de agradecer à Doutora Cristina Veríssimo, por toda a simpatia, ajuda, ensinamentos, amizade, conselhos e contributo na elaboração deste trabalho. À Doutora Helena Simões, por toda a ajuda, confiança, simpatia. Ao Doutor João Brandão por toda a simpatia e conhecimentos transmitidos. À Dona São, por toda a simpatia, apoio, gratidão e ajuda prestada. Muito obrigado por tudo o que fez por mim!
Quero também agradecer à Doutora Carla Viegas a colaboração, simpatia e ajuda na recolha das amostras ambientais e clinicas, tão essenciais para a elaboração deste trabalho de investigação.
Agradeço também à minha orientadora interna a Professora Doutora Deodália Dias, pelas horas despendidas em burocracias, pela simpatia, e por toda a ajuda e empenho no desenvolvimento do trabalho realizado.
Não poderia deixar de fazer um agradecimento muito especial a toda a minha família, que tiveram um papel importantíssimo, nomeadamente ao meu pai Armando, à minha mãe Edite, à minha irmã Raquel, ao meu tio António e à minha tia Luísa e ao meu namorado John e ao meu cunhado Rui por toda a paciência, motivação, confiança, carinho, união, ajuda e conselhos. Ao meu sobrinho João Maria por todo o carinho, alegria e distração.
Não podia deixar de agradecer a todos os meus amigos e colegas, nomeadamente à minha amiga Constança por todo o carinho e confiança e conselhos.
III
Índice
AGRADECIMENTOS _____________________________________________________________ II LISTA DE TABELAS _____________________________________________________________ VI LISTA DE FIGURAS _____________________________________________________________ VIII LISTA DE ABREVIATURAS _______________________________________________________ IX RESUMO _______________________________________________________________________ X ABSTRAT ______________________________________________________________________ XI 1. INTRODUÇÃO _______________________________________________________________ 1 1. Género Aspergillus __________________________________________________________ 1 1.1. Morfologia ________________________________________________________________ 2 1.2. Identificação de espécie do género Aspergillus ___________________________________ 2 1.3. Secções e espécies crípticas ___________________________________________________ 3Aspergillus fumigatus ___________________________________________________________ 3 Aspergillus fumigatus sensu stricto _________________________________________________ 4
Porque é que Aspergillus fumigatus é bem-sucedido? __________________________________ 4
2. Tratamento ________________________________________________________________ 5 2.1. Antifúngicos utilizados _____________________________________________________ 5 2.1.1. Polienos _____________________________________________________________ 5 Anfotericna B (AMB) ______________________________________________________ 5 2.1.2. Azóis/Triazois ________________________________________________________ 6 Itraconazol _______________________________________________________________ 6 Voriconazol ______________________________________________________________ 6 Posaconazol ______________________________________________________________ 6 2.3.1 Equinocandinas _______________________________________________________ 7 2.2. A problemática da resistência aos antifúngico ____________________________________ 7 2.3. Mecanismos de resistência aos azóis em Aspergillus fumigatus ______________________ 7 2.4. Multirresistência ___________________________________________________________ 8
3. Patologias associadas a infeção por Aspergillus spp _______________________________ 8
3.1. Aspergilose bronco pulmonar alérgica (ABPA) __________________________________ 9 3.2. Aspergiloma ______________________________________________________________ 9 3.3. Aspergilose invasiva (AI) ___________________________________________________ 9
4. Infeções nosocomiais ________________________________________________________ 9 5. Objetivos da dissertação _____________________________________________________ 10 2. MATERIAL E MÉTODOS ____________________________________________________ 11 1. Amostras biológicas _________________________________________________________ 11 1.1. Colheita __________________________________________________________________ 11 Amostras clínicas ______________________________________________________________ 11 Amostras ambientais ____________________________________________________________ 11 1.2. Processamento cultural ______________________________________________________ 12 1.3. Identificação molecular ______________________________________________________ 13 1.3.1. Procedimento _________________________________________________________ 13 Ø Extração de DNA _________________________________________________________ 13 Ø PCR (Polymerase Chain Reaction) para identificação das espécies de Aspergillus spp ___ 13 ITS (Internal transcribed spacer) _______________________________________________ 13 Calmodulina ________________________________________________________________ 14
IV Ø Gel de eletroforese ________________________________________________________ 15 Ø Purificação ______________________________________________________________ 15 Ø Sequenciação _____________________________________________________________ 15 ITS _______________________________________________________________________ 15 Calmodulina ________________________________________________________________ 16
β-tubulina ___________________________________________________________ 16
Ø
PCR (Polymerase Chain Reaction) para otimização da amplificação do gene Cyp51A__
17 Ø Especificidade do primer ___________________________________________________ 17 PCR (Polymerase Chain Reaction) em tempo real __________________________________ 18 Ø Deteção Aspergillus fumigatus sensu stricto em amostras ambientais _________________ 18 Ø Deteção de mutações de Aspergillus fumigatus que conferem resistência aos azóis por PCRtempo real _______________________________________________________________ 19
2. Teste de susceptibilidade aos antifúngicos _______________________________________ 20
2.1. Meios de screening _________________________________________________________ 20 2.2. Microdiluições _____________________________________________________________ 20 3. RESULTADOS _______________________________________________________________ 22 Resultados culturais das amostras clínicas ___________________________________________ 22 Resultados culturais das amostras ambientais _________________________________________ 22 Superfície __________________________________________________________________ 22 Ar (líquido) _________________________________________________________________ 23 Terra ______________________________________________________________________ 24 Determinação da susceptibilidade aos antifúngicos ____________________________________ 27 Determinação da suscetibilidade dos isolados provenientes de amostras clínicas _____________ 27 Determinação da suscetibilidade dos isolados provenientes de amostras ambientais ___________ 28 Otimização das condições de PCR do gene Cyp51A para deteção Aspergillus fumigatus sensu stricto em amostras ambientais ____________________________________________________ 32 Especificidade do primer _________________________________________________________ 33 PCR (Polymerase Chain Reaction) em tempo real _____________________________________ 34 Deteção Aspergillus fumigatus sensu stricto em amostras ambientais ___________________ 34 Deteção de mutações de Aspergillus fumigatus que conferem resistência aos azóis por PCR em tempo real __________________________________________________________________ 34
4. DISCUSSÃO _________________________________________________________________ 37
Caraterização de isolados de Aspergillus spp. ________________________________________ 37 Caraterização dos padrões de suscetibilidade aos antifúngicos dos isolados recolhidos ________ 39 Otimização das condições de PCR do gene Cyp51A ___________________________________ 40 Especificidade do primer _________________________________________________________ 40 PCR tempo real ________________________________________________________________ 41 Deteção Aspergillus fumigatus sensu stricto em amostras ambientais ___________________ 41 Deteção de mutações de Aspergillus sp. que conferem resistências aos azóis por PCR em tempo real _______________________________________________________________________ 42 Conclusões finais e perspetivas futuras ______________________________________________ 43
5. BIBLIOGRAFIA _____________________________________________________________ 45 6. ANEXOS ____________________________________________________________________ 49
Anexo 1: meios de screening de resistência aos azóis (meios seletivos de crescimento de isolados resistentes) ___________________________________________________________________ 49 Anexo 2: procedimento microdiluições _____________________________________________ 50 Anexo 3: produção cientifica associada a este estudo – publicações em poster _______________ 53
V
VI
Lista de Tabelas
Tabela 1.1: Diferenças entre espécies crípticas de Aspergillus fumigatus sensu stricto ___________ 4 Tabela 2.1: Valores de ciclo limite (Threshold) e Temperatura de Melting do controlo positio _____ 19 Tabela 2.2: Valores de Temperatura de Melting da amostra se wildtype para os diferentes loci cuja mutação confere resistência aos azóis _________________________________________________ 20 Tabela 2.3: Valores de Temperatura de Melting da amostra se mutante para os diferentes loci cuja mutação confere resistência aos azóis _________________________________________________ 20 Tabela 2.4: Diferenças entre os dois métodos de determinação da suscetibilidade aos antifúngicos _______________________________________________________________________________ 21 Tabela 2.5: Valores do corte epidemiológicos do corte para a anfotericina B, voriconazol e posaconazol para as espécies de Aspergilus _____________________________________________ 21 Tabela 3.1: Resultados culturais das amostras ambientais de superfície em meios de malte _______ 23 Tabela 3.2: Resultados culturais das amostras ambientais de ar (líquido) em meios de malte ______ 24 Tabela 3.3: Resultados culturais das amostras ambientais de terra em meios de malte ___________ 24 Tabela 3.4: Identificação morfológica e molecular dos isolados de Aspergillus sp. encontrados nas amostras ambientais recolhidas ______________________________________________________ 25 Tabela 3.4 (continuação): Identificação morfológica e molecular dos isolados de Aspergillus sp. encontrados nas amostras ambientais recolhidas _________________________________________ 26 Tabela 3.4 (continuação): Identificação morfológica e molecular dos isolados de Aspergillus sp. encontrados nas amostras ambientais recolhidas _________________________________________ 27 Tabela 3.5: Resultados culturais das amostras clínicas em meios de screening de itraconazol e voriconazol ______________________________________________________________________ 27 Tabela 3.5(continuação): Resultados culturais das amostras clínicas em meios de screening de itraconazol e voriconazol ___________________________________________________________ 28 Tabela 3.6: Suscetibilidade aos antifúngicos dos isolados de Aspergillus sp. (provenientes de ambiente hospitalar), determinada através de meio de screening agar e microdiluições ___________________ 29 Tabela 3.6 (continuação): Suscetibilidade aos antifúngicos dos isolados de Aspergillus sp. (provenientes de ambiente hospitalar), determinada através de meio de screening agar e microdiluições _______________________________________________________________________________ 30 Tabela 3.6 (continuação): Suscetibilidade aos antifúngicos dos isolados de Aspergillus sp. (provenientes de ambiente hospitalar), determinada através de meio de screening agar e microdiluições _______________________________________________________________________________ 31 Tabela 3.7: Suscetibilidade aos antifúngicos das diferentes secções de Aspergillus sp. recolhidos em ambiente hospitalar ________________________________________________________________ 31 Tabela 3.7 (continuação): Suscetibilidade aos antifúngicos das diferentes secções de Aspergillus sp. recolhidos em ambiente hospitalar ____________________________________________________ 32 Tabela 3.8: Amostras de ar utilizadas para a realização do PCR em tempo real _________________ 34 Tabela 3.9: Amostras utilizadas para deteção de mutações que conferem resistência aos azóis em
Aspergillus fumigatus sensu stricto ___________________________________________________ 35
Tabela 3.10: Resultados das análises às mutações do cyp51A com as condições testadas _________ 36 Tabela 4.1: Diferenças entre os isolados entre os dois métodos (meios de screening e microdiluições) de caraterização dos padrões de suscetibilidade aos antifúngicos ____________________________ 39 Tabela 4.2: Tabela comparativa dos resultados obtidos por métodos culturais e convencionais em algumas amostras de ar _____________________________________________________________ 42 Tabela 6.1: Resultados da extração e identificação molecular de leveduras de amostras da rotina do laboratório de micologia do Instituto Nacional de Saúde Doutor Ricardo Jorge _________________ 56
VII
Tabela 6.1 (continuação): Resultados da extração e identificação molecular de leveduras de amostras da rotina do laboratório de micologia do Instituto Nacional de Saúde Doutor Ricardo Jorge _______ 57 Tabela 6.2: Resultados da extração e identificação molecular de desmatófitos de amostras da rotina do laboratório de micologia do Instituto Nacional de Saúde Doutor Ricardo Jorge _________________ 57 Tabela 6.2 (continuação): Resultados da extração e identificação molecular de desmatófitos de amostras da rotina do laboratório de micologia do Instituto Nacional de Saúde Doutor Ricardo Jorge _______________________________________________________________________________ 58
VIII
Lista de Figuras
Figura 1.1: Representação esquemática da morfologia de um Aspergillus sp ___________________ 2 Figura 1.2: A Aspergillus fumigatus em placa de agar de Malte a 30ºC durante 7 dias; B conidióforos; C conídios. ______________________________________________________________________ 2 Figura 3.1: Gráfico representativo dos géneros fúngicos encontrados nas amostras clínicas analisadas _______________________________________________________________________________ 22 Figura 3.2: Resultado do gel de eletroforese da 2ª tentativa de otimizar as condições de amplificação de PCR com o primer cyp51A _______________________________________________________ 32 Figura 3.3: Resultado do gel de eletroforese da 5ª tentativa de otimizar as condições de amplificação de PCR com o primer cyp51A _______________________________________________________ 32 Figura 3.4: Resultado do gel de eletroforese da 11ª tentativa de otimizar as condições de amplificação de PCR com o primer cyp51A _______________________________________________________ 33 Figura 3.5: Fotografia do gel de agarose resultante do PCR para testar a especificidade do primer Cyp51A ________________________________________________________________________ 33 Figura 3.6: Pesquisa de DNA de Aspergillus fumigatus sensu stricto diretamente em amostras de colheitas ambientais de ar em meio líquido por amplificação do gene Cyp51A através de PCR em tempo real com Sybergreen _________________________________________________________ 34 Figura 3.7: Temperatura de melting do locus onde ocorre mutaçãoo L989H (flurocromo verde) no gene CYP51A em Aspergillus fumigatus sensu strico _____________________________________ 35 Figura 3.8: Temperatura de melting do locus onde ocorre mutaçãoo TR34 (flurocromo amarelo) no gene CYP51A em Aspergillus fumigatus sensu strico _____________________________________ 35 Figura 3.9: Temperatura de melting do locus onde ocorre mutaçãoo T289A (flurocromo laranja) no gene CYP51A em Aspergillus fumigatus sensu strico _____________________________________ 36 Figura 3.10: Temperatura de melting do locus onde ocorre mutaçãoo Y121F (flurocromo vermelho) no gene CYP51A em Aspergillus fumigatus sensu strico _____________________________________ 36 Figura 6.1: Ilustração do procedimento de distribuição do solvente pelos eppendorf’s ___________ 50 Figura 6.2: Excerto de artigo “Fungos e Ambiente Hospitalar: Preocupações relevantes e riscos para o doente” _________________________________________________________________________ 52 Figura 6.3: Poster apresentado no “Annual Meeting of International Society of Exposure Science” _ 53 Figura 6.4: Poster apresentado no “7th Advances against of Aspergilosis ______________________ 54 Figura 6.5: Ata do congresso no “Annual Meeting of International Society of Exposure Science” __ 55
IX
Lista de Abreviaturas
ABPA aspergilose bronco pulmonar alérgica AI aspergilose invasiva
ATCC American Type Culture Collection ATPase adenosinatrifosfatases
BLAST Basic Local Alignment Search Tool CLSI Clinical and Laboratory Standards Institute
CMI Concentração mínima inibitória DMSO dimetilsulfóxido
ESTSEL Escola Superior de Tecnologia de Lisboa
EUCAST European Committee on Antimicrobial Susceptibility Testing g grama
H2O água
HIV vírus da imunodeficiência humana
INSA Instituto Nacional de Saúde Doutor Ricardo Jorge ITS Intergenic Transcribed Spacer
l litro
max máximo
MEA malte extrato de agar mg/ml miligrama/mililitro MgCl2 cloreto de magnésio
min mínimo mm milímetros
MOPs Ácido 4-morfolinopropanosulfónico ou Ácido 3- (N-morfolinopropanosulfónico)
N Número
NaOH hidróxido de sódio
NEQAS National External Quality Assessment Scheme
nm
nanómetropb Número de pares de bases de resíduos de nucleótidos (base pairs) PBS Tampão fosfato salino (Phosphate Buffered Saline)
PCR Polymerase Chain Reaction pH Potencial hidrogeniónico
RPMI Roswell Park Memorial Institute medium
Taq Thermus aquaticus
TMO transplante de medula óssea ufc unidades formadoras de colónias
X
Resumo
Aspergillus sp. é um fungo potencialmente patogénico com elevada letalidade em doentes
imunocomprometidos, nomeadamente transplantados e sob terapias imunossupressoras. Por se tratar de um fungo ambiental cosmopolita, a qualidade microbiológica do ambiente hospitalar que rodeia este tipo de doentes reveste-se de particular importância. Assim, este estudo teve como objetivo a deteção e caracterização de isolados de Aspergillus spp. em ambiente hospitalar. Para tal, foram analisadas 51 amostras ambientais (ar, superfície e substrato). O género fúngico mais frequentemente isolado foi Penicillium em 33% das amostras. Apesar de menos frequente, Aspergillus sp. foi isolado em 18% das amostras. O número de unidades formadoras de colónias variou entre 0 e 111 ufc/m3 no ar, 0 e 1000 ufc/m2 nas superfícies e 55 e 175 ufc/g na terra. Usando uma abordagem polifásica na identificação e apenas após aplicação de metodologias moleculares, verificou-se que 63% dos isolados eram espécies crípticas, sendo que a espécie críptica mais prevalente Aspergillus protuberus (27%), pertencente à secção de Aspergillus versicolor.
Outro dos objetivos desta dissertação foi a caracterização dos padrões de susceptibilidade aos antifúngicos dos isolados de Aspergillus spp. recolhidos, para isso foram realizadas duas técnicas: meios screening (itraconazol e voriconazol) e microdiluições (anfotericina B, posaconazol e voriconazol). As metodologias mostraram elevada percentagem de concordância e apresentam-se como complementares. Não se detetaram resistências nos isolados pertencentes à secção Fumigati, enquanto os isolados da secção Versicolores foram aqueles que apresentaram valores mais elevados de concentrações mínimas inibitórias para diferentes antifúngicos. Através dos meios de screening foram ainda pesquisados isolados Aspergillus sp. resistentes aos azóis em exsudados nasais de trabalhadores de uma indústria corticeira. Foram detetados, em dois dos trabalhadores, três isolados de Aspergillus sp. com susceptibilidade reduzida ao itraconazol, dois deles pertencentes à secção Niger e um à secção
Fumigati. A confirmação desta redução na susceptibilidade ao itraconazol não foi possível efetuar
pelo método de referência. A otimização de um PCR específico usando o primer cyp51A permitiu desenvolver uma metodologia de PCR em tempo real com elevada sensibilidade e que permite a deteção rápida de Aspergillus fumigatus sensu stricto a partir de amostras ambientais críticas, nomeadamente ar colhido em ambiente hospitalar. Resultados preliminares obtidos para a deteção de mutações que conferem resistência aos azóis em Aspergillus fumigatus sensu stricto, por PCR efetuado diretamente na amostra, sugerem tratar-se de uma técnica com potencial no estudo destes
settings.
Como conclusão, a realização desta tese permitiu caracterizar detalhadamente os isolados de
Aspergillus spp. no que respeita à sua deteção, identificação molecular e suscetibilidade aos
antifúngicos. Os resultados obtidos permitiram estabelecer novos objetivos para desenvolvimentos futuros.
XI
Abstrat
Aspergillus sp. is a potentially pathogenic fungus with high lethality in immunocompromised
patients, namely the transplanted and the ones subjected to immunosuppressive therapies. Since this is an environmental fungus with a cosmopolitan distribution, the microbiological quality of the hospital environment surrounding these patients is of particular importance. Thus, this study aimed to detect and characterize isolates of Aspergillus sp. collected from hospital environment. For this purpose, 51 environmental samples (air, surface and substrate) were analysed. The most frequent fungal genus found was Penicillium. in 33% of samples. Although less frequent, Aspergillus sp. was isolated in 18% of the samples. The number of colony-forming units ranged from 0 to 111 ufc/m3 in the air, 0 and 1000 ufc/ m2 on the surfaces and 55 and 175 ufc/g in the studied substrate. Using a poliphasic approach to species identification and only after applying molecular methods, it was possible to verify that 63% of the isolates collected were considered as cryptic species. Aspergillus protuberus (belonging to section Versicolores) was the most frequent cryptic species found (27%).
Another objective of this dissertation was to characterization of the antifungal susceptibility patterns of the Aspergillus spp. isolates collected. Two techniques were used: screening media (itraconazole and voriconazole) and microdilutions (amphotericin B, posaconazole and voriconazole).
The two methodologies showed high percentage of agreement and we may consider them as complementary. No resistance was detected in isolates belonging to the Fumigati complex, whereas isolates belonging to the Versicolores complex showed the highest values of minimum inhibitory concentrations for different antifungal agents. Through the screening-media methodology, we also investigated isolates of Aspergillus spp. collected in nasal exudates of workers from a cork industry.
Three isolates of Aspergillus sp. (collected from two workers) presented reduced susceptibility to itraconazole. Two isolates belong to the Niger complex and one to the Fumigati complex. The confirmation of the reduced susceptibility of these isolates is not possible to perform by the reference method. The optimization of a PCR methodology using the cyp51A primer allowed the development of a high sensitivity real-time PCR methodology that allows rapid detection of Aspergillus fumigatus sensu strict from critical environmental samples. Preliminary results obtained for the detection of mutations that confer resistance to azoles in Aspergillus fumigatus sensu stricto by PCR done directly in the sample, suggest that this technique as potential in the study of these parameters.
In conclusion, the elaboration of this thesis allowed the detection and characterization of the
Aspergillus sp. isolates in regard to their. molecular identification and antifungal susceptibility. The
results obtained allowed to establishment of new goals for future studies.
1
1. Introdução
Os fungos são organismos pertencentes ao reino Fungi e caracterizam-se por serem eucariotas e heterotróficos. Na maioria dos casos desenvolvem filamentos ramificados e reproduzem-se tanto de forma sexuada como assexuada, produzindo esporos. [1] Caracterizam-se ainda por terem paredes celulares constituídas por quitina, β-glucano entre outros.
Uma grande variedade de fatores tem contribuído para o aumento do número de pessoas em risco de desenvolvimento de infeções fúngicas, incluindo espécies que nunca tinham sido descritas como patogénicas humanas. Inserem-se nestes fatores, o envelhecimento da população, que é representada em grande parte por pacientes com doenças degenerativas e neoplásicas, pacientes que sofreram transplantes de órgãos sólidos e de células estaminais hematopoiéticas, e pacientes que realizaram terapia imunossupressora. [2]. Por outro lado, os progressos feitos no desenvolvimento e na melhoria das terapias contra as doenças humanas têm feito com que haja um aumento da sobrevivência de pacientes com doenças graves e de pacientes com deficiência do sistema imunitário. Como consequência de uma acumulação dos fatores de risco há um favorecimento da progressão de doenças infeciosas, tais como as infeções fúngicas invasivas. [3]
Os fungos cosmopolitas potencialmente patogénicos mais frequentes são a Candida sp., o
Aspergillus sp., o Pneumocystis sp. e o Cryptococcus sp. Estima-se que estas espécies de fungos
causem pelo menos 1,4 milhões de mortes por ano em todo o mundo. As infeções causadas por
Aspergillus sp. são as segundas infeções fúngicas invasivas mais frequentes (a seguir às causadas por Candida sp.) e são as infeções microbianas mais comuns em transplantes de células estaminais
hematopoiéticas. [3,4]
1. Género Aspergillus
O género Aspergillus pertence ao filo Ascomycota, ao reino Fungi, à ordem Eurotiales e à família
Thichonomacea. Os pertencentes ao género Aspergillus caracterizam-se por serem organismos
filamentosos. Na fase anamórficas, ou seja, assexuadas, a reprodução é realizada através de esporos assexuais, chamados conídios. [1]
Este género é considerado bastante diverso, sendo constituído por 344 espécies [5] tendo um grande impacto económico e também social. As espécies pertencentes a este género podem-se encontrar em todo o mundo e em diversos habitats.
Muitas espécies de Aspergillus sp. são utilizadas na biotecnologia para a produção de vários metabolitos tais como antibióticos, ácidos orgânicos, enzimas, medicamentos, ou como fermentadores na indústria alimentar. [6]
Contaminam comummente alimentos e algumas produzem micotoxinas. Raramente a inalação de conídios por indivíduos saudáveis (imunocompetentes) provoca algum efeito adverso, uma vez que os conídios são eliminados de forma relativamente eficaz pelos mecanismos de imunidade inata do ser humano. No entanto, algumas espécies são frequentemente descritas como patogénicas para humanos e animais, sendo responsáveis por um largo espectro de infeções fúngicas, nomeadamente: [1,2,5,6,7]
− aspergilose bronco pulmonar alérgica (desenvolve-se essencialmente em indivíduos susceptíveis que estão frequentemente expostos a elevadas concentrações de conídios);
− aspergiloma (crescimento de uma massa fúngica no interior das cavidades pulmonares resultantes de sequelas em pacientes com tuberculose prévia);
− aspergilose invasiva (disseminação para diferentes órgãos, normalmente fatal em doentes imunocomprometidos).
2
As patologias associadas a este género (nomeadamente Aspergillus fumigatus) afetam maioritariamente os pulmões, embora também possam ocorrer noutros órgãos. [8,9,10]
No ponto 4 da introdução desta dissertação, serão descritas mais detalhadamente as patologias associadas a Aspergillus sp.
1.1. Morfologia
A morfologia é uma parte importante na identificação de espécies, nomeadamente das espécies do género Aspergillus, sendo feita maioritariamente através da observação da tipologia da colónia (macro morfologia) e da morfologia dos conídios e conidióforos (micro morfologia). A cabeça aspergilar situa-se no topo de um conidióforo que se dilata na sua extremidade formando a vesícula. As células produtoras de esporos (fiálides) são suportadas diretamente pela vesícula ou por uma camada de células estéreis chamadas métula. As fiálides podem cobrir toda a vesícula ou apenas o seu topo, sendo a sua disposição uma característica essencial na identificação morfológica das diferentes espécies de Aspergillus spp. A partir da extremidade das fiálides, surgem os conídios cujas dimensões são variáveis consoante a espécie. Na base dos conidióforos, sustentados por uma célula basal, encontram-se as hifas (Figura 1.1). [1]
1.2. Identificação de espécies do género Aspergillus
Figura 1.1: Representação esquemática da morfologia de um Aspergillus spp. [2014, Valente, J.]
Figura 1.2: A Aspergillus fumigatus em placa de agar de Malte 30ºC durante 7 dias. B conidióforos. C
conídios. [8]
3
A correta identificação de isolados de Aspergillus spp. é um fator bastante importante, sendo que as mais recentes descobertas, têm demonstrado que infelizmente, muitas estirpes continuam a ser identificadas de forma incorreta. Isto acontece, pois a sua identificação é feita através da observação de características fenotípicas (observação da morfologia das colónias e identificação microscópica), havendo espécies de Aspergillus spp. morfologicamente idênticas entre si, por vezes indistintas morfologicamente, mas ao serem analisadas a nível molecular verifica-se serem espécies diferentes (as denominadas espécies crípticas, todas pertencentes à mesma secção de espécies). Por outro lado, por vezes, as estirpes isoladas de tecidos humanos ou animais tendem a ter uma esporulação mais restrita e podem mostrar diferenças na micromorfologia, como os conidióforos serem mais ramificados, alongados ou os conídios variarem bastante em termos de tamanho e forma. Esta variação faz com que seja habitual a sua má identificação, levando a que fossem descritas "novas" espécies de Aspergillus
spp. de origem clínica, onde se inclui o Aspergillus fumigatus. Através de vários estudos percebeu-se
que através da biologia molecular e através da filogenia todas as espécies são sinónimas do
Aspergillus fumigatus, tendo sido revista recentemente a taxonomia das espécies de Aspergillus fumigatus e afins, através de parâmetros moleculares, morfológicos e fisiológicos. [6,8,12]
1.3. Secções e espécies crípticas
Assim, de acordo com metodologias moleculares recentes verificou-se que o género Aspergillus é dividido em oito subgrupos que, por sua vez são, subdivididos em várias secções que incluem uma grande variedade de espécies estritamente relacionadas (crípticas). As seções clinicamente mais relevantes são Fumigati, Flavi, Terrei, Usti, Nigri e Nidulantes. A maior parte dos estudos utiliza a sequenciação da região Intergenic Transcribed Spacer (ITS) do DNA ribossomal que permite a identificação da espécie de Aspergillus spp. ao nível da secção. A sequenciação através de genes adicionais por vezes é necessária para ter uma melhor especiação, como é o caso da ß-tubulina e calmodulina que têm uma grande variabilidade interespecífica e são relativamente conservados entre espécies. [13] É através da sequenciação destes genes que é possível identificar espécies crípticas dentro das diferentes secções de Aspergillus spp. Estudos moleculares realizados revelaram que existem numerosas espécies crípticas nas diferentes seções do género Aspergillus [5,10].
Quando fazemos apenas a identificação morfológica ou através da sequenciação da região ITS, falamos apenas ao nível da secção, só poderemos designar a espécie identificada por sensu lato e apenas após sequenciação dos referidos genes podemos identificar a espécie como sensu stricto ou como uma das suas espécies crípticas.
Por exemplo, Aspergillus fumigatus pertence ao subgénero Fumigati, secção Fumigati. Dentro desta secção, podemos encontrar a espécie Aspergillus fumigatus sensu stricto e as suas espécies crípticas (Aspergillus lentulus, Aspergillus udagawae, Aspergillus viridinutans, Aspergillus
felis, Aspergillus fischeri, Aspergillus pseudofischeri, Aspergillus hiratsukae).
É muito importante a correta identificação das espécies crípticas de Aspergillus spp., pois podem variar em algumas características clinicamente relevantes, nomeadamente a virulência e o perfil de resistência aos antifúngicos. [12]
Aspergillus fumigatus
Aspergillus fumigatus, descrito por Johann Baptist Georg Wolfgang Fresenius em 1863, trata-se de
um fungo filamentoso cosmopolita. Este fungo desempenha um papel importante, na decomposição aeróbica de matérias orgânicas e na reciclagem do carbono e do azoto ambiental. O seu habitat natural é o solo, onde sobrevive e cresce alimentando-se de detritos orgânicos, tendo sido reportada a sua presença em vários substratos por todo o mundo. [8,9,10]
4
Não é considerado um dos fungos mais prevalentes do mundo, mas é um dos mais ubíquos, ou seja, têm a capacidade de estar presente em diversos habitats, tais como: na água, no solo, em alimentos, animais, plantas, em humanos e em detritos. Trata-se de uma espécie termo tolerante, capaz de crescer a temperaturas superiores a 55ºC, sobrevivendo a 70ºC. [1,8,9]
Ao longo dos últimos anos o Aspergillus fumigatus têm vindo a emergir como fungo patogénico, provocando assim infeções invasivas graves e habitualmente fatais em pessoas imunocomprometidas em países desenvolvidos. [8,9]
Os isolados de Aspergillus fumigatus típicos produzem colónias escuras azul esverdeado em placas de malte, podendo existir Aspergillus fumigatus menos pigmentados apresentando conídios brancos. [6,8,10] A cabeça aspergilar situa-se no topo de um conidióforo curto e de parede lisa e apresenta a forma de uma coluna de fiálides compactas. A partir da ponta das fiálides, surgem os conídios que são de pequenas dimensões (2-3mm). Apresentam vesículas (20-30 um diâmetro), normalmente férteis na metade superior. As fiálides são suportadas diretamente na vesícula (6-8 x 2-3 um). [1]
Aspergillus fumigatus sensu stricto
O Aspergillus fumigatus sensu lato é dividido em cinco outros grupos, onde se encontra o
Aspergillus fumigatus sensu stricto. A sua morfologia varia um pouco, sendo que a largura das estrias
dos conidióforos varia 3,5-10 µm, a maioria das cepas apresentam vesículas subclavadas (10-26 µm diâmetro). Em comparação, a maioria das vesículas são mais largas (22 µm), mais estreitas e todas as estirpes de Aspergillus fumigatus sensu stricto crescem a 50ºC, mas não a 10ºC em meio de malte. [10]
As características fenotípicas permitem distinguir os Aspergillus spp. ao nível da secção, não sendo possível a identificação exata das espécies. O Aspergilus fumigatus sensu stricto em comparação como outros Aspergillus spp. Da secção Fumigati pode apresentar características morfológicas diferentes, estando descritas na Tabela 1.1. [14]
Tabela 1.1: Diferenças entre espécies crípticas de Aspergillus fumigatus e sensu stricto. [14]
Aspegillus fumigatus sensu stricto Espécies crípticas Aspergillus fumigatus
Resistência – Triazóis raro redução da susceptibilidade
Macroscopia aveludado
verde – azulado
esbranquiçada pálido verde-azul
Microscopia vesículas: piriforme
22 mm vesículas: globosa, mais pequena 15 mm
Crescimento max: > 55ºC
min: 37ºC
max: 45ºC min: 10ºC
Porque é que Aspergillus fumigatus é bem-sucedido?
Em termos da distribuição global e de prevalência o Aspergillus fumigatus é sem dúvida um organismo evolutivamente bem-sucedido. Uma das razões para o sucesso da espécie é a capacidade de produzir inúmeros conídios por reprodução assexuada e pelo pequeno diâmetro dos conídios o que ajuda a dispersar e também permite a penetração profunda nos alvéolos do pulmão, um factor chave ligado à patogenicidade. [10] Um outro fator de virulência é a sua termotolerância, apresentando capacidade para crescer a temperaturas elevadas. A produção de gliotoxina [5] está também associada a um aumento da sua patogenicidade uma vez que esta enzima permite uma invasão da hifa fúngica no tecido pulmonar. Por último, as evidências apontam para a possibilidade de Aspergillus fumigatus ter a
5
capacidade se reproduzir sexuadamente, o que aumenta a sua variabilidade genética e, consequentemente, a sua adaptabilidade. [6,10]
2. Tratamento
2.1. Antifúngicos utilizados
Atualmente existem três principais famílias de antifúngicos utilizados na prática clínica de tratamento de infeções fúngicas invasivas.
Os polienos (são representados pela anfotericina B e pela nistatina); os azóis (constituídos pelo itraconazol, fluconazol, voriconazol, posaconazol, ketoconazol e pelo miconazol); e as equinocandinas, são representadas pela caspofungina, a micafungina e pela anidulafungina. [3,4,15]. Ao longo dos últimos anos houve um incremento de novos antifúngicos, proporcionando aos médicos uma maior variedade nos tratamentos. O uso crescente de antifúngicos têm provocado uma pressão seletiva maior sobre as diferentes espécies/estirpes de fungos, levando ao aparecimento de resistências: as espécies/estirpes sensíveis vão sendo substituídas por estirpes resistentes, havendo assim uma modificação na epidemiologia das infeções fúngicas, levando a um desenvolvimento de resistências secundárias em várias espécies/estirpes. [4]
A realização de testes de susceptibilidade a determinados antifúngicos, torna possível detetar mais precocemente resistências aos antifúngicos e desta forma torna-se mais fácil de determinar o melhor tratamento para um determinado fungo. [4]
2.1.1. Polienos
Os Polienos são uma classe de antifúngicos que é representada pela anfotericina B e pela nistatina. Estes são absorvidos e administrados via oral. Em infeções orais, da faringe ou periorais. A administração é feita de forma tópica, sendo também por vezes utilizada de forma intravenosa no tratamento de infeções fúngicas sistémicas. [15]
Anfotericina B (AMB)
A anfotericina B é considerada o antifúngico mais eficaz para o tratamento da aspergilose invasiva, apresentando uma atividade clínica útil à semelhança da caspofungina e dos azóis, no tratamento primário da aspergilose invasiva. Também é utilizada no tratamento de diversas outras infeções fúngicas. [15,16,17] Este antifúngico demonstra uma elevada atividade contra várias espécies de fungos. A maioria dos Aspergillus fumigatus são inibidos por concentrações de 0,03 a 1 mg/ml de anfotericina B, sendo que esta não produz efeitos em bactérias ou em vírus. [15]
Mecanismo de ação: A anfotericina B tem a capacidade de se ligar à membrana plasmática do fungo, a qual é constituída pelo ergoesterol necessário para manter a integridade desta mesma membrana. O ergosterol contribui para uma variedade de funções celulares, incluindo a fluidez e a integridade da membrana, bem como a função adequada de enzimas ligadas à membrana, tal como as proteínas associadas com o transporte de nutrientes e a síntese de quitina. [10]
A anfotericina B cria canais pelos quais atravessam iões de potássio, resultando assim num aumento da permeabilidade aos catiões e na interrupção do gradiente de protões, inibindo assim as bombas de protões ATPase. Isto faz com haja um esgotamento das reservas energéticas celulares, o que resulta num aumento da fragilidade da membrana podendo causar danos oxidativos na mesma. [3,8,17]
6
Resistência: as resistências a esta classe de antifúngicos são extremamente raras no género
Aspergillus. A maioria dos isolados de Aspergillus terreus são resistentes à anfotericina B, in vitro,
não sendo claros os mecanismos da resistência intrínseca de Aspergillus terreus a este antifúngico. Foi recentemente observada a resistência à anfotericina B em Aspergilus fumigatus, mas é rara. [8,17]
2.1.2. Azóis / Triazois
Na prática médica, os azóis e mais especificamente os triazóis são os antifúngicos mais utilizados. Possuem um largo espectro de atividade in vitro, sendo agentes terapêuticos importantes para o tratamento sistémico e de prevenção de infeções fúngicas graves, incluindo a aspergilose. Os triazóis apresentam uma toxicidade geral, significativamente menor quando comparados com a anfotericina B. [3,7,16,15]
A via de ergosterol é necessária para a biossíntese de um dos principais constituintes da membrana plasmática fúngica (ergosterol) e é o alvo para os azóis.
Itraconazol
Em contraste com a anfotericina B, o modo de ação do itraconazol é bem caracterizado. [8]
O itraconazol atua contra um largo espectro de fungos (incluindo Aspergillus spp. [15]) que podem causar infeções superficiais e sistémicas, sendo eficaz em pacientes imunocomprometidos menos graves, pois são capazes de absorver itraconazol do trato gastrointestinal, tais como transplantados de órgãos, doentes com anemias e doentes HIV+, sendo também eficaz em pacientes nos quais o tratamento com anfotericina B falhou. [8,15]
Voriconazol
O voriconazol exerce uma ação antifúngica de largo espectro, sendo utilizado no tratamento de infeções graves e é considerado o antifúngico de eleição para o tratamento de aspergilose invasiva. [18]
Vários estudos demonstram que a maioria das estirpes de Aspergillus spp. são totalmente suscetíveis ao voriconazol, embora a sua utilização tenha vindo a ser alterada desde que começou a ser utilizado na pratica clínica. [15,18]
Posaconazol
Este antifúngico possui uma atividade antifúngica de largo espectro in vitro contra o Aspergillus spp. (Aspergillus fumigatus, Aspergillus flavus, Aspergillus terreus, Aspergillus nidulans, Aspergillus
ustus). Encontra-se indicado para o tratamento de várias infeções fúngicas, entre as quais está a
aspergilose invasiva, a quando da rejeição com o tratamento com a anfotericina B, sendo também é indicado para a profilaxia de infeções fúngicas invasivas. [15]
Mecanismo de ação dos triazóis referidos: interferem com a biossíntese do ergosterol que se encontra presente na membrana dos fungos, através da inibição da enzima do citocromo P-450 14alfa-desmetilase (codificada pelo gene cyp51A) que catalisa um passo essencial na biossíntese do ergoesterol: a conversão do lanosterol em ergoesterol, levando à acumulação intracelular de 14alfa-desmetilase e realizada pela alteração da função celular. A inibição do citocromo impede a síntese do ergosterol nas membranas dos fungos, alterando a fluidez da membrana, alterando a via de síntese e na
7
acumulação de fosfolipídeos e dos ácidos gordos insaturados dentro das células fúngicas. Trata-se de um mecanismo seletivo, não afetando as células hospedeiras. [7,15]
Resistências: O primeiro caso publicado de isolados de Aspergilllus fumigatus resistentes ao itraconazol apareceu em 1979. Apesar de ser incomum, a resistência aos azóis em Aspergillus
fumigatus é cada vez mais importante. [8,17]
2.1.3 Equinocandinas
As equinocandinas, do qual é exemplo a caspofungina, pertencem a uma classe de antifúngicos recente, atuando através de um novo mecanismo que inibe um componente essencial na parede celular das células dos fungos, competindo com a síntese do glucano, que não se encontra presente nas células animais, razão pela qual esta classe de antifúngicos revelam um perfil excelente em termos de tolerância. [15]. As equinocandinas vieram resolver alguns dos problemas relacionados com terapias antifúngicas, em particular com azóis, dada a necessidade de ajustamento da dose administrada consoante a idade, a função renal e hepática. [15]
Mecanismo de ação: as equinocandinas inibem e bloqueiam a enzima que faz a biossíntese da parede celular fúngica, através da inibição da biossíntese do ß-glucano, componente essencial da parede celular de Aspergillus spp. Como o ß-D-glucano não está presente nas células dos mamíferos, a atividade da caspofungina revela-se especifica para fungos. [1,3,15]
2.2. A problemática da resistência aos antifúngicos
Tal como referido anteriormente, com a melhoria dos tratamentos de transplantes de órgãos, de medula óssea e de doentes HIV+, o número de pessoas em risco de desenvolver infeções fúngicas aumentou bastante. Ocorreu também um desenvolvimento das moléculas antifúngicas utilizadas, bem como o aparecimento de novos antifúngicos. Esta combinação de fatores levou a uma utilização mais ampla dos diferentes antifúngicos e a um aumento da sua aplicação, que por sua vez levou ao aumento da frequência de resistências aos antifúngicos. As resistências foram descritas em praticamente todos os antifúngicos e em várias espécies, incluindo na Candida spp. e no Aspergillus spp. [1,3]
Nos últimos anos, têm sido observados novos padrões de resistência, incluindo o aparecimento de resistências simultâneas a diferentes classes de antifúngicos (resistências múltiplas), em diferentes espécies de Candida spp., ou resistências a diferentes moléculas antifúngicas pertencentes à mesma classe (Aspergillus spp. resistentes a vários azóis). [3]
Embora a resistência aos azóis em Aspergillus spp. tenha sido documentada desde o final da década de 1990, esta era incomum. No entanto, nos últimos anos estes relatos têm aumentado, tendo vindo a tornar-se num problema de saúde pública, sendo detetadas resistências em isolados clínicos e ambientais de Aspergillus fumigatus principalmente na Europa, como na Holanda, Espanha, Bélgica, Dinamarca, Suécia e França. [7,19,20,21]
2.2.1. Mecanismos de resistência aos azóis em Aspergillus fumigatus
Os mecanismos responsáveis pela resistência aos azóis em Aspergillus fumigatus baseiam-se na alteração da afinidade da enzima 14-esterol-desmetilase para o antifúngico, levando à produção do ergosterol, mesmo na presença de antifúngico. [8]. Esta enzima 14-esterol desmetilase está codificada pelo gene cyp51A. Mutações nas posições G54, G138, G448 e M220 ou a inserção de repetições de 34 a 36 pb (mutação TR34) - em tandem- na região promotora deste gene, juntamente com uma
8
substituição L98H (TR34/L98H) no gene cyp51A tem sido observadas em isolados clínicos e ambientais de Aspergillus spp.com resistência aos azóis. [4]
Mecanismo de resistência envolvendo estas mutações são detetadas por técnicas sofisticadas e dispendiosas, como o PCR ou PCR em tempo real com sondas específicas ou através da sequenciação de DNA. [7,17,19,22]
Foram descritos dois modelos diferentes para o desenvolvimento de resistências aos azóis em
Aspergillus fumigatus:
− Exposição a azóis por profilaxia ou mesmo por tratamento com esta classe de antifúngicos durante um período prolongado, ocorrendo maioritariamente em contexto clínico. Sendo detetadas várias mutações no gene Cyp51A, neste contexto que conferem resistência aos azóis. − Exposição aos azóis agrícolas em isolados ambientais de Aspergillus spp. e a pressão seletiva
causada por estes antifúngicos agrícolas leva a um aumento de isolados ambientais com menor suscetibilidade aos azóis. O rápido aparecimento de resistência aos triazois em isolados de
Aspergillus fumigatus foi atribuída à exposição de fungos ambientais a inibidores
14-desmetilase, estes são comummente usados para controlar o crescimento de fungos em flores ornamentais e em plantas de colheita. [19] Uma substancial quantidade de resíduos de azóis podem persistir ativos nos solos e na água durante vários meses, bem como em frutas e vegetais, pois as moléculas que constituem os azóis são muito estáveis. [4,20] Pessoas mais suscetíveis poderão inalar os seus esporos e desenvolver infeção. Foi detetado um mecanismo de resistência novo (mutação TR34/L98H) nestes isolados ambientais e verificou-se que era comum a isolados obtidos de doentes com infeção por Aspergillus spp. resistentes aos azóis, e que não estiveram previamente expostos a esta classe de antifúngicos. Este facto veio comprovar o novo modelo de desenvolvimento de resistência proposto. [20] De facto, num estudo na Holanda foram identificados cinco triazois agrícolas com semelhanças moleculares com os triazois médicos sendo capazes de induzir o mecanismo de resistência TR34/L98H in vitro. [16,22]
2.2.2. Multirresistência
O fenómeno de resistência a múltiplos antifúngicos é caracterizado pela aquisição dupla de resistência a compostos químicos que são estruturalmente diferentes causando problemas em diversos tratamentos de infeções fúngicas. [23]
É possível ocorrer resistência cruzada entre azóis, tendo sido demonstrada, in vitro e in vivo, a resistência cruzada entre o itraconazol e o posaconazol (estruturalmente semelhantes) sendo pouco provável ocorrer entre o itraconazol e o voriconazol (estruturalmente dissemelhantes). [17]
Dada a emergência de resistências aos antifúngicos que se tem verificado nos últimos anos em
Aspergillus spp., bem como o padrão de menor suscetibilidade que algumas espécies crípticas dentro
da mesma secção apresentam, torna-se essencial efetuar a determinação da suscetibilidade aos antifúngicos. Deste modo, poder-se-á caracterizar o perfil de suscetibilidades/resistências de isolados clínicos e ambientais (quer para melhor adequabilidade da terapia quer por questões epidemiológicas).
3. Patologias associadas a infeção por Aspergillus spp.
De uma forma geral, as patologias provocadas por Aspergillus são três: a aspergilose broncopulmonar alérgica, o aspergiloma e a aspergilose invasiva. Em todas as patologias o órgão primariamente envolvido é o pulmão e o Aspergillus fumigatus é a espécie dominante. [1]
9
3.1. Aspergilose Bronco Pulmonar Alérgica (ABPA)
A aspergilose bronco pulmonar alérgica é o resultado da resposta à hipersensibilidade das vias aéreas à colonização por Aspergillus spp., ocorrendo frequentemente em pessoas com asma e fibrose cística. Esta doença é indolente, ou seja, não têm dor, mas é potencialmente progressiva. A fisiologia patológica desta doença é complexa, havendo inflamação de locais resultantes da remoção ineficaz dos esporos, que leva por sua vez a um aumento da produção de muco, hiper-reactividade das vias aéreas, bronquiectasia, tosse recorrente e pieira. Na maioria das vezes desenvolve-se uma reação alérgica brônquica (asma), após a inalação de esporos de Aspergillus spp. [1,24]
3.2. Aspergiloma
Esta é a mais familiar infeção localizada provocada por Aspergillus spp. Normalmente, os aspergilomas desenvolvem-se em paciente com os pulmões estruturalmente anormais, com cavidades já pré-existentes, por exemplo em antigas cavidades provocadas pela tuberculose. O aspergiloma representa uma forma não invasiva de aspergilose pulmonar, formando uma massa semelhante a uma bola, constituída por uma malha intrincada de hifas normalmente de Aspergillus spp.1,25]
3.3. Aspergilose invasiva (AI)
A Aspergilose Invasiva (AI) pode ser definida como uma infeção oportunista que se tornou numa das principais causas de preocupação devido às elevadas taxas de morbidade e mortalidade em pacientes com doenças malignas hematológicas, com uma taxa de mortalidade média de 50% em pacientes com leucemia. A AI é, de facto, uma das principais causas de morte em centros de tratamento da leucemia, transplantes de medula óssea (TMO) e em unidades de transplante de órgãos sólidos. Este mau prognóstico é, em parte, devido às dificuldades em obter um diagnóstico precoce resultando num atraso prejudicial no início do tratamento antifúngico adequado. Como se trata de uma infeção de rápida progressão (1 a 2 semanas desde o o início até à morte), os médicos por vezes iniciam empiricamente o tratamento ao paciente ao invés de esperar para que o diagnóstico seja estabelecido. O principal agente etiológico da AI é Aspergillus fumigatus (em 90% dos casos), não sendo, no entanto, o único agente patogénico dentro deste género. [8,12,19,26,27]
4. Infeções nosocomiais
As infeções fúngicas invasivas adquiridas em ambiente hospitalar, especialmente a aspergilose, têm vindo a tornar-se um problema crescente em pacientes imunocomprometidos. [28] A exposição a bio aerossóis contaminados é problemática, nomeadamente em ambientes hospitalar, onde sob condições de temperatura e humidade adequadas, poderá ocorrer aumento da esporulação e de conídios presentes no ar e superfícies. Vários estudos têm demonstrado que a percentagem mais elevada de infeções nosocomiais é causada por fungos. [28]
Até há pouco tempo não existiam valores limite aceites em matéria de concentração de fungos no ar nos hospitais. [29] De acordo com alguns autores, os valores permitidos para a presença de fungos nas unidades de cuidados intensivos, não pode ser superior a 300 cfu/m3 no ar interior; nas salas de operações o número de cfu/m3 permitido é 0, enquanto que em salas de tratamento, o valor permitido é de 50 cfu/m3, e nas restantes unidades hospitalares o valor permitido é de 200 cfu/m3. [30]
Em muitos dos casos de AI é difícil determinar onde foram adquiridos, se dentro ou fora das instalações hospitalares. [19] Patterson et al. [31] definiu que um caso de infeção nosocomial de AI ocorre mais de uma semana após a entrada no hospital, ou em menos de 2 semanas.
10
Admite-se que o ambiente hospitalar é a principal fonte de contaminação dos pacientes que acabam por desenvolver AI; e a eliminação dos esporos de Aspergillus spp. deste ambiente foi mostrado que é importante para a redução da incidência de AI adquirida em hospitais. [26]
A deteção de Aspergillus fumigatus em unidades hospitalares com doentes de alto risco é uma importante forma de prevenção da AI nosocomial. De acordo com o guia da AIHA (American Industrial Hygiene Association), a presença confirmada de Stachybotrys chartarum, Aspergillus
versicolor, Aspergillus flavus, Aspergillus fumigatus e Fusarium moniliforme em ambiente hospitalar
exige a toma de decisões que levem à implementação de medidas corretivas e preventivas. [30]
Foram recentemente encontrados Aspergillus fumigatus na água de hospitais, sendo claro que é importante e que têm potenciais implicações para a prevenção de infeções. Também vários estudos relatam de que o ar dos hospitais se encontra contaminado com esporos de Aspergillus spp. [19]. Os pacientes poderão, pois, desenvolver infeção após inalação de esporos presentes nestes reservatórios. De acordo com alguns estudos, em 2009 demonstrou-se pela primeira vez que os pacientes com AI causada Aspergillus fumigatus resistente aos azóis possam ter adquirido esta estirpe no meio ambiente, tendo sido encontrados azóis no solo e em compostagem em locais envolventes aos hospitais. [19,20]
A propagação de Aspergillus fumigatus resistentes a azóis por transmissão pessoa-a-pessoa é uma situação extremamente rara e só ocorre se aerossóis estiverem contaminados com conídios infetados. Isto apenas pode ocorrer em pacientes com aspergiloma, tendo uma cavidade na qual pode ocorrer a esporulação e os conídios poderem ser transmitidos através da tosse e da infeção se poder desenvolver através da re-inalação por um hospedeiro suscetível, embora este é extremamente raro. [16]
5. Objetivos da dissertação
Esta dissertação teve como principais objetivos a deteção e caracterização de isolados de
Aspergillus spp. em ambiente hospitalar.
A caracterização dos isolados encontrados foi realizada através de técnicas moleculares (nomeadamente sequenciação da região ITS -Internal transcribed spacer - e dos genes que codificam a β-tubulina e calmodulina)fim de proceder à identificação até ao nível da espécie.
Efetuou-se ainda a caracterização dos padrões de susceptibilidade aos antifúngicos dos isolados recolhidos, através de duas técnicas diferentes e complementares: meios de screnning para deteção de isolados resistentes aos azóis e microdiluições em placa (método de referência CLSI).
Pretendeu-se também com este trabalho desenvolver uma metodologia que permita de forma mais rápida e eficaz a deteção de Aspergillus fumigatus a partir de amostras ambientais críticas, nomeadamente ar colhido em ambiente hospitalar.
11
2. Material e Métodos
1. Amostras biológicas 1.1. ColheitaForam recolhidas um total de 51 amostras ambientais e 105 amostras clínicas para pesquisa de
Aspergillus spp.
As amostras ambientais foram obtidas através de colheitas realizadas (ao longo de um dia, durante o mês de Março de 2016) num hospital da grande área de Lisboa. Estas colheitas ambientais inserem-se no âmbito de um estudo de vigilância em Aspergillus spp. que tem vindo a inserem-ser deinserem-senvolvido na Unidade de Referência de Infeções Parasitárias e Fúngicas do INSA. Neste estudo foram já efetuadas colheitas em ambiente hospitalar (no mesmo hospital) em anos prévios.
As amostras clínicas foram obtidas em colheitas realizadas aos trabalhadores de uma indústria corticeira durante vários dias de Setembro e Outubro de 2015.
Amostras clinicas:
As amostras clínicas recolhidas foram exsudados nasais de trabalhadores da indústria corticeira. A seleção deste grupo de estudo prende-se com o facto de estes trabalhadores estarem expostos a concentrações elevadas de esporos, que advém do trabalho inerente à manipulação do sobreiro, cortiça e seus derivados. Por se tratar de um potencial grupo de risco para exposição a fungos, nomeadamente
Aspergillus spp., realizou-se uma pesquisa da flora fúngica existente na cavidade nasal deste grupo de
indivíduos.
Amostras de exsudados nasais: foram colhidas 105 amostras clínicas aos trabalhadores da indústria corticeira. As amostras clínicas recolhidas foram exsudados nasais, colhidos através de zaragatoas, que foram conservadas imersas em soro fisiológico num eppendorf a 4ºC.
Amostras de ambientais:
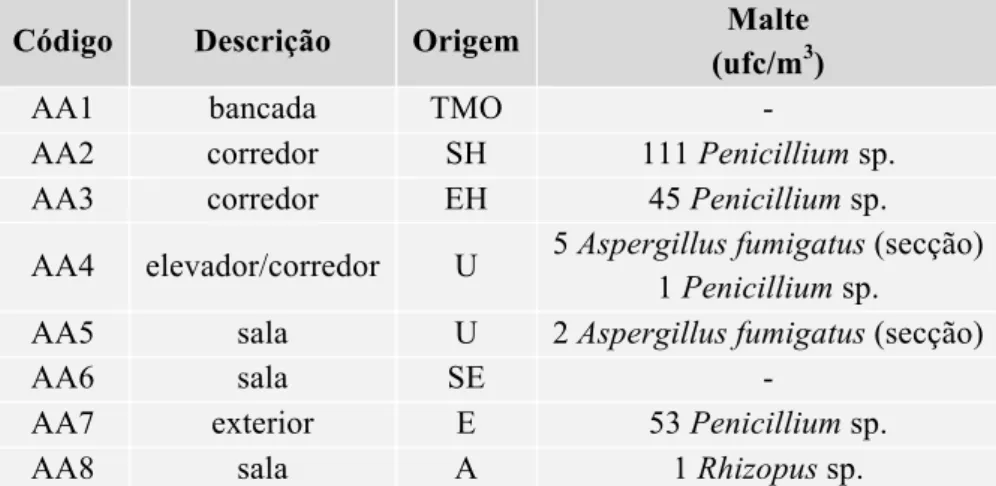
As amostras ambientais recolhidas foram: terra (n=2), ar (n=26) e superfícies (n=23) provenientes do hospital acima mencionado. Foram efetuadas colheitas em ambiente hospitalar, uma vez que este ambiente tem de estar o mais limpo possível e com baixas concentrações de esporos fúngicos, nomeadamente de Aspergillus spp., pois trata-se de um local onde se encontram internadas e circulam pessoas com o sistema imunitário debilitado e que estão, portanto, mais suscetíveis a desenvolver uma infeção grave. Como tal, foram realizadas recolhas ambientais na área do exterior e envolvente ao hospital (amostras de terra e de ar), tendo ainda sido também realizadas colheitas no interior do hospital (amostras de ar, terra e superfícies).
Amostras de terra: foram recolhidas 2 amostras de terra, uma das amostras foi terra de um jardim da área envolvente ao hospital (no exterior), sendo que a segunda foi uma amostra retirada de um vaso que se encontrava no corredor (no interior) do hospital analisado.
A colheita foi realizada recolhendo 50g de terra de cada um dos locais já referidos para um saco de plástico estéril. As amostras foram refrigeradas no transporte para o laboratório.
12
Amostras de ar: foram recolhidas 26 amostras de ar utilizando dois métodos de colheita diferentes: usando um coletor de ar por impacto em meio líquido em meio sólido (Millipore Air Tester, Millipore) e um coletor de ar em meio líquido tipo Impinger (Coriolis, Bertin Tecnologies). De cada local foram colhidos 900L de ar, a 1 metro de altura do chão e a uma velocidade de 140L/min, diretamente para os meios associados a cada amostrador de ar. Utilizando o método de impacto em meio sólidos, as amostras de ar para cada local foram colhidas sempre para 2 placas: sabouraud com itraconazol (4 µg/ml) e outra com sabouraud com voriconazol (2 µg/ml), anteriormente preparadas como está descrito no Anexo 1. Foram colhidas 16 amostras, correspondendo 10 dos corredores, 2 das salas da unidade de transplante de medula óssea, 4 da hematologia, 6 das urgências, 4 dos arquivos, 2 das consultas e também a um 2 do exterior.
Utilizando o amostrador coriolis, as amostras de ar foram recolhidas para um tudo estéril cónico contendo 10 ml de solução salina com tampão fosfato estéril e 0,05% Triton X-100. [2013, Viegas,C.] Foram recolhidas 7 amostras, correspondendo a 5 dos corredores, 1 das salas da unidade de transplante de medula óssea, 2 do serviço de hematologia, 2 das urgências, 1 do arquivo, 1 das consultas e também 1 do exterior (área envolvente). As amostras foram refrigeradas no transporte para o laboratório.
Amostras de superfície: foram recolhidas 23 amostras de superfície pelo método do molde quadrado por estria fina, de acordo com a norma ISO International Standard ISO 18593 (2004). Zaragatoas humedecidas em soro fisiológico foram passadas em estria nas superfícies a analisar de várias zonas interiores de um hospital da grande área de Lisboa. [32] foram recolhidas 23 amostras, correspondendo a 7 maçanetas, 3 paredes, 3 bancadas, 2 carrinhos de apoio, 2 mesas, 2 bancos, 1 janela e 3 painéis eletrónicos (máquina de senhas, botões de elevador). As amostras foram refrigeradas no transporte para o laboratório.
1.2. Processamento cultural
Amostras clínicas: as zaragatoas foram lavadas (por agitação em vortex) e 400µl do lavado plaqueados em 2 placas petri: uma contendo meios de sabouraud com itraconazol (4 µg/ml) e outra, meio de sabouraud com voriconazol (2 µg/ml), colocando-se a crescer em estufa a 37ºC durante 7 dias. Em estudo paralelo e complementar a decorrer na Escola Superior de Tecnologia de Lisboa (ESTSEL), as zaragatoas dos exsudados nasais dos mesmos trabalhadores foram inoculadas em placas de malte suplementado com cloranfenicol a 0,05%.
Amostras de terra: 40 g de cada amostra de terra recolhida foram estão diluídos em 40 ml de água destilada e agitou-se 30 min. Foram plaqueados 200µl do lavado através da técnica de espalhamento em 3 meios de cultura diferentes: meio de malte suplementado com clorofenicol 0,05%, meio de sabouraud com itraconazol (4 µg/ml) e meio de sabouraud com voriconazol (2 µg/ml). Foram colocadas a crescer na estufa a 37ºC durante 7 dias e efetuaram-se os cálculos necessários para os resultados obtidos serem apresentados em UFC (unidades formadoras de colónia) /g de terra. [32]
Amostras de superfície: os esfregaços (zaragatoas) das superfícies foram plaqueados por espalhamentos em 3 meios de cultura diferentes: meio de malte suplementado com clorofenicol a 0,05%, sabouraud com itraconazol (4 µg/ml) e com voriconazol (2 µg/ml) e foram posteriormente colocados na estufa a 37ºC durante 7 dias e efetuaram-se os cálculos necessários para os resultados obtidos serem apresentados em UFC/m2. [32]
13
As diferentes amostras recolhidas foram plaqueadas em vários meios de cultura: o meio de malte foi utilizado para crescimento e identificação de todos os isolados fúngicos presentes na amostra. Os meios de sabouraud suplementados com os antifúngicos itrazconazol e voriconazol (4 µg/ml e 2 µg/ml, respetivamente) foram utilizados para pesquisa de isolados potencialmente com os antifúngicos, uma vez que a concentração de antifúngico no meio de cultura é elevada e corresponde a um valor cujo crescimento de Aspergillus fumigatus indica estarmos perante um isolado potencialmente resistente.
Ao fim dos 7 dias, foram identificados todas os isolados encontrados. Para tal, efetuou-se a sua caracterização macro e microscópia. Para a observação das características macroscópicas, foram verificados a cor da frente e reverso da colónia, a sua topografia, textura. Para a observação microscópica, foram efetuadas preparações microscópicas através duas técnicas diferentes: colocando uma pequena porção da colónia, dissociada com o auxilio de lanceta, numa lâmina com uma gosta de azul de lactonfenol e lamela e ainda através da técnica da fita-cola. Posteriormente, foi realizada a observação e identificação morfológica ao microscópio com ampliação de 400x.
As placas com as culturas isoladas foram guardadas a 4ºC. Foram efetuadas em crio tubos, suspensões de esporos dos isolados de Aspergillus spp. Utilizou-se tampão PBST (PBS com 2% de Tween 80) e duas gotas de glicerol esterilizado para conservar estas as suspensões, que foram posteriormente guardadas a -80ºC. Todos os isolados de Aspergillus spp. foram analisados por biologia molecular, como referido no ponto 2, sendo o seu DNA inicialmente conservado a 4ºC (durante o processamento) e posteriormente congelado a -30ºC.
1.3. Identificação Molecular
A análise molecular foi realizada como metodologia complementar à identificação morfológica realizada e permitiu efetuar a identificação dos isolados até à espécie (dentro da secção). Esta análise é realizada através de várias etapas: extração de DNA, PCR de amplificação, gel de eletroforese, purificação e sequenciação, de seguida discriminadas em pormenor.
1.3.1. Procedimento:
Ø Extração de DNA
As extrações de DNA foram realizadas através da utilização de um kit de extração de DNA “High Pure PCR Template Preparation Kit” (Roche) de acordo com as instruções do fabricante (secção2.6 e 2.8) e disponíveis em: hhtps://cssportal.roche.com/LFR_PublicDocs/ras/11796828001_en_10.pdf. [11]
Ø PCR (Polymerase Chain Reaction) para identificação das espécies de Aspergillus spp.
Para identificação da secção de espécies a que pertencia cada isolado de Aspergillus spp. foi realizada uma reação de PCR que amplifica a região ITS (Internal transcribed spacer). Para identificação das diferentes espécies dentro de cada secção, amplificaram-se os genes que codificam a β-tubulina e a calmodulina.
Foram utilizadas várias reações de PCR: ITS, β-tubulina e calmodulina. [33]
ITS (Internal transcribed spacer)