UNIVERSIDADE FEDRAL DO CEARÁ CENTRO DE CIÊNCIAS
DEPARTAMENTO DE BIOQUÍMICA E BIOLOGIA MOLECULAR
AURELICE BARBOSA DE OLIVEIRA
METABOLISMO ANTIOXIDANTE E QUALIDADE DURANTE A MATURAÇÃO DE FRUTOS TROPICAIS PRODUZIDOS PELOS SISTEMAS
DE PRODUÇÃO ORGÂNICO E CONVENCIONAL
AURELICE BARBOSA DE OLIVEIRA
METABOLISMO ANTIOXIDANTE E QUALIDADE DURANTE A MATURAÇÃO DE FRUTOS TROPICAIS PRODUZIDOS PELOS SISTEMAS DE PRODUÇÃO
ORGÂNICO E CONVENCIONAL
Tese submetida à Coordenação do Curso de Pós-Graduação em Bioquímica e Biologia Molecular da Universidade Federal do Ceará como requisito parcial para obtenção do título de Doutor em Bioquímica.
Área de Concentração: Bioquímica Vegetal.
Orientadora: Profa. Dra. Maria Raquel Alcântara de Miranda.
AURELICE BARBOSA DE OLIVEIRA
METABOLISMO ANTIOXIDANTE E QUALIDADE DURANTE A MATURAÇÃO DE FRUTOS TROPICAIS PRODUZIDOS PELOS SISTEMAS DE PRODUÇÃO
ORGÂNICO E CONVENCIONAL
Tese submetida à Coordenação do Curso de Pós-Graduação em Bioquímica e Biologia Molecular da Universidade Federal do Ceará como requisito parcial para obtenção do título de Doutor em Bioquímica.
Aprovada em _______/_______/________
BANCA EXAMINADORA
_______________________________________________ Profa. Dra. Maria Raquel Alcântara de Miranda (Orientadora)
Universidade Federal do Ceará
________________________________________________ Dr. Carlos Farley Herbster Moura
Pesquisador Embrapa Agroindústria Tropical
__________________________________________________ Profa. Dra. Claúdia Araújo Marco
Universidade Federal do Ceará - Cariri
_____________________________________________________ Prof. Dr. Enéas Gomes Filho
Universidade Federal do Ceará
______________________________________________________ Prof. Dr. Fernando Antonio Souza de Aragão
AGRADECIMENTOS
À professora Dra. Maria Raquel Alcântara de Miranda pela orientação e interesse com que acompanhou este trabalho;
Ao pesquisador Dr. Carlos Farley Herbster Moura, pela ajuda na realização de parte deste trabalho;
Ao pesquisador Dr. Fernando Antonio Souza de Aragão, por concordar em participar da banca examinadora dessa tese;
À professora Dra. Claúdia Araújo Marco, pela ajuda na obtenção de parte dos frutos analisados e por concordar em participar da banca examinadora dessa tese;
Ao professor Dr. Enéas Gomes Filho por disponibilizar seu laboratório para realização de análises e por concordar em participar da banca examinadora dessa tese;
Aos professores Dra. Dirce Fernandes e Dr. Joaquim Enéas Filho, por disponibilizar seus laboratórios para realização de análises;
Ao meu esposo por ter sido companheiro e grande incentivador desta empreitada;
Aos professores do Departamento de Bioquímica e Biologia Molecular, pelos ensinamentos;
Aos colegas do curso de Pós-Graduação em Bioquímica, em particular ao Helton, Eduardo, Juan Carlos, Neuza e Andressiane pela ajuda e bons momentos vividos juntos; Aos colegas do Laboratório de Bioquímica e Fisiologia de Frutos, em particular à Luciana, Marcela, Marília, Sérgio, Ana Lívia, Kellina, Winne, Frederico, Thaís, Roberta, Mônica, Jéssica e Rayane, pela ajuda, paciência e agradável convivência; À empresa Amway Nutrilite do Brasil, por ter cedido parte dos frutos para realização deste trabalho;
Ao Sr. Juvêncio, por ter cedido parte dos frutos para realização deste trabalho; À Capes e ao BNB-FUNDECI pelo apoio financeiro;
RESUMO
O crescimento do cultivo orgânico de vegetais vem sendo impulsionado por consumidores que buscam alimentos mais saudáveis, livres de agrotóxicos e de adubos químicos. Desta forma o objetivo desse trabalho foi avaliar as alterações na qualidade e metabolismo antioxidante durante a maturação de frutos de cinco espécies que apresentam importância econômica cultivadas pelos sistemas de cultivo orgânico e convencional. Os frutos do maracujazeiro, bananeira, tomateiro, ateira e aceroleira sob cultivo orgânico e convencional foram colhidos manualmente em diferentes estádios de desenvolvimento e as polpas foram processadas e armazenadas em freezer doméstico à --18 °C visando a realização das análises de qualidade e do metabolismo antioxidante. Os resultados indicam que o sistema de cultivo orgânico induziu um estresse nos frutos do maracujazeiro evidenciado pelo maior grau de peroxidação associado ao menor conteúdo de fenólicos e menor atividade da catalase (CAT), porém estimulou a concentração de vitamina C. A maior atividade da dismutase do superóxido (SOD) e da fenilalanina amônia liase (PAL) indicam que as bananas orgânicas sofreram um estresse oxidativo, porém suas variáveis de qualidade nutricional não foram afetadas diferentemente pelos sistemas de cultivo. O sistema de cultivo orgânico também induziu um estresse nos frutos do tomateiro evidenciado pelo maior grau de peroxidação lipídica e aumento da atividade da PAL e SOD, porém influenciou positivamente todos os componentes antioxidantes de qualidade nutricional. Apesar dos resultados aqui encontrados para ata não permitirem uma comparação entre os sistemas de cultivos, há fortes indícios de que o sistema de cultivo orgânico não induziu ao estresse em atas. Já com as acerolas BRS 235, há indícios de que o sistema orgânico induziu um estresse oxidativo pelo maior grau de peroxidação lipídica encontrado. Conforme os dados obtidos, o sistema orgânico induziu estresse nos frutos de maracujazeiro, tomateiro, bananeira e aceroleira. O sistema de cultivo orgânico influenciou positivamente os antioxidantes não enzimáticos em maracujá e em tomate, nos demais frutos não houve influência ou ela foi negativa, como no caso das acerolas. Portanto, pode-se concluir que o estresse induzido pelo sistema de cultivo orgânico não irá necessariamente estimular a produção de componentes antioxidantes de qualidade em frutos.
ABSTRACT
The growth of the organic cultivation of vegetables is driven by consumers seeking healthier foods free of pesticides and chemical fertilizers. Thus the aim of this study was to evaluate changes in quality and antioxidant metabolism during fruit ripening of five species that have economic importance grown by organic farming systems and conventional. The yellow passion fruit, banana, tomato, sugar apple and acerola cultivated under organic and conventional farming were manually harvested at different stages of development, the pulp were processed and stored at 18 °C. The results indicate that the organic cropping system induced stress in passion fruit as shown by the greater degree of peroxidation and lowest phenolic content and CAT activity, however it stimulated vitamin C. The higher SOD and PAL activities indicate that organic bananas suffered an oxidative stress, but their nutritional quality parameters were not affected. The organic farming system also induced stress in tomato evidenced by the greater degree of lipid peroxidation and increased PAL and SOD activities, but also positively influenced all nutritional antioxidants components. Although the present results for sugar apple do not allow a comparison between cropping systems, there are strong indications that the organic cropping system did not induce stress in sugar apple. For acerola BRS 235, there are signs that organic system induced an oxidative stress due to the higher lipid peroxidation degree. As the data obtained, the organic system induced stress in passion fruits, tomato, banana and acerola. The organic cropping system positively influenced the non-enzymatic antioxidants in yellow passion fruit and tomatoes, however for the others fruits, there was no influence or it was negative, as in acerola. Therefore, it can be concluded that stress induced by organic cropping system will not necessarily stimulate the production of antioxidant compounds.
Keywords: passion fruit, banana, tomato, sugar apple, acerola, organic, conventional,
LISTA DE FIGURAS
Figura 1 – Origem das EROs em células vegetais... 20
Figura 2 – Formação de espécies reativas de oxigênio... 21
Figura 3 – Sistemas antioxidantes enzimáticos e não-enzimáticos... 23
Figura 4 – Oxidação do ácido ascórbico ao ácido desidroascórbico... 29
Figura 5 – Biossíntese dos Flavonóides... 30
Figura 6 – Estádios de desenvolvimento dos frutos do maracujazeiro e bananeira sob cultivo convencional e orgânico... 42
Figura 7 - Estádios de desenvolvimento dos frutos do tomateiro e aceroleira sob cultivo convencional e orgânico... 43
Figura 8 - Metabolismo durante o amadurecimento do maracujá cultivado nos sistemas de produção orgânico e convencional... 56
Figura 9 - Metabolismo durante o desenvolvimento da banana cultivada nos sistemas de produção orgânico e convencional... 62
Figura 10 - Metabolismo durante o desenvolvimento do tomate cultivado nos sistemas de produção orgânico e convencional... 71
Figura 11 - Metabolismo durante o amadurecimento da ata cultivada nos sistemas de produção orgânico e convencional... 77
LISTA DE TABELAS
SUMÁRIO
1 INTRODUÇÃO... 12
2 OBJETIVOS... 14
2.1 Objetivo Geral... 14
2.2 Objetivos Específicos... 14
3 REVISÃO BIBLIOGRÁFICA... 15
3.1 Agricultura Orgânica... 15
3.2 Sistema de Produção e Estresse Oxidativo... 17
3.3 Estresse Oxidativo e Sistema Antioxidante... 22
3.3.1 Antioxidantes Enzimáticos... 24
3.3.2 Antioxidantes Não-enzimáticos... 27
3.3.2.1 Vitamina C... 27
3.3.2.2 Compostos Fenólicos... 29
3.4 Sistema de Produção e Antioxidantes... 32
3.5 Origem e Importância dos Frutos em Estudo... 34
3.5.1 Maracujá... 34
3.5.2 Banana ... 35
3.5.3 Tomate... 37
3.5.4 Ata ... 38
3.5.5 Acerola... 39
4. MATERIAL E MÉTODOS... 41
4.1 Obtenção dos Frutos... 41
4.2 Análises de Qualidade... 44
4.2.1 pH... 44
4.2.2 Acidez Titulável... 44
4.2.3 Sólidos Solúveis... 44
4.3 Análises de Compostos Antioxidantes... 44
4.3.1 Antocianinas e Flavonóides-Amarelos... 44
4.3.2 Vitamina C... 45
4.4 Determinação da Atividade Antioxidante Total e Polifenóis Totais... 45
4.4.1 Obtenção do Extrato... 45
4.4.2 Determinação da Atividade Antioxidante Total... 46
4.4.3 Determinação de Polifenóis Totais... 47
4.5.1 Atividade da Fenilalanina Amônia-Liase... 47
4.5.2 Determinação de Proteínas Solúveis... 48
4.6 Determinação da Atividade de Enzimas Antioxidantes... 48
4.6.1 Obtenção do Extrato... 48
4.6.2 Atividade da Peroxidase do Ascorbato ... 48
4.6.3 Atividade da Catalase ... 49
4.6.4 Atividade da Dismutase do Superóxido ... 59
4.7 Peroxidação de Lipídios... 50
4.8 Análise Estatística... 50
5 RESULTADOS E DISCUSSÃO... 51
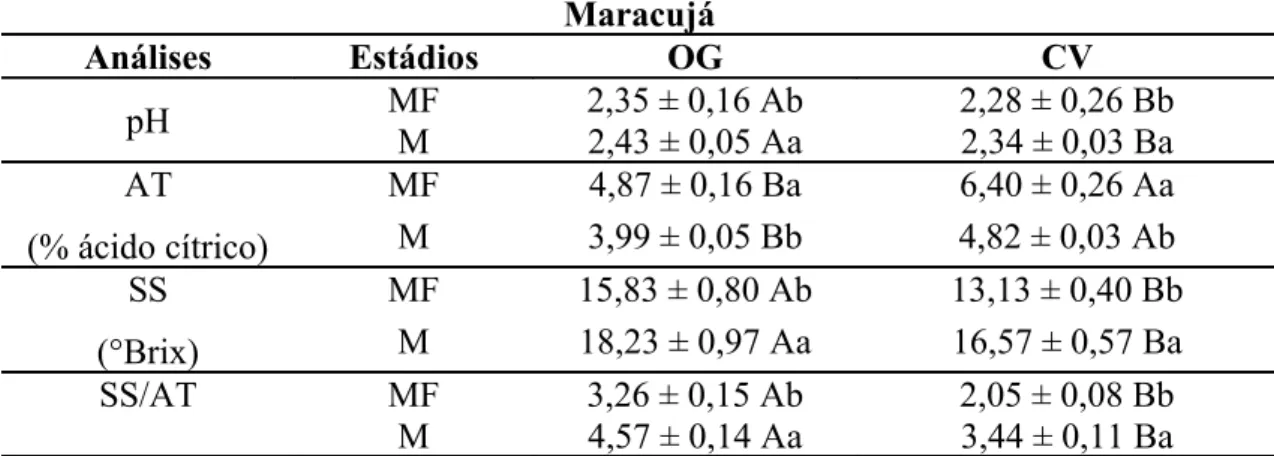
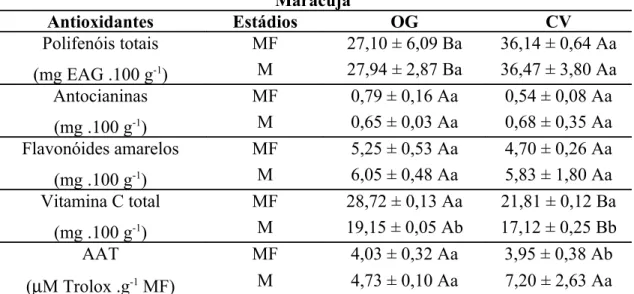
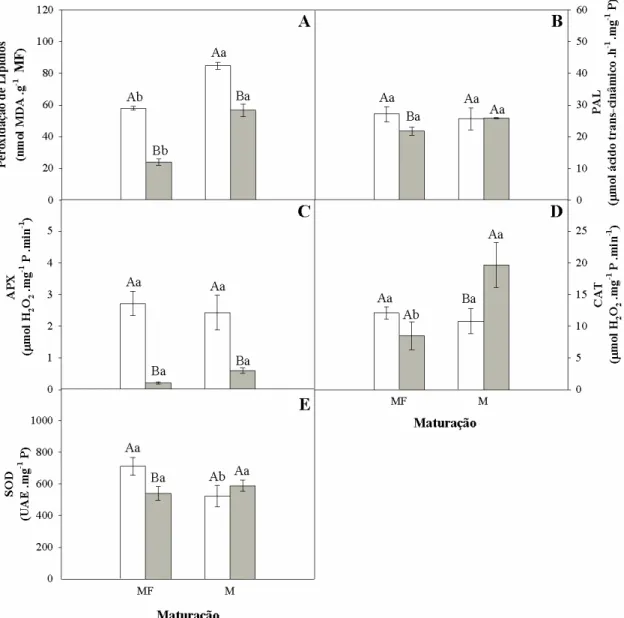
5.1 Maracujá... 51
5.1.1 Qualidade... 51
5.1.2 Antioxidantes Não-enzimáticos... 52
5.1.3 Peroxidação de Lipídios e Enzimas... 55
5.2 Banana... 58
5.2.1 Qualidade... 58
5.2.2 Antioxidantes Não-enzimáticos... 59
5.2.3 Peroxidação de Lipídios e Enzimas... 61
5.3 Tomate... 65
5.3.1 Qualidade... 65
5.3.2 Antioxidantes Não-enzimáticos... 66
5.3.3 Peroxidação de Lipídios e Enzimas... 70
5.4 Ata... 73
5.4.1 Qualidade... 73
5.4.2 Antioxidantes Não-enzimáticos... 74
5.4.3 Peroxidação de Lipídios e Enzimas... 76
5.5 Acerola... 79
5.5.1 Qualidade... 79
5.5.2 Antioxidantes Não-enzimáticos... 81
5.5.3 Peroxidação de Lipídios e Enzimas Antioxidantes... 84
6 CONCLUSÕES... 88
REFERÊNCIAS... 90
1 INTRODUÇÃO
A crescente demanda por alimentos saudáveis deve-se a uma maior conscientização dos consumidores acerca dos benefícios de frutos e hortaliças para a saúde e da importância da preservação das condições ambientais. Desta forma, a demanda por produtos com boa qualidade obtidos por meio de práticas agrícolas sustentáveis tem aumentado substancialmente.
A produção de alimentos orgânicos é regulamentada pela Lei n° 10.831 de 24 de dezembro de 2003, a qual preconiza que o sistema orgânico de produção se caracteriza como aquele em que se adotam técnicas específicas mediante à otimização do uso de recursos naturais e socioeconômicos disponíveis, além do respeito à integridade cultural das comunidades rurais, tendo por objetivo a sustentabilidade econômica e ecológica, a maximização dos benefícios sociais e a minimização da dependência de energia não-renovável. Além do emprego de métodos culturais, biológicos e mecânicos em contraposição ao uso de materiais sintéticos, a lei prevê a eliminação do uso de organismos geneticamente modificados e radiações ionizantes em qualquer fase da produção, do processamento, do armazenamento, da distribuição e da comercialização, até a proteção do ambiente. (BRASIL, 2003)
Estudos vêm mostrando que no sistema de produção orgânico, as concentrações de metabólitos secundários são maiores quando comparadas ao sistema de produção convencional. No orgânico, pode ocorrer uma baixa disponibilidade de nitrogênio no solo promovendo alterações no metabolismo vegetal e induzindo à formação de metabólitos secundários envolvidos com a defesa da planta, enquanto que no convencional, o nitrogênio disponível é utilizado para a formação de compostos utilizados para o crescimento e desenvolvimento da planta (BRANDT; MOLGAARD, 2001).
sistema de produção orgânico quando comparadas àquelas cultivadas convencionalmente apresentaram um maior conteúdo de vitaminas antioxidantes como tocoferol e caroteno, e de compostos fenólicos. Contudo, ameixas cultivadas convencionalmente apresentaram maior conteúdo de macronutrientes (LOMBARDI-BOCCIA et al., 2004). Já quando frutos do tomateiro foram avaliados, observou-se que os ocultivados no sistema de produção orgânico apresentaram valores mais altos de sólidos solúveis, de acidez titulável e de firmeza, porém uma menor concentração de compostos antioxidantes quando comparado àqueles produzidos sob cultivo convencional (BARRETT et al., 2007).
2 OBJETIVOS
2.1 Objetivo Geral:
Avaliar as alterações no metabolismo antioxidante e na qualidade durante o desenvolvimento dos frutos de cinco espécies economicamente relevantes cultivadas pelos sistemas de produção orgânico e convencional.
2.2 Objetivos Específicos:
- Avaliar e comparar o efeito dos sistemas de produção durante o desenvolvimento dos frutos do maracujazeiro, bananeira, tomateiro, ateira e aceroleira quanto ao metabolismo antioxidante e à qualidade pós-colheita;
- Estudar o efeito do sistema de produção orgânico na indução do estresse oxidativo nos frutos avaliados;
- Averiguar se o sistema de produção orgânico influencia a concentração de compostos antioxidantes presente nos frutos;
3 REVISÃO BIBLIOGRÁFICA
3.1 Agricultura Orgânica
O desenvolvimento da agricultura orgânica se deu na década de 1920 com os trabalhos de adubação orgânica e compostagem realizados por Sir Albert Howard na Índia, sendo divulgados na Inglaterra e nos Estados Unidos (EHLERS, 1996). No Brasil, os princípios da agricultura orgânica foram introduzidos no início da década de 1970, quando se começava a repensar o modelo convencional de produção agropecuária. Nos anos de 1972 e 1973, duas experiências de cunho prático surgiram quase que simultaneamente e marcaram o lançamento da semente orgânica no país. Uma delas foi a fundação da Estância Demétria, em Botucatu no interior de São Paulo, que segue os princípios da agricultura biodinâmica, e a outra foi a instalação de uma granja orgânica pelo engenheiro agrônomo, formado no Japão, Dr. Yoshio Tsuzuki, no município de Cotia-SP (DAROLT, 2011).
Santos e Monteiro (2004) afirmam que desde 1990, a agricultura orgânica vem crescendo rapidamente tanto em área cultivada como em número de produtores e tamanho do mercado consumidor. Este aumento se deve principalmente aos impactos causados pela agricultura convencional com a degradação do meio ambiente, redução de mão-de-obra e de subsídios estatais, pelos resíduos químicos dos insumos agrícolas e à maior consciência dos consumidores quanto aos efeitos adversos que estes resíduos podem causar à saúde (ARAÚJO; PAIVA, 2007; SANTOS; MONTEIRO, 2004).
De acordo com Neves et al. (2004), a agricultura orgânica é um sistema de manejo sustentável da unidade de produção, com enfoque holístico que privilegia a preservação ambiental, a agrobiodiversidade, os ciclos biológicos e a qualidade de vida do homem, visando a sustentabilidade social, ambiental e econômica no tempo e no espaço. Baseia-se na conservação dos recursos naturais e não utiliza fertilizantes de alta solubilidade, agrotóxicos, antibióticos, aditivos químico-sintéticos, hormônios, organismos transgênicos e radiações ionizantes.
manejo e a proteção dos recursos naturais sem a utilização de produtos químicos agressivos à saúde humana e ao meio ambiente, mantendo a diversidade biológica e respeitando a integridade cultural dos agricultores, não obstante as pequenas diferenças existentes (SANTOS; MONTEIRO, 2004).
Segundo a pesquisa realizada pelo Instituto de Pesquisa da Agricultura Orgânica FiBL (Forschungsinstitut für Biologischen Landbau) em 2008, mais de 30 milhões de ha foram cultivados organicamente por mais de 700.000 fazendas em todo o mundo no ano de 2006. O país com mais terras agrícolas orgânicas é a Austrália com 12 milhões de hectares (ha), seguida pela Europa com 7 milhões de ha, América Latina (4 milhões de ha), Ásia (3 milhões de ha), América do Norte (2 milhões de ha) e África (0,4 milhões de ha) (WILLER; YUSSEFI-MENZLER; SORENSEN, 2011). O Brasil ocupa o trigésimo quarto lugar no ranking dos países exportadores de produtos orgânicos. Nos últimos anos, o crescimento anual das vendas aumentou em 50%. Estima-se que já estão sendo cultivados perto de 100 mil ha em cerca de 4.500 unidades de produção orgânica. Aproximadamente, 70% da produção brasileira está concentrada nos estados do Paraná, São Paulo, Rio Grande do Sul, Minas Gerais e Espírito Santo (DAROLT, 2011).
De acordo com Feiden et al. (2002), a crescente demanda por produtos orgânicos, bem como a expansão do mercado exigiram novos mecanismos de garantia de qualidade através da certificação dos produtos orgânicos. A certificação de produtos orgânicos visa conquistar maior credibilidade dos consumidores e conferir maior transparência às práticas e aos princípios utilizados na produção orgânica (CAMPANHOLA; VALARINI, 2001).
Para a exportação de produtos orgânicos é necessária a emissão de um certificado para cada tipo de produto, emitido por entidades reconhecidas pelos países e também pela International Federation of Organic Agriculture Movements (IFOAM). No Brasil cerca de dezenove entidades certificadoras, dentre as quais as principais são a Associação de Agricultura Orgânica (AAO) e o Instituto Biodinâmico (IBD) situados em São Paulo (PENTEADO, 2000). No Brasil, são utilizados os “Selos de Qualidade” (selo de certificação) juntamente à marca específica de cada produtor para indicar a concordância com as diretrizes, que são atestadas por certificadoras credenciadas junto ao Colegiado Nacional para a Produção Orgânica (CNPOrg) (IBD, 2002).
açúcar erva-mate, banana, suco de laranja, hortaliças, castanha de caju, guaraná, arroz, soja, mel e café (DAROLT, 2002).
Apesar do crescimento do mercado de produtos orgânicos, o setor apresenta alguns entraves ao seu desenvolvimento como a baixa escala de produção, os custos com a certificação, fiscalização e assistência técnica que, diferentemente do sistema convencional, representam gastos adicionais aos produtores (DAROLT, 2011). Além disso, os consumidores destacam como restrições ao consumo os preços elevados e a disponibilidade limitada de produtos orgânicos (BORGUINI, 2002).
Existe ainda uma parcela de produtores que aderiu ao sistema de produção orgânico porque indispõem de condições financeiras para arcar com o cultivo convencional. Esses produtores se encontram em regiões rurais circunvizinhas aos centros urbanos do interior dos estados mais carentes como o Ceará e comercializam seus produtos principalmente em feiras e, portanto, veem a produção e comercialização de orgânicos como uma forma de agregar valor aos seus produtos.
3.2 Sistema de Produção e Estresse Oxidativo
As plantas estão expostas a uma grande variedade de estresses ambientais, como aqueles associados às mudanças de temperatura, seca, níveis de luz, salinidade, hipóxia, metais pesados e deficiência de nutrientes minerais.
O nitrogênio é o elemento essencial necessário em maior quantidade para o crescimento das plantas (MILLER et al., 2007), portanto a sua deficiência é mais prontamente sentida pelas mesmas. Ele é necessário para síntese de nucleotídios e aminoácidos, que são monômeros de ácidos nucléicos e proteínas, respectivamente, e de muitos metabólitos secundários que desempenham diversas funções em processos como fotossíntese, sinalização e estruturação celular (TSCHOEP et al., 2009). O nitrogênio é absorvido pelas raízes sob a forma de nitrato (NO3-) ou amônio (NH4+), sendo incorporado em aminoácidos na própria raiz ou na parte aérea (BREDEMEIE; MUNDSTOCK, 2000). O nitrato absorvido pelas raízes é convertido em amônio pelas enzimas nitrato redutase (NR) e nitrito redutase, sendo então incorporado à glutamato via ação das enzimas glutamina sintetase (GS) e glutamina:oxoglutarato aminotransferase (GOGAT) formando glutamina (TAIZ; ZEIGER, 2004).
Uma lenta mineralização pode resultar em baixas concentrações de nitrogênio no solo resultando em uma diminuição de glutamina e, portanto, no conteúdo dos demais aminoácidos e proteínas (LEMAITRE et al., 2008). Além disso, afeta diretamente a fotossíntese, pois o nitrogênio é componente de estruturas fotossintéticas como clorofila, de importantes proteínas como a enzima ribulose bifosfato carboxilase/oxigenase (Rubisco) e como as que formam os complexos de captação de luz, levando a uma diminuição da capacidade de assimilação do CO2 (EVANS; POORTER, 2001). De acordo com Amor (2006), folhas de pimentões orgânicos apresentaram uma redução da taxa fotossintética, de transpiração e de conteúdo de clorofila a e b, em relação às folhas de pimentões de cultivo convencional e integrado.
O nitrato age também como um sinal da regulação da atividade de muitas enzimas e transportadores, incluindo a NR, fosfoenolpiruvato carboxilase (PEP carboxilase), malato desidrogenase, sacarose fosfato sintase (SPS) e transportadores de nitrato envolvidos na regulação do balanço entre carbono e nitrogênio em plantas (SCHEIBLE et al., 1997). A exposição de plantas às baixas concentrações de nitrato, inativa a PEP carboxilase, enzima que catalisa a síntese de oxaloacetato e ativa a enzima ADP-glicose pirofosforilase redirecionando o fluxo de carbono da produção de aminoácidos e ácidos orgânicos para a biossíntese do amido e metabólitos secundários, os quais possuem ação protetora em relação a estresses abióticos (CRAWFORD et al., 2000).
convencionais: a primeira hipótese considera os impactos das diferentes práticas de fertilização sobre o metabolismo da planta. Na agricultura convencional, os fertilizantes sintéticos frequentemente tornam o nitrogênio mais disponível para as plantas do que os fertilizantes orgânicos, acelerando o crescimento e desenvolvimento das plantas, sendo os recursos vegetais alocados para fins de crescimento, resultando em uma diminuição na produção de metabólitos secundários, clorofila, e aminoácidos. Esse argumento se baseia na Hipótese do Balanço Crescimento-Diferenciação que explica como a planta alocará carbono para processos relativos à diferenciação ou processos relativos ao crescimento dentro de uma faixa de disponibilidade de recursos ambientais (água, luz, nutrientes). As plantas que crescem em ambientes com boa disponibilidade de recursos não têm limitações nem nas funções de crescimento nem nas funções de diferenciação e, assim, alocam a maior quantidade de carbono proveniente da fotossíntese para crescer tornando-os pouco disponíveis para a produção de aleloquímicos e, consequentemente, menores concentrações de metabólitos secundários (AMARAL, 2008).
A segunda hipótese considera as respostas das plantas aos estresses ambientais como ataques de insetos, ervas daninhas e patógenos. Tem sido argumentado que os métodos de produção orgânica, em que são limitados o uso de defensivos agrícolas, pode criar um estresse nas plantas, as quais redirecionaríam mais recursos para a síntese de seus próprios mecanismos de defesa química.
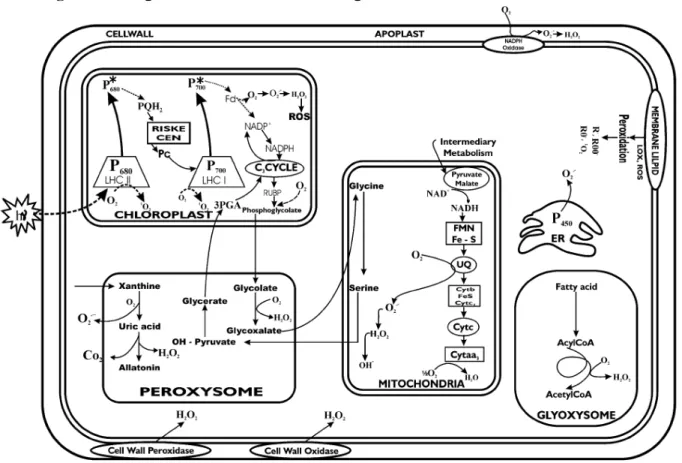
Figura 1 - Origem das EROs em células vegetais.
Fonte: Bhattacharjee (2005)
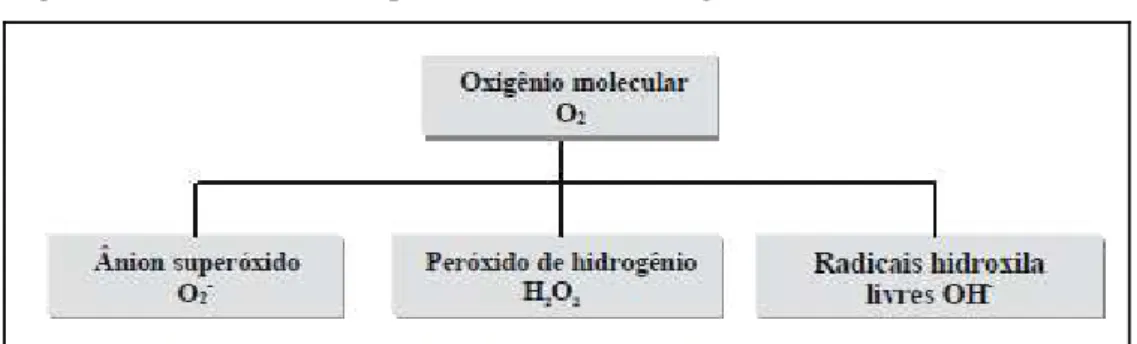
Figura 2 - Formação de espécies reativas de oxigênio.
Fonte: Resende et al. (2003).
O peróxido de hidrogênio (H2O2) é formado pela redução univalente do O2•-, sendo uma molécula moderadamente reativa com uma meia-vida (1 ms) relativamente longa (BHATTACHARJEE, 2005). O H2O2 é formado em organelas como cloroplastos, peroxissomos e mitocôndrias, como resultado de múltiplas reações, incluindo dismutação do O2•-, β-oxidação de ácidos graxos e reações peroxissomais envolvendo oxidação do glioxilato (HODGES, 2003). De acordo com Quan et al. (2008), o H2O2 desempenha um papel duplo em plantas: em baixas concentrações, atua como molécula de sinalização envolvida na aclimatação, promovendo tolerância a vários estresses bióticos e abióticos e em altas concentrações, leva à morte celular programada. O H2O2 também pode atuar como um regulador chave em vários processos fisiológicos tais como senescência, fotorrespiração e fotossíntese, movimento estomático, ciclo celular, crescimento e desenvolvimento (BRIGHT et al., 2006; FOREMAN et al., 2003; MITTLER et al., 2004; NOCTOR; FOYER, 1998; PENG et al., 2005). Já, o radical hidroxil (OH•) é o produto da redução univalente do H2O2, sendo um dos mais fortes oxidantes bioquímicos, e portanto, altamente reativo com proteínas, ácidos nucléicos e lipídios e tal como o O2•-, OH• e 1O2, têm uma meia-vida curta (2-4 µs) (BHATTACHRJEE, 2005).
expressão de genes; componentes da via de sinalização podem ser diretamente oxidados pelas EROs; as espécies reativas de oxigênio podem mudar a expressão de genes por modificar a atividade de fatores de transcrição. A diminuição da concentração do ácido ascórbico por oxidação através da ação de espécies reativas de oxigênio, como peróxido de hidrogênio, é um dos primeiros eventos na cascata de sinalização (PASTORI et al., 2003).
O estresse oxidativo também tem sido associado à maturação, amadurecimento e senescência de frutos, folhas e flores (CHAKRABARTY; CHATTERJEE; DATTA, 2007; JIMÉNEZ et al., 2002; KAN et al., 2011; LESHAM, 1992). Em geral, essas etapas do desenvolvimento dos frutos se caracterizam pela degradação de componentes da parede celular e por alterações que levam à ruptura das membranas biológicas ocasionando uma desorganização estrutural do tecido (PALIYATH; DROILLARD, 1992). Assim, o amadurecimento e a senescência de frutos podem ser vistos como fenômenos oxidativos (BRENNAN; FRENKEL, 1977).
Lacan e Baccou (1998) observaram em melão ‘Jerac’ que a peroxidação de lipídeos da membrana plasmática por radicais livres resultou em aumento do vazamento do material intracelular e foi consequência de um desequilíbrio entre a atividade das enzimas antioxidantes e das lipolíticas. Em tomate ‘Ailsa Craig’, o aumento na peroxidação de lipídeos é um dos sintomas do início do amadurecimento podendo ser observado já no estádio da maturidade fisiológica (JIMÉNEZ et al., 2002). De acordo com Awad, Al-Qurashi e Mohamed (2011), o amadurecimento de tâmaras é um processo oxidativo em que a transição da juvenilidade para a maturação/senescência é acompanhado por uma mudança progressiva para um estado oxidativo. Kan et al. (2010) também observaram um acúmulo de EROs durante o amadurecimento e senescência de pêssegos, causando danos à integridade das mitocôndrias.
3.3 Estresse Oxidativo e Sistema Antioxidante
Figura 3 - Sistemas antioxidantes enzimáticos e não-enzimáticos.
Fonte: Soares; Machado (2007).
3.3.1 Antioxidantes Enzimáticos
A enzima superóxido dismutase [SOD, EC 1.15.1.1] pertence a um grupo de metaloenzimas que protegem a célula de radicais superóxido por catalisar a dismutação do O2•- para oxigênio molecular (O2) e peróxido de hidrogênio (Equação 1) (HODGES, 2003).
O2
•- + O2•- + 2H+ → H2O2 + O2 (Eq. 1)No interior da célula, as dismutases do superóxido (SOD’s) constituem a primeira linha de defesa contra as espécies reativas de oxigênio (ALSCHER; ERTURK; HEATH, 2002). Três isoformas diferentes de SOD, baseado no íon metálico no seu sítio ativo, têm sido identificadas e todas elas estão presentes em todas as células eucarióticas: a isoforma cobre e zinco (Cu/ZnSOD) é encontrada principalmente no citosol, núcleo, plasma e estroma dos cloroplastos de plantas; a isoforma manganês (MnSOD) é encontrada na matrix mitocondrial, embora tenha sido observada uma MnSOD ligada à membrana do cloroplasto de plantas; e a isoforma ferro (FeSOD), geralmente é encontrada em procariontes (LIMÓN-PACHECO; GONSEBATT, 2009; SCANDALIOS, 1993), sendo identificada também uma isoforma FeSOD em cloroplastos de milho (IANNELLI et al., 1999). De acordo com Asada (1999), o número, o tipo e abundância relativa de cada isoforma da SOD são variáveis entre as espécies vegetais.
A atividade da SOD é aumentada em resposta a diferentes condições de estresse como, por exemplo, o aumento na atividade da MnSOD mediado por Paraquat® em protoplastos de ervilha, coincidindo com o branqueamento e eventual morte celular (ALSCHER; DONAHUE; CRAMER, 1997). Também foi observado um aumento da atividade da Cu/ZnSOD citolósica em folhas de feijão, associada ao percentual de injúria causada por ozônio (PITCHER; BRENNAN; ZILINSKAS, 1992). Lacan e Baccou (1998) observaram um atraso do processo de senescência em melões, associado à elevada atividade da SOD.
2 H2O2
→ 2 H2O + O2 (Eq. 2) As plantas possuem várias isoformas de catalase, as quais estão divididas em três classes: classe 1, encontrada nos peroxissomos de células fotossintéticas; classe 2, encontrada em tecidos vasculares e podem exercer uma função de lignificação, mas sua função biológica permanece desconhecida; e classe 3, encontrada nos glioxissomos (RESENDE; SALGADO; CHAVES, 2003). Nos peroxissomos de plantas C3, a catalase remove o H2O2 produzido durante a fotorrespiração pela conversão do glicolato em glioxilato (FOYER; FLETCHER 2001; JAYAKUMAR et al. 2008); nos glioxissomos, a catalase decompõe o H2O2 formado durante a β-oxidação dos ácidos graxos (FAZELI; GHORBANLI; NIKNAM, 2007).A atividade da catalase é regulada por várias condições abióticas que induzem o estresse (ALI; HAHN; PAEK, 2005; JALEEL et al. 2007a, b; SANKAR et al. 2007). Ali et al. (2008) observaram que o aumento da atividade da catalase em raízes de ginseng expostas ao CO2 contribui para o efeito protetor contra o estresse causado pelo CO2. Além disso, o estresse oxidativo caracterizado pela produção de EROs parece ser uma característica intrínseca da senescência e amadurecimento dos frutos, uma vez que promove o processo oxidativo, contribuindo para uma deterioração geral do metabolismo celular (RÍO DEL et al, 1998; THOMPSON; LEDGE; BARBER, 1987;). Huang et al. (2007) observaram alterações nos sistemas antioxidantes de laranjas e evidenciaram uma diminuição da atividade de enzimas antioxidantes, inclusive a atividade da catalase, durante o amadurecimento.
NADPH (Figura 3) (GOPI et al. 2007; HOEKSTRA; GOLOVINA; BUITINK, 2001;). Todas as isoformas de APX têm uma alta especificidade pelo ascorbato como doador de elétrons (LEONARDIS; DIPIERRO; DIPIERRO, 2000) e podem ser encontradas em quatro compartimentos celulares: no estroma e ligadas à membrana dos tilacóides dos cloroplastos; ligadas à membrana (mAPX) dos peroxissomos e glioxissomos; no citosol (cAPX) e ligadas à membrana mitocondriais (mitAPX) (LEONARDIS; DIPIERRO; DIPIERRO, 2000; SHIGEOKA et al., 2002;). As isoformas da APX desempenham um papel protetor contra EROs produzidas em excesso sob diversas condições de estresse pós-colheita e durante o amadurecimento de frutos climatéricos, considerado como um processo oxidativo (BRENNAN; FRENKEL, 1977; NISHIKAWA et al., 2003;). Portanto, seu nível de expressão pode ser aumentado, diminuído ou mesmo inalterado, refletindo a ocorrência de diferentes condições de estresse. Em brócolis, a expressão de duas isoformas citosólicas da APX foi marcadamente induzida em diferentes partes da planta após a colheita, porém a transcrição de isoformas cloroplásticas permaneceu inalterada até 6 h após a colheita e depois diminuiu rapidamente (NISHIKAWA et al., 2003). Huang et al. (2007) observaram uma diminuição da atividade da APX durante a maturação e amadurecimento de laranjas.
Experimentos com maçãs, ‘Fuji’ e ‘Golden Delicious’, mostraram que a atividade das enzimas SOD e CAT aumentava concomitante ao pico de etileno no climatério e depois decrescia no pós-climatério (MASIA, 1998). O autor explicou que o aumento na atividade enzimática era um reflexo do aumento nos níveis de radicais livres ocorrido com o climatério no sentido de proteger as células de danos oxidativos. Quando maçãs ‘Fuji’ foram armazenados sob refrigeração, eles apresentaram uma maior produção de H2O2 indicando um estresse oxidativo que provavelmente ativava os sistemas de defesa da planta, fato evidenciado pelo aumento na produção de etileno. Além disso, maçãs ‘Fuji’ apresentaram níveis mais baixos de SOD e CAT o que refletiu em uma menor vida útil pós-colheita do que as maçãs ‘Golden Delicious’ (MASIA, 1998).
amadurecimento, assim como os níveis de seus mRNAs (JIMÉNEZ et al., 2002). Wang e Jiao (2001) observaram um decréscimo nas atividades da SOD, CAT e peroxidases assim como um aumento na peroxidação dos lipídeos concomitante ao amadurecimento de amora preta (Rubus sp).
3.3.2 Antioxidantes Não-Enzimáticos
Os antioxidantes não enzimáticos são capazes de interceptar e neutralizar os radicais livres gerados pelo metabolismo celular ou por fontes exógenas, impedindo o ataque sobre os lipídeos, os aminoácidos das proteínas, a dupla ligação dos ácidos graxos polinsaturados e as bases do DNA, evitando a formação de lesões e perda da integridade celular. Esses compostos são de vital importância para o metabolismo vegetal assim como para a saúde humana, a qual depende do consumo de antioxidantes obtidos da dieta como as vitaminas E, C e A, flavonóides e carotenóides para a eliminação de radicais livres e no reparo das lesões causadas por esses radicais (BIANCHI; ANTUNES, 1999).
Recentemente, tem-se demonstrado que um aumento no consumo de frutas e hortaliças está associado à diminuição na incidência de doenças cardiovasculares (KRIS-ETHERTON et al, 2002). A proteção promovida por esses alimentos contra várias doenças tem sido atribuída aos vários compostos antioxidantes que os constituem, como por exemplo, a vitamina C e compostos fenólicos.
3.3.2.1 Vitamina C
O ácido ascórbico é um dos antioxidantes mais estudados e tem sido detectado intracelularmente e no apoplasto, sendo um importante componente do sistema antioxidante das plantas (GIOVANNONI, 2007; SMIRNOFF, 2000). Por ser solúvel em água, a vitamina C pode estar na linha de frente de defesa contra moléculas muito reativas e radicais livres gerados pelo metabolismo, tais como peróxido de hidrogênio, radical hidroxil, radical peroxil e oxigênio singleto, atuando no plasma sanguíneo como um sequestrador destas espécies químicas e dissipando-as antes que possam reagir com membranas biológicas e lipoproteínas (BASU, 1999). Shao, Liang e Shao (2005) evidenciaram uma redução no AA em milho e trigo sob estresse hídrico, sugerindo seu envolvimento na resposta antioxidativa.
O AA tem a capacidade de proteger as membranas contra peroxidação de lipídios por reduzir radicais hidroperoxilas através do ciclo redox da vitamina E (TRABER; STEVENS, 2011). O AA participa de muitos processos fisiológicos como a regulação do crescimento, a diferenciação e metabolismo das plantas. Porém, seu papel fundamental é no sistema de defesa antioxidante de plantas protegendo contra o H2O2, minimizando os danos causados pelos processos oxidativos através da função sinérgica com outros antioxidantes (SHAO et al., 2008).
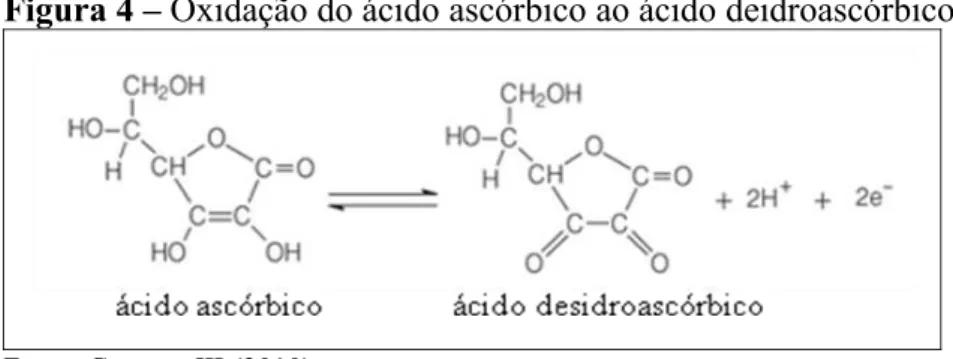
O ácido ascórbico, por ser um poderoso agente redutor, é muito suscetível à oxidação, em especial quando catalisada por íons metálicos de transição como Cu2+ e Fe3+, sendo o processo acelerado pelo calor e luz, enquanto fatores como pH, concentração de oxigênio e atividade da água influenciam muito na velocidade da reação. A primeira etapa de sua oxidação produz ácido desidroascórbico (Figura 4), o qual é altamente instável e suscetível à hidrólise da ponte de lactona sendo convertido a ácido 2,3-dicetogulônico (GREGORY III, 2010).
Além disso, o conteúdo de ácido ascórbico tende a diminuir com a maturação e com o armazenamento de muitos produtos hortícolas, devido à atuação direta das enzimas ácido ascórbico oxidase ou peroxidases, sendo utilizado como um índice de avaliação do efeito do processamento sobre a retenção de nutrientes (CHITARRA; CHITARRA, 2005).
quimioprevenção do câncer e no tratamento de sepsia e de doenças neurodegenerativas (BUTTERFIELD; LANGE; SULTANA, 2010; GANN, 2009; GAZIANO et al., 2009; PADAYATTY et al., 2010; WILSON, 2009).
Figura 4 – Oxidação do ácido ascórbico ao ácido deidroascórbico.
Fonte: Gregory III (2010).
3.3.2.2 Compostos Fenólicos
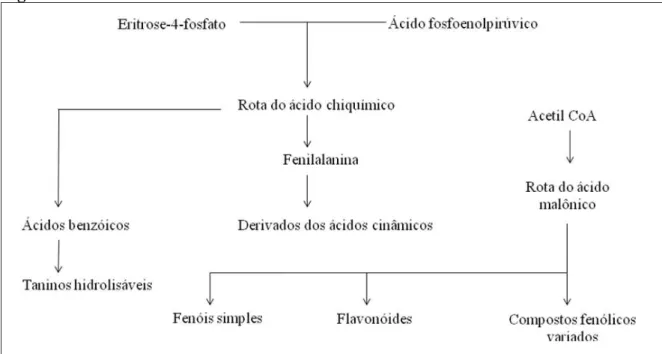
Os compostos fenólicos ou polifenóis são substâncias que possuem um anel aromático com um ou mais substituintes hidroxílicos, compreendendo uma grande variedade de compostos que são divididos em mais de dez classes de acordo com sua estrutura química (MALACRIDA; MOTTA, 2005; MANACH et al., 2004). Os polifenóis estão amplamente distribuídos no reino vegetal e especialmente nos frutos, sendo importante na determinação da cor e sabor, além de agirem como sinalizadores químicos (FIGUEIREDO, 2000). Os compostos fenólicos são biossintetizados a partir de duas vias metabólicas principais: a via do ácido chiquímico e a vida do ácido mevalônico (TAIZ; ZEIGER, 2004).
(REIN et al., 2000; SEERAM et al., 2006; SERAFINI et al., 1996, 2003; WHITEHEAD et al., 1995; ZHU et al., 1999).
Flavonóides são compostos polifenólicos biossintetizados a partir da via dos fenilpropanóides e do acetato, precursores de vários grupos de substâncias como aminoácidos alifáticos, terpenóides e ácidos graxos, dentre outros (Figura 5) (MANN, 1987).
Figura 5 – Biossíntese dos Flavonóides.
Fonte: Taiz; Zeiger (2004).
diabetes e mal de Alzheimer (ABDILLE et al., 2005; ISHIGE; SCHUBERT; SAGARA, 2001; KATSUBE, 2003; STOCLET et al., 2004; WANG; MAZZA, 2002). Além disso, ensaios biológicos usando combinações isoladas revelam que os flavonóides demonstram efeitos antimicrobiano, antiviral, antiulcerogênico, citotóxico, antineoplásico, antioxidante, antihepatotóxico, antihipertensivo, hipolipidêmico, antinflamatório, antiplaquetário (MACHADO et al., 2008).
Dentre os flavonóides, as antocianinas são compostos responsáveis pelas cores vermelha, azul e roxa de frutas, hortaliças e plantas ornamentais (BRITO et al., 2007). As antocianinas encontradas em alimentos são todas derivadas das agliconas pertencentes a três pigmentos básicos: pelargonidina (vermelho), cianidina (vermelho) e delfinidina (violeta) (VOLP et al., 2008; CARDOSO et al., 2011).
As antocianinas são glicosídeos que apresentam em sua estrutura química um resíduo de açúcar na posição 3, facilmente hidrolizado por aquecimento com HCl. Como produtos desta hidrólise, têm-se o componente glicídico e a aglicona, denominada antocianidina (ARSEGO et al., 2002). O pH é o fator que mais influencia na coloração das antocianinas, visto que, em função de sua acidez ou alcalinidade, estas podem apresentar diferentes estruturas (BORDIGNON Jr. et al., 2009).
Vários estudos demonstram que a ingestão de antocianinas promove redução do risco de doença cardíaca coronariana, proteção contra a obesidade e hipoglicemia, reforço da memória e proteção do tecido cerebral fetal (ANDRES-LACUEVA et al., 2005; JAYAPRAKASAM et al., 2006; LOREN et al., 2005; SUMNER et al., 2005). Além disso, estudo realizado por Miyazaki et al. (2008) demonstrou que as antocianinas são capazes de aumentar a resistência da LDL (lipoproteína de baixa densidade) à oxidação, promovendo uma redução nas lesões ateroscleróticas (45%) e nos níveis de TBARS (substâncias que reagem com o ácido tiobarbitúrico) no fígado.
3.4 Sistema de Produção e Antioxidantes
fitoquímicos (vitamina C, vitamina E, β-caroteno, polifenóis) que contribuem significativamente para sua capacidade antioxidante total (LIMA et al., 2005). Wang, CAO e PRIOR (1996) realizaram um estudo com doze frutos e cinco sucos de frutas e
verificaram que a capacidade antioxidante total varia consideravelmente com o tipo de
fruto e que grande parte desta capacidade deve-se aos compostos fenólicos e vitaminas.
Resultados semelhantes foram encontrados por Melo et al. (2008) em polpas congeladas
de acerola, caju, ciriguela, goiaba, manga, pitanga e uva que se apresentaram como
fortes antioxidantes. Portanto, o consumo de frutas e hortaliças tem sido associado com
o menor risco de doenças crônicas, como doenças cardiovasculares, câncer, hipertensão e diabetes tipo 2 devido à presença de fitoquímicos que apresentam propriedades antioxidantes, anti-inflamatórias e anticancerígenas (ARTES; HOLLMAN, 2005; CHUN; KIM, 2004; KUSKOSKI; ASUERO; TRONCOSO, 2005; MANACH et al. 2004).
O conteúdo de fitoquímicos antioxidantes é amplamente influenciado por
diversos fatores como fatores genéticos, estádio de maturação, condições climáticas e de
cultivo (MELO et al., 2008; TSAI; WU; CHENG, 2008). A indução do metabolismo
secundário, resultando em uma maior síntese de fitoquímicos, está ainda fortemente relacionada à atividade da enzima fenilalanina amônia liase (PAL- do idioma inglês phenylalanine ammonia lyase). De modo que sua atividade é estimulada quando as plantas são expostas a diferentes estresses como seca, frio, danos físicos, luz, baixos níveis de nutrientes no solo, bem como pelo etileno e por moléculas sinalizadoras, como o ácido jasmônico e ácido salicílico (CAMPOS-VARGAS; SALTVEIT, 2002; LAFUENTE et al., 2003; TAIZ; ZEIGER, 2004; CAMPOS-VARGAS et al., 2005; REYES; VILLAREAL; CISNEROS-ZEVALLOS, 2007). A PAL desempenha uma função crucial na biossíntese dos fenilpropanóides, pois é um ponto de ramificação entre o metabolismo primário e secundário (DIXON; PAIVA, 1995). A PAL catalisa a formação de ácido trans-cinâmico a partir do aminoácido fenilalanina resultando na síntese de uma variedade de compostos fenólicos como lignina, hidroxicinamato, flavonóides e antocianinas (GUO; WANG, 2010).
secundários ou bloqueiam a rota do ácido chiquímico como, por exemplo, o glifosato (Roundup®) que inibe competitivamente a enzima 5-enolpiruvilchiquimato-3-fosfato sintase (EPSPS) que catalisa o penúltimo passo na rota do ácido chiquímico, reduzindo a biossíntese de aminoácidos aromáticos e compostos secundários como os fenólicos (LYDON; DUKE, 1989; BENTLEY, 1990; FRANZ et al., 2009).
Os produtos orgânicos são popularmente conhecidos como mais nutritivos, além da sua produção promover um menor impacto ambiental. Em relação à qualidade dos produtos orgânicos, Barret et al. (2007) encontraram um maior conteúdo de sólidos solúveis, acidez titulável e firmeza em tomates orgânicos quando comparado aos frutos convencionais. Por outro lado, estudos realizados por Roussos e Gasparatos (2009) não apresentaram diferenças entre os sistemas de cultivo orgânico e convencional nos parâmetros de qualidade de maçãs. Resultados semelhantes foram obtidos por Juroszek et al. (2009) em relação aos parâmetros de qualidade no tomate. De acordo com
Lombardi-Boccia et al. (2004), as concentrações de algumas vitaminas antioxidantes (α e γ-tocoferol e β-caroteno) e compostos fenólicos (polifenóis totais, ácidos fenólicos, flavonóis) foram maiores em ameixas cultivadas organicamente. Estudos demonstraram que as concentrações de carotenóides, minerais, fenólicos e a atividade da enzima peroxidase, que contribuem para uma maior resistência a patógenos, foram maiores em pimentões orgânicos do que naqueles produzidos de maneira convencional (AMOR et al. 2007; PÉREZ-LÓPEZ et al., 2007).
Todavia, os resultados das pesquisas ainda são controversos quanto à influência dos sistemas de produção no valor nutricional dos produtos vegetais. Winter e Davis (2006), por exemplo, afirmam que ainda é muito cedo para concluir que o alimento orgânico é melhor do que o convencional, pelo menos em relação à segurança e qualidade nutricional.
3.5 Origem e Importância dos Frutos em Estudo
3.5.1 Maracujá
quente e úmido bem adaptadas às regiões de clima tropical e sub-tropical. O maracujazeiro-amarelo é a espécie mais vigorosa, melhor adaptada as altas temperaturas e de maior interesse comercial (SEAGRI, 2005).
O maracujazeiro-amarelo é originário da América tropical e rico em vitamina C, cálcio e fósforo. A maior importância econômica do fruto do maracujazeiro está no produto industrializado sob a forma de suco concentrado (FERRARI; COLUSSI; AYUB, 2004). Muito embora a exportação do maracujá também ocorra sob as formas de fruto fresco e congelado, sendo os principais destinos os países europeus e, mais recentemente, a Argentina e o Uruguai, no caso de frutas in natura. A participação da fruta fresca no total das exportações do Brasil se restringe a 1,5%, sendo maior a parcela relativa à exportação de fruta conservada congelada, comercializada principalmente para os mercados italiano, norte-americano, alemão e argentino, e de suco concentrado, comercializado mais intensamente para os mercados da Holanda, Estados Unidos, Porto Rico, Japão e Alemanha, os quais importam 76% desse produto (TODA FRUTA, 2006). Segundo dados referentes a 2010, no Brasil a área cultivada de maracujá era de 62.243 ha e a produção brasileira era de 920.158 toneladas de frutos, com destaque para a Bahia (461.105 toneladas) e o Ceará (159.886 toneladas) (IBGE, 2011).
As espécies do gênero Passiflora têm sido também utilizadas extensivamente com fins terapêuticos. Na América do Sul, a espécie Passiflora edulis tem sido utilizada como sedativo, diurético, anti-helmíntico, anti-diarréico, estimulante, tônico e também no tratamento de hipertensão, sintomas da menopausa e cólicas infantis. No Brasil, a espécie P. incarnata é utilizada como analgésico, anti-espasmódico, anti-asmático e sedativo e o suco da espécie P. maliformis Linn. é utilizado para febres intermitentes (DHAWAN; DHAWAN; SHARMA, 2004). Segundo Dembitsky et al. (2011), o extrato de maracujá tem o efeito de reduzir a pressão arterial e níveis séricos de óxido nítrico, além de promover efeitos hepatoprotetor, antioxidante e anti-inflamatório em mamíferos.
açúcares, redução no conteúdo de ácidos e perda de firmeza. A polpa é formada por sementes pretas, cobertas de uma substância amarela e translúcida, ligeiramente ácida e de aroma acentuado (DE MARCHI et al., 2000), caracterizado por substâncias pertencentes à classe dos terpenos e ésteres (MACORIS et al., 2011). Segundo Vianna-Silva et al. (2008), a composição dos frutos pode ser influenciada por diferentes fatores como por exemplo: estádio de maturação, época de colheita, condições de armazenamento, variabilidade genética, práticas culturais e adubação.
3.5.2 Banana
A bananeira teve sua origem no sudeste do Continente Asiático na região ocupada, atualmente, pela Malásia, Indonésia e Filipinas, onde existem ainda muitas variedades de bananas selvagens (BORGES et al., 2006). A bananeira pertence à família botânica Musaceae, na qual se destaca o gênero Musa e o gênero Ensete (que produz as chamadas “falsas bananas”). Dentre as inúmeras cultivares de banana difundidas mundialmente, destacam-se no Brasil as cultivares: Nanica, Nanicão e Grande Naine, utilizadas principalmente na exportação, e Prata, Pacovan, Prata Anã, Maçã, Mysore, Terra e D'Angola (SILVA et al., 1997).
A bananeira é uma planta herbácea com porte de 2-8 m de altura, cujo caule verdadeiro é subterrâneo, as folhas têm bainhas justapostas que formam o pseudocaule aéreo e os frutos são partenocárpicos (SEAGRI, 2011). Os frutos formam-se em cachos na parte superior dos pseudocaules que nascem do caule subterrâneo e chega a ter uma longevidade de 15 anos ou mais. Depois da maturação e colheita do cacho de bananas, o pseudocaule morre ou é cortado, dando origem, posteriormente, a novas plantas por afilhamento. As pseudobagas formam-se em conjuntos (clusters) que se agrupam até cerca de vinte bananas em "pencas". Os cachos de bananas, pendentes na extremidade do falso caule da bananeira, podem ter cinco a vinte pencas e podem pesar de 30 a 50 kg (GOMES, 1999).
Nordeste. A Região Nordeste contribuiu com 37,6 % da produção nacional, com aproximadamente 2,6 milhões de toneladas de frutos. No Ceará, os principais agropólos produtores de banana são o Baixo Jaguaribe, Cariri e Centro-Sul. Embora a maior parte da produção brasileira de bananas seja consumida in natura, na industrialização da banana podem ser obtidos vários produtos, dentre os quais: purê, néctar, fruta em calda, produtos desidratados, “chips”, doces e produtos fermentados (NOGUEIRA; TORREZAN, 1997).
O comércio mundial de banana orgânica registrou em 2000 um aumento de 50% nas exportações totais, sendo o principal mercado importador a Comunidade Européia, impulsionado principalmente pelo Reino Unido (BORGES et al., 2006). De acordo com Júnior et al. (2009), a produção de bananas no sistema orgânico aprarece como alternativa para que o produto final possa atingir uma parcela de consumidores específica, com maior poder aquisitivo, bem como é uma alternativa de redução de custos, além de ser um método mais sustentável de cultivo, gerando menores impactos ao meio ambiente.
Diversos estudos mostram que o consumo de frutas e vegetais tem sido associado com menor risco de problemas crônicos de saúde humana, como doenças cardiovasculares, câncer, hipertensão e diabetes tipo dois, devido ao seu conteúdo elevado de fitoquímicos com propriedades antioxidantes, anti-inflamatório e anticancerígeno atividade (ARTES; HOLLMAN, 2005; CHUN; KIM, 2004; KUSKOSKI; ASUERO; TRONCOSO, 2005; MANACH et al., 2004). Segundo Saura-Calixto e Goni (2006) este efeito protetor das frutas está relacionado com seu conteúdo de polifenóis, vitamina C e E, carotenóides e flavonóides.
3.5.3 Tomate
O tomateiro pertencente à ordem Tubiflorae, família Solanaceae e ao gênero Solanum, é nativo da região andina que abrange parte do Chile, Colômbia, Equador, Bolívia e Peru. (SANTOS, 2009). O tomateiro é uma planta herbácea, caule flexível ramificado, flores amareladas em cachos, frutos alongados ou achatados vermelhos e amarelos, rosados, apresentando espécies rasteiras e espécies trepadeiras (SEAGRI, 2011).
A produção mundial de tomate, em 2010, totalizou 145,7 milhões de toneladas de frutos. O maior produtor de tomate é a China, seguida pelos Estados Unidos, Índia e Egito (FAO, 2010). O Brasil ocupou a nona posição no ranking mundial, com uma produção de 4,1 milhões de toneladas de frutos, em uma área cultivada de aproximadamente 68.000 hectares e rendimento médio de aproximadamente 60,5 Kg/ha. No Brasil, a região Sudeste é a maior produtora de tomate (33,7%), seguida pela região Centro-Oeste (28%) e região Nordeste (21,5%). No Nordeste, os maiores produtores são os estados da Bahia (325.932 t), Pernambuco (115.123 t) e Ceará (115.853 t) (IBGE, 2010).
De acordo com Espinoza (1991), o tomate é consumido in natura como ingrediente de saladas ou na forma de produtos processados em extrato, sob a forma de suco, desidratado, com vinagre (picles), sendo os frutos verdes, em alguns países, utilizados para o preparo de doces. Os componentes do tomate como licopeno, fenólicos, flavonóides e vitaminas C e E são os principais responsáveis pela capacidade antioxidante do tomate e produtos processados de tomate, relacionados com a probabilidade de reduzir várias doenças crônicas, inclusive doenças cardiovasculares e certos tipos de câncer (GIOVANNUCCI, 1999; GÓMEZ-ROMERO et al., 2007; STEWART et al., 2000). Além disso, Toor e Savage (2005) demonstraram que a casca e sementes do tomate são fontes ricas em compostos antioxidantes e que a incorporação dessas frações no consumo in natura ou no processamento pode elevar o conteúdo de antioxidantes em 40-53%.
tomate seja o principal produto cultivado organicamente (PINHO, et al., 2011), as informações sobre os atributos físico-químicos, microbiológicos e nutricionais são escassas (BORGUINI; SILVA, 2007).
3.5.4 Ata
A ata é originária das Antilhas e foi introduzida na Bahia por volta de 1626, pelo Conde de Miranda, origem de um dos seus nomes populares. A ateira pertence à família Annonaceae, gênero Annona, que inclui aproximadamente 120 gêneros e 2000 espécies. As espécies mais importantes do gênero são Annona cherimóia Mill,Annona muricata L, Annona squamosa L, Annona reticulata L, e o híbrido atemóia (A. cherimola x A. squamosa) (DONADIO; MARTINS; VALENTE, 1992).
No Brasil a produção de ata ocorre principalmente nos estados de São Paulo, Rio de Janeiro, Minas Gerais, Distrito Federal e em vários estados do Norte e Nordeste (CORDEIRO et al., 2000). Segundo os mesmos autores os produtores da região do submédio São Francisco estão cada vez mais incentivados a investir no plantio desta fruteira, uma vez que nos mercados do Rio de Janeiro e São Paulo, os frutos alcançam altos preços, principalmente no início da safra. As principais fruteiras da família Annonaceae cultivadas no Brasil são: a pinha, a graviola e a atemóia. No Ceará, a área cultivada com ata foi de 184 ha com uma produção de 612 toneladas em 2011.
O fruto da ateira é uma baga constituída por muitos carpelos achatados que se afastam durante a maturação (GOMES, 1999). O principal índice de maturidade da ata consiste nas alterações na coloração da casca de verde-escuro para verde-amarelado e o apareciemnto da cor creme entre os carpelos separados (KADER; ARPAIA, 2006; PINTO et al., 2005). A polpa corresponde a 28-37% do peso total dos frutos e as sementes correspondem a 23-40%, além de carboidratos como a frutose, sacarose, glicose e oligossacarídios (LEAL, 1990; PAREEK et al., 2011). De acordo com Cordeiro et al. (2000),o ponto de colheita é um dos parâmetros mais importante de sua comercialização, pois quanto mais tempo o fruto permanece na planta, melhor será sua qualidade.
squamosa possuem efeitos hipoglicêmico, antidiabético e atividade antioxidante (GUPTA et al., 2005; KALEEM et al., 2006; SHIRWAIKAR et al., 2004). Além disso, flavonóides, glicosídios, alcalóides foram isolados das folhas desta planta. Contudo, as informações referentes à caracterização físico-química e conteúdo de compostos antioxidantes na polpa ainda são escassas.
3.5.5 Acerola
A acerola, também conhecida como cereja-das-Antilhas (Malpighia emarginata D.C.), é um fruto avermelhado originário da região das Antilhas, norte da América do Sul e América Central (NETO, 1986). A sua dispersão iniciou-se antes da chegada dos europeus, através dos nativos das ilhas Antilhanas, os quais a utilizavam muito em sua alimentação e a disseminaram de ilha em ilha em suas viagens e migrações (ALVES, 1996). A aceroleira é uma dicotiledônea da família Malpighiaceae que compreende aproximadamente 60 gêneros e mais de 1100 espécies.
No Brasil, a introdução da aceroleira ocorreu por volta de 1956 no estado de Pernambuco, porém somente após a divulgação de seu elevado conteúdo de vitamina C, na década de 80, é que o plantio se difundiu (NONINO, 1997). Segundo o Instituto Agropólos do Ceará, a área cultivada com acerola no Ceará em 2011 é estimada em 1.848 ha, com uma produção de mais de 13.000 toneladas de frutos, destacando-se a região da Serra da Ibiapaba. O mercado externo absorve aproximadamente 40% da produção nacional, sendo os principais destinos o Japão, a Europa e os Estados Unidos (COELHO; RITZINGER; OLIVEIRA, 2003).
crianças com anemia, regulação do crescimento de células anormais na fase de promoção da tumorigenesis pulmonar em ratos, como resultado da supressão da fase de iniciação, no processo da auto-oxidação (ARANHA; MOURA; SIMÕES, 2004; COSTA; TERTO; SANTOS, 2001; NAGAMINE et al., 2002).
4 MATERIAL E MÉTODOS
4.1 Obtenção dos Frutos
Os frutos do maracujazeiro (Passiflora edulis Sims Flavicarpa Deg., Figura 6) produzidos nos sistemas orgânicos e convencionais utilizados neste trabalho foram provenientes da Fazenda Nutrilite Amway e Fazenda Marovino, respectivamente, localizadas no município de Tianguá-CE. Os frutos da bananeira (Musa cv. Prata-anã, Figura 6) e do tomateiro (Solanum lycopersicum grupo Santa Cruz, Figura 7) oriundos de cultivos orgânico e convencional foram obtidos de pequenos produtores no município de Crato-CE. Os frutos da aceroleira (Malpighia emarginata D.C.) do clone BRS 235 (Figura 7) cultivados orgânica e convencionalmente foram provenientes da Fazenda Nutrilite Amway localizada no município de Tianguá-CE e da Estação Experimental da Embrapa Agroindústria Tropical localizada no munícipio de Pacajus-CE, respectivamente. Os frutos da ateira (Annona squamosa L.) cultivados orgânica e convencionalmente foram adquiridos da Central de Abastecimento do Ceará S/A (CEASA/CE) localizada no munícipio de Maracanaú-CE e provenientes da Fazenda Kabocla localizada em Limoeiro do Norte-CE, respectivamente. O sistema de produção orgânico usou como biofertilizante: coquetel de leguminosas, esterco bovino e bagaço de cana, sendo o extrato aquoso das folhas de Neem (Azadirachta indica) foi usado como pesticida. No sistema convencional, defensivos e fertilizantes inorgânicos foram usados segundo as recomendações para cada cultura.
Figura 6 - Estádios de desenvolvimento dos frutos do maracujazeiro e bananeira sob cultivo convencional e orgânico.
Fonte: Aurelice Barbosa de Oliveira
Figura 7 - Estádios de desenvolvimento dos frutos do tomateiro e aceroleira sob cultivo convencional e orgânico.
Fonte: Aurelice Barbosa de Oliveira
4.2 Análises de Qualidade
4.2.1 pH
O pH foi medido diretamente na polpa utilizando um potenciômetro digital, conforme metodologia recomendada pela AOAC (1995).
4.2.2 Acidez Titulável (AT)
A acidez titulável foi determinada por titulação volumétrica com solução de NaOH 0,1 N conforme IAL (1985). Aproximadamente 1 g da polpa foi pesado e diluído em 50 mL de água destilada. Fenolftaleína 1% foi utilizada como indicador. Uma solução de NaOH 0,1 N foi adicionada lentamente até a mudança de cor para levemente róseo. Os resultados foram expressos em percentagem de ácido málico (acerola e banana) e ácido cítrico (maracujá, tomate, ata).
4.2.3 Sólidos Solúveis (SS)
A polpa foi filtrada em papel de filtro e, em seguida, o conteúdo de sólidos solúveis foi medido utilizando um refratômetro digital portátil com compensação automática de temperatura, de acordo com metodologia recomendada por AOAC (1995). Os resultados foram expressos em oBrix.
4.3 Análises de Compostos Antioxidantes
4.3.1 Antocianinas e Flavonóides Amarelos
vidro e colocado por 12 h na geladeira. Após esse período, o material foi filtrado em papel de filtro qualitativo. O extrato, mantido em recipiente envolto com folha de papel de alumínio, teve sua absorbância medida a 535 e 374 nm para antocianinas e flavonóides amarelos, respectivamente, utilizando-se espectrofotômetro. Os resultados de ambas as análises foram expressos em mg.100 g-1 de polpa e calculados através da fórmula: absorbância x fator de diluição/98,2 e absorbância x fator de diluição/76,6 para antocianinas e flavonóides amarelos, respectivamente.
4.3.2 Vitamina C
O conteúdo de vitamina C foi determinado por titulação direta com solução de Tillman (2,6-dicloro-fenol-indofenol) segundo metodologia descrita por Strohecker e Henning (1967). Amostras de 0,5 g (acerola) e 1 g (maracujá, banana, tomate e ata) de polpa homogeneizada foram diluídas em 50 ml de ácido oxálico 0,5 %. Em seguida, foi retirada uma alíquota de 5 mL da amostra, diluída em 50 mL de água destilada e titulada em duplicata, com solução de Tillman até o ponto de viragem. Os resultados foram expressos em mg.100 g-1 de polpa.
4.4 Determinação da Atividade Antioxidante Total e Polifenóis Totais
4.4.1 Obtenção do Extrato
4.4.2 Determinação da atividade antioxidante total
A atividade antioxidante total (AAT) foi determinada segundo metodologia descrita por Re et al. (1999) e adaptada por Rufino et al. (2007). A análise envolve a produção direta do cromóforo ABTS.+ de cor azul esverdeado, obtido pela reação de 5 mL da solução de ABTS a 7 mM com 88 µL de solução de persulfato de potássio a 140 mM. O sistema foi mantido em repouso a temperatura ambiente (25°C), durante 16 h na ausência de luz. Uma vez formado o radical ABTS●+, o mesmo foi diluído com etanol P.A. até obter-se um valor de absorbância de 0,700 em comprimento de onda de 734 nm.
A atividade antioxidante total foi calculada com base em uma curva padrão linear utilizando como antioxidante de referência o composto 6-hidroxi-2,5,7,8-tetrametilchroman-2-ácido carboxílico (Trolox) preparado com etanol absoluto utilizando concentrações entre 100 e 2.000 µM. Em ambiente escuro, com as análises realizadas em triplicata para cada concentração foram utilizadas alíquotas de: 600 e 800 µL do extrato de maracujá na maturidade fisiológica e maduro, respectivamente; 100 µL dos extratos de ata e 30 µL dos extratos de acerola foram adicionadas a 3 mL da solução preparada do radical ABTS.+. Para a banana e tomate, alíquotas de 1.000 µL dos extratos foram adicionadas a 2 mL da solução preparada do radical ABTS. As absorbâncias foram medidas em espectrofotômetro a 734 nm, 6 minutos após a adição da solução do radical. A partir dessa curva foi obtida uma equação a partir da qual calculou-se a absorbância referente a 1.000 µM de Trolox.
4.4.3 Determinação de polifenóis solúveis totais
Os polifenóis solúveis totais foram determinados utilizando o reagente Folin-Ciocalteu e o ácido gálico como padrão, conforme metodologia descrita por Obanda e Owuor (1997). Em tubos de ensaio, foram adicionados 150 µL (acerola) ou 1.000 µL (maracujá, banana, tomate e ata) do extrato, 1 mL da solução de Folin Ciocalteau (1:2), 2 mL da solução de carbonato de sódio anidro a 20% e 2 mL de água destilada, na ausência de luz. As amostras permaneceram em repouso e em ausência de luz, por 30 minutos. Após este período foi realizada a leitura da absorbância a 700 nm. As concentrações de polifenóis solúveis totais foram calculadas com base em uma curva padrão de doses crescentes de ácido gálico 98% (0-50 µg). As análise foram realizadas em triplicata e os resultados expressos em mg de equivalente de ácido gálico por 100 g de polpa (mg EAG .100 g-1).
4.5 Determinação da Fenilalanina Amônia-Liase (PAL) e Proteínas Solúveis
4.5.1 Atividade da Fenilalanina Amônia-Liase (PAL)
O extrato enzimático da fenilalanina amônia-liase foi preparado segundo metodologia descrita por Mori et al. (2001). Pesou-se 1 g (maracujá, banana, tomate, ata) de polpa e homogeneizou-se com 2 mL (maracujá, tomate, ata) e 3 mL (banana) de Tampão Tris-HCl 100 mM pH 8,4 e 0,5 g de polivinilpirrolidona (PVP) por 3 min a 4 °C. Em seguida, centrifugou-se a 3.300 g por 20 min a 4 °C. O extrato enzimático obtido foi congelado e armazenado. A análise envolve a desaminação não oxidativa da fenilalanina através da reação espontânea catalisada pela fenilalanina amônia-liase. A atividade da PAL não foi determinada na acerola devido à indisponibilidade de amostras para realização da análise.