UNIVERSIDADE FEDERAL DO CEARÁ
CENTRO DE CIÊNCIAS
DEPARTAMENTO DE QUÍMICA ORGÂNICA E INORGÂNICA
CURSO DE PÓS-GRADUAÇÃO EM QUÍMICA
JULIANA MARIA OLIVEIRA DE SOUZA
BIORREDUÇÃO DE CETONAS AROMÁTICAS
UTILIZANDO CÉLULAS ÍNTEGRAS DE HELIANTHUS
ANNUUS L. (GIRASSOL)
FORTALEZA-CEARÁ
JULIANA MARIA OLIVEIRA DE SOUZA
BIORREDUÇÃO DE CETONAS AROMÁTICAS UTILIZANDO CÉLULAS ÍNTEGRAS DE HELIANTHUS ANNUUS L. (GIRASSOL)
FORTALEZA-CEARÁ
2012
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca de Ciências e Tecnologia
______________________________________________________________________
S715b Souza, Juliana Maria Oliveira de.
Biorredução de cetonas aromáticos utilizando células íntegras de Helianthus annuus L. (Girassol) / Juliana Maria Oliveira de Souza. – 2012.
137 f. : il. color., enc. ; 30 cm.
Dissertação (mestrado) – Universidade Federal do Ceará, Centro de Ciências, Departamento de Química. Programa de Pós-Graduação em Química, Fortaleza, 2012.
Área de concentração: Química Orgânica.
Orientação: Profa. Dra. Telma Leda Gomes de Lemos.
1. Biorredução-cetona. 2. Biocatálise. 3. Girassol. I. Título.
A Deus por toda graça.
A minha mãe e irmão por todo amor e dedicação.
Ao meu pai, meu herói.
A minha vó, Izaura (in memoriam), por todo exemplo.
AGRADECIMENTOS
A Deus por todo amor e infinita misericórdia, por sustentar-me inúmeras vezes nessa batalha tão difícil que a vida, por mostrar-me os caminhos certos a seguir e por nunca desistir de mim, por ter me dado a oportunidade de ser apenas eu e poder estar ao lado dessas pessoas aqui embaixo, agradecendo a elas também.
A minha mãe, razão de toda essa conquista, por sempre estar ao meu lado, demonstrando infinito amor e compreensão, por fazer o seu melhor, para sempre ver o meu melhor acontecer, obrigada por tudo.
Ao meu pai, por quem eu sempre busquei ser melhor nessa vida.
A minha vó (in memoriam), por ter me incentivado a ser uma pessoa guerreira e batalhadora por aquilo que acredito, por ser meu maior exemplo e minha maior coragem de viver. Saudades!
A minha orientadora, Profa. Telma Leda, por ter aceito mais esta filha de peito aberto na família LBPN, por todos os conhecimentos repassados, por toda atenção, disponibilidade e contribuição para a minha vida acadêmica e profissional.
Ao meu irmão, Rafael, por ser meu apoio, minha segurança, minha infância sempre vivida e revivida a cada dia.
A Leila Parente, por ter me encaminhado nos primeiros experimentos do laboratório,
por ter me ensinado o “andar da carruagem” e assim contribuído com o
desenvolvimento deste trabalho e seu consequente sucesso.
Aos amigos irmãos do laboratório mais feliz da UFC: Ayla, Leo Alcântara, Bertini, Luciana, Felipe, Cleane, Patrícia, André, Leila, Karina, Anderson, Allyson, Gisele e Leo Carvalho. Os melhores dias são todos aqueles em podemos trabalhar juntos. Obrigada por tudo, por me acolherem, por todo apoio, amizade, companheirismo e lealdade, guardo-os em meu coração. Não esquecendo da amiga Daniele, pelos momentos de descontração e fiel amizade.
A minha família tão querida e que sempre me apoiou, obrigada pelos sempre belos gestos de amizade e pelas orações.
Aos meus amigos mais polares, Thays e Leo, por sempre estarem ao meu lado, por me amarem tanto, amo-os muito, que a vida possa sempre dar oportunidade para eu declarar minha felicidade por tê-los comigo sempre
A minha amiga mais irmã, Lilian, flor da minha vida, presente sempre nos momentos de alegria e nos momentos de não tanta alegria, apoio certo e amizade eterna.
As minhas amigas, Pamella e Gliamici, lembrança sempre viva em meu coração, base de tudo sou, pessoas mais que importantes são essenciais em minha vida.
Aos amigos de hoje e sempre, que levaram um pouco de mim e deixaram um pouco de si, obrigada por me cativarem, e terem se tornado únicos no mundo.
Aos professores do Curso de Pós-Graduação em Química pelos conhecimentos e apoio durante o curso, obrigada por contribuirem de forma direta para minha formação.
A Caroline Lustosa do LABS por conceder, sempre com muita atenção, alguns dos substratos investigados neste trabalho.
RESUMO
O estudo da biocatálise tem se intensificado nos últimos anos devido à busca de rotas sintéticas alternativas para a obtenção de compostos enantiomericamente puros. A utilização de sementes de Helianthus annuus L. ainda não foi relatada na literatura em reações de biorredução e diante dessa perspectiva, foram investigadas na biorredução de cetonas aromáticas, para a obtenção de álcoois enantiomericamente puros. O teor de proteínas das sementes foi determinado pelos métodos de Lowry e Bradford e apresentaram valores correspondentes a 10,1 g/L e 8,8 g/L, respectivamente. As reações de biorredução foram otimizadas utilizando acetofenona (1), e nestas foram avaliados os fatores: quantidade de biocatalisador, meio tamponante (pH), co-solvente, germinação de sementes e extrato bruto com polivilpirrolidona (PVP). Foram obtidos boas conversões (56,9%) em meio aquoso e, excelentes excessos enantiómericos (ee), (>99,0%) com o extrato bruto enzimático em PVP do enantiômero (S). Derivados da
acetofenona, uma cetona α-halogenada e duas outras cetonas aromáticas, α-tetralona e
α-indanona, foram submetidas às metodologias otimizadas de conversão e ee, obtendo-se bons resultados, com produção do enantiômero S, exceto para a 3-metóxi-acetofenona em meio aquoso, que apresentou o isômero R. A quantificação dos teores de conversão foi realizada por intermédio da construção de curvas de calibração em Cromatográfo Líquido de Alta Eficiência (CLAE), bem como a resolução dos álcoois quirais utilizando coluna quiral OB-H.
ABSTRACT
The study of biocatalysis has intensified in recent years due to the search for alternative synthetic routes to obtain enantiomerically pure compounds. The use of seeds of
Helianthus annuus L. has not been reported in the literature and bioreduction reactions at this point of view, were investigated in the bioreduction of aromatic ketones, to obtain enantiomerically pure alcohols. The protein content of the seeds was determined by Lowry and Bradford methods and gave values corresponding to 10,1g/L and 8,8g/L, respectively. The bioreduction reactions were optimized using acetophenone (1), and these factors were evaluated: the amount of biocatalyst, using buffer (pH), co-solvent, seed germination and the crude extract with polyvinylpyrrolidone (PVP). Good conversions were obtained (56,9%) in aqueous solution and excellent enantiomeric excess (ee) (>99,0%) crude extract with the enzyme in PVP enantiomer (S). Derivatives of acetophenone, an α-halogenated ketone and two other aromatic ketones, α-tetralone and α-indanone were subjected to the methods of conversion and ee optimized to yield good results, with production of the S enantiomer, except for the 3-methoxy-acetophenone in aqueous media, which made the R isomer. Quantitation of the conversion levels were determined by the construction of calibration curves in a High Efficiency Liquid Chromatograph (HPLC) and the resolution of chiral alcohols using a chiral column OB-H.
LISTA DE FIGURAS
Figura 1 Estruturas da Efedrina, Ampicilina e Cefadroxil obtidas por
biotransformações... 32
Figura 2 Álcoois quirais e produtos obtidos a partir de álcoois quirais... 34
Figura 3 Estruturas de terpenos quirais e produtos obtidos a partir deles... 35
Figura 4 Álcoois quirais de interesse industrial... 36
Figura 5 Redução assimétrica biocatálitica de compostos carbonílicos com NADPH na presença de ADH... 37
Figura 6 Biorredução da acetofenona utilizando várias espécies de plantas... 38
Figura 7 Cetonas utilizadas na biorredução com Arabidopsis thaliana... 39
Figura 8 Fotografia da flor de Helianthus annuus L. tendo como detalhe as sementes utilizadas nas biotransformações... 41
Figura 9 Estruturas dos ácidos fenólicos presentes nas sementes de Helianthus annuus L... 43
Figura 10 Aminoácidos utilizados para biotransformação por Helianthus annuus L... 44
Figura 11 Esquema da reação de redução das cetonas pró-quirais por via química... 46
Figura 12 Detalhe da reação do extrato enzimático das sementes de Helianthus annuus L. com o íon cobre (II)... 55
Figura 13 Detalhe da reação do extrato enzimático das sementes de Helianthus annuus L. com o reagente de Folin-Ciocalteau... 55
Figura 14 Detalhe do método de Bradford para determinação de proteínas após a adição do reagente Coomassie Brilliant Blue G-250... 56
Figura 15 Esquema da reação de redução da acetofenona por via enzimática... 58
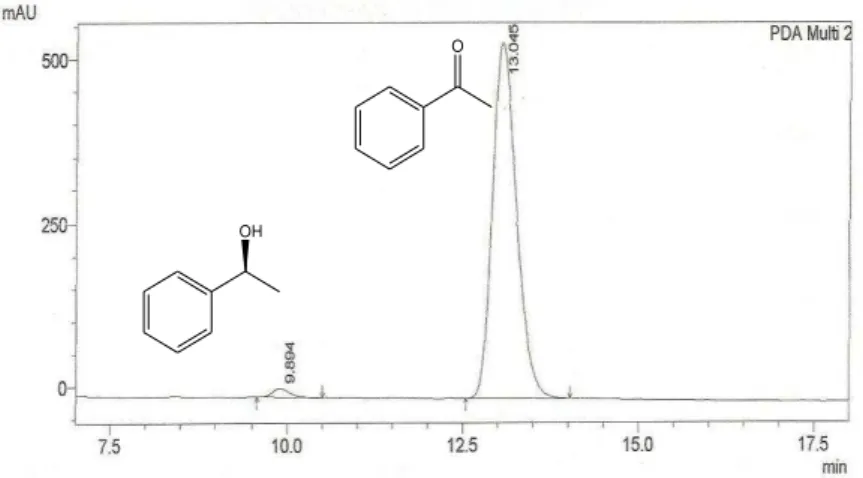
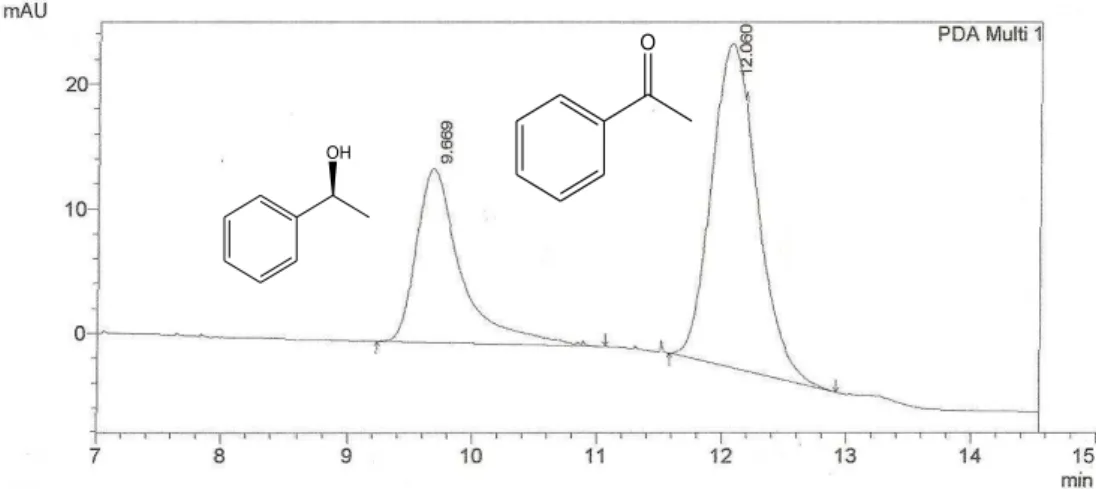
Figura 16 Cromatograma do produto da biorredução da acetofenona utilizando 5 g de Helianthus annuus L... 59
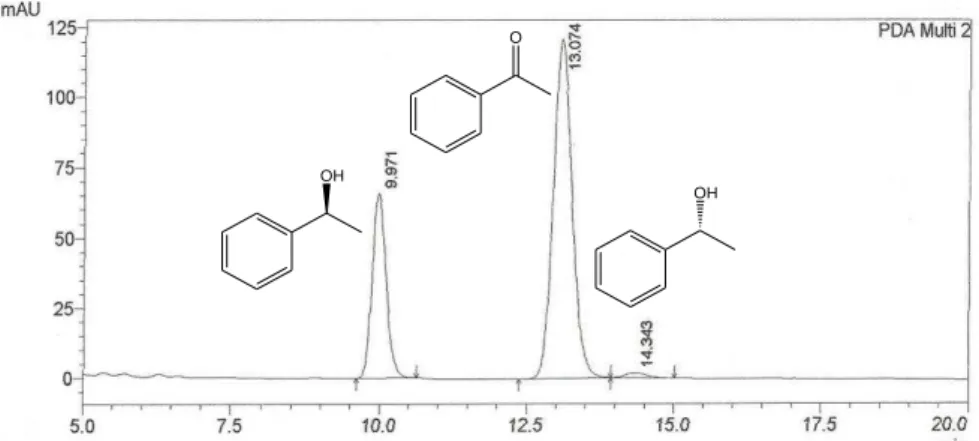
Figura 17 Cromatograma do produto da biorredução da acetofenona utilizando 10 g de Helianthus annuus L... 59
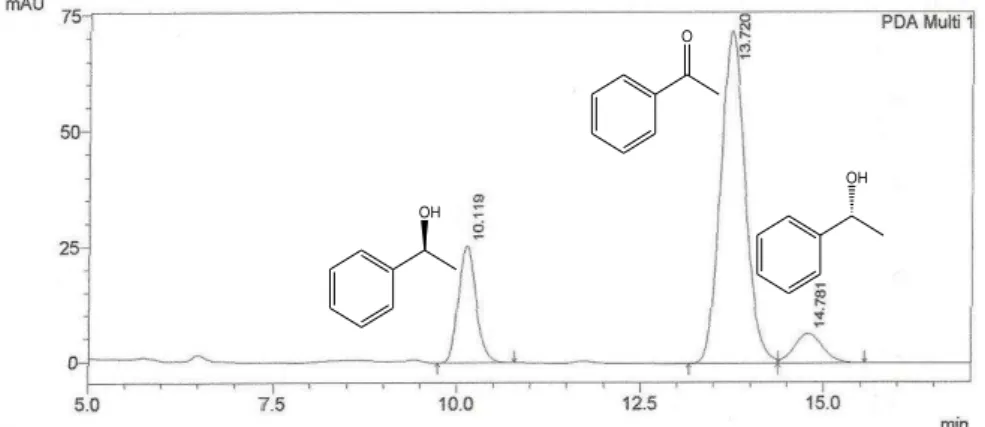
Figura 18 Cromatograma do produto da biorredução da acetofenona utilizando 20 g de Helianthus annuus L... 59
Figura 19 Cromatograma do produto da biorredução da acetofenona utilizando 1% de isopropanol... 61
Figura 21 Cromatograma do produto da biorredução da acetofenona utilizando 5% de isopropanol... 62 Figura 22 Cromatograma do produto da biorredução da acetofenona utilizando 10%
de isopropanol... 62 Figura 23 Cromatograma do produto da biorredução da acetofenona utilizando
solução tampão pH 6,0... 64 Figura 24 Cromatograma do produto da biorredução da acetofenona utilizando
solução tampão pH 7,0... 64 Figura 25 Cromatograma do produto da biorredução da acetofenona utilizando
solução tampão pH 8,0... 65 Figura 26 Cromatograma do produto da biorredução da acetofenona utilizando
extrato bruto enzimático com PVP... 66 Figura 27 Estrutura monomérica do polímero PVP... 67 Figura 28 Cromatograma do produto da biorredução da acetofenona utilizando
sementes germinadas de Helianthus annuus L... 68 Figura 29 Cetonas selecionadas para a reação com as sementes de Helianthus annuus
L... 69 Figura 30 Produtos esperados da reação das cetonas -para substituídas utilizando a
metodologia G10 e Gpvp... 70 Figura 31 Cromatograma de biorredução da 4-bromo-acetofenona utilizando a
metodologia G10... 71 Figura 32 Cromatograma de biorredução da 4-bromo-acetofenona utilizando a
metodologia Gpvp... 71 Figura 33 Cromatograma de biorredução da 4-fluoro-acetofenona utilizando a
metodologia G10... 73 Figura 34 Cromatograma de biorredução da 4-fluoro-acetofenona utilizando a
metodologia Gpvp... 73 Figura 35 Cromatograma de biorredução da 4-cloro-acetofenona utilizando a
metodologia G10... 74 Figura 36 Cromatograma de biorredução da 4-cloro-acetofenona utilizando a
metodologia Gpvp... 75 Figura 37 Cromatograma de biorredução da 4-metóxi-acetofenona utilizando a
Figura 38 Cromatograma de biorredução da 4-metóxi-acetofenona utilizando a metodologia Gpvp... 76 Figura 39 Cromatograma de biorredução da 4-metil-acetofenona utilizando a
metodologia G10... 78 Figura 40 Cromatograma de biorredução da 4-metil-acetofenona utilizando a
metodologia Gpvp... 78 Figura 41 Cromatograma CG/EM da biorredução da 4-metil-acetofenona utilizando a
metodologia Gpvp... 79 Figura 42 Espectro de massa do 4-metil-feniletanol... 79 Figura 43 Espectro de massa da 4-metil-acetofenona... 79 Figura 44 Produtos esperados da reação das cetonas -meta substituídas utilizando a
metodologia G10 e Gpvp... 81 Figura 45 Cromatograma de biorredução da 3-bromo-acetofenona utilizando a
metodologia G10... 82 Figura 46 Cromatograma de biorredução da 3-bromo-acetofenona utilizando a
metodologia Gpvp... 82 Figura 47 Cromatograma de biorredução da 3-metóxi-acetofenona utilizando a
metodologia G10... 84 Figura 48 Cromatograma de biorredução da 3-metóxi-acetofenona utilizando a
metodologia Gpvp... 84 Figura 49 Produtos esperados da reação das cetonas -orto substituídas utilizando a
metodologia G10 e Gpvp... 85 Figura 50 Cromatograma de biorredução da 2-bromo-acetofenona utilizando a
metodologia G10... 86 Figura 51 Cromatograma de biorredução da 2-bromo-acetofenona utilizando a
metodologia Gpvp... 86 Figura 52 Cromatograma de biorredução da 2-cloro-acetofenona utilizando a
metodologia G10... 88 Figura 53 Cromatograma de biorredução da 2-cloro-acetofenona utilizando a
metodologia Gpvp... 88 Figura 54 Cromatograma de biorredução da 2-metóxi-acetofenona utilizando a
Figura 55 Cromatograma de biorredução da 2-metóxi-acetofenona utilizando a metodologia Gpvp... 90 Figura 56 Cromatograma de biorredução da 2-hidróxi-acetofenona utilizando a
metodologia G10... 91 Figura 57 Cromatograma de biorredução da 2-hidróxi-acetofenona utilizando a
metodologia Gpvp... 91 Figura 58 Espectro de RMN ¹H (300 MHz, CDCl3) da 2-hidróxi-acetofenona... 92 Figura 59 Produto esperado da reação da 2,2,2-trifluoro-acetofenona utilizando a
metodologia G10 e Gpvp... 93 Figura 60 Cromatograma de biorredução da 2,2,2-trifluoro-acetofenona utilizando a
metodologia G10... 94 Figura 61 Cromatograma de biorredução da 2,2,2-trifluoro-acetofenona utilizando a
metodologia Gpvp... 94 Figura 62 Produtos esperados da reação da α-tetralona e da α-indanona utilizando a
metodologia G10 e Gpvp... 95 Figura 63 Cromatograma de biorredução da α-tetralona utilizando a metodologia
G10... 96 Figura 64 Cromatograma de biorredução da α-tetralona utilizando a metodologia
Gpvp... 96 Figura 65 Cromatograma de biorredução da α-indanona utilizando a metodologia
G10... 98 Figura 66 Cromatograma de biorredução da α-indanona utilizando a metodologia
Gpvp... 98 Figura 67 Detalhe da CCD da biorredução da acetofenona... 101 Figura 68 Cromátografo Líquido de Alta Eficiência utilizado nas análises de
LISTA DE TABELAS
Tabela 1 Disposição cinética e efeitos estereosseletivos de alguns fármacos quirais... 31 Tabela 2 Rendimentos da obtenção dos álcoois padrões 1a-15a... 46 Tabela 3 Substratos utilizados para a obtenção das curvas de calibração para
análise do teor de conversão nas reações de biorredução... 47 Tabela 4 Resultados de biorredução da acetofenona utilizando 5 g, 10 g e 20 g de
Helianthus annuus L... 58 Tabela 5 Resultados de biorredução da acetofenona com sementes de Helianthus
annuus L. utilizando isopropanol como co-solvente... 61 Tabela 6 Resultados de biorredução da acetofenona com sementes de Helianthus
annuus L. utilizando diferentes soluções tampão... 64 Tabela 7 Resultados de biorredução da acetofenona com sementes de Helianthus
annuus L. utilizando extrato bruto enzimático com PVP... 66 Tabela 8 Resultados de biorredução da acetofenona com sementes de Helianthus
annuus L.germinadas... 67 Tabela 9 Resultados da biotransformação da 4-bromo-acetofenona com sementes
de Helianthus annuus L. pelas metodologias G10 e Gpvp... 71 Tabela 10 Resultados da biotransformação da 4-fluoro-acetofenona com sementes
de Helianthus annuus L. pelas metodologias G10 e Gpvp... 72 Tabela 11 Resultados da biotransformação da 4-cloro-acetofenona com sementes
de Helianthus annuus L. pelas metodologias G10 e Gpvp... 74 Tabela 12 Resultados da biotransformação da 4-cloro-acetofenona com sementes
de Helianthus annuus L. pelas metodologias G10 e Gpvp... 76 Tabela 13 Resultados da biotransformação da 4-metil-acetofenona com sementes
de Helianthus annuus L. pelas metodologias G10 e Gpvp... 77 Tabela 14 Resultados da biotransformação da 3-bromo-acetofenona com sementes
de Helianthus annuus L. pelas metodologias G10 e Gpvp... 81 Tabela 15 Resultados da biotransformação da 3-metóxi-acetofenona com sementes
de Helianthus annuus L. pelas metodologias G10 e Gpvp... 83 Tabela 16 Resultados da biotransformação da 2-bromo-acetofenona com sementes
Tabela 17 Resultados da biotransformação da 2-cloro-acetofenona com sementes de Helianthus annuus L. pelas metodologias G10 e Gpvp... 87 Tabela 18 Resultados da biotransformação da 2-metóxi-acetofenona com sementes
de Helianthus annuus L. pelas metodologias G10 e Gpvp... 89 Tabela 19 Resultados da biotransformação da 2-hidróxi-acetofenona com sementes
de Helianthus annuus L. pelas metodologias G10 e Gpvp... 90 Tabela 20 Resultados da biotransformação da 2,2,2-trifluoro-acetofenona com
sementes de Helianthus annuus L. pelas metodologias G10 e Gpvp... 93 Tabela 21 Resultados da biotransformação da α-tetralona com sementes de
Helianthus annuus L. pelas metodologias G10 e Gpvp... 96 Tabela 22 Resultados da biotransformação da α-indanona com sementes de
Helianthus annuus L. pelas metodologias G10 e Gpvp... 97 Tabela 23 Parâmetros de análise por CLAE dos substratos utilizados nas reações de
LISTA DE GRÁFICOS
Gráfico 1 Curva de calibração da acetofenona... 49
Gráfico 2 Curva de calibração do (±)-feniletanol... 49
Gráfico 3 Curva de calibração da 4-bromo-acetofenona... 50
Gráfico 4 Curva de calibração do: (±) 1-(4-bromofenil)-etanol... 50
Gráfico 5 Curva de calibração da 4-fluoro-acetofenona... 50
Gráfico 6 Curva de calibração do (±) 1-(4-fluorofenil)-etanol... 50
Gráfico 7 Curva de calibração da 4-cloro-acetofenona... 50
Gráfico 8 Curva de calibração do (±) 1-(4-clorofenil)-etanol... 50
Gráfico 9 Curva de calibração da 4-metóxi-acetofenona... 51
Gráfico 10 Curva de calibração do (±) 1-(4-metóxifenil)-etanol... 51
Gráfico 11 Curva de calibração da 4-metil-acetofenona... 51
Gráfico 12 Curva de calibração do (±) 1-(4-metilfenil)-etanol... 51
Gráfico 13 Curva de calibração da 3-bromo-acetofenona... 51
Gráfico 14 Curva de calibração do (±)3-bromo-feniletanol... 51
Gráfico 15 Curva de calibração da 3-metóxi-acetofenona... 52
Gráfico 16 Curva de calibração do (±) 1-(3-metóxifenil)-etanol... 52
Gráfico 17 Curva de calibração da 2-bromo-acetofenona... 52
Gráfico 18 Curva de calibração do (±) 1-(2-bromofenil)-etanol... 52
Gráfico 19 Curva de calibração da 2-cloro-acetofenona... 52
Gráfico 20 Curva de calibração do (±) 1-(2-clorofenil)-etanol... 52
Gráfico 21 Curva de calibração da 2-metóxi-acetofenona... 53
Gráfico 22 Curva de calibração do (±) 1-(2-metóxifenil)-etanol... 53
Gráfico 23 Curva de calibração da 2,2,2-trifluoro-acetofenona... 53
Gráfico 25 Curva de calibração da α-tetralona... 53
Gráfico 26 Curva de calibração do (±)-α-tetralol... 53
Gráfico 27 Curva de calibração da α-indanona... 54
Gráfico 28 Curva de calibração do α-indanol... 54
Gráfico 29 Estudo comparativo das metodologias de Lowry e Bradford para a determinação de proteínas solúveis totais... 57
Gráfico 30 Perfil de conversão da biorredução da acetofenona utilizando diferentes proporções de biocatalisador... 60
Gráfico 31 Perfil do excesso enantiomérico da biorredução da acetofenona utilizando diferentes proporções de biocatalisador... 60
Gráfico 32 Perfil de conversão da biorredução da acetofenona utilizando diferentes proporções de co-solvente: isopropanol... 63
Gráfico 33 Perfil do excesso enantiomérico da biorredução da acetofenona utilizando diferentes proporções de co-solvente: isopropanol... 63
Gráfico 34 Perfil de conversão da biorredução da acetofenona utilizando soluções tampão com diferentes valores de pH... 65
Gráfico 35 Perfil do excesso enantiomérico da biorredução da acetofenona utilizando soluções tampão com diferentes valores de pH... 65
Gráfico 36 Perfil de biotransformação da 4-bromo-acetofenona utilizando as metodologias G10 e Gpvp... 72
Gráfico 37 Perfil de biotransformação da 4-fluoro-acetofenona utilizando as metodologias G10 e Gpvp... 73
Gráfico 38 Perfil de biotransformação da 4-cloro-acetofenona utilizando as metodologias G10 e Gpvp... 75
Gráfico 39 Perfil de biotransformação da 4-metóxi-acetofenona utilizando as metodologias G10 e Gpvp... 77
Gráfico 40 Perfil de biotransformação da 4-metil-acetofenona utilizando as metodologias G10 e Gpvp... 80
Gráfico 41 Perfil de biotransformação da 3-bromo-acetofenona utilizando as metodologias G10 e Gpvp... 82
Gráfico 43 Perfil de biotransformação da 2-bromo-acetofenona utilizando as metodologias G10 e Gpvp... 87 Gráfico 44 Perfil de biotransformação da 2-cloro-acetofenona utilizando as
metodologias G10 e Gpvp... 88 Gráfico 45 Perfil de biotransformação da 2-metóxi-acetofenona utilizando as
metodologias G10 e Gpvp... 90 Gráfico 46 Perfil de biotransformação da 2,2,2-trifluoro-acetofenona utilizando as
metodologias G10 e Gpvp... 94 Gráfico 47 Perfil de biotransformação da α-tetralona utilizando as metodologias
G10 e Gpvp... 97 Gráfico 48 Perfil de biotransformação da α-indanona utilizando as metodologias
LISTA DE ABREVIATURAS
AcOEt Acetato de Etila
BSA Albumina Bovina
CC Coluna Cromatográfica
CCD Cromatografia em Camada Delgada
CENAUREMN Centro Nordestino de Aplicação e Uso da Ressonância Magnética Nuclear
CG/EM Cromatografia Gasosa acoplada a Espectrometria de Massas CLAE Cromatografia Líquida de Alta Eficiência
ee Excesso Enantiomérico
IV Infravermelho
iPrOH Isopropanol
NADH/NAD+ Nicotinamida Adenina Dinucleotídeo
NADP/NADPH Nicotinamida Adenina Dinucleótideo Fosfato
pH Potencial Hidrogeniônico
RMN 1H Ressonância Magnética Nuclear de Hidrogênio r.p.m Rotação por minuto
Tr Tempo de retenção
UV-Vis Ultravioleta Visível
SUMÁRIO
LISTA DE FIGURAS... 9
LISTA DE TABELAS... LISTA DE GRÁFICOS... LISTA DE ABREVIATURAS E SIGLAS... 13 15 18 1. INTRODUÇÃO... 23
2. BIOCATÁLISE... 28
2.1 Quiralidade e Biocatálise... 30
2.2 Álcoois Quirais... 33
2.2.1 Obtenção de álcoois a partir de cetonas via enzimática... 37
3. CONSIDERAÇÕES SOBRE Helianthus annuus L... 41
4. RESULTADOS E DISCUSSÕES... 46
4.1 Obtenção dos álcoois padrões por via química... 46
4.2 Curvas de calibração dos substratos... 47
4.2.1 Acetofenona e (±)-1-feniletanol... 49
4.2.2 4-bromo-acetofenona e (±) 1-(4-bromofenil)-etanol... 50
4.2.3 4-fluoro-acetofenona e (±) 1-(4-fluorofenil)-etanol... 50
4.2.4 4-cloro-acetofenona e (±) 1-(4-clorofenil)-etanol... 50
4.2.5 4-metóxi-acetofenona e (±) 1-(4-metóxifenil)-etanol... 51
4.2.6 4-metil-acetofenona e (±) 1-(4-metilfenil)-etanol... 51
4.2.7 3-bromo-acetofenona e (±) 1-(3-bromofenil)-etanol... 51
4.2.8 3-metóxi-acetofena e (±) 1-(3-metóxifenil)-etanol... 52
4.2.9 2-bromo-acetofenona e (±) 1-(2-bromofenil)-etanol... 52
4.2.10 2-cloro-acetofenona e (±) 1-(2-clorofenil)-etanol... 52
4.2.11 2-metóxi-acetofenona e (±) 1-(2-metóxifenil)-etanol... 53
4.2.12 2,2,2-trifluoro-acetofenona e (±)-2,2,2-trifluoro-feniletanol... 53
4.2.13 α-tetralona e (±)-α-tetralol... 53
4.2.14 α-indanona e (±)-α-indanol... 54
4.3 Determinação do teor de proteínas das sementes de Helianthus annuus L... 54
4.3.1 Método de Lowry (modificado por Hartree)... 54
4.3.2 Método de Bradford... 56
4.4 Processos biocatalíticos... 57
4.4.2 Co-solvente: Isopropanol... 60 4.4.3 Meio tamponante: tampão fosfato... 63 4.4.4 Extrato enzimático bruto segundo Lupetti (2000)... 65 4.4.5 Germinação das sementes de Helianthus annuus L... 67 4.4.6 Reações de biotransformação utilizando derivados da acetofenona... 68 4.4.6.1 Cetonas -para substituídas... 70 4.4.6.2 Cetonas -meta substituídas... 80 4.4.6.3 Cetonas -orto substituídas... 85 4.4.6.4 Cetona α-halogenada... 92 4.4.6.5 Cetonas aromáticas... 95 5. PROCEDIMENTO EXPERIMENTAL... 100
5.1 Material utilizado... 100 5.2 Métodos de Análise... 100 5.2.1 Cromatografia em Camada Delgada (CCD)... 100 5.2.2 Cromatografia de Adsorção... 101 5.2.3 Cromatografia Líquida de Alta Eficiência (CLAE)... 101 5.2.4 Ressonância Magnética Nuclear (RMN)... 103 5.2.5 Espectroscopia na Região do UV/VIS... 103 5.2.6 Cromatografia Gasosa acoplada à Espectrometria de Massas (CG/EM)... 104 5.3 Determinação de Proteínas... 104 5.3.1 Método de Lowry (modificado por Hartree)... 105 5.3.2 Método de Bradford... 105 5.4 Processos Biocatalíticos... 106 5.4.1 Procedimento geral das biotransformações utilizando células íntegras de
vegetais... 106 5.4.1.1Quantidade de biocatalisador... 107 5.4.1.2Uso de co-solvente: Isopropanol... 107 5.4.1.3Meio tamponante: pH 6,0, 7,0 e 8,0... 108 5.4.1.4Extrato bruto enzimático (LUPPETI, 2000)... 108 5.4.1.5Sementes de Helianthus annuus L. germinadas... 108 5.4.2 Obtenção dos álcoois padrões por via química... 109 5.4.3 Substratos selecionados nas reações de biotransformação utilizando as
5.4.5 Obtenção dos excessos enantioméricos (ee)... 110 5.4.6 Obtenção das curvas de calibração dos substratos e produtos esperados... 110 6. CONSIDERAÇÕES FINAIS... 112
7. REFERÊNCIAS... 115
1. INTRODUÇÃO
O termo biotransformação pode ser aplicado para descrever modificações específicas ou interconversões de substâncias químicas catalisadas por células vegetais, animais ou microbianas, ou ainda enzimas isoladas. É conhecido por apresentar um grande potencial em gerar novos produtos ou, ainda, produzir mais eficientemente produtos conhecidos.
Grande parte do interesse pelas biotransformações deve-se à habilidade de se catalisar reações com regio-, quimio- e estereosseletividade, aliada a outros fatores como a utilização de meios aquosos, biodegradabilidade e a não necessidade de proteção de alguns grupos funcionais. A união destes fatores representa uma alternativa sintética bastante viável e dentro dos princípios da química verde.
A área multidisciplinar da biocatálise encontra-se atualmente em amplo desenvolvimento. Pesquisas realizadas em vários ramos da química e da biologia tem como principal objetivo o desenvolvimento de novos catalisadores para uso industrial.
A biocatálise é hoje um dos campos mais promissores dentro das novas tecnologias para síntese de compostos de alto valor agregado (CARVALHO et al., 2005). O seu desenvolvimento pode ser relacionado com produção de novas drogas e agrotóxicos, bem como o seu uso em outros processos industriais (ZAKS; DODDS, 1997). Várias reações foram introduzidas e aperfeiçoadas, especialmente em síntese de moléculas quirais de interesse farmacológico (LUNA, 2004; SHARMA et al., 2005), cosméticos e substâncias químicas indústrias (VEIT, 2004; LIU; WEIS; GLEIDER., 2004).
Indústrias que adquiriram conhecimentos em síntese assimétrica, atualmente apresentam grandes vantagens tecnológicas e industriais, comparadas com as que não se encontram capacitadas para a produção de compostos enantiomericamente puros. Também, a área de biocatálise emergiu como uma ferramenta poderosa para a chamada química ecologicamente correta (green chemistry), a qual levará cada vez mais a processos industriais comprometidos com a preservação ambiental (VIEIRA et al., 2010).
Dentre as numerosas aplicações de reações enzimáticas em meio orgânico destacam-se a síntese de produtos de interesse nas áreas clínica, nutricional, ambiental, industrial e biotecnológica (REETZ, 2002).
Os processos mais estudados em reações enzimáticas utilizam bactérias e fungos, mas também são relatados ensaios com enzimas isoladas e, mais recentemente, com células íntegras e imobilizadas de vegetais. O uso de células íntegras significa a utilização da biomassa da fonte enzimática nas reações em questão (VILELA; SGARBIERI; ALVIM, 2000).
A incessante busca por compostos com atividade farmacológica os quais, em sua grande maioria, são compostos quirais com pelo menos um centro estereogênico, o que pode dificultar sua obtenção através de reações por via química, torna os estudos de biocatálise e a procura de novas fontes biocatalíticas cada vez mais comuns. Em função disto, as maiores aplicações da biocatálise são referentes a sua utilização em síntese assimétrica, onde enzimas vêm sendo utilizadas em substituição dos processos químicos clássicos (PANKE; HELD; WOBBOLTS, 2004). Outra realidade a ser apontada é o fato de que o emprego de catalisadores naturais apresenta uma alternativa ambientalmente mais correta em relação às rotas sintéticas convencionais.
Vários estudos relatam a relação da atividade biológica com a quiralidade molecular. Um dos casos mais conhecidos é a talidomida, onde na década de 1960, provocou a má formação fetal em várias gestantes. Descobriu-se que apenas o enantiômero R era o responsável pelas funções biológicas do medicamento (SILVEIRA
et al., 2001).
eficientes e altamente seletivos para a síntese de enantiômeros puros através de reações assimétricas (BALAKRISHNAN et al., 2011).
A produção de compostos quirais requer o uso de catalisadores específicos, caros e tóxicos. Nessa perspectiva a biocatálise pode ser utilizada para minimizar esses impactos. Dentre os compostos quirais que possuem grande importância nos processos de síntese orgânica, destacam-se os álcoois.
A produção de álcoois enantiomericamente puros é de grande importância para a química orgânica, pois estes são utilizados como intermediários na síntese de produtos químicos para as indústrias agroquímicas e farmacêuticas, mais especificamente. Muitos destes compostos são obtidos através de reduções assimétricas de cetonas pró-quirais utilizando microorganismos, vegetais ou enzimas isoladas como biocatalisadores (KURBANOGLU et al., 2010).
A redução assimétrica de cetonas é uma das reações mais importantes, fundamentais e práticas para a produção de álcoois quirais, que podem ser transformados em várias funcionalidades na sua forma enantiomérica pura (YANG et al., 2006).
O emprego de células íntegras de vegetais na biorredução de cetonas para a produção de álcoois vem aumentado atualmente em relação ao uso de enzimas isoladas, pois não necessitam de co-fatores e sua regeneração não é necessária para a manutenção de sua atividade catalítica. Destaca-se também, o fato que são de mais fácil obtenção, baixo custo e mais estáveis (KURBANOGLU et al., 2010).
Em reações químicas e bioquímicas, o uso de enzimas puras pode ser dispendioso e seu descarte após o uso é economicamente inviável. Além disso, a recuperação do meio reacional pode ser difícil (FABER, 2000).
O uso de vegetais em reações de biocatálise, mesmo com todos os avanços e investigações já realizados até o momento, ainda é um campo muito novo visto a enorme diversidade de espécies vegetais existentes e ao pequeno número de espécies investigadas. Só no Brasil, o número de espécies de plantas ultrapassa os 56.000 (cinquenta e seis mil), o que compreende quase 19% da flora mundial, sendo que o conhecimento da biodiversidade no país ainda é muito incompleto (GIULIETTI et al., 2005).
2. BIOCATÁLISE
O estudo da biocatálise consiste na utilização de enzimas para promover a catálise de reações químicas, onde esses biocatalisadores podem ser oriundos de fontes vegetais, fúngicas, microbianas, bem como de animais. O emprego dos biocatalisadores nas reações químicas pode ser feito na sua forma purificada, isolado de algum material, e na sua forma imobilizada, onde se utiliza um suporte polimérico como matriz imobilizadora das enzimas, bem como na sua forma íntegra, natural, onde são usadas as fontes enzimáticas em si, como por exemplo, vegetais e células em crescimento de microorganismos.
Segundo Faber (2004) a utilização dos materiais, fontes de enzimas, para as reações de biocatálise, ocorre da seguinte forma:
Células em crescimento: os substratos são adicionados ao meio de cultura simultaneamente à inoculação ou durante a fase de crescimento do micro-organismo;
Células em repouso: o micro-organismo é cultivado até seu crescimento ótimo, a biomassa é filtrada ou centrifugada e ressuspensa em soluções ou solventes adequados, com posterior adição de susbtratos;
Enzimas imobilizadas: as enzimas estão ligadas a suportes inertes insolúveis por meios físicos ou químicos;
Enzimas isoladas: as enzimas são adicionadas diretamente no meio reacional, dependendo da enzima há necessidade da adição de co-fator. A utilização de células vegetais na sua forma íntegra tem sido relatada na literatura com frequência. A manipulação da fonte biocatalítica neste procedimento é simples e consiste na desinfecção do material vegetal e adição deste, juntamente com o substrato, em soluções ou solventes adequados.
A utilização de enzimas na transformação de compostos orgânicos é conhecida há mais de cem anos (COSTA; AMORIM, 1999). A aplicação de biocatalisadores na indústria é objeto de muitas investigações e a importância do uso de enzimas em biocatálise tem se mostrado cada vez mais evidente por apresentar inúmeras vantagens. Dentre as vantagens do uso de biocatalisadores em reações orgânicas destacam-se:
valor considerado muito acima dos promovidos por catalisadores comuns (FERREIRA, 2002);
Não geram resíduos de alta toxicidade e são facilmente degradados pelo meio ambiente;
Atuam sob condições brandas de reação como pH e temperatura.
Catalisam uma ampla faixa de reações químicas como reduções, oxidações, glicosilações, hidroxilações, esterificações, hidrolises, entre outras.
São bastante específicos e catalisam reações com:
Quimiosseletividade: a enzima atua preferencialmente em grupos funcionais específicos, mantendo as demais funcionalidades presentes nos substratos intactas;
Regiosseletividade: a enzima atua diferenciando grupos funcionais idênticos de acordo com o ambiente químico em que se encontram nos substratos;
Estereosseletividade: a enzima é capaz de diferenciar um enantiômero do outro, produzindo com isso, compostos enantiomericamente puros, pois são considerados catalisadores quirais e reconhecem em seu sítio ativo, moléculas quirais ou pró-quirais (ARAÚJO, 2010).
A possibilidade da produção de compostos enatiomericamente puros pelas enzimas em reações químicas motivaram uma ampla busca por novas fontes biocatalíticas e a grande biodiversidade mundial, mais especificamente brasileira, tem sido fator primordial.
A exploração da biodiversidade na busca de novos catalisadores por técnicas de seleção de microrganismos, de plantas ou células animais representam os métodos tradicionais de descoberta de novas enzimas para o desenvolvimento da biocatálise em escala industrial e acadêmica (DEMIRJIAN; SHAH; MORIS-VAS, 1999).
A grande variabilidade de plantas taxionomicamente diferentes disponíveis e com fácil acesso, associado aos fatores experimentais como fácil separação do produto da mistura reacional, através de simples filtração ou centrifugação, somam pontos positivos para a crescente busca de materiais vegetais como fontes biocatalíticas, além de sua realização em meio aquoso e o restante do material descartado ser facilmente degradado pelo meio ambiente, mostrando em contrapartida uma alternativa viável em relação às reações químicas clássicas que requerem o uso de reagentes tóxicos e metais pesados, onde sua eliminação ao meio ambiente geram grandes impactos (SALVANO
Segundo Takeda et al. (2011) a utilização de materiais vegetais como fontes de enzimas são mais eficientes porque fornecem um ambiente mais favorável para a biotransformação de substratos onde destacam-se a presença de numerosas enzimas e em grande variedade e a presença de co-fatores, bem como as vias metabólicas necessárias para a regeneração dos co-fatores. Ressalta-se ainda a facilidade de obtenção desses materiais vegetais, o baixo custo apresentado e estabilidade por eles garantida (KURBANOGLU et al., 2010).
Muitas transformações de diferentes substratos, tais como hidroxilação e reações de oxidação (Gynostemma pentaphyllum), hidrólise de ésteres (Solanum tuberosum, Helianthus tuberosus), bioredução de cetonas e aldeídos (Daucus carota, Foeniculum vulgare, Cucurbita pepo, Phaseolus aureus, Cocos nucifera, Saccharum officinarum, Manihot dulcis, Manihot esculenta), lactonização (Malus sylvestris, Helianthus tuberosus) glicosilação, (Ipomoea batatas, Eucalyptus perriniana), etc, tem sido realizadas, e produziram bons resultados usando plantas e suas células em cultura. (SALVANO et al., 2011).
2.1Quiralidade e Biocatálise
Compostos opticamente ativos são intermediários úteis para a síntese de produtos farmacêuticos, agroquímicos e cristais líquidos. A necessidade de síntese estereosseletiva de compostos opticamente ativos com atividades biológicas é importante porque somente um isômero entre os muitos compostos opticamente ativos disponível tem uma atividade biológica específica (GOTOR; ALFONSA; GARCIA-URDIALES, 2008).
Tabela 1: Disposição cinética e efeitos estereosseletivos de alguns fármacos quirais
FÁRMACO QUIRAL Disposição cinética e efeito farmacológico dos enantiômeros
Morfina (analgésico) O enantiômero (-)-(R)- é o único com atividade analgésica. Propanolol (antiarrítimico) A forma enantiomérica (+)-(S)- é 100 vezes mais potente
que a (-)-(R)- e apresenta tempo de meia vida mais longo.
Ácido 1-metil-5-fenil-5-propilbarbitúrico (sedativo)
Atividades opostas no sistema nervoso central. Um enantiômero apresenta o efeito sedativo desejado (hipnótico ou narcótico dependendo da dose) e o outro é
um convulsivante. Ácido
2-bromofenoxipropiônico (agente de crescimento)
Uma ação antagonista é evidenciada pela forma (-)-(R)- enquanto o enantiômero (+)-(S)- é um estimulante de
crescimento.
Ibuprofeno (antinflamatório)
Este fármaco é administrado como racemato pois o enantiômero inativo (-)-(R)- sofre inversão quiral para o
enantiômero ativo (+)-(S)- no organismo.
A utilização de biocatalisadores para o desenvolvimento de novos fármacos e agrotóxicos é bem conhecida e, uma grande variedade de enzimas já está sendo usada
Figura 1: Estruturas da Efedrina, Ampicilina e Cefadroxil obtidas por
biotransformações.
NHCH3 OH
CH3
NH2
O HO
N
O
S
COOH H
NH2
O N
O
H
S
COOH
Ampicilina
Cefadroxil Efedrina
Além de atuarem na preparação de fármacos como precursores, compostos opticamente ativos são importantes na síntese de feromônios, aromas, fragrâncias, cosméticos e pesticidas (UTSUKIHARA et al., 2007).
2.2 Álcoois Quirais
A produção de álcoois quirais enantiomericamente puros é relevante na química orgânica, pois eles são importantes intermediários para a síntese de produtos químicos, mais precisamente de fármacos, e também podem ser utilizados como blocos de
construção quiral (“chiral building blocks”) na produção de diversos compostos quirais
Figura 2: Álcoois quirais e produtos obtidos a partir de álcoois quirais. OH O O OH OH O CH3 O
(S)-(-)-3-hidróxi-butanoato de etila
(S)-(+)-sulcatol
(R)-lavandulol
(R)-(+)-recifeiolídeo
O O
O
O O
O H3C
H3C
(R,R)-(-)-grahamimicina O O O O O O H3C
CH3
(R,R)-pirenoforina
carbomicina B
O H3C
H3CO
OCOCH3 OR' CH3 CHO O O
R' = desoxiaçúcar
Figura 3: Estruturas de terpenos quirais e produtos obtidos a partir deles.
O O
O
O
H3C CH3
OH CH3
CH3 H3C
Milbemicina b3
CH3
O HN
Bn
O H3C
H3C
Proxifomina
HO
CH3
HO
CH3
(S)-(-)-citronelol
(R)-(+)-citronelol
sintetizados por vários métodos clássicos, de complexidade variável, envolvendo a-aminoácidos, carboidratos e terpenos como material de partida. Um exemplo de álcool quiral ainda mais notável é o 1-octen-3-ol (g) que é feromônio importante na atração de mosquitos, tendo chamado muito a atenção de pesquisadores em todo o mundo e no Brasil (TEMBA; OLIVEIRA; DONNICI, 2003).
Figura 4: Álcoois quirais de interesse industrial.
OH
OH
OH OH
OH OH
OH
(a) (b) (c) (d)
(e)
(f)
(g)
Nessa perspectiva a produção de álcoois quirais se torna um campo promissor de estudo para vários setores estratégicos, como nas indústrias de medicamentos, cosméticos, agrotóxicos, alimentícias, biotecnologias, entre outras, que buscam acima de tudo metodologias capazes para sua obtenção de forma eficiente, através de rotas alternativas, ambientamente favoráveis e economicamente mais atraentes.
2.2.1 Obtenção de álcoois a partir de cetonas via enzimática
A redução enzimática de grupos carbonila representa uma das reações importantes mais empregadas na síntese de álcoois quirais. As enzimas responsáveis por essa transformação são as oxidorredutases, mais precisamente as álcool desidrogenases (ADH), que necessitam da presença de um co-fator (coenzima), como NADH ou NADPH, que transfere o hidreto para o ânion do composto carbonílico, sendo formado NAD+ ou NADP+. O papel da álcool desidrogenase é proporcionar uma interação do substrato com o co-fator de forma termodinamicamente favorável para que a reação ocorra (Figura 5) (ARAÚJO et al., 2010).
Figura 5: Redução assimétrica biocatálitica de compostos carbonílicos com NADPH na
presença de ADH.
R O
+ NADPH
ADH
R OH
H
*
+ NADP+
Nos últimos anos, as culturas de células vegetais na sua forma íntegra, têm sido investigados como potenciais agentes para reações de biotransformação.
Um dos primeiros trabalhos utilizando vegetais na forma de células íntegras foi com as raízes de Daucus carota (cenoura). Este estudo alertou investigações no uso de planta fresca, intacta como um reagente ao invés do uso de sistemas de células, suspendida ou imobilizada, ou algumas enzimas derivadas. Estes investigadores descreveram aspectos dos seus estudos em uma patente italiana (CORDELL et al., 2007).
Yadav et al. (2002), utilizando como fonte de biocatalisador as raízes de Daucus carota obteve álcoois secundários opticamente ativos através da redução de várias
cetonas proquirais tais como acetofenonas, cetonas α-azido aril, -ceto-ésteres, cetonas alifáticas cíclicas e acíclicas com rendimentos químicos de moderados a excelentes sob condições extremamente suaves e aceitas ambientalmente em meio aquoso.
correspondentes álcoois quirais foram preparados conseguindo 99% de excesso enantiomérico. Andrade et al. (2004), relatou as mesmas biorreduções utilizando células íntegras de fungos. Andrade et al. (2006), realizou um estudo com acetofenona (Figura 6) utilizando espécies de plantas como biocatalisadores.
Figura 6: Biorredução da acetofenona utilizando várias espécies de plantas.
Machado et al. (2006) utilizando espécies de Manihot esculenta e Manihot dulcis na redução de cetonas (alifáticas, cíclicas e α, -insaturadas) obteve entre baixos (12,5-14,9%) e altos (91,7-97,8%) de valores de conversão para o respectivo álcool, apresentando também ótimos valores de excesso enantiómero 93-98%. Entretanto, cetonas esteroidais não foram reduzidas.
Fonseca et al. (2008) avaliaram o potencial biocatalítico da água de côco do Ceará (Cocos nucifera) na redução de cetonas alifáticas, cíclicas e aromáticas obtendo ótimos valores de excesso enantiomérico (56-99%) dos álcoois correspondentes. Destaca-se a redução da acetofenona e da 3-metóxi-acetofenona com valores de excesso enantiomérico de 95% e 99%, respectivamente.
Assunção et al. (2008) investigaram o potencial do caldo de cana obtido da moagem da cana-de-açúcar, Saccharum officinarum, como fonte enzimática para a redução de uma série de cetonas com excelentes rendimentos e moderada enantiosseletividade.
Bizerra et al. (2010) realizou o estudo de biorredução de cetonas aromáticas e alifáticas utilizando feijão (Vigna unguiculata) onde obteve excelentes valores de excessos enantioméricos dos produtos formados, variando entre 87% e acima de 99%, entretanto os valores de conversão apresentaram-se entre baixos (5%) para os substratos (2-metóxi-acetofenona e 4-metóxi-acetofenona) e ótimos (86%) para a 3-metóxi-acetofenona.
Mais recentemente, Takeda et al. (2011) utilizando a espécie Arabidopsis thaliana promoveu a biorredução de cetonas assimétricas (aromáticas e alifáticas) obtendo valores moderados de conversão e excelentes excessos enantioméricos (Figura 7).
Figura 7: Cetonas utilizadas na biorredução com Arabidopsis thaliana.
O R1 R2
Arabidopsis thaliana
OH R1 R2
OH R1 R2 +
1a-d
(1a) R1=CF3; R2=C6H5 (1b) R1=CH3; R2=CH2CO2Bu
(1c) R1=CO2CH3; R2=C6H5
(1d) R1= 2-tienil; R2= CF3
(2a);(2c);(2d) 2b
CONSIDERAÇÕES
3. CONSIDERAÇÕES SOBRE Helianthus annuus L.
Helianthus annuus L., conhecido popularmente por girassol, é uma dicotiledônia anual caracterizada por apresentar sistema radicular com raiz principal pivotante e inflorescência conhecida como capítulo (Figura 8) (GONÇALVES; TOMICH, 1999), pertencente à família Asteraceae (ROSSI, 1991). A própria planta do girassol, bem como os grãos, os restos da cultura e os subprodutos gerados na extração do óleo podem ser usados na alimentação animal. Na dieta de ruminantes o girassol pode ser utilizado como alimento volumoso. Tem sua origem conhecida nas planícies da Mesoamérica desde o século 26 a.C (POPE et al., 2001).
Figura 8: Fotografia da flor de Helianthus annuus L. tendo como detalhe as sementes utilizadas nas biotransformações.
O cultivo de Helianthus annuus L. é promissor em todo mundo, por se tratar de uma oleoginosa (PUTT, 1978; JONIC et al., 2000). O óleo de Helianthus annuus L.
Nos últimos anos a produção mundial de sementes de girassol (Heliantus annuus
L.) tem aumentado significativamente em comparação com outras culturas de produtoras de óleo(NIMET et al., 2011). Dentre as mais importantes culturas o girassol encontrou-se em 6º lugar no ranking mundial das fontes de oleoginosas com a produção de 30,4 milhões de toneladas em 2010, segundo dados da organização das nações unidas para a alimentação em cultura (FAOSTAT, 2011). Devido à sua composição química e valor nutritivo, as sementes de girassol são consideradas como grande fonte de lipídios e proteínas e além de ser utilizada na produção de óleos comestíveis, também vem sendo comercializada para alimentação animal (BRATFALEAN et al., 2008). O teor de proteínas das sementes é de aproximadamente 50-60%. Além disso, o óleo de girassol tem uma elevada quantidade de vitamina E natural oxidante em comparação com outros óleos comestíveis (NIMET et al., 2011).
O girassol apresenta características agronômicas importantes, como maior resistência à seca, ao frio e ao calor, que a maioria das espécies normalmente cultivadas no Brasil. Apresenta ampla adaptabilidade a diferentes condições edafoclimáticas e seu rendimento é pouco influenciado pela latitude, pela altitude e pelo fotoperíodo (GOMES et al., 2006).
Figura 9: Estruturas dos ácidos fenólicos presentes nas sementes de Helianthus annuus L. OH O HO HO Ácido protocatequínico OH O HO H3CO
Ácido siríngico OCH3 O OH O HO OH OH O OH OH Ácido clorogênico HO OH O Ácido ferúlico HO OH O HO Ácido caféico
Hartwell (1982) relata o uso das sementes de Helianthus annuus L. na medicina popular onde são utilizadas no tratamento de doenças pulmonares, tosse, garganta, constipações e expectorantes, bem como afirma o uso associado com as flores em remédios populares na Venezuela para o tratamento de câncer.
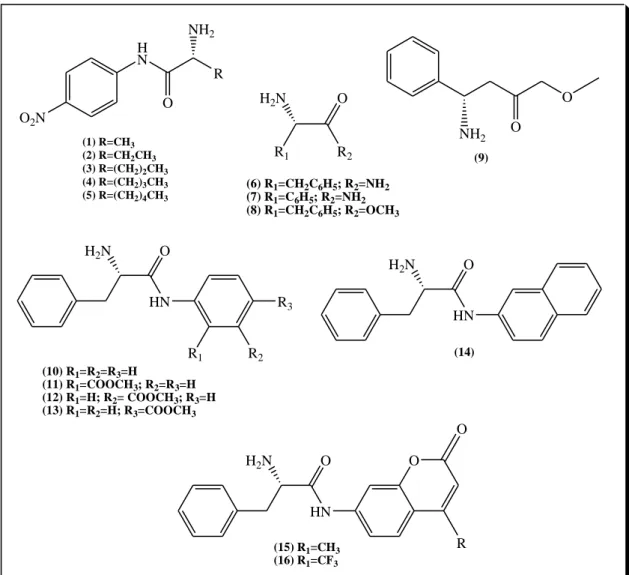
Figura 10: Aminoácidos utilizados para biotransformação por Helianthus annuus L.
O2N
H N
O
R NH2
(1) R=CH3
(2) R=CH2CH3
(3) R=(CH2)2CH3
(4) R=(CH2)3CH3
(5) R=(CH2)4CH3
O
R2 R1
H2N
(6) R1=CH2C6H5; R2=NH2 (7) R1=C6H5; R2=NH2 (8) R1=CH2C6H5; R2=OCH3
O O NH2 (9) O HN
R1 R2 R3 H2N
(10) R1=R2=R3=H
(11) R1=COOCH3; R2=R3=H (12) R1=H; R2= COOCH3; R3=H (13) R1=R2=H; R3=COOCH3
O
HN H2N
(14)
O
HN
H2N O
(15) R1=CH3 (16) R1=CF3
O
R
Aminopeptidades das sementes de girassol foram empregadas com sucesso na resolução de misturas racêmicas de amidas e aminoácidos, mostrando-se eficiência catalítica e alta enantiosseletividade para o isômero S (TISHINOV et al., 2009).
RESULTADOS E
4. RESULTADOS E DISCUSSÕES
4.1 Obtenção dos alcoóis padrões por via química
Os alcoóis padrões das respectivas cetonas pró-quirais utilizadas nos processo de biorredução, foram obtidos por via química utilizando NaBH4/MeOH conforme Figura 11 e metodologia descrita no item 5.4.2 (p. 109). Os alcoóis 1a-15a (Tabela 2) foram obtidos em bons rendimentos após purificação por cromatografia em coluna, sendo em seguida analisados por RMN ¹H para a confirmação de suas estruturas (anexo). A finalidade desta etapa foi a obtenção de padrões para a construção de curvas de calibração e comparação com os produtos das biorreduções.
Figura 11: Esquema da reação de redução das cetonas pró-quirais por via química.
Tabela 2:Rendimentos da obtenção dos alcoóis padrões 1a-15a Álcool padrão Rendimento (%)
(±)-1-feniletanol (1a) 89,8
(±) 1-(4-bromofenil)-etanol (2a) 89,7 (±) 1-(4-fluorfenil)-etanol (3a) 86,0 (±) 1-(4-clorofenil)-etanol (4a) 88,5 (±) 1-(4-metóxifenil)-etanol (5a) 79,9 (±) 1-(4-metilfenil)-etanol (6a) 81,4 (±) 1-(3-bromofenil)-etanol (7a) 85,0 (±) 1-(3-metóxifenil)-etanol (8a) 84,1 (±) 1-(2-bromofenil)-etanol (9a) 80,9 (±) 1-(2-clorofenil)-etanol (10a) 83,4 (±) 1-(2-metóxifenil)-etanol (11a) 86,2 (±) 1-(2-hidróxifenil)-etanol (12a) 72,5 (±)-2,2,2-trifluor-feniletanol (13a) 92,0
(±)-α-tetralol (14a) 61,3
(±)-α-indanol (15a) 70,0
R O
R'
NaBH4
R
OH
4.2 Curvas de calibração dos substratos
As análises do teor de conversão dos substratos 1-15 (cetonas) utilizados nas reações de biorredução foram realizadas por intermédio de curvas de calibração. Os respectivos padrões foram injetados em equipamento de Cromatografia Líquida de Alta Eficiência (CLAE) e as curvas elaboradas em programa Origin 7.0. A obtenção das curvas tanto do substrato, cetona, quanto do produto, álcool, fez-se necessária para minimizar os erros de quantificação da conversão. As estruturas dos substratos utilizados estão listadas na Tabela 3, bem como dos respectivos produtos.
Tabela 3: Substratos e produtos utilizados na obtenção das curvas de calibração para
análise do teor de conversão nas reações de biorredução.
SUBSTRATO PRODUTO
acetofenona (1) (±)-1-feniletanol (1a)
4-bromo-acetofenona (2) (±) 1-(4-bromofenil)-etanol (2a)
4-fluoro-acetofenona (3) (±) 1-(4-fluorofenil)-etanol (3a)
4-cloro-acetofenona (4) (±) 1-(4-clorofenil)-etanol (4a)
4-metóxi-acetofenona (5) (±) 1-(4-metóxifenil)-etanol (5a)
OH O
O
Br
OH
Br
O
F
OH
F
O
Cl
OH
Cl
OH
H3CO
O
4-metil-acetofenona (6) (±) 1-(4-metilfenil)-etanol (6a)
3-bromo-acetofenona (7) (±) 1-(3-bromofenil)-etanol (7a)
3-metóxi-acetofenona (8) (±) 1-(3-metóxifenil)-etanol (8a)
2-bromo-acetofenona (9) (±) 1-(2-bromofenil)-etanol (9a)
2-cloro-acetofenona (10) (±) 1-(2-clorofenil)-etanol (10a)
2-metóxi-acetofenona (11) (±) 1-(2-metóxifenil)-etanol (11a)
2-hidróxi-acetofenona (12) (±) 1-(2-hidróxifenil)-etanol (12a)
O
H3C
OH
H3C
O
Br
OH
Br
O
OCH3
OH
OCH3
OH
Br O
Br
O
Cl
OH
Cl
OH
OCH3 O
OCH3
O
OH
OH
2,2,2-trifluor-acetofenona (13) (±)-2,2,2-trifluor-feniletanol (13a)
α-tetralona (14) (±)-α-tetralol (14a)
α-indanona (15) (±)-α-indanol (15a)
A seguir são apresentadas as respectivas curvas de calibração para as cetonas utilizadas no procedimento experimental e para os alcoóis obtidos (Gráficos 1-28, p. 49-54). Os gráficos foram plotados em função das concentrações versus área, obtendo-se os
respectivos valores de “R” e equação da reta para cada composto.
4.2.1 Acetofenona e (±)-1-feniletanol
20 40 60 80 100
2000000 4000000 6000000 8000000 10000000 Ab so rb â n ci a
Concentraçمo em ppm
0 10 20 30 40 50
0 1000000 2000000 3000000 4000000 5000000 6000000 7000000 Ab so rb â n ci a
Concentraçمo em ppm
R = 0,99949
OH CF3 OH CF3 O O OH O OH
R = 0,99826
O
Á
re
a Áre
a
Gráfico 2: Curva de calibração do (±) 1-feniletanol.
4.2.2 4-bromo-acetofenona e (±) 1-(4-bromofenil)-etanol
0 10 20 30 40 50 60 70 80 90
0 2000000 4000000 6000000 8000000 10000000 12000000 14000000 Ab so rb â n ci a
Concentraçمo em ppm
0 20 40 60 80 100
0 5000000 10000000 15000000 20000000 25000000 Ab so rb â n ci a
Concentraçمo em ppm
4.2.3 4-fluoro-acetofenona e (±) 1-(4-fluorofenil)-etanol
0 10 20 30 40 50 60 70 80 90
0 2000000 4000000 6000000 8000000 10000000 12000000 Ab so rb â n ci a
Concentraçمo em ppm
20 40 60 80 100
2000000 4000000 6000000 8000000 10000000 12000000 14000000 16000000 Ab so rb â n ci a
Concentraçمo em ppm
4.2.4 4-cloro-acetofenona e (±) 1-(4-clorofenil)-etanol
0 20 40 60 80 100
0 2000000 4000000 6000000 8000000 10000000 12000000 Ab so rb â n ci a
Concentraçمo em ppm
0 20 40 60 80 100
0 1000000 2000000 3000000 4000000 5000000 6000000 7000000 8000000 Ab so rb â n ci a
Concentraçمo em ppm
R = 0,99962 O
Br
R = 0,99987 OH
Br
F
O
R = 0,99915
OH
F
R = 0,99947
O
Cl
OH
Cl
R = 0,99997 R = 0,99993
Á re a Á re a Á re a Á re a Á re a Á re a
Gráfico 3: Curva de calibração da 4-bromo-acetofenona.
Gráfico 4: Curva de calibração do (±) 1-(4-bromofenil)-etanol.
Gráfico 5: Curva de calibração da 4-fluoro-acetofenona.
Gráfico 6: Curva de calibração do (±) 1-(4-fluorofenil)-etanol.
Gráfico 7: Curva de calibração da 4-cloro-acetofenona.
4.2.5 4-metóxi-acetofenona e (±) 1-(4-metóxifenil)-etanol
0 20 40 60 80 100
0 2000000 4000000 6000000 8000000 10000000 Ab so rb â n ci a
Concentraçمo em ppm
0 20 40 60 80 100
0 1000000 2000000 3000000 4000000 5000000 6000000 7000000 Ab so rb â n ci a
Concentraçمo em ppm
4.2.6 4-metil-acetofenona e (±) 1-(4-metilfenil)-etanol
0 20 40 60 80 100
0 2000000 4000000 6000000 8000000 10000000 12000000 14000000 Ab so rb â n ci a
Concentraçمo em ppm
0 20 40 60 80 100
0 1000000 2000000 3000000 4000000 5000000 6000000 7000000 8000000 Ab so rb â n ci a
Concentraçمo em ppm
4.2.7 3-bromo-acetofenona e (±) 1-(3-bromofenil)-etanol
0 20 40 60 80 100
0 5000000 10000000 15000000 20000000 25000000 30000000 35000000 Ab so rb â n ci a
Concentraçمo em ppm
0 20 40 60 80 100
0 2000000 4000000 6000000 8000000 10000000 12000000 14000000 Ab so rb â n ci a
Concentraçمo em ppm
O
H3CO
OH
H3CO
R = 0,99983 R = 0,99984
O
Br
R = 0,99954 R = 0,99975
OH
Br O
H3C
OH
H3C
R = 0,99982 R = 0,99977
Á re a Á re a Á re a Á re a Á re a Á re a
Gráfico 9: Curva de calibração da 4-metóxi-acetofenona.
Gráfico 10: Curva de calibração do (±) 1-(4-metóxifenil)-etanol.
Gráfico 11: Curva de calibração da 4-metil-acetofenona.
Gráfico 12: Curva de calibração do (±) 1-(4-metilfenil)-etanol.
Gráfico 13: Curva de calibração da 3-bromo-acetofenona.
4.2.8 3-metóxi-acetofena e (±) 1-(3-metóxifenil)-etanol
0 20 40 60 80 100
0 5000000 10000000 15000000 20000000 25000000 Ab so rb â n ci a
Concentraçمo em ppm
0 20 40 60 80 100
0 1000000 2000000 3000000 4000000 5000000 6000000 7000000 Ab so rb â n ci a
Concentraçمo em ppm
4.2.9 2-bromo-acetofenona e (±) 1-(2-bromofenil)-etanol
0 10 20 30 40 50 60 70 80 90
0 10000000 20000000 30000000 40000000 50000000 A b so rb â n c ia
Concentração em ppm
0 20 40 60 80 100
0 2000000 4000000 6000000 8000000 10000000 12000000 A b so rb â n c ia
Concentração em ppm
4.2.10 2-cloro-acetofenona e (±) 1-(2-clorofenil)-etanol
0 20 40 60 80 100
0 1000000 2000000 3000000 4000000 5000000 6000000 7000000 8000000 A b so rb â n ci a
Concentração em ppm
0 20 40 60 80 100
0 1000000 2000000 3000000 4000000 5000000 6000000 A b so rb â n ci a
Concentração em ppm O
Br
OH
Br
R = 0,9985 R = 0,99985
O
Cl
OH
Cl
R = 0,99966 R = 0,99916
O
OCH3
OH
OCH3
R = 0,99982 R = 0,99996
Á re a Á re a Á re a Á re a Á re a Á re a
Gráfico 15: Curva de calibração da 3-metóxi-acetofenona.
Gráfico 16: Curva de calibração do (±) 1-(3-metóxifenil)-etanol.
Gráfico 17: Curva de calibração da 2-bromo-acetofenona.
Gráfico 18: Curva de calibração do (±) 1-(2-bromofenil)-etanol.
Gráfico 20: Curva de calibração do (±) 1-(2-clorofenil)-etanol.
4.2.11 2-metóxi-acetofenona e (±) 1-(2-metóxifenil)-etanol
0 20 40 60 80 100
0 5000000 10000000 15000000 20000000 25000000 Ab so rb â n ci a
Concentraçمo em ppm
0 10 20 30 40 50 60 70 80 90
0 1000000 2000000 3000000 4000000 5000000 6000000 7000000 Ab so rb â n ci a
Concentraçمo em ppm
4.2.12 2,2,2-trifluoro-acetofenona e (±)-2,2,2-trifluoro-feniletanol
20ppm 40ppm 60ppm 80ppm 100ppm 2000000 4000000 6000000 8000000 10000000 12000000 Ab so rb â n ci a
Concentraçمo em ppm
0 20 40 60 80 100
0 1000000 2000000 3000000 4000000 5000000 6000000 7000000 8000000 Ab so rb â n ci a
Concentraçمo em ppm
4.2.13 α-tetralona e (±)-α-tetralol
0 20 40 60 80 100
0 5000000 10000000 15000000 20000000 25000000 30000000 35000000 Ab so rb â n ci a
Concentraçمo em ppm
0 10 20 30 40 50 60 70 80 90
0 2000000 4000000 6000000 8000000 10000000 12000000 14000000 16000000 18000000 Ab so rb â n ci a
Concentraçمo em ppm
R = 0,99953
O
R = 0,99978
OH
CF3
O
CF3
OH
R = 0,99993 R = 0,9968
O
OCH3
OH
OCH3
R = 0,99946 R = 0,99858
Á re a Á re a Á re
a Áre
a Á re a Á re a
Gráfico 21: Curva de calibração da 2-metóxi-acetofenona.
Gráfico 22: Curva de calibração do (±) 1-(2-metóxifenil)-etanol.
Gráfico 23: Curva de calibração da 2,2,2-trifluoro-acetofenona.
Gráfico 24: Curva de calibração do 2,2,2-trifluoro-feniletanol.
Gráfico 25: Curva de calibração da α -tetralona.
4.2.14 α-indanona e (±)-α-indanol
0 20 40 60 80 100
0 2000000 4000000 6000000 8000000 10000000 12000000 14000000 16000000 A b so rb â n c ia
Concentração em ppm
0 20 40 60 80 100
0 2000000 4000000 6000000 8000000 10000000 12000000 14000000 16000000 18000000 A b so rb â n c ia
Concentração em ppm
4.3 Determinação do teor de proteínas das sementes de Helianthus annuus L.
A determinação do teor de proteínas das sementes de Helianthus annuus L. foi realizada como estudo inicial para avaliar o seu possível potencial como fonte biocatalítica em reações de biorredução. A medida do teor de proteínas serve de estimativa da concentração de enzimas do material vegetal.
Vários métodos são encontrados na literatura relacionados com determinação da concentração de proteínas, tais como: métodos do Biureto, de Lowry, de Bradford, entre outros. Todos esses métodos baseiam-se na obtenção de compostos coloridos através da reação de grupos presentes na molécula da proteína e substâncias específicas (MIWA, 2003).
No presente trabalho foram utilizados os métodos de determinação de proteínas proposto por Lowry (modificado por Hartree, 1972), que determina a concentração de proteínas solúveis e o proposto por Bradford. Estes métodos apresentam como principal vantagem a alta sensibilidade (LUCARINI; KILIKIAN, 1999).
4.3.1 Método de Lowry (modificado por Hartree)
A determinação de proteínas proposta por Lowry (modificada por Hartree, 1972) foi realizada no extrato aquoso da semente de Helianthus annuus L. O método consiste na reação da proteína com íon cobre (II) em solução alcalina (reação do biureto) o que resulta em uma coloração azul (Figura 12, p. 55).
O OH
R = 0,99975 R = 0,99972
Á re a Á re a
Gráfico 27: Curva de calibração da α -indanona.
Figura 12: Detalhe da reação do extrato enzimático das sementes de Helianthus annuus
L. com o íon cobre (II).
A utilização de reagente Folin-Ciocalteau, constituído de uma mistura de ácidos fosfomolibdato-fosfotungstico (3H2O.P2O5.13WO3.5MoO3.10H2O e 3H2O.P2O5.14WO3.4MoO3.10H2O) é necessária para ampliar o sinal do Biureto, onde a redução do reagente em questão com proteínas na presença de cobre em solução alcalina, produz um complexo de coloração azul, como mostrado na Figura 13 (MIWA, 2003;OKUTUCU et al., 2007).
Figura 13: Detalhe da reação do extrato enzimático das sementes de Helianthus annuus
L. com o reagente de Folin-Ciocalteau.
4.3.2 Método de Bradford
O método para determinação de proteínas totais de Bradford (1976) em comparação com Lowry (modificada por Hartree, 1972) é mais sensível, mais rápido e está sujeito a um número menor de interferentes, destaca Zaia et al. (1998).
O processo consiste na interação entre o corante BG-250 e macromoléculas de proteínas que contém aminoácidos de cadeias laterais básicas ou aromáticas, como por exemplo, arginina e histidina (Figura 14). No pH de reação, a interação entre a proteína de alto peso molecular e o corante BG-250 provoca o deslocamento do equilíbrio do corante para a forma aniônica, que absorve fortemente em 595 nm (LUCARINI; KILIKIAN, 1999; ZAIA et al., 1998).
A utilização do reagente de Bradford contendo o corante BG-250 modifica instantaneamente o extrato enzimático a ser analisado, no caso o extrato aquoso das sementes de Helianthus annuus L. como detalhado na Figura 14 .
Figura 14: Detalhe do método de Bradford para determinação de proteínas após a
adição do reagente Coomassie Brilliant Blue G-250.