i
UNIVERSIDADE FEDERAL DO CEARÁ
CENTRO DE CIÊNCIAS
DEPARTAMENTO DE QUÍMICA ORGÂNICA E INORGÂNICA
Prospecção química de
Acnistus arborescens
(L.)
Schltdl visando a caracterização de vitaesteróides
através de Cromatografia Líquida acoplada à
Espectrometria de Massas
Ana Isabel Vitorino Maia
iv
DEDICATÓRIAS
A Deus, pela oportunidade de viver.
A minha mãe, Herbene Vitorino que me incentivou e apoiou incansavelmente durante todos esses anos de estudos. Ela sempre foi meu maior exemplo de vida, humildade e humanidade que me servirá como base para toda a vida;
Ao meu pai, Alexandre Maia que sempre me incentivou com amor;
Ao meu irmão, Alexander Vitorino que sempre foi um amigo leal;
Ao meu marido, Mauro Neto pela paciência, compreensão, pelo apoio e companheirismo em todos os momentos;
Aos meus avós, Manoel e Anita Vitorino, Izete e Valdemar Maia (in memorian) pelo
carinho, apoio, incentivo e amor que sempre me dedicaram;
Aos meus tios Felipe, Márcia, Cláudio, Ana, Silvana, Nícia, Lúcia, Cláudia, Gracinha e Nazaré, que muitas vezes agiram como meus pais. Em especial ao meu tio Cláudio que sempre me apoiou financeiramente e me presenteou com o meu primeiro Jaleco e a minha tia Lúcia com o meu primeiro computador.
A todos os meus primos, em especial ao meu primo Cláudio Tadeu Vitorino Lira (in memorian)
v
AGRADECIMENTOS
À minha orientadora, Profa. Dra. Otília Deusdênia Loiola Pessoa pela dedicação e empenho na orientação da elaboração desta tese e pela confiança dedicada a mim; Ao Prof. Dr. Edilberto Rocha Silveira pela parceria e pelos ensinamentos, sempre contribuindo no enriquecimento do meu trabalho;
À Profa. Dra. Simone da Silveira Sá Borges pelos ensinamentos, não apenas científicos, mas como ser humano;
Ao Prof. Dr. Carlos Alberto de Simone pela obtenção da cristalografia de Raio-X; A todos os professores do curso de Pós-Graduação em Química pela cooperação e contribuição teórica essencial para minha formação;
Aos operadores do CENAUREMN e EM pela obtenção dos espectros;
A minha amiga-irmã Ceiça Menezes pelo companheirismo, pela amizade, confiança e força em todos os momentos;
Ao meu amigo inseparável, Leonardo Carvalho, apenas por ele existir;
Aos meus amigos Anastácio Martins, Aurélio Aquino e Glauber Bezerra pela amizade sincera e pelos momentos de descontração;
As minhas amigas Patrícia Freitas, Natália Nogueira, Andreza Pires, Thiciana Silva, Milena Barreto e Julieta Rangel pela amizade;
Aos meus amigos do LAFIPLAM Cléia, Dany, Robério, Aurélio, Roberto, Chaguinha, Guga, Max, Luiz Cláudio, que me auxiliaram no desenvolvimento deste trabalho e tornaram o laboratório um local bastante agradável.
Às funcionárias Mundinha e Lana pela amizade, carinho e colaboração e ao Sr. Paulo pelo auxílio na obtenção do material de estudo;
Aos terceirizados Sr. Raimundo, Paulinha, Cátia, Larry e Cícero, pelo carinho e amizade;
A toda minha família, porque sem a estrutura familiar não teria sido possível realizar esse trabalho;
Aos órgãos CNPq, CAPES e FUNCAP pelo apoio financeiro;
vii
SUMÁRIO
LISTA DE FIGURAS ... x
LISTA DE TABELAS ... xv
LISTA DE FLUXOGRAMAS... xix
LISTA DE ESQUEMAS... xx
LISTA DE ABREVIATURAS E SÍMBOLOS... xxii
RESUMO... xxiv
ABSTRACT... xxv
INTRODUÇÃO ... 1
CAPÍTULO 1 - CONSIDERAÇÕES BOTÂNICAS ... 12
1.1 Considerações sobre a família Solanaceae... 12
1.2. Considerações sobre o gênero Acnistus... 13
1.3. Considerações sobre o Acnistus Arborescens... 13
CAPÍTULO 2– REVISÃO BIBLIOGRÁFICA ... 15
CAPÍTULO 3- DETERMINAÇÃO ESTRUTURAL ... 46
3.1. Determinação estrutural de AA-1 ... 46
3.2. Determinação estrutural de AA-2 ... 58
3.3. Determinação estrutural de AA-3 ... 64
3.4. Determinação estrutural de AA-4 ... 76
3.5. Determinação estrutural de AA-5 ... 83
3.6. Determinação estrutural de AA-6 ... 92
3.7. Determinação estrutural de AA-7 ... 102
3.8. Determinação estrutural de AA-8 ... 110
3.9. Determinação estrutural de AA-9 ... 118
3.10. Determinação estrutural de AA-10 ... 125
3.11. Determinação estrutural de AA-11... 131
viii
CAPÍTULO 4 –PROCEDIMENTO EXPERIMENTAL... 147
4.1. Material Vegetal ... 147
4.2. Métodos Cromatográficos ... 147
4.2.1. Cromatografia em Coluna... 147
4.2.2. Cromatografia Líquida de Alta Eficiência (CLAE)... 148
4.3. Métodos Físicos ... 148
4.3.1. Espectroscopia na região de absorção do Infravermelho (IV)... 148
4.3.2. Espectrometria de Massas (EM)... 149
4.3.3. Ponto de Fusão ... 149
4.3.4. Espectroscopia de Ressonância Magnética Nuclear (RMN) ... 149
4.4. Estudo dos constituintes fixos de Acnistus arborescens (L.)... 150
4.4.1.Preparação dos extratos de A. arborescens... 150
4.4.2. Fracionamento cromatográfico líquido-líquido de EEFAA... 151
4.4.2.1. Fracionamento cromatográfico de EEFAA-DM... 151
4.4.2.2. Fracionamento cromatográfico de EEFAA-DM-1 e isolamento de AA-1, AA-2, AA-3, AA-4, AA-5, AA-6 e AA-7... 152
4.4.2.2.1. Fracionamento cromatográfico de F-1... 153
4.4.2.3. Fracionamento cromatográfico de EEFAA-DM-2 e isolamento de AA-10, AA-11 e AA-12... 166
4.4.2.3.1. Fracionamento cromatográfico da fração F-B... 166
4.4.2.3.2. Fracionamento cromatográfico da fração F-C... 167
4.4.3. Preparação dos extratos de A. arborescens utilizando nova metodologia... 173
4.4.3.1. Fracionamento cromatográfico de EHAFAA e isolamento de AA-8 e AA-9... 173 CAPÍTULO 5 - Cromatografia Líquida e Espectrometria de Massas (CLAE-EM)... 178
5.1. Estudo de fragmentação de massa das vitafisalinas isoladas de A. arborescens... 197
5.2. Análise por CLAE-EM da fração PPTC38... 207
ix CONCLUSÃO... 210
x
LISTA DE FIGURAS
Figura 1 – Alguns fármacos derivados de plantas medicinais... 2
Figura 2 –Espectrômetro de massas (visão geral)....... 4
Figura 3– Esquema de formação do electrospray no modo positivo... 6
Figura 4– Mecanismos de formação de íons em ESI... 7
Figura 5– Representação esquemática do analisador IT... 8
Figura 6– Representação esquemática do analisador ToF... 9
Figura 7– Representação esquemática de dois analisadores em tandem..... 10
Figura 8 –Fotografia de A. arborescens em seu habitat natural... 14
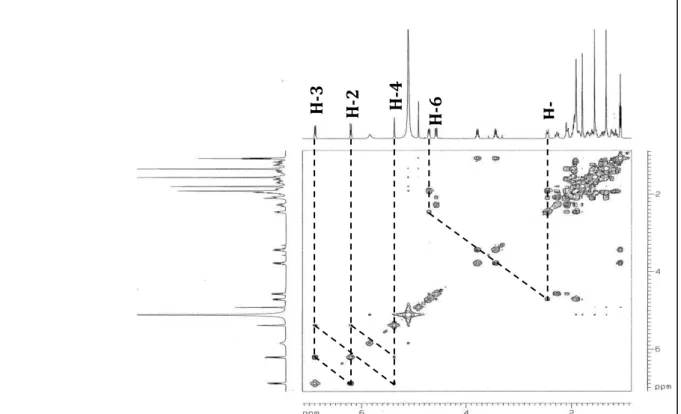
Figura 9– Principais correlações a longa distância (1H, 13C –HMBC) de AA-1... 48
Figura 10– Principais correlações a longa distância 1H,1H – NOESY de AA-1... 49
Figura 11– Projeção Ortep de AA-1....... 49
Figura 12– Espectro de absorção na região do infravermelho de AA-1 (KBr)... 52
Figura 13– Espectro de RM'N 1H (500 MHz, C5D5N) de AA-1... 52
Figura 14– Espectro de RMN 13C' (125 MHz, C5D5N) de AA-1... 53
Figura 15– Espectro de RMN 13C – DEPT 135º (125 MHz, C5D5N) de AA-1... 53
Figura 16 –Espectro de RMN HSQC – Expansão (500 e 125 MHz, C5D5N) de AA-1... 54
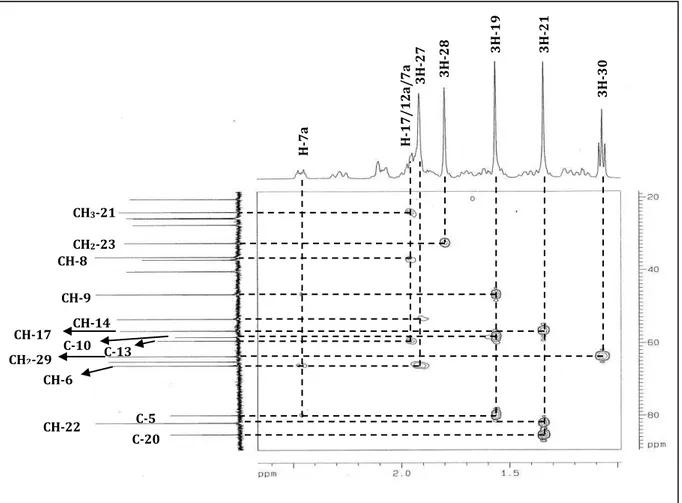
Figura 17– Espectro de RMN HMBC - Expansão (500 e 125 MHz, C5D5N) de AA-1... 55
Figura 18 – Espectro RMN 1H,1H - COSY (500 MHz, C5D5N) de AA-1... 55
Figura 19– Espectro de RMN 1H,1H - NOESY – Expansão (500, C5D5N) de AA-1... 56
Figura 20– Espectro de massas por ionização eletrônica de AA-1... 56
Figura 21– Espectro de massas com ionização por ESI (modo positivo) de AA-1... 57
Figura 22– Espectro de absorção na região do infravermelho de AA-2... 61
Figura 23 – Espectro de RMN 1H (500 MHz, C5D5N) de AA-2... 61
Figura 24– Espectro de RMN 13C (125 MHz, C5D5N) de AA-2... 62
Figura 25– Espectro de RMN 13C – DEPT 135º (125 MHz, C5D5N) de AA-2... 62
Figura 26– Espectro de massas com ionização por ESI (modo positivo) de AA-2... 63
Figura 27– Espectro de absorção na região do infravermelho de AA-3... 69
Figura 28 – Espectro de RMN 1H (500 MHz, C5D5N) de AA-3... 69
Figura 29– Espectro de RMN 13C (125 MHz, C5D5N) de AA-3... 70
Figura 30– Espectro de RMN 13C – DEPT 135º (125 MHz, C5D5N) de AA-3... 70
xi
Figura 32– Espectro de RMN HSQC (500 e 125 MHz, C5D5N) de AA-3... 71
Figura 33– Espectro de RMN HMBC – Expansão (500 e 125 MHz, C5D5N) de AA-3... 72
Figura 34– Espectro de RMN HMBC – Expansão (500 e 125 MHz, C5D5N) de AA-3... 72
Figura 35– Espectro de RMN HMBC – Expansão (500 e 125 MHz, C5D5N) de AA-3... 73
Figura 36– Espectro de RMN NOESY - Expansão (500 e 125 MHz, C5D5N) de AA-3.... 73
Figura 37 –Espectro de massa ESI (modo positivo) de AA-3... 74
Figura 38– Espectro de massa ESI (modo negativo) de AA-3... 74
Figura 39 – Espectro de RMN 1H (500 MHz, CDCl3) do derivado acetilado de AA-3... 74
Figura 40– Espectro de massa ESI (modo positivo) do derivado acetilado de AA-3... 75
Figura 41– Espectro de absorção na região do infravermelho de AA-4 (KBr)... 78
Figura 42– Espectro de RMN 1H (500 MHz, C5D5N) de AA-4... 78
Figura 43– Espectro de RMN 13C (125 MHz, C5D5N) de AA-4... 79
Figura 44– Espectro de RMN 13C – DEPT 135º (125 MHz, C5D5N) de AA-4... 79
Figura 45 – Espectro RMN 1H,1H - COSY (500 MHz, C5D5N) de AA-4... 80
Figura 46 – Espectro de RMN HSQC (500 e 125 MHz, C5D5N) de AA-4... 80
Figura 47– Espectro de RMN HMBC (500 e 125 MHz, C5D5N) de AA-4... 81
Figura 48– Espectro de RMN 1H,1H - NOESY (500, C5D5N) de AA-4... 81
Figura 49– Espectro de massas com ionização por ESI (modo positivo) de AA-4... 82
Figura 50 – Fragmentos observados no espectro de EM2 de AA-5... 85
Figura 51– Espectro de absorção na região do infravermelho de AA-5 (KBr)... 87
Figura 52– Espectro de RMN 1H (500 MHz, C5D5N) de AA-5... 87
Figura 53– Espectro de RMN 13C (125 MHz, C5D5N) de AA-5... 88
Figura 54– Espectro de RMN 13C – DEPT 135º (125 MHz, C5D5N) de AA-5... 88
Figura 55 – Espectro RMN 1H,1H - COSY (500 MHz, C5D5N) de AA-5... 89
Figura 56 – Espectro de RMN HSQC (500 e 125 MHz, C5D5N) de AA-5... 89
Figura 57– Espectro de RMN HMBC (500 e 125 MHz, C5D5N) de AA-5... 90
Figura 58– Espectro de RMN 1H,1H - NOESY – Expansão (500, C5D5N) de AA-5... 90
Figura 59– Espectro de massas com ionização por ESI (modo positivo) de AA-5... 91
Figura 60– Espectro de massas com ionização por ESI (modo negativo) de AA-5... 91
Figura 61– Espectro de massas EM2 do pico m/z 557,2288 de AA-5... 91
Figura 62– Principais correlações a longa distância (1H,13C – HMBC) de AA-6... 94
Figura 63– Espectro de absorção na região do infravermelho de AA-6 (KBr)... 96
xii
Figura 65– Espectro de RMN 13C (125 MHz, C5D5N) de AA-6... 97
Figura 66– Espectro de RMN 13C – DEPT 135º (125 MHz, C5D5N) de AA-6... 97
Figura 67– Espectro RMN 1H,1H - COSY (500 MHz, C5D5N) de AA-6... 98
Figura 68– Espectro de RMN HSQC (500 e 125 MHz, C5D5N) de AA-6... 98
Figura 69– Espectro de RMN HMBC – Expansão (500 e 125 MHz, C5D5N) de AA-6... 99
Figura 70– Espectro de RMN HMBC – Expansão (500 e 125 MHz, C5D5N) de AA-6... 99
Figura 71– Espectro de RMN HMBC – Expansão (500 e 125 MHz, C5D5N) de AA-6... 100
Figura 72 – Espectro de RMN 1H,1H - NOESY (500, C5D5N) de AA-6... 100
Figura 73– Espectro de massas por ionização eletrônica de AA-6... 101
Figura 74– Espectro de massas com ionização por ESI (modo positivo) de AA-6... 101
Figura 75– Espectro de absorção na região do infravermelho de AA-7 (KBr)... 105
Figura 76– Espectro de RMN 1H (500 MHz, C5D5N) de AA-7... 105
Figura 77– Espectro de RMN 13C (125 MHz, C5D5N) de AA-7... 106
Figura 78– Espectro de RMN 13C – DEPT 135º (125 MHz, C5D5N) de AA-7... 106
Figura 79– Espectro de RMN 1H,1H - COSY (500 MHz, C5D5N) de AA-7... 107
Figura 80– Espectro de RMN HSQC (500 e 125 MHz, C5D5N) de AA-7... 107
Figura 81– Espectro de RMN HSQC – Expansão (500 e 125 MHz, C5D5N) de AA-7... 108
Figura 82– Espectro de RMN HSQC – Expansão (500 MHz, C5D5N) de AA-7... 108
Figura 83– Espectro de massas por ionização eletrônica de AA-7... 109
Figura 84– Espectro de massas com ionização por ESI (modo positivo) de AA-7... 109
Figura 85– Espectro de absorção na região do infravermelho de AA-8 (KBr)... 114
Figura 86– Espectro de RM'N 1H (500 MHz, C5D5N) de AA-8... 114
Figura 87 – Espectro de RMN 13C (125 MHz, C5D5N) de AA-8... 115
Figura 88– Espectro de RMN 13C – DEPT 135º (125 MHz, C5D5N) de AA-8... 115
Figura 89 – Espectro de RMN HSQC (500 e 125 MHz, C5D5N) de AA-8... 116
Figura 90 – Espectro de RMN HMBC (500 e 125 MHz, C5D5N) de AA-8... 116
Figura 91– Espectro de massas com ionização por ESI (modo positivo) de AA-8... 117
Figura 92– Espectro de absorção na região do infravermelho de AA-9 (KBr)... 121
Figura 93– Espectro de RM'N 1H (500 MHz, C5D5N) de AA-9... 121
Figura 94– Espectro de RMN 13C (125 MHz, C5D5N) de AA-9... 122
Figura 95 – Espectro de RMN 13C – DEPT 135º (125 MHz, C5D5N) de AA-9... 122
Figura 96– Espectro de RMN HSQC (500 e 125 MHz, C5D5N) de AA-9... 123
xiii
Figura 98 – Espectro de massas com ionização por ESI (modo positivo) de AA-9... 124
Figura 99 – Principais Correlações a longa distância (1H,13C – HMBC) de AA-10... 126
Figura 100– Espectro de absorção na região do infravermelho de AA-10 (KBr)... 128
Figura 101– Espectro de RMN 1H (500 MHz, MeOD) de AA-10... 128
Figura 102– Espectro de RMN 13C (125 MHz, CD3OD) de AA-10... 129
Figura 103– Espectro de RMN 13C – DEPT 135º (125 MHz, CD3OD) de AA-10... 129
Figura 104– Espectro de RMN HSQC (125 MHz, CD3OD) de AA-10... 130
Figura 105– Espectro de RMN HMBC (125 MHz, CD3OD) de AA-10... 130
Figura 106– Espectro de absorção na região do infravermelho de AA-11 (KBr)... 133
Figura 107– Espectro de RMN 1H (300 MHz, CD3OD) de AA-11... 133
Figura 108– Espectro de RMN 13C (75 MHz, CD3OD) de AA-11... 134
Figura 109– Espectro de RMN 13C – DEPT 135º (75 MHz, CD3OD) de AA-11... 134
Figura 110 –Correlações vicinais (1H,1H COSY) de AA-12... 136
Figura 111– Correlações a longa distância (1H,13C – HMBC) de AA-12... 136
Figura 112– Espectro de absorção na região do infravermelho de AA-12 (KBr)... 140
Figura 113– Espectro de RMN 1H (500 MHz, C5D5N) de AA-12... 140
Figura 114– Espectro de RMN 13C (125 MHz, C5D5N) de AA-12... 141
Figura 115– Espectro de RMN 13C – DEPT 135º (125 MHz, C5D5N) de AA-12... 141
Figura 116– Espectro de RMN COSY (1H , 1H) (500 MHz, C5D5N) de AA-12... 142
Figura 117 – Espectro de RMN HMQC – Expansão (500 e 125 MHz, C5D5N) de AA-12. 142 Figura 118 – Espectro de RMN HMQC – Expansão (500 e 125 MHz, C5D5N) de AA-12. 143 Figura 119 – Espectro de RMN HMQC – Expansão (500 e 125 MHz, C5D5N) de AA-12. 143 Figura 120– Espectro de RMN HMBC – Expansão (500 e 125 MHz, C5D5N) de AA-12. 144 Figura 121– Espectro de RMN HMBC – Expansão (500 e 125 MHz, C5D5N) de AA-12. 144 Figura 122– Espectro de RMN HMBC – Expansão (500 e 125 MHz, C5D5N) de AA-12. 145 Figura 123– Espectro de massas com ionização eletrônica de AA-12... 145
Figura 124 – Espectro de massas com ionização por ESI (modo positivo) de AA-12... 146
Figura125 – Cromatograma de isolamento das substâncias AA-4 e AA-5... 159
Figura 126– Cromatograma de isolamento da substância AA-2... 161
Figura 127– Cromatograma de isolamento das substâncias AA-6 e AA-7... 164
Figura128– Cromatograma de isolamento das substâncias AA-8 e AA-9... 176
Figura 129– Vitafisalinas isoladas de Acnistus arborescens... 179
xiv
Figura 131– Espectro de massas ESI(+) EM (a) e EM2 (b)(c) da Vitafisalina 2... 182
Figura 132– Espectro de massas ESI(-) EM (a) e EM2 (b) da Vitafisalina 2... 184
Figura 133– Espectro de massas ESI(-) EM (a) e EM2 (b)(c) da Vitafisalina 3... 187
Figura 134– Espectro de massas ESI(-) EM (a) e EM2 (b)(c) da Vitafisalina 4... 189
Figura 135– Espectro de massas ESI(+) EM (a) e EM2 (b) da Vitafisalina 5... 191
Figura 136– Espectro de massas ESI(-) EM (a) e EM2 (b) da Vitafisalina 5... 191
Figura 137– Espectro de massas ESI(+) EM (a) e EM2 (b) da Vitafisalina 6... 192
Figura 138– Espectro de massas ESI(-) EM (a) e EM2 (b) da Vitafisalina 6... 193
Figura 139– Espectro de massas ESI(+) EM (a) e EM2 (b) da Vitafisalina 7... 195
Figura 140– Espectro de massas ESI(+) EM (a) e EM2 (b) da Vitafisalina 8... 196
Figura 141 – Cromatogramas CLAE (215-400 nm) (a) e EM (b) da fração PPTC38... 198
Figura 142– Vitafisalinas identificadas por CLAE-EMn na fração PPTC38... 198
Figura 143– Espectro de massas ESI (+) EM (a) e EM2 (b) da Vitafisalina C... 199
Figura 144– Espectro de massas ESI (+) EM (a) e EM2 (b) da Vitafisalina D... 200
Figura 145– Espectro de massas ESI (+) EM (a) e EM2 (b) da Vitafisalina E... 201
Figura 146– Espectro de massas ESI (+) EM (a) e EM2 (b) da Vitafisalina F... 202
Figura 147– Espectro de massas ESI (+) EM (a) e EM2 (b) da Vitafisalina G... 203
Figura 148– Espectro de massas ESI (+) EM (a) e EM2 (b) da Vitafisalina H... 204
Figura 149– Espectro de massas ESI (+) EM (a) e EM2 (b) da Vitafisalina J... 205
Figura 150– Espectro de massas ESI (+) EM (a) e EM2 (b) da Vitafisalina K... 206
Figura 151 – Cromatogramas CLAE (a) EM (b) de FA-EHA... 208
Figura 152– Espectro de massa ESI (modo positivo) de FA-EHA... 209
Figura 153 – Cromatogramas CLAE (a) EM (b) da Vitafisalina F... 209
xv
LISTA DE TABELAS
Tabela 1– Dados de RMN 13C de 1 (500 MHz, CDCl3)... 22
Tabela 2– Dados de RMN 13C de 2 (500 MHz, CD3OD:CDCl3 1:1)... 22
Tabela 3– Dados de RMN 13C de 3 (500 MHz, CD3OD:CDCl3 1:1)... 22
Tabela 4– Dados de RMN 13C de 4 (100 MHz, CD3OD)... 23
Tabela 5– Dados de RMN 13C de 5 (100 MHz, CD3OD) ... 23
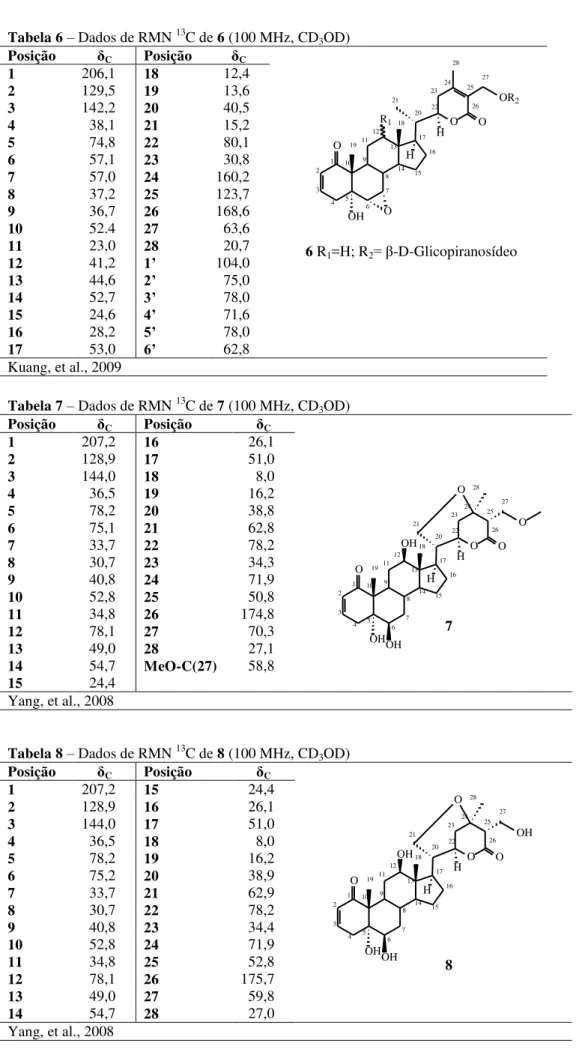
Tabela 6– Dados de RMN 13C de 6 (100 MHz, CD3OD) ... 24
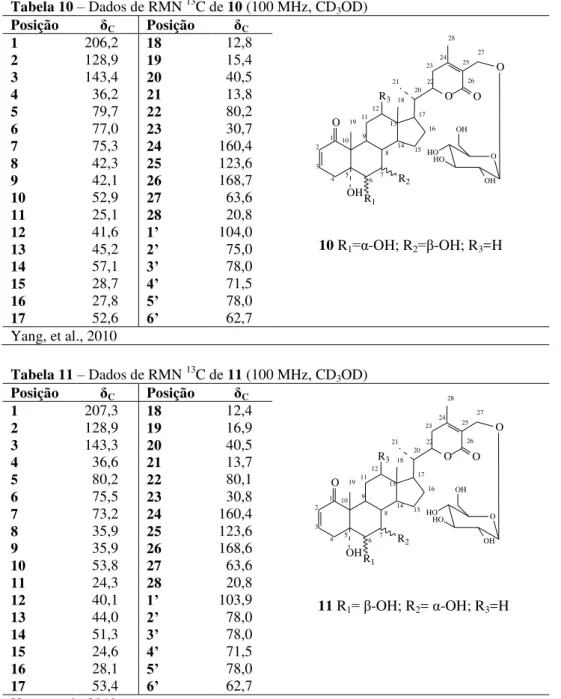
Tabela 7– Dados de RMN 13C de 7 (100 MHz, CD3OD) ... 24
Tabela 8– Dados de RMN 13C de 8 (100 MHz, CD3OD) ... 25
Tabela 9– Dados de RMN 13C de 9 (100 MHz, CD3OD) ... 25
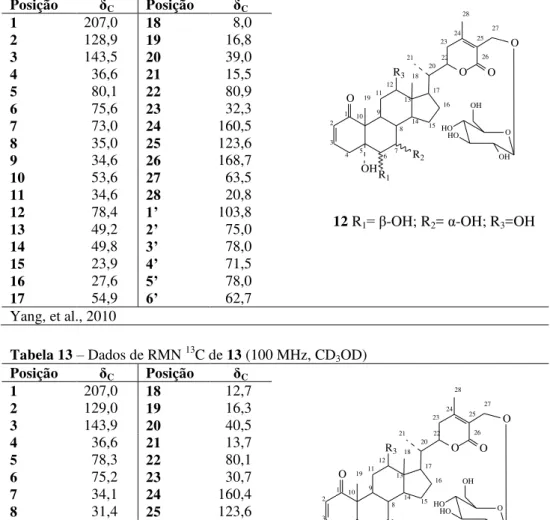
Tabela 10– Dados de RMN 13C de 10 (100 MHz, CD3OD) ... 26
Tabela 11– Dados de RMN 13C de 11 (100 MHz, CD3OD) ... 26
Tabela 12– Dados de RMN 13C de 12 (100 MHz, CD3OD) ... 27
Tabela 13– Dados de RMN 13C de 13 (100 MHz, CD3OD) ... 27
Tabela 14– Dados de RMN 13C de 14 (400 MHz, C5D5N) ... 28
Tabela 15– Dados de RMN 13C de 15 (400 MHz, C5D5N) ... 28
Tabela 16– Dados de RMN 13C de 16 (400 MHz, C5D5N) ... 28
Tabela 17– Dados de RMN 13C de 17 (400 MHz, C5D5N) ... 29
Tabela 18– Dados de RMN 13C de 18 (100 MHz, C5D5N) ... 29
Tabela 19– Dados de RMN 13C de 19 (100 MHz, C5D5N) ... 29
Tabela 20– Dados de RMN 13C de 20 (100 MHz, C5D5N) ... 30
Tabela 21– Dados de RMN 13C de 21 (125 MHz, C5D5N) ... 30
Tabela 22– Dados de RMN 13C de 22 (100 MHz, C5D5N) ... 31
Tabela 23– Dados de RMN 13C de 23 (125 MHz, CDCl3) ... 31
Tabela 24– Dados de RMN 13C de 24 (125 MHz, CDCl3) ... 32
Tabela 25– Dados de RMN 13C de 25 (125 MHz, CDCl3) ... 32
Tabela 26– Dados de RMN 13C de 26 (125 MHz, CDCl3) ... 33
Tabela 27– Dados de RMN 13C de 27 (100 MHz, CDCl3) ... 33
Tabela 28– Dados de RMN 13C de 28 (100 MHz, CDCl3) ... 34
Tabela 29– Dados de RMN 13C de 29 (150 MHz, CDCl3) ... 34
Tabela 30– Dados de RMN 13C de 30 (150 MHz, CDCl3) ... 35
xvi
Tabela 32– Dados de RMN 13C de 32 (125 MHz, C5D5N) ... 36
Tabela 33– Dados de RMN 13C de 33 (75 MHz, CDCl3) ... 36
Tabela 34– Dados de RMN 13C de 34 (75 MHz, CDCl3) ... 37
Tabela 35– Dados de RMN 13C de 35 (75 MHz, CDCl3) ... 37
Tabela 36– Dados de RMN 13C de 36 (100 MHz, CDCl3) ... 37
Tabela 37– Dados de RMN 13C de 37 (100 MHz, CDCl3) ... 38
Tabela 38– Dados de RMN 13C de 38 (100 MHz, CDCl3) ... 38
Tabela 39– Dados de RMN 13C de 39 (100 MHz, CDCl3) ... 38
Tabela 40– Dados de RMN 13C de 40 (100 MHz, CDCl3)... .. 39
Tabela 41– Dados de RMN 13C de 41 (100 MHz, CDCl3) ... 39
Tabela 42– Dados de RMN 13C de 42 (100 MHz, CDCl3) ... 39
Tabela 43– Dados de RMN 13C de 43 (100 MHz, CDCl3) ... .. 40
Tabela 44– Dados de RMN 13C de 44 (100 MHz,C5D5N) ... 40
Tabela 45– Dados de RMN 13C de 45 (100 MHz, C5D5N) ... 40
Tabela 46– Dados de RMN 13C de 46 (100 MHz,C5D5N) ... 41
Tabela 47– Dados de RMN 13C de 47 (100 MHz, CDCl3) ... 41
Tabela 48– Dados de RMN 13C de 48 (100 MHz, C5D5N) ... 41
Tabela 49– Dados de RMN 13C de 49 (150 MHz, CD3OD) ... 42
Tabela 50– Dados de RMN 13C de 50 (100 MHz, CDCl3) ... 42
Tabela 51– Dados de RMN 13C de 51 (100 MHz, CDCl3) ... 42
Tabela 52– Dados de RMN 13C de 52 (100 MHz, CD3OD) ... 43
Tabela 53– Dados de RMN 13C de 53 (125 MHz, CDCl3) ... 43
Tabela 54– Dados de RMN 13C de 54 (100 MHz, CD3OD) ... 44
Tabela 55– Dados de RMN 13C de 55 (100 MHz, CD3OD) ... 44
Tabela 56– Dados de RMN 13C de 56 (75 MHz, CDCl3) ... 45
Tabela 57– Dados de RMN 13C de 57 (75 MHz, CDCl3) ... 45
Tabela 58– Dados de RMN 13C de 58 (75 MHz, CDCl3) ... 45
Tabela 59– Padrão de hidrogenação de AA-1, determinado através de análise comparativa dos espectros de RMN 13C – DEPT 135º... 47
Tabela 60– Deslocamentos químicos de RMN 13C e 1H (C5D5N) de AA-1... 51
Tabela 61 –Deslocamentos químicos de RMN 13C e 1H (C5D5N) de AA-2... 60
xvii
Tabela 63 – Dados de RMN HSQC e HMBC (C5D5N) de AA-3... 68
Tabela 64 –Deslocamentos químicos de RMN 13C (125 MHz) e 1H (500 MHz) (C5D5N) de AA-3 e AA-4... 77
Tabela 65 - Deslocamentos químicos de RMN 13C (125 MHz) e 1H (500 MHz) (C5D5N) de AA-3 e AA-5... 86
Tabela 66 –Deslocamentos químicos de RMN 13C e 1H (C5D5N) de AA-6... 95
Tabela 67 –Deslocamentos químicos de RMN 13C e 1H (C5D5N) de AA-7... 104
Tabela 68 – Padrão de hidrogenação de AA-8 18R e 18S, determinado através de análise comparativa dos espectros de RMN 13C – DEPT 135º... 111
Tabela 69 – Deslocamentos químicos de RMN 13C e 1H (C5D5N) de AA-8 (18R e 18S).... 113
Tabela 70 – Padrão de hidrogenação de AA-9 18R e 18S, determinado através de análise comparativa dos espectros de RMN 13C – DEPT 135º... 119
Tabela 71 – Deslocamentos químicos de RMN 13C e 1H (C5D5N) de AA-9 (18R e 18S).... 120
Tabela 72 –Comparação dos deslocamentos químicos de RMN 13C e 1H (CD3OD) de AA-10 com valores da literatura (Agrawal, 1989)... 127
Tabela 73 –Deslocamentos químicos de RMN 13C e 1H (CD3OD) de AA-11 comparados com dados da literatura (Agrawal, 1989)... 132
Tabela 74 –Deslocamentos químicos de RMN 13C e 1H (C5D5N) de AA-12, em comparação com dados da literatura (Su, et al., 2002)... 139
Tabela 75 – Dados referentes ao fracionamento preliminar do extrato etanólico bruto das folhas de A. arborescens (EEFAA)... 151
Tabela 76 – Descrição do gradiente de eluição do tratamento cromatográfico da fração EEFAA-DM... 152
Tabela 77 – Descrição do gradiente de eluição do tratamento cromatográfico da fração EEFAA-DM-1... 152
Tabela 78 – Dados referentes ao fracionamento cromatográfico da fração F-1... 153
Tabela 79 – Dados referentes ao fracionamento cromatográfico da fração F-1.β’... 154
Tabela 80 – Resultado do fracionamento cromatográfico da fração 29-36... 155
Tabela 81 – Frações resultantes do fracionamento cromatográfico da fração LMC38... 156
Tabela 82 – Subfrações obtidas do fracionamento cromatográfico da fração 6-10... 156
Tabela 83 –Frações provenientes do fracionamento cromatográfico das frações 19-30... 156
xviii
Tabela 85 –Frações resultantes do fracionamento cromatográfico das frações 98-126
(PPT) ... 160
Tabela 86 – Frações resultantes do fracionamento cromatográfico das frações F-1.6 e
F-1.7... 162
Tabela 87 – Frações resultantes do fracionamento cromatográfico da fração FDA60... 163
Tabela 88 – Descrição do gradiente de eluição do tratamento cromatográfico da fração
EEFAA-DM-2... 166
Tabela 89 – Frações resultantes do fracionamento cromatográfico da fração F-B... 167
Tabela 90 – Descrição do gradiente de eluição do tratamento cromatográfico da fração
F-C... 168
Tabela 91 – Resultado do tratamento cromatográfico das frações 14-25... 169
Tabela 92 – Resultado do tratamento cromatográfico das frações 10-21... 169
Tabela 93 – Descrição do gradiente de eluição do tratamento cromatográfico das frações
25-50... 170
Tabela 94 – Descrição das frações reunidas, resultantes da cromatografia por exclusão
das frações 11-24 e 19-31... 171
Tabela 95 – Extratos das folhas de A. arborescens... 173
Tabela 96 – Fracionamento cromatográfico do extrato EHAFAA... 174
Tabela 97 – Descrição das frações obtidas do fracionamento cromatográfico da fração
AcOEt... 174
Tabela 98 – Descrição do fracionamento cromatográfico de F19-30... 175
Tabela 99 - Valores das massas exatas experimentais e teóricas das espécies submetidas
à fragmentação das vitafisalinas 1-8... 179
Tabela 100 – Frações obtidas dos fracionamentos cromatográficos de EHAFAA e
EEFAA... 207
xix
LISTA DE FLUXOGRAMAS
Fluxograma 1 –Rota esquemática da obtenção dos extratos hexânico e etanólico das
folhas de A. arborescens... 150
Fluxograma 2 – Rota esquemática do isolamento dos constituintes químicos AA-1,
AA-2, AA-3, AA-4, AA-5, AA-6 e AA-7 obtidos a partir do extrato etanólico das folhas de A.arborescens... 165
Fluxograma 3 – Rota esquemática do isolamento de AA-10, AA-11 e AA-12 obtidos a
partir do extrato etanólico das folhas de A. arborescens... 172
Fluxograma 4 – Rota esquemática do isolamento de AA-8 e AA-9 obtidos a partir do
xx
LISTA DE ESQUEMAS
Esquema 1– Propostas de fragmentos de massas observados nos espectros de massas da
vitafisalina 1... 180
Esquema 2– Propostas de fragmentos de massas observados nos espectros de massas da
vitafisalina 2... 181
Esquema 3– Propostas de fragmentos de massas observados nos espectros de massas da
vitafisalina 3... 185
Esquema 4– Propostas de fragmentos de massas observados nos espectros de massas da
vitafisalina 4... 188
Esquema 5– Propostas de fragmentos de massas observados nos espectros de massas da
vitafisalina 5... 190
Esquema 6– Propostas de fragmentos de massas observados nos espectros de massas da
vitafisalina 6... 192
Esquema 7– Propostas de fragmentos de massas observados nos espectros de massas da
vitafisalina 7... 194
Esquema 8– Propostas de fragmentos de massas observados nos espectros de massas da
vitafisalina 8... 195
Esquema 9– Propostas de fragmentos de massas observados nos espectros de massas da
substância C... 199
Esquema 10 – Propostas de fragmentos de massas observados nos espectros de massas
da substância D... 200
Esquema 11 – Propostas de fragmentos de massas observados nos espectros de massas
da substância E... 201
Esquema 12 – Propostas de fragmentos de massas observados nos espectros de massas
da substância F... 202
Esquema 13 – Propostas de fragmentos de massas observados nos espectros de massas
da substância G... 203
Esquema 14 – Propostas de fragmentos de massas observados nos espectros de massas
da substância H... 204
xxi da substância J... 205
Esquema 16 – Propostas de fragmentos de massas observados nos espectros de massas
da substância K... 206
xxii
LISTA DE ABREVIATURAS E SÍMBOLOS
ACN Acetonitrila
AcOEt Acetato de etila C5D5N Piridina deuterada
calc. Calculada
CC Cromatografia em coluna
CCD Cromatografia em Camada Delgada CD3OD Metanol deuterado
CH2Cl2 Diclorometano
CID Collisional Induced Dissociation (Dissociação Induzida por Colisão)
CLAE Cromatografia Líquida de Alta Eficiência
CLAE-EM Cromatografia Líquida de Alta Eficiência – Espectrometria de Massas COSY Correlation Spectroscopy
CPD Composition Pulse Decoupling (Desacoplamento com Pulso Composto)
d Dupleto
dd Duplo dupleto
DEPT Distortionless Enhancement by Polarization Transfer
EI Electron Ionization (Ionização Eletrônica)
EM Espectrometria de Massas
EMAR Espectrometria de Massas de Alta Resolução
EM-IES Espectrometria de Massas com Ionização por electrospray
ESI Electrospray ionisation (ionização por electrospray)
EtOH Etanol
Exp. Experimental
HMBC Heteronuclear Multiple Bond Connectivity
HMQC Heteronuclear Multiple Quantum Coherence
HPLC High Performance Liquid Chromatography
HSQC Heteronuclear Single Quantum Coherence
Hz Hertz
IT Ion Trap (Armadilha de Íons)
IV Infravermelho
xxiii KBr Brometo de potássio
m Multipleto
m/z Razão massa/carga
MeOH Metanol
MHz Mega Hertz
NOESY Nuclear Overhauser Enhancement Spectroscopy
p.f. Ponto de fusão
PDA Photodiode Array (Detector de Arranjo de Diodos)
ppm Partes por milhão
RMN 13C Ressonância Magnética Nuclear de Carbono-13 RMN 1H Ressonância Magnética Nuclear de Hidrogênio-1
s Singleto
sl Singleto largo
t Tripleto
td Tripleto duplo
Teor. Teórica
ToF Time of Flight (Tempo de Vôo)
UFLC Ultra Fast Liquid Chromatography (Cromatografia Líquida Ultra Rápida)
UV-Vis Ultavioleta – visível
δ Deslocamento químico
υmáx Absorção maxima
xxiv
RESUMO
Este trabalho descreve a prospecção química do extrato etanólico das folhas de Acnistus arborescens (Solanaceae). Esse estudo resultou no isolamento e caracterização de vários
metabólitos secundários, incluindo as vitafisalinas M, N, O, F (epímeros 18R e 18S) e
2,3-desidro-F (epímeros 18R e 18S), além de quatro novas vitafisalinas, sendo três cloradas. As
estruturas das novas vitafisalinas foram estabelecidas como: rel-(17S, 20R, 22R)-6
-cloro-18S-etóxi-18,20-epóxi-4,5-dihidróxi-1-oxo-vita-2,24-dienolido, rel-(17S, 20R, 22R)-6
-cloro-18R-etóxi-18,20-epóxi-4,5-dihidróxi-1-oxo-vita-2,24-dienolido, rel-(17S, 20R,
22R)-6α-cloro-18,20-epóxi-4 ,5 -diidróxi-18α-metóxi-1-oxovita-2,24-dienolido e rel
-(17S,20R,22R)-5 ,6 :18,20-diepóxi-3 ,18α-dietóxi-4 -hidróxi-1-oxovita-24-enolido.
Adicionalmente a estes compostos, foram também isolados dois flavonóides, canferol e quercetina, e uma ceramida, cuja estrutura foi determinada como (2R,3S,4S,16E)-β[(β’R
)-2’-hidroxiheneicosanoilamino]-nonadec-16-eno-1,3,4-triol. Foi realizado ainda um estudo de fragmentação de massas com as vitafisalinas isoladas, para a construção de uma mini-biblioteca de padrões de fragmentação, a fim de reconhecer estes compostos ou análogos em outros extratos. Com isso, foi possível identificar oito novas vitafisalinas (C-H, J e K) numa fração de elevado potencial citotóxico (PPTC38), além de realizar um estudo qualitativo da composição química dos extratos obtidos das folhas de A. arborescens
cultivada, onde foi possível identificar a vitafisalina F como constituinte majoritário na fração analisada. As técnicas analíticas utilizadas na elucidação estrutural dos compostos isolados foram IV, EMAR e RMN 1H e 13C (1D e 2D), enquanto a técnica utilizada no estudo de fragmentação, bem como na análise qualitativa das frações foi a cromatografia líquida acoplada à espectrometria de massas de alta resolução (CLAE-EM).
xxv
ABSTRACT
In this study herein, describes the chemical prospect of ethanol extract from leaves of
Acnistus arborescens (Solanaceae). Therefore, this study resulted in the isolation and
characterization of several secondary metabolites, including the withaphysalins M, N, O, F (epimers 18R and 18S) and 2,3-dehydro-F (epimers 18R and 18S), as well as four new
withaphysalins, being three chlorinated. Their structures were established as new withaphysalins: rel-(17S, 20R, 22R)-6-chloro-18S-ethoxy-18,20-epoxy-4,5
-dihidroxy-1-oxo-witha-2,24-dienolide, rel-(17S, 20R, 22R)-6-chloro-18R
-ethoxy-18,20-epoxy-4,5-dihidroxy-1-oxo-witha-2,24-dienolide, rel-(17S, 20R, 22R)-6α
-chloro-18,20-epoxy-4 ,5 -dihidroxy-18α-methoxy-1-oxo-whita-2,24-dienolide e rel-(17S,20R,22R
)-5 ,6 :18,20-diepoxy-3 ,18α-diethoxy-4 -hidroxy-1-oxo-witha-24-enolide. Furthermore, two flavonoids, kaempferol and quercetin, were also isolated and a ceramide, whose structure was determined as rel-(2S,3S,4R,16E)-2-[(β’R)-β’
-hydroxynonadecanoylamino]-heneicosadec-16-ene-1,3,4-triol. A study was also carried out about fragmentation with withaphysalins isolated with the objective to construct a mini-library with fragmentation patterns, in order to recognize the withaphysalins or similar compounds in other extracts. Hence, it was possible to identify eight new withaphysalins (C-H, J and K) in a fraction of high cytotoxic potential (PPTC38), and perform a qualitative study of the chemical composition in extracts from leaves of A. arborescens, whereby it was possible to identify
the withaphysalin F, as a major constituent from the fraction duly analyzed. The analytical techniques used in the structural elucidation of isolated compounds were IR, MSHR and
1H and 13C NMR (1D and 2D), where as the technique used in the study of fragmentation,
as well as the qualitative analysis of the fractions, was the liquid chromatography-mass spectrometry high resolution (HPLC-MS).
Maia, A. I. V. 1
INTRODUÇÃO
A utilização de plantas pelo homem, como fonte de medicamento é secular. Registros mostram que antigas civilizações, em especial, a Chinesa, Egípcia e Romana, lançavam mão das ervas para os mais diversos fins, incluindo para o tratamento ou prevenção de doenças. Portanto, as plantas podem ser consideradas a base para a descoberta de novos fármacos. De fato, a cada dia as plantas vêm sendo reconhecidas pela sua capacidade de produzir metabólitos secundários, muitas vezes, com alto potencial biológico e/ou farmacológico (Farnsworth et al., 1985).
Nas últimas décadas, os produtos naturais têm desempenhado um importante papel na descoberta de novos fármacos, quer seja na sua forma original ou modificado estruturalmente (Rocha, et al., 2006). Uma análise da origem de drogas desenvolvidas no período entre 1981 a 2002 mostrou que os produtos naturais, ou drogas derivadas destes, compreendem cerca de 28% de todas as entidades químicas lançadas no mercado de medicamentos. Em adição, 24% destas drogas, são originárias de produtos naturais modificados ou foram sintetizadas tendo produtos naturais como modelos (Chin et al, 2006). Estes valores percentuais demonstram que os produtos naturais são importantes candidatos no planejamento para a descoberta de novas drogas. De fato, um escrutínio envolvendo indicações médicas tem demonstrado que os produtos naturais, incluindo as drogas desenvolvidas tendo produtos naturais como modelos, são usados para tratar 87% de todas as categorias de doenças humanas, incluindo entre outros, agentes antibacterianos, anticâncer, anticoagulantes, antiparasitários e imunosupressivos. Além do mais, das 90 drogas comercialmente disponíveis ou aprovadas nos Estados Unidos entre 1982 a 2002, aproximadamente 79% podem ser consideradas de origem natural (Chin et al, 2006). Reforçando a importância dos produtos naturais, Butler (2004), mostrou que entre as 35 drogas mais vendidas no mundo inteiro, no período de 2000 a 2002, os produtos naturais ou derivados destes, contribuem com fração significativa (40% em 2000; 24% em 2001 e 26% em 2002).
Maia, A. I. V. 2 Um número significativo de agentes a partir de plantas continua em experimento clínico para o tratamento do câncer. Alguns estão sendo investigados como citotoxinas diretas, enquanto outros estão sendo estudados considerando seu potencial como inibidores de enzimas, proteínas e vias do ciclo celular (Cragg & Newman, 2007).
Plantas da família Solanaceae têm sido usadas na medicina popular desde a antiguidade devido suas propriedades anticâncer, antiinflamatória e antipirética, assim como no tratamento de malária, asma, hepatite, dermatite e reumatismo (Benjumea et al., 2009; Cordero et al., 2009; Minguzzi et al., 2002; Rocha et al., 2006; Roumy et al., 2010). Como exemplos de Solanaceas medicinalmente importantes podem ser citadas, entre outras, as seguintes espécies: Acnistus Arborescens, Acnistus breviflorus, Datura fastuosa, Dunalia australis, Nicandra Physaloides e Withania somnifera (Chiang et al., 1992a; 1992b; Lin et al.,
1992; Pietro et al., 2000; Ismail & Alam, 2001; Lorenzi & Matos, 2002; Ray & Gupta, 1994; Soares et al., 2003; Wu et al., 2004). Acnistus arborescens é reconhecida por seu reputado
Taxol (® 3)
O NH
O O
OH OH
O O
O
OH
O
O H
O
O O
N
N
O
O OH
O
Camptotecina (4) N
OH
N H
O O
O
N N
H
R H OH
O O
O O
Vimblastina; R=CH3 (1)
Vincristina; R=CHO (2)
Maia, A. I. V. 3 valor medicinal, particularmente no tratamento de câncer (Kupchan et al., 1965, 1969; Sinha et al., 1987). Desta forma, estudos químicos associados a farmacológicos vêm sendo realizados com propósitos de se obter um maior conhecimento sobre o potencial antitumoral dos metabólitos secundários elaborados por esta espécie. O extrato etanólico de suas folhas apresentou elevada atividade contra o sarcoma 180, sendo atribuída à presença de vitanolidos (lactonas esteroidais) (Kupchan et al., 1965, 1969; Minguzzi et al., 2002).
Cromatografia Líquida e Espectrometria de Massas (CLAE-EM)
A espectrometria de massas (EM) hoje constitui uma das técnicas instrumentais mais abrangentes da ciência, com amplas aplicações em diversas áreas, como química, biologia, ciências médicas e tecnológicas, isto devido a recentes avanços em instrumentos e o desenvolvimento de novas técnicas de ionização que a revitalizaram. A importância desta técnica está refletida no número de artigos publicados, seja para simples determinação da massa molar de substâncias puras, ou na identificação e quantificação de substâncias de interesse em extratos brutos (Crotti et al., 2006). O acoplamento da cromatografia líquida à
espectrometria de massas com ionização por electrospray (CL-EM-IES) tornou-se uma
importante técnica para análise qualitativa e quantitativa de compostos bioativos presentes em materiais das mais variadas fontes de produtos naturais (Morais et al., 2007), constituindo
uma eficiente e poderosa ferramenta analítica para o estudo rápido e acurado dos constituintes químicos em extratos de plantas, bem como na análise de controle de qualidade de fitoterápicos, bebidas, cosméticos, produtos alimentícios, etc. A CL-EM-IES combina a capacidade eficiente de separação da cromatografia líquida (CL) e o poder de caracterização estrutural da espectrometria de massas (EM), constituindo uma técnica bastante utilizada em estudos fitoquímicos, com alta sensibilidade, rapidez e pequena quantidade de amostra.
Espectrômetro de massas
Um espectrômetro de massas é um instrumento utilizado para separar espécies carregadas de acordo com suas razões massa/carga (m/z) e determinar suas intensidades,
relacionando-as. Dessa forma, um espectrômetro de massas típico é constituído pelas seguintes partes: fonte de ionização, analisador de massas, detector e sistema de processamento de dados (Gates et al., 2006) (Fig. 2, p. 4). Neste estudo, o acoplamento
Maia, A. I. V. 4 baseia-se no fenômeno CID (do inglês collisional induced dissociation) que caracteriza-se
pela fragmentação induzida por colisão, conferindo maiores informações estruturais às moléculas além de permitir um estudo comparativo devido ao padrão de fragmentação que é fornecido.
]
Ionização dos analitos
A introdução da amostra no espectrômetro é realizada online através de um sistema de
entrada adequado, podendo ser proveniente de uma coluna analítica, quando o mesmo encontra-se acoplado à cromatografia líquida ou através de uma seringa (injeção direta) ou ainda com o auxílio de uma bomba (infusão). Para que o espectrômetro de massas possa reconhecer os analitos, uma técnica de ionização se faz necessária, uma vez que o equipamento só possui capacidade de analisar espécies carregadas. Há diversas técnicas de ionização que podem ser empregadas, dependendo da natureza dos analitos. As técnicas de ionização mais bem sucedidas no acoplamento com a cromatografia líquida são aquelas que utilizam interfaces de ionização à pressão atmosférica (API), que são ionização química à pressão atmosférica (APCI) e ionização por electrospray (ESI). Outra vantagem destas
técnicas é a suavidade com que elas geram/transferem os íons, permitindo que as moléculas atinjam a fase gasosa predominantemente na forma intacta.
Maia, A. I. V. 5
Ionização por electrospray (ESI)
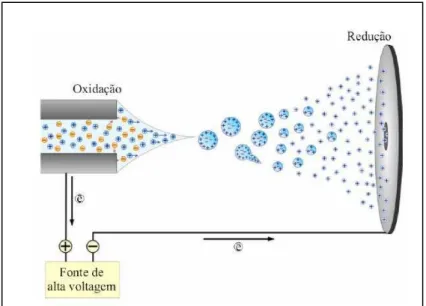
A ionização por electrospray é basicamente uma técnica de transferência dos analitos da
fase líquida para a fase gasosa. Ela é bastante amena e geralmente é bem sucedida para moléculas de polaridade mediana. Adicionalmente, a técnica ESI produz com frequência íons com múltiplas cargas para moléculas grandes como proteínas e peptídeos. Nos últimos anos a ionização por electrospray tem se tornado uma das mais importantes técnicas de ionização em
uso. Seus mecanismos permanecem em constante estudo por ainda não serem bem compreendidos, porém alguns autores tentam explicar os fenômenos que ocorrem na fonte de ionização.
A ESI pode ser dividida em três etapas principais: a nebulização da solução da amostra em gotículas carregadas produzidas pela aplicação direta de voltagem no capilar, a liberação dos íons a partir das gotículas e o transporte dos íons da região de pressão atmosférica da fonte para a região de alto vácuo do analisador (Chapman, 1993).Uma diferença de potencial (2-4 kV) é aplicada ao capilar por onde o líquido contendo a amostra flui em direção a um contra-eletrodo, o que causa a separação dos íons com carga positiva e negativa formando uma dupla camada elétrica. A atração eletrostática dos íons em excesso na camada exterior do líquido, em direção ao contra-eletrodo, causa uma distorção da sua superfície no formato de
um cone, conhecido como “cone de Taylor”. À medida que isso ocorre, a tensão superficial
do líquido atua para manter a superfície não deformada, até chegar o momento que a tensão superficial não é mais capaz de manter a superfície coesa e um fino filamento líquido
formando o “cone de Taylor” emite um jato de gotículas carregadas em direção ao
contra-eletrodo. À medida que as gotículas “viajam” em direção ao contra-eletrodo, o solvente tende a evaporar, aumentando a razão carga/volume. Quando a repulsão entre as cargas vence a
tensão superficial, ocorre a “explosão coulombica” e gotículas menores são ejetadas das
gotículas iniciais (Fig. 3, p. 6).
O mecanismo pela qual os íons chegam à fase gasosa ainda é debatido constantemente, pois ainda não se conhece com detalhes este processo. Dois modelos foram propostos para tentar explicar os mecanismos de formação dos íons em fase gasosa (Fig. 4, p. 7). Um deles foi sugerido por Dole et al. (1968) e ficou conhecido como modelo das cargas residuais - MCR (do inglês, charge residue model – CRM) e propõe que as gotículas carregadas saem da
ponta do capilar formando o cone de Taylor, e com o auxilio de um fluxo de gás aquecido, geralmente N2, as gotículas carregadas com várias unidades de carga sofrem a evaporação do
Maia, A. I. V. 6 carga, tornando a repulsão entre as cargas, maior que a tensão superficial. Este efeito faz com que as gotículas se desintegrem em gotículas ainda menores e o mesmo processo pode ser repetido até que o solvente seja evaporado por completo, restando apenas os íons da amostra.
O outro modelo proposto por Iribarbe e Thomsom (1976 e 1979) foi o modelo da dessorção dos íons – MDI (do inglês, ion evaporation model - IEM), ele propõe que o
aumento da densidade superficial de carga devido à evaporação do solvente cria um campo superficial que supera as forças de solvatação dos íons antes de exceder a tensão superficial do solvente, causando a ejeção do íon antes da explosão coulombica.
Diferentemente da técnica de ionização por elétrons, onde ocorre a perda ou a captura de elétrons gerando íons com energia interna muito alta e consequentemente muitos fragmentos, nas técnicas de ionização branda a informação estrutural é muito pouca ou nenhuma, pois os íons gerados têm baixas energias internas, o que resulta em espectros de massas com picos intensos relativos aos íons protonados ou desprotonados e pouca ou nenhuma informação relativa aos picos oriundos de fragmentos.
Um espectro de massas com ionização por ESI, de um modo geral, apresenta o íon protonado ou desprotonado e/ou seus adutos (Na, K e/ou Cl) como os principais picos, apresentando poucas informações estruturais devido a ausência de fragmentação. Porém, como discutido anteriormente, estas informações podem ser obtidas por espectrometria de massas tandem ou ainda, alguma fragmentação pode ser obtida na fonte de ionização,
aumentando-se os potenciais aplicados no capilar e nos cones de transmissão.
Maia, A. I. V. 7
Analisadores de massas
Após a ionização, os íons produzidos na fonte são direcionados a uma região de alto vácuo, onde se localizam os analisadores de massas, os quais têm a função de separar os íons de acordo com suas razões m/z. Atualmente, estão disponíveis diversos tipos de analisadores
de massas e sua escolha depende do tipo de aplicação desejada. Alguns aspectos como intervalo de massas, poder de resolução, exatidão de massa, taxa de transmissão dos íons e sensibilidade, quantificação, velocidade de varredura, bem como facilidade de acoplamento com o sistema de separação devem ser considerados. As opções para a escolha dos analisadores de massas incluem os do tipo quadrupolo (Q), ion trap (IT), tempo de vôo (ToF),
setores do tipo elétrico e magnético, equipamentos com transformada de Fourier do tipo ressonância ciclotrônica de íons (FT-ICR) e orbitrap (Niwa, 1995; Makarov, 2000). Além
desses equipamentos, há possibilidades de combinação de mais de um analisador para obtenção de análise em tandem, quer seja com analisadores do mesmo tipo (por exemplo:
triplo quadrupolo) ou com equipamentos híbridos (exemplo: Q-ToF) (Vekey, 2001). Neste trabalho foi utilizado um equipamento híbrido IT-ToF, então esses dois tipos de analisadores serão brevemente discutidos.
Analisadores do tipo IT funcionam como uma “armadilha” de íons, onde operam por princípios físicos os quais aprisionam os íons através de um campo magnético que os mantém em uma órbita estável em seu interior (Fig. 5, p. 8). Os íons são ejetados para fora do analisador pela aplicação de uma rampa crescente de radiofrequência (RF), de acordo com seus valores de m/z (March, 2005; Dass, 2007). Devido sua capacidade de aprisionar os íons
MH+
Figura 4 - Mecanismos de formação de íons em ESI
Raio crítico
Repulsão de cargas > tensão superficial
Força do campo > 109 V/M
Evaporação
Evaporação Desintegração
Maia, A. I. V. 8 em seu interior, os analisadores do tipo IT podem proporcionar diversos estágios de fragmentação, num processo chamado espectrometria de massas tandem, EMn onde n é o
número de fragmentações sofridas pelos íons.
Detectores do tipo tempo de vôo são baseados no princípio de que os íons com mesma carga têm energias cinéticas iguais, e sua velocidade será inversamente proporcional à raiz quadrada da sua massa. Então se dois íons com mesma carga, mas com massas diferentes, são acelerados através de um campo elétrico com potencial constante, suas velocidades serão
dependentes de suas massas, e eles atingirão o detector com “tempos de vôo” diferentes.
Assim, o íon de menor valor de m/z atingirá o detector primeiro, enquanto que o de maior
massa levará mais tempo para chegar ao detector (Hoffmann e Stroobant, 2007; Dass, 2007). Para o funcionamento do ToF, é imprescindível que todos os íons formados na fonte, entrem no analisador ao mesmo tempo, pois só assim será possível determinar o tempo que cada íon levou para percorrer toda a extensão do analisador. Para aumentar a distância percorrida pelos íons, refletores são posicionados nos analisadores, o que permite aumentar a precisão do analisador (Fig. 6, p. 9).
Maia, A. I. V. 9 A junção destes dois analisadores (IT-ToF) tornou-se uma ferramenta ideal tanto para análises qualitativas, quanto para quantitativas, onde a combinação da capacidade de vários estágios de fragmentação do IT com a alta sensibilidade e exatidão do ToF, fizeram desta, uma técnica de análise de alta resolução.
Espectrometria de massas tandem (EMn)
A escolha a interface em CLAE-EM para uma aplicação em particular, depende da polaridade e da massa molar do analito, bem como da quantidade de informação que se deseja obter. O uso de interfaces como ionização eletrônica (EI) é uma opção atrativa para análise qualitativa, devido sua aparente habilidade de gerar espectros de massas contendo fragmentos, ou seja, o espectro fornece informação estrutural. Contudo, na prática, a maioria dos compostos que necessitam do uso da CLAE-EM são termicamente instáveis e então não fornecem informações estruturais úteis quando analisados por EI (Crotti et al., 2006). Para análises quantitativas, as técnicas APCI e ESI são adequadas. Entretanto, devido a suavidade destas técnicas, não se observa fragmentação do analito e a informação estrutural é muito limitada. Quando ambas as análises são desejadas, técnicas de ionização brandas podem ser usadas em combinação com a espectrometria de massas tandem (EMn) (Romijn et al, 2003).
Num experimento EMn típico, um íon do primeiro estágio EM (íon precussor ou “pai”) é
selecionado e transferido para a célula de colisão (Fig. 7, p. 10). A fragmentação do íon precussor é realizada através da dissociação induzida por colisão, usando um gás inerte (geralmente Ar, He, N2 ou CO2). Os íons fragmentos (íons produtos ou “filhos”) são
altamente indicativos da estrutura do íon precussor. Usando analisadores do tipo ion trap, a
Maia, A. I. V. 10 análise pode ser estendida a mais etapas, através da fragmentação sequencial (EMn), onde n<10 (Tozuka et al, 2003). A identificação de compostos desconhecidos tem sido demonstrada através do uso de dados de EMn em combinação com sua massa exata. Este é especialmente o caso onde a relação estrutura-fragmentação de uma série homóloga de compostos é previamente conhecida (Crotti et al., 2005).
Figura 7 – Representação esquemática de dois analisadores em
Maia, A. I. V. 11
Objetivos
Isolar novos constituintes químicos, particularmente da classe dos vitaesteróides; Realizar um estudo de fragmentação de massas de todas as vitafisalinas isoladas
no presente trabalho com o intuito de gerar um banco de dados para essa classe de compostos;
Proceder uma análise qualitativa das vitafisalinas presentes nos extratos e/ou frações ativas;
Maia, A. I. V. 12
1. CONSIDERAÇÕES BOTÂNICAS
1.1. Considerações sobre a família Solanaceae
A família Solanaceae é uma das maiores e mais complexas dentre as Angiospermas, com cerca de 2.300 espécies subordinadas a 92 gêneros. Apresenta ampla distribuição geográfica e está concentrada principalmente na América do Sul, onde se encontra sua maior diversidade. Estima-se nesta região a presença de aproximadamente 50 gêneros endêmicos, assim, considera-se que este seja o seu provável centro de origem (Agra & Nurit, 2005). O Brasil apresenta cerca de 30% de todas as espécies de Solanaceae do mundo, com aproximadamente 10% fazendo parte da flora da região nordeste (Albuquerque, Velazquez e Vasconcellos-Neto, 2006).
Algumas espécies de Solanaceae são de grande importância na alimentação humana como Lycopersicon esculetum (tomate), Solanum tuberosum (batata inglesa) e Capsicum frutenses (pimenta malagueta), enquanto outras são ornamentais, como Brugmansia candida, Petunia violacea e Solanum pseudocapsicum. Algumas delas apresentam restrições
ecológicas como Solanum inodorum que ocorre a 800 m acima do nível do mar e, no México, Lycianthes monziniana, distribuída acima de 2000 m em florestas de pino-encino (Williams,
1993). Outras espécies se apresentam em áreas restritas como Physalis tehuacanensis e P. queretaroensis (endêmicas do México), enquanto outras como S. americanum distribuem-se
em praticamente todos os biomas terrestres. Esse fato pode ser atribuído à grande diversidade de espécies e de hábitos de vida desse grupo, apresentando desde árvores, arbustos, ervas e lianas, às vezes semiepífitas (Markea e Juanulloa), ou ervas rizomáticas, quase acaules
(Jaborosa), muitas vezes armadas (Acnistus, Grabowskia e Solanum) ou inermes
(Albuquerque, Velazquez, Vasconcellos-Neto, 2006).
Maia, A. I. V. 13
1.2. Considerações gerais sobre o gênero Acnistus
O gênero Acnistus é constituído por aproximadamente 60 espécies, encontradas como
arbustos e pequenas árvores, desde o México até o sul da Argentina. No que diz respeito à sua distribuição geográfica no Brasil, a região sudeste é a que apresenta maior riqueza de espécies do gênero, não eliminando a possibilidade de ocorrência em outras regiões brasileiras (Carvalho, Costa e Duarte, 2001).
Plantas deste gênero constituem uma rica fonte de vitaesteróides, lactonas esteroidais de esqueleto do tipo ergostano. Acnistinas, vitanolidos, jaborols e vitafisalinas são exemplos de vitaesteróides isolados de espécies do gênero Acnistus (Ray & Gupta, 1994).
1.3. Considerações gerais sobre Acnistus arborescens L. Schltdl
A. arborescens (Fig. 8, p. 14) pode ser encontrada tanto na forma de arbusto como árvore
de pequeno porte, é popularmente conhecida como esporão de galo falso, marianeira, ou simplesmente, mariana. Nativa das Américas do Sul e Central, México e Antilhas, A. arborescens é utilizada na medicina popular como diurético, no tratamento de hemorróidas e
Maia, A. I. V. 14 Pio Corrêa (1984) descreve A. arborescens como:
“Arbusto até 3 m ou árvore regular até 10 m de altura; casca parda, rugosa, inerme, ramos eretos, patentes, às vezes nodosos; folhas alternas, pecioladas (pecíolo de 1-3 cm), elípticas até oblongas ou ovado-elípticas, agudas ou obtusas no ápice e muito estreitas na base, de 5-15 cm de comprimento, inteiras, glabras na página superior e flocoso-pubescentes na inferior; flores pediceladas, branco-esverdeadas, aromáticas, dispostas em fascículos sésseis laterais, multifloros; cálice campanulado-infundibuliforme, irregularmente crenado; ovário bilocular, fruto baga globosa, amarela de 5-6 mm de diâmetro, contendo sementes brancas”.
Figura 8–A. arborescens em seu habitat natural: Serra de
Guaramiranga, Pacoti - CE
F
otos :
P
rof
. Edil
be
rto
R
oc
ha
S
il
ve
Maia, A. I. V. 15
2. Revisão bibliográfica sobre vitaesteróides
Neste capítulo de revisão bibliográfica será registrado as estruturas de todos os novos vitaesteróides encontrados nos últimos dois anos (2008-10/2010) incluindo seus dados de RMN 13C. A busca foi realizada no “Scifinder scholar” utilizando os termos “withasteroids”, “withanolides”, “whitaphysalins”, “physalins”, “acnistins”, “ixocarpalactones” e “perulactones”. Este levantamento teve como objetivo atualizar uma revisão publicada recentemente (Veras, et. al., 2010) pelo nosso grupo de pesquisa. Essa revisão reuniu dados de dezoito anos (1990-2008) sobre a química e farmacologia dos vitaesteróides. Nesses 18 anos foram registrados o isolamento de 618 vitaesteróides a partir de espécies de 21 gêneros da família Solanaceae (Acnistus, Brachistus, Datura, Deprea, Discopodium, Dunalia, Exodecomus, Hyoscyamus, Iochroma, Jaborosa, Lycium, Nicandra, Physalis, Salpichroa, Saracha, Solanum, Trechonaetes, Tubocapsicum, Vassobia, Withania e Witheringia), dos
gêneros Ajuga (Labiatae), Tacca (Taccaceae) e Cassia (Leguminosae) e da espécie marinha Minabea sp. Através da atualização desta revisão (2008-2010) foi registrado o isolamento de
58 vitaesteróides, isolados principalmente de espécies de gêneros pertencentes à família Solanaceae, incluindo o gênero Mandragora, o qual não havia sido reportado anteriormente.
Também foi verificado o isolamento de vitaesteróides do gênero Eucalyptus, pertencente à
família Myrtaceae. Dos 58 vitaesteróides registrados, 17 foram isolados do gênero Physalis e
22 do gênero Withania.
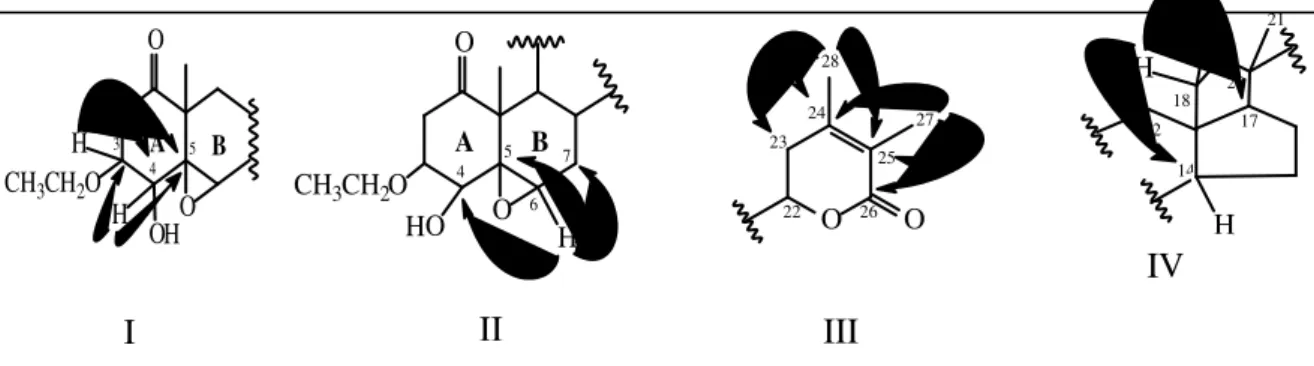
Os vitaesteróides são lactonas esteroidais (C-28) com esqueleto do tipo ergostano, ricos em funções oxigenadas que são as principais responsáveis pelas modificações estruturais, tanto do esqueleto esteroidal quanto da cadeia lateral, resultando em estruturas diversificadas e complexas (Glotter, 1991). Segundo Glotter, estes metabólitos podem ser agrupados da seguinte forma: vitanolidos (I), vitanolidos com anel A aromático (II), vitanolidos com anel D aromático (III), vitafisalinas (IV), fisalinas (V), acnistinas (VI), ixocarpalactonas (VII) e perulactonas (VIII).
O
O O
1 2
3
4 5 6
7 8 9 10
11 12 13
14 15 16 17 18
19
20 21
22 23
24 25
26 27 28
A B
C D
Maia, A. I. V. 16 Os vitanolidos derivados do ergostano, geralmente são oxidados em C-1, C-22 e C-26 e constituem o grupo mais abundante dos vitaesteróides, fato que pôde ser comprovado pela presente revisão bibliográfica, a qual, dentre os 58 vitaesteróides encontrados, foram registrados o isolamento de 56 novos vitanolidos e apenas 2 fisalinas.
O O
(I) Vitanolido
O
O O
(II) Vitanolido com anel A aromático
O OH
(III) Vitanolido com anel D aromático
O O
O O
(IV) Vitafisalina
HO O
O
O O
O
O O
(V) Fisalina
O O
OH
(VI) Acnistina
O O
(VII) Ixocarpalactona
O O
Maia, A. I. V. 17 Duas novas subclasses de vitanolidos foram relatadas, os baimantuoluosidos (4-6 e 10
-13) e baimantuoluolinos (7-9), os quais foram isolados das folhas de Datura metel. Os
baimantuoluosidos são vitanolidos contendo um -D-glicopiranosídeo localizado no carbono
β7 do anel E (δ-lactona α, -insaturada) (Yang et al., 2008 e 2010; Kuang et al., 2009).
O estudo das partes aéreas de Physalis virginiana deu origem ao isolamento de outra
subclasse de vitanolidos, os virginols (23, 24 e 25), característicos por possuírem um epóxi-lactol no anel E (Maldonado et al., 2010). O gênero Physalis também se destacou pelo
isolamento de vitanolidos citotóxicos como vitagulatina I (26) obtido de Physalis angulata
(Lee et al., 2008) e o fiperunolido A (14) de Physalis peruviana (Lan et al., 2009).
O gênero Withania se destacou por apresentar a maior diversidade de vitanolidos com
atividade biológica como o γ -O-sulfato-2,3-dihidrovitaferina A (31), uma pró-droga da
vitaferina A, obtido das partes aéreas de Withania somnifera (Xu et al., 2009). Outro
vitanolido obtido também de W. somnifera, contendo uma função sulfóxido (32) apresentou
inibição da enzima ciclooxigenase e a proliferação de células tumorais humanas (Mulabagal et al., 2009). Um vitanolido chamado vitaristatina (35) isolado de W. aristata apresentou
atividade diurética (Benjumea et al., 2009). Isolados da mesma espécie, os vitanolidos 36-39
apresentaram uma significativa atividade citotóxica (LLanos et al., 2010). De Withania coagulans, foram isolados seis vitanolidos (43-48) todos exibindo uma forte atividade
imunossupressora (Huang et al., 2009). Dos frutos de W. coagulans foi isolado um novo
vitanolido denominado coagulanolido (52) o qual exibiu uma significante atividade anti-hiperglicêmica (Maurya et al., 2008).
Conforme pode ser observado através desta atualização de dados, assim como através
do “review” (Veras, et. al., 2010), os vitaesteróides, em geral, constituem uma grande classe de compostos bioativos e muito provavelmente, são suas propriedades medicinais que motivam a investigação de plantas produtoras destes metabólitos secundários.
Biossíntese de vitanolídeos
Maia, A. I. V. 18
Physalis mínima var. indica e Datua metel. A participação de cada um destes compostos na
biossíntese dos vitaesteróides é uma possibilidade teórica.
(53) R=H (55) (56)
(54) R=OH
Trabalhos de biossíntese de vitanolídeos foram iniciados por Lockley, Rees e Goodwin (1976), que estudaram a incorporação de substratos radioativos nos vitanolídeos de
Withania somnifera, e concluiram que o 24-metileno-colesterol (53) é o verdadeiro precursor
dos vitanolídeos, ao invés de seu isômero de ligação dupla (55). O isolamento de (56) de
Withania coagulans levou o grupo de Levie (1983) a sugerir que este era mais um
intermediário na rota dos vitanolídeos que através da ciclização do C-22, do C-26 e os passos oxidativos adicionais podem levar à formação da típica lactona de seis membros na cadeia lateral dos vitaesteróides. Para a funcionalização dos anéis A e B, uma via razoável proposta pelo mesmo grupo (rota esquemática) envolve a hidroxilação do lado menos protegido do esteróide precursor 5-en-3-ol, como primeiro passo. A oxidação seletiva do 1-hidroxil desse intermediário e a subsequente desidratação da origem a 2,5-dien-1-ona. O isolamento de
vitaesteróides contendo o sistema 1α,γ -hidroxi-5-eno junto com aqueles que tem o
grupamento 2-en-1-ona das mesmas plantas confere veracidade a esta hipótese.
Rota esquemática proposta para a funcionalização dos anéis A e B.
Enquanto os vitanolídeos radioativos isolados de W. somnifera pela administração do
24-[28-3H]-metileno colesterol não foram submetidos à degradação para confirmar que a marcação ainda estava no C-28, Veleiro, Burton e Gros degradaram a vitaferina A marcada, obtida pela administração do [2-14C]-mevalonolactona das folhas de Acnistus breviflorus, a
H
HO
R
25 H
HO
OH
H
HO
HO HO
OH
HO