UNIVERSIDADE FEDERAL
DE OURO PRETO
Instituto de Ciências Exatas e
Biológicas
Dissertação
Síntese e Avaliação Biológica de
3,5-Diarilisoxazóis: Potenciais Agentes
Quimioterápicos Antimicrobianos e
Antichagásicos
Aline Aparecida Nunes de Souza
Programa de Pós-Graduação em Química
PPGQUIM
Ouro Preto
i
MINISTÉRIO DA EDUCAÇÃO E DO DESPORTO Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Programa de Pós-Graduação em Química
SÍNTESE E AVALIAÇÃO BIOLÓGICA DE 3,5-DIARILISOXAZÓIS: POTENCIAIS AGENTES QUIMIOTERÁPICOS ANTIMICROBIANOS E ANTICHAGÁSICOS
Área de concentração:
Química Orgânica
Ouro Preto/MG
Junho de 2016
iv AGRADECIMENTOS
Primeiro agradeço a Deus, por sempre me guiar pelos caminhos certos, os quais, me trouxeram nesse momento.
Aos meus pais Lelio e Neidimar e a meus irmãos Natália e Rafael, que foram, são e sempre serão a razão da minha força de vontade de sempre vencer, apesar dos obstáculos. Sem eles e o apoio deles nada disso seria possível! Amo vocês!
Ao meu orientador Prof. Jason, por ter me recebido tão bem em seu grupo de pesquisa, por ter me conduzido a um amadurecimento científico e por sempre me incentivar.
Agradeço as minhas amigas, que considero como irmãs, Paula e Ana Paula pela imensa ajuda que me deram, pelo apoio, pelas brincadeiras, pelos momentos de serenidade, de conversas longas, de desabafos, de risos misturados com lágrimas, pelos vários encontros fora da Universidade, e pela acolhida na casa de vocês, que agora considero como parte da minha família. Amizade para a vida toda!
Agradeço imensamente aos meus amigos Josierika, Marlon, Gleice, Viviane, Josilene, Priscila e Diego pelo companheirismo, amizade, conselhos e pelos momentos de alegria.
Ao Professor Marcelo Siqueira Valle e a Professora Viviane Rebello dos Santos Martins, por terem aceitado o convite para fazerem parte da minha banca.
A UFU, pela grande instituição de ensino que é e ter me proporcionado conhecimento suficiente para ingressar no Mestrado da UFOP.
Ao Prof. Anízio, que sempre me incentivou a continuar no caminho acadêmico, aprimorando sempre os conhecimentos.
A UFV, UNICAMP e UFMG por ceder o uso do aparelho de RMN, e aos técnicos que fizeram as análises.
A FioCruz e ao técnico Policarpo por se disponibilizar para a realização dos testes biológicos para Chagas.
v
SUMÁRIO
LISTA DE ESQUEMAS ... ...iii
LISTA DE FIGURAS ...iv
LISTA DE TABELAS...vi
LISTA DE ABREVIAÇÕES...vii
RESUMO...1
1. INTRODUÇÃO ... ...2
1.1 Doença de Chagas...2
1.1.1 A Epidemia da Doença de Chagas...2
1.1.2 Ciclo de vida do Tripanossoma cruzi...4
1.1.3. Quimioterapia para a Doença de Chagas...5
1.2 Isoxazóis...7
1.2.1 Importância e Relevância na Inovação de Fármacos...7
1.2.2 Obtenção de Isoxazóis 3,5-dissubstiuídos...9
2. REVISÃO DAS METODOLOGIAS PARA SÍNTESE DOS ISOXAZÓIS...10
2.1 Principais métodos para obtenção dos isoxazóis ...10
2.1.1 β-Dicetonas...10
2.1.2 Compostos carbonilados α-β insaturadas...10
2.1.3 Flavonas...11
2.1.4 Cicloadição...12
2.2 Moléculas Bioativas contra T.Cruzi ...14
2.2.1 1,2,4-Oxadiazóis...14
2.2.2 Derivados de nitroftalazinas...15
2.2.3 Nitroisoindóis...16
2.2.4 Tiazóis...17
2.2.5. Derivados de 3-nitrotriazóis...18
2.3 Considerações finais...19
3. OBJETIVOS...20
3.1 Objetivos gerais...20
3.2 Objetivos específicos...20
4. PARTE EXPERIMENTAL...21
4.1Técnicas utilizadas para a caracterização dos compostos...21
vi
4.2.1 Síntese dos Isoxazóis e seus Intermediários...21
4.2.2 Síntese da 3,5-dicloro-2-hidroxiacetofenona (40)...22
4.2.3 Síntese dos ésteres (41)...23
4.2.4 Síntese das β-dicetonas (42)...31
4.2.5 Síntese das flavonas (43)...33
4.2.6 Síntese dos isoxazóis a partir das β-dicetonas (44)...39
4.2.7 Síntese dos isoxazóis a partir das flavonas (44)...40
4.2.8 Alquilação dos isoxazóis (45)...45
5. RESULTADOS E DISCUSSÃO ...54
5.1 Síntese dos Isoxazóis e seus Intermediários...54
5.1.1 Síntese da 3,5-dicloro-2-hidroxiacetofenona (40)...54
5.1.2 Síntese dos ésteres (41)...57
5.1.3 Síntese das β-dicetonas (42)...61
5.1.4 Síntese das flavonas (43) ...64
5.1.5 Síntese dos isoxazóis (44) ...69
5.1.6 Alquilação dos isoxazóis (45)...76
6. TESTES BIOLÓGICOS...80
6.1 Avaliação da atividade antichagásica...80
6.1.1 Resultados...80
6.2 Introdução: Avaliação da atividade antimicrobiana...83
6.2.1 Resultados...84
7. CONCLUSÕES...86
8. REFERÊNCIAS...87
ANEXO I...92
ANEXO II...96
vii
LISTA DE ESQUEMAS
Esquema 1- Mecanismo de ação proposto para os fármacos Nifurtimox (1) e
Benzonidazol (2)...6
Esquema 2- Diferentes materiais de partida para obtenção dos isoxazóis...9
Esquema 3-Estudo da influência dos substituintes na razão isomérica ...10
Esquema 4-Metodologia para obtenção dos isoxazóis 3,5-dissubstituídos...11
Esquema 5-Rota sintética para obtenção dos isoxazois...12
Esquema 6-Formação de isoxazóis substituídos pelas reações de óxidos de nitrila com alcenos e alcinos...13
Esquema 7- Formação de isoxazóis 3,5-dissubstituídos pela cicloadição de óxidos de nitrila...13
Esquema 8- Rota sintética para a obtenção dos isoxazóis 3,5 dissubstituídos...20
Esquema 9-Equação reacional para a síntese do composto 40...54
Esquema 10- Proposta do mecanismo reacional para a síntese da 3,5-diclo-2-idroxiacetofenona (Rearranjo de Fries)...55
Esquema 11-Metodologia sintética para obtenção dos compostos 41a–41w...58
Esquema 12-Síntese dos compostos 42a–42w ...62
Esquema 13- Proposta de mecanismo reacional para a síntese das β-dicetonas (Rearranjo de Baker Venkataraman)...63
Esquema 14-Síntese dos compostos 43b a 43w...64
Esquema 15- Proposta de mecanismo reacional para a síntese das flavonas...65
Esquema 16-Rota sintética para obtenção dos isoxazóis através das β-dicetonas...68
Esquema 17- Síntese dos isoxazóis 3,5-dissubstituídos 44a a 44w...69
Esquema 18- Mecanismo reacional proposto para a formação dos isoxazóis...71
Esquema 19- Alquilação de alguns isoxazóis obtidos como mistura isomérica...76
viii
LISTA DE FIGURAS
Figura 1-Foto do transmissor do protozoário Tripanossoma cruzi...2
Figura 2- Pessoa picada pelo vetor (esquerda), comparação de um coração sadio com um no estágio crônico da doença de Chagas (direita)...3
Figura 3-Ciclo biológico do Tripanosoma cruzi...5
Figura 4-Estruturas Químicas do Nifurtimox (1) e Benzonidazol (2)...5
Figura 5-Isoxazol...7
Figura 6- Muscimol...7
Figura 7- Resultados da aplicação das moléculas na cepa Y do Tripanossoma cruzi....15
Figura 8-Resultados da aplicação das moléculas imidazol e derivados no nitroftalazinas das formas amastigota e tripomastigota do Tripanossoma cruzi...16
Figura 9- Resultados da aplicação das moléculas 3-alcoxi-1-alquil-5-nitroindazóis das formas amastigota e tripomastigota do Tripanossoma cruzi...17
Figura 10- Resultados da aplicação das moléculas 4-aril tiazolilo hidrazona da forma tripomastigota do Tripanossoma cruzi...17
Figura 11-- Resultados da aplicação das moléculas derivadas de triazóis da forma amastigota do Tripanossoma cruzi...18
Figura 12-Numeração das moléculas correspondente às nomenclaturas...22
Figura 13-Espectro de massas do composto 40...56
Figura 14- Espectro de RMN ¹H da 3,5-dicloro-2-hidroxiacetofenona em CDCl3 em aparelho de 300 MHz...56
Figura 15- Espectro de RMN ¹³C da 3,5-dicloro-2-hidroxiacetofenona em CDCl3 em aparelho de 75 MHz...57
Figura 16-Espectro de massas do composto 41b...59
Figura 17- Espectro de RMN ¹H 1-acetilfenil-4-metoxibenzoato em CDCl3 em aparelho de 500 MHz ...60
Figura 18- Espectro de RMN ¹³C 1-acetilfenil-4-metoxibenzoato em CDCl3 em aparelho de 125 MHz...61
Figura 19- Espectro de RMN ¹H da dicetona 42a em CDCl3 em aparelho de 300 MHz..64
Figura 20- Espectro de massas do composto 43b...66
ix Figura 21- Espectro de RMN ¹H 2-(4-metoxifenil)-4H-croman-4-ona em CDCl3 em
aparelho de 500 MHz...67
Figura 22- Espectro de RMN ¹H 2-(4-metoxifenil)-4H-croman-4-ona em CDCl3 em
aparelho de 125 MHz...68
Figura 23- Espectro de massas do composto 44c...71
Figura 24- Espectro de RMN ¹H 1''-(3-(4-metilfenil)isoxazol-5-il)fenol em DMSO em aparelho de 500 MHz...72
Figura 25- Espectro de RMN ¹H 1’’-(4-metoxifenil)isoxazol-5-il)fenol em DMSO em aparelho de 300 MHz...74
Figura 26- Espectro de RMN ¹³C 1’’-(4-metoxifenil)isoxazol-5-il)fenol em DMSO em
aparelho de 75 MHz...74
Figura 27- Espectro no IV do composto 44b...75
Figura 28-Espectro de RMN ¹H 5-(2-(benziloxi)fenil)-3-(4-metoxifenil)isoxazol em CDCl3
em aparelho de 400 MHz...77
Figura 29- Espectro de RMN ¹³C 5-(2-(benziloxi)fenil)-3-(4-metoxifenil)isoxazol em CDCl3
em aparelho de 100 MHz...78
Figura 30-Espectro no IV do composto 45b...78
x
LISTA DE TABELAS
Tabela 1- Medicamentos comercializados com estrutura base dos isoxazóis...8
Tabela 2- Dados sobre as reações para a síntese das dicetonas...31
Tabela 3-Valores dos rendimentos dos ésteres 41u a 41w...58
Tabela 4-Valores dos rendimentos das β-dicetonas 42a a 42w...62
Tabela 5-Valores dos rendimentos das flavonas 43a a 42w...;...65
Tabela 6-Valores dos rendimentos dos hidroxi-isoxazóis 44a a 44w...70
Tabela 7-Caracterização de isômeros e a razão entre os mesmos...73
Tabela 8- Caracterizações dos isoxazóis puros...75
Tabela 9-Valores dos rendimentos dos isoxazóis alquilados...76
Tabela 10-Caracterizações dos isoxazóis alquilados...79
Tabela 11-Resultados da atividade antichagásica de alguns isoxazóis 3,5-dissubstiuídos para as formas amastigota e tripomastigota do T.cruzi...81
Tabela 12- Resultados da atividade antimicrobiana de alguns isoxazóis 3,5-dissubstiuídos...84
xi
LISTA DE ABREVIAÇÕES
ADN - Ácido Desoxirribonucléico ARN - Ácido ribonucléico
Bnz - Benzonidazol
CCD – Cromatografia em Camada Delgada CIM – Concentração Inibitória Mínima DTNs - Doenças Tropicais Negligenciadas EM - Espectrometria de Massas
GABA – ácido 4-aminobutanóico
IC50– Concentração inibitória que causa morte de 50,0% dos parasitos
IV - Espectroscopia no Infra -Vermelho OMS – Organização Mundial da Saúde RMN - Ressonância Magnética Nuclear SI – Índice de Seletividade
sl – Simpleto largo
SN2 – Substituição Nucleofílica Bimolecular T.cruzi - Tripanossoma cruzi
0
RESUMO
A Tripanossomíase americana, também conhecida como doença de Chagas, está incluída na lista de Doenças Tropicais Negligenciadas e é endémico em 21 países latino-americanos. Os dois fármacos atualmente disponíveis para o tratamento da doença de Chagas são nifurtimox e benzonidazol e ambos resultam em muitos efeitos colaterais significativos. A doença é a chamada "doença negligenciada" porque os mercados de saúde em países afetados são insuficientes para atrair a indústria farmacêutica a investir em pesquisa e desenvolvimento. Assim, o maior obstáculo para o tratamento da doença tem sido a descoberta e desenvolvimento de novas entidades químicas capazes de atender esse déficit em inovação. O estudo descrito neste trabalho envolve a síntese e avaliação biológica de isoxazóis 3,5-diarilsubstituídos, pois os isoxazóis são uma classe relevante de compostos orgânicos comprovados biologicamente, como evidenciado pela sua presença na estrutura orgânica que compreendem muitos medicamentos aprovados no mercado atualmente. Embora os isoxazóis apresentem atividades biológicas como antiproliferativos, anticancerígenos e antimicrobianos, eles não foram totalmente explorados para as suas atividades antiparasitárias. Partindo de 2-hidroxiacetofenonas e cloretos de benzoíla, as flavonas foram obtidas em três etapas; a esterificação, o Rearranjo Baker-Venkataraman e, finalmente, a desidratação / ciclização de 1,3-dicetonas para fornecer flavonas na penúltima etapa da nossa rota sintética. Infelizmente, não foi possível evitar a formação de uma mistura isomérica de isoxazóis. A presença de grupos doadores de elétrons na flavona favorece a reação de formação de um isoxazol de interesse. A mistura isomérica de isoxazóis foram alquiladas e purificadas para proporcionar 27 produtos, dos quais 19 são inéditos. Os melhores resultados de CIM contra bactérias gram-positivas S. aureus e L. monocytogenes foi <1,77 µM, bactérias gram-negativas E. coli 40,88 μM e para P. rettgeri, 7,02 μM foram os melhores resultados. No caso de
o fungo C. albicans o isoxazol mais ativo resultou num valor de CIM de 5,91 μM. O
isoxazol mais ativo contra as formas amastigota e tripomastigota de T. cruzi foi
1
Synthesis and Biological Evaluation of 3,5-Diarylisoxazoles: Potential Chemotherapeutic Antimicrobial and Antichagasic Agents
Abstract
The American trypanosomiasis, also known as Chagas disease, is included in the Neglected Tropical Diseases list and is endemic to 21 Latin American countries. The two drugs currently available for treating Chagas disease are nifurtimox and benznidazole and both result in many significant side effects. The disease is a so-called ―neglected disease‖ because health markets in affected countries are insufficient to attract pharmaceutical industry to invest in research and development. Thus, the biggest obstacle to treating the disease has been the discovery and development of new chemical entities able to meet this deficit in innovation. The study described in this dissertation involves the synthesis and biological evaluation of 3,5-disubstituted isoxazoles. This research project was motivated by the fact that isoxazoles are a proven biological relevant class of organic compounds as evidenced by their presence in organic structure that comprise many approved medicines on the market today. Although biologically active isoxazoles have demonstrated antiproliferative, anticancerous and antimicrobial properties, they have not been fully explored for their antiparasitic activities. Staring from 2-hydroxyacetophenones and benzoyl chlorides, flavones were obtained in a three steps; esterification, the Baker-Venkataraman Rearrangement and finally dehydration/ cyclisation of 1,3-diketones to provided flavones in the penultimate step of our synthetic route. Unfortunately, it was not possible to avoid the formation of an isomeric mixture of isoxazoles. The presence of electron donating groups on the reacting flavone favored the exclusive formation of the desired isoxazole. The isomeric mixture of isoxazoles were alkylated and purified to provide 27 products of which 19 were novel. The best MIC results against gram positive bacteria S. aureus and L. monocytogenes was <1,77 µM,
gram-negative bacteria E. coli was 40,88 μM and for P. rettgeri, 7,02 μM were the
best results. In the case of the fungus C. albicans the most active isoxazole gave a
MIC of 5,91 μM. The most active isoxazole against amastigote and trpymastigotes of
2
1. INTRODUÇÃO
1.1 Doença de Chagas
1.1.1 A Epidemia da Doença de Chagas
Um dos grandes problemas relacionados às doenças infecciosas, que a humanidade enfrenta, é a contínua mutação que os microrganismos sofrem e a resistência que eles adquirem aos medicamentos utilizados para interromper sua multiplicação celular. Esses fatores não se restringem apenas às bactérias, mas também é vista por outra classe de parasitos, os protozoários.1
Um exemplo que ilustra esse fato são as cepas de Tripanosoma cruzi, que
apresentam resistência aos medicamentos disponíveis. É um protozoário responsável pela transmissão de uma doença que atinge apenas mamíferos, e é típica dos Continentes Americanos, a Tripanossomíase americana.2
Descoberta pelo cientista brasileiro Carlos Chagas em 1909, a doença tornou-se popularmente conhecida como doença de Chagas, e sua transmissão no homem geralmente ocorre pela deposição de fezes contaminadas pelo T. cruzi após a
picada do barbeiro, um inseto hematófago do gênero Triatomíneo. O T. cruzi penetra
no organismo do hospedeiro vertebrado por rupturas na pele ou pela mucosa da boca e olhos, sendo a forma mais comum da transmissão, (Figura 1).3,4
Figura 1 - Foto do transmissor do protozoário Tripanossoma cruzi
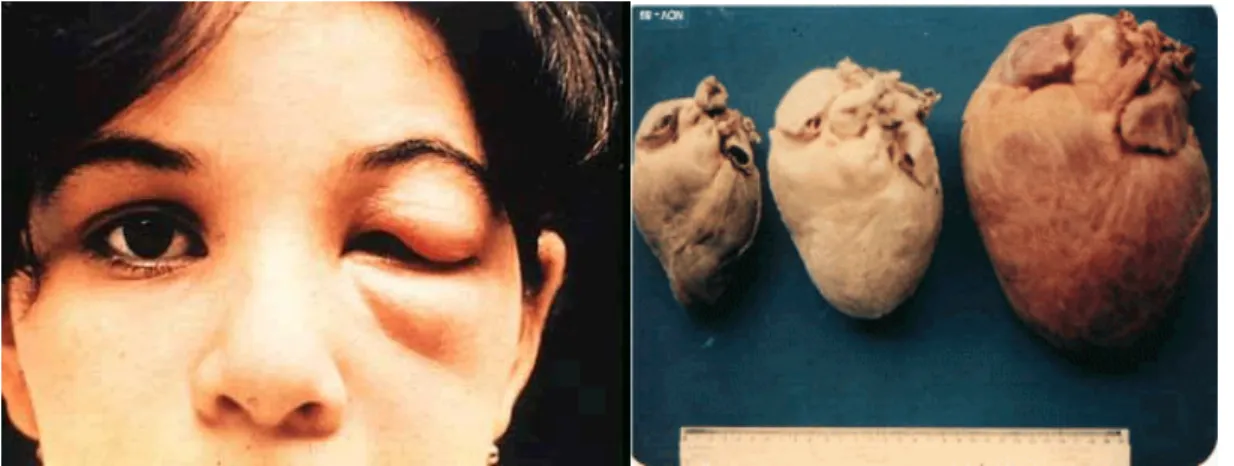
3 coração e o músculo digestivo. A fase crônica é diagnosticada pelas complicações cardíacas e digestivas causadas por alterações na fisionomia anatômica do miocárdio e do tubo digestivo. A picada desse inseto causa lesões na pele, provocando um sinal característico da infecção. (Figura 2).5,6
É uma doença que pode ser fatal, pela forma com que se manifesta em nosso organismo, pois, durante quase todo período de proliferação do parasito, é assintomática.7
Figura 2 - Pessoa picada pelo vetor (esquerda), comparação de um coração sadio com um no estágio crônico da doença de Chagas (direita)
O quadro de pessoas infectadas com doença de Chagas está em torno de 6 milhões na América Latina, região considerada endêmica. Especula-se que, cerca de 70 milhões de pessoas estejam em risco de contrair a doença. Pelo levantamento da OMS, essa doença causa 7000 mortes por ano e, menos de 1% da população infectada recebem tratamento.8
Os países de maior incidência de contaminação são: os Estados Unidos, a Argentina e o Chile. A preocupação agora também é com relatos do aumento de contaminação de pessoas em áreas fora do alcance de proliferação do vetor, como Canadá, Europa, Japão e Austrália, sendo a causa da transmissão transfusões de sangue e transplante de órgãos.8
4 Porém, atualmente casos de pessoas com a doença na fase aguda vêm crescendo, principalmente na área da Amazônia Legal.9,10
Em 2015, o Ministério da Saúde, fez um levantamento sobre o histórico da doença de Chagas aguda no Brasil, entre os anos de 2000 a 2013. Foram confirmados, 1570 casos da doença, sendo a forma de transmissão mais predominante a oral (1023 casos), seguida da congênita (329 casos), vetorial (70 casos) e por outras formas de transmissão menos decorrentes (148 casos). As regiões com maior incidência de infecção foram norte e nordeste, e as de menores números de casos nas regiões sul, centro-oeste e sudeste.11
1.1.2 Ciclo de vida do Tripanossoma cruzi
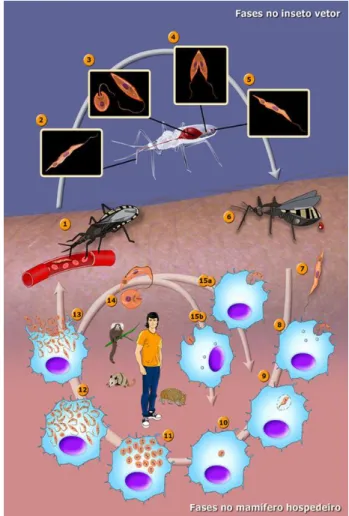
O ciclo de vida do protozoário (Figura 3) se inicia quando o vetor (1) se alimenta do sangue do hospedeiro vertebrado, já contaminado ingerindo as formas tripomastigotas sanguíneos (2), que são levados para o estômago do barbeiro e, acabam assumindo a forma epimastigotas (3), as quais são digeridas. As formas epimastigotas sobreviventes, vão para o intestino e começam a se multiplicar (4) e se aderem pelo flagelo às membranas que são secretadas pelas células intestinais. Em seguida, eles são levados para o intestino e assumem a forma de tripomastigotas metacíclicos (5), sendo eliminados na urina ou fezes do vetor. O hospedeiro é contaminado quando o vetor infectado elimina suas vezes e urina (6), transmitindo o parasito na sua forma alongada (7) através de ferimentos ou mucosas. Quando entram na corrente sanguínea, invadem uma gama de células nucleadas (8) e são fagocitadas (9), assumindo a forma amastigota (10). Nesse momento, uma multiplicação dessa forma acontece, podendo tomar conta do citoplasma (11). Transformam-se na forma tripomastigota (12), que acabam provocando a ruptura das células, devido a grande quantidade presente no interior das mesmas (13). A ruptura pode ocorrer antes da transformação total de amostigotas em tripomastigotas (14), sendo as duas formas responsáveis por infectar outra gama células (15a e 15b).12
5
Figura 3 - Ciclo biológico do Tripanosoma cruzi
1.1.3. Quimioterapia para a doença de Chagas
Desde a década de 60, apenas dois medicamentos são responsáveis pelo tratamento da doença de chagas: o nifurtimox (3-metil-N-[(5-nitro-2-furfuril)
metileno]-4-timorfolinoamina-1,1-dióxido) (1), comercializado pela farmacêutica Bayer e o Benzonidazol (2-nitro-N-(fenilmetil)-1H-imidazol-1-acetamida) (2) atualmente
comercializado pelo Laboratório Farmacêutico de Estado de Pernambuco (LAFEPE), (Figura 4). 11
H N
O N
N NO2
S N N
O NO2
O O
(1) (2)
6 Esses compostos nitroderivados são pouco eficazes na fase crônica, e apresentam melhor atividade na fase aguda. Diversos efeitos colaterais, também são associados durante o tratamento de pacientes com esses fármacos. O benzonidazol pode causar edema, febre, erupção cutânea, e da mesma forma, o nifurtimox pode provocar perda de peso, erupção cutânea, psicose, náuseas, vômitos, leucopenia, neurotoxicidade e anormalidades do tecido.13
O nifurtimox não é mais comercializado no Brasil e em outros países, devido sua elevada toxicidade e pouca seletividade para combater o parasito.
O grupo nitro nas estruturas dos dois medicamentos é de grande importância para o efeito tripanocida. O mecanismo de ação desses medicamentos (Esquema 1) ocorre pela inibição e degradação da síntese do ADN, ARN e proteínas do parasito.
Benzonidazol R-NO2
R-NH2 R-NO / R-NHOH Nitroredutases
proteínas lipídeos DNA
HO- + HO- Fe3+O2- + H2O2 HABER WEISS
Nifurtimox R-NO2
R-NO2
-nitro anion radical Nitroredutases O
2-ciclo redox O2 SOD
2H+
Esquema 1 - Mecanismo de ação proposto para os fármacos Benzonidazol e Nifurtimox
Os quimioterápicos produzem metabólitos citotóxicos oxigenados altamente reativos ou radicais livres. O grupo nitro presente nessas drogas é reduzido formando o intermediário ânion nitro radicalar (R-NO2•-), que consequentemente,
forma hidroxiaminas correspondentes pela ação de enzimas do tipo nitroredutases.14
7 parasito, inibindo o ciclo de reprodução celular. Já para o benzonidazol, o efeito tripanocida do nitro radicalar formado está associado com ligações covalentes em macromoléculas do parasito.14
Com os efeitos colaterais destes dois medicamentos utilizados, e a resistência de cepas desse protozoário, torna-se necessário a formulação de novos medicamentos que atuem por diferentes modos de ação ou através de outros mecanismos biológicos.
1.2 Isoxazóis
1.2.1 Importância e Relevância na Inovação de Fármacos
Azóis são compostos aromáticos heterocíclicos de cinco membros, que contém um grupo azo e pelo menos mais um heteroátomo (N, S, O),
os quais apresentam poucas aplicações na indústria farmacêutica e na síntese orgânica de moléculas complexas. Um grupo dessas moléculas que tem ganhado atenção devida suas propriedades biológicas, são os chamados isoxazóis (3) (Figura 5).15
Figura 5 - Isoxazol Seu nome foi proposto pelo pesquisador Hantsch, e que tem a contagem de átomos iniciada no oxigênio. Os compostos isoxazolínicos são utilizados como intermediários na síntese de compostos como o muscimol (4) (Figura 6), que é um potente e seletivo agonista para os receptores GABA (ácido 4-aminobutanóico, principal neurotransmissor no sistema nervoso central).
Uma desordem nesses receptores está associada com doenças como epilepsia, esquizofrenia e doença de Huntington (afetando a coordenação muscular).15
Figura 6 - Muscimol Os isoxazóis e seus derivados são considerados heterocíclicos de grande importância, devido às suas propriedades biológicas, tais como agentes antiiperglicêmicos, agentes antiproliferativos, antitumorais, potentes receptores agonistas e antagonistas (estímulos provocados devido ao aumento ou diminuição de atividade celular), antivirais, antimicrobiais, ulcerogênicos, dentre outros.16,17
Na Tabela 1 são apresentados alguns isoxazóis e suas aplicações.
1 2 3 4
5 O N
R1 R2
R3
(3)
(4) N O
8
Tabela 1: Medicamentos comercializados com estrutura base dos isoxazóis.
Nome Estrutura Aplicação
Leflunomida18
(5) F3C
N H
O
O N
Indicado para artrite
reumatoide, inibindo a
destruição das articulações.
Cloxacilina19
(6) N O Cl O H N N O S OH O H
É um antibiótico do grupo das penicilinas, agindo em bactérias como Streptococcus pyogene pneumoniae e Staphylococcus aureus epidermidis.
Sulfisoxazol20
(7)
H2N S
O
O NH
N O
Possui atividade antibiótica contra uma ampla gama de bactérias Gram-positivas e Gram-negativas.
Isocarboxazida21
(8)
H N N H O O N
Eficaz no tratamento da depressão e síndrome do pânico.
Broxaterol22
(9)
N O
OH H N
Br
Indicados para o tratamento de asma e outros distúrbios pulmonares.
Sitaxentano23
(10) N O Cl NH S O O S O O O
9 Nestes exemplos, o isoxazol é importante pela atividade farmacológica e é capaz de se envolver em interações doador/receptor em ligações de hidrogênio com uma variedade de enzimas receptoras indisponíveis para outros sistemas aromáticos.
1.2.2 Obtenção de isoxazóis 3,5-dissubstiuídos .
Um grande desafio para o uso dessas abordagens é escolher condições adequadas que direcionem seletivamente a reação com hidroxilamina em um dos seus dois centros eletrofílicos.
Como neste trabalho o estudo é voltado para a síntese e aplicação de moléculas isoxazolínicas 3,5-diarilsubstituídas, foi feito o levantamento apenas das metodologias aplicadas para a obtenção dessa estrutura.
As principais reações para a obtenção dos compostos 3,5-diarilisoxazóis (11) envolvem a utilização de chalconas (12) (cetonas α-β insaturadas), β-dicetonas (13), flavonas (14) e a ciclocondensação de óxidos de nitrilas (15) com alcinos (16), métodos esses largamente utilizados, (Esquema 2).24
(11) (12)
(13)
(14)
(15) (16) N O
Ar1 Ar2
O
O O
O O
+ N O
10
2 REVISÃO DAS METODOLOGIAS PARA SÍNTESE DOS ISOXAZÓIS
2.1 Principais métodos para obtenção dos isoxazóis
2.1.1 β-Dicetonas
Segundo Bandeira e colaboradores (1992), os efeitos estéricos e eletrônicos dos substituintes no grupo aril das β-dicetonas, que reagem com o cloridrato de hidroxilamina, tem grande influência na obtenção em maior proporção de um isoxazol, ou até mesmo a formação de um único regioisômero. Em um estudo feito por eles, foi possível observar que grupos arilas deficientes em elétrons na posição 3 formam um isômero em maior excesso.
Quando o meio neutro é atingido para promover a reação, os grupos arilas ricos em elétrons proporcionam esse excesso. Outra observação foi a formação de um único isômero, quando grupos arilas na posição 5 são muito substituídos, principalmente na posição orto. Porém, os rendimentos de alguns isoxazóis
diminuíram drasticamente devido o grande efeito estérico, (Esquema 3).25
(17)
(19) (18)
Ph Ph' Rend% (A) Razão Rend% (B) Razão
Ar 4-OMeC6H4 71 60:40 67 60:40 Ar 4-NO2C6H4 76 27:73 74 70:30 3-NO2C6H4 4-OMeC6H4 73 63:37 67 38:62 4 - NO2C6H4 4-OMeC6H4 85 73:23 66 40:60 4-OMeC6H4 Mesitil 48 100:0 35 100:0 3 - NO2C6H4 Mesitil 48 100:0 30 100:0 2 - NO2C6H4 Mesitil 8 100:0
-N
O N
O Ph
Ph'
Ph'
Ph +
Método A
1)HONH.HCl, MeOH, refluxo 2) HClconc.
Método B NH2OH/MeOH, refluxo
Ph
O O
Ph'
Esquema 3 - Estudo da influência dos substituintes na razão isomérica
2.1.2 Compostos carbonilados α-β insaturadas
11 utilizando uma gama de cetonas α,β-insaturadas (obtidas a partir de uma acetofenonas e benzaldeídos em meio básico com etanol) com o cloridrato de hidroxilamina em meio básico. Depois, inseriu nesses compostos um grupo de ácido carboxílico através da reação com o ácido 2-cloro acético em meio básico (Esquema 4).26
(21) (20)
(22) (23)
R1 R2 R3 R4 Rend. %
Ph H OH OCH3 70,2 Ph H CH2COOH OCH3 76,6 Ph OH H H 62,6 Ph CH2COOH H H 71,6 C7H7F H OH H 63,4 C7H7F H CH2COOH H 70,3 R1
O
(0,01 mol)
R2 R3
R4
O
R5
HONH2.HCl (0,01 mol)
KOH/MeOH (0,02 mol)
N O HONH2.HCl
(0,01 mol) KOH/MeOH (0,02 mol) HO HO R5 R2 R3
R4 NO
R1
Comp. R5 Rend. %
23a C8H10O 69,5
23b C7H7Cl 63,1
23c C5H6O 60,8 Comp. 21a 21b 21c 21d 21e 21f
Esquema 4 - Metodologia para obtenção dos isoxazóis 3,5-dissubstituídos
Os rendimentos obtidos foram razoáveis, e essas moléculas foram testadas quanto a sua atividade como hipolipidêmico in vivo, com bons resultados.
2.1.3 Flavonas
As flavonas reagem facilmente com o cloridrato de hidroxilamina. No estudo desenvolvido por Aitmambetov, Khilya, Kubzheterova (2000), os hidroxi-isoxazóis e seus derivados foram obtidos através de flavonas com diferentes substituintes, reagindo com o cloridrato de hidroxilamina na presença de piridina (Esquema 5).27
12
(26) (25)
(24)
O
O R1 R2
R3
Comp. R1 R2 R3 Rend. %
25a H Me H 53
25b H H Cl 71
25c H H H 31
25d H Me Me 63
25e Cl H Cl 69
25f H OMe H 67
25g H H NO2 73 HONH2.HCl
18 mmol piridina, 110 ºC 10 hs OH R1 R2 R3 N O OH R1 R2 R3 O N +
Não é formado Esquema 5 - Rota sintética para obtenção dos isoxazóis
Eles observaram que se a reação for mantida em refluxo, uma mistura isomérica é obtida para todos os compostos. Os melhores resultados obtidos, foram aqueles em que os substituintes do aromático eram grupos retiradores de densidade eletrônica. Segundo eles, o isômero obtido preferencialmente é aquele em que o átomo de oxigênio do anel de cinco membro está mais próximo da hidroxila do que o átomo de nitrogênio.27
2.1.4 Cicloadição
Reações de óxidos de nitrila (27) com alcenos (28) (com subsequente aromatização oxidativa ou espontânea) e também com alcinos (29) promovem a formação de isoxazóis substituídos (30). Uma reação lateral observada é a cicloadição com dipolarófilos formando dímeros de furoxans (31) (Esquema 6). A proporção entre estes dois processos é determinada pela reatividade do dipolarófilo e fatores estéricos. Os óxidos de nitrila geralmente são gerados in situ pelos
13 (27)
(28) (29)
(30) (31)
R1 N H (X) OH R1 N X OH Base
-HX R1 N O
O2N R1 -H2O
Ox. R1 N H OH N N O R1 R1
O N O R1 N O R1
R2 R2
R2 Ox.
R2
(X) Agente de halogenação, X (halogênio), Ox (oxidante)
(1) (2)
(3)
Esquema 6 - Formação de isoxazóis substituídos pelas reações de óxidos de nitrila com alcenos e alcinos.
Cicloadição de oxidos de nitrila, gerado através da desidroalogenação de cloretos de N-hidroximidoil (32) sob condições ácidas, para alcinos terminais (29), é
na maioria das vezes altamente regiosseletiva para a formação dos isoxazóis 3,5-dissubstituídos (30). Para formar preferencialmente esses compostos, catalisadores de cobre (33) vêm sendo utilizados, (Esquema 7).28
(33) (32)
R1
NOH Cl
+ R2
1) CuSO4.5H2O(0,2 mol%), KHCO3, H2O - n-BuOH (1:1),
20 ºC, 14 h
2)
O O
OH ONa HO
HO (10 mol%)
N O R1
R2 (29)
(30)
14 2.2 Moléculas bioativas contra T.Cruz
Sabe-se que, alguns estudos têm sido desenvolvidos para avaliar o efeito de quimioterápicos na inibição da multiplicação celular do Tripanossoma cruzi, sem
afetar de forma agressiva as células dos hospedeiros. Porém, poucos são levados adiante para testes in vivo, devido a elevada toxicidade para as células dos
hospedeiros, tornado assim o desenvolvimento de um tratamento eficaz mais complicado.
O presente levantamento bibliográfico, relata alguns importantes trabalhos envolvendo a síntese de moléculas que contém como base a estrutura de um heterocíclico de cinco membros, e a aplicação desses compostos em testes de atividade anti T. cruzi, sobre as formas infectantes amastigotas ou tripomastigotas
sanguíneos e ensaios de citotoxicidade em células de mamíferos, com intuito de desenvolver novos fármacos para combater o Tripanossoma cruzi. Os resultados
das atividades são expressos em valores de IC50 (concentração dos compostos que
matam 50% dos parasitos). Foi dada ênfase aos estudos relacionados a essas moléculas, pois o foco deste estudo é a síntese e aplicação de isoxazóis.
2.2.1 1,2,4-Oxadiazóis
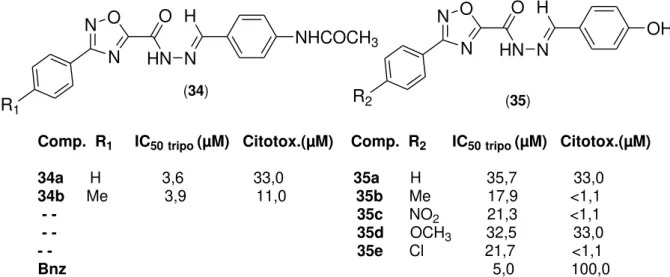
Pelo fato dos 1,2,4-oxadiazóis terem estruturas relacionadas com agentes antitripanossomicidas, Filho e colaboradores (2009), sintetizaram e avaliaram o potencial dos compostos 3-(4-aril-substituído)-1,2,4-oxadiazóis (34) contra a forma infectante tripomastigota do T. cruzi. A citotoxicidade dos compostos foi testada em
15 (35)
(34)
Comp. R1 IC50tripo (µM) Citotox.(µM) Comp. R2 IC50tripo (µM) Citotox.(µM)
34a H 3,6 33,0 35a H 35,7 33,0
34b Me 3,9 11,0 35b Me 17,9 <1,1
- - 35c NO2 21,3 <1,1
- - 35d OCH3 32,5 33,0
- - 35e Cl 21,7 <1,1
Bnz 5,0 100,0 R1
N O
N O
HN N H
NHCOCH3
R2
N O
N O
HN N H
OH
Figura 7 - Resultados de IC50 e citotoxicidade da aplicação das moléculas 1,2,4-oxadiazóis na atividade anti T. cruzi
As moléculas foram obtidas pela condensação entre hidroxibenzimidamidas com o metil-2-cloro-2-oxoacetato, seguida da reação intramolecular com derivados de benzaldeídos substituídos. Os compostos 34a e 34b, apresentaram melhores resultados de IC50 e de citotoxicidade que o padrão benzonidazol. Os outros
compostos 35a a 35e foram menos ativos que o fármaco de referência benzonidazol, mas os compostos 35a e 35d apresentaram melhor atividade. O grupo amida tem grande influência na atividade dos compostos34a e 34b, quando comparado com seus derivados 35a e 35b. Outra influência são a dos grupos fortemente retiradores e doadores, que diminuem a atividade quando comparado do
35a ao 35e.29
2.2.2 Derivados de nitroftalazinas
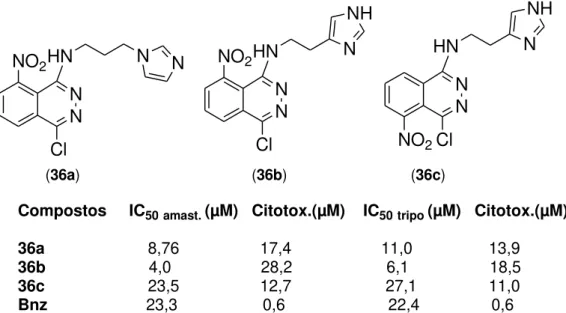
Olmo e colaboradores (2015), sintetizaram e testaram in vitro contra as
formas amastigota e tripomastigota do T. cruzi, derivados de nitroftalazinas (36),
16 (36a)
Compostos IC50amast. (µM) Citotox.(µM) IC50tripo (µM) Citotox.(µM)
36a 8,76 17,4 11,0 13,9
36b 4,0 28,2 6,1 18,5
36c 23,5 12,7 27,1 11,0
Bnz 23,3 0,6 22,4 0,6
N N NO2HN
Cl
N N
N N NO2HN
Cl
N NH
N N HN
Cl
N NH
NO2 (36b) (36c)
Figura 8 - Resultados de aplicação das moléculas imidazol e derivados no nitroftalazinas das formas amastigota e tripomastigota do Tripanosoma cruzi
As moléculas foram obtidas pela condensação entre o 1,4-dicloro-5-nitroftalazina e um derivado do imidazol. A posição em que o imidazol é adicionado interfere na atividade, assim como a posição do grupo NO2,que diminui a atividade e
seletividade quando está distante do grupo imidazol. Alguns valores de IC50 foram
satisfatórios, uma vez que, foram bem abaixo que o medicamento padrão, porém, os mesmos apresentaram maior toxicidade que o benzonidazol.30
2.2.3 Nitro-isoindóis
Muro e colaboradores (2014), sintetizaram e avaliaram compostos 3-alcoxi-1-alquil-5-nitro-isoindóis (37), com base no fato de que os heterocíclicos com grupo NO2 aumentam a seletividade dos compostos, em estudos anteriores realizados por
17 (37a)
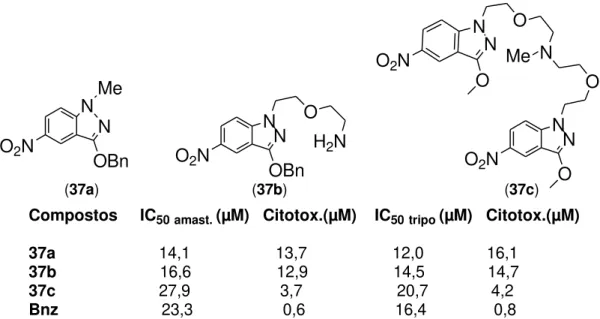
Compostos IC50amast. (µM) Citotox.(µM) IC50tripo (µM) Citotox.(µM)
37a 14,1 13,7 12,0 16,1
37b 16,6 12,9 14,5 14,7
37c 27,9 3,7 20,7 4,2
Bnz 23,3 0,6 16,4 0,8
N N N N Me OBn O2N
O2N
O O N Me O N N O O2N
N N
OBn O2N
O H2N
(37b) (37c)
Figura 9: Resultados da aplicação das moléculas 3-alcoxi-1-alquil-5-nitroindazóis das formas amastigota e tripomastigota do Tripanosoma cruzi
Essas moléculas foram obtidas pela alquilação dos derivados do 1-metil-5-nitroindazol. Todas as moléculas apresentaram maiores níveis de toxicidade do que o padrão Benzonidazol. Os valores de IC50 foram razoáveis.
2.2.4 Tiazóis
Na pesquisa desenvolvida por Caputto e colaboradores (2012), uma série de novos composto 4-ariltiazolilo-idrazonas (38) (Figura 10) foram sintetizados a partir de indanonas por irradiação de micro-ondas. As moléculas foram caracterizadas e avaliadas quanto a atividade antichagásica in vitro, contra as formas tripomastigota e
amastigota do parasito, utilizando a linhagem de células Vero. Os quatro derivados de tiazol apresentados (Figura 10) mostraram atividades superiores ao do benzonidazol para a forma infectante tripomastigota.32
(38)
Comp. R1 R2 R3 R4 IC50tripo (µM)
38a H H Me Me 17,24
38b H H Me Cl 20,01
38c H H OMe Cl 19,72
38d Me H H H 22,74
Bnz 30,26
N HN
S N R1 R2 R3 R4
18 Os resultados mostraram que os substituintes metílicos do composto 38a
podem ter sido responsáveis pelo aumento da atividade desse composto.32
Essas moléculas mais seletivas foram avaliadas contra a forma amastigota do protozoário, e as três primeiras apresentaram excelentes resultados com valores de
IC50 iguais a 0,72, 0,09 e 0,84 µM, respectivamente, sendo que o composto 38b
apresentou o menor, tornando-se um fármaco em potencial para teste in vivo.32
A avaliação da citotoxicidade mostrou que essas moléculas provocaram morte celular numa concentração de 100,00 µM, bem próxima a do Benzonidazol, 89,79 µM.32
2.2.5. Derivados de 3-nitrotriazóis
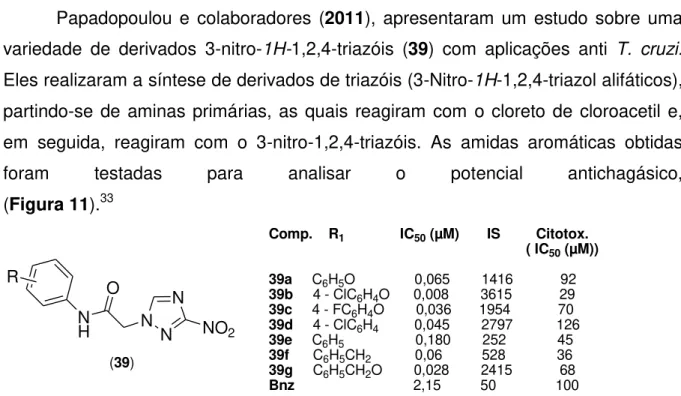
Papadopoulou e colaboradores (2011), apresentaram um estudo sobre uma variedade de derivados 3-nitro-1H-1,2,4-triazóis (39) com aplicações anti T. cruzi.
Eles realizaram a síntese de derivados de triazóis (3-Nitro-1H-1,2,4-triazol alifáticos),
partindo-se de aminas primárias, as quais reagiram com o cloreto de cloroacetil e, em seguida, reagiram com o 3-nitro-1,2,4-triazóis. As amidas aromáticas obtidas foram testadas para analisar o potencial antichagásico, (Figura 11).33
(39)
Comp. R1 IC50 (µM) IS Citotox. ( IC50 (µM)) 39a C6H5O 0,065 1416 92
39b 4 - ClC6H4O 0,008 3615 29
39c 4 - FC6H4O 0,036 1954 70
39d 4 - ClC6H4 0,045 2797 126
39e C6H5 0,180 252 45
39f C6H5CH2 0,06 528 36
39g C6H5CH2O 0,028 2415 68
Bnz 2,15 50 100 N
N
N NO2
O N H R
Figura 11 - Resultados da aplicação das moléculas derivadas de triazóis da forma amastigota do
Tripanosoma cruzi
Os derivados de 39a a 39g foram mais ativos do que o fármaco de referência, o Bnz (IC50 Bnz 2,15 µM). Claramente, a presença de grupos substituintes no
19 seletividade superiores a 50, sendo indicados para ensaios de atividade antichagásica in vivo.33
2.3 CONSIDERAÇÕES FINAIS
Nesse levantamento, foi possível verificar a dificuldade em se obter moléculas que sejam, ao mesmo tempo, ativas e mais seletivas que o benzonidazol. Apenas no estudo de Papadopoulou e colaboradores (2011), as moléculas apresentaram melhores atividades e foram altamente seletivas.
Nos outros estudos citados na revisão dessa dissertação, os resultados são promissores. Isso indica que esses compostos apresentam grande capacidade de se tornarem potenciais fármacos para combater o parasito transmissor da doença de Chagas.
Os compostos aromáticos têm destaque na busca de novos fármacos que interajam com o DNA dos parasitos transmissores de inúmeras doenças, pelo fato de apresentarem essa característica e por possuírem grande capacidade antimicrobiana.
Tendo em vista que os isoxazóis são heterocíclicos aromáticos, que seus derivados têm se tornado importantes, graças às propriedades biológicas e, que medicamentos com essas estruturas já são comercializados, torna-se de grande relevância aplicar essas moléculas contra o parasito T. cruzi, uma vez que elas são
obtidas através de três intermediários sintetizados de forma simples, e que nunca foram avaliados para tal fim.
O teste antichagásico deste trabalho foi realizado in vitro, contra as formas
amastigotas e tripomastigotas da cepa Tulahuen (modificada em laboratório para realização de testes contra o T.cruzi), a forma epimastigota foi desconsiderada uma
20
3 OBJETIVOS
3.1 Objetivo geral
Como compostos heterocíclicos são promissores para o tratamento da doença de Chagas e, que os isoxazóis são potenciais antimicrobianos e antifungicidas, tem-se como objetivo geral desse estudo sintetizar uma quantidade considerável de moléculas 3,5-diarilisoxazóis não simétricos (Esquema 8).
3.2 Objetivos específicos
Sintetizar uma gama de isoxazóis 3,5-diarilsubstituídos com bons rendimentos.
Avaliar a aplicabilidade das moléculas de forma preliminar como antimicrobianos.
Avaliar uma possível ação tóxica desses isoxazóis nas células do parasito
Tripanosoma cruzi nas formas amastigota e tripomastigota e a menor
concentração para tal efeito também de forma preliminar.
R O
Cl +
1) Piridina, 3 hs, t.a.
2) HCl 3,0 M
O O R O O OH R2
R1 1) Piridina, KOH 30min
50,0 ºC
2) CH3COOH 10%
R OH
O O
R1
R2
CH3COOH, H2SO4cat.
60min, 100,0 ºC
O O R R1 R2 N O R OH Piridina,
H2NOH.HCl
12hs, 110,0 ºC
R1
R2
1) K2CO3, , C6H5CH2Br
Acetona
24hs, 60,0 ºC
N O R O R1 R2 Ph
R R1 R2 4-MePh 4-OMePh Ph 4-ClPh 4-FPh 3,4,5-(OMe)3Ph Furano 3-NO2Ph Ph 3,4,5-(OMe)3Ph 4-ClPh 4-OMePh
R R1 R2 Ph
4-OMePh 4-FPh 3,4,5-(OMe)
3Ph 4- ClPh 3-NO2Ph Furano Ph 4-FPh
3,4,5-(OMe)3Ph 3-NO2Ph C4H3O H H
H H H H H H H H H H H H H H Cl Cl Cl Cl Cl Cl Cl Cl
Cl H Cl H Cl H Cl H Cl H Cl H Cl H OMe H OMe H OMe H OMe H OMe H
(40) (41) (42)
(43) (44)
(45)
21
4- PARTE EXPERIMENTAL
Para a cromatografia em camada delgada (CCD) foi utilizada a placa de sílica gel 60G. Após a eluição, elas foram observadas sob a lâmpada ultravioleta (λ = 254 nm). As purificações dos produtos finais foram realizadas por coluna cromatográfica utilizando a sílica gel 60 (70-230 mersh) como fase estacionária. As purificações dos intermediários (ésteres, β-dicetonas e flavonas) foram realizadas pela recristalização com metanol. As temperaturas de fusão foram determinadas em aparelho büchi Melting Point B-540.
4.1 Técnicas utilizadas para a caracterização dos compostos
Os espectros de Ressonância Magnética Nuclear de hidrogênio e carbono foram registrados em espectrômetros Bruker Avance 300 MHz (Departamento de Química, UFV), Bruker 400 MHz e 500 MHz (Departamento de Química, UNICAMP), Bruker Avance DRX 400 MHz e Bruker Avance DPX 200 MHz (Departamento de Química, UFMG). Os compostos foram solubilizados nos solventes clorofórmio deuterado e dimetilsufóxido-d6. Os espectros de massas foram obtidos em um
equipamento Shimadzu CG/MS-QP2010 Plus, e os espectros no Infravermelho foram obtidos no equipamento Varian 640-IR acoplado com MIRacle ATR FTIR Spectrometers, ambos multiusuários da UFOP.
4.2 Procedimentos de síntese e dados de caracterização 4.2.1Síntese dos Isoxazóis e seus Intermediários
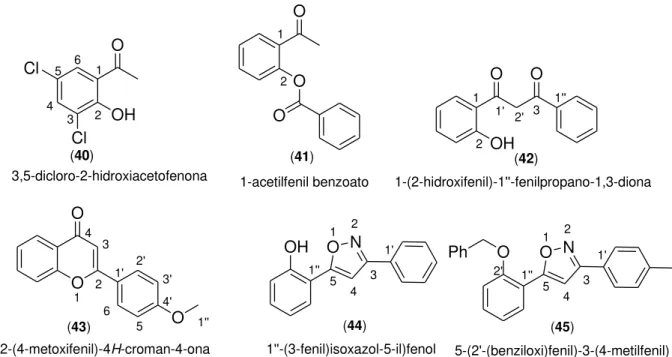
22 (41)
(40) (42)
(43) (44) (45)
1 2 3 4 5 6 O OH Cl Cl OH O O 1 2
1' 2' 3 1''
1-(2-hidroxifenil)-1''-fenilpropano-1,3-diona 1 2 1' 3 4 5 1'' N O OH 1''-(3-fenil)isoxazol-5-il)fenol 1 2 1' 2' 3 4 3' 4' 5 6 O O O 1''
2-(4-metoxifenil)-4H-croman-4-ona 3,5-dicloro-2-hidroxiacetofenona O O O 1 2 1-acetilfenil benzoato 5-(2'-(benziloxi)fenil)-3-(4-metilfenil) 1 2 1' 3 4 5 1'' N O O Ph 2'
Figura 12– Numeração das moléculas correspondente às nomenclaturas
As metodologias utilizadas para a síntese de todos os compostos, desde as hidroxiacetofenonas aos isoxazóis alquilados, estão descritos na literatura. 34, 35, 36, 37, 38, 39, 40
4.2.2 Síntese da 3,5-dicloro-2-hidroxiacetofenona (40)
Em um balão de fundo redondo (100,0 mL) foram adicionados o 2,4-diclorofenol (3,30 g; 20,37 mmol), o anidrido acético (2,80 mL; 30,55 mmol) e ácido acético glacial (20,0 mL) como solvente. Inicialmente, foi promovida a agitação da mistura reacional, à temperatura ambiente, e em seguida, foi adicionado o ácido sulfúrico em quantidade catalítica (0,5 mL). Posteriormente, o balão foi transferido para um banho de óleo a 90,0 ºC, durante 6 horas. Após o período reacional, foi adicionada uma solução saturada de NaHCO3 (50,0 mL) sendo feita a extração
líquido-líquido com água destilada (30,0 mL) e AcOEt (2 x 30,0 mL). As fases orgânicas reunidas foram secas com Na2SO4 anidro, filtradas, e o solvente
foi evaporado no rotaevaporador resultando em um óleo incolor (3,5 g em rendimento de 75,0 %). O óleo obtido foi utilizado sem purificação (3,40 g; 15,5 mmol) para reagir com o AlCl3 (2,0 g; 15,1 mmol). Essa mistura reacional foi
23 tempo, foi adicionada uma solução de HCl 6M (20,0 mL) à mistura reacional, que foi mantida em agitação por 30 minutos, sendo formado uma sólido branco que foi filtrado a vácuo e recristalizado com uma solução de metanol/água (1:1).
Rendimento: 2,8 g (88,6 %)
Características: sólido branco
Tf: 95,1 – 100,0 °C (Lit. = 95,0°C)41
CCD: Rf= 0,6 (30,0 % de AcOEt/Hex)
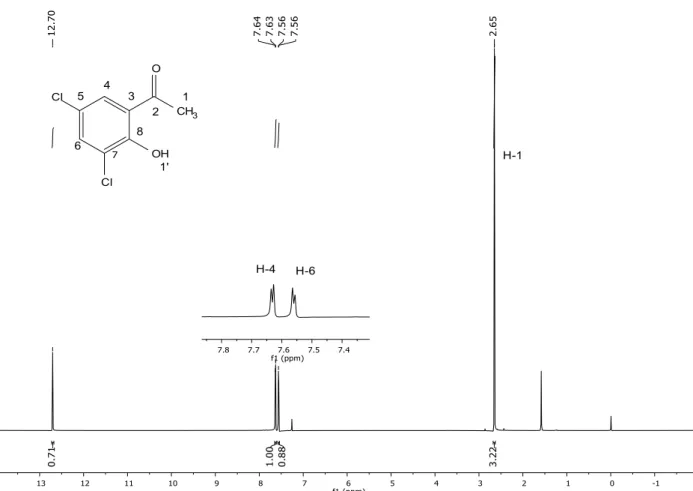
1 2
7 8 3 4 5
6
1' O
OH Cl
Cl
RMN 1H ppm (300 MHz, CDCl
3): δ = 2,6 (s, 3 H, H-1); 7,6 (d, J = 2,4 Hz, 1H, H-6);
7,6 (d, J = 3 Hz, 1H, H-4); 12,7 (sl, 1H, OH) sl = simpleto largo
RMN 13C ppm (75 MHz, CDCl3): δ = 26,82 (C-1); 120,61 (C-3); 123,33 (C-7); 123,98
(C-5); 128,47 (C-6); 135,91 (C-4); 156,84 (C-8); 203,42 (C-2)
EM m/z: 204 (40%), 189 (100%), 133 (30%), 97 (20%)
4.2.3 Síntese dos ésteres (41)
Em um balão de fundo redondo (50,0 mL) foram adicionados a hidroxiacetofenona (1,0 equivalente) e a piridina (8,0 mL) como base, sendo promovida a agitação durante 5 minutos antes de adicionar o cloreto de benzoíla (1,5 equivalente) em banho de gelo. Após esse processo, a mistura reacional foi deixada em temperatura ambiente no período de 1-3 horas e acompanhada por CCD. Após o período reacional, foi adicionado ao balão, uma solução de HCl 3,0 M (30,0 mL) e um pouco de gelo, que levaram a formação dos sólidos. Os ésteres formados foram filtrados a vácuo, e recristalizados em metanol a quente.
24
Nome: 4-metilbenzoato de 1-acetilfenil (41a)
Reagentes: Hidroxiacetofenona (10,0 mmol) e cloreto de 4-metilbenzoíla (15,0 mmol)
Rendimento: 2,5 g (100,0 %)
Características: sólido branco
Tf: 84,4 – 85,0 °C (Lit. = 99,0 – 109,0 °C)42
CCD: Rf= 0,8 (30,0 % de AcOEt/Hex)
O O O 1 2 7 8 3 4 5 6 9 14 13 12 11 10
RMN 1H ppm (300 MHz, CDCl3):δ = 2,5 (s, 3H, H-14); 2,5 (s, 3 H, H-1); 7,2 (d, J = 9
Hz, 1H, H-7); 7,3 – 7,4 (m, 3H, H-5 e H-12); 7,6 (t, J = 9 Hz, 1H, H-6); 7,9 (d, J = 6
Hz, 1H, H-4); 8,1 (d, J = 9 Hz, 2H, H-11) RMN 13C ppm (75 MHz, CDCl
3): δ = 22,0 (C-14); 30,2 1); 124,2 7) 126,3
(C-5); 129,7 (C-12); 129,8 (C-10); 130,5 (C-3); 130,6 (C-11); 130,9 (C-4); 133,6 (C-6); 145,0 (C-13); 149,7 (C-8); 185,4 (C-9); 197,9 (C-2)
EM m/z: 119 (100%); 91 (40%)
Nome: 4-metoxibenzoato de 1-acetilfenil (41b)
Reagentes: Hidroxiacetofenona (10,0 mmol) e cloreto de 4-metoxibenzoíla (15,0 mmol)
Rendimento: 2,7 g (100,0 %)
Características: sólido branco
Tf: 106,0 -106,5 °C (Lit. = 115,0 – 116,0 °C)43
CCD: Rf= 0,5 (30,0 % de AcOEt/Hex)
O O O 1 2 7 8 3 4 5 6 9 14 13 12 11 10 O
RMN 1H ppm (500 MHz, CDCl3): δ = 2,6 ppm (s, 3 H, H-1); 3,9 ppm (s, 3H, H-14);
7,0 ppm (d, J = 9 Hz, 2H, H-12); 7,3 ppm (d, J = 10 Hz, 1H, H-7); 7,4 ppm
(t, J = 8 Hz, 1H, H-5); 7,6 ppm (t, J = 10 Hz, 1H, H-6); 7,9 ppm (d, J = 8 Hz, 1H, H-4), 8,2 ppm (d, J = 9 Hz, 2H, H-11)
RMN 13C ppm (125 MHz, CDCl
3): δ = 29,9 (C-1); 55,58 (C-14); 114,0 (C-12) 121,5
(C-10); 123,9 (C-7); 126,0 (C-5); 130,2 (C-6); 131,6 (C-3); 132,5 (C-11); 133,3 (C-4); 149,5 (C-8); 164,1 (C-13); 164,8 (C-9); 197,7 (C-2)
25
Nome: benzoato de 1-acetilfenil (41c)
Reagentes: Hidroxiacetofenona (6,6 mmol) e cloreto de benzoíla (9,9 mmol)
Rendimento: 1,6 g (100,0 %)
Características: sólido branco
Tf: 87,0 – 88,0 °C (Lit. = 88,0 – 89,0 °C)44
CCD: Rf= 0,7 (30,0 % de AcOEt/Hex)
O O O 1 2 7 8 3 4 5 6 9 13 12 11 10
RMN 1H ppm (500 MHz, CDCl
3):δ = 2,6 (s, 3 H, H-1); 7,3 (d, J = 8 Hz, 1H, H-7); 7,4
(t, J =7,5 Hz, 1H, H-5); 7,57 (t, J = 8,5 Hz, 2H, H-12); 7,6 (t, J = 8 Hz, 1H, H-6); 7,7 (t, J = 7,5 Hz, 1H, H-13); 7,89 - 7,91 (d, J = 6,5 Hz, 1H, H-4); 8,3 (d, J = 8,5 Hz, 2H,
H-11)
RMN 13C ppm (125 MHz, CDCl3): δ = 29,8 (C-1); 123,9 7); 126,2 5) 128,7
(C-12); 129,3 (C-3); 130,3 (C-6); 130,4 (C-11); 131,4 (C-10); 133,5 (C-13); 133,9 (C-4); 149,4 (C-8); 165,2 (C-9); 197,6 (C-2)
EM m/z: 240 (3%), 105 (100%), 77 (70%)
Nome: 4-clorobenzoato de 1-acetilfenil (41d)
Reagentes: Hidroxiacetofenona (10,0 mmol) e cloreto de 4-clorobenzoíla (15,0 mmol)
Rendimento: 2,8 g (100,0 %)
Características: sólido branco
Tf: 89,0 °C (Lit. = 90,0 – 93,0 °C)44
CCD: Rf= 0,6 (30,0 % de AcOEt/Hex)
O O O 1 2 7 8 3 4 5 6 9 13 12 11 10 Cl
RMN 1H ppm (500 MHz, CDCl3):δ = 2,5 (s, 3 H, H-1); 7,4 (d, J = 8 Hz, 1H, H-7); 7,5
(t, J = 8 Hz, 1H, H-5); 7,6 (d, J = 8,5 Hz, 1H, H-6); 7,7 (d, J = 8,5 Hz, 2H, H-12); 7,9
(d, J = 8,5 Hz; 1H, H-4); 8,1 (d, J = 8,5 Hz, 2H, H-11); RMN 13C ppm (125 MHz, CDCl
3): δ = 29,9 1); 124,5 7); 127,0 5); 129,2
(C-6); 129,6 (C-12); 131,1 (C-4); 131,6 (C-10); 132,2 (C-11); 134,2 (C-3); 139,5 (C-13); 148,9 (C-8); 164,3 (C-9); 197,9 (C-2)
26
Nome: 4-fluorobenzoato de 1-acetilfenil (41e)
Reagentes: Hidroxiacetofenona (2,5 mmol) e cloreto de 4-fluorbenzoíla (3,7 mmol)
Rendimento: 0,3 g (50,0 %)
Características: sólido branco
Tf: 164,4 – 168,0 °C
CCD: Rf= 0,5 (30,0 % de AcOEt/Hex)
O O O 1 2 7 8 3 4 5 6 9 13 12 11 10 F
RMN 1H ppm (300 MHz, CDCl
3): δ = 2,5 (s, 3 H, H-1); 7,2 – 7,3 (m, 3H, H-7; H-2);
7,4 (t, J = 7,2 Hz; 1H, H-5); 7,6 (t, J = 7,8 Hz; 1H, H-6); 7,9 (d, J = 7,8 Hz, 1H, H-4); 8,3 (d, J = 8,4 Hz; 2H, H-11)
RMN 13C ppm (75 MHz, CDCl3): δ = 29,6 (C-1); 116,1 (d, JC-F= 24 Hz; C-12); 123,9
(C-7); 125,6 (d, JC-F= 3 Hz; C-10); 126,3 (C-5); 130,4 (C-6); 131,0 (C-3); 133,0 (d, J C-F= 9 Hz; C-11); 133,5 (C-4); 149,2 (C-8); 164,2 (C-9); 166,2 (d, JC-F= 254,25 Hz;
C-13); 197,5 (C-2)
Nome: 3,4,5-trimetoxibenzoato de 1-acetilfenil (41f)
Reagentes: Hidroxiacetofenona (5,8 mmol) e cloreto de 3,4,5-trimetoxibenzoíla (8,7 mmol)
Rendimento: 1,9 g (100,0 %)
Características: sólido branco
Tf: 125,0 – 126,0 °C (Lit. = 108,0 °C)45
CCD: Rf= 0,6 (30,0 % de AcOEt/Hex)
O O O 1 2 7 8 3 4 5 6 10 14 13 12 9 11 15 O O O
RMN 1H ppm (300 MHz, CDCl3): δ = 2,5 (s, 3 H, H-1); 3,9 (s, 9 H, H-14; H-15); 7,2
(d, J = 8,1 Hz, 1H, H-7); 7,4 (t, J = 5,7 Hz, 1H, H-5); 7,5 ppm (s, 2H, H-11); 7,6 (t, J =
7,5 Hz, 1H, H-6); 7,9 (d, J = 7,8 Hz, 1H, H-4) RMN 13C ppm (75 MHz, CDCl
3): δ = 29,7 (C-1); 56,3 14); 60,9 15); 107,4
(C-11); 123,9 (C-7) 124,1 (C-10); 126,2 (C-5); 130,3 (C-3); 131,1 (C-4); 133,5 (C-6); 142,9 (C-13); 149,3 (C-8); 153,1 (C-12); 164,8 (C-9); 197,7 (C-2)
27
Nome: furan-2-carboxilato de 1-acetilfenil (41g)
Reagentes: Hidroxiacetofenona (10,0 mmol) e cloreto de 2-furoíla (15,0 mmol)
Rendimento: 2,4 g (100,0 %)
Características: sólido branco
Tf: 89,5 - 90,0 °C (Lit. = 90,0 – 92,0 °C)46
CCD: Rf= 0,6 (30,0 % de AcOEt/Hex)
O O O 1 2 7 8 3 4 5 6 10 13 12 9 11 O
RMN 1H ppm (300 MHz, CDCl
3): δ = 2,5 (s, 3 H, H-1); 6,59 – 6,61 (m, 1 H, H-12);
7,2 (d, J = 9 Hz, 1H, H-7); 7,3 (t, 1H, H-5); 7,4 (d, J = 3,3 Hz; 1H, H-11); 7,6
(t, J = 9 Hz, 1H, H-6); 7,67 – 7,68 (m, 1H, H-4); 7,8 (d, J = 7,8 Hz; 1H, H-13)
RMN 13C ppm (75 MHz, CDCl3): δ = 29,8 (C-1); 112,4 (C-12); 120,0 (C-11); 123,8
(C-7); 126,4 (C-5) 130,3 (C-6); 131,1 (C-3); 133,4 (C-4); 143,7 (C-10); 147,5 (C-13); 148,4 (C-8); 156,6 (C-9); 197,5 (C-2)
EM m/z: 135 (100%); 107 (30%); 92 (30%)
Nome: 3-nitrobenzoato de 1-acetilfenil (41h)
Reagentes: Hidroxiacetofenona (5,0 mmol) e cloreto de 3-nitrobenzoíla (7,5 mmol)
Rendimento: 1,5 (100,0 %)
Características: sólido marrom claro
Tf: 77,7 – 78,0 °C (Lit. = 99,0 – 125,0 °C)47
CCD: Rf= 0,7 (30,0 % de AcOEt/Hex)
O O O 1 2 7 8 3 4 5 6 10 14 13 12 9 11 15 NO2
RMN 1H ppm (500 MHz, CDCl3):δ = 2,6 (s, 3 H, H-1); 7,3 (d, J = 8 Hz, 1H, H-7); 7,5
(t, J = 8,5 Hz, 1H, H-5); 7,7 (t, J = 8 Hz; 1H, H-14); 7,8 (t, J = 8 Hz; 1H, H-6); 7,9 (d, J
= ,5 Hz, 1H, H-4); 8,52 – 8,57 (m, 2H, H-13; H-14); 9,1 (s, 1H, H-11)
RMN 13C ppm (125 MHz, CDCl3): δ = 29,1 (C-1); 123,9 7); 125,3 5) 126,7
(C-14); 128,0 (C-6); 129,9 (C-4); 130,2 (C-3); 130,8 (C-15); 131,3 (C-10); 133,9 (C-13); 135,9 (C-11); 148,4 (C-12); 148,9 (C-8); 163,4 (C-9); 197,3 (C-2)
28
Nome: 3,4,5-trimetoxibenzoato de 1-acetil-4,6-diclorofenil (41j)
Reagentes: 3,5 – dicloro-2-hidroxiacetofenona (1,0 mmol) e 3,4,5-trimetoxicloreto de benzoíla (1,1 mmol)
Rendimento: 0,3 g (77,7 %)
Características: sólido branco
Tf: 123,5 – 124,1°C
CCD: Rf= 0,6 (30,0 % AcOEt/Hex.)
O O O 1 2 7 8 3 4 5 6 10 14 13 12 9 11 15 O O O Cl Cl
RMN 1H ppm (300 MHz, CDCl
3): δ 2,5 (s, 3H, H-1); 3,9 (sl, 9H, H-14; H-15); 7,5 (s,
2H, H-11); 7,7 (d, J = 3,3 Hz; 1H, H-6); 7,7 (d, J = 8 Hz; 1H, H-4)
RMN 13C ppm (75 MHz, CDCl3): δ 29,6 1); 56,3 14); 60,9 15); 107, 8
(C-11); 122,9 (C-10); 128,4 (C-4) 130,1 (C-7); 132,1 (C-5); 133,3 (C-3); 134,1 (C-6); 143,5 (C-13); 144,5 (C-8); 153,2 (C-12); 163,4 (C-9); 195,3 (C-2);
EM m/z: 195 (100%); 152 (10%)
Nome: 4-metoxibenzoato de 1-acetil-3,5-diclorofenil (41m)
Reagentes: 3,5 – dicloro-2-hidroxiacetofenona (0,9 mmol) e cloreto de 4-metoxibenzoíla (1,3 mmol)
Rendimento: 0,24 g (83,0%)
Características: sólido branco
Tf: 74,0 – 86,0 °C (Lit. = 107,0 °C)48
CCD: Rf= 0,4 (30,0 % AcOEt/Hex.)
O O O 1 2 7 8 3 4 5 6 10 14 13 12 9 11 O Cl Cl
RMN 1H ppm (300 MHz, CDCl
3): δ 2,5 (s, 3H, H-1); 3,9 (s, 3H, H-14); 7,0 (d, J = 8 Hz; 2H, H-12); 7,6 (d, J = 3 Hz; 1H, H-6); 7,7 (d, J = 3 Hz; 1H, H-4);
8,2 (d, J = 8 Hz; 2H, H-11) RMN 13C ppm (75 MHz, CDCl
3): δ 29,8 (C-1); 55,6 14); 114, 2 12); 120,4
(C-10); 128,3 (C-6); 130,1 (C-3); 131,9 (C-7); 132,7 (C-11); 133,2 (C-4); 134,4 (C-5); 144,8 (C-8); 163,4 (C-13); 164,5 (C-9); 195,4 (C-2)
29
Nome: benzoato de 1-acetil-5-clorofenil (41n)
Reagentes: 5-cloro-2-hidroxiacetofenona (2,9 mmol) e cloreto de benzoíla (4,4 mmol)
Rendimento: 0,76 g (95,0 %)
Características: sólido branco
Tf: 52,0 – 53,0 °C (Lit. = 72,0 – 73,0 °C)49
CCD: Rf= 0,6 (30,0 % AcOEt/Hex.)
O O O 1 2 7 8 3 4 5 6 10 13 12 9 11 Cl
RMN 1H ppm (200 MHz, CDCl3): δ 2,5 (s, 3H, H-1); 7,2 (d, J = 8,8 Hz; 1H, H-7); 7,5
– 7,7 (m, 4H, H-6; H-12; H-13); 7,8 (d, J = 2,4 Hz; 1H, H-4);
8,2 (d, J = 7,2 Hz; 2H, H-11) RMN 13C ppm (50 MHz, CDCl
3): δ 29,9 (C-1); 125,6 (C-7); 128,9 (C-3; C-12); 130,2
10); 130,5 11); 132,0 6); 132,7 5); 133,3 4); 134,2 13); 148,0 (C-8); 165,1 (C-9); 196,3 (C-2)
Nome: 4-fluorbenzoato de 1-acetil-5-clorofenil (41p)
Reagentes: 5-cloro-2-hidroxiacetofenona (2,9 mmol) e cloreto de 4-fluorbenzoíla (4,4 mmol)
Rendimento: 0,85 g (90,0 %)
Características: sólido branco
Tf: 105,7 – 107,5 °C
CCD: Rf= 0,7 (30,0 % AcOEt/Hex.)
O O O 1 2 7 8 3 4 5 6 9 13 12 11 10 F Cl
RMN 1H ppm (200 MHz, CDCl3): δ 2,5 (s, 3H, H-1); 7,2 - 7,3 (m, 3H, H-7; H-12);
7,53 – 7,57 (d, J = 8,6 Hz; 1H, H-6); 7,8 (d, J = 2,6 Hz; 1H, H-4); 8,18 - 8,25
(m, 2H, H-11)
RMN 13C ppm (50 MHz, CDCl3): δ 29,7 (C-1); 116,4 (d, JC-F= 22,0 Hz ; C-12); 125,4
(d, JC-F= 2,5 Hz, C-10); 125,6 7); 130,3 6); 132,1 4); 132,6 3); 133,1
30
Nome: 3-nitrobenzoato de 1-acetil-5-clorofenil (41s)
Reagentes: 5-cloro-2-hidroxiacetofenona (2,9 mmol) e cloreto de 3-nitrobenzoíla (4,4 mmol)
Rendimento: 1,0 g (95,0 %)
Características: sólido marrom
Tf: 118,7 – 121,0 °C (Lit. = 122,0 °C)49
CCD: Rf= 0,5 (30,0 % AcOEt/Hex.)
O O O 1 2 7 8 3 4 5 6 10 14 13 12 9 11 15 Cl NO2
RMN 1H ppm (200 MHz, CDCl3):δ 2,5 (s, 3H, H-1); 7,2 (d, J = 8 Hz, 1H, H-14); 7,6 –
7,9 (m, 3H, H-4; H-6; H-7); 8,5 (d, J = 8 Hz, 2H, H-13; H-15); 9,0 (s, 1H, H-11) RMN 13C ppm (50 MHz, CDCl
3): δ 29,0 (C-1); 125,2 (C-14); 128,1 (C-7); 128,4 (C-6);
129,9 (C-4); 130,4 (C-5); 130,8 (C-3); 131,5 (C-10); 132,1 (C-13); 133,4 (C-15); 135,8 (C-11); 147,1 (C-12); 148,4 (C-8); 163,0 (C-9);195,8 (C-2)
Nome: 3-nitrobenzoato de 1-acetil-5-metoxifenil (41z)
Reagentes: 5-metoxi-2-hidroxiacetofenona (3,0 mmol) e cloreto de 3-nitrobenzoíla (3,6 mmol)
Rendimento: 0,53 g (55,8 %)
Características: sólido marrom
Tf: 111,0 – 114,1 °C
CCD: Rf= 0,5 (30,0 % AcOEt/Hex.)
O O O 1 2 7 8 3 4 5 6 10 16 14 13 12 9 11 15 O NO2
RMN 1H ppm (200 MHz, CDCl3):δ 2,5 (s, 3H, H-1); 3,9 (s, 3H, 16); 7,2 (sl, 2H,
H-4; H-6); 7,4 (sl; 1H, H-7); 7,7 (t, J = 8 Hz; 1H, H-14); 8,48 – 8,54 (m, 2H, H-13; H-15);
9,0 (s, 1H, H-11)
RMN 13C ppm (50 MHz, CDCl3): δ 29,1 (C-1); 55,8 (C-16); 115,6 (C-6); 118,6 (C-4);
31
4.2.4 Síntese das β-dicetonas (42)
Os ésteres sintetizados anteriormente foram utilizados para a formação das β-dicetonas. Em um balão de fundo redondo (50,0 mL) foram adicionados o éster (1,0 equivalente), a piridina (8,0 mL) como solvente e a base KOH (2,0 equivalentes). A reação foi mantida em aquecimento (50,0 ºC) durante o período reacional, que foi de 30 minutos. Ao final da reação, verteu-se a mistura reacional em um erlenmeyer contendo uma solução de CH3COOH a 10% (20,0 mL). Os
sólidos formados apresentaram uma coloração amarela intensa, característica essa atribuída a formação das β-dicetonas. Todas essas informações estão apresentadas na Tabela 2. Os produtos formados foram filtrados a vácuo e o bruto foi utilizado para a etapa seguinte.
Tabela 2: Dados sobre as reações para a síntese das dicetonas
Nome:1-(2-hidroxifenil)-1''-4-metilfenil propano-1,3-diona (42a)
Reagentes: 41a (6,0 mmol) e KOH (12,0 mmol)
Rendimento: 1,54 g (100,0 %)
Características: sólido amarelo
Tf: 110,0 – 111,8°C
(Lit.= 106,0 – 110,0 °C)50
CCD: Rf= 0,5 (30,0 % AcOEt/Hex.)
EM m/z: 119 (100%)
Nome:1-(2-hidroxifenil)-3-(4-metoxi fenil)propano-1,3-diona (42b)
Reagentes: 41b (6,0 mmol) e KOH (11,0 mmol)
Rendimento: 1,2 g (80,0 %)
Características: sólido amarelo
Tf: 108,0 – 109,7 °C
(Lit.= 109,0 -110,0 °C)51
CCD: Rf= 0,5 (30,0 % AcOEt/Hex.)
EM m/z: 270 (3%); 135 (100%),
Nome:1-(2-hidroxifenil)-1''-fenil propano-1,3-diona (42c)
Reagentes: 41c (6,0 mmol) e KOH (12,0 mmol)
Rendimento: 1,2 g; (80,0 %)
Características: sólido amarelo
Tf: 119,0 – 120,0 °C
(Lit.= 121,0 – 122,0 °C)46
CCD: Rf= 0,5 (30,0 % AcOEt/Hex.)
EM m/z: 240 (5%); 105 (100%), 77 (40%)
Nome:1-(2-hidroxifenil)-1''-4-clorofenil propano-1,3-diona (42d)
Reagentes: 41d (2,0 mmol) e KOH (2,0 mmol)
Rendimento: 0,2 g (72,0 %)
Características: sólido amarelo
Tf: 122,0 – 123,0°C
(Lit.= 122,0 – 127,0 °C)46
CCD: Rf= 0,7 (30% AcOEt/Hex.)