UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS
DEPARTAMENTO DE QUÍMICA ANALÍTICA E FÍSICO-QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
JÉSSICA SALES BARBOSA
REVESTIMENTO DE PARTÍCULAS DE TiO2 PELO MÉTODO DE ULTRASSOM PARA APLICAÇÃO EM PROTETOR SOLAR
JÉSSICA SALES BARBOSA
REVESTIMENTO DE PARTÍCULAS DE TiO2 PELO MÉTODO DE ULTRASSOM PARA
APLICAÇÃO EM PROTETOR SOLAR
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Química da Universidade Federal do Ceará, como requisito parcial à obtenção do título de Mestre em Química. Área de concentraçãoμ Química.
Orientadorμ Prof. Dr. Pierre Basílio Almeida Fechine.
Coorientadoraμ Profª. Drª. Tamara Gonçalves Araújo.
JÉSSICA SALES BARBOSA
REVESTIMENTO DE PARTÍCULAS DE TiO2 PELO MÉTODO DE ULTRASSOM PARA
APLICAÇÃO EM PROTETOR SOLAR
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Química da Universidade Federal do Ceará, como requisito parcial à obtenção do título de Mestre em Química. Área de concentraçãoμ Química.
Aprovada emμ ___/___/______.
BANCA EXAMINADORA
________________________________________ Prof. Dr. Pierre Basílio Almeida Fechine
Universidade Federal do Ceará (UFC)
_________________________________________ Profa. Dra. Tamara Gonçalves Araújo
Universidade Federal do Ceará (UFC)
_________________________________________ Prof. Dr. Antoninho Valentini
Universidade Federal do Ceará (UFC)
________________________________________ Prof. Dra. Cristiane Pinto Oliveira
AGRADECIMENTOS
Gostaria de agradecer ao meu orientador, Prof. Dr. Pierre Basílio Almeida Fechine e minha coorientadora, Tamara Gonçalves Araújo, pela orientação e paciência durante esse tempo.
Aos integrantes da banca examinadora que se disponibilizaram para avaliar e colaborar com o trabalho.
Aos colegas de GQMat que colaboraram com boas ideias e me ajudaram durante esse período.
À minha família, meus pais Marta e Manoel e meus irmãos, Juliana e Lucas, por estarem sempre presentes e me apoiarem.
RESUMO
TiO2 é um filtro inorgânico muito utilizado em protetores solares e tem a propriedade de
dispersar, absorver e refletir a radiação ultravioleta. As partículas de TiO2 precisam de
revestimentos para aumentar a sua dispersibilidade em cremes de proteção solar e diminuir a formação de aglomerados, influenciando na estabilidade e estética do produto final, além de diminuir sua atividade fotocatalítica. Portanto, o objetivo do presente estudo foi revestir partículas de TiO2 comercial para investigar sua estabilidade, atividade fotocatalítica sem perda
da proteção UV e, por fim, aplicar em protetores solares. A metodologia empregada para o revestimento foi baseada na radiação ultrassônica, onde o TiO2 foi revestido com SiO2, Al2O3,
ZrO2, citrato e poliacrilato de sódio. Para a caracterização dos materiais foram utilizadas as
técnicas de Difração de Raios X (DRX), onde foi possível identificar a fase rutila nas amostras revestidas, Fluorescência de Raios X (FRX), Espectroscopia na Região do Infravermelho com Transformada de Fourier (FT-IR) e Termogravimetria, onde foi possível comprovar os revestimentos nas amostras TiO2/SiO2, TiO2/Al2O3, TiO2/ZrO2 e TiO2/PAANa. Pela
Microscopia Eletrônica de Varredura (MEV), determinou-se o tamanho de partícula das amostras. De acordo com o Potencial Zeta (ξ) e Espalhamento Dinâmico da Luz (DLS), verificou-se a mudança nas cargas de superfície das amostras após os revestimentos, com melhor estabilidade do TiO2/SiO2 e TiO2/PAANa. As partículas de TiO2 produzidas, em relação
ao TiO2 comercial (TiO2-COM) apresentaram semelhante proteção UV e apresentaram uma
menor atividade fotocatalítica. Os protetores solares contendo as partículas de TiO2 revestidas
foram produzidos, onde se avaliou o fator de proteção solar (FPS), o potencial ξ e DLS das formulações, onde todas as amostras apresentaram semelhante FPS, sendo o TiO2/PAANa a que
apresentou melhor estabilidade.
ABSTRACT
TiO2 is a common inorganic filter used in sunscreens and it has the propriety of scattering,
reflect and absorb the ultraviolet radiation. TiO2 particles need a coating to increase its
dispersion in sunscreen products and resist the formation of particle agglomerations, influencing stability and aesthetics of the final product as well as reducing its photocatalytic activity. Therefore, the objective of the present study was to coat particles of commercial TiO2,
evaluate its stability, photocatalytic activity without loss of UV protection, for application in sunscreens. The methodology used for the coating was based on ultrasonic radiation and TiO2
was coated with SiO2, Al2O3, ZrO2, citrate, and sodium polyacrylate. X-Ray Diffraction (XRD)
technique was used to characterize the materials, where it was possible to identify the rutile phase in the coated samples. X-ray fluorescence, Fourier-transform infrared spectroscopy (FTIR) and Thermogravimetry confirmed the coatings in TiO2/SiO2, TiO2/Al2O3, TiO2/ZrO2 e
TiO2/PAANa. Scanning Electron Microscopy (SEM) determined the particle size of the
samples. According to Zeta Potential (ξ) and Dynamic Light Scattering (DLS), the change in the surface loads of the samples after the coatings was verified, with better stability of TiO2/SiO2
and TiO2/PAANa. All coated TiO2 particles produced, in relation to the commercial TiO2
(TiO2-COM) presented similar UV protection and showed a lower photocatalytic activity. The sunscreens containing the coated TiO2 particles were produced, where the sun protection factor
(SPF), the ξ potential and DLS of the formulations were evaluated, where all the samples presented similar FPS, with TiO2/PAANa being the one with the best stability.
LISTA DE FIGURAS
Figura 1 – Alterações causadas na pele pela radiação UV ... .. 12
Figura 2 – Mecanismo de ação dos filtros orgânicos e inorgânicos ... 14
Figura 3 – Filtros orgânicos ... 15
Figura 4 – Estruturas cristalinas do TiO2: (a) anatase, (b) rutila e (c) brookita ... 16
Figura 5 – Espectro da atenuação UV/Vis de diversas partículas de TiO2 ... 18
Figura 6 – Diferenças entre o espalhamento de Rayleigh e Mie ... 19
Figura 7 – DEM da pele (a) não protegida e (b) protegida com protetor solar FPS 8 ... 21
Figura 8 – Agentes de revestimento utilizados neste trabalho ... 24
Figura 9 – Valores de E ( ) e S ( ) utilizados para o cálculo do FPS ... 27
Figura 10 – DRX das amostras de TiO2 ... 31
Figura 11 – FTIR das amostras ... 35
Figura 12 – Espectroscopia Raman das amostras de TiO2 ... 36
Figura 13 – TG das amostras de TiO2 ... 37
Figura 14 – MEV das amostras de TiO2: (A) TiO2-COM, (B) TiO2-US, (C) TiO2/SiO2, (D) TiO2/Al2O3, (E) TiO2/ZrO2, (F) TiO2/PAANa ... 39 Figura 15 – Histogramas das partículas de TiO2 ... 40
Figura 16 – EDS das amostras de TiO2 ... 41
Figura 17 – UV/Vis das amostras de TiO2 ... 44
Figura 18 – Corantes Utilizados para a atividade fotocatalítica ... 45
Figura 19 – Mecanismo fotocatalítico para o TiO2 ... 46
Figura 20 – Atividade fotocatalítica para TiO2-COM, TiO2-US, TiO2/Al2O3, e TiO2/ZrO2 47 Figura 21 – Atividade fotocatalítica TiO2-COM, TiO2-US, TiO2/SiO2 e TiO2/PAANa ... 48
Figura 22 – Protetores Solares produzidos com as amostras de TiO2 ... 49
Figura 23 – Fita Transpore® na lâmina para análise do FPS ... 50
Figura 24 – FPS dos protetores solares ... 50
LISTA DE TABELAS
Tabela 1 – Composição dos protetores solares ... 26
Tabela 2 – Composição da Loção Lanette Base utilizada na preparação dos protetores solares (Lote para 10.000 mL) ... 26 Tabela 3 – Parâmetros estruturais das amostras refinadas pelo método de Rietveld ... 32
Tabela 4 – Resultado das análises de FRX ... 33
Tabela 5 – Composição das amostras obtidas por EDX ... 41
Sumário
1 INTRODUÇÃO ... 11
1.1 Radiação Ultravioleta ... 11
1.2 Câncer de Pele ... 12
1.3 Protetores Solares ... 13
1.4 Dióxido de Titânio ... 15
1.4.1 Mecanismo de ação ... 18
1.4.2 Atividade Fotocatalítica ... 19
1.5 Fator de Proteção Solar ... 20
1.6 Sonoquímica ... 22
2 OBJETIVOS ... 23
2.1 Objetivo Geral ... 23
2.2 Objetivos Específicos ... 23
3 MATERIAIS E MÉTODOS ... 24
3.1 Reagentes ... 24
3.2 Síntese ... 24
3.3 Preparação dos Protetores Solares ... 26
3.4 Fator de Proteção Solar (FPS) ... 26
3.5 Caracterizações ... 27
3.5.1 Difração de Raios X (DRX)... 27
3.5.2 Fluorescência de Raios-X (FRX)... 28
3.5.3 Espectroscopia na Região do Infravermelho (FT-IR) ... 28
3.5.4 Espectroscopia Raman ... 28
3.5.5 Microscopia Eletrônica de Varredura (MEV) ... 28
3.5.6 Potencial Zeta (ξ) e Espalhamento Dinâmico de Luz (DLS)... 28
3.5.7 Análise Termogravimétrica ... 29
3.5.8 Espectrofotometria no UV/Visível ... 29
3.5.9 Atividade Fotocatalítica ... 29
3.5.10 Potencial ξ e DLS dos protetores solares... 29
4 RESULTADOS E DISCUSSÃO ... 30
4.1 Difração de raios-X (DRX) ... 30
4.2 Flourescência de raios-X (FRX) ... 33
4.4 Espectroscopia Raman ... 36
4.5 Termogravimetria ... 37
4.6 Microscopia Eletrônica de Varredura (MEV) ... 38
4.7 Potencial ξ... 42
4.8 Espectrofotometria no UV/Visível ... 43
4.9 Atividade Fotocatalítica ... 45
4.10 FPS dos Protetores Solares ... 49
4.11 Potencial ζ e DLS dos Protetores Solares ... 52
5 CONCLUSÕES ... 54
REFERÊNCIAS ... 55
1 INTRODUÇÃO
1.1 Radiação Ultravioleta
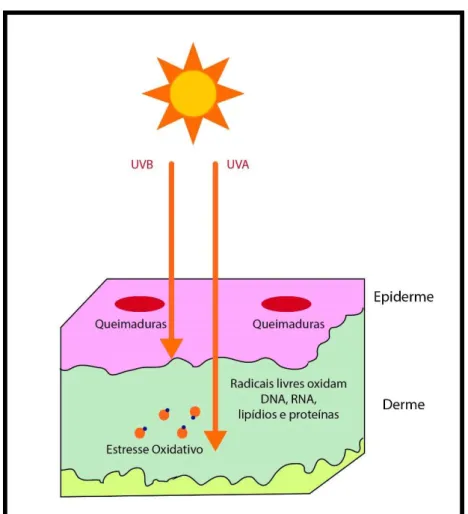
A pele humana é exposta diariamente à radiação solar, que inclui a radiação ultravioleta (200 a 400 nm), a visível (400 a 700 nm) e a infravermelha (700 a 1700 nm) (LEVI, 2013). A radiação ultravioleta corresponde àquelas de menor comprimento de onda, ou seja, as mais energéticas e as mais preocupantes devido aos danos causados na pele. Esse tipo de radiação é comumente dividida em três faixas: UVC (200-290 nm), UVB (290-320 nm) e UVA (320-400 nm) (BATISTA, 2010). A luz UV tem efeitos importantes para a pele como a melhora do humor, aumento da síntese de vitamina D3 e melhora da aparência da pele em doenças como a psoríase, porém, ela é a principal responsável pelos danos à pele, como as queimaduras solares (COHEN; GRANT, 2016).
Devido à camada de ozônio, a radiação UVC não atinge a superfície da Terra e, portanto, não tem efeitos danosos significativos sobre a nossa pele (LEVI, 2013). Os raios UVB correspondem a, aproximadamente, 5% de toda a radiação ultravioleta que atinge a pele humana e tem um papel importante na saúde da população, pois ela é crucial para síntese de vitamina D. Entretanto, ela é a mais citotóxica e mutagênica, apesar de atingir a pele de forma menos significativa que a UVA. Além disso, esses raios conseguem penetrar apenas na camada mais superficial da pele, a epiderme, causando eritema em apenas poucos minutos após a sua exposição e danos direto ao DNA, que em longo prazo pode levar ao câncer de pele (JI et al., 2012; LEVI, 2013; BLACK, 2014a; BAKER et al., 2016).
Devido a destruição da camada de ozônio, o aumento da radiação UVB na Terra é uma grande ameaça para a pele, aumentando o risco de danos a longo prazo como o fotoenvelhecimento, a fotoimunossupressão e a fotocarcinogênese (CAVINATO; JANSEN-DÜRR, 2017).
Figura 1 Alterações causadas na pele pela radiação UV
Fonte: Próprio autor
A radiação UVA é capaz de causar danos na estrutura do colágeno e da elastina que são proteínas presentes na derme, resultando em aumento das enzimas de degradação do colágeno e, consequentemente, há a fragmentação das fibras de colágeno e uma diminuição da tensão da pele. Essa perda de tensão da pele juntamente com a redução da elasticidade e extensibilidade da derme após a exposição a luz UV dá origem às rugas (LEVI, 2013).
1.2 Câncer de Pele
A relação entre a exposição a luz UV e o câncer de pele já é bem documentado na literatura (COOLEY; QUALE, 2013). A exposição ao sol aumenta o risco de neoplasma benigno, pré-maligno e maligno nas áreas do corpo que são cronicamente expostos por ele, como o rosto, o pescoço e as mãos (COHEN; GRANT, 2016).
carcinógeno, pois além de iniciar a tumorigênese induzindo mutações em genes supressores de tumor, eles também promovem o desenvolvimento do tumor (GORDON, 2013).
A incidência de melanoma vem aumentando rapidamente em todo o mundo e sua incidência é muito maior na população branca em relação a população mais pigmentada. A pigmentação advinda da melanina, produzida pelos melanócitos, fornecem proteção contra os raios UV. Estudos mostram que, na América do Sul, as pessoas que possuem ancestrais europeus possuem um maior risco de desenvolver o melanoma e, no Brasil, a incidência desse tipo de câncer e a mortalidade é muito alta em populações com elevada proporção de pessoas com a pele branca (GORDON, 2013; DE VRIES et al., 2016).
De acordo com o Instituto Nacional do Câncer (INCA), o câncer de pele é o mais frequente no Brasil, correspondendo a 30% de todos os tumores malignos registrados no país. O melanoma corresponde a 3% desse tipo de tumor, porém é o que possui maior gravidade devido à sua alta possibilidade de metástase. O tipo não melanoma possui uma maior incidência, porém uma menor mortalidade.
Ainda de acordo com o INCA, a estimativa de novos casos de câncer de pele não melanoma no Brasil para o ano de 2016 foi de 175.760, sendo 80.850 homens e 94.910 mulheres. Para o tipo melanoma, a estimativa foi de 5.670 novos casos, sendo 3.000 homens e 2.670 mulheres.
Estudos sugerem que a redução da exposição ao sol durante a infância e adolescência através de medidas fotoprotetoras podem diminuir, durante a vida, o risco de desenvolver um câncer de pele não melanoma em até 78% (GORDON, 2013), portanto, como forma de prevenir e tratar os efeitos danosos da radiação UV, métodos de fotoproteção devem ser utilizados, como restrição a exposição solar, roupas protetoras e os protetores solares, que são os de primeira escolha na defesa contra esses danos (MANCEBO; HU; WANG, 2014).
1.3 Protetores Solares
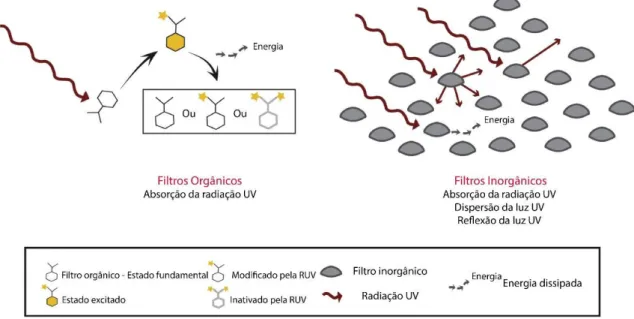
Figura 2 Mecanismo de ação dos filtros orgânicos e inorgânicos
Fonte: (MANCEBO; HU; WANG, 2014) Adaptado
Os filtros orgânicos geralmente possuem compostos aromáticos conjugados com grupos carbonila e absorvem fótons de alta energia advindos da luz UV. Essa energia absorvida é transmitida aos elétrons que pulam para um estado excitado e liberam essa energia na forma de calor ou luz de maior comprimento de onda ao voltar para o estado fundamental, podendo causar modificações químicas na molécula, formando novos compostos ou foto produtos que podem ser inativos, diminuindo a eficácia do protetor solar, além de poderem interagir com biocomponentes da pele levando a reações fotoalérgicas e fototóxicas ou ainda interagir com componentes da formulação fotoprotetora, como outros filtros UV, levando a formação de compostos com toxicidade desconhecida (AFONSO et al., 2014; MANCEBO; HU; WANG, 2014).
O ácido para-aminobenzoico (PABA) é um filtro orgânico, um dos primeiros ativos utilizado em protetor solar e um efetivo filtro UVB. Mais de 4% da população que o utiliza apresenta reações fotoalérgicas, além da possibilidade de carcinogênese devido ao uso de produtos contendo PABA (BALOGH; PEDRIALI; KANEKO, 2011; SAMBANDAN; RATNER, 2011).
Figura 3 Filtros orgânicos
Fonte: Próprio autor
Os filtros inorgânicos são minerais que possuem a capacidade de absorver, refletir e dispersar a radiação UV. Os filtros inorgânicos aprovados pela Anvisa para o uso no Brasil são os compostos por dióxido de titânio (TiO2) e óxido de zinco (ZnO) (BRASIL, 2006). São filtros com amplo espectro de proteção e são muito utilizados devido a vantagem de causar baixa irritação na pele, o que os tornam mais indicados para crianças e pessoas de pele sensível (KOCKLER et al., 2012). Um estudo realizado no Reino Unido mostrou que aproximadamente metade dos protetores solares utilizados na região possuem óxidos metálicos na sua composição, sendo 90,2% desses contendo TiO2 e 9,8% o ZnO (WAHIE; LLOYD; FARR, 2007).
1.4 Dióxido de Titânio
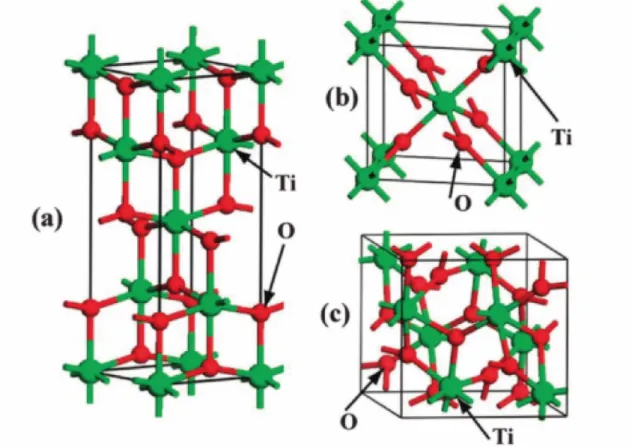
Figura 4 Estruturas cristalinas do TiO2: (a) anatase, (b) rutila e (c) brookita
Fonte: (ZHANG et al., 2014)
O dióxido de titânio tem a capacidade de espalhar, refletir e absorver a radiação UV. Por esses motivos, ele é utilizado como um filtro inorgânico, protegendo, assim, o DNA da pele contra os danos causados por esse tipo de radiação. Ele protege principalmente contra os raios UVB, podendo também proteger contra os raios UVA, dependendo do tamanho e distribuição das partículas. Além de disso, o TiO2 é comumente utilizado na indústria como pigmento branco para plásticos, tintas, papel etc. (BOEHM, 2008; MANAIA et al., 2013; WANG; LIM, 2016).
formulações esteticamente mais agradáveis (BOEHM, 2008; SADRIEH et al., 2010). Partículas muito pequenas, apesar de serem totalmente transparentes, perdem a sua eficácia como protetor solar. Partículas de TiO2 com tamanho de 20 nm ou menos são totalmente transparentes, mas possuem pobre atenuação UV. TiO2 com 50 nm apresenta baixo espalhamento da luz visível, com alta proteção UVB e baixa proteção UVA. Já partículas com 100 nm apresentam alta proteção UVB e UVA, mas há um significante espalhamento da luz visível, portanto, o ideal em um protetor solar são tamanhos de partícula variando de 50 a 120 nm (Figura 5). Porém, o tamanho e a distribuição das partículas devem ser mantidos, ou seja, não deve haver a formação de aglomerados, onde as partículas se comportarão opticamente como partículas maiores, com menor transparência e menor atenuação da luz UV (SMIJS; PAVEL, 2011; WANG; LIM, 2016).
Mudanças na superfície das partículas têm sido realizadas, como o revestimento da partícula com outros óxidos inorgânicos (silica, alumina e zircônia), com o intuito de ajudar a sua dispersibilidade e impedir a formação de grandes aglomerados de partículas. Além disso, esses revestimentos contribuem para a diminuição da atividade fotocatalítica, o que é ideal para a utilização em protetores solares (BOEHM, 2008; WANG; LIM, 2016).
Figura 5 Espectro da atenuação UV/Vis de diversas partículas de TiO2
Fonte: (WIECHERS; MUSEE, 2010) Adaptado
1.4.1 Mecanismo de ação
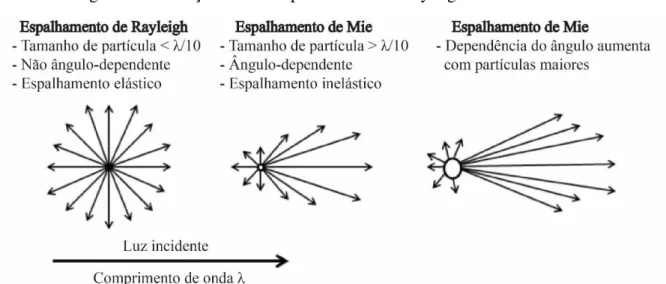
O mecanismo da atenuação da luz UV pelo TiO2 envolve a capacidade dessas partículas de tanto absorver quanto espalhar essa radiação (EGERTON; TOOLEY, 2012). O mecanismo de absorção ocorre, pois o TiO2 é um semicondutor, sendo capaz de absorver a luz UV, promovendo uma transição de elétrons da banda de valência para a banda de condução. A fase anatase tem uma menor absorção UV devido ao seu maior band gap (3,2 eV) comparado ao da rutila (3,0 eV) (FLOR; DAVOLOS; CORREA, 2007; ZHANG et al., 2014).
Figura 6 Diferenças entre o espalhamento de Rayleigh e Mie
Fonte: (BHATTACHARJEE, 2016) Adaptado
1.4.2 Atividade Fotocatalítica
O TiO2 é um semicondutor, com capacidade de absorver a luz UV e gerar espécies reativas de oxigênio (EROs), como radical hidroxil (HO●), radical superóxido (O2●-), além de peróxido de hidrogênio (H2O2) e oxigênio singlete (1O2). Quando a absorção da luz UV ocorre, um elétron migra da banda de valência para a banda de condução, deixando um buraco positivo na banda de valência (KOCKLER et al., 2012). Devido a esta propriedade fotocatalítica, o TiO2 pode ser aplicado em células solares, técnicas para limpeza de água e degradação de compostos orgânicos, dentre outros. Entretanto, quando se quer utilizá-lo em protetores solares, a atividade fotocatalítica não é bem-vinda. O dióxido de titânio utilizado nesses cosméticos deve possuir uma baixa atividade fotocatalítica, pois os radicais livres produzidos nesse processo podem degradar os próprios excipientes da formulação, prejudicando a estabilidade do produto, além de ser possível causar danos na pele (SIDDIQUEY et al., 2008; KOCKLER et al., 2012).
rutila. Dessa forma, a chance dos elétrons fotoexcitados e buracos na anatase participarem de reações químicas de superfície aumenta (ZHANG et al., 2014).
A forma rutila é a mais utilizada em fotoprotetores devido a sua baixa atividade fotocatalítica comparada a forma anatase e é comumente revestida com materiais inertes no intuito de minimizar ainda mais essa atividade e aumentar a estabilidade do produto final (SIDDIQUEY et al., 2008).
1.5 Fator de Proteção Solar
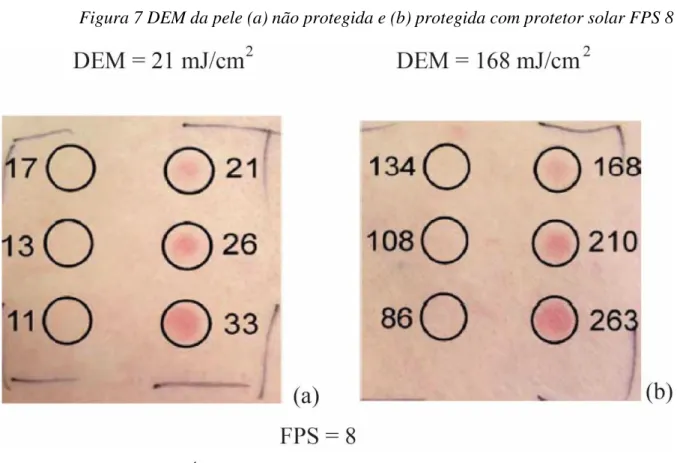
O Fator de Proteção Solar (FPS) de um produto é definido como a razão entre a Dose Eritematosa Mínima (DEM) da pele protegida com o fotoprotetor e a Dose Eritematosa Mínima da pele não protegida:
�� = � � � ã � � �� �� � � �� �
Figura 7 DEM da pele (a) não protegida e (b) protegida com protetor solar FPS 8
Fonte: (BENDOVÁ et al., 2007) Adaptado
Os testes de FPS in vivo são caros e despendem muito tempo (GAROLI et al., 2009). Entretanto, o FPS pode ser calculado in vitro através da medida da transmitância difusa do filme de protetor solar em função do comprimento de onda. Esse método é ideal para fotoprotetores contendo filtros inorgânicos, onde a transmitância esférica total é medida com a utilização de uma esfera de integração que coleta a luz dispersada em todos os ângulos (VELASCO et al., 2011). As amostras de protetor são aplicadas em uma fita Transpore® 3M em uma concentração de 2 mg/cm2 e a transmitância é medida em UV/Vis com integrador de esferas. O FPS é calculado de acordo com a equação:
∑ � . � � / ∑ � . � � /� �
400
290 400
290
Onde,
• � = Eficácia espectral de desenvolvimento de eritema solar no comprimento de onda �;
• � � = A razão entre a transmitância no comprimento de onda da fita sem o protetor solar aplicado pela correspondente transmitância com o protetor solar aplicado.
1.6 Sonoquímica
Nos últimos anos, o processo sonoquímico tem sido uma técnica útil para formar materiais com diferentes propriedades. A radiação ultrassônica fornece condições de reação bastante incomuns em comparação a fontes de energia tradicionais e que não podem ser realizadas por outros métodos, como altas temperaturas e pressões em um curto período de tempo. Devido ao processo de cavitação, que consiste na formação, crescimento e colapso das bolhas no líquido, o ultrassom tem a capacidade de realizar transformações químicas. O processo permite a síntese de compostos sem a necessidade de altas temperaturas e pressões, além de tempos de reação longos. Condições extremas são geradas temporariamente pelo ultrassom, podendo atingir, em determinadas regiões, temperaturas de 5000 K, pressões superiores a 1800 atm e velocidades de aquecimento e arrefecimento 1010 K/s (BANG; SUSLICK, 2010).
2 OBJETIVOS
2.1 Objetivo Geral
Revestir e caracterizar partículas de TiO2 com sílica, alumina, zircônia, citrato e poliacrilato de sódio pelo método de ultrassom, avaliar sua estabilidade e atividade fotocatalítica para uso como agente ativo em uma loção fotoprotetora.
2.2 Objetivos Específicos
Revestir partículas de TiO2 micronizadas e caracterizá-las através das técnicas de DRX, FRX, FTIR e TG/DTG.
Avaliar a estabilidade das partículas através do Potencial Zeta e Espalhamento Dinâmico de Luz (DLS).
Avaliar a morfologia das amostras através da Microscopia Eletrônica de Varredura.
Avaliar a habilidade em bloquear a luz UV e a transparência das amostras pela Espectrofotometria de UV-Vis.
Avaliar a atividade fotocatalítica das amostras pela degradação dos corantes azul de metileno e rodamina B.
Produzir protetores solares das amostras e avaliar a estabilidade das partículas através do Potencial Zeta e DLS.
3 MATERIAIS E MÉTODOS
3.1 Reagentes
Os reagentes utilizados neste trabalho foram utilizados como recebido: TiO2 micronizado (ViaFarma), tetraetoxisilano 99% (TEOS) (Sigma-Aldrich), nitrato de alumínio nonahidratado 99% (Vetec), oxicloreto de zircônio 98% (Sigma-Aldrich), citrato de sódio 99% (Sigma-Aldrich), poliacrilato de sódio (PAANa) (Sigma-Aldrich), Etanol 95% (Vetec), hidróxido de amônio 29% (Dinâmica Química) e água destilada.
3.2 Síntese
As estruturas químicas dos agentes de revestimento utilizados são mostradas na Figura 8.
Figura 8 Agentes de revestimento utilizados neste trabalho
Fonte: Próprio autor
TiO2-US: 1g de TiO2 (TiO2-COM) foi disperso em 15,3g de etanol e 24 mL de água destilada. A mistura foi colocada em agitação magnética por 20 min. Em seguida, a dispersão foi colocada na sonda de ultrassom (20 kHz; 750 W) por 5 min, com o gotejamento de 9,57 mL de hidróxido de amônio nos 4 minutos finais. Após o fim do processo, as amostras foram lavadas com água destilada e centrifugadas até atingir o pH da água e secadas em estufa. Essa síntese foi realizada para a avaliação do efeito do método de ultrassom nas partículas.
TiO2/SiO2: 0,693 g de TEOS foram dissolvidos em 15,3 g de etanol. Adicionou-se 1g de TiO2-COM a essa mistura e logo após 24 mL de água. A mistura foi colocada em agitação magnética durante 20 minutos. Em seguida, a dispersão foi colocada na sonda de ultrassom (20 kHz; 750 W) por 5 min, com o gotejamento de 9,57 mL de hidróxido de amônio nos 4 minutos finais. Após o fim do processo, as amostras foram lavadas com água destilada e centrifugadas até atingir o pH da água e secadas em estufa.
TiO2/Al2O3: 1,244 g de nitrato de alumínio foi disperso em 12 mL de água (1). 1g de TiO2-COM foi disperso em 12 mL de água (2). Adicionou-se (2) em (1) e logo após15,3 g de etanol, colocou-se em agitação magnética por 20 minutos. Em seguida, a dispersão foi colocada na sonda de ultrassom (20 kHz; 750 W) por 5 min, com o gotejamento de 9,57 mL de hidróxido de amônio nos 4 minutos finais. Após o fim do processo, as amostras foram lavadas com água destilada e centrifugadas até atingir o pH da água e secadas em estufa.
TiO2/ZrO2: 1,069 g de oxicloreto de zircônio foi disperso em 12 mL de água (1). 1 g de TiO2-COM foi disperso em 12 mL de água (2). Adicionou-se (2) em (1) e logo após 15,3 g de etanol, colocou-se em agitação magnética por 20 minutos. Em seguida, a dispersão foi colocada na sonda de ultrassom (20 kHz; 750 W) por 5 min, com o gotejamento de 9,57 mL de hidróxido de amônio nos 4 minutos finais. Após o fim do processo, as amostras foram lavadas com água destilada e centrifugadas até atingir o pH da água e secadas em estufa.
TiO2/Citrato: 0,8572g de citrato de sódio foi dissolvido em 24 mL de água e foi adicionado na dispersão de 1 g de TiO2-COM em 15,3 g de etanol. A mistura foi colocada em agitação magnética durante 20 minutos. Em seguida, a dispersão foi colocada na sonda de ultrassom (20 kHz; 750 W) por 5 min, com o gotejamento de 9,57 mL de hidróxido de amônio nos 4 minutos finais. Após o fim do processo, as amostras foram lavadas com água destilada e centrifugadas até atingir o pH da água e secadas em estufa.
nos 4 minutos finais. Após o fim do processo, as amostras foram lavadas com água destilada e centrifugadas até atingir o pH da água e secadas em estufa.
3.3 Preparação dos Protetores Solares
Uma loção fotoprotetora (25 g) foi preparada para as amostras TiO2, TiO2/Al2O3, TiO2/ZrO2, TiO2/SiO2 e TiO2/PAANa). O pó da amostra, em uma concentração de 4%, foi incorporada a uma base já preparada utilizando o propilenoglicol (Tabela 1). O fator de proteção solar (FPS), potencial ξ e DLS foram determinados para cada produto. A composição da Loção Lanette Base utilizada é mostrada na Tabela 2.
Tabela 1 Composição dos protetores solares
Matéria-Prima Quantidade
TiO2* 1 g
Propilenoglicol 1,25 g
Loção Lanette Base q.s.p** 25 g
*= TiO2, TiO2/Al2O3, TiO2/ZrO2, TiO2/SiO2 e TiO2/PAANa ** quantidade suficiente para
Fonte: Próprio autor
Tabela 2 Composição da Loção Lanette Base utilizada na preparação dos protetores solares (Lote para 10.000 mL)
Matéria-Prima Quantidade
Cera Lanette N (álcool cetoestearílico e cetoestearil sulfato de sódio)
500 g
Cetiol V (oleato de decila) 350 mL
Ácido esteárico 150 g
Glicerina 600 g
Solução de parabenos 20% 150 mL
Água Purificada 7.850 mL
Fonte: Próprio autor
3.4 Fator de Proteção Solar (FPS)
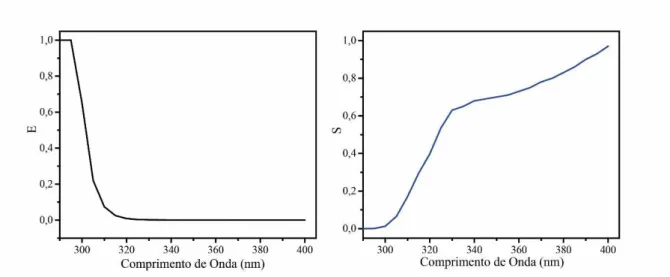
realizadas e o valor de FPS foi calculado. O FPS foi calculado de acordo com a fórmula abaixo e valores de E ( ) e S( ) são mostrados na Figura λ:
∑ � . � � / ∑ � . � � /� �
400
290 400
290
Onde,
• � = Eficácia espectral de desenvolvimento de eritema solar no comprimento de onda �;
• � � = Região espectral relativa onde abrange a radiação solar no comprimento de onda � ;
• � � = A razão entre a transmitância no comprimento de onda da fita sem o protetor solar aplicado pela correspondente transmitância com o protetor solar aplicado (DIFFEY; ROBSON, 1989; BENDOVÁ et al., 2007).
Figura 9 Valores de E (λ) e S (λ) utilizados para o cálculo do FPS.
3.5 Caracterizações
3.5.1 Difração de Raios X (DRX)
3.5.2 Fluorescência de Raios-X (FRX)
A fluorescência de Raios-X das amostras foi obtida utilizando uma medida semi-quantitativa pelo equipamento Rigaku (ZSX-Mini) que quantifica os elementos do F ao U (Laboratório de raios-X/Departamento de Física-UFC).
3.5.3 Espectroscopia na Região do Infravermelho (FT-IR)
Os dados de FT-IR foram obtidos no Espectrômetro Perkin Elmer FT-IR. Para a realização das medidas, as amostras foram previamente diluídas em KBr e então, os espectros foram coletados na faixa de 400–4000 cm-1 (Departamento de Química Orgânica e Inorgânica – UFC).
3.5.4 Espectroscopia Raman
A Espectroscopia Raman foi realizada em um equipamento modelo LabRAM HR da marca HORIBA Scientific. A excitação espectral foi realizada com um laser utilizando a linha de 632,8 nm, com filtro ajustável D1 com potências efetivas de 10;7 W com 3 acumulações de 10 s (Departamento de Física-UFC).
3.5.5 Microscopia Eletrônica de Varredura (MEV)
As micrografias da superfície das amostras foram obtidas em um microscópio eletrônico de varredura, MEV Quanta-FEG FEI. As amostras foram fixadas sobre um stub de alumínio com o auxílio de uma fita adesiva condutora de carbono. As amostras foram recobertas com ouro com aproximadamente 20 nm de espessura (Central Analítica/Departamento de Física-UFC).
3.5.6 Potencial Zeta (ξ) e Espalhamento Dinâmico de Luz (DLS)
3.5.7 Análise Termogravimétrica
A análise térmica foi realizada nas amostras de TiO2-COM, TiO2-US, TiO2/Citrato e TiO2/PAANa, utilizando o equipamento METTLER TOLEDO TGA/SDTA 851e, numa faixa de temperatura de 50 a 800°C, com razão de aquecimento de 10°C/min e atmosfera de nitrogênio com vazão de 10 mL/min, cadinho de alumina e massa de amostra de 10 mg (Departamento de Química Orgânica e Inorgânica – UFC).
3.5.8 Espectrofotometria no UV/Visível
Os espectros de transmitância na região UV/Visível foram obtidos utilizando um espectrofotômetro na região UV/Vis equipado com um integrador de esferas na região de 200 a 600 nm (Departamento de Química Orgânica e Inorgânica – UFC). O branco foi realizado com o sulfato de bário (UV-2600, SHIMADZU).
3.5.9 Atividade Fotocatalítica
A atividade fotocatalítica das amostras TiO2-COM, TiO2-US, TiO2/Al2O3 e TiO2/ZrO2 foi determinada pela fotodegradação do corante azul de metileno (AM). As análises foram realizadas em temperatura ambiente. 100 mg da amostra foram adicionados à 100 mL de uma solução de AM a 4,7 µM. A dispersão foi deixada em agitação magnética por 30 min para ocorrer o equilíbrio de adsorção/dessorção e então a amostra foi irradiada com luz negra UVA (25 W) por 180 min. A cada intervalo de 30 min, uma alíquota foi retirada e centrifugada a 6000 rpm por 5 min e a absorbância da solução de AM foi medida a 665 nm em um espectrofotômetro UV-Vis (Genesys 10S, Thermo Scientific).
A atividade fotocatalítica das amostras TiO2-COM, TiO2-US, TiO2/PAANa e TiO2/SiO2 foi determinada pela fotodegradação do corante Rodamina B (RB). As análises foram realizadas sob as mesmas condições utilizadas para o AM, porém, a concentração da solução de RB foi de 3,1 µM e a absorbância da solução foi medida a 554 nm (Departamento de Química Analítica e Físico Química-UFC).
3.5.10 Potencial ξ e DLS dos protetores solares
4 RESULTADOS E DISCUSSÃO
4.1 Difração de raios-X (DRX)
Figura 10 DRX das amostras de TiO2
Fonte: Próprio autor
a concordância entre o perfil observado e o calculado, respectivamente. Valores de Rwp entre 10-20% e S < 1,3 demonstram uma boa qualidade do refinamento (BEZERRA, 2007). Todas as amostras estão de acordo com estes valores. Na amostra de TiO2-COM foi possível identificar duas fases, sendo 96,73% rutila e 3,27% anatase. Nas demais, foi identificado uma única fase, sendo esta a rutila.
Tabela 3 Parâmetros estruturais das amostras refinadas pelo método de Rietveld.
Fonte: Próprio autor
O tamanho do cristalito para o TiO2-COM é de 58,84 ± 2,35 nm (rutila) e 85,97 ± 3,64 nm (anatase). Não houve mudanças de tamanho para a fase rutila na amostra TiO2-US (61,18 ± 2,25 nm) e, após os revestimentos, o tamanho do cristalito aumentou para 85,83 ± 3,60 nm, 75,09 ± 3,00 nm, 79,76 ± 3,26 nm, 72,67 ± 2,87 nm e 80,59 ± 3,31 nm para TiO2/Al2O3, TiO2/SiO2, TiO2/Citrato, TiO2/PAANa e TiO2/ZrO2, respectivamente. Não houve mudanças nos parâmetros de rede do TiO2-COM para as demais amostras.
Composto Tamanho do
Cristalito (nm) Parâmetros de Rede RWP (%) S TiO2-COM R: 58,84 ± 2,35
A: 85,97 ± 3,64
1°- a = b =4,5943 c = 2,9590
2°- a = b = 3,7899
c = 9,5427
15,54 0,89
TiO2-US 61,18 ± 2,25 a = b = 4,5954 c = 2,9599
17,70 0,89
TiO2/Al2O3 85,83 ± 3,60 a = b = 4,5937 c = 2,9588
17,47 0,90
TiO2/SiO2 75,09 ± 3,00 a = b = 4,5939 c = 2,9590
16,37 0,87
TiO2/Citrato 79,76 ± 3,26 a = b = 4,5934 c = 2,9589
15,52 0,87
TiO2/PAANa 72,67 ± 2,87 a = b = 4,5938 c = 2,9589
16,58 0,89
TiO2/ZrO2 80,59 ± 3,31 a = b = 4,5938 c = 2,9589
4.2 Flourescência de raios-X (FRX)
A Tabela 4 mostra o resultado da FRX. O TiO2-COM utilizado para os revestimentos apresenta quantidades de impurezas de Si (0,3%), Al (0,7%) e Zr (0,03%) provenientes do próprio fabricante. Também foi observado que devido ao processo de revestimento, a quantidade desses elementos aumentou. As amostras de TiO2-COM e TiO2-US apresentaram teor de Ti de 98,3% e 97,8%, respectivamente, enquanto as revestidas de TiO2/SiO2, TiO2/Al2O3 e TiO2/ZrO2 apresentaram teor de Ti de 96,9%, 93,8% e 61,5%, respectivamente. O decréscimo no teor de Ti é devido ao aumento do teor dos elementos Si (1,4%), Al (5,1%) e Zr (35,1%) nas respectivas amostras.
Tabela 4 Resultado das análises de FRX
Ti (%) Si (%) Al (%) Zr (%)
TiO2-COM 98,32 0,33 0,75 0,03
TiO2-US 97,84 0,48 1,06 0,05
TiO2/SiO2 96,92 1,40 1,04 0,04
TiO2/Al2O3 93,86 0,40 5,07 0,05
TiO2/ZrO2 61,16 0,27 0,49 35,16
Fonte: Próprio Autor
O equipamento utilizado para FRX detecta compostos do F ao U e não detecta compostos como Carbono e Oxigênio. Por esse motivo a FRX não foi realizada para as amostras revestidas com citrato e poliacrilato de sódio.
4.3 Espectroscopia na Região do Infravermelho (FT-IR)
Os espectros de FT-IR das amostras estão apresentados na Figura 11. As bandas em aproximadamente 1635 cm-1 e 3400 cm-1 estão presentes em todos os espectros das amostras e correspondem a vibração de dobramento da ligação H-O-H e estiramento O-H, respectivamente. Estas indicam a presença de água e grupos hidroxila na superfície do TiO2 (FURUSAWA et al., 2008).
características entre 1500-1650 cm-1 e aproximadamente em 1400 cm-1 que correspondem ao estiramento simétrico e assimétrico das ligações C-O e que, geralmente, aparecem no espectro das partículas revestidas com esse composto. Entretanto, a amostra revestida com citrato de sódio (TiO2/Citrato) não apresentou nenhuma dessas bandas em seu espectro, indicando a ausência desse composto na superfície do TiO2, fato que pode ser confirmado através da termogravimetria (seção 4.5). Para a amostra TiO2/ZrO2, também não houve o aparecimento de modos adicionais mostrado pelo FT-IR comparado ao TiO2-COM, embora um grande teor de Zr ter sido identificado pela FRX, o que pode ser devido a banda relativa a ligação Zr-O aparecer no espectro em bandas inferiores a 1000 cm-1, região muito próxima a banda referente ao TiO2, portanto, a intensidade da banda deve ser muito fraca para ser observada por FT-IR (ZHANG et al., 2010).
A amostra TiO2/SiO2, comparada ao espectro do TiO2-COM, apresenta uma banda em 1070 cm-1 que está relacionada ao estiramento assimétrico Si-O-Si (SIDDIQUEY et al., 2008). Ademais, a amostra TiO2/Al2O3 possui uma banda em 1071 cm-1 correspondente ao estiramento de Al-O, referente ao revestimento (LIU et al., 2009).
Figura 11 FTIR das amostras.
4.4 Espectroscopia Raman
A utilização da espectroscopia Raman teve como objetivo complementar o estudo estrutural realizado pela DRX. A Figura 12 apresenta os espectros Raman das amostras de TiO2 -COM, TiO2-US, TiO2/SiO2, TiO2/Al2O3, TiO2/ZrO2, TiO2/Citrato e TiO2/PAANa. Os espectros mostram que não há nenhuma modificação entre a amostra de TiO2-COM e as demais.
Figura 12 Espectroscopia Raman das amostras de TiO2
A estrutura cristalina rutila do TiO2 (grupo espacial D144h – P42/mnm) possui 4 modos Raman ativos: 614,52 cm-1 (A
1g), 141,18 cm-1 (B1g), 819,15 cm-1 (B2g) e 466,28 cm-1 (Eg), enquanto a estrutura anatase (grupo espacial D194h – I41/amd) possui 6 modos Raman ativos: 141,18 cm-1 (E
g), 154,46 cm-1 (Eg), 381,78 cm-1 (B1g), 503,72 cm-1 (B1g), 526,92 cm-1 (A1g) e 653,63 cm-1 (Eg) (FRANK et al., 2012). O modo vibracional existente nas duas fases cristalinas do TiO2 (141,18 cm-1) pode ser distinguido uma da outra pela intensidade, onde na fase anatase a banda é bem mais intensa. Os espectros das amostras de TiO2 mostram os 4 modos vibracionais referentes à fase rutila, que como já havia sido determinado pelo DRX, é a fase predominante nas amostras. Nenhuma nova banda relativa aos revestimentos foi detectada.
4.5 Termogravimetria
Como a FRX não identifica compostos orgânicos, foi realizado o TG/DTG para complementar a caracterização dos compostos TiO2/Citrato e TiO2/PAANa. As amostras TiO2 -COM e TiO2-US foram utilizadas para avaliar as mudanças realizadas nos compostos. Os resultados estão apresentados na Figura 13.
Figura 13 TG das amostras de TiO2
Fonte: Próprio autor
massa de 3,25%, enquanto as amostras TiO2-US e TiO2/Citrato, que estão quase sobrepostas no gráfico, perderam 1,69% e 1,73% em massa, correspondente a perda de água na superfície do material. Não há o aparecimento de nenhum outro evento para a amostra TiO2/Citrato referente a decomposição do polímero citrato de sódio, confirmando que o revestimento na superfície do TiO2 não ocorreu. A amostra TiO2/PAANa apresenta 5 eventos de perda de massa. Os dois primeiros eventos correspondem a perda de água superficial das partículas. Os eventos com picos máximos em 412 °C e 443 °C estão relacionados a ruptura dos grupos COO- e C-O do poliacrilato, sendo o evento de menor temperatura relacionado ao polímero fracamente ligado ao TiO2. Ainda há outro evento (580 °C), correspondente aos últimos fragmentos da cadeia advindos da cisão do polímero, mostrando que toda a matéria orgânica foi degradada (LIUFU; XIAO; LI, ; TAO; FEI; YUE-CHUAN, 2006; TETSUKA et al., 2007; PFLIPSEN et al., 2013).
4.6 Microscopia Eletrônica de Varredura (MEV)
A Figura 14 exibe as imagens de MEV das amostras com um fator de ampliação de 50.000X. A partir das imagens obtidas pelo MEV, pode-se verificar que as partículas de todas as amostras se apresentam aglomeradas com morfologia não uniforme. Foi possível determinar o tamanho médio das partículas a partir dessas imagens e o resultado obtido está apresentado na Figura 15.
As partículas de TiO2-COM possuem tamanho médio de 114,5 ± 2,44 nm e após as partículas passarem pelo processo de ultrassom (TiO2-US) houve uma diminuição no tamanho médio das partículas para 104,4 ± 2,29 nm. A diminuição no tamanho das partículas é resultado da energia gerada pelo processo cavitação promovido pelo ultrassom (SUMARI; ROESYADI; SUMARNO, 2013). Após o processo de revestimento, o tamanho médio das partículas amentou, sendo de 108,5 ± 1,98 nm, 116,2 ± 2,19 nm, 112,2 ± 1,15 nm e 132,8 ± 2,98 nm para TiO2/SiO2, TiO2/Al2O3, TiO2/ZrO2 e TiO2/PAANa, respectivamente. O aumento do tamanho médio das partículas é devido aos revestimentos na superfície das respectivas partículas.
A microscopia eletrônica de varredura (MEV) foi realizada com energia dispersiva de raios X (EDX). Dessa forma, foi possível obter o mapa composicional de cada amostra. As imagens obtidas por EDS estão apresentadas na Figura 16 e as composições de cada amostra obtidas por essa análise estão na Tabela 5.
ao processo de revestimento e a presença desses elementos na superfície do TiO2 pode ser observado na Fig. 15.
Figura 14 MEV das amostras de TiO2: (A) TiO2-COM, (B) TiO2-US, (C) TiO2/SiO2, (D) TiO2/Al2O3, (E) TiO2/ZrO2, (F) TiO2/PAANa
Figura 15 Histogramas das partículas de TiO2
Figura 16 EDS das amostras de TiO2
Fonte: Próprio autor
Tabela 5 Composição das amostras obtidas por EDX
Fonte: Próprio autor
Amostra Ti (%) O (%) Si (%) Al (%) Zr (%)
TiO2-COM 48,0 49,8 0,4 1,3 -
TiO2-US 54,1 42,9 0,6 2,0 -
TiO2/SiO2 42,6 53,8 1,7 1,5 -
TiO2/Al2O3 38,6 52,8 - 8,0 -
TiO2/ZrO2 34,3 49,2 - 1,2 14,8
4.7 Potencial ξ
O potencial ξ de uma partícula em uma suspensão é a carga de superfície medida experimentalmente em torno de uma partícula em um líquido. É uma das propriedades físicas de partículas importantes que determinam o seu comportamento de dispersão/aglomeração (OTSUKI; BRYANT, 2015). O potencial ξ foi realizado nas amostras, pois esse teste revela a intensidade da força de repulsão das partículas e dá um indicativo da estabilidade da suspenção. Esse parâmetro é crucial para o controle da estabilidade de partículas de TiO2 e mudanças em sua superfície, que podem alterar os valores do potencial ξ, além da utilização de diferentes solventes e pHs (LIAO; WU; LIAO, 2009). Nas análises realizadas, o solvente utilizado foi água destilada e o seu resultado está na Tabela 6.
Tabela 6 Potencial ξ e DLS para as amostras de TiO2
Fonte: Próprio autor
Na literatura, as dispersões de partículas são comumente classificadas em altamente instável (± 0-10 mV), relativamente estável (± 10-20 mV), moderadamente estável (± 20-30 mV) e altamente estável (± 30 mV), de acordo com os valores de potencial ξ. Entretanto, é importante destacar que a estabilidade coloidal é muito mais complexa que isso, sendo o potencial ξ apenas umas indicação dessa estabilidade (BHATTACHARJEE, 2016). Utilizando a classificação citada acima como forma de comparar as amostras, pode-se verificar que as partículas de TiO2-COM são bastante instáveis com potencial ξ de -5,29 ± 0.77 mV. As partículas do TiO2-US apresentam potencial ξ de -17.36 ± 0.11 mV, sendo classificadas com relativamente estáveis, mostrando que só método de ultrassom já é capaz de modicar a superfície das partículas, deixando-as mais negativas. A ultrasonicação afeta a superfície e a estrutura das partículas, atuando como forças repulsivas, prevenindo a aglomeração das partículas com o aumento dos valores de potencial ξ em módulo (MAHBUBUL et al., 2015).
Amostras ξ (mV) Raio hidrodinâmico
(nm)
PDI
TiO2-COM - 5.29 ± 0.77 2301 ± 1097,56 0.774 ± 0.391
TiO2-US - 17.36 ± 0.11 297,46 ± 3,66 0.182 ± 0.015
TiO2/SiO2 - 25.13 ± 0.41 298,73 ± 4,94 0.195 ± 0.007
TiO2/Al2O3 - 16.86 ± 0.56 1367,66 ± 254,26 0.848 ± 0.053
TiO2/ZrO2 - 21.4 ± 0.75 1921,33 ± 230,57 0.944 ± 0.095
Para as amostras revestidas, os valores de potencial ξ foram de -16.86 ± 0.56 mV para TiO2/Al2O3 (relativamente estável), -21.4 ± 0.75 mV para TiO2/ZrO2 (moderadamente estável), -25.13 ± 0.41 mV para TiO2/SiO2 (moderadamente estável) e -27.6 ± 0.52 mV para TiO2/PAANa (moderadamente estável). Portanto, todas as amostras apresentaram mudança na superfície das partículas após os revestimentos, sendo as amostras TiO2/SiO2 e TiO2/PAANa as que apresentaram maior potencial ξ em módulo.
As suspensões de partículas inorgânicas são estabilizadas pelos grupamentos -OH+, -OH e O-em suas superfícies. As mudanças do potencial ξ são devido a mudanças dessas cargas na superfície das amostras (SARKAR; KIM, 2015). As amostras TiO2-US, TiO2/SiO2, TiO2/ZrO2 deixaram a superfície do TiO2 mais negativa devido a maior quantidade de grupamentos -O-, usando a água como solvente. No caso do TiO
2/PAANa este fato foi devido aos grupos carboxilatos do poliacrilato de sódio.
O raio hidrodinâmico e o índice de polidispersão (PDI) foram obtidos pela técnica de espalhamento dinâmico da luz (DLS). A amostra de TiO2-COM apresenta um elevado raio hidrodinâmico de 2301 ± 1097,56 nm, assim como TiO2/Al2O3 (1367,66 ± 254,26 nm) e TiO2/ZrO2 (1921,33 ± 230,57 nm). Esses valores indicam uma grande aglomeração das partículas dessas amostras. TiO2-US apresenta menores tamanho de partícula (297,46 ± 3.66 nm) e valor de PDI (0.182 ± 0.015) comparado com o TiO2-COM, devido a energia do ultrassom que pode quebrar as partículas aglomeradas (MAHBUBUL et al., 2017), o que ocorre também para as amostras TiO2/SiO2 e TiO2/PAANa que apresentam raios hidrodinâmicos de 297,46 ± 3.66, 298,73 ± 4,94, 301,4 ± 3,67, respectivamente, indicando uma menor formação de aglomerados.
Valores de PDI superiores a 0,7 indicam que há uma grande heterogeneidade na distribuição das partículas, como ocorre para as amostras de TiO2-COM (0.774 ± 0.391), TiO2/Al2O3 (0.848 ± 0.053) e TiO2/ZrO2 (0.944 ± 0.095). Valores de PDI < 0,3 indicam uma homogeneidade das amostras, como evidenciado nas amostras TiO2-US (0.182 ± 0.015), TiO2/SiO2 (0.195 ± 0.007) e TiO2/PAANa (0.243 ± 0.014).
4.8 Espectrofotometria no UV/Visível
Figura 17 UV/Vis das amostras de TiO2
Fonte: Próprio autor
A partir do gráfico, pode-se verificar que todas as amostras apresentam um amplo espectro de proteção, pois, tanto na região UVB (290-320 nm) quanto boa parte da região UVA (320-400 nm), a transmitância é próxima de zero, ou seja, quase todos os raios nessa faixa foram bloqueados. Não houve diminuição da transmitância para as amostras revestidas nessa faixa de comprimento de onda, indicando que não houve perda de proteção mesmo com o teor de Ti diminuindo.
4.9 Atividade Fotocatalítica
A atividade fotocatalítica das amostras foi determinada analisando a sua capacidade em degradar os corantes azul de metileno (AM) e a Rodamina B (RB) (Figura 18). Para as amostras TiO2-COM, TiO2-US, TiO2/Al2O3 e TiO2/ZrO2 o azul de metileno foi utilizado. Não foi possível utilizar o AM para as amostras TiO2/SiO2 e TiO2/PAANa, pois estas adsorveram o AM e não foi possível separar o pó da solução por centrifugação. Dessa forma, foi utilizada a Rodamina B para avaliar a atividade fotocatalítica dessas amostras, assim como para as amostras TiO2-COM e TiO2-US para fins de comparação.
Figura 18 Corantes Utilizados para a atividade fotocatalítica
Fonte: próprio autor
Figura 19 Mecanismo fotocatalítico para o TiO2
Fonte: (ZHANG et al., 2011) Adaptado
Figura 20 Atividade fotocatalítica para TiO2-COM, TiO2-US, TiO2/Al2O3, e TiO2/ZrO2
Fonte: próprio autor
As amostras TiO2/Al2O3 e TiO2/ZrO2 degradaram o AM 7% e 3% menos que o TiO2-COM, respectivamente. Essa diminuição da atividade fotocatalítica pode ser devido a essas amostras não terem se dispersado da mesma forma que o TiO2-COM e TiO2-US, mostrando-se mais hidrofóbicas, impedindo, assim, o contato do TiO2 com a solução de azul de metileno e, consequentemente, diminuindo a formação de radicais hidroxila (TOLOTTI, 2004). Além disso, os revestimentos na superfície do TiO2 podem impedir a transferência de cargas para a superfície, com consequente diminuição da atividade fotocatalítica (EGERTON, 2013).
fotocatalítica, pois o contato do TiO2 com a solução de rodamina B diminuiu, diminuindo também a formação de radicais hidroxila.
Figura 21 Atividade fotocatalítica TiO2-COM, TiO2-US, TiO2/SiO2 e TiO2/PAANa.
Fonte: próprio autor
4.10 FPS dos Protetores Solares
Todos os protetores solares apresentam as mesmas características organolépticas (aspecto, cor, odor) e são mostrados na Figura 22. A partir dos produtos produzidos, foi possível calcular o fator de proteção solar para protetor solar. As concentrações de TiO2 em uma formulação podem variar de 4% a 25%, sendo utilizado, para as amostras, a concentração mínima. Os protetores solares foram colocados na fita Transpore® em uma lâmina, como mostrado na Figura 23, e o FPS foi calculado a partir da transmitância das amostras e pode-se verifica-los na Figura 24.
Figura 22 Protetores Solares produzidos com as amostras de TiO2
Figura 23 Fita Transpore® na lâmina para análise do FPS
Fonte: Próprio autor
Figura 24 FPS dos protetores solares
Fonte: Próprio autor
-COM, TiO2/SiO2 e TiO2/PAANa apresentam um FPS estatisticamente igual, ou seja, o revestimento não afetou a capacidade proteção das amostras, como já tinha sido evidenciado no UV/Vis de sólido. Para as amostras revestidas TiO2/Al2O3 e TiO2/ZrO2, houve uma pequena diminuição do FPS. Na análise de UV/Vis dos pós, para essas amostras, não houve diminuição da proteção contra os raios UV quando comparado ao TiO2-COM. Portanto, esse decréscimo no FPS pode estar relacionado a estabilidade desses protetores solares, como será mostrado nos resultados de potencial ξ e DLS.
Figura 25 FPS das amostras por comprimento de onda
Fonte: Próprio autor
4.11 Potencial ζ e DLS dos Protetores Solares
protetores contendo partículas de TiO2 revestidas, com exceção do TiO2/Al2O3, apresentaram um potencial ζ maior, em módulo, que o com o TiO2-COM. Além disso todas as amostras possuem um potencial ζ menor que -30 mV, indicando boa estabilidade. Porém, avaliando o resultado de DLS, pode-se perceber que os protetores com TiO2/Al2O3 e o TiO2/ZrO2 apresentam um alto raio hidrodinâmico (701,58 ± 121,35 nm e 2179,42 ± 1340,20 nm, respectivamente) e um alto valor de PDI (0,622 ± 0,099 e 0,894 ± 0,186, respectivamente), quando comparado ao TiO2-COM (338,35 ± 10,44 nm e 0,293 ± 0,039, respectivamente), indicando que as partículas estão bastante aglomeradas e com heterogeneidade na distribuição das partículas na formulação. Este fato pode explicar o porquê dessas amostras apresentarem um menor FPS comparado com as demais amostras, pois um grande tamanho de partícula resulta em baixa eficácia na atenuação dos raios UV (UKMAR et al., 2009; EGERTON; TOOLEY, 2012). Além disso, essa aglomeração pode acelerar a sedimentação das partículas, diminuindo a estabilidade do produto.
Tabela 6 Potencial ξ e DLS para os protetores solares
Amostras ζ (mV) Raio hidrodinâmico
(nm)
PDI
TiO2-COM - 32,9 ± 1,37 338,35 ± 10,44 0,293 ± 0,039
TiO2/SiO2 - 38,8 ± 4,15 432,12 ± 21,74 0,327 ± 0,035
TiO2/Al2O3 - 35,5 ± 1,56 701,58 ± 121,35 0,622 ± 0,099
TiO2/ZrO2 - 40,7 ± 6,15 2179,42 ± 1340,20 0,894 ± 0,186
TiO2/PAANa - 38,8 ± 3,62 265,86 ± 3,77 0,226 ± 0,023
Fonte: Próprio autor
5 CONCLUSÃO
De acordo com os resultados obtidos pelo FTIR, TG e MEV, pode-se concluir que o revestimento das partículas de TiO2-COM foi realizado com sucesso para todas as amostras (TiO2/SiO2, TiO2/Al2O3, TiO2/ZrO2 e TiO2/PAANa), com exceção da amostra TiO2/Citrato, por um processo rápido e fácil (radiação de ultrassom). Pelas análises de DRX, foi possível detectar duas fases no TiO2-COM: rutila e, em menor quantidade, anatase. Para as demais amostras, apenas a fase rutila foi detectada. Nas análises de FRX e MEV-EDS, foi possível verificar a presença dos elementos Si, Al e Zr nas amostras de TiO2/SiO2, TiO2/Al2O3, TiO2/ZrO2, respectivamente, relativos ao processo de revestimento. Além disso, o processo de revestimento foi confirmado pelas análises de FTIR e termogravimetria (TiO2/PAANa). No caso da amostra TiO2/Citrato, essas duas análises mostraram que não houve revestimento das partículas de TiO2 com o citrato de sódio.
As amostras TiO2/Al2O3 e TiO2/ZrO2 degradaram menos o corante azul de metileno que a amostra TiO2-COM degradou, ou seja, possuem uma menor atividade fotocatalíca que o TiO2-COM. Além disso, essas amostras apresentaram mesma proteção UV, verificada pelo UV/Vis nos pós. Foi possível verificar também uma melhora na estabilidade detectada pelo potencial ξ. Quando aplicados nos protetores solares, houve apenas uma leve diminuição do FPS comparado ao do TiO2-COM.
REFERÊNCIAS
AFONSO, S.; HORITA, K.; SOUSA E SILVA, J. P.; ALMEIDA, I. F.; AMARAL, M. H.; LOBÃO, P. A.; COSTA, P. C.; MIRANDA, M. S.; ESTEVES DA SILVA, J. C. G.; SOUSA LOBO, J. M. Photodegradation of avobenzone: stabilization effect of antioxidants. Journal of photochemistry and photobiology. B, Biology, v. 140, p. 36–40, nov. 2014.
BAKER, L. A.; GROSVENOR, L. C.; ASHFOLD, M. N. R.; STAVROS, V. G. Ultrafast photophysical studies of a multicomponent sunscreen: Oxybenzone–titanium dioxide mixtures. Chemical Physics Letters, v. 664, p. 39–43, nov. 2016.
BALOGH, T. S.; PEDRIALI, C. A.; KANEKO, T. M. Proteção à radiação ultravioleta μ recursos disponíveis na. Anais Brasileiros de Dermatologia, v. 1, p. 732–742, 2011.
BANG, J. H.; SUSLICK, K. S. Applications of Ultrasound to the Synthesis of Nanostructured Materials. Advanced Materials, v. 22, n. 10, p. 1039–1059, 1 fev. 2010.
BATISTA, T. S. de A. Desenvolvimento de nanomateriais absorvedores no ultravioleta para aplicação em filtros solares. 2010. Universidade Federal de Sergipe, 2010.
BENDOVÁ, H.; AKRMAN, J.; KREJČÍ, A.; KUBÁČ, L.; JÍROVÁ, D.; KEJLOVÁ, K.; KOLÁŘOVÁ, H.; BRABEC, M.; MALÝ, M. In vitro approaches to evaluation of Sun Protection Factor. Toxicology in Vitro, v. 21, n. 7, p. 1268–1275, 2007.
BHATTACHARJEE, S. DLS and zeta potential - What they are and what they are not?
Journal of Controlled Release, v. 235, p. 337–351, 2016.
BINKS, B. P.; FLETCHER, P. D. I.; JOHNSON, A. J.; MARINOPOULOS, I.;
CROWTHER, J.; THOMPSON, M. A. How the sun protection factor (SPF) of sunscreen films change during solar irradiation. Journal of Photochemistry and Photobiology A: Chemistry, v. 333, p. 186–199, 2017.
BLACK, A. T. Ultraviolet B. In: Encyclopedia of Toxicology. [s.l.] Elsevier, 2014a. p. 896– 898.
BLACK, A. T. Ultraviolet A. In: Encyclopedia of Toxicology. [s.l: s.n.]p. 893–895.
BOEHM, H.-P. Surface Chemical Characterization of Carbons from Adsorption Studies. In: NASIR, A.; FRIEDMAN, A.; WANG, S. (Ed.). Adsorption by Carbons. New York, NY: Elsevier, 2008. 34p. 301–327.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução da diretoria colegiada no 47, de 16 de março de 2006. Diário Oficial da República Federativa do Brasil, Poder Executivo, Brasília. p. 6–10, 2006.
CAVINATO, M.; JANSEN-DÜRR, P. Molecular mechanisms of UVB-induced senescence of dermal fibroblasts and its relevance for photoaging of the human skin. Experimental Gerontology, 14 jan. 2017.
COOLEY, J. H.; QUALE, L. M. Skin cancer preventive behavior and sun protection recommendations. Seminars in Oncology Nursing, v. 29, n. 3, p. 223–226, 2013.
DE VRIES, E.; SIERRA, M.; PIÑEROS, M.; LORIA, D.; FORMAN, D. The burden of cutaneous melanoma and status of preventive measures in Central and South America.
Cancer Epidemiology, v. 44, p. S100–S109, set. 2016.
DIFFEY, B. L.; ROBSON, J. A new substrate to measure sunscreen protection factors
throughout the ultraviolet spectrum. J. Soc. Cosmet. Chem., v. 40, n. June, p. 127–133, 1989.
EGERTON, T. A. The Influence of Surface Alumina and Silica on the Photocatalytic Degradation of Organic Pollutants. Catalysts, v. 3, p. 338–362, 2013.
EGERTON, T. A.; TOOLEY, I. R. UV absorption and scattering properties of inorganic-based sunscreens. International Journal of Cosmetic Science, v. 34, n. 2, p. 117–122, abr. 2012.
FLOR, J.; DAVOLOS, M. R.; CORREA, M. A. Protetores solares. Química Nova, v. 30, n. 1, p. 153–158, fev. 2007.
FRANK, O.; ZUKALOVA, M.; LASKOVA, B.; KOLTAI, J.; KAVAN, L. Raman spectra of titanium dioxide (anatase, rutile) with identified oxygen isotopes (16, 17, 18)w. Phys. Chem. Chem. Phys. Phys. Chem. Chem. Phys, v. 14, n. 14, p. 14567–14572, 2012.
FURUSAWA, T.; HONDA, K.; UKAJI, E.; SATO, M.; SUZUKI, N. The microwave effect on the properties of silica-coated TiO2 fine particles prepared using sol-gel method.
Materials Research Bulletin, v. 43, n. 4, p. 946–957, 2008.
GAROLI, D.; PELIZZO, M. G.; NICOLOSI, P.; PESERICO, A.; TONIN, E.; ALAIBAC, M. Effectiveness of different substrate materials for in vitro sunscreen tests. Journal of
Dermatological Science, v. 56, n. 2, p. 89–98, 2009.
GORDON, R. Skin cancer: An overview of epidemiology and risk factors. Seminars in Oncology Nursing, v. 29, n. 3, p. 160–169, 2013.
JI, C.; YANG, B.; YANG, Z.; TU, Y.; YANG, Y.; HE, L.; BI, Z.-G. Ultra-violet B (UVB)-induced skin cell death occurs through a cyclophilin D intrinsic signaling pathway.
Biochemical and biophysical research communications, v. 425, n. 4, p. 825–9, 7 set. 2012.
KOCKLER, J.; OELGEMÖLLER, M.; ROBERTSON, S.; GLASS, B. D. Photostability of sunscreens. Journal of Photochemistry and Photobiology C: Photochemistry Reviews, v. 13, n. 1, p. 91–110, 2012.
LEVI, K. UV damage and sun care: Deciphering mechanics of skin to develop next
generation therapies. Journal of the Mechanical Behavior of Biomedical Materials, v. 28, p. 471–473, 2013.
LI, H.; TRIPP, C. P. Interaction of sodium polyacrylate adsorbed on TiO2 with cationic and anionic surfactants. Langmuir : the ACS journal of surfaces and colloids, v. 20, n. 24, p. 10526–10533, 2004.
with surfactants. Colloids and Surfaces A: Physicochemical and Engineering Aspects, v. 348, n. 1, p. 270–275, 2009.
LIU, Q.-J.; RAN, Z.; LIU, F.-S.; LIU, Z.-T. Phase transitions and mechanical stability of TiO2 polymorphs under high pressure. Journal of Alloys and Compounds, v. 631, p. 192– 201, maio 2015.
LIU, Y.; ZHANG, Y.; GE, C.; YIN, H.; WANG, A.; REN, M.; FENG, H.; CHEN, J.; JIANG, T.; YU, L. Evolution mechanism of alumina coating layer on rutile TiO2 powders and the pigmentary properties. Applied Surface Science, v. 255, n. 16, p. 7427–7433, 2009.
LIUFU, S.-C.; XIAO, H.-N.; LI, Y.-P. Thermal analysis and degradation mechanism of polyacrylate/ZnO nanocomposites. [s.d.]
LU, P.-J.; HUANG, S.-C.; CHEN, Y.-P.; CHIUEH, L.-C.; SHIH, D. Y.-C. Analysis of titanium dioxide and zinc oxide nanoparticles in cosmetics. Journal of Food and Drug Analysis, v. 23, n. 3, p. 587–594, set. 2015.
MAHBUBUL, I. M.; ELCIOGLU, E. B.; SAIDUR, R.; AMALINA, M. A. Optimization of ultrasonication period for better dispersion and stability of TiO2–water nanofluid.
Ultrasonics Sonochemistry, v. 37, p. 360–367, 2017.
MAHBUBUL, I. M.; SAIDUR, R.; AMALINA, M. A.; ELCIOGLU, E. B.; OKUTUCU-OZYURT, T. Effective ultrasonication process for better colloidal dispersion of nanofluid.
Ultrasonics Sonochemistry, v. 26, p. 361–369, 2015.
MANAIA, E. B.; CRISTINA, R.; KAMINSKI, K.; CORRÊA, M. A.; CHIAVACCI, L. A. Inorganic UV filters. Brazilian Journal of Pharmaceutical Sciences, v. 49, n. 2, 2013.
MANCEBO, S. E.; HU, J. Y.; WANG, S. Q. Sunscreens: a review of health benefits, regulations, and controversies. Dermatologic clinics, v. 32, n. 3, p. 427–38, x, jul. 2014.
NAKANO, T.; YUASA, H. Suppression of agglomeration in fluidized bed coating. IV. Effects of sodium citrate concentration on the suppression of particle agglomeration and the physical properties of HPMC film. International journal of pharmaceutics, v. 215, n. 1-2, p. 3–12, 14 mar. 2001.
OTSUKI, A.; BRYANT, G. Characterization of the interactions within fine particle mixtures in highly concentrated suspensions for advanced particle processing. Advances in Colloid and Interface Science, v. 226, p. 37–43, 2015.
PFLIPSEN, C.; FORGE, D.; BENALI, S.; GOSSUIN, Y. Improved Stability and Relaxivity of a Commercial Magnetic Ferrofluid. The Journal of Physical Chemistry C, v. 117, n. 40, p. 20919–20926, 10 out. 2013.
PINJARI, D. V.; PRASAD, K.; GOGATE, P. R.; MHASKE, S. T.; PANDIT, A. B. Synthesis of titanium dioxide by ultrasound assisted sol–gel technique: Effect of calcination and
sonication time. Ultrasonics Sonochemistry, v. 23, p. 185–191, 2015.
SADRIEH, N.; WOKOVICH, A. M.; GOPEE, N. V; ZHENG, J.; HAINES, D.; PARMITER, D.; SIITONEN, P. H.; COZART, C. R.; PATRI, A. K.; MCNEIL, S. E.; HOWARD, P. C.; DOUB, W. H.; BUHSE, L. F. Lack of significant dermal penetration of titanium dioxide from sunscreen formulations containing nano- and submicron-size TiO2 particles. Toxicological sciences : an official journal of the Society of Toxicology, v. 115, n. 1, p. 156–66, maio 2010.
SAHA, A.; BASIRUDDIN, S. K.; RAY, S. C.; ROY, S. S.; JANA, N. R. Functionalized graphene and graphene oxide solution via polyacrylate coating. Nanoscale, v. 2, n. 12, p. 2777–2782, 2010.
SAMBANDAN, D. R.; RATNER, D. Sunscreens: An overview and update. Journal of the American Academy of Dermatology, v. 64, n. 4, p. 748–758, 2011.
SARKAR, N.; KIM, I. J. Porous Ceramics. In: MOHAMED, A. (Ed.). Advanced Ceramic Processing. [s.l.] InTech, 2015.
SIDDIQUEY, I. A.; FURUSAWA, T.; SATO, M.; HONDA, K.; SUZUKI, N. Control of the photocatalytic activity of TiO2 nanoparticles by silica coating with polydiethoxysiloxane.
Dyes and Pigments, v. 76, n. 3, p. 754–759, 2008.
SIREROL, J. A.; FEDDI, F.; MENA, S.; RODRIGUEZ, M. L.; SIRERA, P.; AUPÍ, M.; PÉREZ, S.; ASENSI, M.; ORTEGA, A.; ESTRELA, J. M. Topical treatment with
pterostilbene, a natural phytoalexin, effectively protects hairless mice against UVB radiation-induced skin damage and carcinogenesis. Free Radical Biology and Medicine, v. 85, p. 1– 11, 2015.
SMIJS, T. G.; PAVEL, S. Titanium dioxide and zinc oxide nanoparticles in sunscreens: focus on their safety and effectiveness. Nanotechnology, science and applications, v. 4, p. 95– 112, 2011.
SUMARI, S.; ROESYADI, A.; SUMARNO, S. Effects of ultrasound on the morphology, particle size, crystallinity, and crystallite size of cellulose. Scientific Study and Research: Chemistry and Chemical Engineering, Biotechnology, Food Industry, v. 14, n. 4, p. 229– 239, 2013.
TAO, W.; FEI, F.; YUE-CHUAN, W. Structure and thermal properties of titanium dioxide-polyacrylate nanocomposites. Polymer Bulletin, v. 56, n. 4-5, p. 413–426, 27 mar. 2006.
TETSUKA, H.; EBINA, T.; NANJO, H.; MIZUKAMI, F. Highly transparent flexible clay films modified with organic polymer: structural characterization and intercalation properties.
Journal of Materials Chemistry, v. 17, n. 33, p. 3545, 2007.
TOLOTTI, M. Protetores solares à base de filtros inorgânicos: desenvolvimento e caracterização. 2004. Universidade Estadual do Centro Oeste, 2004.
UKMAR, T.; GODEC, A.; MAVER, U.; PLANINŠEK, O.; BELE, M.; JAMNIK, J.; GABERŠČEK, M. Suspensions of modified TiO2 nanoparticles with supreme UV filtering ability,. Journal of Materials Chemistry, v. 19, n. 43, p. 8176, 2009.