UNIVERSIDADE FEDERAL DO CEARÁ
CENTRO DE TECNOLOGIA
DEPARTAMENTO DE ENGENHARIA HIDRÁULICA E AMBIENTAL
CURSO DE ENGENHARIA AMBIENTAL
VIVIANE MALVEIRA CAVALCANTI
DEGRADAÇÃO DE NAFTALINA EM SOLO CONTAMINADO -
RESULTADOS DE AMOSTRAS EM BATCH
DEGRADAÇÃO DE NAFTALINA EM SOLO CONTAMINADO - RESULTADOS DE AMOSTRAS EM BATCH
Monografia apresentada ao Curso de Engenharia Ambiental do Centro de Tecnologia da Universidade Federal do Ceará, como parte dos pré-requisitos para obtenção do grau de Engenheira Ambiental.
Orientador:Prof. Dr. Fernando José Araújo da Silva
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca de Ciências e Tecnologia
C367d Cavalcanti, Viviane Malveira.
Degradação da naftalina em solo contaminado: resultado em amostras Batch / Viviane
Malveira Cavalcanti. – 2015.
55 f. : il. color.
Monografia (Graduação) – Universidade Federal do Ceará, Centro de Tecnologia, Curso de
Engenharia Ambiental, Fortaleza, 2015.
Orientação: Prof. Dr. Fernando José de Araújo Silva.
1. Biodegradação. 2. Solos - Contaminação. 3. Cromatografia a gás. I. Título.
Á Deus, que guia meus passos e me mostra que nada é impossível aos seus olhos.
AGRADECIMENTOS
Agradeço, primeiramente, aos meus pais, por serem meu porto seguro nos momentos difíceis e me darem apoio incondicional ao longo dessa caminhada.
Ao meu pai, Guilherme, que me inspira e me incentiva a sempre buscar mais conhecimento e me mostra que sempre posso ir além para alcançar meus objetivos.
A minha mãe, Jô, pelo compreensivo amor que me dá e pelo exemplo de mulher batalhadora e determinada.
A minha irmã, que é meu espelho, minha amiga, meu suporte nas horas ruins e minha companhia diária.
Ao professor Fernando José, pela orientação, pela disponibilidade, e pela oportunidade que me concedeu, que foram indispensáveis para a elaboração deste trabalho e pelo exemplo de docente e profissional
À professora Ana Bárbara e ao professor Ronaldo Stefanutti que estiveram presentes nesta caminhada desde o início, mostrando-me os prazeres da Engenharia Ambiental como profissão.
Aos meus amigos da faculdade, que trilharam esse caminho ao meu lado, tornando-o mais prazeroso, compartilhando conhecimento e fornecendo ombro amigo incontáveis vezes.
Aos meus amigos de infância, que sempre estiveram ao meu lado, principalmente durante as maiores escolhas da vida.
Ao André, pelo carinho e companheirismo diário e por compreender e apoiar as minhas decisões.
À Universidade de Toronto, que me abraçou como estudante e me forneceu a oportunidade de desenvolver esta pesquisa em um de seus laboratórios.
Ao Governo Brasileiro e ao CNPq, pelo suporte financeiro concedido para que esta pesquisa fosse realizada.
Abstract
A study was conducted, at the Norah Vaughan Laboratories, at the University
of Toronto, Canada, in order to evaluate the potential of naphthalene’s
biodegradation under anaerobic conditions on a soil contaminated by petroleum byproducts. Soil samples were taken from a former fuel terminal in Greensboro, North Carolina, United States, in order to prepare microcosms simulating field conditions. The microcosms are kept at 30ºC water baths. In this study, the biodegradation was enhaced by the addition of naphthalene’s
to the sintetic groundwater produced in laboratory and added to the microcrosms. Three of the microcosms were sterelized and, in order to
evaluate naphthalene’s potential to volatilize and the adsorption potential of
the soil. Samples of the groundwater from the microcosms were analized weekly by performing a gas cromatography, using a flame ionization detection
and a SPME fiber. After 50 days of analysis, the groundwater naphthalene’s
Resumo
Um estudo realizado no Laboratorio Norah Vaughan, da Universidade de Toronto, em Toronto no Canadá foi conduzido para avaliar o potencial de biodegradação do naftaleno, um derivado do petróleo, sob condições anaeróbicas em um solo contaminado. Foram coletadas amostras do solo contaminado por hidrocarbonetos derivados do petróleo na cidade de Greensboro, situada na Carolina do Norte, nos Estados Unidos. Em laboratório, preparou-se uma água subterrânea com características físico-quimicas semelhantes as analisadas em campo. A partir das amostras de solo preparou-se oito microcosmos, que são mimetização das condições do campo. Os microcosmos foram mantidos em banho-maria a 30ºC. Nesse estudo, o crescimento da comunidade bacteriana foi induzido pela adição de naftaleno a água subterrânea sintética preparada e posteriormente introduzida nos microcosmos. Três microcosmos foram esterilizados, a fim de analisar-se o potencial de volatilização da substancia e de adsorção do solo. Amostras da água subterrânea dos microcosmos ativos e esterelizados foram analisadas semanalmente, a partir do método de cromatografia a gas, utilizando um detector de ionização de chamas e uma fibra para microextração em fase sólida. Ao fim dos 50 dias de análise, obteve-se uma degradação de 28% do naftaleno presente e uma adsorção e volatilização de 32% do naftaleno presente.
LISTA DE FIGURAS
Figura 1. Estrutura química do naftaleno (C10H8) ... 19
Figura 2. Relação entre taxa de crescimento de microbiano e a temperatura do meio ambiente. ... 24
Figura 3. Detector de Ionização por chama (FID) ... 25
Figura 4. Características do local contaminado. ... 26
Figura 5. Glove bag de polietileno ... 31
Figura 6. Microcosmos preparados. ... 32
Figura 7. Banho-Maria mantido a temperatura de 30ºC ... 33
Figura 8. Amostra de água subterrânea sintética sendo inserida no frasco de ambar ... 34
Figura 9. Seringas de vidro utilizadas para amostragem lavadas com solução de metanol ... 35
Figura 10. Equipamento GC Agilent Technologies 7890 – com ionização de chama e fibra SPME ... 36
Figura 11. Equipamento de cromatografia a gás ... 37
Figura 12. Esquema de monitoramento de pressão dos microcosmos. ... 38
Figura 13. Microcosmos ativos verdes e controles incolores ... 48
Figura 14. Concentrações de naftaleno na água subterrânea e local de onde foram retiradas as amostras de solo. ... 57
LISTA DE GRÁFICOS
Gráfico 1. Equação da reta a partir de soluções padrão de naftalina ... 39 Gráfico 2. Curva de degradação das soluções de naftalina utilizadas para
calibração na cromatografia... 40 Gráfico 3. Curva de degradação das soluções de naftalina utilizadas para
calibração na cromatografia... 40 Gráfico 4. Curva de calibração das soluções A. ... 41 Gráfico 5. Curva de calibração das soluções padrão preparadas em 09/04 .. 41 Gráfico 6. Taxa de degradação dos microcosmos controle ... 43
Gráfico 7. Taxa de degradação da naftalina nos microcosmos ativos ... 44 Gráfico 8. Equação linear da reta. ... 47 Gráfico 9 Concentração de naftalina nos microcosmos preparados há 300
LISTA DE TABELAS
Tabela 1. Valores de hidrocarbonetos aceitáveis em amostras de águas
subterrâneas ... 18
Tabela 2. Características físico-químicas da naftalina. ... 19
Tabela 3. Concentração final de íons e naftalina na água subterrânea sintéticaelaborada em laboratório. ... 30
Tabela 4. Soluções diluídas da solução estoque ... 31
Tabela 5. Resultados da constante degradação ... 46
Tabela 6. Pressão nas amostras 270 dias após o preparo. ... 49
Tabela 7. Monitoramento da pressão (Psi) nos microcosmos. ... 49
LISTA DE ABREVIATURAS E SIGLAS
HAPs - Hidrocarbonetos Aromáticos Policíclicos ET-DSP - Electro-Thermal Dynamic Stripping Process BTEX - Benzeno, Tolueno, Etilbenzeno e Xileno VOCs - Compostos Orgânicos Voláteis
OD - Oxigênio Dissolvido
NAPL - Non Aqueous Phase Liquid
SPME - Solid Phase Micro Extraction
GC-FID - Gas Chromatography – Flame Ionization Detector VRQ - Valor de Referência de Qualidade
VMP - Valor Máximo Permitido
SUMÁRIO
Introdução ... 13
1.1 Considerações iniciais ... 13
1.3 Objetivo Geral ... 14
1.3.1 Objetivos Específicos ... 14
1.4 Estrutura do trabalho ... 14
Revisão Bibliográfica ... 15
2.1. Sobre a exploração do petróleo ... 15
2.1.1 A Contaminação de águas subterrâneas e do solo ... 17
2.2 Naftalina ... 19
2.2.1 Disponibilidade da naftalina ... 20
2.3 Remediação de solos contaminados por derivados do petróleo ... 21
2.3.1 O efeito da temperatura na biorremediação ... 23
2.4 Cromatografia a gás ... 24
2.4.1 Cromatografia a gás com detector de ionização de chama ... 24
2.5 Prévia do campo de estudo ... 25
2.5 Legislação Vigente sobre Hidrocarbonetos Policicloaromáticos ... 27
Metodologia ... 29
3.1 Amostras de solo ... 29
3.2 Preparação da água subterrânea sintética ... 29
3.3 Solução estoque de naftalina ... 30
3.4 Soluções diluídas de naftalina ... 30
3.5 Preparação dos microcosmos ... 31
3.6 Preparação das amostras ... 33
3.7 Análise de naftalina ... 35
3.8 Método CG ... 36
3.9 Monitoramento da pressão interna dos microcosmos ... 37
3.10 Calibração do método ... 38
3.11 Soluções diluídas de naftalina ... 39
3.12 Limite de detecção do método ... 42
4.1 Degradação da naftalina ... 43
4.2 Microcosmos previamente preparados (2013) ... 46
Recomendações ... 51
Introdução
1.1 Considerações iniciais
A biorremediação é uma técnica que usa organismos para descontaminar solo ou água subterrânea. Esse procedimento consiste em dois métodos principais: i) estímulo ao crescimento da população microbial que degradam poluentes e/ou ii) adição de micróbios não presentes no local meio contaminado, a fim de completar a degradação do poluente (CETESB, 2001)
Portanto, para estimular o crescimento da população microbial, um aceptor de elétrons, como o oxigênio (O2), em processos aeróbios e os íons nitrato (NO3), sulfato (SO2) e gás carbônico (CO2), em processos anaeróbios, e uma fonte de carbono ou nutrientes são adicionados ao sítio de contaminação. Após a adição, os micro-organismos quebram as ligações dos contaminantes a fim de gerar subprodutos (byproducts) menos tóxicos (USEPA, 1996) ou mesmo degradá-los por completo.
No tocante à contaminação de solos e águas subterrâneas por compostos orgânicos voláteis, isto tem destaque, pela associação com a indústria de petróleo e os seus derivados. Um derivado comum é a naftalina, que é um componente liberado na combustão incompleta de alcatrão de carvão e óleo cru. Esse composto apresenta alta toxicidade para a saúde humana, podendo causar doenças diversas, após um longo período de exposição através da inalação ou ingestão (USEPA, 1998). Esse hidrocarboneto aromático policíclico (HAP) é considerado potencialmente cancerígeno, de acordo com a Agência Internacional para Pesquisas sobre o Câncer (IARC), o que torna o seu monitoramento ainda mais relevante.
A naftalina é semi-volátil, de baixo peso, baixo ponto de ebulição, baixa pressão de vapor, baixa solubilidade e altos coeficientes de sorção. Estas características a tornam difícil de degradar através da termoremediação (GERVAIS et al., 2010).
corresponde ao conteúdo microbiano natural. Desta forma, a biorremediação complementa a termoremediação, com base na própria microbiota do solo.
1.2 Motivação do estudo
A contaminação da água por derivados do petróleo é um problema que vem assolando os corpos hídricos em todo o mundo. De toda a água doce existente 96% disponível para consumo são de fontes subterrâneas, garantindo a sobrevivência de uma parte significativa da população mundial, 80% da Europa, Rússia e grande parte do Oriente Médio (MMA, 2007). Por isso, é importante que estudos acerca da degradação de derivados do petróleo em águas subterrâneas sejam elaborados. Futuramente, a recuperação de mananciais subterrâneos contaminados por derivados do petróleo será de importância crítica para a garantia de qualidade de vida em muitas localidades.
1.3 Objetivo Geral
Este trabalho visa analisar a biorremediação da naftalina em solo e água subterrânea contaminados por derivados do petróleo.
1.3.1 Objetivos Específicos
Analisar a degradação da naftalina por bactérias nativas, sob condições anaeróbias.
Analisar o potencial do solo de adsorver a naftalina, postergando sua presença na natureza.
1.4 Estrutura do trabalho
Revisão Bibliográfica
2.1. Sobre a exploração do petróleo
O petróleo é um óleo natural que possui uma coloração escura, é composto por hidrocarbonetos, é menos denso que a água, é inflamável e é utilizado na indústria como insumo produtivo (FREITAS E COSTA, 1969) Este óleo é formado a partir da decomposição da matéria orgânica originada do plâncton, no fundo dos mares e lagos, em um ambiente pouco oxigenado. Quando compactada e aquecida, a matéria orgânica decomposta da origem ao saproprel, precursor do petróleo. O processo de formação do petróleo é lento e exige condições de temperatura e pressão favoráveis a sua origem. Quanto à composição química, o óleo é formado por hidrocarbonetos complexos, de cadeia longa, podendo haver ligações de compostos sulfurados, nitrogenados, oxigenados e organometálicos entre as suas estruturas. O petróleo é encontrado em cavidades de rochas sedimentares, neste caso chamadas rochas reservatório, existindo uma rocha impermeável acima impedindo o seu fluxo ascendente (THOMAS, 2001)
Segundo Baird (2002), os combustíveis produzidos a partir do petróleo, como a gasolina e o óleo diesel, possuem um conteúdo energético alto e são relativamente baratos de serem produzidos, o que torna a exploração do petróleo ainda mais atraente para o setor industrial. Além de ser a fonte de energia mais utilizada no mundo atualmente, o petróleo dá origem a derivados que servem de matéria prima para uma variedade infindável de bens de consumo (MARIANO, 2005). Existem 5 (cinco) tipos de petróleo a serem utilizados pela indústria petroquímica:
Petróleo Brent: é o petróleo bruto. É produzido, principalmente na região do mar do Norte (Europa).
Petróleo light: consiste em um óleo refinado e sem impurezas, que produz gasolina com maior eficiência, sendo assim, o de maior valor.
naftênicos em sua composição química.
Petróleo parafínico: tem elevada concentração de hidrocarbonetos parafínicos.
Petróleo aromático: petróleo com hidrocarbonetos aromáticos na sua composição química.
Apesar de trazer desenvolvimento e benefícios à sociedade, a indústria petroquímica e as refinarias geram uma quantidade significante de resíduos perigosos, que quando em contato com a água subterrânea alteram suas características físico-químicas, tornando seus índices de toxicidade, de corrosividade e de patogenicidade prejudiciais a qualidade da água (ABDANUR, 2005).
Os derramamentos de óleo já ocorridos durante a história da exploração de petróleo forneceram informações acerca dos malefícios causados pelos seus derivados tanto para os seres humanos, quanto para o meio ambiente aquático e para as águas subterrâneas contaminadas.
Em 1991, o pior vazamento de petróleo da história aconteceu e de forma proposital pelas forças iraquianas. A abertura das válvulas dos poços de petróleo e oleodutos injetou um volume de 1,36 milhões de toneladas de contaminantes no Golfo Pérsico que percorreram mais de 1.600 km2, cobrindo a costa pérsica de óleo por mais de um ano.
Em 2010, um poço da British Petroleum explodiu, afundando uma plataforma de petróleo e levando mais de 11 milhões de litros de petróleo para o fundo do Golfo do México que se espalhou por mais de 1.500 km durante 87 dias, contaminando e matando diversas espécies de animais. Os efeitos desse vazamento ainda aparecem até hoje, quase 6 anos depois, sendo encontrado derivados de petróleo em ovos de pássaros e de algumas espécies de peixes.
causando malefícios a vida humana e aquática, além de poluir corpos hídricos, um bem que já se mostra escasso em várias partes do mundo.
2.1.1 A Contaminação de águas subterrâneas e do solo
O uso das águas subterrâneas como fonte de abastecimento humano tem aumentado significativamente nos últimos anos. A qualidade da água subterrânea é naturalmente melhor do que de corpos hídricos superficiais, tornando os custos com tratamento e infraestrutura bem menores quando águas subterrâneas são utilizadas para abastecimento humano (REBOUÇAS, 2006).
A contaminação de aquíferos por derivados do petróleo vem crescendo consideravelmente com o passar dos anos. O crescimento populacional, a descoberta de novas tecnologias e o aumento do poder de aquisição de bens de consumo originados de derivados do petróleo tem contribuído para o aumento da contaminação de corpos hídricos subterrâneos. Além disso, a quantidade de postos de combustíveis é um dos fatores chave para esse aumento, já que os tanques de armazenamento de gasolina têm vida útil de aproximadamente 25 anos, podendo aumentar a ocorrência de vazamentos nos seus últimos anos de vida (CORSEUIL; MARINS, 1997).
Um fator agravante é a ausência de uma fiscalização regular dos tanques de armazenamento e uma legislação eficaz, que possibilite o controle e regule a quantidade de postos de combustíveis. Em 1996, a Prefeitura de Joinville, Santa Catarina, realizou estudos em 65 postos da cidade e constatou que apenas um não apresentava problemas de contaminação do lençol freático.
O benzeno é o mais tóxico dos BTEX, possuindo um padrão de potabilidade de 10 ug/L, estabelecido pelo Ministério da Saúde. Além dos BTEX, derramamentos de gasolina acarretam na dispersão de hidrocarbonetos aromáticos policíclicos (HAPs), como o antraceno, o naftaleno e entre outros, que são prejudiciais à saúde humana e sofrem um longo processo de remediação natural.
Os hidrocarbonetos aromáticos policíclicos (HAPs) são produtos derivados da combustão incompleta de substâncias orgânicas, gerados naturalmente. Quando presentes no solo ou em águas subterrâneas, os HAPs são originados da produção industrial, da produção de carvão vegetal, ou da extração, manejo e utilização do petróleo e de seus derivados (BANFORTH; SINGLETON, 2005).
Uma das principais fontes geradoras dos HAPs é o vazamento nos tanques de armazenamento de combustíveis, localizados, muitas vezes próximos ao lençol freático. Os locais mais propícios a contaminação dos HAPs são os centros urbanos (LIMA et al., 2001). Uma vez em contato com a água, os HAPs se dispersam facilmente podendo chegar a rios e lagos urbanos, causando transtornos a vida aquática e ao ser humano, quando em contato com o solo, podem, em parte, aderir aos sedimentos por sorção, perpetuando sua existência no meio ambiente.
A CETESB, em 2001, publicou a primeira lista de valores para concentrações máximas aceitáveis de 37 compostos em solos e águas subterrâneas, na Tabela 1, vê-se os valores aceitáveis para a presença de BTEX e naftalina em águas subterrâneas no Estado de São Paulo.
Tabela 1. Valores de hidrocarbonetos aceitáveis em amostras de águas subterrâneas
Hidrocarbonetos CETESB (µg/L) ASTM (EUA) (µg/L)
Benzeno 1,00 NA
Tolueno 1,00 NA
Xileno 1,00 NA
Naftaleno NA 3,00
2.2 Naftalina
O naftaleno ou naftalina, como é comercialmente conhecido, é um hidrocarboneto aromático derivado da gasolina, composto por dois anéis benzênicos, representado pela fórmula C10H8. É uma substância encontrada no estado sólido a temperatura ambiente, é tóxica, inflamável, possui baixa solubilidade, cor branca e odor forte
Figura 1. Estrutura química do naftaleno (C10H8)
Fonte: infoescola (2010)
A degradação da naftalina na natureza ocorre de forma lenta devido as suas características físico-químicas, expressadas na Tabela 2.
Tabela 2. Características físico-químicas da naftalina.
Característica Valor (unidade)
Massa molar 128,17052 g/mol
Densidade 1,16 g/cm3
Ponto de fusão 80,35 ºC
Ponto de ebulição 218 ºC
Solubilidade 31,7 mg/L
Pressão a vapor 0,087 mmHg
Fonte: NEWFIELD (2014)
Quando lançado no meio ambiente, o naftaleno infiltra-se nas águas subterrâneas, fluindo na direção de rios e lagos. O naftaleno foi considerado uma das substancias mais presentes em rejeitos líquidos e sedimentos, aumentando sua toxicidade. (ELJARRAT; BARCELÓ, 2003).
2.2.1 Disponibilidade da naftalina
A biodisponibilidade de substratos disponíveis para a degradação depende primariamente da temperatura, pois as características dos compostos químicos são alteradas por mudanças na temperatura.
No caso da naftalina o composto tem transporte preferencial via transferencia de massa. Sua disponibilidade depende da transferência de massa da fase não aquosa (NAPL) para a fase aquosa (FEITKENHAUER; MARKL, 2003). Viamajala et al. (2007) descobriram que mesmo que a solubilidade da naftalina aumentasse com a temperatura, a sua degradação continua limitada pela transferência de massa. Além disso, uma quantidade relevante de naftalina é adsorvida pelo solo, já que ela apresenta coeficientes de sorção altos e baixa solubilidade mesmo em altas temperaturas.
A biodisponibilidade do naftaleno, também depende da fração organica do solo ( foc ), que é função do coeficiente de distribuição (Kd) e do coeficiente de partição solo-agua (Koc). (OWABOR, 2013)
𝑲𝒐𝒄 = 𝑲𝒅/𝒇𝒐𝒄 (1)
Esta relação implica que, quanto maior a fração de componentes orgânicos no solo, maior o coeficiente de sorção, consequentemente mais naftaleno é adsorvido. De acordo com Owabor et al (2013), solos argilosos retêm mais naftaleno que solos arenosos, pois este fica imóvel sob a forma não aquosa com maior dificuldade para percolar, já os solos arenosos retém mais naftaleno durante a dessorção. Conclui-se que o tipo de solo impacta na biodisponibilidade do naftaleno. Os HPAs que são em sua maior parte semi-voláteis e imiscíveis em água, tendem a permanecer adsorvidos no solo, tornando mais dificil a sua biorremediação (CUNNINGHAM et al, 2004)
longo período, como por exemplo, por microesporos e por difusão de matéria orgânica. Após estes processos, a desorção torna-se mais dificil de ocorrer, prolongando a existencia dos contaminantes na natureza (HULSHER; CORNELISSEN, 1996).
2.3 Remediação de solos contaminados por derivados do petróleo
Existem várias técnicas de remediação de solos contaminados por petróleo e seus derivados, como a atenuação natural, a termorremediação e a biorremediação, que são as formas mais utilizadas atualmente (ANDRADE, 2010).
A atenuação natural é a tecnologia de remediação que faz uso dos processos naturais (volatilização, diluição, dispersão, biodegradação e adsorção) para o acompanhamento da degradação natural dos contaminantes. Antes de seu uso deve-se realizar uma caracterização geral da área e durante seu processo deve-se realizar a modelagem da evolução da degradação dos contaminantes. Este método é largamente utilizado para a remediação de contaminantes como os compostos orgânicos voláteis (VOCs) não halogenados e combustíveis derivados do petróleo (SCHMIDT, 2010) Contudo, a adoção desse processo deve ser feita com ressalvas, dependendo do tipo e da concentração dos contaminantes, devendo-se sempre basear-se em estudos preliminares e elaborar-se uma análise de risco da população exposta a contaminação.
A biorremediação é uma técnica que atua através da aceleração do processo natural de biodegradação. Esse processo ocorre devido a adição de microrganismos no meio ambiente contaminado, para degradar contaminantes específicos e é bastante empregada para degradar hidrocarbonetos derivados do petróleo e compostos orgânicos clorados. Essa técnica pode ser aplicada in-situ ou ex-situ e consiste na degradação dos contaminantes, que são usados como fonte de alimentação, por microrganismos inseridos no ambiente ou lá presentes (MOLINA-BARAHONA et al, 2004) Pode-se considerar a biorremediação uma otimização da biodegradação, podendo ocorrer de três formas diferentes.
Através da bioestimulação, que consiste na adição de nutrientes, estimulando assim o crescimento da população microbiana ja existente, da bioaugmentação, que consiste na adição de microrganismos ao ambiente para que o contaminante seja degradado ou da biorremediação intrínseca, que consiste no monitoramento e análise da atenuação natural.
A biorremediação intrínseca é um método que vem crescendo atualmente, pois estudos previamente realizados comprovaram que o deslocamento da pluma é limitado pela degradação natural dos contaminantes, diminuindo assim com o passar dos anos (CORSEUIL; MARINS, 1998).
2.3.1 O efeito da temperatura na biorremediação
A biodegradação de hidrocarbonetos no solo é uma variável dependente de vários parâmetros físico-químicos, como por exemplo, pH, temperatura e quantidade de nutrientes e de características biológicas dos microrganismos nativos (BETANCUR-GALVIS et al., 2006). A biodisponibilidade do substrato também é um fator muito importante para a concretização da biodegradação. Menedez-Venga et al. (2007) destacam que o solo contaminado por óleo possui concentração maior de contaminantes com uma solubilidade baixa. Isto diminui a eficiência da biorremediação.
O impacto da temperatura no crescimento e na sobrevivência dos microrganismos é muito delicado. Cada espécie de micro-organismo tem uma temperatura mínima para que seu crescimento ocorra, na medida em que a temperatura aumenta o ponto ótimo pode ser atingido, momento em que as taxas das reações químicas e enzimáticas atingem nível máximo.
O contínuo aumento da temperatura acima desse nível começa a inibir o crescimento dos microrganismos e suas funções, até que as moléculas perdem sua estrutura por meio de um processo chamado desnaturação (MADIGAN et al., 1984). Nesse estudo, os microcosmos foram mantidos a 30º C, que é denotada baixa temperatura, onde as bactérias mesófilas e termófilas funcionam fora do seu ponto ótimo. Pseudomonas aeruginosa e Pseudomons fluoresens são dois dos micro-organismos degradadores de hidrocarbonetos aromáticos policíclicos mais comuns já estudados. A literatura tem mostrado que eles apresentam taxas de crescimento melhores entre 40º e 45º C (HARITASH; KAUSHIK, 2009).
Figura 2. Relação entre taxa de crescimento microbiano e a temperatura do meio ambiente.
Fonte: NEWFIELD (2014)
Hidrocarbonetos aromáticos policíclicos (HAPs) são contaminantes frequentes do solo. A degradação dos HAPs por microrganismos mesófilos e termófilos sob condições aeróbicas tem sido bastante estudada (FEITKENHAUER; MARKL, 2003) Como mostra a figura 2, os microrganismos termófilos têm uma taxa de crescimento maior que os mesófilos na sua temperatura ótima, o que significa que o processo de degradação ocorre mais rápido quando organismos termófilos são utilizados.
2.4 Cromatografia a gás
A cromatografia a gás é um método físico-químico empregado para a separação de substâncias. Este método consiste em duas fases imisciveis, que tornam possível a separação de componentes baseada na diferença de interações entre a fase móvel e a fase estacionária. As substâncias a serem analisadas por esse método são gasosas ou voláteis (COLLINS; BRAGA 1993). Uma técnica muito utilizada na indústria petroquímica e de gás natural, é a cromatografia a gás com detector de ionização de chama (SAARI, 2009).
2.4.1 Cromatografia a gás com detector de ionização de chama
ao longo da coluna cromatográfica. Os componentes da amostra são separados a partir da aplicação de um método com rampas de temperaturas. Ao sair da coluna, os compostos passam pelo detector de ionização de chama, ilustrado na Figura 3, onde sofrem pirólise, pela ação do gás hidrogênio, produzindo compostos eletricamente carregados. (HARRIS, 2012) Quando amostras são voláteis ou as concentrações analisadas são de uma escala não usual utiliza-se uma coluna com fibra para microextração em fase sólida (SPME). A fibra não utiliza solventes e pode ser utilizada para amostras líquidas ou headspace. (ALPENDURATA, 2000)
Figura 3. Detector de Ionização de chama (FID)
Fonte: Linde gas (2015)
2.5 Prévia do campo de estudo
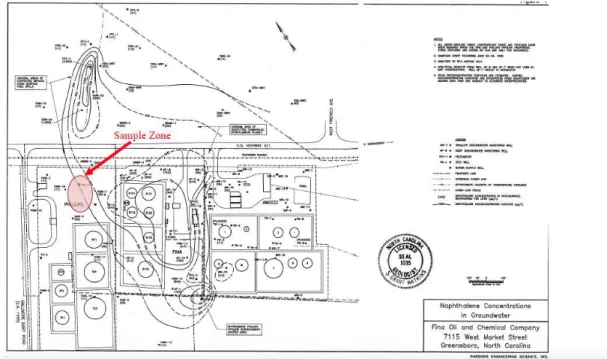
Amostras de solo foram retiradas de um antigo posto de combustíveis, situado em Greensboro, na Carolina do Norte, que operou entre 1973 e 1990. Durante o tempo de funcionamento do posto de combustíveis houve a contaminação do lençol freático por gasolina, diesel e querosene, devido a vazamentos no tanque subterrâneo de combustíveis.
localizada entre 18 e 24 metros. O nível da água variava entre 2,5 e 6,0 m de profundidade, dependendo da localização. Todas as amostras foram retiradas de profundidades acima de 6 metros, a fim de se garantir as condições necessárias para a remediação da água subterrânea contaminada.
A pluma de contaminantes antes da retirada das amostras de solo era composta por 7,4% em peso de naftaleno e a concentração de naftalina em alguns pontos chegava a 3.900 µg/L. Entretanto, nas amostras retiradas para este estudo, a concentração de naftalina é em torno de 1,0 µg/L. Outros parâmetros físico-químico também foram analisados previamente, os níveis de oxigênio dissolvido obtiveram uma média de 0,05 mg/L, as concentrações de ferro, 95 mg/L, e de sulfato 4 mg/L.
A Figura 4 ilustra uma representação geológica do local de onde foram retiradas as amostras de solo.
Figura 4. Características do local contaminado.
Fonte: ARCADIS (2005).
foi executada, removendo aproximadamente 42 m3 de hidrocarbonetos aromáticos policíclicos.
Em 2004, um estudo no campo abordou 3 diferentes tipos de tecnologias de remediação, desidratação à vácuo, aspersão de ar a vácuo e ET-DSP, patenteada pela corporação McGillan e McGee. Os resultados obtidos mostraram que o método ET-DSP™ obtinha um tempo de
remediação de 3 anos, o método de aspersão de ar combinado com a extração de vapor obteve um tempo de remediação de aproximadamente 15 a 20 anos. Entre 2007 e 2010, o método ET-DSP foi implantado em uma das quatro zonas de contaminação obtendo uma queda de 85% na concentração dos hidrocarbonetos derivados do petróleo.
Este método é baseado no aquecimento de resistências elétricas, através da instalação de eletrodos ao redor da superfície contaminada e da aplicação de uma DDP (diferença de potencial) de 3 Volts, aquecendo a superfície e a água subterrânea a temperaturas acima de 100º C. Ao fim da aplicação do método, os contaminantes com pressão de vapor maiores que 5 mmHg a 10º C não foram retirados, necessitando assim da biodegradação natural para removê-los totalmente.
2.5 Legislação Vigente sobre Hidrocarbonetos Policicloaromáticos
No Brasil, a Resolução 420 do Conselho Nacional do Meio Ambiente (CONAMA), publicada em 28 de dezembro de 2009, dispõe sobre critérios e valores orientadores de qualidade do solo quanto à presença de substâncias químicas e estabelece diretrizes para o gerenciamento ambiental de áreas contaminadas por essas substancias em decorrência de atividades antrópicas. Os hidrocarbonetos políciclicos aromáticos se enquadram na categoria disposta, quando não ocorrem naturalmente no solo e em águas subterrâneas.
naftaleno, é admitida uma concentração de 0,12 mg/kg de solo seco, e uma concentração de 140 ug/L de água subterrânea.
Além desta, encontra-se vigente também a Resolução 396, publicada em 07 de abril de 2008, que dispõe sobre a classificação e diretrizes ambientais para o enquadramento das águas subterrâneas e dá outras providências.
A partir desta Resolução, classificou-se as águas subterrâneas de acordo com o seu uso e estabeleceu-se padrões e condições de qualidade da água, como forma de controle e prevenção da poluição das águas subterraneas.
Esta Resolução estabelece em seu artigo 6º, que os padrões das Classes 1 a 4 são estabelecidos com base nos Valores de Referência de Qualidade (VRQ), nos Valores Máximos Permitidos (VMP) para cada uso, e nos Limites de Quantificação Praticáveis (LQPs), que encontram-se dispostos no Anexo I da Resolução. Porém, são estabelecidos VMP e LQP para os fenóis de cadeia até 10 carbonos, estando o naftaleno incluso nesse grupo. A Resolução estabelece um VMP de 3 ug de naftaleno por litro de água subterranea utilizada para consumo humano, 2 ug/L quando utilizada para dessendentação de animais ou recreação e um LQP de 10ug/L.
Dentre os Estados Brasileiros, apenas o Estado de São Paulo possui uma legislação que trata da contaminação de águas subterrâneas por HAPs regida pela Companhia Estadual de Tecnologia e Saneamento Básico (CETESB).
Metodologia
3.1 Amostras de solo
Uma amostra de areia argilosa obtida de um antigo terminal de combustíveis em Greensboro, Carolina do Norte, localizada em uma zona termoremediada, atingiu uma temperatura pico de 37 ºC em 2012 e foi retirada de uma profundidade de 11,25 m. As amostras foram extraídas por uma empresa subcontratada para McMillan-McGee, usando um geoprobe de perfuração e posteriormente foram enviadas ao Laboratório de Meio Ambiente Nora Vaughan, na Universidade de Toronto, onde as amostras foram homogeneizadas para a pesquisa.
3.2 Preparação da água subterrânea sintética
A água subterrânea sintética foi preparada a fim de simular as
condições da água subterrânea presente “in situ”. A solução de sais minerais consistiu na seguinte mistura: 1 mL de sulfato de ferro (11,6 g/L FeSO4), 1
mL de carbonato de cálcio (80,2 g/L CaCO3),1 mL de cloreto de magnésio (80,2 g/L CaCO3) e 1 mL de nitrato de sódio (4,2 g/L NaNO3) em uma garrafa de vidro com 1 litro de água ultrapura proveniente de MilliQ, purgada com uma mistura gasosa de nitrogênio e oxigênio (70% de N2 com 30% de O2). Ácido clorídrico (0,1N HCL) também foi adicionado a garrafa a fim de manter um pH neutro (pH = 7).
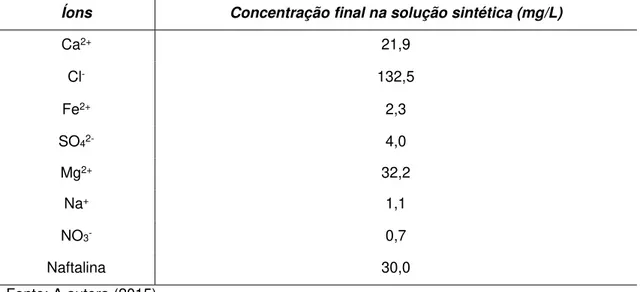
Tabela 3. Concentração final de íons e naftalina na água subterrânea sintéticaelaborada em laboratório.
Íons Concentração final na solução sintética (mg/L)
Ca2+ 21,9
Cl- 132,5
Fe2+ 2,3
SO42- 4,0
Mg2+ 32,2
Na+ 1,1
NO3- 0,7
Naftalina 30,0
Fonte: A autora (2015)
3.3 Solução estoque de naftalina
Para preparar a solução de estoque de naftalina a ser adicionada nos microcosmos, 7,5 mg de naftalina sólida (Sigma Aldrich > 99%) foram adicionadas a uma garrafa de vidro com 250 mL de Água MilliQ. A garrafa de vidro foi embalada com papel alumínio, pois a naftalina é um composto fotosensitivo, e foi agitada magneticamente por 1 semana. Após uma semana a concentração da solução apresentou valor próximo a solubilidade da
naftalina em água a 25˚ C, 30 mg/L. A solução padrão de estoque foi mantida na capela.
3.4 Soluções diluídas de naftalina
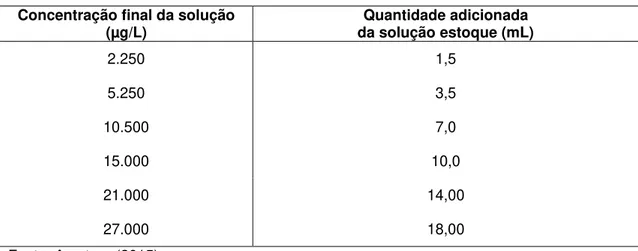
Tabela 4. Soluções diluídas da solução estoque Concentração final da solução
(µg/L)
Quantidade adicionada da solução estoque (mL)
2.250 1,5
5.250 3,5
10.500 7,0
15.000 10,0
21.000 14,00
27.000 18,00
Fonte: A autora (2015)
3.5 Preparação dos microcosmos
Os microcosmos foram preparados dentro de uma glove bag de polietileno (Atmosbag Sigma Aldrich), ilustrada na Figura 5. Antes do início da preparação a glove bag foi purgada duas vezes com gás nitrogênio e depois cheia de gás nitrogênio (N2(g), PRAXAIR), a fim de garantir um ambiente anaeróbio. Todo o material usado foi lavado e auto clavado previamente.
Figura 5. Glove bag de polietileno
Foram preparados 8 (oito) microcosmos, ilustrados na Figura 6, através da adição de 10 gramas de solo argilo-arenoso e 60 mL de água subterrânea sintética em garrafas de vidro de 120 mL. As garrafas foram então seladas com rolhas azuis (Bellco Glass) e tampadas com cápsulas de aço inoxidável. Após o preparo, 03 (três) microcosmos foram esterilizados, utilizando seringas de vidro (gastight #1001 Hamilton), adicionando 0,1 mL de azida sódica e 0,3 mL de cloreto de mercúrio (HgCl2) para inativar quaisquer micro-organismos presente. 1 mL da solução de estoque de naftalina (30 mg/L) foi adicionado aos cinco (05) microcosmos que não foram esterilizados, os quais foram denominados ativos. Após a adição da naftalina, 100 µL de resazurina foram adicionados ao microcosmo controle 3 e aos microcosmos ativos 3 e 5, a fim de controlar as condições anaeróbicas. A resazurina é um indicador de condições aeróbias, já que quando em contato com o oxigênio adquire uma coloração rosada.
Figura 6. Microcosmos preparados.
Fonte: A autora (2014)
Após o procedimento preparatório, os microcosmos foram estocados dentro de banhos-maria mantidos a 30˚C, equipamento ilustrado na Figura 7.
subterrânea sintética de dentro das garrafas de microcosmos durante todo o estudo.
Figura 7. Banho-Maria mantido a temperatura de 30ºC
Fonte: A autora (2014)
3.6 Preparação das amostras
O procedimento para amostragem ocorre dentro do exaustor e consistiu no seguinte passo a passo:
1. Separam-se frascos de âmbar de 2mL para que as amostras de água subterranea retiradas dos microcosmos sejam inseridas;
2. Adiciona-se 0,3 mL de água MilliQ aos frascos de âmbar de 2 mL; 3. Retira-se os microcosmos do banho-maria, com o máximo de cuidado
para que o ambiente não sofra nenhuma perturbação brusca; 4. Esteriliza-se as tampas dos microcosmos com etanol 70%;
5. Acoplam-se agulhas calibre 22 (BDPrecision Glide Needle) a seringas de vidro de 1 mL (gastight #1001 Hamilton);
7. Descarta-se a agulha da seringa, mantendo o conteúdo de 1mL extraído dentro da seringa de vidro;
8. Acopla-se um filtro de membrana 0,22 micron (Millex com membrana PVDF) a uma agulha calibre 25 (5/8) (BDPrecision Glide Needle) 9. Insere-se o conjunto na seringa que contém 1 mL da água
subterranea. A adição do filtro faz-se necessária pois os sedimentos presentes na água subterranea podem vir a interfir na análise cromatográfica.
10. Insere-se a água subterrânea sintética contida nas seringas de vidro nos frascos de ambar.
11. Sela-se os frascos de ambar com tampas de alumínio.
12. Lava-se a seringa 5 vezes com metanol (Sigma Aldrich,>99%) depois que cada amostra é dispensada dentro dos frascos de âmbar.
Nas Figuras 8 e 9 vê-se detalhes da injeção das amostras nos frascos de âmbar utilizando uma seringa de vidro.
Figura 8. Amostra de água subterrânea sintética sendo
inserida no frasco de ambar
Figura 9. Seringas de vidro utilizadas para amostragem lavadas com solução de metanol
Fonte: A autora (2014)
3.7 Análise de naftalina
A análise de naftalina é realizada utilizando o equipamento GC Agilent Technologies 7890 com ionização de flama (GC-FID) e com coluna capilar DB 624, ilustrados na Figura 10. Uma microextração da fase sólida (SPME) é usada para extrair amostras dos frascos de âmbar. A fibra (calibre 24, 50/30 μm, DVB/CAR/PDMS - Supelco) é acoplada ao amostrador de SPME e é inserida nas amostras através do septo das tampas de alumínio dos frascos de âmbar de 2mL. Antes de usa-la a primeira vez, a fibra é calibrada, procedimento que consiste na imersão da mesma na amostra líquida por 25 minutos a uma temperatura de 260˚C. Após a calibração, a
Figura 10. Equipamento GC Agilent Technologies 7890 –
com ionização de chama e fibra SPME
Fonte: A autora (2014)
3.8 Método CG
O método utilizado para a análise das amostras foi o desenvolvido por Newfield K. (2014), o qual consiste em ajustar o equipamento a:
1. Taxa de fluxo de Gás Hélio pureza 5,0 (Praxair)
2. Taxa de aquecimento do forno 40˚C por 1 min, sofrendo um
aumento de 25˚C/minuto até 200˚C, temperatura mantida por 1,5
minutos.
3. Detector FID mantido a 250˚C, com Hidrogênio pureza 5,0 (Praxair) e Hélio pureza 5,0 (Praxair) a uma vazão de 30 mL/min.
Como as concentrações das amostras estavam acima de 500 μg/L, um método de dessorção da fibra foi executado entre as amostras, a fim de obter-se a limpeza da fibra SPME. O método consiste em dessorver a fibra SPME por 600s na entrada do cromatógrafo por 8 min, mantendo o detector
FID a 250˚C. A entrada é mantida a 260˚C. O forno é mantido a 40˚C por 1 minuto, sofrendo um aumento de 35˚C/minuto até 200˚C, sendo a temperatura final mantida por 5 minutos.
3600s na entrada, que é mantida a 250˚C, com uma vazão de 8mL/min de
gás hélio pureza 5,0 (Praxair). O forno é mantido a 65˚C por 1 minuto,
sofrendo um aumento de 25˚C por minuto até 260˚C, temperatura mantida
por 50,8 minutos.
Um esquema do equipamento e do seu funcionamento do equipamento ilustrado na Figura 11.
Figura 11. Equipamento de cromatografia a gás
Fonte: Lanças, F.M. Cromatografia Unificada. Universidade de São Paulo, 2004.
3.9 Monitoramento da pressão interna dos microcosmos
Em 2013, foram preparados 18 microcosmos com o mesmo solo do antigo posto de combustível e utilizando o mesmo método de preparação, a fim de estudar-se o efeito da termorremediação na degradação da naftalina. Os microcosmos foram separados e mantidos a três temperaturas, 30˚C, 45˚C e 60˚C.
Estes microcosmos tiveram sua pressão monitorada. Os frascos
Para medir a pressão acoplou-se o medidor de pressão a uma seringa e a uma agulha calibre 22 (BDPrecision Glide Needle), ilustado na Figura 12. O procedimento para liberar a pressão consiste em extrair o ar do espaço acima do nível da água subterrânea utilizando uma seringa de 60 mL acoplada a uma agulha calibre 22 (BDPrecision Glide Needle). Durante esse procedimento, o medidor de pressão mostra a diferença de pressão, na medida que a seringa puxa o ar para fora do microcosmo.
Figura 12. Esquema de monitoramento de pressão dos microcosmos.
Fonte: A autora (2014)
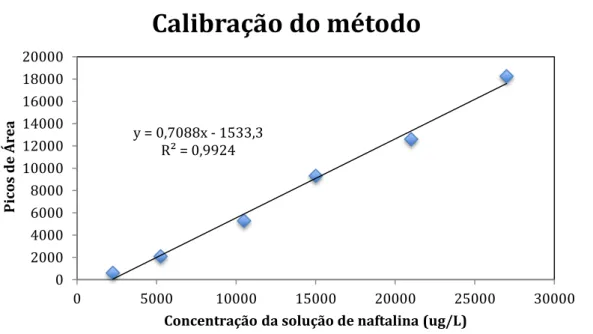
3.10 Calibração do método
Gráfico 1. Equação da reta obtida a partir de soluções padrão de naftalina
3.11 Soluções diluídas de naftalina
As soluções diluídas de naftalina foram analisadas aproximadamente 1 vez por semana, para manter o equipamento GCAgilent Technologies 7890 calibrado.
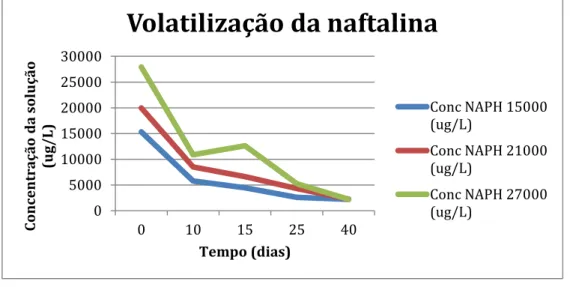
Estas soluções mostraram uma alta taxa de volatilização nos primeiros 10 dias, devido a alta volatilidade da naftalina. Percebe-se também que as amostras com menores concentrações obtiveram uma queda menor na concentração total em comparação com as amostras de maior concentração. Após 30 dias, as soluções apresentaram uma taxa de volatilização quase estável e concentrações entre 2.200 ug/L e 2.600 ug/L, não importando a concentração inicial da solução. Conclui-se que após um certo período de tempo a naftalina atinge um equilíbrio de concentração, quando não esta exposta a um ambiente onde possa ser adsorvida ou degradada. Vide volatilização nos gráficos 2 e 3.
y = 0,7088x - 1533,3 R² = 0,9924
0 2000 4000 6000 8000 10000 12000 14000 16000 18000 20000
0 5000 10000 15000 20000 25000 30000
Picos
d
e
Ár
ea
Gráfico 2. Curva de degradação das soluções de naftalina utilizadas para calibração na cromatografia.
Gráfico 3. Curva de degradação das soluções de naftalina utilizadas para calibração na cromatografia.
Durante o desenvolvimento dessa pesquisa, uma nova solução padrão de estoque de naftalina foi preparada, chamada de solução de estoque B, utilizando o mesmo procedimento, a fim de comparar o resultado da primeira calibração da solução A com a solução B e a taxa de degradação das duas soluções. Após o preparo da solução de estoque, novas soluções diluídas também foram preparadas.
As soluções diluídas B foram utilizadas na calibração do equipamento e apresentaram um intervalo de confiança menor quando comparadas com as soluções de estoque A.
0 2000 4000 6000 8000 10000 12000
0 10 15 25 40
C on cent ra çã o d a so lu çã o (u g/L) Tempo (dias)
Volatilização da naftlina
Conc NAPH 2250 (ug/L)
Conc NAPH 5250 (ug/L)
Conc NAPH 10500 (ug/L) 0 5000 10000 15000 20000 25000 30000
0 10 15 25 40
C on cent ra çã o d a so lu çã o (u g/ L ) Tempo (dias)
Volatilização da naftalina
Conc NAPH 15000 (ug/L)
Conc NAPH 21000 (ug/L)
Gráfico 4. Curva de calibração das soluções A.
Gráfico 5. Curva de calibração das soluções padrão preparadas em 09/04
Essa diferença de pico de área se deve as condições de preparo das soluções de estoque, como a exposição a luz durante o período de agitação magnética dentro da capela. Outro aspecto impactante é a sua alta volatilidade, logo, mesmo que o método de preparação da solução tenha sido similar, a quantidade de soluto volatilizado não necessariamente seria a mesma durante as duas preparações. Outro fator é o clima, a preparação da
y = 0,7088x - 1533,3 R² = 0,9924
0 2000 4000 6000 8000 10000 12000 14000 16000 18000 20000
0 5000 10000 15000 20000 25000 30000
Picos
d
e
Ár
ea
Concentração das soluções (ug/L)
Soluções diluídas A
y = 0,7239x + 416,61 R² = 0,9611
0 5000 10000 15000 20000 25000
0 5000 10000 15000 20000 25000 30000
Picos
d
e
Ár
ea
solução A, em 25 de fevereiro, ocorreu durante o inverno, já a preparação da solução B, em 9 de abril, ocorreu durante a primavera, o que denota uma variação grande de temperatura. O inverno canadense pode chegar a temperaturas muito negativas, já na primavera a temperatura é mais amena. Sabe-se que a solubilidade de uma substância varia com a temperatura. Normalmente, a solubilidade aumenta com o incremento de temperatura.
3.12 Limite de detecção do método
De acordo com o Ministério do Meio Ambiente, o Limite de Detecção do método é a menor concentração que pode ser detectada do composto analisado dentro de um intervalo de confiança de 99%. O Limite de Detecção é uma ferramenta importante para avaliar a sensibilidade de um método utilizado.
Esse método não é utilizado para quantificar a menor concentração possível de uma substância, mas sim a menor concentração que pode ser detectada com uma alta confiabilidade.
Já o limite de quantificação é a menor concentração de uma dada substância que pode ser quantificada com precisão e exatidão garantindo a utilidade do método (ALBANO; RAYA RODRIGUES, 2009).
Para calcular o limite de detecção (LD) e o limite de quantificação (LQ), a menor concentração da solução diluída de naftalina foi preparada em réplicas e analisada continuamente 08 (oito) vezes. Em seguida o desvio padrão entre os picos de área obtidos foi calculado através da fórmula estatística de desvio-padrão.
O teste-t de Student é uma análise de densidade probabilística de médias de uma mesma população, no caso a solução de estoque da naftalina. A distribuição t é utilizada, segundo a literatura, quando são realizadas análises pequenas, com menos de 30 observações.
Para calcular o limite de detecção utilizou-se a seguinte fórmula:
LD = valor de t x desvio padrão (2)
O valor calculado para o limite de detecção foi de 122,61 µg/L. Esse resultado demonstra que a quantidade de amostra analisada está acima do limite de detecção, logo, para as amostras analisadas, existe 99% de confiança de que o analito existe. Já o Limite de Quantificação obtido mostra que a partir da análise de amostras com concentração superior a 408,97ug/L podemos considerar os resultados muito precisos. Esses resultados demonstram que todas as amostras analisadas por esse método possuem resultados precisos e que há 99% de certeza da quantidade de naftalina presente nas amostras.
Resultados e Discussão
4.1 Degradação da naftalina
A degradação da naftalina nos microcosmos controle e ativos preparados e mantidos sob condições anaeróbias foi monitorada durante 53 dias, sendo suas concentrações apresentadas nos gráficos 6 e 7.
Gráfico 6. Taxa de degradação dos microcosmos controle
0 2000 4000 6000 8000 10000 12000 14000 16000 18000
0 20 40 60
Entre 20 e 35 dias da preparação dos microcosmos foi observado que a concentração de naftalina nos microcosmos se manteve quase estável, o que denota que parte da naftalina adsorvida pelo solo foi dessorvida, até que o e equilíbrio foi estabelecido.
Essa estabilidade mostra que cerca de 20 dias foram necessários para que a naftalina atingisse o equilíbrio de adsorção-desorção. O equilíbrio significa que a taxa de adsorção e de dessorção do componente é a mesma, e que o equilíbrio não indica o fim do processo, mas sim que a estabilidade entre os dois foi atingida (KAHLOW, 2007). A concentração final de naftalina após 55 dias variou de 7500 a 11500 µg/L, o que denota que cerca de 32% da naftalina presente nos microcosmos sofreu processo de adsorção pelo solo 3, classificado como argiloso.
Gráfico 7. Taxa de degradação da naftalina nos microcosmos ativos
De acordo com o Gráfico 7 um decaimento maior na concentração da naftalina nos microcosmos ativos ocorreu durante os 20 primeiros dias de análise. Esta queda de naftalina se deve a alta taxa de volatilização e de adsorção que o composto sofreu e não a degradação por bactérias nativas. De acordo com Mihelcic e Luthy (1988), comunidades microbianas anaeróbias passam por um período de aclimatização que leva entre 12 e 36
0 2000 4000 6000 8000 10000 12000 14000 16000 18000 20000
0 10 20 30 40 50 60
dias, em solos previamente expostos a compostos derivados do petróleo, como a naftalina.
Após 35 dias pode-se enxergar que houve um decaimento na taxa de degradação da naftalina, o que indica que a atividade microbiana estava começando a ocorrer, processo que ocorre lentamente. Estudos prévios indicam que sob condições anaeróbias baixas concentrações de naftalina sofrem biodegradação entre um período de 40 a 70 dias (CHAGAS-SPINELLI, 2007)
A baixa taxa de biodegradação na concentração de naftalina não indica que não há bactérias presentes no solo, o que podemos concluir é que há a necessidade de se monitorar os microcosmos por um período de tempo maior até que a biodegradação da naftalina chegue ao fim. Uma série de estudos mostra que a população de bactérias degradadoras de hidrocarbonetos é 5 a 12 vezes maior em solos previamente expostos a derivados do petróleo do que em solos não contaminados (HEITKAMP; FREEMAN, CERNIGLIA, 1987)
Os resultados entre os gráficos 6 e 7 mostram que após 50 dias pode-se comprovar que a atividade microbiana teve início, já que depois de 55 dias de monitoramento as concentrações de naftalina nos microcosmos ativos se encontravam entre 5500 e 9500 µg/L enquanto nos microcosmos controle, onde não houve atividade microbiana, a concentração de naftalina se manteve entre 7500 e 11500 µg/L. A partir desses resultados conclui-se que cerca de 28% da naftalina foi degradada, fazendo-se necessário um período maior de monitoramento para que uma maior quantidade da naftalina seja degradada sob condições anaeróbias.
A partir dos resultados obtidos calculou-se a taxa de degradação da naftalina sob condições anaeróbias, utilizando-se os preceitos de variação da massa de um poluente quando não há fluxo contínuo. Para tanto, determinou-se k com base dos resultados da concentração ao longo do intervalo de tempo de 50 dias, considerando a equação 3.
Obteve-se o seguinte resultado apresentado na Tabela 5:
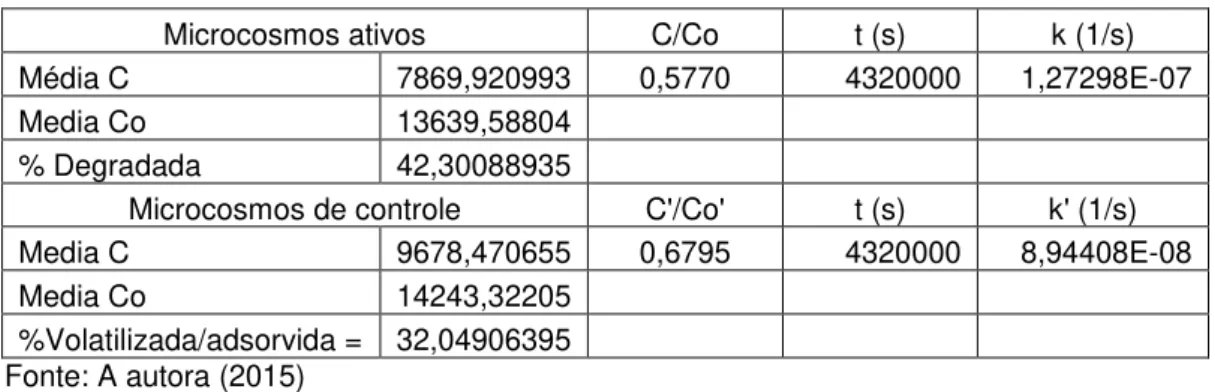
Tabela 5. Resultados da constante degradação
Microcosmos ativos C/Co t (s) k (1/s)
Média C 7869,920993 0,5770 4320000 1,27298E-07
Media Co 13639,58804
% Degradada 42,30088935
Microcosmos de controle C'/Co' t (s) k' (1/s)
Media C 9678,470655 0,6795 4320000 8,94408E-08
Media Co 14243,32205
%Volatilizada/adsorvida = 32,04906395 Fonte: A autora (2015)
Onde a constante de degradação dos microcosmos ativos é 1,42 vezes maior que a taxa de degradação da naftalina nos microcosmos controle. Esse resultado comprova a existência da atividade bacteriana consumindo a naftalina presente, a alta adsorção sofrida e a alta volatilidade da naftalina por si só, já que esta se encontra em um ambiente estéril nos microcosmos controle.
4.2 Microcosmos previamente preparados (2013)
Cinco (05) microcosmos preparados em maio de 2013 para uma dissertação de mestrado foram monitorados durante 55 dias, 10 meses após o preparo, a fim de analisar-se a biodegradação da naftalina. Estes microcosmos foram mantidos em banho-maria sob as temperaturas de 30 ºC, 45º C e 60º C e inicialmente tinham uma concentração de 10mg/L de naftalina. O solo utilizado para a sua preparação foi o mesmo utilizado no preparo dos microcosmos analisados neste estudo.
Gráfico 8. Equação linear da reta.
Utilizou-se os dados obtidos no estudo realizado anteriormente para que se obtivesse os resultados mais próximos da realidade possíveis. Nesta etapa, só foi realizado o monitoramento dos microcosmos preparados anteriormente, e utilizou-se os dados já obtidos por Newfield (2013) para calcular-se a concentração de naftalina nas amostras.
Em 55 dias os microcosmos apresentaram uma taxa de degradação entre 25% e 40% da concentração inicial, 300 dias após a preparação da amostra, sinalizando que a degradação da naftalina por bactérias anaeróbias nativas ainda está em processo.
Gráfico 9 Concentração de naftalina nos microcosmos preparados há 300 dias.
y = 1,1802x - 223,87 R² = 0,9956
-2000 0 2000 4000 6000 8000 10000 12000 14000
0 2000 4000 6000 8000 10000 12000
Ar ea Concentração(ug/L)
Naftaleno (2013)
0 200 400 600 800 1000 1200 14000 20 40 60
C on cent ra çã o d e na ft al ina (u g/L) Tempo (dias)
Microcosmos Ativos (300 dias)
S2-2-30
S3-2-45
S2-2-45
S3-2-45
O Gráfico 9 mostra que a concentração da naftalina após aproximadamente 355 dias da sua preparação encontra-se na faixa de 450 ug/L a 800ug/L. Nota-se que os microcosmos expostos a temperatura de 60ºC atingiram níveis de naftalina não detectáveis em menos de 365 dias, já os microcosmos mantidos a temperatura de 45ºC obtiveram concentrações mais elevadas, entre 450 e 550 µg/L e os mantidos a temperatura de 30ºC, entre 620 e 800 µg/L. Esta diferença na concentração da naftalina deve-se ao aumento da biodisponibilidade da naftalina quando submetida a temperaturas maiores e também ao aumento do metabolismo celular das bactérias (NEWFIELD, 2013).
Estes resultados indicam que uma área contaminada por petroquímicos, mantida a 30ºC, sob condições anaeróbias, só seria bioremediada após 365 dias de exposição as bactérias nativas, já uma área mantida a 60ºC, apresentaria um nível aceitável de biorremediação em 365 dias.
Na Figura 13 nota-se que os microcosmos ativos preparados 10 meses antes apresentam coloração verde, o que indica forte metabolismo celular. Os controles continuaram incolores, confirmando a sua esterilidade.
Figura 13. Microcosmos ativos verdes e controles incolores
Nesse estudo também foi monitorada a pressão dos microcosmos, já que a naftalina adicionada aos frascos foi preparada em solução de metanol. Os microcosmos mantidos a 30ºC apresentaram pressões altas, de até 12 psi. Esse fato indica a presença de metano, produzido por bactérias metanogênicas. A fonte se deve ao metanol utilizado para preparar a solução de naftalina adicionada aos microcosmos. O monitoramento da pressão se deu inicialmente após 270 dias do preparo dos microcosmos. A pressão foi aliviada através da inserção de uma seringa de 60 mL no vazio dos microscomos
Tabela 6. Pressão nas amostras 270 dias após o preparo.
Amostra Pressão inicial (psi) Pressão Final (psi) Volume de ar retirado (mL)
S3-2-30 13,19 0,47 >60
S3-3-30 12,04 0,53 57
S3-C1-30 2,31 2,31 0
S3-C2-30 2,32 2,32 0
Tabela 7. Monitoramento da pressão (Psi) nos microcosmos.
Amostra Período
270 dias 285 dias 305 dias
S3-2-30 0,47 1,80 2,42
S3-3-30 0,53 1,58 2,64
S3-C1-30 2,31 1,77 1,10
S3-C2-30 2,32 2,02 2,08
Nesse estudo, a naftalina foi adicionada diretamente a água subterrânea sintética, a fim de garantir que seria a fonte de carbono preferível aos microrganismos, já que hidrocarbonetos poliaromáticas (HAPs) são biologicamente difíceis de degradar, especialmente se há outra fonte de carbono, de mais fácil degradação, presente no ambiente.
Conclusão
Através dos resultados obtidos nesse estudo, concluiu-se que a degradação da naftalina ocorreu a partir do 35º dia de análise. Confirmando a hipótese de que a degradação da naftalina sob condições anaeróbias ocorre de forma lenta. Para resultados mais consistentes acerca da quantidade de tempo necessária para a completa remoção da naftalina do local contaminado, análises devem ser realizadas por um longo período de tempo, a fim de se estabelecer uma média de tempo para a remoção completa da naftalina pela biodegradação natural.
Por fim, os resultados obtidos neste estudo foram excelentes para incorporar a literatura disponível que trata de dados sobre a degradação anaeróbia de naftaleno por bactérias nativas de solos contaminados por derivados do petróleo.
Recomendações
Referencias Bibliográficas
ABDANUR, A. Remediação de solo e água subterrânea contaminados por hidrocarbonetos de petróleo: estudo de caso na refinaria. 2005, 156f, Dissertação (Mestrado em Ciências do Solo) – Universidade Federal do Paraná, Curitiba, 2005.
ALPENDURATA, M. F. Solid-phase Microextraction: a promising technique for sample preparation in environmental analysis. Journal of Chromatography, Amsterdam, v 889, p 3-14, 2000.
ANDRADE, J; AUGUSTO, F.; JARDIM, I. C. S. F. Biorremediação de solos contaminados por petróleo e seus derivados. Ecletica Quimica, vol. 35, n.3, São Paulo, 2010.
ANNWEILER, E., RICHNOW, H. H., ANTRANIKIAN, H. H., HEBENBROCK, S., GARMS, C., FRANKE, S., FRANCKE, W., MICHAELIS, W. Naphthalene Degradation and Incorporation of Naphthalene-Derived Carbon into Biomass by the Thermophile Bacillus thermoleovorans, Applied and Environmental Microbiology. 2000, February; 66(2): 518–523.PMCID: PMC91857
BAMFORTH, S.; SINGLETON, I. Bioremediation of polycyclic aromatic hydrocarbons: current knowledge and future directions. Journal of Chemical Technology and Biotechnology, Sussex, v.80, n.7, p.723-736, 2005.
BETANCUR-GALVIS L. A., ALVAREZ-BERNAL, D., RAMOS-VALDIVIA, A. C., DENDOOVEN, L. Bioremediation of polycyclic aromatic hydrocarbon-contaminated saline-alkaline soils of the former Lake Texcoco. Chemosphere 62, p1749–1760, 2006.
CHAGAS-SPINELLI, A. C. O. Biorremediação de solo argiloso contaminado por hidrocarbonetos poliaromáticos provenientes de derrame de óleo diesel. 2007, 174f, Tese (Doutorado em Geociências), Universidade Federal de Pernambuco, Recife, 2007.
COLLINS, C.H.; BRAGA, G.L. e BONATO, P.S. Introdução a métodos cromatográficos. 5ª ed, Campinas, Editora da Unicamp, 1993
COMPANHIA DE TECNOLOGIA DE SANEAMENTO AMBIENTAL. Relatório de estabelecimento de valores orientadores para solos e águas
subterrâneas no estado de São Paulo / Dorothy C. P. Casarini [et al.]. -
-São Paulo, p 49, 2001.
CONAMA (Conselho Nacional do Meio Ambiente / Ministério do Meio Ambiente), 2016. Resolução Nº: 420, de 30 de dezembro de 2009. Site:
http://www.mma.gov.br/port/conama/legiabre.cfm?codlegi=620, acessado em 26 de janeiro de 2016.
CONAMA (Conselho Nacional do Meio Ambiente / Ministério do Meio Ambiente), 2016. Resolução Nº 396, de 07 de abril de 2008. Site:
http://www.mma.gov.br/port/conama/legiabre.cfm?codlegi=562, acessado em 26 de janeiro de 2016.
CORSEUIL, H. X. Enhanced Degradation of Monoaromatic Hydrocarbons in Sandy Aquifer Materials by Inoculation Using Biologically Active Carbon Reactors. PhD dissertation, Ann Arbor, MI, EUA, 1992.
CORSEUIL, H. X.; MARTINS, M. D. M. Contaminação de Águas
Subterrâneas por Derramamento de Gasolina: O Problema é Grave?. Revista Engenharia Sanitária e Ambiental, v. 2, n. 2, p.50-54, abr./jun. 1997. CUNNINGHAM, C.J., IVSHINA, I.B., LOZINSKY, V.I., KUYUKINA, M.S., PHILP, J.C., 2004. Bioremediation of diesel-contaminated soil by microorganisms immobilized in polyvinyl alcohol. International Biodeterioration & Biodegradation, 54, pp.167 – 174, 2004.
DAVIS, E. Groundwater and Ecosystems Restoration Research, United States Environmental Protection Agency, 2009.
FEITKENHAUER, H., MARKL, H. Biodegradation of Aliphatic and Aromatic Hydrocarbons at High Temperatures, Water Science and Technology, vol. 47, no. 10, pp. 123-130, 2003.
FREITAS, R. G.; COSTA, C. A. C. Química Orgânica II, Ao livro técnico S.A, Rio de Janeiro, 1969.
GERVAIS, J. LUUKINEN, B.; BUHL, K.; STONE, D. Naphthalene Technical Fact Sheet; National Pesticide Information Center, Oregon State University Extension Services. 2010.
HARITASH, A.K.; KAUSHIK, C.P. Biodegradation aspects of Polycyclic Aromatic Hydrocarbons (PAHs): A review, Journal of Hazardous Materials
Volume 169, Issues 1–3, 30 September 2009, Pages 1–15
HARRIS, D. C. Análise química quantitativa, 8 ed, Rio de Janeiro, LTC, 2012
HEITKAMP, M. A., J. P. FREEMAN, and C. E. CERNIGLIA. 1987.
HIGARASHI, M. M. Processos oxidativos avançados aplicados à
remediação de solos brasileiros contaminados com pesticidas. Tese
(doutorado) – Universidade Estadual de Campinas, Instituto de química,
Campinas, 1999.
Hulscher, T., Cornelissen, G. Effect of Temperature on Sorption Equilibrium and Sorption Kinetics of Organic Micropollutants - a review,
Chemosphere, vol. 32, no. 4, pp. 609-626, 1996.
IARC Monographs on the Evaluation of the Carcinogenic Risk to Humans , Vol. 82, Some Traditional Herbal Medicines, Some Mycotoxins, Naphthalene and Styrene, Naphthalene, Lyon, IARC Press , pp. 367–418, 1985
LIMA, U de A., AQUARONE, E., BORZANI W., SCHMIDELL, W.
Biotecnologia Industrial, volume 3, 1ª edição, São Paulo, Editora Edgar Blucher Ltda, 2001.
MIHELCIC, J., LUTHY, R. Microbial Degradation of Acenaphthene and Naphthalene Under Denitrification Conditions in Soil-Water Systems,
Applied and Environmental Microbiology, vol. 54, no. 5, pp. 1188-1198, 1988 MADIGAN, J. MARTINKO, J. PARKER, Brock Biology of Microorganisms, 9 ed., 1984, p. 17.
MARIANO, J. B. Impactos Ambientais do refino de petroleo. Rio de Janeiro: Interciência, p228, 2005.
MCMILLAN-MCGEE CORP., “Technical Description: ET-DSP In Situ Thermal Remediation”, 2011.
MIHELCIC, J. R., and R. G. LUTHY. Degradation of polycyclic aromatic hydrocarbon compounds under various redox conditions in soil-water systems. Applied and Environmental Microbiology.54:1182–1187, 1988. MINISTÉRIO DO MEIO AMBIENTE, Águas subterrâneas: um recurso a ser reconhecido e protegido. Agencia Crio, p7-9, Brasília, 2007.
MINISTRY OF ENVIRONMENT, Lands and ParksProvince of British Columbia, Ambient Water Quality Criteria For Polycyclic Aromatic Hydrocarbons (PAHs), 1993.
MOLINA-BARAHONA, L., RODR ́IGUEZ-VÁZQUEZ, R., HERNÁNDEZ VELASCO, M., VEGA-JARQUIN C., ZAPATA-PÉREZ, O., MENDOZA-CANTÚ, A., ALBORES, A. 2004. Diesel removal from contaminated soils by biostimulation and supplementation with crop residues. Applied oil Ecology, 27: pp.165-175.