Universidade Federal de Uberlândia
Instituto de Ciências Biomédicas
Programa de Pós Graduação em Biologia Celular e Estrutural Aplicadas
Júlia Borges Paes Lemes
Participação dos receptores P2X7 presentes em células da glia
do gânglio da raiz dorsal na nocicepção
Júlia Borges Paes Lemes
Participação dos receptores P2X7 presentes em células da glia
do gânglio da raiz dorsal na nocicepção
Dissertação apresentada como requisito para a obtenção do título de Mestre do Programa de Pós-graduação em Biologia Celular e Estrutural Aplicadas da Universidade Federal de Uberlândia.
Orientadora: Drª Celina Monteiro da Cruz Lotufo
Uberlândia
Dados Internacionais de Catalogação na Publicação (CIP) Sistema de Bibliotecas da UFU, MG, Brasil.
L552p 2017
Lemes, Júlia Borges Paes, 1992
Participação dos receptores P2X7 presentes em células da glia do gânglio da raiz dorsal na nocicepção / Júlia Borges Paes Lemes. - 2017.
60 f. : il.
Orientadora: Celina Monteiro da Cruz Lotufo.
Dissertação (mestrado) - Universidade Federal de Uberlândia, Programa de Pós-Graduação em Biologia Celular e Estrutural Aplicadas.
Inclui bibliografia.
1. Citologia Teses. 2. Gânglios Sensitivos Teses. 3. Neurônios -Teses. 4. Receptores Purinérgicos - -Teses. I. Lotufo, Celina Monteiro da Cruz. II. Universidade Federal de Uberlândia. Programa de Pós-Graduação em Biologia Celular e Estrutural Aplicadas. III. Título.
Lemes, Júlia B.P.
Participação dos receptores P2X7 presentes em células da glia do gânglio da raiz dorsal na nocicepção
Dissertação (mestrado) Universidade Federal de Uberlândia. Instituto de Ciências Biomédicas. Área de Ciências Fisiológicas.
Orientadora: Celina Monteiro da Cruz Lotufo
Júlia Borges Paes Lemes
Participação dos receptores P2X7 presentes em células da glia do
gânglio da raiz dorsal na nocicepção
Dissertação apresentada como requisito para a obtenção do título de Mestre do Programa de Pós-graduação em Biologia Celular e Estrutural Aplicadas da Universidade Federal de Uberlândia.
Orientadora: Drª Celina Monteiro da Cruz Lotufo
Aprovada em 13 de Fevereiro de 2017
Banca examinadora:
______________________________________
Drª. Celina Monteiro da Cruz Lotufo
______________________________________
Dr. Cássia Regina Silva
______________________________________
Drª Simone Ramos Deconte
Uberlândia
AGRADECIMENTOS
Aos meus pais, Kátia e José Maurício, por sempre me apoiar e incentivar meus estudos. Vocês me ensinaram que a conquista de um sonho requer muito esforço, trabalho e dedicação.
Às minhas irmãs Carolina e Marina pela compreensão, amizade e companheirismo. Agradeço também minhas tias, tios, avós e primas por me darem forças nas horas mais difíceis e por acreditarem no meu potencial.
À minha orientadora e amiga, Drª. Celina Monteiro da Cruz Lotufo, que sempre esteve ao meu lado em todos os momentos desse trabalho, me ajudando nos experimentos, me orientando, me mostrado o caminho e me dando todo suporte para não desistir do meu sonho. Você foi e é minha inspiração como pesquisadora e professora.
À todos os meus colegas da Pós-graduação de Biologia Celular e Estrutural Aplicadas que foram meus companheiros nessa batalha, me deram conselhos e me ajudaram a seguir em frente.
Aos meus colegas de laboratório, Danielle, Paulla, Ruth, Maria Vitória, Bruno, Felipe, Taís e Débora que me ajudaram nos experimentos e me apoiaram nas minhas decisões. De colegas de trabalho se tornaram meus amigos que vou levar para vida toda.
Aos professores do ARFIS, em especial a Profa. Ana Paula, pelo apoio, incentivo e conselhos. O trabalho ficava mais alegre e divertido com as nossas conversas.
A Capes pelo financiamento que permitiu o desenvolvimento desse projeto.
A Universidade Federal de Uberlândia, incluindo todos os colaboradores pela credibilidade, financiamento e contribuições feitas a esse projeto.
RESUMO
Nos gânglios sensitivos, os corpos celulares dos neurônios encontram-se circundados por células gliais denominadas células satélites. Estudos recentes apontam para uma possível comunicação entre neurônios e células satélites através da liberação de ATP e ativação de receptores P2X7 presentes nas células gliais. Além disto, células satélites adjacentes podem
comunicação entre células satélites e neurônios tem sido implicada na cronificação da dor e em processos inflamatórios. Nesse estudo buscamos avaliar o papel da comunicação entre neurônios e células satélites através da ativação dos receptores P2X7 assim como das junções comunicantes em modelos de dor aguda. Em culturas primárias de gânglios da raiz dorsal, verificamos que a administração de capsaicina leva a um aumento de cálcio em neurônios e em seguida em células satélites sendo que a resposta das células satélites foi bloqueada por A740003, um antagonista seletivo para receptores P2X7, indicando que os nociceptores quando ativados liberam ATP que, por sua vez, ativa receptores P2X7 nas células gliais. Para avaliar o papel desta comunicação celular in vivo, o antagonista P2X7 ou o bloqueador de junções
comunicantes, carbenoxolona, foram administrados por via intraganglionar (L5) e foram avaliados os efeitos das injeções intraplantares de capsaicina, mentol e formalina em ratos. Tanto o A740003 quanto a carbenoxolona reduziram a nocicepção induzida por capsaicina e mentol. No teste da formalina, ambas as substâncias afetaram apenas a segunda fase do teste, considerada a fase inflamatória. Capsaicina ativa seletivamente receptores TRPV1 e mentol ativa receptores TRPM8, e possivelmente receptores TRPA1, que são expressos majoritariamente em neurônios nociceptivos associados a fibras C. Além disto, estudos de outros autores indicam a primeira fase do teste da formalina envolve principalmente a ativação
Considerando estes dados juntamente como os presentes resultados, podemos sugerir que a comunicação entre células satélites e neurônios ocorre também na dor aguda, mas apenas quando esta depende da ativação de fibras C. Deste modo, a comunicação entre neurônios e células satélites, via liberação de ATP e ativação de receptores P2X7, assim como uma comunicação entre células satélites adjacentes através de junções comunicantes parecem estar envolvidos em um processamento rápido do sinal doloroso no gânglio da raiz dorsal.
ABSTRACT
In sensory ganglia, the cellular bodies of neurons are surrounded by glial cells called satellite cells. Recent studies point to a possible communication between neurons and satellite cells through the release of ATP and activation of P2X7 receptors present in glial cells. In addition, adjacent satellite cells may be connected through gap junctions. Still today, the communication between satellite cells and neurons has been implicated in chronic pain and in inflammatory processes. In this study we sought to evaluate the role of communication between neurons and satellite cells through the activation of the P2X7 receptors as well as of the communicating junctions in acute pain models. In primary cultures of dorsal root ganglia, we found that the administration of capsaicin leads to an increase of calcium in neurons and then in satellite cells. The response of satellite cells was blocked by A740003, a selective antagonist for P2X7 receptors, indicating that nociceptors when activated release ATP, which in turn activates P2X7 receptors in the glial cells. To assess the role of this in vivo cellular
communication, the P2X7 antagonist or the gap junction blocker, carbenoxolone, were administered by intraganglionar injection (L5) and the effects of intraplantar injections of capsaicin, menthol or formalin in rats were evaluated. Both A740003 and carbenoxolone reduced nociception induced by capsaicin and menthol. In the formalin test, both substances affected only the second phase of the test, considered the inflammatory phase. Capsaicin selectively activates TRPV1 receptors while menthol activates TRPM8 receptors, and possibly TRPA1 receptors, which are expressed mainly in nociceptive neurons associated with C fibers. In addition, studies by other authors indicate that the first phase of the formalin test involves
primarily the act fibers
and C fibers. Considering these data together with the present results, we can suggest that the communication between satellite cells and neurons also occurs in acute pain, but only, when it depends on the activation of C fibers. Thus, communication between neurons and satellite cells, via release of ATP and activation of P2X7 receptors, as well as communication between adjacent satellite cells through gap junctions seems to be involved in a rapid processing of the pain signal in the dorsal root ganglion.
LISTA DE FIGURAS
Figura 1: Esquema geral dos experimentosin vivo...25
Figura 2: Injeção intraganglionar (i.g.) ...27
Figura 3: Método von Frey eletrônico ...29
Figura 4: Avaliação do papel dos receptores P2X7 e liberação de ATP por neurônios nociceptivos ativados por capsaicinain vitro. ...31
Figura 5: Avaliação da participação dos receptores P2X7 na nocicepção e na hiperalgesia mecânica, induzida por capsaicina ...32
Figura 6: Avaliação da participação das junções comunicantes na nocicepção e na hiperalgesia mecânica, induzida por capsaicina ...33
Figura 7: Avaliação do efeito conjunto de A740003 + carbenoxolona na nocicepção induzida por capsaicina...34
Figura 8: Avaliação da participação dos receptores P2X7 na nocicepção induzida por mentol...35
Figura 9: Avaliação da participação dos receptores P2X7 na nocicepção induzida por formalina...36
Figura 10: Avaliação da participações das junções comunicantes na nocicepção induzida por formalina ...36
Figura 11: Avaliação do efeito do BzATP sobre a resposta dos neurônios e células satélites estimulados com capsaicina...37
LISTA DE ABREVIATURAS
ATP - Adenosina trifosfato
CFA - Adjuvante Completo de Freund
CGRP - peptídeo relacionado ao gene da calcitonina CSGs - Células Satélites Gliais
Da - Dalton
DMEM -meio de Eagle modificado por Dulbecc
DMSO dimetilsulfóxido GRD - Gânglio da Raiz Dorsal GT - Gânglio trigeminal
GFAP -Proteína ácida fibrilar glial
HEPES - ácido N-(2-hidroxietil) piperazina-N'-2-etanossulfónico I.g. - Injeção Intraganglionar
I.pl. - Injeção Intraplantar
IASP- Associação Internacional para o Estudo da Dor IB4- isolectina B4
IL1
-L5 - vértebra lombar 5
LPS - lipopolissacarídeo deEscherichia coli
NGF - fator de crescimento neuronal
P2X7 Receptor purinérgico inotrópicos subtipo sete P2X3 - Receptor purinérgico inotrópicos subtipo três P2X1 - Receptor purinérgico inotrópicos subtipo um SNC sistema nervoso central
SNP sistema nervoso periférico
TrkA - receptor com alta afinidade para neurotrofina
TRPA1 - receptor de potencial transitório, da subfamília anquirina, membro um TRPM8 - receptor de potencial transitório, da subfamília melastatina, membro oito TRPV1 - receptor vanilóide de potencial transitório 1
SUMÁRIO
1. Introdução...12
1.1. Dor: Visão geral...12
1.2. Nociceptores...13
1.3. Gânglio da raiz dorsal...14
1.4. Receptores TRPs...16
1.5. Células satélites gliais (CSGs) e seu papel na dor...18
1.6. ...20
1.7. ATP e receptores purinérgicos...21
2. Objetivos...24
2.1. Objetivo geral...24
2.2. Objetivo específico...24
3. Material e Métodos...25
3.1. Animais...25
3.2. Drogas...25
3.3. Delineamento experimental...25
3.4. Técnicas...26
3.4.1. Injeção intraganglionar...26
3.4.2. Injeção intraplantar de capsaicina...27
3.4.3. Injeção intraplantar de mentol...27
3.4.4. Teste da formalina...28
3.4.5. Teste de pressão crescente: von Frey eletrônico...28
3.4.6. Cultura primária do gânglio da raiz dorsal ...29
3.5. Análise estatística...30
4. Resultados...31
4.1. Papel dos receptores P2X7 gliais e liberação de ATP por neurônios nociceptivos ativados por capsaicina...31
4.2. Participação dos receptores P2X7 na nocicepção induzida por capsaicina...32
4.3. Participação das junções comunicantes na nocicepção induzida por capsaicina...33
4.4. Avaliação do efeito conjunto do bloqueio de junções comunicantes e receptores P2X7 na nocicepção induzida por capsaicina...33
4.6. Participação dos receptores P2X7 na nocicepção induzida por formalina...35 4.7. Participação das junções comunicantes na nocicepção induzida por
formalina...36 4.8. Cultura do GRD: avaliação do efeito do BzATP sobre a resposta dos neurônios e células satélites estimulados com capsaicina...37 5. Discussão...38 5.1. Esquema: Comunicação neurônio-glia no GRD envolvendo liberação de ATP...45 6. Conclusão...46
Referências bibliográficas...47
1. INTRODUÇÃO
1.1. Dor: visão geral
Segundo a Associação Internacional para o Estudo da Dor (IASP), a dor é definida como
Essa definição foi a primeira a reconhecer o fenômeno da dor como uma experiência envolvendo tanto dimensões sensorial-discriminativa como afetivo-motivacional. O componente sensorial-discriminativa da dor se refere à percepção e detecção do estímulo nocivo quanto a sua intensidade, localização, duração, padrão temporal e qualidade. Já o componente afetivo-motivacional diz respeito ao componente emocional da dor, percebido como sofrimento (OLIVEIRA IN LENT, 2008). Assim, a dor é uma experiência sensorial complexa que não envolve apenas a transdução do estímulo nocivo, mas também processos cognitivos e emocionais (JULIUS e BASBAUM, 2001).
A dor constitui um dos componentes essenciais na defesa corporal, pois fornece um rápido aviso ao Sistema Nervoso Central (SNC) que resulta em uma resposta motora buscando a preservação física do indivíduo. Em casos raros, como em condição de insensibilidade congênita, o indivíduo não tem a percepção da dor, causando sérios problemas para a saúde, tais como: automutilações, autoamputações e perda da visão (AXELROD e HILZ, 2003). Por outro lado, em algumas patologias, principalmente em inflamações crônicas e neuropatias, a dor deixa de ter caráter protetor e se torna um sintoma indesejável prejudicando, significativamente, o bem estar do indivíduo e podendo tornar-se debilitante. Nesses casos, utilizam-se fármacos com ação analgésica e anti-inflamatória buscando o alívio da dor.
De maneira geral, a dor pode ser classificada em nociceptiva (fisiológica) ou patológica. A primeira requer uma estímulo nocivo, e geralmente é transitória, pois tende a desaparecer quando o estímulo nocivo é cessado (dor aguda). Esse tipo de dor fornece o alerta ao organismo, ocasionando respostas comportamentais e reação de retirada ou afastamento do estímulo nocivo. Já o segundo tipo de dor, também referida como dor crônica, possui como característica a persistência, mesmo na ausência do estímulo, e geralmente é de difícil localização. As dores patológicas estão associadas a inflamação do tecido advindo de uma lesão (dor inflamatória) ou a lesões do sistema nervoso periférico ou central, dor neuropática (OLIVEIRA IN LENT, 2008).
célula e iniciar o reparo tecidual. A inflamação aguda é uma reposta protetora envolvendo células do sistema imune, vasos sanguíneos e mediadores moleculares. Vários dos mediadores inflamatórios conhecidos causam dor ao se ligar a seus receptores em neurônios sensoriais primários no sistema nervoso periférico (SNP) que inervam pele lesada, músculos e tecidos articulares (BASBAUM et al., 2009; GOLD et al., 2010). A dor inflamatória apresenta a função de proteger a região lesada de forma a favorecer a recuperação. Em contraste com a inflamação aguda, a inflamação crônica é muitas vezes prejudicial, estando envolvida em uma série de doenças como a periodontite, aterosclerose, artrite reumatóide e até mesmo câncer (JI et al., 2014).
Portanto, diferentes formas de dor são produzidas por diversos mecanismos moleculares e celulares que podem atuar isoladamente ou em combinação com o sistema nervoso periférico e central. Assim, compreender os mecanismos envolvidos na geração, manutenção, modulação da dor e identificar as células e/ou moléculas envolvidas é substancial para descoberta de novos alvos terapêuticos (MCMAHON et al., 2006; SCHOLZ, 2002).
1.2. Nociceptores
Os nociceptores são células nervosas especializadas na detecção do estímulo doloroso. Cerca de um século atrás, Sherrington propôs a existência do nociceptor como sendo neurônio sensorial primário que é ativado por estímulos capazes de provocar danos nos tecidos. Posteriormente, estudos com eletrofisiologia demostraram, de fato, a existência de neurônios sensoriais primários que são excitados pelo calor nocivo, a pressão intensa ou produtos químicos irritantes. Os neurônios aferentes primários se diferem dos demais por apresentarem limiares altos característicos ou sensibilidade baixa (JULIUS e BASBAUM, 2001). Os nociceptores possuem terminações nervosas livres que estão presentes em diferentes tecidos como pele, músculos, articulações, vasos, osso e vísceras, e são capazes de transduzir e codificar diferentes estímulos nociceptivos externos e internos ao organismo (LOESER e TREEDE, 2008).
1.3.Gânglio da raiz dorsal
em forma de T. Um ramo da bifurcação estende-se para a periferia formando as terminações sensoriais na pele, músculo, vísceras e outros órgãos, e outro ramo para medula espinhal (LIEBERMAN, 1976). Esses neurônios não apresentam dendritos e, portanto, parece não existir sinapses entre eles no GRD, entretanto, no corpo celular destes neurônios são encontrados receptores para neurotransmissores e para diversos mediadores, inclusive para mediadores
inflamatórios, como IL- - , 1999).
Neurônios do GRD consistem em múltiplos tipos de neurônios sensoriais primários com anatomia e morfologia diferentes. Suas subpopulações de fibras são divididas em mielinizadas (Fibras A) e não mielinizadas (Fibras C). Fibras A mielinizadas apresentam maior velocidade As fibras A participam de respostas táteis BASBAUM e JESSELL, 2000; LIU et al., 2001).
são finamente
velocidade de condução média entre 12 e 30 m/s e correspondem aproximadamente 13% das fibras de dor na pele (BRENNEIS et al, 2013). As fibras C, não mielinizadas, são de pequeno velocidade de condução menor (0,5 a 2 m/s) e correspondem a 87% das fibras condutoras da informação dolorosa presentes na pele. São responsáveis pela dor lenta e difusa (MILLAN, 1999; JULIUS e BASBAUM, 2001).
Os nociceptores propriamente ditos estão associados a fibras C e a sua ativação pode resultar na liberação de glutamato, substância P e proteína associada ao gene da calcitonina (CGRP) pelos terminais centrais (MILLAN, 1999) que se conectam com os neurônios sensoriais de segunda ordem no corno dorsal da medula espinhal. A maioria dos nociceptores associados a fibra C são polimodais, respondendo a estímulos térmicos e mecânicos nocivos (RAJA, 1999). As fibras C também respondem a estímulos químicos nocivos, tais como a capsaicina, o ingrediente pungente das pimentas ardentes. Além desses, outros nociceptores são chamados silenciosos pois respondem somente quando sensibilizados por lesão tecidual (SCHUMIDT, 1995).
-D-Galactosil-isolectina (IB4) (BASBAUM et al., 2009). Esta classificação funciona como um marcador molecular adicional para a identificação das células neuronais.
As vias responsáveis pela nocicepção originam-se junto a outros neurônios sensoriais no gânglio da raiz dorsal e, os axônios centrais das células nociceptivas entram na medula espinhal através das raízes dorsais. Os nociceptores chegam de forma ordenada no corno dorsal da medula espinhal, com as fibras A terminando principalmente nas lâminas I e V, as fibras C não peptidérgica na lâmina II, as fibras C peptidérgicas na lâmina I e as fibras A na lâmina III, IV e V. Nessas regiões encontram-se neurônios de projeção e interneurônios de segunda ordem sendo alguns deles ativados apenas por estímulos nocivos. Os axônios dos neurônios de segunda ordem cruzam a linha média e ascendem ao tronco encefálico e ao tálamo no quadrante anterolateral (PURVES et al, 2010; MILLAN, 1999). O tálamo é responsável pela recepção, integração e transferência do potencial nociceptivo. As diferentes projeções para seus núcleos e deles para o córtex definem a circuitaria funcional de processamento da dor. Os aspectos sensoriais e discriminativos são interpretados no cortéx somatossensorial e os aspectos afetivos e motivacionais são direcionados a amígdala, hipotálamo, substância cinzenta periaquedutal, colículo superior, formação reticular e núcleos talâmicos da linha média (WENG et al., 2000).
Os nociceptores quando excitados continuamente podem alterar sua função e responderem diferentemente a determinados estímulos. Quando se tem uma lesão tecidual são liberados vários mediadores inflamatórios que podem atuar sobre os neurônios sensoriais primários, como citocinas, eicosanóides, bradicinina, serotonina e histamina (FERREIRA et al., 1988, CUNHA et al., 1991, SACHS et al., 2002). A ação destes mediadores provocam a sensibilização neuronal, isto é, a diminuição do limiar de excitabilidade neuronal. Portanto, fibras sensibilizadas apresentam maior facilidade em serem ativadas frente a uma estimulação (RIEDEL; NEECK, 2001). Esse aumento da sensação provocada por um estímulo doloroso decorrente de um processo inflamatório, por exemplo, é denominado de hiperalgesia. Estudos mostram que a ação destes mediadores resultam em alterações fenotípicas nos neurônios sensoriais que contribuem para esse estado sensibilizado, como o aumento na expressão de alguns tipos de canais de sódio em fibras nociceptivas (ENGLAND et al., 1996; GOLD et al., 1998). Outro evento associado ao processo inflamatório é a alodinia. Nesse caso, um estímulo inócuo se torna doloroso.
propriamente dita. Enquanto que a nocicepção é a ativação das vias nociceptivas, isto é, o disparo de potenciais de ação, que será percebida como dor, a hiperalgesia ou sensibilização neuronal é um processo que não depende da excitação dos neurônios, mas que facilita o disparo dos potenciais de ação frente a um estímulo.
1.4. Receptores TRPs
Na membrana plasmática dos nociceptores estão presentes famílias de proteínas transmembranas que constituem em receptores e canais, os quais participam da transdução do sinal nervoso em várias modalidades de estímulos nocivos (OLIVEIRA IN LENT, 2008). Um exemplo importante são os canais TRP (receptor de potencial transitório). Esses canais representam uma extensa família de proteínas contendo mais de 30 tipos (RAMSEY et al., 2006) e possuem papel em vários processos biológicos como: absorção de cálcio, crescimento do cone neuronal, desenvolvimento de queratinócito e transdução sensorial (NILIUS, 2007). A família de canais TRP incluem seis membros: TRPC (canônico), TRPV (vanilóide), TRPM (melastatina), TRPA (anquirina), TRPP (policistina), TRPML (mucolipina). Todos esses canais são tetrâmeros e respondem a estímulos mecânicos, térmicos, químicos e vários outros advindos do ambiente extracelular e intracelular (PALAZZO et al., 2012).
O TRPV1 (receptor de potencial transitório, subfamília vaniloide, membro 1) é o fundador da subfamília de canais termosensitivos sendo o primeiro a ser descrito. Eles são expressos nos neurônios não mielinizados (fibras C) no GRD e GT e constituem aproximadamente 30-50% de todos os neurônios somatossensitivos dentro dos gânglios sensoriais de roedores (JULIUS 2005, PATAPOUTIAN et al., 2009; KOBAYASHI et al., 2005b; TOMINAGA et al., 1998). Esse receptor forma um canal catiônico permeável a cátions monovalentes, como o sódio e potássio, e divalentes, com preferência para Ca2+(BINSHTOK et al., 2007). A sua ativação leva ao aumento do Ca2+citosólico e subsequente liberação de neuropeptídios, como a substância P e o CGRP, por exocitose (DEVESA et al., 2014, SRINIVASAN, 2015).
-up,
head-formam interações específicas ancorando o ligante ao receptor (SMUTZER et al., 2016).
ocicepção térmica aguda, o que comprova o papel deste canal na dor provocada pelo calor. Vale ressaltar também que, os produtos resultantes de danos nos tecidos e inflamação podem diminuir drasticamente o limiar de temperatura desse receptor, podendo resultar em hiperalgesia térmica e hipersensibilidade à dor (BASBAUM et al. 2000; DAVIS et al., 2000).
Assim como o TRPV1, o TRPM8 forma um canal de cátion não seletivo homotetramérico com permeabilidade substancial aos íons cálcio (MCCOY et al., 2011; PEIER et al., 2002; YUDIN e ROHACS, 2012). O canal TRPM8 (receptor de potencial transitório, da subfamília melastatina, membro oito) é ativado por componentes naturais ou sintéticos que causam frio, como o mentol, bem como por estímulo térmico a frio (< 26ºC). TRPM8 é expresso em 15% de todos os neurônios somatosensoial, a maior parte em fibras C, e pouca e um subconjunto destas células TRPM8 positivas podem coexpressar TRPV1. Em contraste com o TRPV1 que em condições normais confere sensibilidade a estímulos térmicos apenas dentro da gama nociva, o TRPM8 desempenha um papel tanto na sensação de frio inócuo como nocivoin vivo (BAUTISTA et al., 2007; DHAKA et al., 2008;
KNOWLTON et al., 2010, YUDIN e ROHACS, 2012). Outro canal TRP associado a resposta nociceptiva é o TRPA1. Esse canal é expresso em cerca de metade dos neurônios que expressam TRPV1. Alguns estudos tem associado TRPA1 com capacidade de detectar a dor ao frio (MC KEMY, 2005; KAWAN et al., 2009). O TRPA1 é seletivamente ativado por óleo de mostarda, mas também parece ser ativado por mentol (KARASHIMA, 2007; XIAO, 2008). No contexto da nocicepção, TRPA1 em mamíferos foi relacionado com a função de detectar o frio nocivo e contribuir para a sensibilização não mediada por TRPM8 (STORY et al., 2003). Entretanto, alguns autores apontam o contrário (CASPANI e HEPPENSTALL, 2009). Evidências recentes sugerem que TRPA1 exerce, em parte, papel na sensação aguda de dor, porém, contribui mais fortemente na lesão provocada pela hipersensibilidade.
1.5. Células satélites gliais (CSGs) e seu papel na dor
colocados em um espaço de tecido conjuntivo comum. Esses grupos são mais prevalentes em animais jovens (PANNESE et al, 1991; PANNESE et al., 1996). Alguns estudos mostraram que as CSGs compartilham características com astrócitos, como a expressão de glutamina sintase e vários neurotransmissores (HANANI, 2005; TAKEDA et al., 2009; JASMIN et al., 2010). Entretanto, exames ultraestruturais levaram a conclusão de que as células satélites gliais são um tipo distinto de célula da glia (PANNESE, 1981). As funções das células satélites ainda são pouco compreendidas, mas está claro que elas possuem receptores para vários neurotransmissores e portanto, participam da comunicação intercelular (WEICK et al., 2003; CERUTI et al., 2008; GU et al., 2010).
Na maior parte do SNC as células endoteliais formam uma barreira para a difusão de moléculas grandes dos vasos sanguíneos para o espaço extracelular ao redor do neurônio, formando a barreira hematoencefálica. Entretanto, no gânglio sensorial essa barreira não existe (ARVIDSON, 1979; AZZI 1990; TEN TUSSCHER, 1989; JACOBS, 1976). Shinder e Devor (1994) observaram que La3+ penetrou pelo espaço entre CSGs e neurônio, e sugerem que o arranjo dessas células permite a comunicação entre neurônios no GRD por meio da difusão de neurotransmissores. Trabalhos demonstraram também que não apenas íons e neurotransmissores pequenos podem atravessar a bainha de CSGs, mas também macromoléculas (HU, 2002). Outros estudos mostraram resultados semelhantes que concluíram que CSGs em gânglios sensitivos não formam uma barreira absoluta. Esse arranjo estrutural entre o corpo neuronal e células satélites gliais sugere que existe uma comunicação e que esta é um fator determinante para atividade somática (HUANG et al, 2013).
Estudos recentes que avaliam as funções neuronais sugerem que o neurônio não é o único tipo de célula que contribui para sinalização neuronal, as células não neuronais, incluindo os astrócitos, oligodendrócitos e células satélites também desempenham papéis importantes na atividade neuronal por meio da interação neurônio-glia. Pesquisas em gânglios sensoriais vêm buscando entender o papel das células glais em diversos modelos de dor em animais. (CHIANG et al., 2011; HANANAI, 2005; TSUDA et al, 2005; WATKING et al, 2007).
causou aumento de acoplamento entre as CSGs ao redor de diferentes neurônios no GRD. Essa mudança parece estar correlacionada com o aumento de junções comunicantes entre as células satélites gliais. Em análise de microscopia eletrônica do GRD de animais que sofreram lesão no nervo, observaram o crescimento de processos entre os neurônios vizinhos e neles estavam presentes as junções comunicantes (HANANAI, 2012). No gânglio trigeminal, utilizando um modelo de dor orofacial que envolve axotomia do nervo infraorbital, foi observado também o aumento do acoplamento entre as células satélites (CHERKAS et al., 2004). Em um modelo de dor inflamatória induzido por injeção de CFA na pata de camundongos, verificou o aumento no acoplamento das células satélites gliais visualizados em microscopia eletrônica e hipersensilidade mecânica. Utilizando um inibidor de junções comunicantes foi verificada redução da hipersensibilidade, indicando a participação das células satélites gliais e junções comunicantes no processamento da dor (DUBLIN e HANANI, 2007). Ainda, em outro trabalho em que utilizou o modelo de dor sistêmica por LPS também foi mostrado maior acoplamento entre as CSGs no GRD, que por sua vez, contribuiu para a hipersensibilidade do neurônio (BLUM et al., 2014). Assim, tendo visto o que foi exposto acima, as células satélites gliais e as junções comunicantes se mostram importantes em processos envolvidos com sensibilização neuronal, ou seja, dores inflamatórias, neuropáticas e crônicas. Mas ainda não há estudos que relatam a participação dessas células e junções na reposta da dor rápida e fisiológica. Por isso, o trabalho aqui apresentado tem a intenção de compreender a influência das células satélites na nocicepção, assunto que merece destaque devido à grande relevância dessa células no processamento e modulação da dor.
1.6. ap junctions
As junctions são agregados de canais intercelulares que
(ROZENTAL et al., 2000). No SNC, as células da glia são a maior população de células acopladas através dessas junções, sendo o nível de expressão de Cx maior em células gliais comparada com neurônios e sua expressão persiste na fase adulta. Entretanto, existem diferenças qualitativas e quantitativas entre as classes de células gliais, cada tipo irá expressar um conjunto específicos de conexinas e a força de acoplamento assim como o nível de expressão também será diferente dependendo do tipo de célula glial (ROUACH, 2002). Até os dias de hoje oito Cxs diferentes foram detectadas nas populações de células neuronais, estudada em modelos in vitro e in vivo. Um estudo recente confirmou que a expressão de Cx36 está
restrita aos neurônios, enquanto que Cx32 e Cx43 foram encontradas em oligodendrócitos e astrócitos, respectivamente (RASH et al., 2000). No sistema nervo periférico foi mostrada a expressão de Cx32 nas membranas da bainha de mielina (SATAKE, 1997) e, no gânglio da raiz dorsal identificaram a Cx43 em células satélites gliais de ratos (HANANI, 2005).
As junções comunicantes são um caminho pelo qual as CSGs podem se comunicar umas com as outras. Em microscopia eletrônica, essas junções foram encontradas entre as CSGs adjacentes ao redor de um único corpo neuronal em GRD de animais controle. Não foi observada a existência dessas junções entre as bainhas das CSGs com neurônios e entre o corpo neuronal (HUANG et al., 2006; PANNESE, 2010). Os estudos indicam que o aumento das junções comunicantes contribuem para a dor crônica em uma variedade de modelos de dor. Estudos in vitro demonstraram que o bloqueio dessas junções reduzem a atividade elétrica
espontânea e a hiperexcitabilidade de neurônios sensoriais (HUANG et al., 2010). Portanto, essas estruturas são importantes para o processamento da transmissão da dor pois alteram a atividade dos nociceptores.
1.7. ATP e receptores purinérgicos
O papel dessa molécula como um neurotransmissor na sinalização purinérgica já encontra-se bastante elucidada. Nos terminais pré-sinapticos ele é transportado para dentro das vesículas sinápticas, as quais posteriormentes são liberadas por exocitose (PANKRATOV, 2006; BODIN, 2001; ZHANG et al., 2007). Contudo, o mecanismo envolvido na liberação de ATP em outros locais, como no GRD, ainda não foi estabelecido. Alguns estudos relatam que o ATP pode ser liberado por exocitose pelo corpo neuroral ou através de hemicanais como as junções comunicantes (ZHANG et al., 2007; BAO et al., 2004).
No SNP a molécula de ATP parece ser importante na transmissão da dor. Foi visto que a injeção intraplantar de ATP promove a excitação dos neurônios sensoriais primários, comportamento espontâneo de dor, hiperalgesia térmica e alodinia mecânica (BURNSTOCK, 2006; HAMILTON et al., 1999; HILLIGES et al., 2002). Em culturas do GRD foram observadas grandes quantidades de ATP nas margens do soma contidas dentro de vesículas lisossomais, as quais foram encontradas, principalmente, em neurônios de pequeno e médio tamanho, ou seja, aqueles neurônios responsáveis pela transmissão dos estímulos nocivos (JUNG et al., 2013; NISHIDA et al., 2014). Trabalhos recentes sugerem que o principal mediador da comunicação entre neurônio e glia nos gânglios sensoriais é o ATP, que atua sobre os receptores purinérgicos tanto no neurônio quanto na glia (CHEN et al., 2008; CHERKAS et al., 2004; TAKEDA et al., 2009).
Os receptores purinérgicos são classificados em ionotrópicos (P2X) e metabotrópicos (P2Y) com base no seu mecanismo de ação e farmacologia (LUSTIG et al., 1993; RALEVIC e BURNSTOCK, 1998). Esses receptores são abundantes nos tecidos de mamíferos podendo ser encontrados em todos os tipos de células incluindo as de origem neuronal. Receptores P2X são canais operados por ligantes catiônicos clássicos que após a ligação de ATP forma um poro permeável a Na+, K+, Ca2+. Os receptores P2X são trímeros formado por subunidades individuais codificadas por sete distintos genes, designados por P2X1 a P2X7 de acordo com a ordem histórica de clonagem (ROBERTS et al., 2006; NORTH et al., 2002). Os receptores metabotrópicos possuem 8 subtipos P2Y1,2,4,6,11,12,13 e 14 e encontram-se acoplados a proteínas Gi/G0 ou Gq/G11 (ABBRACCHIO et al., 2006).
demais receptores P2X. Este receptor é ativado por concentrações altas de ATP e após um estímulo sustentado induz a formação de um poro na membrana celular que é permeável a solutos hidrofílicos de peso molecular até 900 Da (SUPRENANT et al., 1996). Se esta estimulação é prolongada, entre 15 e 30 minutos, a maioria das células entra em apoptose (DI VIRGILIO et al., 1998). A ativação de receptores do tipo P2X7 por ATP em células da glia pode induzir a liberação de citocinas. Em especial, estudos recentes indicam que a ativação de receptores P2X7 por ATP é um passo essencial para a maturação e liberação de
IL-et al., 2001; FERRARI IL-et al., 1997, revisado por FERRARI IL-et al., 2006). O bloqueio do receptor P2X7 com um antagonista ou a redução da sua expressão utilizando RNA de interferência em roedores normais, resulta em uma expressão neuronal aumentada de P2X3, sugerindo que a ativação dos receptores P2X7 exerce uma inibição tônica sobre o P2X3. Por outro lado, o ATP liberado pelos neurônios ativa o receptor P2X7 das células satélites levando à liberação de citocinas como
TNF-neurônio. (ZHANG et al., 2007; KOBAYASHI et al., 2005a; CHEN et al., 2008; KUSHNIR et al., 2011). Assim, pode-se dizer que P2X7 exerce influência tanto excitatória quanto inibitória no corpo do neurônio sensorial. Em um estudo utilizando camundongos knockout para P2X7 foi observado que esses animais não apresentaram hiperalgesia mecânica ou térmica após indução de neuropatia por ligação parcial do nervo ciático e também não apresentavam hiperalgesia após indução de inflamação pela administração intraplantar de Adjuvante Completo de Freud (CFA). Os animais deficientes do receptor purinérgico também
apresentavam níveis mais baixos de IL- e
(CHESSELL et al., 2005).
2. OBJETIVOS
2.1. Objetivo geral
Avaliar o papel dos receptores P2X7 presentes nas células satélites gliais e a das junções comunicantes na nocicepção, utilizando modelos de dor aguda. Deste modo, pretende-se avaliar o papel da comunicação neurônio-glia no GRD na transmissão do estímulo doloroso.
2.2. Objetivos específicos
a) Avaliar o envolvimento do ATP e de receptores P2X7 na comunicação entre neurônios nociceptivos e células satélites gliais em culturas de GRD.
b) Avaliar o papel dos receptores P2X7 presentes em células satélites do GRD na nocicepção induzida por agentes que ativam diretamente os neurônios nociceptivos (capsaicina, mentol e formalina).
c) Avaliar o papel do ATP e dos receptores P2X7 presentes em células satélites na hiperalgesia mecânica induzida por capsaicina e mentol.
d) Avaliar a participação das junções comunicantes na nocicepção induzida por agentes que ativam diretamente os neurônios nociceptivos (capsaicina e formalina).
3. MATERIAL E MÉTODOS 3.1. Animais
Foram utilizados ratos Wistar machos com aproximadamente 200-250 g. Os animais foram mantidos no Depositário de Animais ARFIS-UFU em gabinetes próprios com temperatura controlada (22±1 °C), ciclo claro/escuro de 12 em 12 horas e acesso à água e comida ad libitum até o dia do experimento. Todos os experimentos seguiram as normas de
ética estabelecidas para experimentação com animais acordados, recomendadas pela IASP (International Association for the Study of Pain) (ZIMMERMANN, 1983). Os procedimentos experimentais foram analisados e aprovados pelo Comitê de Ética em Experimentação Animal da Universidade Federal de Uberlândia, Protocolo 098/16 (Anexo 1).
3.2. Drogas
-A740003 (TOCRIS) - antagonistas de receptores P2X7. -BzATP (TOCRIS) agonista de receptores P2X7. -Capsaicina (Sigma).
-Carbenoxolona (Sigma) inibidor de junções comunicantes. -Mentol (Sigma).
-Fluo-3AM (Invitrogen).
3.3. Delineamento experimental
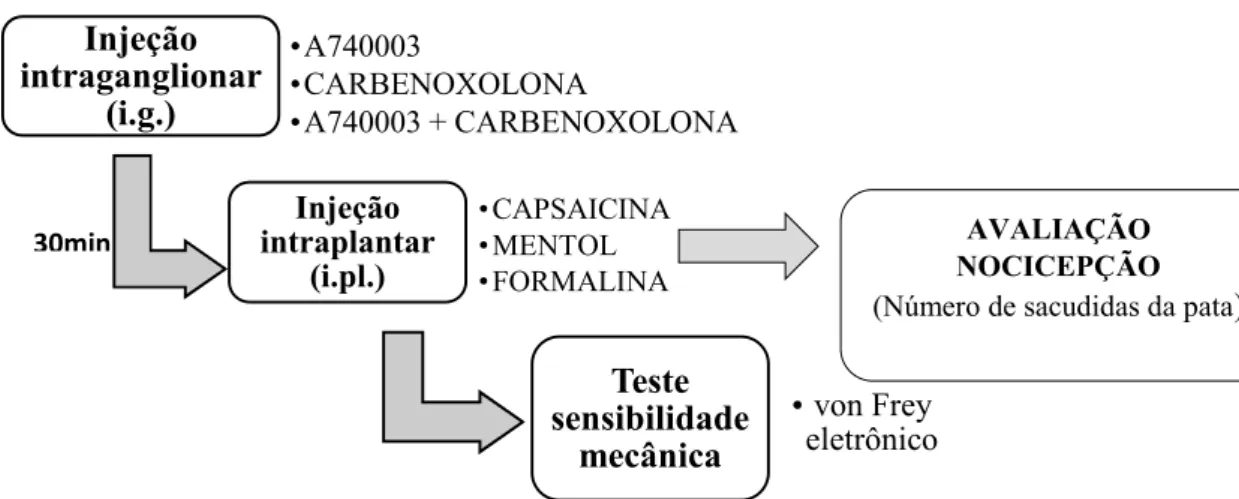
Figura 1: Esquema geral dos experimentosin vivo.O experimento iniciou com a administração das drogas por via intraganglionar (i.g.): A740003 (antagonista de receptores P2X7), Carbenoxolona (inibidores de junções comunicantes) ou ambas as drogas. Após 30min foi feito a administração de agentes indutores de dor por via intraplantar (i.pl): capsaicina, mentol ou formalina. Posteriormente foi feita a avaliação da nocicepção em cada teste experimental e avaliação da hipersensibilidade mecânica pelo método de von Frey eletrônico.
AVALIAÇÃO NOCICEPÇÃO
(Número de sacudidas da pata)
Injeção intraganglionar
(i.g.)
A740003
CARBENOXOLONA
A740003 + CARBENOXOLONA
3.4. Técnicas
3.4.1. Injeção intraganglionar
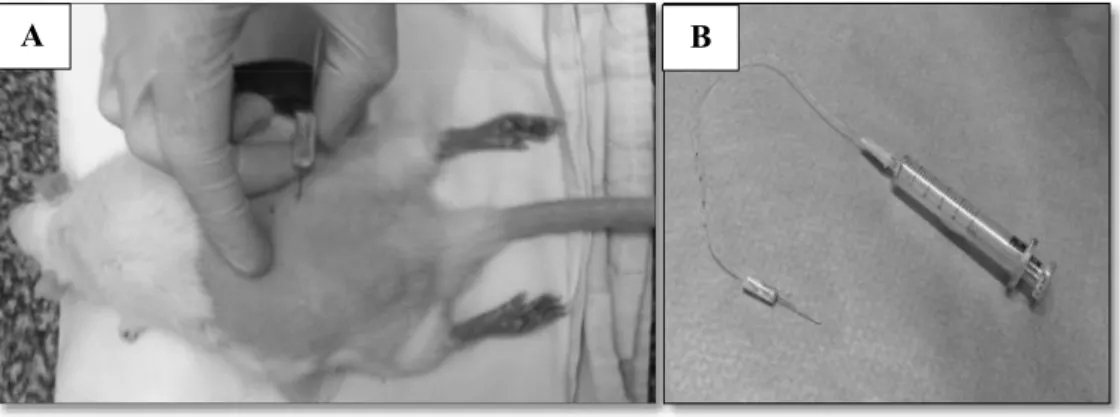
Para a inoculação de drogas no gânglio da raiz dorsal (GRD) foi utilizado o método de injeção direta (FERRARI et al., 2007). Esse método permite verificar os efeitos das drogas apenas sobre neurônios nociceptivos primários e células satélites sem a possibilidade de ação das mesmas em neurônios medulares (secundários) ou em outras células do tecido periférico. Como previamente descrito por FERRARI et al., 2007, o GRD-L5 possui a maioria dos corpos celulares dos neurônios nociceptivos primários que inervam a porção central da pata de ratos, local onde foram administrados os agentes dolorosos: capsaicina, mentol e formalina.
Devido ao pequeno tamanho do gânglio, volumes acima de 5 µL são passíveis de extravasar e permear estruturas adjacentes ao gânglio. Assim, para que volumes pequenos pudessem ser administrados, foi confeccionada uma escala utilizada para controle fino da quantidade de solução injetada. Esta escala foi adaptada a um cateter de 30 cm PE-10 (Intramedic Clay Adams, diâmetro interno de 0.28 mm e externo de 0.61 mm), calibrado de maneira que 25 mm de deslocamento da solução dentro do cateter corresponderiam ao depósito de 1µl de solução. O cateter foi conectado a uma agulha gengival (Dentbras, 30G curta), e, em sua outra extremidade, a uma seringa de vidro (Figura 2B).
procedimento total de administração intraganglionar durou de 10 a 15 min até a recuperação do estado consciente dos ratos.
Figura 2: Injeção intraganglionar (i.g.). Em A: rato anestesiado recebendo a droga via i.g. EmB: material utilizado para a realização da administração da solução no gânglio da raiz dorsal L5 (agulha gengival-cateter-seringa de vidro). Fotos de autoria própria.
3.4.2. Injeção intraplantar da capsaicina
Esse modelo foi proposto por Sakurada et al. em 1992 para o estudo de compostos que atuam sobre a dor neurogênica. A injeção de capsaicina induz a estimulação direta dos neurônios nociceptivos por ativar o canal TRPV1 e causa a liberação de vários neuropeptídios envolvidos na transmissão dolorosa. Nesse teste foi realizada uma injeção intraplantar a direita dos animais tratados e controles. A injeção intraplantar da capsaicina foi feita após 30 minutos da injeção intraganglionar de 1nM A740003, 1nM Carbenoxolona e 1nM A740003 + Carbenoxolona no grupo tratado e veículo no grupo controle. Logo após a administração intraplantar da capsaicina, os animais foram observados por 5 minutos para avaliação da nocicepção. Durante esse tempo foi registrado o número de vezes que o animal sacodiu e lambeu a pata afetada. Para padronização, cada lambida foi considerada como uma sacudida.
3.4.3. Injeção intraplantar do mentol
Após 30 minutos da injeção intraganglionar de 1nM A740003 (grupo tratado) e veículo (10% DMSO + SALIN) no grupo controle, foi injetado por via intraplantar 25 µl de uma solução contento 50 mg de mentol na pata traseira direita dos animais (GENTRY et al., 2010). O mentol atua nos neurônios por meio da ativação do TRPM8.
Nessa concentração o mentol atua como estímulo nocivo aos nociceptores (dor provocada pelo frio). Após a injeção intraplantar do mentol, os animais foram observados durante 10 minutos para avaliação da nocicepção. Durante esse período foi registrado o número de sacudidas e lambidas de cada animal, mantendo o mesmo padrão de avaliação.
3.4.4. Teste da formalina
O teste da formalina realizado neste estudo consistiu na injeção intraplantar de uma solução de 50 contendo 1% de formalina. Esta injeção foi feita também 30 minutos após injeção intraganglionar de 1nM A740003 ou 1nM carbenoxolona no grupo tratado e no grupo controle (10% DMSO+ salina ou salina).
A formalina desencadeia comportamentos relacionados com a dor ao ativar TRPA1 em nociceptores aferentes primários (MCNAMARA et al., 2007). A dor induzida por formalina possui duas fases distintas. A primeira fase é neurogênica, começando logo após a injeção de formalina, que dura aproximadamente 10 minutos. A segunda fase é inflamatória, normalmente começando após 15 a 20 minutos e com duração de até 60 minutos (DUBUISSON e DENNIS 1977). Os animais tratados e controles foram observados por um tempo total de 60 minutos. O tempo de registro foi separado em blocos de 5 minutos e um escore de dor foi determinado para cada bloco determinando-se o número de vezes que o animal sacodiu ou lambeu a pata, seguindo o mesmo padrão de avaliação do teste da capsaicina e mentol.
3.4.5. Teste de pressão crescente: von Frey eletrônico
administração do estímulo). Durante os experimentos os animais são mantidos em caixas acrílicas medindo 12 x 100 por 17 cm de altura, com assoalho formado por uma rede de malhas medindo cerca de 5 mm2constituída de arame não maleável de 1mm de diâmetro (Figura 3B). Antes do início dos experimentos os animais permanecem nessas caixas por quinze minutos para a adaptação do ambiente.
Figura 3: Método von Frey eletrônico. EmA: transdutor de pressão que mede a força em gramas. EmB:caixas acrílicas onde os ratos são colocados para a estimulação mecânica. Fotos de autoria própria.
3.4.6. Cultura primária do gânglio da raiz dorsal
As culturas foram realizadas conforme o protocolo descrito por Linhart et al., 2003. Os ratos foram anestesiados com Halotano, eutanaziados por decaptação, e em seguida, foram retirados os gânglios da raiz dorsal da região lombar e torácica (16 a 20 gânglios por animal). Posteriormente, os gânglios foram colocados em solução éril com 10 mM de tampão HEPES e, em seguida, dissociadas por incubação a 37oC durante 75 minutos em
contendo 0,28 U/ml de colagenase (ti contendo
0,25 mg/ml de tripsina. Após essas etapas, os gânglios foram lavados e dissociados mecanicamente utilizando uma pipeta Pasteur, em meio DMEM suplementado com 10% de soro fetal bovino inativado, 2 mM de glutamina, 50 U/ml de penicilina, 50 mg/ml de streptomicina. As células foram então cultivadas em placas cobertas com Matrigel e mantidas em atmosfera de 5% CO2e 37oC.
As culturas foram utilizadas após 48 horas e incubados com o indicador fluorescente intracelular de Ca2+ Fluo-3AM (5 µM) durante 40 minutos no escuro. Em seguida, foram levadas para microscópio confocal (Zeiss) e separadas em placas controles e tratadas. Nas placas controle
administrou-A740003 (10 nM) ou BzATP (500 µM) 5 minutos antes da capsaicina (1 µM). Entre as administrações não foi feita a lavagem das placas. Uma sequência de fotos logo após cada administração foi feita e, posteriormente as imagens foram analisadas através do software ImageJ (NIH) onde quantificou-se a fluorescência emitida do neurônio e glia em cada momento. A variação da fluorescência corresponde as alterações no níveis de Ca2+.
3.5.Análise estatística
0 30 60 90 120 -0.25 0.00 0.25 0.50 0.75 1.00 1.25 1.50 1.75 2.00 2.25 2.50 2.75 3.00 neurônios glia tempo (s) 4. RESULTADOS
4.1. Papel dos receptores P2X7 gliais e liberação de ATP por neurônios nociceptivos ativados por capsaicina.
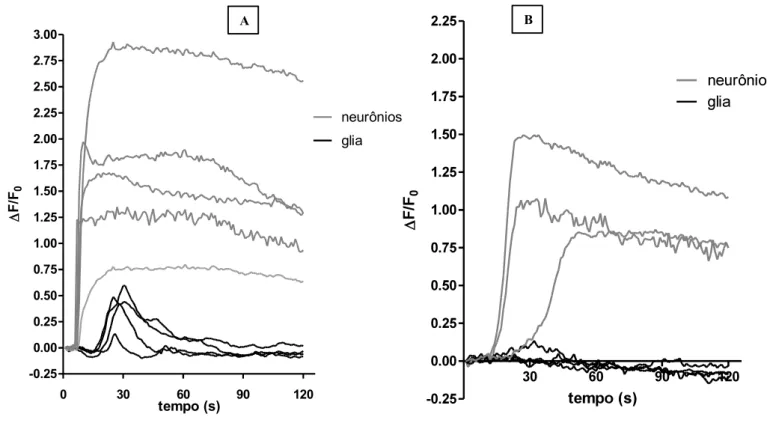
O efeito da capsaicina sobre os níveis intracelulares de cálcio foi avaliado em culturas primárias de GRD através do uso da sonda fluorescente Fluo3-AM, conforme descrito nos métodos. A administração da capsaicina (1 µM) nas placas controle gerou aumento dos níveis de Ca2+intracelular nos neurônios, como já era esperado, visto que, essas células apresentam o receptor da capsaicina (TRPV1). Porém, após alguns segundos também foi observada uma resposta nas células satélites, as quais, não possuem receptor para capsaicina (Figura 4A). Administração prévia do antagonista seletivo para receptores P2X7, A740003 (1 nM), resultou na diminuição da resposta das células satélites à capsaicina enquanto a resposta dos neurônios à capsaicina permaneceu inalterada (Figura 4B).
Figura 4: Avaliação do papel dos receptores P2X7 e liberação de ATP por neurônios nociceptivos ativados por capsaicina in vitro. Em A: Efeito da capsaicina (1µM) sobre o cálcio intracelular observado através de fluorescência em neurônios (curvas cinzas) e células satélites (curvas pretas). EmB: Efeito do tratamento com o A740003 (10 nM) administrado 5 minutos antes da administração de capsaicina (1 µM) sobre o aumento de cálcio observado em neurônios e em células satélites. Resultados representativos de 3 diferentes experimentos realizados através de microscopia confocal em culturas de GRD de ratos carregadas com o indicador fluorescente Fluo3-AM (5µM).
4.2. Participação dos receptores P2X7 na nocicepção induzida por capsaicina.
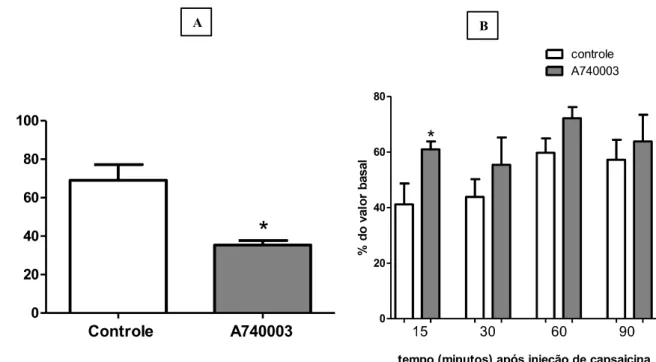
No experimentoin vivo para a avaliação do papel dos receptores P2X7 na nocicepção
induzida por capsaicina (10 µg), os animais previamente tratados o antagonista desse receptor (1 nM A740003 i.g.), apresentaram uma diminuição da nocicepção quando comparado ao grupo controle. Os animais controles apresentaram maior número de sacudidas do que os animais tratados (Figura 5A). Para a avaliação da hiperalgesia mecânica desses animais foi realizado o teste de von Frey, nos tempos de 15, 30, 60, 90 minutos após a injeção intraplantar de capsaicina. O resultado mostrou diferença significativa na sensibilidade mecânica no tempo 15 minutos (Figura 5B). Isto é, o grupo previamente tratado com o antagonista de receptores P2X7 resistiu a um estímulo mecânico de maior pressão quando comparado com o grupo controle. Nos tempos 30, 60 e 90 minutos não foi observada diferença estatística entre os grupos.
Figura 5: Avaliação da participação dos receptores P2X7 na nocicepção e na hiperalgesia mecânica, induzida por capsaicina. A-Número de sacudidas após a injeção intraplantar da capsaicina ( ) de animais controles (salina i.g.) e animais tratados (A740003 1nM i.g).B- Teste von Frey eletrônico 15, 30, 60, 90 minutos após a injeção da capsaicina. Dados mostrados como média e EPM de 6 animais por grupo. * p<0,005 diferente do grupo controle (teste t).
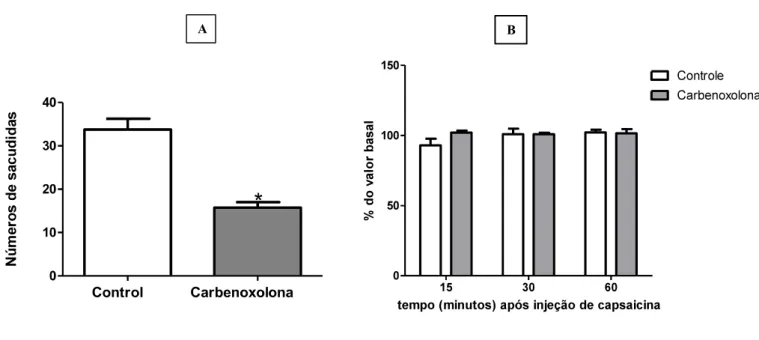
4.3. Participação das junções comunicantes na nocicepção induzida por capsaicina.
A participação das junções comunicantes na dor aguda foi avaliada injetando-se o inibidor carbenoxolona (1 nM, 5 µl) por via intraganglionar (L5) 30 minutos antes da injeção intraplantar de 10 µg de capsaicina. (Figura 6A). O bloqueio das junções comunicantes no gânglio da raiz dorsal reduziu significativamente a nocicepção induzida por capsaicina. Após a avaliação da nocicepção, a sensibilidade mecânica foi avaliada através do teste do von Frey eletrônico (Figura 6B). Neste experimento, a injeção de capsaicina não induziu hipernocicepção mecânica não sendo, portanto, possível observar diferenção com o tratamento com carbenoxolona.
Figura 6: Avaliação da participação das junções comunicantes na nocicepção e na hiperalgesia mecânica, induzidas por capsaicina. A- Número de sacudidas após a injeção intraplantar da capsaicina ( ) de animais controles (salina i.g,) e animais tratados (Carbenoxolona 1nM i.g).B- Teste von Frey eletrônico 15, 30, 60 minutos após a injeção da capsaicina. Dados mostrados como média e EPM de 6 animais por grupo. * p<0,005 diferente do grupo controle (teste t).
4.4. Avaliação do efeito conjunto do bloqueio de junções comunicantes e receptores P2X7 na nocicepção induzida por capsaicina.
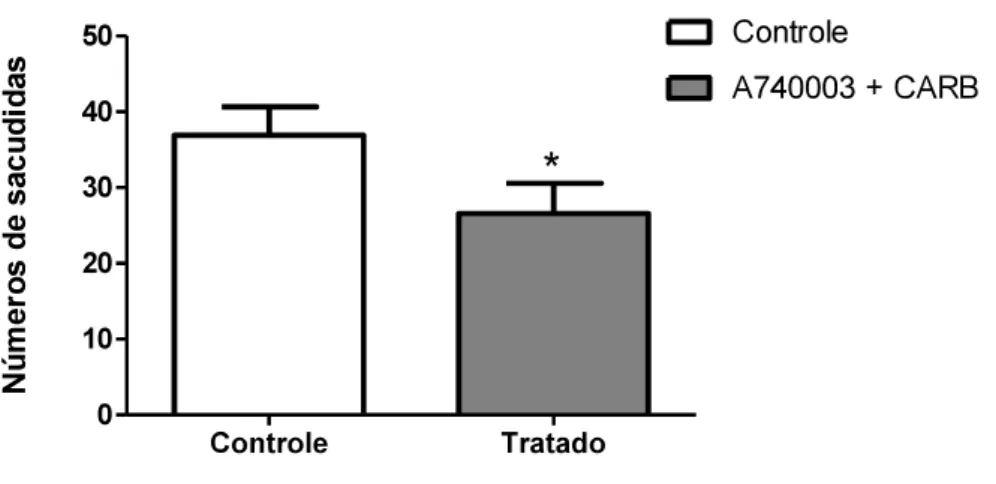
Nesse experimento foi administrado o antagonista de receptores P2X7 juntamente com inibidor das junções comunicantes (1 nM A740003 + 1 nM carbenoxolona) por via
intraganglionar. Como pode-se observar na figura 7, os animais tratados com ambas as drogas obtiveram uma redução da nocicepção à capsaicina quando comparado com o controle, porém não há um somatório do efeito das drogas. A aplicação conjunta do inibidor de junções comunicantes e antagonista de receptores P2X7 no gânglio não teve efeito maior do que aplicação das drogas separadamente, como é mostrado na figura 5A e 6A.
Figura 7: Avaliação do efeito conjunto de A740003 + carbenoxolona na nocicepção induzida por capsaicina.
O gráfico representa o número de sacudidas após a injeção intraplantar da capsaicina ( ) de animais controles (salina i.g,) e animais tratados (A740003 + Carbenoxolona 1nM i.g). Dados mostrados como média e EPM de 11 animais por grupo. * p<0,005 diferente do grupo controle (teste t).
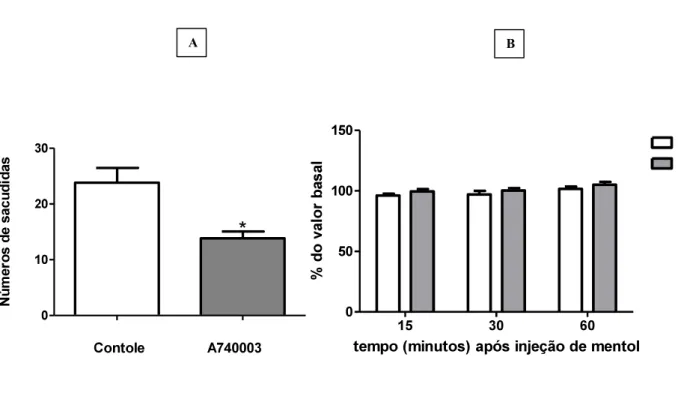
4.5. Participação dos receptores P2X7 na nocicepção induzida por mentol.
No experimentoin vivo para a avaliação do papel dos receptores P2X7 na nocicepção
Figura 8: Avaliação da participação dos receptores P2X7 na nocicepção induzida por mentol. A- Número de sacudidas após a injeção intraplantar de mentol (25 mg em 25µl) em animais controles (salina i.g,) e animais tratados (A740003 1nM i.g). B- Teste von Frey eletrônico 15, 30, 60 minutos após a injeção intraplanatar de mentol. Dados mostrados como média e EPM de 6 animais por grupo. * p<0,005 diferente do grupo controle (teste t).
4.6. Participação dos receptores P2X7 na nocicepção induzida por formalina
Nesse experimento os animais foram previamente tratados com uma injeção intraganglionar de 1nM de A740003 no grupo tratado e veículo no grupo controle assim como nos testes anteriores. Após 30 minutos os animais tratados e controles receberam a injeção intraplantar de 1% de formalina e, logo em seguida, foram observados durante 60 minutos. Foi registrado o número de sacudidas ou lambidas da pata afetada em blocos de 5 minutos (Figura 9). Os resultados mostraram uma redução na nocicepção induzida por formalina do grupo tratado apenas na segunda fase, nos tempos 15, 20, 25 minutos. Na primeira fase que corresponde aos primeiros 10 minutos não houve diferença estatística entre os grupos.
Figura 9: Avaliação da participação dos receptores P2X7 na nocicepção induzida por formalina. O gráfico representa o número de sacudidas após a injeção intraplantar de formalina a 1% em animais controles (10% DMSO + salina i.g.) e animais tratados (1nM A740003 i.g). Dados mostrados como média e EPM n= 6. * p<0,05 diferente do grupo controle (ANOVA duas vias e teste Bonferroni).
4.7. Participações das junções comunicantes na nocicepção induzida por formalina
No teste da formalina, para avaliação das junções comunicantes, os animais previamente tratados com o inibidor dessas junções (1 nM Carbenoxolona i.g.) obtiverem também uma redução na nocicepção induzida por formalina a 1% apenas na segunda fase, porém agora, nos tempos 40 e 50 minutos (Figura 10).
(salina i.g.) e animais tratados (1 nM Carbenoxolona i.g). Dados mostrados como média e EPM n= 6. * p<0,05 diferente do grupo controle (ANOVA duas vias seguida por teste Bonferroni)
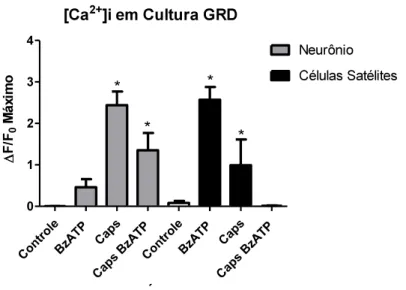
4.8. Cultura do GRD: avaliação do efeito do BzATP sobre a resposta dos neurônios e células satélites estimulados com capsaicina.
O intuito deste teste foi avaliar se o neurônios respondiam diferentemente a capsaicina na presença do agonista de receptor P2X7 (BzATP). As placas foram separadas em controles
onde administrou- 1 µM, e placas tratadas onde
administrou-se BzATP 500µM e posteriormente a capsaicina 1 µM. Foi avaliada as alterações dos níveis de Ca2+tanto dos neurônios quanto de células satélites em cada administração através do uso da sonda fluorescente Fluo3-AM. Como pode-se observar na figura 11, a administração 2+ em nenhuma das células, como já era esperado, visto
que, refere-se ao controle. A administração de BzATP induz aumento significativo dos níveis de Ca2+nas células satélites e em neurônios. A administração de capsaicina nas placas controles leva a aumento dos níveis de cálcio tanto neurônios e células satélites, como também já era esperado. E a administração da capsaicina após o tratamento com o agonista BzATP resultou em uma diminuição na resposta neuronal e nenhuma resposta nas células satélites (Figura 11).
Figura 11: Avaliação do efeito do BzATP sobre a resposta dos neurônios e células satélites estimulados com capsaicina.O gráfico mostra as alterações dos níveis de Ca2+observado através de fluorescência dos neurônios e
5. DISCUSSÃO
Recentemente, vários estudos tem evidenciado a participação das células gliais do sistema nervoso periférico no processamento da dor. As células satélites do gânglio da raiz dorsal vem se destacando por apresentar um papel modulador na resposta dolorosa atuando em comunicação com os nociceptores. A molécula de ATP parece ser um importante mediador da comunicação entre neurônios e células satélites gliais (CHEN et al., 2008; CHERKARS et al., 2004). Em um estudo de Hang et al. (2006) foi detectada a liberação de ATP pelos corpos celulares dos neurônios do GRD, em resposta a um estímulo elétrico. O ATP liberado, por sua vez, atuou nas células satélites através da ativação de receptores purinérgicos do subtipo P2X7. Mecanismo semelhante a esse foi encontrado em nossos resultados. Na cultura do GRD, a administração da capsaicina levou à ativação dos neurônios através dos receptores TRPV1, resultando no aumento nos níveis intracelulares de Ca2+. Em seguida, também foi observada ativação das células satélites. Visto que as células satélites não apresentam receptores para capsaicina, pudemos inferir que algum mediador estava sendo liberado pelos neurônios para então atuar nas células satélites. Em vista do trabalho de Huang et al. (2006), decidimos investigar se estaria ocorrendo liberação de ATP pelos neurônios e ativação de receptores P2X7 em células satélites gliais. Para tanto, foi ulitizado o antagonista seletivo A740003 incubado previamente ao tratamento com capsaicina. A administração do antagonista resultou no bloqueio da resposta das células satélites mas não nos neurônios. Considerando que o receptor P2X7 está presente apenas nas células satélites e que são ativados por altas concentrações de ATP (ZHANG et al., 2005), identificamos que o mediador dessa comunicação neurônio-glia no GRD estimulado pela capsaicina é o ATP.
pesquisa, pois mostram que os neurônios pequenos e médios, possivelmente nociceptores, liberam ATP no GRD.
Visto que a ativação de nociceptores por capsaicina nos teste in vitro resultou em
liberação de ATP e ativação de células satélites gliais, decidimos avaliar se esta comunicação de alguma forma poderia interferir na atividade dos nociceptores in vivo. Para tanto, foi
realizado o teste da capsaicina de forma que os neurônios nociceptivos foram ativados diretamente através de injeção intraplantar de capsaicina, resultando em comportamentos tipicamente nociceptivos como o sacudir e lamber as patas dos animais. A participação das células satélites gliais na nocicepção foi avaliada através da injeção intraganglionar do antagonista de receptores P2X7, o A740003, de forma a bloquear a comunicação entre neurônios e células satélites da mesma maneira que nos testesin vitro.Pudemos observar que
os animais tratados com o antagonista obtiveram uma redução significativa da nocicepção induzida por injeção de capsaicina. Este resultado é surpreendente visto que a capsaicina ativa diretamente potenciais de ação em neurônios, os quais são transmitidos até os terminais centrais levando à liberação de neurotransmissores. Isso sugere que esses receptores estão envolvidos na transmissão do estímulo da capsaicina, confirmando o que foi visto em cultura, isto é, existe uma comunicação entre neurônios e células satélites no GRD que envolve a liberação de ATP pelos neurônio quando ativado pela capsaicina e que por sua vez, atua sobre os receptores P2X7 nas células satélites gliais. A ativação do receptor P2X7 por ATP supostamente promove outros eventos moleculares, os quais, atuariam novamente no neurônio alterando a resposta nociceptiva
Embora este tipo de comunicação tenha sido avaliada por outros autores, este estudo é o primeiro que sugere a participação das células satélites gliais na dor aguda, sem que ocorra sensibilização dos nociceptores.
voltagem (CHERKAS et al., 2004; VIT et al., 2006; ZHANG et al., 2009). Apesar dessas células não responderem a estímulos elétricos, elas respondem a estímulos externos por mudanças no Ca2+ citosólico através da abertura de receptores permeáveis a Ca2+, como por exemplo, receptores purinérgicos ionotrópicos P2X (ZHANG et al., 2007; CERUTI et al., 2008). Deste modo, essas células usam Ca2+intracelular para sinalização, de forma semelhante às células gliais no SNC. Em culturas do gânglio trigêmeo, a estimulação mecânica das células satélites promove ondas de Ca2+ que espalham aos neurônios e entre as células satélites adjacentes. Essa sinalização de Ca2+ é mediada por receptores purinérgicos e por junções (SUADICANI et al., 2010). Considerando isso em nossos resultados, pode-se sugerir que a ativação dos receptores P2X7 pelo ATP liberado pelos neurônios em resposta a capsaicina, levaria ao aumento de Ca2+intracelular que resultaria em ondas de cálcio. Essas ondas teriam ação sobre outras células satélites de unidades vizinhas, resultando na liberação de mais ATP que atuaria agora nos neurônios, provocando uma amplificação do sinal doloroso. Assim sendo, em nossos experimentos, quando realizamos o bloqueio de P2X7 diretamente no GRD, esse possível mecanismo de ondas de Ca2+não estaria ocorrendo e portanto, o resposta do neurônio à capsaicina é reduzida, resultado que foi constatado pela diminuição da nocicepção.
A capsaicina excita de forma robusta e seletiva neurônios sensoriais aferentes primários associados a fibras C, provocando uma sensação de dor aguda de queimação acompanhada de vasodilatação e inflamação locais, seguida de hipersensibilidade ao calor (hiperalgesia térmica) Em nosso teste para a avaliação da hipersensibilidade mecânica utilizando método von Frey eletrônico, na dor induzida por capsaicina, obteve-se diferença estatística apenas no tempo de 15 minutos dos animais tratados com A740003. Portanto, a inibição de receptor P2X7 reduziu a hiperalgesia mecânica, entretanto, nos demais tempos avaliados não houve diferença entre os grupos. A concentração de capsaicina utilizada causou uma dor rápida e hipersensibilidade branda, por isso, não foi verificada alterações nos demais tempos. Nos demais experimentos em que mentol ou capsaicina foram administrados, estes agentes não foram suficientes para induzir um aumento de sensibilidade mecânica. Deste modo, não pudemos avaliar a participação de junções comunicantes ou do receptor P2X7 na sensibilização induzida por estes agentes.
No teste in vivo da capsaicina onde os animais foram previamente tratados com o
foi somatório quando comparado com os testes em que essas drogas foram aplicadas separadamente. Podemos perceber, inclusive que o efeito observado foi menor do que de qualquer um dos inibidores sozinhos. Este resultado sugere que a ativação dos receptores P2X7 nas células gliais e o transporte de substâncias através de junções comunicantes são processos dependentes. Este resultado corrobora com a ideia de que as células satélites seriam ativadas por ATP liberado por neurônios ativados e o sinal seria amplificado através da comunicação entre células satélites de neurônios próximos no gânglio da raiz dorsal. Deste modo, a liberação de ATP e ativação de receptores P2X7 parece depender da comunicação via junções comunicantes para que o sinal possa ser amplificado ou processado no gânglio da raiz dorsal.
Nos experimentos seguintes, procuramos avaliar se a participação de ATP/P2X7 e da comunicação entre neurônios e células satélites é um processo que depende da ativação de receptores TRPV1 para capsaicina, ou se ocorre em qualquer situação de dor aguda. Para tanto, buscamos outros modelos de nocicepção. Visto que os bloqueadores são administrados no gânglio da raiz dorsal no nível L5, só pudemos utilizar de modelos de nocicepção induzida na pata traseira dos animais. Foram utilizados, portanto, os testes de administração de mentol e formalina na pata de ratos. No teste in vivo do mentol observou-se uma diminuição na
nocicepção em animais tratados com antagonista dos receptores P2X7 no gânglio, sugerindo novamente uma comunicação neurônio-glia no GRD mediada por ATP, tal como foi visto com a capsaicina. Dessa forma, o antagonista A740003 alterou a resposta neuronal à dor ao frio
situação de nocicepção. Os resultados obtidos nos testes com capsaicina, mentol e formalina indicam que esta comunicação é exclusiva de um subtipo de fibras nociceptivas, as fibras C, visto que o receptor TRPA1 encontram-se expressos abundantemente nesse tipo de fibra (MCNAMARA et al., 2007). Em um estudo de Puig e Sorkin (1995), foi investigado de forma detalhada o envolvimento de diferentes tipos de fibras nervosas no teste da formalina. Foi verificado que e C são ativadas, sendo que os picos médios de
ativação de fibras do que as fibras C. Já na fase 2,
foi observado ativação apenas d e C, sendo que 100% das fibras C apresentaram atividade nesse fase, porém não de maneira uniforme. Esse estudo colabora com os resultados obtidos nesse trabalho. Outro estudo mais recente (SHIELDS et al., 2010), utilizando a destruição de fibras do tipo C através da administração intratecal de capsaicina em camundongos, também mostra a participação diferencial das fibras A e C no teste da formalina. Neste estudo, verifica-se que a concentração de formalina utilizada interfere no tipo de fibra ativada, sendo em 0,5% de formalina ambos os tipos de fibra são ativados, em 2% de formalina predomina a ativação das fibras A , sendo que apenas na segunda fase do teste é detectada ativação de fibras C. Dessa maneira, considerando que as fibras C participam mais ativamente durante a fase 2 e a administração do antagonista dos receptores P2X7 reduziu a nocicepção nesta fase em alguns momentos, sugere-se que este receptor está envolvido em processo de nocicepção envolvendo a ativação das fibra C. Como na fase 1 a fibra C é pouco ativada, o bloqueio do P2X7 não alterou a resposta, pois as ação as fibras se sobressaem nessa fase. Apesar não ter diferença significativa na fase 1, observa-se uma queda na nocicepção dos animais tratados com o antagonista, sugerindo novamente que a ativação de receptores P2X7 das células satélites parece estar envolvido na ativação de fibras não mielinizadas.
efeito analgésico. Os animais tratados apresentaram menor resposta nociceptiva do que os animais controles. Esse resultado indica uma possível participação das junções comunicantes na nocicepção induzida por capsaicina. Já no teste da formalina, o grupo tratado com carbenoxolona, apresentou uma diminuição na nocicicepção apenas nos tempos 40 e 45 minutos, ou seja, no fim da segunda fase da formalina. Isso sugere que as junções comunicantes tem participação mais tardiamente, e os receptores P2X7 atuariam no início da fase 2 como visto no resultado do teste da formalina em animais tratados com antagonista A740003. A carbenoxolona é um inibidor amplamente utilizado em estudos com dor. Em um modelo de dor inflamatória por CFA, o tratamento com carbenoxolona via intraperitonial reduziu o acoplamento entre CSGs no GRD (DUBLIN e HANANI, 2007), e em um modelo de dor sistêmica por LPS, a carbenoxolona também administrada por via intraperitoneal resultou em uma redução da hipersensibilidade mecânica nos animais afetados (BLUM et al., 2014). Esses resultados corroboram com o possível papel das junções comunicantes na transmissão da dor, entretanto, geram algumas dúvidas devido ao local de administração, pois a drogas pode atuar em outros locais que não no GRD. Em nossos testes a administração de carbenoxolona foi diretamente no gânglio sensitivo (L5), o que permite ter maior segurança quanto ao local de atuação da droga. Estudos mais recentes verificaram que em certas concentrações a carbenoxolona também funciona como um inibidor de panexinas, mais especificadamente panx-1 (DAHL et al., 2013). As panexinas também estão envolvidas na liberação de ATP assim como de outros mediadores (ZHANG et al., 2015). Inicialmente foram consideradas como
membros em semelhanças na sequência gênica.
Porém, fortes evidências demonstram que as panexinas são canais de membrana funcionais e que não atuam como canal intercelular em membranas opostas como ocorre nas conexinas OSINKY et al., 2011; LOCOVEI et al., 2006). Alguns estudos apontam para uma relação entre panx1 e receptor P2X7 no sistema nervoso central em modelos de crônica (BRAVO et al., 2015). Desta forma, é possível que a administração de carbenoxolona possa não somente estar bloqueando a comunicação intercelular através de junções comunicantes, mas também esteja inibindo a liberação de ATP através de panexinas. Os processos envolvidos na liberação de ATP no gânglio da raiz dorsal parecem ser importantes para o processamento da dor e pretendemos estudar estes eventos em estudo próximo.