Ocorrência de listeria monocytogenes em frangos alternativos
Occurrence of listeria monocytogenes in alternative poultry
DOI:10.34117/bjdv6n6-137
Recebimento dos originais: 08/05/2020 Aceitação para publicação: 05/06/2020
Cleise de Oliveira Sigarini Sander de Souza
Formação acadêmica: Docente do Curso de Ciência e Tecnologia de Alimentos. Instituição: Universidade Federal de Mato Grosso (UFMT).
Endereço: Avenida Fernando Correa da Costa, 2367 –Boa Esperança. Cuiabá, Mato Grosso, Brasil – 78060-900
E-mail: csouza0503@gmail.com Roberto de Oliveira Roça
Formação acadêmica: Docente da Faculdade de Medicina Veterinária e Zootecnia Instituição: Universidade Estadual Paulista Júlio de Mesquita Filho - UNESP.
Endereço: Caixa Postal, 237. CEP 18.603-970. Botucatu. SP. Brasil. Pesquisador do CNPQ. E-mail: robertoroca@fca.unesp.br
José Paes de Almeida Nogueira Pinto
Formação acadêmica: Docente da Faculdade de Medicina Veterinária e Zootecnia Instituição: Universidade Estadual Paulista Júlio de Mesquita Filho - UNESP.
Endreço: Caixa Postal 572. CEP 18.618-000. Botucatu. SP. Brasil. Ricardo Ichiro Sakate
Formação acadêmica: Fiscal Federal Agropecuário.
Instituição: Ministério da Agricultura Pecuária e Abastecimento. Brasília/DF André Vicente Ruiz de Matos
Formação acadêmica: Médico Veterinário
Instituição: Universidade Estadual Paulista Júlio de Mesquita Filho - UNESP. Botucatu - SP. Greika Ferreira Moura
Formação acadêmica: Doutoranda do Programa de Pós Graduação em Ciência Animal - UFMT, Cuiabá, Mato Grosso, Brasil.
RESUMO
A criação de frangos alternativos preconiza o bem estar das aves sem o uso de antibióticos, coccidiostásticos, promotores de crescimento e ração de origem animal. No entanto, devido à ausência de inibidores exógenos, bactérias patogênicas podem estar se disseminando sem restrição na granja, sendo levadas ao abatedouro, contaminando não só o ambiente de abate, mas também o produto destinado ao consumidor final. Uma destas bactérias, Listeria monocytogenes é um microrganismo ubíquo, responsável pela listeriose, doença zoonótica grave que leva a aborto/natimortos, neuropatias, gastroenterites. É portanto, de fundamental importância que conheçamos a incidência desta bactéria da recepção das aves no abatedouro até o acondicionamento do produto final, para que possamos identificar com precisão os principais focos de contaminação. Assim, foram colhidas 230 amostras sendo estas, em ambientes, equipamentos, utensílios e carcaças
de frango em diferentes etapas de abate/processamento de frangos alternativos. As amostras foram analisadas pela técnica convencional de isolamento de L. monocytogenes e posterior confirmação por técnica molecular. De 230 amostras analisadas, apenas 12 foram confirmadas como L. monocytogenes, representando 5,21% do total de amostras colhidas em diferentes pontos do fluxograma de abate. Do total de amostras positivas (12), apenas duas (3,33%) destas foram identificadas no produto final (cortes embalados).
Palavras-chave: Criação alternativa, listeriose, abate de aves, microbiologia de alimentos.
ABSTRACT
The alternative systems chicken prodution focuses animal welfare, antibiotic-free animal production, with no coccidiostatic drugs or growth promoters or food of animal origin. However the absence of exogenous inhibitors could potentially spread pathogenic bacteria to the farm and then to the slaughterhouse, contaminating not only the environment of slaughter, but also the final product. One of these bacteria, Listeria monocytogenes, is an ubiquitous pathogen which causes listeriosis, a severe zoonotic disease that leads to abortion/ stillbirth, neuropathy, gastroenteritis. Therefore, the identification of sources of this bacterium in poultry slaughterhouses and in the final product is very important. A total of 230 samples were collected from the slaughterhouse environment, equipment, utensils and carcasses in different stages of slaughtering and chicken processing. Samples were analyzed using the conventional technique for isolation of L. monocytogenes. Confirmation was achieved using molecular technique. Only 12 out of 230 samples were positive for L. monocytogenes which represent 5.21% of the samples from this slaughterhouse. Only two samples (3.33%) from the final product were positive for this pathogen.
Keywords: Alternative system, listeriosis, poultry slaughtering, food microbiology.
1. INTRODUÇÃO
O gênero Listeria compreende quinze espécies: Listeria welshimeri, Listeria seeligeri, L. monocytogenes, Listeria innocua, L. grayi, L. ivanovii, L. marthii (GRAVES et al., 2010), L. rocourtiae, L. weihenstephanensis (LANG HALTER, NEUHAUS, SCHERER, 2013), L. fleischmannii L. aquática, L. cornellensis, L. floridensis, L. grandensis e L. riparia (DEN BAKKER et al., 2014).
Listeria monocytogenes é o agente etiológico de uma das mais graves enfermidades transmitidas por alimentos (ETA), a listeriose. Patógeno oportunista, sua presença em alimentos confere sérios riscos à saúde de gestantes, recém nascidos, idosos e indivíduos imunocomprometidos, devido a sua alta mortalidade (JANZTEN et al., 2006).
Segundo Nakamura et al. (2013), Listeria monocytogenes é um dos microrganismos mais problemáticos para a indústria de alimentos, por sua capacidade de colonizar superfícies de equipamentos, formando biofilme bacteriano e por apresentar resistência a sanitizantes comumente utilizados, favorecendo assim, a disseminação deste patógeno aos demais setores da indústria.
Por ser um microrganismo ubiqüitário, isolado no solo, água, silagem, vegetais e outras fontes ambientais, torna-se extremamente difícil restringir as fontes de contaminação nas diferentes etapas de processamento de alimentos. A disseminação deste patógeno na indústria alimentícia é favorecida
por sua tolerância aos efeitos deletérios do congelamento, desidratação, acidez e altas temperaturas, apesar de sua incapacidade de formar esporos (DYKES e MOORHEAD, 2000). Vincula-se à L. monocytogenes uma grande importância na indústria de alimentos por sua capacidade de sobreviver e se multiplicar em temperatura de refrigeração. Assim, enquanto a refriger ação constitui obstáculo para a maioria dos patógenos, L. monocytogenes encontra um ambiente com baixa competição para multiplicação, uma vez que a maioria dos produtos de origem animal são armazenados sob refrigeração, são ricos em proteínas e gorduras, estes se tornam o substrato ideal para este patógeno. Lage (1993); Kabuki (1997) e Pelisser et al. (2001), colheram amostras de carne de frango resfriada do comércio varejista em diferentes estados brasileiros, e analisaram quanto à presença de Listeria spp e L. monocytogenes. Resultados muito semelhantes foram verificados por estes autores, entre 90% a 100% de contaminação por Listeria spp. Quanto à contaminação por L. monocytogenes houve um variação de 4,4% a 60% de positividade. Osaili, Alaboudi e Nesier (2011), avaliaram 160 amostras de carcaças de frango, e constatou a presença de L. monocytogenes em 9,4% das carcaças. O nível de contaminação de carne de frango, inteiro e resfriado, para Listeria spp bem como Listeria monocytogenes, também foi avaliado por Mendes (2000) em Florianópolis, durante o período de maio a julho de 1999. Isolou-se Listeria spp em 37,5% das amostras analisadas. Destas, 27,1% foram identificadas como Listeria monocytogenes, 2,1% como Listeria innocua, 6,2% como Listeria seeligeri e 2,1% como Listeria welshimeri.
A maioria dos trabalhos nacionais identificando a presença de L. monocytogenes em frango aponta um alto nível de contaminação por este patógeno (GONÇALVES et al., 2001; ARAGON et al., 2003), no entanto, estas pesquisas se restringem às amostras colhidas somente no comércio varejista, tornando-se difícil a identificação dos pontos de contaminação e disseminação do patógeno na cadeia produtiva do frango de corte. Identificar a contaminação do produto final torna-se de maior relevância, quando se identifica qual elo da cadeia produtiva em questão é falha e pode ser melhorada. Milillo et al. (2012), realizaram estudo buscando a prevalência de L. monocytogenes em granja de frangos alternativos, um total de 399 amostras de swab cecal foram analisadas, destas 1,75% foram positivas para L. monocytogenes, o que demostra que as aves podem trazer a contaminação para indústria.
Diante da relevância em saúde pública de L. monocytogenes e de diferentes pesquisas identificando a presença deste patógeno em carne de frango e derivados, o presente trabalho tem como objetivo verificar a ocorrência de L. monocytogenes em carcaças e cortes de frangos, submetidos ao sistema de criação alternativa. O ponto de partida desta pesquisa fundamenta-se no fato da dieta destes animais não utilizarem antibióticos, coccidiostáticos e promotores de crescimento, como no sistema convencional de criação, assim, aventa-se uma maior susceptibilidade destes
animais a contaminação por L. monocytogenes e a conseqüente disseminação deste no ambiente de abate e no produto final.
2. MATERIAL E MÉTODOS
Um total de 230 amostras foram colhidas em um abatedouro no Estado de São Paulo, destinado exclusivamente ao abate de frangos alternativos, sob o regime de fiscalização federal.
Foram realizadas dez visitas ao referido estabelecimento, sendo que em cada uma destas 23 amostras foram colhidas, em 14 pontos: Carcaça - Após a sangria (P1), Carcaça - Após evisceração (P2), Carcaça - Após o chiller (P3), Cortes armazenados em câmara fria (P4), Mesa inox da sala de evisceração (P5), Água do Chiller (P6), Luvas dos manipuladores da sala de evisceração (P7), Faca da sala de evisceração (P8), Faca do setor desossa (P9), Luva do setor desossa (P10), Mesas da desossa (P11), Ralo da desossa (P12), Bandeja para armazenamento de produtos na câmara fria (P13) e Cortes embalados (P14). Perfazendo um total de 230 amostras.
As carcaças de frango foram escolhidas aleatoriamente e amostradas pela técnica de enxágüe duas carcaças de frango, após as etapas de sangria, evisceração e imediatamente após a saída dos resfriadores contínuos. Procedimento semelhante foi realizado para obtenção das amostras de cortes armazenados em câmara fria. As amostras colhidas nesta etapa representavam os cortes do abate do dia anterior. Para colheita das amostras de água foram utilizados recipientes estéreis contendo tiossulfato de sódio a 1%, próprio para coleta de água. Aplicou-se a técnica de imersão, colhendo 100 mL de água na parte final do tanque de resfriamento contínuo. Amostras das luvas dos funcionários dos setores de evisceração e sala de desossa. As mãos dos funcionários foram enxaguadas e massageadas com 200 mL de solução salina estéril (0,85% NaCl) durante um minuto.
Para as amostras da superfície em contato com o alimento, foram colhidas amostras da superfície de bandejas plásticas utilizadas para o armazenamento de produtos, mesas de inox da sala de evisceração e desossa. Estas foram obtidas com auxílio de moldes de aço inox de 50 X 50 cm (totalizando 100 cm2) e de gazes, previamente esterilizadas e embebidas em 10 mL de solução salina. Amostras das facas dos setores de evisceração e desossa, também foram colhidas com auxílio de gaze embebida em 10 mL de solução salina, em toda a sua superfície.
Todas as amostras obtidas com auxílio de gazes foram armazenadas individualmente, em bolsas plásticas apropriadas para colheita de amostras, identificadas e acondicionadas em isopor com gelo reciclável, até o momento da pesquisa bacteriológica.
Para o isolamento e identificação de L. monocytogenes, adotou-se a metodologia revisada do USDA (UNITED STATES, 2008), sendo esta, subdividida nas seguintes etapas: enriquecimento
seletivo primário, enriquecimento seletivo secundário, plaqueamento seletivo diferencial, purificação e confirmação bioquímica.
Foram consideradas positivas para L. monocytogenes as amostras que apresentaram comportamento bioquímico segundo Pagoto et al. (2006), sendo este dextrose e ramnose positivas, xilose e manitol negativas e presença de beta hemólise em ágar sangue equino. Todas as amostras com perfil bioquímico característico para L. monocytogenes e L. innocua foram estocadas e posteriormente submetidas à técnica molecular de PCR, uma vez que a única diferença entre estas espécies encontra-se na capacidade, de apenas a primeira causar beta hemólise em ágar sangue de carneiro e ou equino.
Cada amostra suspeita foi inoculada em caldo tripticase de soja suplementado com 0,6% de extrato de levedura (TSB-YE) e incubada a 35ºC por 24 horas. Após o crescimento, adicionou-se uma alíquota de óleo mineral estéril, a fim de garantir a integridade celular bacteriana durante a etapa de estocagem em freezer, para posterior emprego de técnica molecular.
Para Extração do DNA bacteriano, adotou-se a técnica descrita por Sambrook e Russel (2001). Para o preparo da reação e amplificação foram utilizados os seguintes oligonucleotídeos específicos para Listeria monocytogenes: LIS-R (AAGCAGTTACTCTTATCCT); MONO5-F (GCTAATACCGAATGATAAGA); MONO7-F (GGCTAATACCGAATGATGAA), conforme descrito por Somer e Kashi (2003). As reações foram realizadas com volume final de 25 L, sendo utilizado para cada reação 0,5 U de Taq DNA polimerase; 1 L de DNA; 0,2 mM de cada dNTP; 2,5 mM de MgCl2; tampão da Taq 1X e o par de primers na concentração de 20Mm, nas respectivas proporções de: 2 L de LisF, 1 L de Mono5-F e 1L de Mono7-F.
As condições para amplificação de um fragmento de 314 pb foram estabelecidas e a especificidade e sensibilidade analítica foram determinadas. A PCR foi otimizada utilizando-se os seguintes parâmetros: 5 minutos a 95C para desnaturação inicial, seguida por 40 ciclos de amplificação. Cada ciclo consistiu nas etapas de desnaturação (95C por 40 min.), anelamento (58C por 40 min.), extensão dos oligonucleotídeos (72C por 40 min.) e ainda um ciclo final a 72C por 7 minutos. Como controle positivo, utilizou-se L. monocytogenes CDC F4555 e ATCC 19119, padrões obtidos na Fundação Oswaldo Cruz. Os produtos resultantes da PCR foram analisados pelo protocolo de eletroforese estabelecido por Sambrook e Russel, 2001.
3. RESULTADOS E DISCUSSÃO
Dentre as 230 amostras analisadas, baseado na metodologia da USDA, para identificação e diferenciação de bactérias do gênero Listeria, 107 apresentaram comportamento bioquímico característico para L. innocua e apenas duas amostras apresentaram comportamento bioquímico
característicos para L. monocytogenes, totalizando 109 amostras estocadas para posterior confirmação molecular.
Nesta pesquisa, optou-se pela estocagem de tais espécies em razão da similaridade do comportamento bioquímico destas bactérias nas provas de metabolismo dos açúcares e tendo a prova de hemólise em ágar sangue como único diferencial entre as mesmas. Assim, em ágar sangue, L. monocytogenes por ser uma cepa beta - hemolítica apresenta um halo de hemólise entorno da UFC, enquanto L. innocua não. No entanto, existem algumas cepas de L. monocytogenes que apesar de patogênicas, reduzem ou perdem sua capacidade de causar a beta hemólise em ágar sangue, tornando impossível a distinção entre L. monocytogenes não hemolítica de L. innocua.
Das 107 amostras identificadas como L. innocua através de técnica tradicional, dez, posteriormente, foram identificadas como L. monocytogenes através de técnica molecular de PCR, confirmando a incapacidade destas de provocar hemólise. Desta forma, 9,34% das amostras positivas para L. monocytogenes seriam erroneamente interpretadas como L. innocua caso os resultados fossem baseados exclusivamente pela metodologia tradicional. Resultados semelhantes foram verificados por Chiarini (2007), em pesquisa realizada também em abatedouro de aves, no qual verificou um percentual de 23,3% de resultados falsos negativos.
Apenas duas amostras foram identificadas como L. monocytogenes por técnica convencional e em seguida confirmadas por PCR. De um total de 230 amostras analisadas, 109 amostras foram armazenadas como suspeitas para ambos os microrganismos, destas, apenas 12 amostras foram confirmadas como L. monocytogenes, representando 5,21% do total de amostras analisadas.
As demais amostras (97) armazenadas como suspeitas, foram confirmadas como L. innocua, representando 89% das 109 amostras suspeitas estocadas. O alto nível de contaminação por L. innocua também foi verificado por Pinho et al. (2006), ao investigar a diversidade do gênero Listeria em uma planta de abate e industrialização de aves. Em sua pesquisa constataram que L. innocua era a espécie mais freqüente do gênero em todos os setores de abate de aves. Estes autores sugerem a ocorrência de antagonismo dentro do gênero, uma vez que à medida que a freqüência desta espécie cresce, a riqueza específica do gênero diminui.
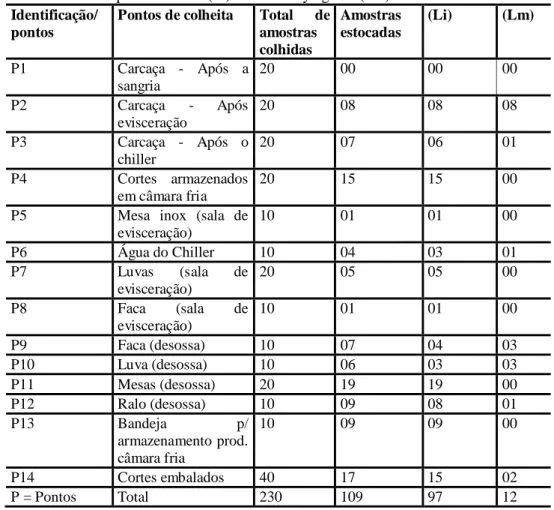
Observando os dados expressos na Tabela 1 é possível verificar a crescente contaminação de L. innocua, durante o processo de abate destas aves, demonstrando a ocorrência de contaminação cruzada neste abatedouro. Este fato pode ser observado a partir do P6, onde se inicia o contato do” ambiente de abate”, equipamentos e utensílios com a matéria prima.
Tabela 1 - Pontos contaminados por L. innocua (Li) e L. monocytogenes (Lm). Identificação/
pontos
Pontos de colheita Total de amostras colhidas Amostras estocadas (Li) (Lm) P1 Carcaça - Após a sangria 20 00 00 00 P2 Carcaça - Após evisceração 20 08 08 08 P3 Carcaça - Após o chiller 20 07 06 01 P4 Cortes armazenados em câmara fria 20 15 15 00
P5 Mesa inox (sala de evisceração) 10 01 01 00 P6 Água do Chiller 10 04 03 01 P7 Luvas (sala de evisceração) 20 05 05 00 P8 Faca (sala de evisceração) 10 01 01 00 P9 Faca (desossa) 10 07 04 03 P10 Luva (desossa) 10 06 03 03 P11 Mesas (desossa) 20 19 19 00 P12 Ralo (desossa) 10 09 08 01 P13 Bandeja p/ armazenamento prod. câmara fria 10 09 09 00 P14 Cortes embalados 40 17 15 02 P = Pontos Total 230 109 97 12
Verifica-se também que, houve maior contaminação de facas, luvas e mesas do setor de desossa, quando comparado com os mesmos itens do setor de evisceração. Este fato pode estar relacionado à capacidade de L. monocytogenes sobreviver em ambiente de refrigeração, assim o ambiente climatizado da sala de desossa exerce efeito negativo sobre os demais microrganismos, favorecendo então a proliferação de listeria neste ambiente.
Este dado pode ser interpretado de diferentes maneiras, como a possibilidade desta bactéria estar presente na planta processadora, através de biofilmes formados em equipamentos e ou utensílios, causando contaminação cruzada durante as etapas de abate e acondicionamento do produto final. Tompkin (2002) afirma que as células agrupadas em biofilmes bacterianos, são mais resistentes ao processo de higienização e também tem grande potencial de se libertar, fazendo deste local uma fonte contínua de contaminação.
Tal resultado também pode ser relacionado ao número restrito de funcionários deste estabelecimento, que desempenhando mais de uma função em diferentes setores do abatedouro, podem carrear a contaminação de um setor para outro. Tal possibilidade, pode estar relacionada à afirmação de Pinho et al. (2006), onde estes afirmam que a contaminação ambiental é a mais frequente para L. monocytogenes.
As diferentes pesquisas realizadas em plantas frigoríficas de aves demonstram que o maior percentual de isolamento de L. monocytogenes encontra-se na área limpa e principalmente refrigerada do abatedouro (RORVICK et al., 2003; CHIARINI, 2007; ALONSO-HERNANDO et al., 2012). Este constatação tem sua importância elevada quando realizamos uma análise do quadro geral. A característica de baixa competitividade deste patógeno frente a outros contaminantes ambientais associados a sua habilidade de crescimento em temperatura de refrigeração, cria um impasse, uma vez que a constante busca do controle de qualidade de uma empresa para implantação e validação dos programas de qualidade (HACCP, PPHO, GMP, além dos ISOS) assegura um ambiente favorável à contaminação por L. monocytogenes.
Com relação às amostras obtidas das luvas dos manipuladores de alimentos, verificou -se a presença de L. monocytogenes em 10% (3/30) de amostras de luvas e 1,34% (3/230) do total analisado. Resultado semelhante foi verificado por Barbalho et al. (2005), ao analisarem a prevalência deste patógeno em um abatedouro de aves na Bahia. Isolaram L. monocytogenes em 11,8% das amostras de luvas e mãos dos manipuladores. Ainda em concordância, Chiarini (2007), também identificou a presença deste patógeno em 13,2% das amostras de luvas e mãos de manipuladores.
Não foi verificada a presença de L. monocytogenes nas amostras de facas do setor de evisceração, no entanto, verificou-se a presença do referido patógeno em 30% (3/10) das facas do setor de desossa.
Apenas uma 10% (1/10) das amostras de água do chiller analisadas foi identificada como L. monocytogenes. Este resultado também se encontra em conformidade com os resultados encontrados por outros pesquisadores (Barbalho et al., 2005, Chiarini, 2007) em amostras de água do chiller.
Do total de amostras de água de chiller examinadas (10), quatro (40%) foram estocadas como suspeitas apenas para L. innocua destas, três (30%) foram confirmadas por PCR e uma amostra foi identificada como L. monocytogenes.
As amostras colhidas do ralo da sala de desossa, apenas uma, representando 10% do total destas, foi confirmada como L. monocytogenes através de técnica molecular. Entanto, Rodrigues et al. (2002), identificaram a presença de L. monocytogenes em 100% das amostras de drenos e pisos de uma linha de processamento de nuggets congelados de frango.
Do total de 60 amostras de cortes de frango analisados (P4 + P14), 32 amostras (53,33%) foram armazenadas de acordo com o comportamento bioquímico, como suspeitas para L. innocua. Destas, 30 amostras (50%) foram confirmadas por PCR como L. innocua e duas amostras (3,12%) foram identificadas como L. monocytogenes.
Foram consideradas as amostras do produto final como positivas para L. monocytogenes, apenas aquelas que após isolamento por metodologia tradicional foram confirmadas por PCR com
amplificação de um fragmento de 314 pb. Assim, nesta pesquisa, identificou -se a presença do referido patógeno no produto final apenas em duas amostras, representando 3,33% do total de cortes pesquisados. As amostras positivas para L. monocytogenes estão apresentadas na Figura 1.
Figura 1 Distribuição das amostras positivas para L. monocytogenes nos seis grupos de amostras colhidas.
A detecção de L. monocytogenes em 3,33% do produto final analisado deve ser analisada por dois ângulos. Apesar de se ter detectado este microrganismo no produto final analisado, tal resultado não indica um risco direto a saúde do consumidor, uma vez que o produto passará por tratamento térmico antes do consumo. Por outro lado, o produto contaminado será fonte de contaminação, favorecendo a disseminação do patógeno para o ambiente de preparo e armazenamento do alimento. Além de favorecer a contaminação cruzada através de manipuladores e de equipamentos e utensílios que entrem em contato com o mesmo.
Ao analisarmos os resultados verificados em diferentes pesquisas em abatedouro de aves, observamos que não há um nível de contaminação a ser esperado, em virtude da discrepância dos resultados verificados. Chiarini (2007) em sua pesquisa relata que a contaminação do produto final por L. monocytogenes em um abatedouro com evisceração automática foi de 14,4% (13/90) amostras, enquanto que em um abatedouro com evisceração manual foi de 19,4% (18/93) amostras. Autores como Lage (1993); Kabuki (1997) e Pelisser et al. (2001), relataram contaminação do produto final na proporção que variam de 4,4% a 60%. Desta forma, torna-se extremamente difícil comparar tais resultados e afirmar que o nível de contaminação por L. monocytogenes neste abatedouro foi superior ou inferior a aquele.
Assim, os resultados encontrados na presente pesquisa e os diferentes resultados verificados na literatura científica, devem ser correlacionados com cautela uma vez que devemos considerar variáveis como, volume de abate do estabelecimento amostrado, os procedimentos operacionais
0,00% 2,00% 4,00% 6,00% 8,00% 10,00% 12,00% 14,00% 16,00% L. monocytogenes Carcaças (P2+P3) Produtos (P4+P14) Facas (P8+P9) Superfícies sem contato (P12) Luvas (P7+P10) Água do Chiller (P6)
padrões, os planos de controle de qualidade aplicados em cada, assim como a metodologia utilizada para identificação do microrganismo em cada pesquisa.
De uma forma geral, de um total de 230 amostras analisadas nesta pesquisa, apenas 12 foram confirmadas como L. monocytogenes, representando 5,21% das amostras em um abatedouro de aves. Resultados semelhantes foram verificados por Hosseinzadeh et al. (2012), que de um total de 100 amostras de frango, obteve 7% de amostras positivas. O nível de contaminação por L. monocytogenes verificado nesta pesquisa encontra-se abaixo da média dos verificados em outras pesquisas similares, no entanto, os resultados verificados para L. innocua encontram-se dentro da média. Em pesquisa realizada em abatedouro de aves por Chiarini (2007), identificou a presença de L. monocytogenes em 16,4% das amostras e 58,4% para L. innocua.
Outro fator que merece destaque constatado nesta pesquisa refere-se ao índice de contaminação por L. innocua na planta processadora e no produto final. Apesar desta espéci e não apresentar perigo em saúde pública, por não ser patogênica ao homem, o elevado nível de contaminação deve ser encarado como um indicativo de falhas no fluxograma de abate, permitindo a entrada e perpetuação de L. innocua, e o risco de contaminação por L. monocytogenes.
Petran e Swanson (1993) verificaram que os caldos de enriquecimento comumente utilizados para identificação de Listeria em alimentos favorecem o crescimento de L. innocua em relação a L. monocytogenes. Estes autores relatam que ao inocularem proporções iguais de L. innocua e L. monocytogenes nos caldos de enriquecimento TSB-YE, FRASER e UVM, o tempo de geração de L. innocua foi menor que de L. monocytogenes apresentando assim, uma população de L. innocua superior. Neste contexto, estes autores afirmam que a real incidência de L. monocytogenes talvez não seja normalmente registrada, uma vez que os meios de enriquecimento usados no isolamento de L. monocytogenes favorecem a multiplicação de L. innocua, acordando com isso Yokoyama et al. (2005), em pesquisa avaliando o tempo de geração de L. innocua e de L. monocytogenes em alimentos, verificou que L. innocua produz bacteriocinas, sendo estas responsáveis pela inibição da fase de crescimento exponencial de L. monocytogenes.
As facas do setor de desossa assim como as luvas dos manipuladores, apresentaram o maior percentual de contaminação por L. monocytogenes, quando comparado com as demais amostras positivas nesta pesquisa. Desta forma, deve-se considerar a importância das mesmas, como fonte de disseminação do patógeno para todos os setores da indústria.
4. CONCLUSÃO
Com base nos resultados obtidos nesta pesquisa pode-se concluir que:
- O sistema alternativo de criação dos frangos não favoreceu a contaminação por L. monocytogenes dos mesmos.
- Constatou-se um baixo de nível de contaminação por Listeria monocytogenes das amostras de superfície de contato e não contato no abatedouro de aves pesquisado.
- As facas e as luvas dos manipuladores contribuíram para a contaminação do produto final, conferindo risco de colonização do ambiente e perpetuação do patógeno através de biofilmes bacterianos.
REFERÊNCIAS
ALONSO-HERNANDO, A. et al. Increase over time in the prevalence of multiple antibiotic resistance among isolates of Listeria monocytogenes from poultry in Spain. Food Control, v. 23, p. 37-41, 2012. doi:10.1016/j.foodcont.2011.06.006
ARAGON, L. C., et al. Detection of Listeria sp. in VIP for Listeria immunoassays and a cultural procedure. In: CONGRESSO BRASILEIRO DE MICROBIOLOGIA, 22. 2003, Florianópolis. Anais... Florianópolis, 2003.
BARBALHO, T. C. F., et al. Prevalence of Listeria spp., at a poultry processing plant in Brazil and a phage test for rapid confirmation of suspect colonies. Food Control, v. 16, p. 211-216, 2005. doi:10.1016/j.foodcont.2004.01.014
CHIARINI, E. Listeria monocytogenes em matadouros de aves: marcadores sorológicos e genéticos no monitoramento de sua disseminação. 2007. 149 p. Tese (Doutorado em Ciência dos Alimentos) – Faculdade de Ciências Farmacêuticas, Universidade de São Paulo, São Paulo, 2007. DEN BAKKER, H.C. et al. Listeria floridensis sp. nov., Listeria aquatica sp. nov., Listeria cornellensis sp. nov., Listeria riparia sp. nov. and Listeria grandensis sp. nov., from agricultural and natural environments. Journal of Systematic and Evolutionary Microbiology, v. 64, p. 1882-1889, Jun.,2014. doi: 10.1099/ijs.0.052720-0
DYKES, G. A.; MOORHEAD, S. M. Survival of osmotic and acid stress by Listeria monocytogenes strains of clinical or meat origin. International Journal of Food Microbiology, v. 56, p. 161-166, 2000. doi:10.1016/S0168-1605(99)00205-6
GONÇALVES, A. C., et al. Ocorrência de Listeria spp. em peitos de frango e controle da contaminação através de desinfetantes comerciais. In: SIMPÓSIO LATINO-AMERICANO DE CIÊNCIA DE ALIMENTOS, 4., 2001, Campinas. Anais... Campinas, 2001.
GRAVES, L.M. et al. Listeria marthii sp. nov., isolated from the natural environment, Finger Lakes National Forest. International Journal of Systematic and Evolutionary Microbiology, v. 60, p. 1280–1288, 2010. doi: 10.1099/ijs.0.014118-0
HOSSEINZADEH. S., et al. 2012. Prevalence and Risk Factors for Listeria monocytogenes in Broiler Flocks in Shiraz, Southern Iran. Foodborne Pathog Dis 9: 568-572.
JANZTEN, M. M., et al. Specific detection of Listeria monocytogenes in foods using commercial methods: from chromogenic media to real time PCR. Spanish Journal of Agricultural Research, v. 4, p. 235-247, 2006. doi: 10.5424/sjar/2006043-198
KABUKI, D. Y. Contagem de Listeria spp pelo método do número mais provável (NMP), avaliação de sua ocorrência em carnes de frango e da eficiência de sanitizantes na redução da contaminação por Listeria monocytogenes. 1997. 91 p. Dissertação (Mestrado em Tecnologia de Alimentos) – Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas, Campinas, 1997.
LAGE, M. E. Ocorrência de Listeria spp em carne de frango no mercado da cidade de Belo Horizonte, MG. 1993. 78 p. Dissertação (Mestrado em Medicina) - Universidade Federal de Minas Gerais, Belo Horizonte, 1993.
LANG HALTER, E.; NEUHAUS, K.; SCHERER, S. Listeria weihenstephanensis sp. nov., isolated from the water plant Lemna trisulca taken from a freshwater pond. International Journal of Systematic and Evolutionary Microbiology, v. 63, p. 641-647, fev.,2013. doi: 10.1099/ijs.0.036830-0
MENDES, S. D. C. Detecção de Listeria spp. em frango resfriado pelo método convencional em condições de aerobiose e microaerofilia. 2000. 59 p. Dissertação (Mestrado em Ciências dos Alimentos) - Universidade Federal de Santa Catarina, Florianópolis, 2000.
MILILLO, S. R. et al. Listeria monocytogenes and hemolytic Listeria innocua in poultry. Poultry Science, v. 91, p. 2158–2163, 2011. http://dx.doi.org/ 10.3382/ps.2012-02292
NAKAMURA, H., TAKAKURA, K., SONE, Y., ITANO, Y., NISHIKAWA, Y. Biofilm formation and resistance to benzalkonium chloride in Listeria monocytogenes isolated from a fish processing plant. Journal of Food Protection, 76, 1120-1299, 2013. doi: 10.4315/0362-028X.JFP-12-225.
PAGOTTO, F., et al. Isolation of Listeria monocytogenes from all food and environmental samples. In: HEALTH CANADA. Food & Nutrition. Research Programs & Analytical Methods. Compendium of analytical methods. Listeria spp. and L. monocytogenes. Canadá, 2006, v. 3. Disponível em: <http://www.hc-sc.gc.ca/fn-an/res-rech/analy-meth/microbio.html>
PELISSER, M. R., et al. Detection of Listeria species in refrigerated chicken carcasses using clearview and a modified conventional culture method. Brazilian Journal of Microbiology, v. 32, p. 113-116, 2001. < http://dx.doi.org/10.1590/S1517-83822001000200008 >
PETRAN, R. L.; SWANSON, K. M. J. Simultaneous growth of Listeria monocytogenes and Listeria innocua. Journal of Food Protection, v.56, p.616-618, 1993. https://doi.org/10.4315/0362-028X-56.7.616
PINHO, M. Á.; et al. Diversidade do Gênero Listeria em uma planta de abate e industrialização de aves. Biotemas, Florianópolis, v. 19, n. 4, p. 7-12, jan. 2006. ISSN 2175-7925. Disponível em: <https://periodicos.ufsc.br/index.php/biotemas/article/view/21088>. Acesso em: 15 ago. 2015. doi:http://dx.doi.org/10.5007/21088
RODRIGUES, D.; et al. Evaluation of two methods for the detection of Listeria sp. and Listeria monocytogenes in a chicken nugget processing plant. Canadian Journal Microbiology, v. 48, p. 275-278, 2002. doi: 10.1139/w01-142
SAMBROOK, J.; RUSSEL, D. W. Molecular cloning: a laboratory manual. 3rd ed. Londres: Cold Spring Harbor Laboratory Press, 2001. 1448 p.
SOMER, L.; KASHI, Y. A PCR method based on 16S rRNA sequence for simultaneous detection of genus Listeria and species Listeria monocytogenes in food products. Journal of Food Protection, v. 66, n. 9, p. 1658-1665, 2003. https://doi.org/10.4315/0362-028X-66.9.1658
OSAILI, T.M.; ALABOUDI, A.R.; NESIAR, E.A. Prevalence of Listeria spp. and antibiotic susceptibility of Listeria monocytogenes isolated from raw chicken and ready-to-eat chicken products in Jordan. Food Control, v. 22, p. 586-59, 2011. doi:10.1016/j.foodcont.2010.10.008
TOMPKIN, R. B. Control of Listeria monocytogenes in the food-processing environmental. Journal of Food Protection, v. 65, p. 709-725, 2002.
UNITED STATES. Department of Agriculture. Food Safety and Inspection Service. Microbiology Laboratory Guidebook. Isolation and identification of Listeria monocytogenes from meat, poultry, egg and environmental samples. 5 ed. rev. 2008.
YOKOYAMA, E., et al. Influence of bacteriocin-like substance, generation times, and genetic profiles of Listeria innocua on the isolation of L. monocytogenes. Comparative Immunology, Microbiology & Infectious Diseases, v. 28, p. 177-186, 2005. doi: 10.1016/j.cimid.2005.01.002