Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 19708-19722 oct. 2019 ISSN 2525-8761
Isolamento e identificação da microbiota fúngica anemófila em Unidade de
Terapia Intensiva
Isolation and identification of anemophilic fungal microbiota in an
Intensive Care Unit
DOI:10.34117/bjdv5n10-186
Recebimento dos originais: 10/09/2019 Aceitação para publicação: 15/10/2019
Rodrigo José Nunes Calumby
Mestrando em Ciências Farmacêuticas pela Universidade Federal de Alagoas Instituição: Universidade Federal de Alagoas
Endereço: Rua Clístenes de Miranda Pinto, n° 55 - Centro, Maceió, AL, Brasil E-mail: rjnc_biomed@hotmail.com
Juliana Almerino Silva
Mestranda em Ciências Farmacêuticas pela Universidade Federal de Alagoas Instituição: Universidade Federal de Alagoas
Endereço: Rua Eronir Oliveira, n° 210 – Clima Bom, Maceió – AL, Brasil E-mail: juliana.almerino@hotmail.com
Davi Porfírio da Silva
Graduando em Enfermagem pela Universidade Federal de Alagoas Instituição: Universidade Federal de Alagoas
Endereço: Rua Boa Esperança, 40 – Clima Bom, Maceió – AL, Brasil E-mail: daviporfirio14@hotmail.com
Rossana Teotônio de Farias Moreira
Doutora em Patologia Ambiental e Experimental pela Universidade Paulista Instituição: Universidade Federal de Alagoas
Endereço: Av. Lourival Melo Mota, s/n, Escola de Enfermagem, Campus A.C. Simões – Tabuleiro dos Martins, Maceió – AL, Brasil
E-mail: rossanateo@hotmail.com Maria Anilda dos Santos Araújo
Doutora em Biologia dos Fungos pela Universidade Federal de Pernambuco Instituição: Centro Universitário Tiradentes - UNIT
Endereço: Rua Conselheiro Francisco Vieira, n° 23 - Prado, Maceió – AL, Brasil E-mail: fungosanilda@hotmail.com
Lara Mendes de Almeida
Doutora em Ciências pela Universidade de São Paulo Instituição: Universidade Federal de Alagoas
Endereço: Av. Lourival Melo Mota, s/n, Instituto de Ciências Farmacêuticas, Campus A.C. Simões – Tabuleiro dos Martins, Maceió – AL, Brasil
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 19708-19722 oct. 2019 ISSN 2525-8761 Luciano Aparecido Meireles Grillo
Doutor em Química Biológica pela Universidade Federal do Rio de Janeiro Instituição: Universidade Federal de Alagoas
Endereço: Av. Lourival Melo Mota, s/n, Instituto de Ciências Farmacêuticas, Campus A.C. Simões – Tabuleiro dos Martins, Maceió – AL, Brasil
E-mail: lucianomeirelesgrillo@gmail.com Valter Alvino
Doutor em Química e Biotecnologia pela Universidade Federal de Alagoas Instituição: Universidade Federal de Alagoas
Endereço: Av. Lourival Melo Mota, s/n, Instituto de Ciências Farmacêuticas, Campus A.C. Simões – Tabuleiro dos Martins, Maceió – AL, Brasil
E-mail: valteralvinos@hotmail.com
RESUMO
Justificativa e objetivo: Os fungos anemófilos são microrganismos encontrados no ar atmosférico que podem desencadear processos alérgicos e infecções disseminadas em pacientes imunocomprometidos. Nos últimos anos, as infecções fúngicas de origem hospitalar, especialmente em Unidades de Terapia Intensiva (UTI), passaram a ser de grande importância, pelo seu aumento gradativo e pelas elevadas taxas de morbidade e mortalidade. Assim, este estudo teve por objetivo isolar e identificar a microbiota fúngica anemófila em UTI de um hospital de Maceió – Estado de Alagoas. Material e Métodos: As amostras do ar foram analisadas através da técnica de sedimentação espontânea em placas de Petri contendo Ágar Sabouraud Dextrose (ASD). Para identificação dos fungos, realizou-se classificação específica baseada na associação dos aspectos macroscópicos com as características microscópicas do exame direto da cultura, sendo os fungos filamentosos confirmados pela estimulação da esporulação pela técnica de microcultivo em lâmina utilizando-se Ágar Lactrimel. As leveduras do gênero Candida foram caracterizadas através da inoculação em ágar cromogênico. Resultados: Na análise quantitativa foi observado o crescimento de 114 Unidades Formadoras de Colônias (UFC), sendo identificados 17 gêneros fúngicos, com destaque para Cladosporium spp. (28,1%), Aspergillus spp. (17,5%) e Penicillium spp. (12,3%). Cladosporium cladosporioides foi a espécie mais frequente (21,9%), seguida por
Aspergillus fumigatus com 10 (8,8%) e Mycelia sterilia com 9 (7,9%). Conclusão: A grande
diversidade e a elevada frequência de isolamento de fungos na UTI são fatores preocupantes, uma vez que a condição imunológica dos pacientes hospitalizados pode implicar no acometimento de infecções nosocomiais, demonstrando a necessidade de monitoramento constante desses ambientes.
Palavras-chave: fungos anemófilos, qualidade do ar, infecção hospitalar.
ABSTRACT
Background and objective: Anemophilous fungi are found in the atmosphere and are a leading cause of allergic reactions and nosocomial infections in immunocompromised in-patients. In recent years, fungal hospital-acquired infections have become a serious concern, mainly in Intensive Care Units (ICU’s), due to the high rates of morbidity and mortality.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 19708-19722 oct. 2019 ISSN 2525-8761 Therefore, the objective of this study was to investigate the anemophilous fungal microbiota in an ICU at a tertiary care hospital in Maceió - State of Alagoas. Material and Methods: Air samples were analyzed using spontaneous sedimentation method with Sabouraud Dextrose Agar (SDA). Fungi were identified based on their macroscopic and microscopic traits as determined by the direct culture examination. Filamentous fungi were confirmed using the microslide technique with Lactrimel agar for sporulation stimulation. Identification of
Candida yeasts was performed using the chromogenic agar. Results: One hundred and
fourteen Colony Forming Units (CFU’s) were obtained. Among these, 17 genera could be identified, such as Cladosporium spp. (28,1%), Aspergillus spp. (17,5%) and Penicillium spp. (12,3%). Cladosporium cladosporioides was the most common species (21,9%), followed by
Aspergillus fumigatus (8,8%) and Mycelia sterilia (7,9%). Conclusion: The incidence of
fungal infections in ICU’s is of serious concern, as immunocompromised in-patients are at a greater risk of acquiring nosocomial infections. Therefore, effective practical measures must be taken in order to prevent fungal infections in clinical settings.
Keywords: anemophilous fungi, air quality, hospital-acquired infections.
1 INTRODUÇÃO
As infecções hospitalares representam uma grande preocupação de saúde mundial, uma vez que elevam as taxas de morbimortalidade, ampliam o tempo de permanência dos pacientes no hospital e, consequentemente, aumentam os custos para os serviços de saúde 1. De acordo com a Portaria do Ministério da Saúde n° 2616 de 12 de maio de 1998 2, define-se como infecção hospitalar, qualquer infecção adquirida após admissão do paciente no hospital e que se manifesta após a internação ou a alta, quando puder ser relacionada com a internação ou procedimentos hospitalares.
As Unidades de Terapia Intensiva (UTI’s) são setores onde os índices de infecção hospitalar, também conhecidas por Infecções Relacionadas a Assistência à Saúde (IRAS), podem ser mais elevados, o que geralmente resulta da interação entre microrganismos, meio ambiente e deficiência dos fatores de defesa dos pacientes 3,4.
Nesse contexto, as infecções de origem fúngica têm-se constituído um problema crescente de saúde pública, em muitos países 5,6, ocupando o terceiro lugar como principal causa de infecção hospitalar 7,8. Diferentes manifestações clínicas, que variam desde processos cutâneos limitados até infecções sistêmicas generalizadas 9,10,11 podem ser adquiridas por via endógena ou exógena, sendo esta última proveniente, principalmente, do ar ambiente, devido a presença de fungos anemófilos 12, os quais possuem dispersão aérea 13 e constituem os principais contaminantes do ar de ambientes internos climatizados, como as UTI’s 14,15.
Nestas unidades, o controle e o conhecimento dos fungos presentes no ar é condição essencial para a garantia de saúde dos pacientes, bem como dos profissionais que trabalham
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 19708-19722 oct. 2019 ISSN 2525-8761 no setor 16 e, por essa razão, a Agência Nacional de Vigilância Sanitária (ANVISA), considera inaceitável a presença de fungos patogênicos e toxigênicos 17. Por considerar a importância
destes fungos no ambiente hospitalar, este estudo se propôs a identificar a microbiota fúngica anemófila em UTI de um hospital público, referência do Estado de Alagoas.
2 MATERIAL E MÉTODOS 2.1 LOCAL DE ESTUDO
O estudo foi realizado na Unidade de Terapia Intensiva do Hospital Universitário Prof. Dr. Alberto Antunes (HUPAA) da Universidade Federal de Alagoas (UFAL), durante o período de fevereiro a abril de 2018.
2.2 AMOSTRAGEM DO AMBIENTE
Para a coleta de fungos anemófilos, foram realizadas exposições mensais de placas de Petri contendo o meio de cultura Ágar Sabouraud Dextrose (ASD) acrescido de cloranfenicol na concentração de 50 mg/L no ambiente da UTI. As placas foram abertas e expostas, com altura de 1,20m, em locais estratégicos e equidistantes do ambiente durante 30 minutos, para deposição de esporos ou outras estruturas fúngicas presentes no ar atmosférico. Em seguida, estas foram incubadas e mantidas à temperatura ambiente (± 25ºC), por um período de sete dias, sendo avaliadas a cada 24 horas, até o surgimento de colônias isoladas.
2.3 IDENTIFICAÇÃO DOS FUNGOS
Após constatação de crescimento fúngico nas placas foi realizada análise quantitativa através de contagem do número de Unidades Formadoras de Colônias (UFC) existentes nas amostras. A identificação dos fungos filamentosos foi baseada na associação dos aspectos macroscópicos com as características microscópicas do exame direto da cultura primária, sendo os mesmos confirmados pela estimulação da esporulação pela técnica de microcultivo em lâmina 18, utilizando-se Ágar Batata Dextrose (BDA) e ágar Lactrimel. Os fungos filamentosos que não apresentaram órgãos de frutificação (esporulação) que permitissem a sua identificação foram classificados como Mycelia sterilia.
Para identificação dos fungos leveduriformes foi realizada análise morfológica das colônias em ágar Sabouraud dextrose e análise microscópica em lâmina corada pela técnica de Gram. O resultado foi associado ao teste de fermentação de fontes de carbono e nitrogênio.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 19708-19722 oct. 2019 ISSN 2525-8761 As leveduras do gênero Candida foram identificadas utilizando-se o meio CHROMágar
Candida®.
2.4 ANÁLISE ESTATÍSTICA
Os dados foram lançados em planilha do programa estatístico GraphPad Prism 8.0® e, após, representados em gráficos e tabelas.
3 RESULTADOS
Na análise quantitativa das colônias foi possível observar a presença de 114 Unidades Formadoras de Colônias (UFC) durante as três coletas realizadas na UTI, destacando-se o mês de abril com 66 UFC. O valor médio de colônias encontradas em cada coleta foi de 38 ± 25,2 UFC, conforme evidenciado na tabela 1. Dentre as 114 UFC encontradas, 99 UFC (86,8%) correspondiam a fungos filamentosos e 15 UFC (13,2%) a fungos leveduriformes.
Tabela 1. Distribuição total de unidades formadoras de colônias de fungos isolados na Unidade de Terapia Intensiva do Hospital Universitário Prof. Alberto Antunes - HUPAA/UFAL, Maceió, AL.
DATA DA COLETA UFC (M ± DP)
Fevereiro/2018 31 (7,75 ± 6,60)
Março/2018 17 (4,25 ± 0,96)
Abril/2018 66 (16,5 ± 15,2)
Total 114 (38,0 ± 25,2)
Legenda: M= Média; DP= Desvio Padrão.
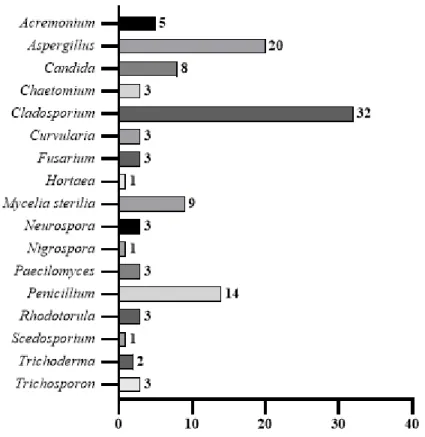
Foram identificados 17 gêneros fúngicos distintos, dentre os quais, 13 pertenciam a fungos filamentosos (Acremonium, Aspergillus, Chaetomium, Cladosporium, Curvularia,
Fusarium, Mycelia sterilia, Neurospora, Nigrospora, Paecilomyces, Penicillium, Scedosporium e Trichoderma) e 4 a fungos leveduriformes (Candida, Phaeoannellomyces, Rhodotorula e Trichosporon), sendo o gênero Cladosporium o mais frequente com 32 (28,1%)
UFC, seguido pelos gêneros Aspergillus com 20 (17,5%) UFC e Penicillium com 14 (12,3%) UFC (figura 1).
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 19708-19722 oct. 2019 ISSN 2525-8761
Figura 1. Distribuição de UFC por gêneros identificados no ambiente da UTI do Hospital Universitário Prof. Alberto Antunes - HUPAA/UFAL, Maceió, AL.
Fungos potencialmente patogênicos e toxigênicos foram isolados nos locais amostrados do ar ambiente da UTI. No que se refere as espécies identificadas, Cladosporium
cladosporioides obteve 25 (21,9%) UFC, seguido por Aspergillus fumigatus com 10 UFC
(8,8%) e Mycelia sterilia com 9 UFC (7,9%), conforme tabela 2.
Tabela 2. Diversidade fúngica anemófila total isolada da UTI do Hospital Universitário Prof. Alberto Antunes - HUPAA/UFAL, Maceió, AL.
Espécies UFC % Classe de Risco Patogenia
Acremonium spp. 5 4,4 1 E Aspergillus flavus 3 2,6 2 P; A; T Aspergillus fumigatus 10 8,8 2 P; A Aspergillus niger 4 3,5 2 P; T Aspergillus ochraceus 3 2,6 1 T Candida albicans 4 3,5 2 E; A Candida krusei 2 1,7 1 E
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 19708-19722 oct. 2019 ISSN 2525-8761
Legenda: Classe de risco 1: baixo risco individual para o trabalhador e para a coletividade, com baixa probabilidade de causar doença ao ser humano. Classe de risco 2: risco individual moderado e com baixa probabilidade de disseminação para a coletividade. Podem causar doenças ao ser humano, para as quais existem meios eficazes de profilaxia ou tratamento; NP: Não patogênico; P: Patogênico; A: Alergênico; E: Emergente ou Oportunista e T: Toxigênico.
4 DISCUSSÃO
A determinação e quantificação de fungos anemófilos de ambientes internos, em áreas críticas de hospitais, como as UTI’s, tem sido pouco pesquisada, contudo alguns estudos têm
Candida tropicalis 2 1,7 2 E Chaetomium spp. 3 2,6 2 E Cladosporium cladosporioides 25 21,9 1 P Cladosporium herbarum 4 3,5 1 P Cladosporium sphaerospermum 3 2,6 1 P Curvularia lunata 2 1,7 1 P Curvularia pallescens 1 0,9 2 P Fusarium incarnatum 1 0,9 1 NP Fusarium oxysporum 2 1,7 2 NP; T Hortaea werneckii 1 0,9 2 P Mycelia sterilia 9 7,9 2 E Neurospora sitophila 3 2,6 1 NP Nigrospora sphaerica 1 0,9 1 NP Paecilomyces variotii 3 2,6 2 E Penicillium aurantiogriseum 6 5,3 1 NP Penicillium citrinum 2 1,7 2 P; T Penicillium chrysogenum 3 2,6 2 P; T Penicillium rugulosum 3 2,6 1 NP Rhodotorula spp. 3 2,6 1 E Scedosporium spp. 1 0,9 2 P Trichoderma harzianum 2 1,7 1 NP Trichosporon spp. 3 2,6 1 NP
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 19708-19722 oct. 2019 ISSN 2525-8761 enfatizado sua importância, em consequência do aumento da incidência desses microrganismos em infecções hospitalares 9,19. Pereira et al. (2014)10 ao avaliarem a presença
de fungos anemófilos em um hospital da cidade de Ariquemes – RO, isolaram 50 colônias em 19 exposições, resultado inferior ao encontrado no presente estudo, onde foram isoladas 114 UFC de fungos em 12 exposições.
Sales et al. (2011)20, em seus estudos sobre a microbiota do ar em unidade de terapia intensiva e centro cirúrgico de um hospital universitário da cidade de Pouso Alegre (MG), realizaram exposição de 180 placas durante o período de 10 meses, detectando um total de 717 UFC de fungos anemófilos. No estudo de Venceslau et al. (2012) 21, a respeito da frequência
de fungos anemófilos em áreas críticas de uma unidade hospitalar de Aracaju - SE, os autores verificaram a ocorrência de 228 UFC em 32 amostras, das quais 58 UFC foram isoladas antes da limpeza e 170 UFC após a limpeza. Os achados destes estudos confirmam o ar atmosférico como um meio eficaz e bem-sucedido de dispersão dos fungos.
A maior ocorrência dos gêneros fúngicos Cladosporium spp., Aspergillus spp. e
Penicillium spp. em amostras provenientes do ar ambiente corrobora com estudos anteriores,
os quais ressaltam a adequabilidade desses microrganismos em ambientes diversos 22,23. Segundo Martins (2016)11, a diversidade de fungos presentes em ambientes fechados é resultante da disseminação ocasionada pelas correntes de ar, entre outros fatores bióticos do ambiente externo, e está relacionada, especialmente, ao aparecimento de gêneros característicos da microbiota local de determinada região.
Em comparação ao estudo de Lobato et al. (2009)24, que coletaram amostras de ar de 26 setores diferentes de um Hospital Universitário do Rio Grande do Sul, os gêneros fúngicos mais prevalentes foram: Cladosporium spp. (75,0%), Aspergillus spp. (71,15%), Alternaria spp. (53,85%) e Penicillium spp. (45,19%). Estes resultados coincidem com o presente estudo, exceto pelo gênero Alternaria spp.
Além destes estudos, pesquisas realizadas no Brasil, tais como as de Mezzari et al. (2003)25, Martins-Diniz et al. (2005)9, Flores & Onofre (2010)14, demonstraram que espécies de Cladosporium estão entre as de maior ocorrência em levantamentos microbiológicos de fungos no ar de ambientes internos.
Na literatura brasileira, poucos trabalhos sobre a microbiota fúngica do ar identificam a nível de espécie os fungos filamentosos encontrados devido às dificuldades como tempo de crescimento, ausência de estruturas reprodutivas e ornamentações fúngicas, carência de
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 19708-19722 oct. 2019 ISSN 2525-8761 literatura especializada, sobretudo na área de taxonomia 9, o que promove limitação na comparação dos resultados entre as espécies.
Comparando o resultado deste estudo com o de Souza (2009)26, que realizou levantamento de fungos anemófilos na UTI neonatal do mesmo hospital, constatou-se que C.
cladosporioides foi a espécie mais prevalente, o que indica uma possível contaminação
ambiental por este microrganismo nesta unidade de saúde. Esta espécie fúngica parece estar amplamente distribuída no ar de ambientes climatizados, sendo responsável por infecções pulmonares, cutâneas e problemas relacionados ao sistema respiratório, frequentemente associada a queixas asmáticas que acometem mais de 10% das crianças e adultos no mundo
27,28,29. Além disso, C. cladosporioides tem sido responsável por um quadro primário de
feo-hifomicose superficial (onicomicose, ceratites), cromoblastomicoses e feo-feo-hifomicose profunda (meningite, quadros pulmonares) 30,31.
Aspergillus e Penicillium são fungos que se destacam por sua ubiquidade. A grande
maioria das espécies destes gêneros são saprófitas, geralmente encontradas no ar, solo, vegetação em decomposição, sementes e grãos 32. Não obstante, conforme Johannessen et al. (2007) 33, algumas espécies são consideradas epidemiologicamente importantes por desencadearem infecções em seres humanos, denominadas de aspergilose e peniciliose.
Dentre as espécies de Aspergillus relevantes e de potencial patogênico identificadas neste estudo, destacam-se: A. fumigatus, A. flavus e A. niger. A. fumigatus é o principal agente etiológico de aspergilose em pacientes imunocomprometidos. A espécie causa uma micose inalatória típica, por meio da qual a colonização e invasão estão geralmente acompanhadas por reações alérgicas 34. Segundo Silva et al. (2017) 35, a presença de A. fumigatus em setores críticos do ambiente hospitalar remete ao potencial risco para acometimento de Aspergilose Pulmonar Invasiva, infecção oportunista em pacientes submetidos à terapia intensiva.
Aspergillus flavus é um dos mais relevantes microrganismos associados a aspergilose
brônquica alérgica em humanos e de infecções pulmonares em pacientes imunologicamente debilitados, os quais podem ter sua patologia agravada pela produção de micotoxinas. Infecciona o ouvido externo e pode desenvolver otite, ocasionalmente com complicações graves. A espécie é também um dos agentes comuns de sinusite fúngica 36.
Aspergillus niger é uma espécie de distribuição universal, com maior prevalência nos
trópicos. É frequentemente isolada de ouvido humano externo, sendo referida como primeiro agente fúngico de otomicoses. Além disso, relata-se na literatura sua importância no
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 19708-19722 oct. 2019 ISSN 2525-8761 acometimento de onicomicose, peritonite e endocardite. Sua ocorrência em pacientes imunocomprometidos está claramente associada com higiene ambiental 34.
Penicillium é um dos principais gêneros fúngicos, apresentando ocorrência
generalizada na maioria dos ambientes terrestres 37. Nos últimos anos, infecções fúngicas por este organismo tornou-se cada vez mais frequentes. Um extenso espectro de entidades clínicas tem sido descritas, sendo que as doenças alérgicas e micoses superficiais são as mais comuns
38. Outro fato peculiar ao gênero é a produção de metabólitos tóxicos, como a citrinina, que
pode ser produzida, principalmente, por espécies de Penicillium citrinum e Penicillium
chrysogenum, ambas encontradas neste estudo 39.
Considerando a importância clínica dos microrganismos encontrados no ar ambiente no desenvolvimento de manifestações alérgicas do trato respiratório (asma, rinite e sinusite), a contaminação microbiológica ambiental evidenciada neste estudo aponta para o risco no acometimento de exacerbações alérgicas em pacientes predispostos internados nesta unidade
35.
5 CONCLUSÃO
A presença de patógenos fúngicos no ambiente podem ocasionar surtos das mais diversas patologias, dentre elas a aspergilose, determinando quadros patológicos específicos, principalmente em pacientes imunocomprometidos.
Os resultados apresentados neste estudo enfatizam a importância do monitoramento de fontes ambientais, bem como a manutenção frequente de aparelhos de ar condicionado, controle de fluxo de pessoas no local, medidas adequadas de antissepsia e desinfecção do ambiente, tornando possível a tomada de medidas preventivas para o controle desses patógenos, contribuindo para a redução de infecções nosocomiais.
REFERÊNCIAS
MENEGUETI, M. G.; CANINI, S. R. M. S.; BELISSIMO-RODRIGUES, F.; LAUS, A. M. Avaliação dos programas de controle de infecção hospitalar em serviços de saúde. Rev. Latino-Am. Enfermagem, v. 23, n. 1, p. 98-105, 2015.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 19708-19722 oct. 2019 ISSN 2525-8761 BRASIL. Ministério da Saúde. Portaria Nº 2.616, de 12 de maio de 1998. Diário Oficial da União, Expede na forma de anexos diretriz e normas para a prevenção e controle das infecções hospitalares, Brasília, 13 mar. 1998.
CARDOSO, A. M. Bactérias Gram-negativas isoladas em uma unidade de terapia intensiva de um Hospital Escola de Goiânia. Revista de Patologia Tropical, v. 34, n. 3, p. 1-10, 2005.
PERNA, T. D. G. S.; PUIATTI, M. A.; PERNA, D. H.; PEREIRA, N. M. M.; COURI, M. G.; FERREIRA, C. M. D. Prevalência de infecção hospitalar pela bactéria do gênero
Klebsiella em uma Unidade de Terapia Intensiva. Rev Soc Bras Clin Med, v. 13, n. 2, p. 119
- 123, 2015.
TAMURA, N. K.; NEGRI, M. F. N.; BONASSOLI, L. A.; SVIDZINSKI, T. I. E. Fatores de virulência de Candida spp. isoladas de cateteres venosos e mãos de servidores hospitalares. Revista da Sociedade Brasileira de Medicina Tropical, v. 40, n. 1, p. 91-93, 2007.
ALANGADEN, G. J. Nosocomial fungal infections: epidemiology, infection control, and prevention. Infectious Disease Clinics of North America, v. 25, p. 201-225, 2011.
PEMÁN, J.; ZARAGOZA, R.; SALAVERT, M. Control y prevención de las infecciones nosocomiales y asociadas a cuidados sanitarios causadas por especies de Candida y otras levaduras. Rev Esp Quimioter, v. 26, n. 4, p. 298-311, 2013.
RUIZ, L. S.; PEREIRA, V. B. R. Importância dos fungos no ambiente hospitalar. Bol Inst Adolfo Lutz, v. 26, n. 2, p. 2-4, 2016.
MARTINS-DINIZ, J. N.; SILVA, R. A. M.; MIRANDA, E. T.; MENDES-GIANNINI, M. J. S. Monitoramento de fungos anemófilos e de leveduras em unidade hospitalar. Rev Saúde Pública, v. 39, n. 3, p. 398-405, 2005.
PEREIRA, J. G.; ZAN, R. A.; JARDIN, C. F.; MENEGUETTI, D. U. O. Análise de fungos anemófilos em hospital da cidade de Ariquemes, Rondônia, Amazônia Ocidental, Brasil. Revista de Epidemiologia e Controle de Infecção, v. 4, n. 1, p. 18-22, 2014.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 19708-19722 oct. 2019 ISSN 2525-8761 MARTINS, O. A. Fungos anemófilos e leveduras isolados em ambientes de laboratórios de microbiologia em instituição de Ensino Superior. [Dissertação de Mestrado] - Universidade Federal de Pelotas. Faculdade de Veterinária. Pelotas - RS, 2016.
NAKAMURA, H. M.; CALDEIRA, S. M.; AVILA, M. A. G. Incidência de infecções fúngicas em pacientes cirúrgicos: uma abordagem retrospectiva. Rev. SOBECC, v. 18, n. 3, p. 49–58, 2013.
RÊGO, C. M.; SANTOS, F. S. Ocorrência de fungos anemófilos e sua relação com fatores abióticos em Barreiras, Bahia. Revista Brasileira de Biociências, v. 13, n. 4, p. 265-271, 2015.
FLORES, L. H.; ONOFRE, S. B. Determinação da presença de fungos anemófilos e Leveduras em unidade de saúde da cidade de Francisco Beltrão – PR. SaBios: Rev. Saúde e Biologia, v.5, n.2, p.22-26, 2010.
SOBRAL, L. V. Fungos anemófilos em ambientes climatizados: prevalência, produção de enzimas e atividade antibacteriana. [Dissertação de Mestrado] - Universidade Federal de Pernambuco. Vitória de Santo Antão – PE, 2016. 64 f.
BOFF, C. Monitoramento de fungos no ar de unidades de terapia intensiva. [Dissertação de mestrado] - Universidade Federal do Rio Grande do Sul. Porto Alegre - RS, 2011. 61 f.
BRASIL, Ministério da Saúde. ANVISA - Agência Nacional de Vigilância Sanitária. Resolução RE nº 09 de 16 de janeiro de 2003. Determina a publicação de Orientação Técnica elaborada por Grupo Técnico Assessor, sobre Padrões Referenciais de Qualidade do Ar Interior, em ambientes climatizados artificialmente de uso público e coletivo. Diário Oficial da União; Poder Executivo, de 20 de janeiro de 2003.
RIDDELL, R. W. Permanent Stained Mycological Preparations Obtained by Slide Culture. Mycologia, v. 42, p. 265–270, 1950.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 19708-19722 oct. 2019 ISSN 2525-8761 ALBERTI, C.; BOUAKLINE, A.; RIBAUD, P.; LACROIX, C.; ROUSSELOT, P.; LEBLANC, T.; DEROUIN, F. Retlationship between environmental fungal contamination and the incidence of invasive aspergillosis in haematology patients. J Hosp Infect, v. 48, n. 3, p. 198-206, 2001.
SALES, E.; SALES, E. M. L.; DIAS, L. F.; COSTAS, F. E. C.; LOYOLA, A. B. A. Micota no ar da unidade de terapia intensiva e centro cirúrgico de um hospital universitário. Bioikos, Campinas, v. 25, n. 2, p. 109–115, 2011.
VENCESLAU, E. M.; MARTINS, R. P. P.; OLIVEIRA, I. D. Frequência de fungos anemófilos em áreas críticas de unidade hospitalar de Aracaju, Sergipe, Brasil. RBAC, v. 44, n. 1, p. 26–30, 2012.
MEZZARI, A. Fungos anemófilos em Porto Alegre, RS. [Tese de Doutorado] - Universidade Federal do Rio Grande do Sul. Porto Alegre - RS, 2002. 75 f.
MENEZES, E. A.; ALCANFOR, A. C.; CUNHA, F. A. Fungos anemófilos na sala de periódicos da biblioteca de ciências da saúde da Universidade Federal do Ceará. Revista Brasileira de Análises Clínicas, v. 38, n. 3, p. 155-158, 2006.
LOBATO, R. C. Sazonalidade e prevalência de fungos anemófilos em ambiente hospitalar no sul do Rio Grande do Sul, Brasil. Rev. Fac. Ciênc. Méd., Sorocaba, v. 11, n. 2, p. 21-28, 2009.
MEZZARI, A.; PERIN, C.; SANTOS JÚNIOR, S. A.; BREND, L. A. G.; DI GESU, G. Fungos anemófilos e sensibilização em indivíduos atópicos em Porto Alegre, RS. Rev. Assoc. Med. Bras., v. 49, n. 3, p. 270-273, 2003.
SOUZA, A. K. P. Microbiota fúngica do ambiente da UTI neonatal e de amostras clínicas dos recém-nascidos internados no Hospital Universitário de Maceió, Al. [Dissertação de Mestrado] - Universidade Federal de Alagoas. Maceió - AL, 2009. 128 f.
LORENTE, C; BÁRCENA, A.; BAHIMA, V. J.; SAPARRAT, M. C.; ARRAMBARRI, A. M.; ROZAS, M. F.; MIRÍFICO, M. V.; BALATTI, P. A. Cladosporium cladosporioides
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 19708-19722 oct. 2019 ISSN 2525-8761 LPSC 1088 produces the 1,8- Dihydroxynaphthalene-Melanin-Like Compound and Carries a Putative pks Gene. Mycopathologia, v. 174, p. 397-408, 2012.
OGOREK, R.; LEJMAN, A.; PLASKOWSKA, E.; BARTNICKI, M. Fungi in the mountain trails of the snieznik massif. Mikologia Lekarska, v. 19, n. 2, p. 57-62, 2012.
SILVA, E. C. Ação de Cladosporium cladosporioides (Fresen.) G.A de Vries isolado de ambientes climatizados sobre as vias respiratórias de camundongos. [Dissertação de mestrado] - Universidade Federal de Alagoas. Maceió - Al, 2015.
HOOG, G. S.; GUARRO, J.; GENÉ, J. FIGUERAS, M. J. Atlas of Clinical Fungi.CBS: Spain, 1126p. 2000.
MENEZES, C. P. Atividade antifúngica in vitro do óleo essencial de Melissa officinalis L. (erva-cidreira) sobre Cladosporium carrionii. [Dissertação de mestrado] – Centro de ciências da saúde, Universidade Federal da Paraíba, João Pessoa/PB. 2012
SOUZA, L. I. O. Desenvolvimento de PCR multiplex para detectar e identificar espécies de
Aspergillus e Penicillium. [Dissertação de mestrado] - Universidade Federal de Alagoas.
Maceió - AL, 2013.
JOHANNESSEN, L. N.; NILSEN, A. M.; LOVIK, M. Mycotozin-induced depletion of intracellular glutathione and altered cytokine production in the human alveolar epithelial cell line. Toxicology letters, v, 168, p. 103-112, 2007.
MOBIN, M.; SALMITO, M. D. A. Microbiota fúngica dos condicionadores de ar nas unidades de terapia intensiva de Teresina, PI. Revista da Sociedade Brasileira de Medicina Tropical, v. 39, n. 6, p. 556–559, 2006.
SILVA, L. B.; POZZER, B. S.; ECKER, C. C.; XAVIER, M. O. Monitoramento da microbiota fúngica anemófila em unidade de terapia intensiva. Rev. Saúde e biologia, v. 11, n. 3, p. 27–34, 2017.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 19708-19722 oct. 2019 ISSN 2525-8761 CARVALHO, L. I C. Aspergillus e Aspergilose - desafios no combate da doença. [Dissertação de Mestrado] - Universidade Fernando Pessoa. Porto - Portugal, 2013.
PETIT, P.; LUCAS, E. M. F.; ABREU, L. M.; PFENNING, L. H.; TAKAHASHI, J. A. Novel antimicrobial secondary metabolites from a Penicillium sp. isolated from Brazilin a cerrado soil. Electronic Journal of Biotechnology, v. 12, p. 1-9, 2009.
NORITOMI, D. T.; BUB, G. L.; IDAL, C.; SILVA, A. S. F.; CLEVA, R.; GAMA-RODRIGUES, J. J. Multiple brain abscesses due to Penicillium spp infection. Revista do Instituto de Medicina Tropical. v. 47, p. 167-70, 2005.
FRISVAD, J.C.; SMEDSGAARD, J.; LARSEN, T. O.; SAMSON, R. A. Mycotoxins, drugs and other extrolites produced by species in Penicillium subgenus Penicillium. Studies in Mycology. v. 49; p. 201-41, 2004.