Ciências da Saúde
Anusca Joana de Lima Paixão Lopes
Dissertação para obtenção do Grau de Mestre em
Medicina
(ciclo de estudos integrado)
Orientador: Professor Doutor Miguel Castelo Branco Craveiro de Sousa
Covilhã, Maio de 2014
O papel da quimioterapia intraperitoneal
hipertérmica no tratamento da carcinomatose
ii
Dedicatória
Aos meus irmãos, Rúben e Rute. Meus companheiros de viagem, meus primeiros e grandes amigos, minha força e inspiração…
iii
Agradecimentos
Primeiramente, um profundo e sentido agradecimento ao meu orientador Professor Doutor Miguel Castelo Branco, não apenas pela sua paciência, dedicação e ajuda na elaboração desta dissertação, mas também, e de uma forma muito especial, pelo que ele representa na nossa faculdade. Pela amabilidade e devoção com que sempre se mostra disponível para resolver todas as questões e pela inestimável compreensão e orientação com que encaminha todos os alunos que passam por esta nossa casa. Sem ele todos os nossos percursos académicos seriam sem dúvida mais tortuosos e duros.
Aos meus pais agradeço o que palavras somente nem são capazes de agradecer. Ainda que agradecesse todos os dias não mostraria a gratidão que sinto. Pelo apoio incondicional para seguir os meus sonhos, pelo ombro sempre disponível em todos os momentos de desilusão, pelo esforço de sempre nos darem, a mim e aos meus irmãos, tudo o que precisamos, mesmo em tempos difíceis, pelo carinho, pela força, pelo orgulho… o meu mais profundo agradecimento! Sei que não foi fácil para mim este percurso, mas acima de tudo sei, que sem vocês e a vossa ajuda, não seria possível.
Aos meus irmãos pela capacidade de aturarem o meu inaturável feitio sempre com brincadeiras e palavras de conforto, ditas entre conversas de risos e lagrimas sempre misturadas com muita saudade. Obrigada, por nunca me deixarem sozinha, nunca permitindo que a distancia corrompesse a nossa cumplicidade. Agradeço-vos, porque embora não saibam, foi às vossas palavras de orgulho, que nos momentos em que me senti pequena e sem força fui buscar o alento e o vigor. Muito obrigada!
Um muito obrigada também aos meus avós, pelo carinho e orgulho sempre demonstrado e pelos ensinamentos dados com o amor e com a sabedoria de quem orienta com experiência, de forma branda e delicada, para a vida.
Ao meu Ricardo, pela paciência que sempre teve, especialmente nesta fase final em que o tempo teimava em não esticar. E principalmente pelo seu amor, por ser a razão de eu sorrir depois de um dia de cansaço, e por sempre, com as suas palavras de carinho, me fazer acreditar em mim.
Uma palavra de agradecimento à Faculdade de Ciências da Saúde e a todos os que nela trabalham, tornando possível que pequenos alunos saídos do secundário se tornem profissionais de excelência e de nobre caráter.
Por fim, mas não com menor importância, agradeço a todos os meus amigos e colegas, que fizeram deste percurso, desta cidade longínqua e inesperada, não só um sítio para onde vim estudar, mas uma verdadeira casa, uma verdadeira “família”, da qual terei a mais eterna saudade.
iv
Resumo
A disseminação de um tumor abdominal ou pélvico unicamente para a cavidade peritoneal pode ocorrer quer na fase da apresentação primária do tumor quer na sua recorrência e é denominada de Carcinomatose Peritoneal (CP). Esta condição, apesar de não representar uma disseminação sistémica da doença, está associada a um prognóstico e sobrevida sombrios, sendo que sem tratamento condiciona uma sobrevida média de cerca de seis meses.
O tratamento oferecido para a CP sempre foi a quimioterapia sistémica (QS), que poucos benefícios apresenta, no que diz respeito à sobrevida, quando comparada com a ausência de tratamento. Outra terapêutica realizada comummente é a cirurgia paliativa, especialmente quando o doente apresenta obstrução intestinal, de modo a minorar as complicações decorrentes da invasão tumoral.
Hoje em dia com os novos quimioterápicos existentes e introduzidos no tratamento desta condição médica os resultados são ligeiramente melhores do que os relatados no passado, no entanto a resposta obtida com esta abordagem continua a não ser satisfatória, o que tem levado a uma crescente investigação de tratamentos inovadores e mais agressivos.
Desse modo surgiu a Quimioterapia Intraperitoneal Hipertérmica (HIPEC) que através da sua associação com a Cirurgia de Citorredução (CRS) representa um grande avanço no prognóstico e sobrevida dos doentes acometidos por tumores abdomino-pelvicos que evoluíram com o aparecimento de CP.
Com a administração de HIPEC são conseguidas concentrações muito superiores de quimioterápico na superfície peritoneal do que quando o tratamento é administrado de forma sistémica. Esta, administrada diretamente na cavidade peritoneal, visa a destruição de toda a doença microscópica existente.
A eliminação prévia de toda a doença macroscópica, não pode, no entanto, ser descurada, para que o fármaco possa penetrar de forma adequada nas células neoplásicas remanescentes e eliminar totalmente a doença. De facto a resseção completa dos implantes peritoneais através da CRS constitui o principal fator prognóstico destes doentes.
O elevado ceticismo quanto aos benefícios da aplicação destas técnicas desde cedo se prendeu com a alta morbilidade obtida em estudos efetuados no início da aplicação do tratamento. Por essa razão este é um dos principais objetos de estudo dos mais variados centros. No entanto os resultados continuam a não ser totalmente esclarecedores, devido à falta de uniformização de critérios. São originados pelos diversos estudos resultados muito díspares. Sendo, apesar disso, seguro afirmar que as taxas de morbi-mortalidade são ultimamente menos preponderantes do que as obtidas inicialmente.
v
A principal vantagem destas técnicas diz respeito ao aumento da sobrevida em relação à abordagem clássica. Apesar de o benefício variar consoante a histologia do tumor e com diversos parâmetros respeitantes à sua evolução, é claro o quanto a sobrevida dos doentes beneficia com este tratamento.
Materiais e Métodos
Para a realização desta dissertação realizei o levantamento bibliográfico em bases de dados nacionais e internacionais, nomeadamente em bases de dados online como a Pubmed e a B-on. A escolha dos artigos foi feita tendo em conta a sua pertinência, validade e atualidade.
Palavras-chave
Quimioterapia Intraperitoneal Hipertérmica; Carcinomatose Peritoneal; Cirurgia de Citorredução; Quimioterapia Sistémica.
vi
Abstract
The dissemination of an abdominal or pelvic tumor only to the peritoneal cavity can occur either at the time of presentation or in its recurrence, that is called Peritoneal Carcinomatosis (CP). This condition, even though it doesn’t represent a systemic dissemination of the disease, is associated with a shadowed prognostic and survival, moreover without treatment it conditions a median survival of about six months
Historically, and even today in many centers, the treatment offered for CP was systemic chemotherapy (QS), that presented few benefits concerning the overall survival. Another therapy commonly used was palliative surgery, especially when the patient presented bowel obstruction. Nowadays with the emergence of new chemotherapeutics the results are slightly better, however the response obtained with this treatment is still not satisfying leading to growing numbers of investigations about innovating and more aggressive treatments.
This was the path that lead to the arising of the Hyperthermic Intraperitoneal Chemotherapy (HIPEC) that when associated with the Cytoreductive Surgery (CRS) represents a major improvement in the outcome and survival of the patients affected by abdomino-pelvic tumors that evolved with the appearance of CP.
With the administration of HIPEC, higher concentrations of chemotherapeutic agent can be achieved in the peritoneal surface when compared with the ones obtained when the same agent is given systemically. The HIPEC aim is the destruction of all the microscopic disease. The previous elimination of all the macroscopic disease cannot, however, be neglected, so that the medicine can properly penetrate in the reminiscent neoplastic cells to completely eliminate the disease. In fact the completeness of resection is the main prognostic factor to determine the progression of the disease.
There has always been a high skepticism concerning the benefits of this techniques and this is mainly related with the high morbidity obtained in studies made early on. Therefor morbidity is one of the main parameters studied by various centers. Regardless the results are still confusing, due to the lack of criteria standardization. The studies tend to generate very disparate results. Even though, it is safe to allege that the morbi-mortality rates obtained in more recent studies are less preponderant than the ones initially reported.
The main advantage of this techniques concerns the increase of the survival rates when compared with the classical approach. Notwithstanding the variation with the different tumor histology’s and the various parameters related with its evolution, it is clear how much the patient’s survival really benefits with this treatment.
vii
Materials and Methods
In order to accomplish this thesis I’ve made a bibliographic research in national and international databases, namely online databases like Pubmed and B-on. The choice of articles was made taking into account its relevance, validity and topicality.
Keywords
Hyperthermic Intraperitoneal Chemotherapy; Peritoneal Carcinomatosis; Cytoreductive Surgery; Systemic Chemotherapy.
viii
Lista de Abreviaturas
HIPEC: Quimioterapia intraperitoneal hipertérmica. CRS: Cirurgia de citorredução.
QS: Quimioterapia sistémica.
PCI: Índice de carcinomatose peritoneal. QoL: Qualidade de vida.
HRQoL: Qualidade de vida relativa à saúde. MMC: Mitomicina-C.
ix
Lista de Figuras
Fig. 1 – Índice de Carcinomatose Peritoneal (PCI) de Sugarbaker.(16) Fig. 2 – Barreira peritoneo-plasmática. (18)
x
Índice
1. Introdução ... 1
2. Patofisiologia da Carcinomatose Peritoneal ... 2
3. Quimioterapia Intraperitoneal Hipertérmica e a sua importante associação com a Cirurgia de Citorredução ... 5
3.1 Técnicas ... 7
3.1.1. Cirurgia de Citorredução ... 7
3.1.2. Técnicas para administração de HIPEC ... 8
3.1.3. Agentes quimioterápicos ... 10
4. Indicações terapêuticas e critérios de seleção ... 11
5. Indicadores de prognóstico ... 12
6. Morbilidade e mortalidade ... 13
7. Sobrevida e qualidade de vida pós CRS + HIPEC ... 15
8. HIPEC versus QS ... 18
9. Conclusão ... 19
10. Bibliografia ... 20
1
1. Introdução
A carcinomatose peritoneal (CP) sempre foi considerada como uma doença virtualmente incurável e com uma esperança média de vida bastante reduzida, de cerca de seis meses, após o diagnóstico. (1)
Historicamente, e ainda hoje em muitos centros, o tratamento realizado pela maioria dos oncologistas é unicamente paliativo, sendo esta tida como uma doença terminal. (2) Mesmo com os avanços realizados e a descoberta e introdução de novos esquemas quimioterápicos, a sobrevida após diagnostico continua a ser muito limitada. De facto, a CP, constitui a principal causa de morte em pacientes que realizaram resseção do tumor primário. (3)
Como doença regional, a CP deveria ter um tratamento regional, ou seja a remoção cirúrgica de todos os implantes peritoneais seguida da aplicação de agentes quimioterápicos diretamente na superfície peritoneal. Esta hipótese foi colocada há cerca de trinta anos e evoluiu como o que é hoje conhecido como Quimioterapia Intraperitoneal Hipertérmica (HIPEC) que é precedida de Cirurgia de Citorredução (CRS) e tem sido estudada exaustivamente por diversos centros, ganhando cada vez um papel mais proeminente no tratamento da CP.
Não obstante, esta nova abordagem terapêutica ainda é alvo de grande crítica, principalmente devido às altas taxas de morbilidade obtidas no início da sua aplicação, em estudos randomizados (1) e que têm vindo a decrescer à medida que se vai criando um maior consenso quanto à escolha das diferentes técnicas e à seleção de doentes que realmente podem beneficiar do tratamento em questão. (4)
Quando em centros especializados e treinados, com os recursos necessários e uma seleção de doentes otimizada poderá esta abordagem ser uma promessa de cura para doentes historicamente condenados a uma sobrevida de escassos meses?
2
2. Patofisiologia da Carcinomatose
Peritoneal.
A Carcinomatose Peritoneal ocorre como consequência da disseminação peritoneal de um tumor primário. Macroscopicamente consiste no aparecimento de nódulos tumorais nas superfícies peritoneais (5) e pode ser vista como uma fase intermédia entre o tumor localizado e o estadio disseminado da doença maligna. Na evolução natural da doença maligna, após o aparecimento do tumor e com a sua proliferação, as suas células neoplásicas disseminam-se para o interior da cavidade peritoneal, constituindo implantes peritoneais. Se nesta fase não ocorrer intervenção, a doença evoluirá para disseminação hematogénica ou linfática com aparecimento de implantes tumorais noutras localização e invasão de órgãos à distância, ocorrendo disseminação da doença. Essa é a razão pela qual a Carcinomatose Peritoneal é vista como um ponto intermédio entre a fase em que a doença se encontra ainda localizada e a sua total disseminação pelo organismo. (6)
Diversas são as vezes em que a CP não é o único local de doença metastática, pois a disseminação começa por ser regional, unicamente para a cavidade peritoneal por via transcelómica, mas posteriormente ocorre disseminação pelas vias hematogénica e linfática acometendo concomitantemente o peritoneu com outros locais à distância. No entanto, 25 a 35% dos doentes apresentam CP isoladamente sem o acometimento de outros órgãos por metástases. (7; 8) Quando isto ocorre considera-se que a doença neoplásica sofreu disseminação regional e não sistémica. (8)
Apesar de ser uma doença regional este é um diagnóstico de gravidade e implica a evolução da doença maligna localizada, estando, deste modo, associado a uma baixa qualidade de vida e a uma sobrevida igualmente baixa, de em média 6 meses, (1; 9; 10) assim como a complicações muito debilitantes, como oclusão intestinal, ascite maligna, dispneia e dor intensa. (11; 12) A ascite maligna é uma complicação frequente de carcinomas abdominais e é definida como acumulação anormal de líquido na cavidade abdominal que ocorre devido à diminuição da reabsorção linfática e ao aumento da sua produção por alteração da permeabilidade capilar provocada pela doença metastática. O tumor que mais comummente causa este tipo de ascite é o tumor do ovário, mas esta também pode ser causada por tumores de outras origens como o do estômago, do pâncreas, do cólon, do apêndice e do útero. (13)
O peritoneu também pode ser acometido por doenças neoplásicas primárias, como é o caso do mesotelioma peritoneal e o carcinoma papilar seroso, porém este tipo de doenças são raras. Em contraste, a disseminação peritoneal de doenças malignas do aparelho digestivo é muito comum. (2)
3
A CP ocorre em cerca de 10% dos doentes com cancro coloretal na altura do diagnóstico (14; 15), mas é ainda mais comum na recorrência tumoral, sendo que nessa fase 25% a 50% dos doentes se apresentam com esta patologia. (16; 17)
O diagnóstico de Carcinomatose Peritoneal tem grande relevância em termos de prognóstico, sendo considerada a principal causa de morte em doentes que se submeteram a ressecção de carcinomas abdominais primários (3) e a segunda causa de morte dos doentes com carcinoma coloretal, logo a seguir à doença metastática do fígado. (7)
A patofisiologia da CP é multifatorial e tanto pode resultar da evolução natural da doença como de fenómenos iatrogénicos, como é a manipulação tumoral aquando da ressecção do tumor primário ou até decorrente de um traumatismo abdominal. Esta consiste em dois passos essenciais 1) disseminação peritoneal de células cancerígenas livres, exfoliadas como consequência da invasão direta pelo tumor primário; 2) implantação peritoneal dessas mesmas células através de moléculas de adesão. (16) Após a implantação peritoneal das células neoplásicas ocorre um processo inflamatório, com recrutamento de fibroblastos e com produção de um exsudado fibrinoso. A fibrina organizada e os vasos neoformados constituem o estroma que sustenta e nutre o implante neoplásico em proliferação. (18)
O mecanismo pelo qual ocorre esta disseminação transparietal, desde o órgão de origem, e através do peritoneu visceral para a cavidade peritoneal, é denominado por – redistribuição neoplásica – e é um processo não aleatório, pois é condicionado por fatores físicos. Estes dependem do tumor primário, do efeito da gravidade, da peristaltase dos órgãos digestivos, da presença ou ausência de ascite maligna, e em menor grau da agressividade do tumor. (16) A ação dos fatores acima descritos vai provocar a concentração de células malignas em locais específicos. De acordo com os locais de principal reabsorção de líquido ascítico, que são o grande e pequeno epiplon e a superfície inferior do peritoneu diafragmático, principalmente do lado direito, assim será a localização dos implantes peritoneais caso exista líquido ascítico. Os locais mais frequentemente acometidos na situação acima descrita são a região pélvica, os espaços subfrénicos, as goteiras parietocólicas e o recesso hepatorrenal. Quando, pelo contrário, não se verifica o aparecimento de ascite maligna, existe uma maior restrição de movimentação das células malignas livres no peritoneu; desta forma as células neoplásicas acabam por se implantar em regiões próximas do tumor primário. Nestas situações, locais mais distantes como o ligamento de Treitz e o pequeno epiplon raramente são acometidos. (16)
Outros locais frequentemente poupados, especialmente nas fases iniciais da doença, são as superfícies mesentéricas e a superfície serosa do intestino delgado. Este fato deve-se à existência de movimentos peristálticos ativos que dificultam a implantação de células malignas. Deste modo, locais como o duodeno e as junções ileocecais e retosigmoideias, que são relativamente fixas, são mais comumente atingidas. (16)
4
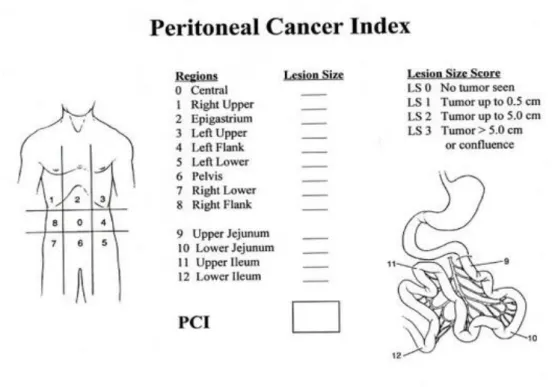
Na tentativa de avaliar o acometimento peritoneal de modo a facilitar a decisão cirúrgica, Sugarbaker descreveu o índice de carcinomatose peritoneal (PCI) que é também relevante como indicador de prognóstico da doença. O abdómen é dividido em nove quadrantes, como se pode observar na figura 1, e o intestino delgado em quatro segmentos: o jejuno proximal e distal e o íleo proximal e distal. O tamanho das lesões também é quantificado através do LS (LS- lesion score) em cada quadrante. Um LS-0 corresponde a ausência de neoplasia no quadrante; LS-1 presença de nódulos neoplásicos inferiores a 0,5cm; LS-2 nódulos neoplásicos no quadrante com tamanho compreendido entre 0,5 a 5 cm e LS-3 correspondente a nódulos neoplásico de tamanho superior a 5cm. A soma dos diferentes scores dos quadrantes representa o PCI. Este pode variar de zero a trinta e nove. (Ver figura representativa do PCI de Sugarbaker abaixo – fig1) (18)
5
3. Quimioterapia intraperitoneal
hipertérmica e a sua importante
associação com a cirurgia de
citorredução.
Historicamente o papel da cirurgia nos doentes com CP era apenas paliativo, em situações de obstrução intestinal, contornando o problema através da realização de bypass intestinal ou de ostomias, derivando o trânsito intestinal de modo a permitir a eliminação das fezes. A primeira cirurgia de citorredução (CRS) com intuito curativo, realizado no decorrer do tratamento desta patologia, foi relatada em 1930, e tinha como objetivo remover todos os depósitos tumorais visíveis na cavidade peritoneal de uma doente com carcinoma do ovário. (1;6; 16)
No entanto, os pacientes em que eram realizadas estas cirurgias sem outro tipo de terapêutica, sofriam recidivas rapidamente e esta foi considerada ineficaz como tratamento da CP. Estudos mostram que estes doentes apresentavam uma sobrevida após cirurgia semelhante à sobrevida sem tratamento. Doentes com CP de origem gástrica, intestinal, pancreática e coloretal, apresentaram com este tratamento uma sobrevida média de 1.0, 1.0, 0.7 e 6.0 meses respetivamente, o que pouca ou nenhuma melhoria representava. (3)
Nas últimas duas décadas muito se tem aprofundado sobre esta doença e tratamentos multidisciplinares têm evoluído na tentativa de curar o doente que padece desta patologia. Este é o caso da Quimioterapia Intraperitoneal Hipertérmica (HIPEC) descrita mais pormenorizadamente à frente, e que combinada com a CRS tem sido o alvo de análise e de prática por parte de diversos centros especializados no tratamento da CP. (5)
O uso da CRS+HIPEC no tratamento da CP expandiu-se e baseou-se na ideia de que como doença local/regional que é, um tratamento local/regional seria mais eficaz do que um tratamento sistémico.
Com a HIPEC existe um benéfico aumento das concentrações de citotóxico e são alcançadas altas concentrações intraperitoneais. Estas ao serem aplicadas diretamente nas células tumorais, encontradas na superfície peritoneal, em maiores concentrações, diminuem de forma relevante os efeitos tóxicos sistémicos associados ao uso dos citotóxicos por via intravenosa. (3; 6; 16)
Sabe-se que entre o peritoneu e o plasma existe uma barreira muito semelhante à barreira hematoencefálica. Esta é denominada de barreira peritoneo-plasmática (fig. 2) e permite que concentrações vinte vezes superiores às conseguidas com a administração sistémica sejam verificadas com a administração intraperitoneal.
Devido à existência desta barreira fármacos de alto peso molecular que são administrados intraperitonealmente são depurados muito mais lentamente do peritoneu, do que quando os mesmos fármacos são administrados de modo intravenoso. Quando a via de administração dos fármacos é intraperitoneal estes são rapidamente detetados na circulação sistémica, enquanto que quando são administrados sistemicamente, os mesmos fármacos, passam de
6
forma lenta para a cavidade peritoneal. Tal denota propriedades de transporte unidirecional por parte da barreira peritoneo-plasmática.
Além disso, a administração sistémica condiciona uma distribuição generalizada dos fármacos pelos diferentes tecidos, especialmente os altamente vascularizados. Consequentemente a concentração plasmática dos fármacos diminui rapidamente, diminuindo também o gradiente com que estes atravessam a barreira o que irá condicionar menores concentrações de fármaco na cavidade peritoneal. (7; 16; 18)
Fig.2 Barreira peritoneo-plasmática. (18)
Também a hipertermia possui efeitos citotóxicos diretos, permitindo o alcance de uma maior penetração dos quimioterápicos no tumor e agindo sinergicamente com os agentes citotóxicos utilizados. Através do aumento da temperatura é conseguida uma alteração da permeabilidade na membrana celular das células cancerígenas que irá permitir uma maior penetração e concentração no interior das células tumorais, tornando-as mais quimiosensiveis. Sem a utilização da hipertermia a penetração tecidual de quimioterápicos varia entre 1 a 3 mm, enquanto que, com esta, a penetração tecidual pode alcançar até 6mm de profundidade. (16)
A importância da associação destas duas técnicas baseia-se na complementaridade das suas ações. A cirurgia é feita inicialmente de modo a remover os implantes peritoneais malignos macroscópicos, e seguidamente, no mesmo tempo cirúrgico, é administrada a HIPEC para remover a doença microscópica remanescente, removendo assim totalmente a doença num único procedimento. (1; 2; 6; 7; 16)
A realização concomitante das duas técnicas é de extrema importância, evitando, deste modo, possíveis aderências abdominais decorrentes da cirurgia que numa fase posterior dificultariam a disseminação abdominal generalizada do quimioterápico a administrar, e prevenindo o crescimento e proliferação de novas células malignas após o manuseamento cirúrgico, uma vez que este é um conhecido estimulo para o crescimento e disseminação de células tumorais. (7)
7
3.1. Técnicas
3.1.1.
Cirurgia de citorredução
A cirurgia citorredução tem como propósito remover completamente qualquer doença macroscópica. Para isso pode requerer uma combinação de diferentes procedimentos cirúrgicos como: peritonectomia visceral e parietal, omentectomia parcial ou total, esplenectomia, colecistectomia, ablação de depósitos tumorais da cápsula hepática, ressecção intestinal, colónica ou retal, gastrectomia parcial, histerectomia, ooforectomia uni ou bilateral, cistectomia, ou ressecção uretral. (5)
Geralmente, aquando da laparotomia na linha média abdominal, da apófise xifoide ao púbis, é realizada a inspeção da cavidade abdominal que permite determinar a possibilidade de efetuar uma citorredução completa, avaliando a extensão da doença peritoneal e calculando o PCI. (1; 6; 7; 16)
A citorredução com peritonectomia normalmente segue os passos seguintes, embora não de forma rígida: i) laparotomia pela linda média; ii) omentectomia total com esplenectomia em bloco (se necessário); iii) percorrer o intestino delgado desde o ligamento de Treitz à válvula ileocecal removendo todos os implantes tumorais do mesentério e da superfície intestinal, se possível; iv) percorrer todo o colon desde o cego até ao reto, eliminando todos os implantes tumorais no mesentério; v) colectomia direita e peritonectomia parietal direita (se acometidos); vi) peritonectomia pélvica e histerectomia com salpingo-ooforectomia bilateral (se acometidos ou rotineiramente se cancro primário do ovário); vii) colectomia esquerda ou sigmoidectomia com peritonectomia parietal esquerda (se acometidos); viii) ressecção gástrica (se acometido); ix) peritonectomia subdiafragmática direita e esquerda com ressecção da cápsula de Glisson e colecistectomia (se acometidos); x) ressecção de doença à esquerda da veia cava retro-hepática. A combinação destes diferentes procedimentos visa eliminar toda a doença macroscópica de modo a permitir a atuação posterior da HIPEC. (4; 16)
Quando existe um atingimento do saco de Douglas, o que acontece na maioria dos casos, e este se encontra repleto de nódulos tumorais que podem afetar ainda parte do sigmoide pode ser necessário efetuar uma peritonectomia pélvica total com ressecção anterior baixa, de forma a remover completamente estes tumores. (4)
Caso exista impossibilidade de ressecção de nódulos tumorais devido à sua localização ou características, a sua espessura deve ser reduzida, de modo a que nenhum implante metastático tenha uma espessura superior a 2,5 mm, por forma a garantir um melhor efeito terapêutico subsequente com a HIPEC. (6; 8; 16) Quando os tumores são pequenos mas se encontram invadindo estruturas vitais que não podem ser ressecadas, muitos dos centros utilizam a citorredução por aspirador cirúrgico ultrassónico cavitacional (CUSA). (3)
Após os procedimentos cirúrgicos necessários é estimado um score de efetividade de citorredução (CCR). Este é classificado como CCR-0: sem nódulos tumorais peritoneais residuais; CCR-1: nódulos tumorais residuais <2.5 mm; CCR-2: nódulos tumorais residuais de tamanhos entre 2.5 mm e 2.5 cm; ou CCR-3: nódulos tumorais residuais> 2.5 cm ou confluência de nódulos tumorais irressecáveis em qualquer localização. (5; 14)
Existe uma discrepância de opiniões quando ao tempo exato de realização das anastomoses intestinais. Frequentemente as anastomoses são realizadas após HIPEC, de forma a facilitar a distribuição uniforme do fármaco profundido, prevenir o aprisionamento de células tumorais
8
na sutura, e ainda evitar a influência, que se acredita existir, do quimioterápico e do calor na manutenção e coesão da anastomose. (7; 8; 14)
3.1.2.
Técnicas para administração de HIPEC
Para a realização deste procedimento é necessário equipamento especializado. É utilizado um circuito fechado que permite a administração de HIPEC de forma continua. Este equipamento consiste de um reservatório com filtro, duas bombas, um permutador de calor, cateteres de silicone para entrada e saída do abdómen, um termostato, e tubos interconectados. (Como se pode ver no esquema representado na figura 3) (5; 16)
O equipamento possui um software que permite controlar e monitorizar a temperatura, a velocidade e volume da perfusão, e ainda as pressões de entrada, de saída e intraperitoneais. (16)
Como descrito anteriormente, a hipertermia possui efeitos citotóxicos, assim o objetivo é atingir uma temperatura intraperitoneal de 41 a 42ºC, pelo que a temperatura externa da solução a profundir deve alcançar os 43 a 44ºC. A velocidade de perfusão pode variar ente os 400 a 800 ml/min. (1; 4; 5; 16)
Existem diversas modalidades para a realização de HIPEC, esta pode ser feita segundo a técnica do abdómen aberto, também denominada de técnica em Coliseu, ou segundo a técnica de abdómen fechado. (5; 16)
Na técnica de abdómen fechado após a colocação dos cateteres a incisão abdominal realizada previamente para a CRS é encerrada com sutura contínua de modo a encerrar a cavidade abdominal. (1; 3) Nesta técnica são colocados usualmente quatro cateteres, posicionados da seguinte forma: dois subdiafragmáticos, um do lado direito e outro do esquerdo e outros dois na região pélvica, um mais profundo e outro superficialmente. Sendo que dois garantem a entrada da solução e outros dois a saída. A massagem abdominal é realizada durante a administração de HIPEC e visa uma melhor distribuição do quimioterápico. (4; 16)
Quando é realizada a técnica em Coliseu, descrita por Sugarbaker, P. H., os bordos da parede abdominal são suspensos usando um retrator com auto fixação, desta forma é criado um espaço aberto na cavidade abdominal onde a solução pode circular de forma mais homogénea. Posteriormente a incisão é coberta com uma “folha” de plástico que é suturado aos bordos da parede abdominal, tendo apenas uma abertura medial para permitir a monitorização e manipulação pelo especialista. Nesta técnica é colocado um cateter de entrada de fluido quimioterápico na região central do abdómen, usualmente um cateter de Tenckhoff, e três ou quatro drenos de saída nas bases hemi-diafragmáticas e na região pélvica. (7; 8) Durante o procedimento o doente é reposicionado e o seu abdómen agitado por forma a permitir uma melhor distribuição do quimioterápico. (3; 9)
A técnica em Coliseu tem como vantagens, não só uma melhor monitorização e manipulação abdominal, mas também uma distribuição mais homogénea do quimioterápico por toda a cavidade peritoneal. No entanto apresenta as desvantagens de uma grande exposição ao fármaco profundido e seus aerossóis e partículas, por parte dos profissionais de saúde participantes no procedimento e ainda uma maior dificuldade em atingir a temperatura intraperitoneal ideal. Já a técnica de abdómen fechado tem como vantagem o facto de conseguir pressões intraperitoneais mais elevadas e assim promover uma maior penetração do agente quimioterápico nos implantes tumorais peritoneais. (5; 16)
Embora nalguns estudos, a realização deste procedimento segundo a técnica aberta ou fachada não demonstre ter uma repercussão significativa na sobrevida, mortalidade e
9
morbilidade, noutros estudos foi demonstrado que a técnica com abdómen fechado restringe o volume de perfusão e diminui a difusão espacial do fármaco instilado resultando numa menor homogeneidade da ação do quimioterápico (2; 20) Devido a esta discrepância de opiniões, o consenso quanto à técnica ideal ainda não foi obtido.
No início da perfusão são instilados cerca de três litros de solução salina, pelo circuito fechado, retirando assim o ar do circuito, de seguida a circulação e o aquecimento da quimioterapia são iniciados. (1) O tempo de administração de HIPEC pode variar de 60 a 120 minutos. (1; 3)
Terminada a HIPEC, toda a solução é retirada da cavidade peritoneal e esta lavada com mais três litros de soro. A incisão é reaberta para inspeção da cavidade e de possíveis lesões que possam ter ocorrido com a administração de HIPEC, e ainda para a realização de anastomoses, que de acordo com a maioria dos estudos são realizadas nesta altura. (1; 7) Por fim é colocado um dreno de sucção e a incisão é encerrada. (1)
10
3.1.3.
Agentes Quimioterápicos
Uma grande variedade de quimioterápicos é usada na administração de HIPEC. Em 1980 Spratt descreveu o sistema de administração de HIPEC utilizando como quimioterápico o tiotepa. (21) Muitas têm sido as experiencias e variações a partir daí.
A mitomicina-C tem sido dos agentes mais amplamente utilizados para as mais variadas histologias neoplásicas. Variando apenas os diferentes centros na concentração e quantidades administradas. É um quimioterápico de uso comum no tratamento da carcinomatose peritoneal de origem coloretal e apendicular, mas também no adenocarcinoma gástrico e no carcinoma do ovário. (3; 5; 6; 8; 16)
Em estudos mais recentes observa-se uma tendência para o uso combinado de diferentes quimioterápicos. Em diferentes referências são encontradas as seguintes associações: cisplatina com mitomicina-c para o tratamento do pseudomixoma peritoneal e da carcinomatose peritoneal com origem no cancro coloretal e do estômago. E a associação de doxurrobicina com cisplatina para o tratamento da CP originada por carcinoma do ovário. (1; 12; 22; 23)
Um composto de platina de terceira geração – a oxaliplatina – tem tido uma utilização crescente como quimioterápico de uso sistémico no tratamento do cancro coloretal avançado. Devido aos bons resultados obtidos com este tipo de terapia existe a possibilidade de esta se tornar também utilizável como HIPEC. No entanto, em estudos já realizados verificou-se que a sua utilização provoca graves anormalidades hidroeletrolíticas potencialmente fatais se não tratadas a tempo, como hiponatrémia, hipoglicemia e acidose metabólica. Quando reconhecidas a tempo estas complicações podem ser tratadas facilmente. Num desses estudos quando comparada com a mitomicina-c, a oxaliplatina demonstrou ratios de re-intervenção, complicações e mortalidade a trinta dias comparáveis. A sua utilização ainda é controversa. (9; 24)
De ressalvar que apesar dos diversos estudos levados a cabo com diferentes fármacos e doses, ainda não foram estabelecidas doses nem protocolos standard. (16)
11
4. Indicações terapêuticas e critérios de
seleção.
A HIPEC está indicada para doentes com disseminação peritoneal de doença neoplásica primária doutro órgão ou para tumores primários do peritoneu. O tratamento com CRS e HIPEC não é indicado para doentes que apresentem disseminação sistémica da doença neoplásica. (2; 22)
Os doentes podem ser submetidos a este tratamento quer a CP acompanhe a apresentação primária do tumor quer esta represente uma recorrência após ressecção do tumor primário. No caso da primeira o tumor primário deve ser ressecado aquando da CRS. (7) Para a realização deste tratamento deve ainda ser verificado se o doente se encontra clinicamente estável para se submeter de modo seguro a procedimentos invasivos como é o caso da CRS e da HIPEC. (7; 8; 16) Os implantes peritoneais devem ainda ser passivos de serem total, ou quase totalmente ressecados. Doentes com metástases hépticas irressecáveis, envolvimento retroperitoneal maciço ou atingimento dos nódulos linfáticos não têm indicação para este tratamento. (16)
A maior parte dos estudos considera como critérios de elegibilidade para realização deste tratamento: ter um diagnóstico confirmado histologicamente de carcinomatose peritoneal ou sarcomatose, ter uma idade máxima de 70 anos (embora a idade não constitua uma indicação absoluta e cada caso deva ser avaliado individualmente), não apresentar metástases à distância nem evidências de doença neoplásica sistémica e ter uma função renal e hepática adequadas. (4; 8) Cada doente tem ainda de dar o seu consentimento informado e escrito para a realização dos procedimentos. (23)
As contraindicações à realização destes procedimentos devem ser tidas em conta, como é o caso da existência de doenças crónicas concomitantes, cardiorrespiratórias, neurológicas ou renais. São ainda contraindicação relativas: excesso de peso (IMC> 40), história de irradiação pélvica, CP muito extensa visualizada nos exames pré-operatórios, mais de quatro procedimentos cirúrgicos abdominais prévios e oclusão intestinal. (16)
Devido à natureza agressiva destes tumores e ao seu mau prognóstico, doentes com CP decorrente de tumores do pâncreas e das vias biliares não devem ser submetidos a HIPEC. O estudo mais aprofundado da HIPEC revelou efeitos colaterais favoráveis que podem ser aplicados com intuito paliativo. Disso é exemplo a sua ação sobre a ascite maligna. Os doentes que apresentam ascite maligna volumosa refrataria a tratamento convencional, e não são candidatos para tratamentos curativos, mas cuja ascite causa sintomas que condicionam severamente a sua qualidade de vida devido ao grande aumento da distensão abdominal, causando dor intensa, desconforto, anorexia, e dispneia; podem ser submetidos a HIPEC com Cisplatina e Doxorrubicina como tratamento paliativo. Num estudo realizado observou-se que 94% dos doentes com ascite maligna submetidos a este tratamento obtiveram desaparecimento definitivo da ascite (13)
12
5. Indicadores de prognóstico
Quando os doentes são criteriosamente selecionados a cura da CP é uma realidade possível. Diferentes variáveis nos doentes e no decorrer dos procedimentos vão condicionar esse prognóstico. Os fatores de prognóstico mais comummente apresentados são: a origem da CP, a extensão da CP avaliada através do PCI, a ressecção conseguida na CRS, e o envolvimento de nódulos linfáticos. (2) Desses, o fator prognóstico mais relevante é a citorredução completa. Doentes em que não é possível uma citorredução completa beneficiam muito pouco deste tipo de tratamento uma vez que os agentes citotóxicos administrados na HIPEC apenas penetram uma espessura limitada dos nódulos neoplásicos. Como tal ressecções tumorais superiores a CCR-1 beneficiam progressivamente menos com este procedimento. Para um melhor prognóstico após a CRS não devem existir implantes peritoneais com espessura superior a 2,5mm. (3; 8; 14; 16)
No que diz respeito ao tumor de origem da CP, uma localização primária no apêndice traduz-se num prognóstico favorável devido à sua baixa agressividade e à baixa incidência de disseminação hematogénea e linfática associadas a esta histologia tumoral. Pelo contrário, uma histologia compatível com adenocarcinoma e a localização primária no estomago estão associadas a um pior prognóstico. (3; 16)
Ao contrário do que acontece com o acometimento neoplásico da superfície hepática, a infiltração parenquimatosa do fígado por células cancerígenas está associada a uma forte probabilidade de disseminação hematogénea da doença, sendo por isso associada a um pior prognóstico. (3)
A extensão da CP avaliada pelo PCI também é um fator importante. Estudos confirmam que um PCI> 20 piora consideravelmente o prognóstico do doente. Num estudo específico realizado por Rodrigo Gomes da Silva e Paul Sugarbaker, verificou-se que em doentes com CP decorrente de cancro coloretal a sobrevida média de doentes com PCI <20 era de 41 meses passando a 16 meses para doentes que apresentavam um PCI> 20. No mesmo estudo foi demonstrado que o atingimento de nódulos linfáticos também representava um fator prognóstico negativo, estatisticamente significativo. (14)
Quando presente um tumor primário coloretal, uma histologia compatível com baixa diferenciação celular e a presença de células em anel de sinete são indicadores significativos de mau prognóstico, assim como uma localização primária no reto. (8)
Tendo em conta os fatores prognósticos, a seleção cuidadosa de doentes para este tratamento torna viável a opção de cura, pois doentes com baixo PCI, sem tingimento dos nódulos linfáticos e com ressecção completa de implantes peritoneais aquando da CRS têm uma sobrevida média a cinco anos de cerca de 50%. (14)
13
6. Morbilidade e Mortalidade
Nos últimos anos, devido à sublimação da técnica cirúrgica e a uma melhor seleção de doentes, as taxas de morbilidade e mortalidade têm vindo a decrescer. (5; 14) Inicialmente elevados números de complicações que levavam a uma taxa de morbilidade elevada, levantavam alguma controvérsia quanto à utilização destas técnicas e ainda hoje, após vários anos de evolução destes procedimentos, as taxas de morbilidade e mortalidade levantam algum criticismo quanto à segurança do tratamento (4; 16)
Existem muitos estudos realizados na tentativa de solucionar e aprofundar este problema, analisando a morbilidade e mortalidade de grandes amostragens submetidas a CRS e HIPEC. No entanto na análise dos diferentes estudos verifica-se uma falta de uniformidade de critérios que resulta numa grande variação em termos de resultados. Quando realizado um levantamento de estudos recentes quanto a estes parâmetros verifica-se uma taxa de mortalidade com variações de 0% a 9,3% e uma taxa de morbilidade de 12% a 54,6%. (ver anexo 1)
A morbilidade pode ser dividida em eventos relacionados com a cirurgia e eventos relacionados com a quimioterapia. As complicações cirúrgicas mais comuns são: a hemorragia, a obstrução intestinal pós-cirúrgica, a deiscência de anastomose, a infeção da incisão, a embolia pulmonar, e a trombose venosa profunda. Os parâmetros de morbilidade relacionados com a quimioterapia são a toxicidade medular, que resulta em leucopenia, anemia e trombocitopenia; a toxicidade renal e a hepática. (1; 12)
Devido ao interesse crescente na morbilidade e mortalidade destes procedimentos, alguns estudos recentes chegaram a conclusão que existem fatores preditivos independentes de morbilidade. O estado geral do doente, a dose de quimioterapia administrada, a duração e extensão da cirurgia, a ressecção visceral, o número de anastomoses do tubo digestivo realizadas, a extensão da carcinomatose peritoneal inicial e a citorredução incompleta são fatores independentes correlacionados com elevadas taxas de morbilidade. (16; 25)
A infeção intra-abdominal devido à deiscência de anastomoses, formando fístulas ou abcessos é tida como a complicação mais significativa e causadora de maior morbilidade. (1; 4) Muitas vezes a única forma de combater estes números é realizar ostomias de forma criteriosa, para prevenir a deiscência das anastomoses, a libertação de conteúdo na cavidade peritoneal e posterior infeção. (4) Um passo igualmente importante para a diminuição dos números da morbilidade, especialmente da associada à cirurgia, é a inspeção cuidadosa da cavidade abdominal e a deteção de áreas de maior fragilidade ou possivelmente danificadas, após a HIPEC e antes de encerrar o abdómen. (4) O tempo de realização das anastomoses também pode estar relacionado com a prevenção da sua deiscência através da realização das mesmas após a HIPEC, embora este tema ainda seja controverso.
Logo após as complicações relacionadas com o trato gastro intestinal, são de consecutiva importância as complicações do trato respiratório. Estas estão muitas vezes associadas à formação de comunicações entre a cavidade abdominal e pleurítica, decorrentes da ressecção do peritoneu diafragmático e da ação térmica do quimioterápico sobre a musculatura diafragmática. Desta forma a HIPEC entra na cavidade torácica causando respostas inflamatórias secundárias à lesão tecidual pelo quimioterápico, traduzidas pela produção de exsudado pleurítico no pós-operatório, que irá condicionar a função respiratória. Para evicção de tal complicação é recomendada uma cuidadosa inspeção do diafragma, especialmente quando o doente tiver sido submetido a peritonectomia subdiafragmática, e reparação de
14
possíveis comunicações inter-cavitárias. Ponderar ainda a inserção de drenos torácicos nestes doentes após a CRS e a realização de antibioterapia profilática no pós-operatório. (4)
No que diz respeito à mortalidade, as principais causas de mortalidade no perioperatório são a sépsis, e a falência multiorgânica como consequência de complicações cirúrgicas. (16) Um estudo sobre a morbilidade e a sobrevida de doentes submetidos a estes procedimentos foi realizado recentemente, em 2013, e concluiu que atualmente a CRS+HIPEC podem ser realizadas com mortalidade mínima e com taxas de morbilidade aceitáveis. Os resultados verificados foram de 0% de mortalidade aos 30 dias e 2,7% aos 60 dias, obtendo deste modo uma taxa de mortalidade baixa quando comparada com a mortalidade de outras cirurgias oncológicas major. Como indicador de morbilidade, foi avaliada a taxa de internamentos com duração superior a 14 dias; apenas 24,1% dos doentes apresentou este condicionamento. (1) Outro estudo realizado também em 2013 sobre a toxicidade e complicações da CRS e HIPEC, obteve taxas de morbilidade e mortalidade de 52,5% e 7,6% respetivamente, sendo que dentro da taxa de morbilidade se encontravam contempladas quer as complicações decorrentes da cirurgia (39%) quer as decorrentes de toxicidade provocada pela HIPEC (25,4%). (12)
Em Portugal um estudo de fase II realizado, obteve taxa de morbilidade de 32%, com as complicações cirúrgicas a representarem apenas 16% e sem complicações associadas à toxicidade da HIPEC, representado o restante número complicações decorrentes do internamento; e uma taxa de mortalidade de 0%. Devido a estes resultados os especialistas concluíram a segurança e a validade da aplicação destas técnicas no tratamento da carcinomatose peritoneal. (26)
15
7. Sobrevida e qualidade de vida pós
CRS+HIPEC
A sobrevida após o tratamento da CP com CRS+ HIPEC varia consoante a origem do tumor primário e varia de forma relevante de estudo para estudo e de centro para centro. Sendo assim, incluindo diferentes origens de tumor primário, a CRS+ HIPEC apresenta resultados de sobrevida média de 16 a 63,2 meses e de sobrevida sem doença de 12,6 a 22 meses, que são resultados bastante favoráveis quando comparados com a sobrevida média obtida sem tratamento (6 meses). (1; 5) (ver anexo 2)
O tumor coloretal mostrou ser o que apresenta menor tempo de sobrevida sem doença, e a histologia de adenocarcinoma apresenta menor tempo de sobrevida média quando comparado com mesotelioma ou outras histologias. Num estudo recente observaram-se taxas de sobrevida a cinco anos de doentes tratados para CP decorrente de adenocarcinomas coloretais e apendiculares de 38,2% e 38,7% respetivamente. (1)
Dentro dos tumores coloretais, que posteriormente originam CP, os tumores de origem retal apresentam pior sobrevida média (17 meses) do que os do colon (35 meses), reiterando que um tumor primário do reto está associado a um prognóstico mais reservado. (14)
A sobrevida é também influenciada por outros fatores, como descrito anteriormente, um deles é o PCI; doentes com PCI <20 apresentam uma diferencia significativa da sobrevida média (41 meses) quando comparada com a dos doentes com PCI> 20 (16 meses). (14)
Outro fator é a idade do doente. Glehen et al chegaram à conclusão que uma idade superior a 61 anos estava associada a uma menor sobrevida. Observaram ainda que o tumor associado a uma menor sobrevida média é o tumor gástrico (9 meses), o que denota a sua maior agressividade ou uma menor responssividade a este tratamento. O mesmo estudo apresentou uma sobrevida média de 30 meses para o cancro coloretal e de 77 para o adenocarcinoma do apêndice. No geral verificaram uma sobrevida média pós tratamento de 34 meses, com uma taxa de sobrevida livre de doença aos cinco anos de 22 %. (2)
Os números acima indicam-nos que, apesar das diferenças de sobrevida com os diferentes tumores de origem da CP e das diferenças entre os diversos centros especializados, é importante notar que, o tratamento com CRS e HIPEC aumenta a sobrevida, aumentando ainda de forma radical o número de anos que o doente vive sem manifestação da doença, tornando-se não só num tratamento de paliação de sintomas e de aumento de sobrevida mas também num tratamento potencialmente curativo. (3)
No que diz respeito à qualidade de vida (QoL) esta é constituída por parâmetros objetivos e subjetivos e a sua avaliação é feita através da avaliação da qualidade de vida relacionada com a saúde (HRQoL), ou seja a forma como o bem-estar usual do doente é afetado por uma condição médica ou pelo seu tratamento.
A QoL pode ser avaliada em pelo menos quatro áreas distintas: bem-estar físico; bem-estar sociofamiliar; bem-estar funcional; e bem-estar emocional. Foram elaboradas diversas ferramentas na tentativa de realizar uma quantificação uniforme da QoL de cada doente, dependendo do seu estado; mas muitos são os fatores que podem causar viés dos resultados, uma vez que estes se baseiam em questionários preenchidos pelos doentes. Tais fatores podem o doente na forma como ele experiencia a sua vida e consecutivamente, na forma
16
como ele depreende a sua qualidade de vida. São exemplos a espiritualidade e crenças, a resiliência psicológica, o apoio financeiro e familiar e a sexualidade. (5)
As ferramentas ou questionários mais comummente utilizados para estudar a QoL em doentes pós CRS + HIPEC são o FACT-C, SF-36 e o EORTC QLQ-CR30.
O FACT-C (Functional Assessment of Cancer Therapy-Colon) é um questionário de autoavaliação que é a soma do FACT-G, a versão geral, que consta de 28 itens, com 9 itens específicos do colon. Além das quatro áreas descritas acima, avalia ainda o indice de resposta ao tratamento.
O SF-36 (The Short Form (36) Health Survey), é uma ferramenta de avaliação da saúde geral, que de 0 a 100 avalia 36 itens sobre parâmetros físicos, emocionais, dor, saúde geral, vitalidade e saúde mental. Um resultado mais elevado obtido nesse questionário é um indicador de melhor qualidade de vida.
O EORTC QLQ-CR30 (European Organization for Research and Treatment of Cancer Quality of Life Questionnaire core 3.0) é um questionário elaborado pela organização europeia para o tratamento e pesquisa sobre o cancro, para avaliação da qualidade de vida. Este inclui cinco escalas funcionais que avaliam as partes física, funcional, emocional, cognitiva e social; três escalas de sintomas que avaliam o doente quanto à dor, fadiga, e náuseas/vómitos; uma escala de avaliação de saúde geral e ainda seis itens individuais, cinco destes para avaliação de sintomatologia usualmente apresentada por estes doentes (dispneia, anorexia, insónia, obstipação e diarreia) e um para avaliação do impacto financeiro da doença.
Os diferentes estudos realizados tendem a avaliar a HRQoL em diferentes alturas, quer no pré e no pós-operatório imediato, quer durante a recuperação. Um destes, realizado em 2006 avalia, com base no FACT-C diferentes momentos da recuperação. O primeiro questionário foi implementado no pré-operatório e os seguintes no quarto, oitavo e décimo-segundo mês após a CRS + HIPEC e verificaram que em todos os parâmetros exceto no bem-estar social, houve uma melhoria da QoL de avaliação para avaliação, sendo que os doentes voltavam a sentir-se como no pré-operatório, em relação à QoL, no quarto mês após o tratamento; a ocorrência de alguma complicação implicava um menor aumento nos níveis do FACT-C. (11)
Um estudo realizado em 2013 usando como ferramenta o questionário EORTC QLQ-CR30, aplicado no pré operatório, ao primeiro mês, ao sexto, ao decimo-segundo após o tratamento e posteriormente se necessário, verificou que existe uma diminuição acentuada da QoL no período imediatamente após a realização das intervenções, mas que esta começa a melhorar ao sexto mês e se encontra próxima da avaliação do pré-operatório no vigésimo quarto mês após CRS+HIPEC nos doentes que sobrevivem. Os parâmetros relativos à função física apesar de também só regressarem à linha de base no vigésimo quarto mês, alcançam posteriormente, em alguns doentes, uma função física superior à relatada na avaliação pré-operatória. Os itens relativos à sintomatologia revelaram uma importância proeminente no primeiro mês do pós-operatório, no entanto e como era de esperar, a maior parte encontrava-se auencontrava-sente na avaliação do encontrava-sexto mês; a diarreia e a dispneia foram sintomas que apresentaram uma tendência a persistir até ao vigésimo quarto mês de pós-operatório. (5) McQuellon, R. et al realizaram em 2001 um estudo extensivo sobre a qualidade de vida após HIPEC em doentes com CP. Além de usar o FACT-C como ferramenta para avaliar a QoL usou subescalas para avaliação das atividade de vida diárias, para avaliação da dor (The brief pain inventory), para avaliação dos sintomas depressivos (CES-D) e ainda uma escala de avaliação da performance (ECOG). Os questionários foram realizados no pré-operatório, no pós-operatório imediato e aos três, seis e doze meses após a intervenção. Quanto à avaliação geral da QoL verificaram uma grande discrepância entre dois grupos distintos, doentes com
17
ascite e doentes sem ascite; os primeiros apresentavam imediatamente no pós-operatório uma melhoria dos parâmetros, enquanto os doentes que não apresentavam ascite no pré operatório apresentaram um decréscimo nos parâmetros de avaliação da QoL, isto deve-se provavelmente á sintomatologia causada pela ascite que é aliviada imediatamente aquando da HIPEC, com o desaparecimento desta, e que dá uma noção mais clara de melhoria imediata. Os sintomas depressivos foram diminuindo logo no pós-operatório e continuaram a decrescer atá aos doze meses, altura em que apresentaram um ligeiro aumento. No que diz respeito aos parâmetros relativos à dor, a percentagem dos pacientes que experienciavam dor severa diminuiu após o procedimento (de 26% para 11 %), consequentemente a percentagem dos que sentiam dor moderada aumentou ligeiramente (de 48% para 49%). O aumento verificado na parcela de doentes que se sentiam severamente limitados para atividades moderadas aumentou imediatamente no pós-operatório (de 32% para 60%) muito devido ao fato de as intervenções serem de carater agressivo e necessitarem de um período considerável de recuperação. Tal hipótese verificou-se na subsequente diminuição destes valores para os de base aos três meses de pós-operatório. Ao primeiro ano uma maior percentagem de doentes do que a obtida em pré-operatório diziam ter uma atividade normal. Com estes resultados chegaram à conclusão que a qualidade de vida e o estado funcional sofre um decréscimo no pós-operatório, mas volta a valores de base (obtidos no pré operatório) aos três meses, apresentando ainda melhorias nas avaliações seguintes. (10) Uma das implicações deste tratamento com grande impacto na qualidade de vida é a disfunção sexual que estes doentes apresentam após os procedimentos. Cerca de 78,5% das mulheres submetidas a este tratamento manifestam alterações na sua sexualidade, a maior parte destas devido à necessidade de remoção do útero, ovários e parte da vagina durante a CRS. Apesar das mulheres apresentares mais comummente problemas deste caracter, o sexo masculino também apresenta queixas de disfunção sexual. Deste modo é importante avaliar estes parâmetros regularmente, de modo a poder diagnostica-los e soluciona-los, melhorando a qualidade de vida dos doentes. (27)
Apesar da, ainda relativamente alta, morbilidade associada a este tratamento, é seguro afirmar que doentes a ele submetidos alcançam um nível de QoL aproximado ao que apresentavam antes de se submeterem a este tratamento no prazo de um ano, e alguns melhoram posteriormente de forma bastante significativa, obtendo uma qualidade de vida superior à que apresentavam no momento do diagnóstico. No entanto, é importante apoiar adequadamente os doentes no seu pós-operatório para que esta melhoria seja conseguida, especialmente no que diz respeito ao suporte psico-oncológico.
18
8. HIPEC versus QS
Antes da realização de CRS + HIPEC e ainda agora em muitos centros, o tratamento, quase de carater paliativo, preconizado para CP era a quimioterapia sistémica, na tentativa desacelerar a progressão da doença e assim aumentar a sobrevida do doente. Esta forma de tratamento de carater menos agressivo acarreta um menor número de complicações mas, do mesmo modo, tem pouca capacidade curativa e a sobrevida alcançada é reduzida, em média 10 meses. (22)
Estudos comparativos das duas modalidades terapêuticas foram realizados de modo a esclarecer melhor a escolha. Um estudo de Verwaal em doentes com CP decorrente de cancro coloretal, publicado em 2008, comparou tratamento isolado com Leucovorina e 5FU administrados sistemicamente com CRS+HIPEC com MMC associado a QS. A sobrevida obtida após o momento de randomização de doentes quanto ao tipo de tratamento a aplicar foi de 12,6 meses com QS versus 22,2 meses quando o tratamento administrado era CRS+HIPEC+QS, foi ainda verificada uma sobrevida média de 48 meses com taxa de sobrevida a cinco anos de 45% em doentes submetidos a CRS+HIPEC+QS nos quais foi conseguida um citorredução completa. (6) Resultados como estes ajudam a clarificar a hipótese cada vez mais preponderante de que a QS e a HIPEC não são adversárias como tratamento para a CP, mas sim aliadas.
A mesma comparação é feita noutro estudo, desta vez em relação CP de origem gástrica, obtendo resultados de sobrevida significativamente superiores com a associação de tratamentos. (22) Mesmo em estudos realizados sem intenção de comparar as duas abordagens terapêuticas a opção de usar QS adjuvante está presente diversas vezes. A QS pode ser realizada no pós-operatório (14), ou no pré-operatório, com quimioterápicos adequados à histologia tumoral. (22)
Franko et al mostram que estas duas terapêuticas são mais efetivas quando utilizadas em conjunto, obtendo resultados de sobrevida mais elevados quando a HIPEC+CRS era adicionada ao tratamento apenas com QS. (28)
É errado pensar nos diferentes tratamentos de uma forma estanque e dividida através da evolução das técnicas, estes são na verdade complementares e devem ser usados dessa forma, visando sempre o maior beneficio do doente no seu processo de cura.
19
9. Conclusão
A Quimioterapia intraperitoneal Hipertérmica em combinação com a Cirurgia de Citorredução apresenta uma nova hipótese para os doentes com diagnóstico de Carcinomatose Peritoneal. O que antes parecia ser quase uma sentença de paliação pode agora ter alcançar uma sobrevida prolongada com qualidade de vida muitas vezes superior à percecionada pelos doentes no pré-operatório, o que tendo em conta a agressividade e complexidade do tratamento revela que tal se deve em parte a uma diminuição da doença ativa e da sua repercussão na vida do doente.
É importante, no entanto, continuar a percorrer o caminho da investigação, especialmente no que diz respeito à uniformização de parâmetros de estudos de morbilidade, para que conclusões coerentes equilibradas e comparáveis possam ser obtidas. Só desta forma será possível obter resultados que, a meu ver, tornarão possível a aclamação deste tratamento como o standard para a Carcinomatose Peritoneal. Não deve ser esquecido que, apesar desta ser uma nova abordagem, a clássica Quimioterapia Sistémica não deve ser abandonada mas sim complementada, uma vez que quando realizadas conjuntamente apresentam resultados mais favoráveis.
Com padrões uniformes entre os diferentes centros no que diz respeito às técnicas, com uma seleção de doentes bem elaborada, standartizada e rigorosa e ainda com o treino e especialização nestas técnicas por parte dos diferentes profissionais de saúde envolvidos, podemos obter deste tratamento a cura tão aguardada para uma metastização neoplásica, que embora regional tenha sempre sido associada a um prognóstico sombrio.
20
10. Bibliografia
1. Michelle H, Francescutti V, Attwood K, McCart JÁ, Fakih M, Kane III JM, Skitzki JJ. A contemporary analysis of morbidity and outcomes in cytoreduction / hyperthermic intraperitoneal chemoperfusion. Cancer Medicine 2013; 2(3): 334-342.
2. Glehen O, Gilly FN, Boutitie F, Bereder JM, Quenet F, Sideris L, Mansvelt B, Lorimier G, Msika S, Elias D and the French Surgical Association. Toward Curative Treatment of Peritoneal Carcinomatosis From Nonovarian Origin by Cytoreductive Surgery Combined With Perioperative Intraperitoneal Chemotherapy. A Multi-Institutional Study of 1290 Patients. Cancer 2010;116:5608-18.
3. Shen P, Levine EA, Hall J, Case D, Russell G, Fleming R, PharmD, McQuellon R, Geisinger KR, Loggie BW. Factors Predicting Survival After Intraperitoneal Hyperthermic Chemotherapy With Mitonycin C After Cytoreductive Surgery for Patients With Peritoneal Carcinomatosis. Archives of Surgery 2013;138:26-33.
4. Kusamura S, Younan R, Baratti D, Costanzo P, Favaro M, Gavazzi C, Deraco M. Cytoreductive Surgery Followed by Interaperitoneal Hyperthermic Perfusion. Cancer 2006;106:1144-53.
5. Zhu Y, Hanna N, Boutros C, Alexander HR Jr. Assessment of clinical benefit and quality of life in patients undergoing cytoreduction and Hyperthermic Intraperitoneal Chemotherapy (HIPEC) for management of peritoneal metástases. Journal of Gastrointestinal Oncology 2013;4(1):62-71.
6. Verwaal VJ, Bruin S, Boot H, Slooten G and Tinteren H. 8-Year Follow-up of Randomized Trial: Cytoreduction and Hyperthermic Intraperitoneal Chemotherapy versus Systemic Chemotherapy in Patients with Peritoneal Carcinomatosis of Coloretal Cancer. Annals of Surgical Oncology 2008;15(9):2426-2432.
7. Verwaal VJ, Ruth S, Bree E, Slooten GW, Tinteren H, Boot H and Zoetmulder F. Randomized Trial of Cytpreduction and Hyperthermic Intraperitoneal Chemotherapy versus Systemic Chemotherapy and Palliative Surgery in Patients With Peritoneal Carcinomatosis of Coloretal Cancer. Journal of Clinical Oncology 2003;21:3737-3743. 8. Verwaal VJ, Tinteren H, Ruth S and Zoetmulder F. Predicting the survival of patients
with peritoneal carcinomatosis of coloretal origin treated by aggressive cytoreduction and hyperthermic intraperitoneal chemotherapy. British Journal of Surgery 2004;91:739-746.
9. Rueth NM, Murray SE, Huddleston SJ, Abbott AM, Greeno EW, Kirstein MN, PharmD and Tuttle TM. Severe Electrolyte Disturbances After Hyperthermic Intraperitoneal Chemotherapy: Oxaliplatin Versus Mitomycin C. Annals of Surgical Oncology 2011;18:174-180.
21
10. McQuellon RP, Loggie BW, Fleming RA, Russell GB, Lehman AB and Rambo TD. Quality of life after intraperitoneal hyperthermic chemotherapy (IPHC) for peritoneal carcinomatosis. EJSO 2001;27:65-73.
11. Tuttle TM, Zhang Y, Greeno E and Knutsen A. Toxicity and Quality of Life after Cytoreductive Surgery plus Hyperthermic Intraperitoneal Chemotherapy. Annals of Surgical Oncology 2006;13(12):1627-1632.
12. Canda AE, Sokmen S, Terzi C, Arslan C, Oztop I, Karabulut B, Ozzeybek D, Sarioglu S and Fuzun M. Complications and Toxicities After Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy. Annals of Surgical Oncology 2013;20:1082-1087.
13. Valle M, Van der Speeten K, Garofalo A. Laparoscopic Hyperthermic Intraperitoneal Peroperative Chemotherapy (HIPEC) in the Management of Refratory Malignant Ascites: A Multi-institutional Retrospective Analysis in 52 Patitents. Journal of Surgical Oncology 2009;100:331-334.
14. Gomes da Silva R, Sugarbaker P, FACS, FRCS. Analysis of Prognostic Factors in Seventy Patients Having a Complete Cytoreduction plus Perioperative Intraperitoneal Chemotherapy for Carcinomatosis from Coloretal Cancer. Journal of the American College of Surgeons 2006;203:878-886.
15. Sadeghi B, Arvieux C, Glehen O, Beaujard AC, Rivoire M, Baulieux J, Fontaumard E, Brachet A, Caillot JL, Faure JL, Porcheron J, Peix JL, François Y, Vignal J, Gilly F. Peritoneal Carcinomatosis from Non-Gynecologic Malignacies: Results of EVOCAP 1 Multicentric Prospective Study. Cancer 2000;88(2):358-363.
16. Roviello F, Caruso S, Marrelli D, Pedrazzani C, Neri A, Stefano A, Pinto E. Treatment of peritoneal carcinomatosis with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy: State of the art and future developments. Surgical Oncology 2011;20:38-54.
17. Glehen O, Osinsky D, Beaujard AC, Gilly FN. Natural history of peritoneal carcinomatosis from nongynecologic malignacies. Surgical Oncology Clinics of North America 2003;12:729-739.
18. Jacquet P, Sugarbaker PH. Clinical research methodologies in diagnosis and staging of patients with peritoneal carcinomatosis. Sugarbaker PH, editor. Peritoneal carcinomatosis: principles of management. Boston, USA: Kluwer Academic Publishers; 1996.
19. Yang XJ, Li Y, Hassan AH, Yang GL, Liu SY, Lu YL, Zhang JW and Yonemura Y. Cytoreductive Surgery Plus Hyperthermic Intraperitoneal Chemotherapy Improves Survival In Selected Patients with Peritoneal Carcinomatosis from Abdominal and Pelvic Malignancies: Results of 21 Cases. Annals of Surgical Oncology 2009;16:345-351. 20. Elias D, Antoun S, Raynard B, Puizzilout JM, Sabourin JC, Ducreux M et al. Traitement