Universidade de Lisboa
Faculdade de Farmácia
INTERAÇÕES ENTRE AGENTES
ANTINEOPLÁSICOS E PLANTAS MEDICINAIS
Margarida Vieira de Bastos Brito de Sá
Mestrado Integrado em Ciências Farmacêuticas
ii
Universidade de Lisboa
Faculdade de Farmácia
INTERAÇÕES ENTRE AGENTES
ANTINEOPLÁSICOS E PLANTAS MEDICINAIS
Margarida Vieira de Bastos Brito de Sá
Monografia de Mestrado Integrado em Ciências Farmacêuticas apresentada à
Universidade de Lisboa através da Faculdade de Farmácia
Orientadora: Doutora Rita Serrano, Profª Auxiliar
iii
Resumo
As terapias do cancro têm sido consideradas um dos maiores desafios das Ciências Médicas modernas. Com o aumento do número dos casos de cancro e das suas diferentes etiologias, atualmente verifica-se que há uma crescente adesão dos doentes oncológicos a terapias alternativas ou complementares, nomeadamente, às que recorrem a plantas ditas medicinais. Ao acreditarem que essas plantas são isentas de nocividade, os doentes procuram uma alternativa não convencional com o objetivo de minimizar os efeitos indesejados da quimioterapia, ou mesmo potenciar os tratamentos prescritos.
Considerando a estreita janela terapêutica da maioria dos agentes antineoplásicos, o uso de plantas com objetivos terapêuticos (fitoterápicos) pode aumentar o risco de interações planta-fármaco clinicamente relevantes.
A literatura mostra que a maioria dessas interações ocorrem quando os compostos ativos da planta, inibem ou induzem as enzimas metabolizadoras dos agentes antineoplásicos, afetando a biodisponibilidade dos medicamentos e causando um aumento ou diminuição do nível dos fármacos no sangue (e, consequentemente, uma situação de toxicidade ou ineficácia da terapia oncológica).
Estas interações são frequentemente associadas a alterações na expressão e na funcionalidade das isoenzimas do citocromo P450. A literatura evidencia ainda que as proteínas transportadoras dependentes de ATP (ATP binding cassette) e os recetores nucleares PXR (recetor de pregnano X), CAR (recetor constitutivo de androstano) e VDR (recetor de ligação à vitamina D), desempenham igualmente um papel importante na indução de enzimas metabolizadoras e transportadoras de fármacos.
Apesar de já existirem alguns estudos relativos às interações que ocorrem com maior frequência, muitos autores realçam a necessidade de ampliar a pesquisa neste campo, assim como, a necessidade de padronizar e regulamentar mais eficientemente os medicamentos à base de plantas, de modo a garantir a sua segurança e eficácia, quando utilizados isoladamente ou em combinação com fármacos ditos convencionais.
O trabalho que se apresenta, consiste numa compilação sistemática de informações sobre as interações frequentes e com maior relevância farmacológica, entre agentes antineoplásicos e plantas medicinais, havendo referenciação dos diferentes mecanismos responsáveis pelas alterações na farmacocinética e farmacodinâmica dos diferentes fitoterápicos e/ou antineoplásicos.
Palavras-chave: plantas medicinais; interação; farmacocinética; antineoplásico; CYP450; revisão sistemática.
iv
Abstract
Cancer therapies are considered one of the greatest challenges of modern medical sciences. With the increase in the number of cancer cases and their different etiologies, there is now an increasing adherence of cancer patients to alternative or complementary therapies, in particular those that use medicinal plants. By believing that these plants are free of side effects, patients seek these unconventional alternatives in order to minimize the unwanted effects of chemotherapy, or even to potentiate the prescribed treatments.
Considering the narrow therapeutic window of most antineoplastic agents, the simultaneous use of therapeutic plants (phytotherapy) may increase the risk of clinically relevant plant-drug interactions.
The literature shows that most of these interactions occur as the plant's active compounds inhibit or induce the metabolizing enzymes of antineoplastic agents, affecting the bioavailability of the drugs, causing an increase or decrease in the level of the drugs in the blood (and, consequently, a situation of toxicity or inefficacy of cancer therapy).
These interactions are often associated with changes in the expression and functionality of cytochrome P450 isoenzymes, a class of drug metabolizing enzymes. The literature also shows that ATP-dependent carrier proteins (ATP binding cassette) and nuclear receptors PXR (pregnane X receptor), CAR (androstane receptor) and VDR (vitamin D receptor) play an important role in the induction of these metabolizing enzymes and drug carriers.
Although there are already some studies on interactions that occur more frequently, many authors emphasize the need to expand research in this field, as well as the need to standardize and regulate herbal medicines more efficiently, in order to ensure their safety and efficacy, when used alone or in combination with conventional drugs.
The present work consists of a systematic compilation of information about the most frequent and pharmacologically relevant interactions between antineoplastic agents and medicinal plants, referring to the different mechanisms responsible for the changes in the pharmacokinetics and pharmacodynamics of the different herbal and/or antineoplastic drugs.
Keywords: medicinal plants; interaction; pharmacokinetics; antineoplastic; CYP450;
v
Dedicatória
Dedico a minha Monografia do Mestrado Integrado em Ciências Farmacêuticas às minhas duas avós, Fátima e Leonilde.
À minha avó Fátima, farmacêutica que atualmente ainda exerce a sua atividade profissional, dedico este trabalho, pois foi um elemento chave para a escolha deste curso e acompanhou-me e apoiou-me, incondicionalmente, desde o princípio até ao fim.
À minha avó “Nini” como sempre lhe chamei, dedico igualmente este
trabalho, por todo o carinho, apoio, palavras amigas, pela sua casa e comida divinal nos períodos mais difíceis.
vi
Agradecimentos
Agradeço aos meus pais, que sempre acreditaram em mim e me
deram a liberdade e a educação necessárias e que definem a pessoa
que sou hoje e que sempre me incentivaram a seguir a minha intuição
e os meus sonhos.
Agradeço, do fundo do coração, todo o incansável apoio da parte do
meu grande amigo Miguel Rodrigues que, apesar da distância que
nos separa fisicamente, 7500km, esteve sempre presente, dia e noite,
para me ajudar e incentivar neste trabalho.
vii
Índice geral
Pág. 1. Introdução ……… 2. Objetivo ……… 3. Metodologia ………. 4. Enquadramento teórico ………4.1) Mecanismos gerais de interação planta-fármaco ………...
4.1.1) Interações farmacodinâmicas ………... 4.1.2) Interações farmacocinéticas ………. 4.1.2.1) Absorção ……… 4.1.2.2) Distribuição ……… 4.1.2.3) Metabolização ……….. 4.1.2.4) Eliminação ……….
4.2) Mecanismos específicos de interação entre agentes antineoplásicos e
plantas medicinais
4.2.1) Interações mediadas por enzimas ……….. 4.2.1.1) Sistema de isoenzimas do citocromo p450 ……… 4.2.2) Interações mediadas por transportadores ………. 4.2.2.1) Proteínas transportadoras dependentes de ATP (família ABC) ….. 4.2.2.2) Interações mediadas por transportadores de soluto (SLC) ………. 4.2.3) Interações “mistas”: mediadas por ação de enzimas e transportadores 4.2.4) A influência dos recetores nucleares………... 4.2.4.1) O recetor de pregano X (PXR) ………... 4.2.4.2) Recetor constitutivo do androstano (CAR) ……….. 4.2.4.3) Recetor de ligação à vitamina D (VDR) ………
5. Resultados ……….
6. Discussão ………..
7. Conclusão ………..
8. Bibliografia ………
9. Anexos
Anexo I – Compilação de imagens: plantas e os seus respetivos compostos com atividade farmacológica
Anexo II – Tabela-resumo: 24 plantas medicinais e as suas possíveis
interações com agentes antineoplásicos
1 3 4 8 8 8 8 8 9 9 10 11 11 11 13 13 14 14 15 15 17 18 19 23 25 27 33 67
viii
Índice de Tabelas
Pág.
Tabela 1 – Relação entre a ocorrência de cada palavra-chave (PC) e os respetivos
artigos
Tabela 2 – Enzimas do CYP450 envolvidas no metabolismo de fármacos
antineoplásicos e suportivos
Tabela 3 – Proteínas transportadoras envolvidas no transporte de fármacos
antineoplásicos
Tabela 4 – Relação entre o número e respetiva percentagem de palavras-chave (e
derivados) e o nº de artigos que as apresentam no seu título
Tabela 5 – Nº de ocorrências de cada PC nos artigos que igualmente continham a
PC-mãe
Tabela 6 – Tabela-resumo: 24 plantas medicinais e as suas possíveis interações com
agentes antineoplásicos (Anexo II)
Tabela 7 – Metabolismo dos canabinoides pelo CYP450 ... Tabela 8 - Contraindicações e precauções associadas ao abuso de tetrahidrocannabinol (THC) e canabidiol (CBD)
Tabela 9 – Condições com potencial de resposta à terapia com canabinoides ……….
Tabela 10 – Tumores sensíveis à inibição do seu crescimento induzida por
canabinoides
Tabela 11 - Efeitos biológicos recentemente relatados de Morinda citrifolia ou Neem
Tabela 12 – Percentagem de contribuição de cada PC nos artigos selecionados
(ordem decrescente)
Tabela 13 – Nº total de artigos contendo as palavras-chave e respetiva percentagem
6 12 13 19 20 67 20 21 21 22 22 23 23
ix
Índice de Gráficos
Pág.
Gráfico 1 – Relação entre o nº total de PC presentes e o nº do artigo que as apresenta
no seu título
19
Índice de Figuras
Pág.
Figura 1 – Isoformas do CYP450 e a sua contribuição no metabolismo enzimático…
Figura 2 – Mecanismo de indução do CYP450 via PXR ………..
Figura 3 – O efeito da hiperforina na terapia antineoplásica com irinotecano ………..
Figura 4 – Mecanismo de indução do CYP2B via CAR ………
12 16 16 17
Índice de Figuras – Anexo I
Pág.
Figura 1 – Camellia sinensis ………...
Figura 2 – Compostos com atividade farmacológica do Chá Verde (EGCG:
epigalocatequina-3-galato; EC: epicatequina)
Figura 3 – Echinacea purpurea ………..
Figura 4 – Compostos com atividade farmacológica da Equinácea ………..
Figura 5 – Hypericum perfuratum ………..
Figura 6 – Compostos com atividade farmacológica do Hipericão ………...
Figura 7 – Zingiber officinale (rizoma) ………
Figura 8 – Compostos com atividade farmacológica do Gengibre ………
Figura 9 – Ginkgo biloba ………..
Figura 10 – Compostos com atividade farmacológica do Ginkgo ………..
Figura 11 – Panax ginseng (raízes) ………...
Figura 12 – Compostos com atividade farmacológica do Ginseng ………
34 34 35 35 36 36 37 37 38 38 39 39
x
Figura 13 – Allium sativum (bolbo) ……….
Figura 14 - Compostos com atividade farmacológica do Alho ………...
Figura 15 – Matricaria recutita ………
Figura 16 – Matricaria recutita, capítulos ………..
Figura 17 – Compostos com atividade farmacológica da Camomila ………
Figura 18 – Valeriana officinalis ……….
Figura 19 – Compostos com atividade farmacológica da Valeriana ……….
Figura 20 – a) Curcuma longa (planta); b) Tubérculo de Curcuma longa; c) Pó de
Curcuma longa
Figura 21 – Compostos com atividade farmacológica do Açafrão (curcumina) ………...
Figura 22 – Silybum marianum ………...
Figura 23 – Compostos com atividade farmacológica do Cardo Mariano ………
Figura 24 – Piper methysticum (planta) ……….
Figura 25 – Piper methysticum (rizoma) ………
Figura 26 – Compostos com atividade farmacológica do Kava kava ………
Figura 27 – Vitis vinifera (folhas e frutos) ………..
Figura 28 – Compostos com atividade farmacológica da Videira (Resveratrol) ………..
Figura 29 – Glycyrrhiza glabra (31) ………
Figura 30 – Compostos com atividade farmacológica do Alcaçuz ………
Figura 31 – Thymus vulgaris (planta) ……….
Figura 32 – Compostos com atividade farmacológica do Tomilho ………
Figura 33 – Cimicifuga racemosa ………..
Figura 34 – Compostos com atividade farmacológica da Erva de São Cristóvão ……...
Figura 35 – Punica granatum ………..
Figura 36 – Compostos com atividade farmacológica da Punica granatum (a-Ácido
elágico; b-Punicalagina; c-Antocianinas presentes no fruto da romã)
Figura 37 – Linum usitatissimum (flores) ………..
40 40 41 41 42 43 43 44 44 45 45 46 46 47 48 48 49 49-50 51 51 52 52-53 54 54-55 56
xi
Figura 38 – Compostos com atividade farmacológica da Linhaça. Estruturas de quatro
glicosídeos cianogénicos (monoglicosídeos: linamarina, Lotaustralin; Diglicosídeos: linustatina e neolinustatina) e SDG (secoisolariciresinol diglicosídeo)
Figura 39 - Foeniculum vulgare ………..
Figura 40 – Compostos com atividade farmacológica da Erva-Doce (estruturas
moleculares dos compostos maioritários presentes no óleo essencial de Foeniculum vulgare)
Figura 41 – Compostos com atividade farmacológica da Erva-Doce (estruturas
moleclares de alguns fenóis e glicosídeos fenólicos isolados de Foeniculum vulgare)
Figura 42 – Mentha piperita ………
Figura 43 – Compostos com atividade farmacológica da Hortelã-pimenta ………..
Figura 44 – Cannabis sativa ………
Figura 45 – Principais compostos com atividade farmacológica da Canábis …………..
Figura 46 – Azadirachta indica (fruto) ………..
Figura 47 – Árvore de Neem (Azaridachta indica) ……….
Figura 48 – Um dos compostos com maior atividade farmacológica de Neem, a
Azadiractina
Figura 49 – Árvore de Noni (Morinda citrifolia) ………...
Figura 50 – Morinda citrifolia (a-Fruto imaturo; b-Fruto maduro) ……….
Figura 51 – Morinda citrifolia (flor) ………
Figura 52 – Compostos com maior atividade farmacológica do Noni (Damnacanthal)
Figura 53 – Viscum album ……….
Figura 54 – Ramos do Viscum album ………...
Figura 55 – Compostos com atividade farmacológica do Azevinho/Visco ……….
56 57 57 58 59 59 60 60 61 61 62 63 63 63 64 65 65 66
xii
Abreviaturas, siglas e acrónimos
AAS - Ácido Acetilsalicílico ABC - ATP Binding Cassette ATP - Adenosina-trifosfato
BCRP - Breast Cancer Resistance Protein BD - Biodisponibilidade
BSEP - Bile Salt Export Pump
CAR - Constitutive Androstane Receptor
Cplasm - Concentração plasmática
Cintracel - Concentração intracelular CYP - Enzimas do Citocromo DOX - Doxorrubicina
EGFR-TK - Epidermal Growth Factor Receptor Tyrosine-Kinase GST - Glutationa-S-transferase
HCl - Ácido Clorídrico
HVI – Human immunodeficiency virus
hPAR - Human Proteinase-Activated Receptor
HPV18 – Vírus do Papiloma Humano do tipo 18
JB6 – Células da epiderme de ratos
LBD - Ligand Binding Domain
MATE - Multidrug and Toxic Compound Extrusion Transporters MOLT - Human acute T lymphoblastic leukaemia (linha celular) MRP - Multidrug-associated Resistance Proteins
mRNA - RNA mensageiro
MT- 4 – Macrófagos (células M-Trópicas) onde o HIV se replica
NR1 - Nuclear Receptors
OAT - Organic Anion Transporters
OATP - Organic Anion Transporting Polypeptides OATP-B - Organic Anion-Transporting Polypeptide B OCT - Organic Cation Transporters
OMS - Organização Mundial de Saúde
PC – Palavra-chave
PEPT - Peptide Transporters P-gp - Permeability Glycoprotein PSA - Prostate Especific-Antigen PXR - Pregnane X Receptor
xiii PXRE - Xenobiotic Response Elements
Ras - Oncogene
RXR - 9-cis Retinoic Acid Receptor
SJW - St. John’s Wort
SLC - Solute Carrier
SN-38G - Metabolito ativo do irinotecano SRC-1 - Steroid Receptor Co-ativator SULT - Sulfotransferase
SXR - Steroid and Xenobiotic Receptor TGI - Trato Gastrointestinal
UDP - Uridine Dinucleotide Phosphate UGTs - UDP-Glucoronosiltransferases VDR - Vitamin D-Binding Receptor 5-FU - 5-Fluorouracilo
1
1. Introdução
A OMS classifica como “medicamentos à base de plantas” a categoria de medicamentos de
origem vegetal, que incluem na sua constituição: plantas, materiais vegetais, preparações à base de plantas e produtos acabados à base de plantas, contendo, como substâncias ativas, partes de plantas ou outros materiais vegetais ou combinações destes materiais entre si. Atualmente, o recurso a medicamentos à base de plantas, também designados por fitoterápicos pela OMS, tem por base uma utilização histórica dos mesmos para fins terapêuticos, desde os tempos mais primordiais. Como tal, nos dias de hoje, a sua prática é bem estabelecida e amplamente reconhecida como segura e eficaz, podendo ser aceite pelas autoridades nacionais que regulamentam o mercado de produtos com atividade terapêutica (1).
A prevalência do uso de medicamentos à base de plantas é elevada e continua a aumentar (2), em particular, em doentes com cancro, que no mundo ocidental estão a conjugar essas substâncias com a terapia convencional, para acelerar os processos terapêuticos, ainda que não seja considerada relevante a comunicação e partilha de tal prática com as comunidades oncológicas, farmacêuticas, químicas, e botânicas (3).
Como é de conhecimento geral, as plantas representam as maiores fontes de substâncias ativas que podem ser usadas na terapêutica, devido à grande diversidade estrutural de metabolitos produzidos sendo, possivelmente, a fonte mais antiga de medicamentos para o Homem (4).
O principal propósito desta revisão é a ampliação sistemática do conhecimento das interações entre agentes antineoplásicos e plantas medicinais. Tais interações indesejadas promovem um risco acrescentado para o doente. Esse risco, estando relacionado com a falta de conhecimento prévio da verdadeira atividade terapêutica das plantas e das possíveis interações com fármacos, pode muitas vezes interferir na terapêutica quimioterápica antineoplásica administrada. Apesar dos avanços tecnológicos e do aumento das investigações químicas e farmacológicas das plantas ditas medicinais, muitas ainda não têm os seus compostos ativos elucidados estruturalmente, assim como os seus efeitos terapêuticos.
Algumas interações planta-fármaco relatadas na literatura encontram-se bem estabelecidas, com mecanismo elucidado. Outras, apesar da relação causa/efeito ter sido estabelecida, não foram investigadas sistematicamente visando estabelecer o mecanismo da interação, restando hipóteses não confirmadas para justificar os resultados clínicos. Paralelamente, a
2 falta de padronização dos extratos de plantas utilizados, das doses e dos períodos de tratamento investigados, nas pesquisas pré-clínicas e clínicas, dificultam a comparação dos resultados obtidos, bem como a extrapolação dos mesmos para o dia-a-dia e para a prática terapêutica (5).
3
2. Objetivo
Como resultado da falta de estudos, os relatos sobre as interações farmacocinéticas clinicamente relevantes no uso concomitante de fitoterápicos com quimioterápicos são relativamente escassos. Assim, pretende-se que esta revisão da literatura compile informações sobre interações mais frequentes e de maior relevância farmacológica, entre agentes antineoplásicos e plantas medicinais, de modo a contribuir para o conhecimento essencial dos profissionais envolvidos nesta prática terapêutica.
4
3. Metodologia
Foram realizadas pesquisas bibliográficas eletrónicas de janeiro de 2017 a agosto de 2017, com o objetivo de identificar Revisões Sistemáticas sobre interações entre plantas medicinais e fármacos convencionais ou antineoplásicos. Para tal, foram utilizados os seguintes bancos de dados eletrónicos: MEDLINE®, SciELO e Google Scholar Database.
Os termos de pesquisa foram construídos usando as palavras "medicamentos fitoterápicos", “plantas medicinais”, “interações", “neoplásicos”, ” neoplasias”, “cancro”, “indução”, “inibição” “CYP450” e os seus termos derivados. A palavra “Revisão" foi igualmente inserida na matriz da pesquisa endoçada ao título do artigo.
As pesquisas bibliográficas foram conduzidas com a imposição de restrições em língua inglesa e portuguesa e o intervalo de publicação foi de [2000 a 2017].
A estratégia de pesquisa seguiu a seguinte linha de ação:
1. Pesquisa bibliográfica nas bases de dados mencionadas, utilizando as “palavras-chave” anteriormente referidas com base na sua ocorrência no título do artigo;
2. Pesquisa de artigos pelo nome da planta;
3. Eliminação de artigos duplicados;
4. Exclusão daqueles artigos que não mencionavam interações planta-fármacos.
As Revisões Sistemáticas foram definidas como artigos que incluíram uma metodologia explícita e repetitiva. Assim, os artigos que estabeleciam Revisões Sistemáticas e que foram incluídos neste trabalho tiveram que se concentrar nas interações entre fármacos e plantas medicinais, sendo que, no caso de duplicados, se optou pelo trabalho mais recente.
Foram excluídas Revisões e/ou Críticas não sistemáticas relativas à efetividade de produtos fitoterápicos.
A qualidade metodológica de todas as Revisões Sistemáticas e artigos foi avaliada utilizando uma tabela onde se registou o número de ocorrências das palavras-chave no título de cada artigo, sendo que, o artigo que teria maior relevância e contribuição para este estudo deveria
5 ser aquele que apresentasse uma maior quantificação de palavras-chave (8 ocorrências). Cada artigo foi identicado pela sua numeração sequencial na bibliografia. A cada palavra-chave em língua portuguesa correspondeu a mesma palavra-chave em língua inglesa.
No presente estudo foram selecionados 84 artigos provenientes das bases de dados já mencionadas, publicados até agosto de 2017, denominados, de seguida, como “Amostra”. Todos os artigos selecionados, que constituíram a Amostra, estavam relacionados com a ”interação entre plantas medicinais e agentes neoplásicos”, seguindo a linha de “colheita” equivalente à ocorrência de pelo menos uma das palavras-chave, previamente selecionadas inscritas no “Titulo” do mesmo.
A tabela 1 apresenta a ocorrência das palavras-chave, ou seus derivados, no título de cada artigo selecionado.
6
Tabela 1 – Relação entre a ocorrência de cada palavra-chave (PC) e os respetivos artigos.
A mostr a (nº d o a rt igo de ac or do c om a B ib li ograf ia ) P lan tas medic ina is Interação Fa rm ac oc iné ti ca A nti ne op lás ico C an cro Ind uç ão C Y P 45 0 R ev isã o S istemá ti ca To tal 1 1 - - - 1 2 1 1 - - - 1 3 3 1 1 - - - 1 - - 3 4 1 - - 1 - - - - 2 5 1 1 1 - - - 3 6 1 1 - - 1 - - - 3 7 - 1 - - - 1 2 8 - 1 1 - - - 1 - 3 9 1 1 1 - - - 3 10 1 1 - - - 2 11 - 1 1 - - - 2 12 1 - 1 - - - 2 13 1 - - - - 1 1 - 3 14 - 1 - - - - 1 - 2 15 - - - 1 - - 1 16 1 - 1 1 - - - - 3 17 - - - 1 - 1 - - 2 18 - - - 1 - - 1 19 1 - - - 1 20 - - - 1 - - 1 21 - - - 1 - 1 22 - - - 1 - 1 23 1 1 - - - 2 24 1 1 - 1 - - - - 3 25 1 1 - - 1 - - - 3 26 1 1 - - - 2 27 1 1 - 1 - - - 1 4 28 1 - - - 1 - 2 29 1 - - - 1 30 1 1 - - - 2 31 1 - - - 1 32 1 1 - - - 2 33 1 - - - 1 - 2 34 - 1 - - - 1 35 1 1 - - - 2 36 1 - - - 1 - - - 2 37 - 1 - - 1 1 - - 3 38 1 - - - 1 2 39 1 - 1 - - - - 1 3 40 1 - - 1 1 - - - 3 41 1 - - - 1 - - - 2 42 - - - - 1 1 - - 2 43 1 - - - 1
7 A mostr a (nº do ar ti go ) P lan tas medic ina is Interação Fa rm ac oc iné ti ca A nti ne op lás ico C an cro Ind uç ão C Y P 45 0 R ev isã o S istemá ti ca To tal 44 1 - 1 - - - - 1 3 45 1 1 - - - 2 46 - 1 - 1 - - 1 - 3 47 1 - - - 1 48 1 - - - 1 49 1 - - - 1 2 50 1 - - - 1 2 51 1 - - - 1 52 1 - - - 1 53 1 - - - 1 2 54 1 - - - 1 2 55 1 - - - 1 - - 1 3 56 1 - - - 1 57 1 1 - - - 2 58 1 1 - 1 - - - - 3 59 1 - - - 1 2 60 1 - - - 1 - - - 2 61 1 - - 1 1 - - - 3 62 1 - - 1 1 - - - 3 63 1 - - 1 1 - - - 3 64 1 - - 1 - - - - 2 65 1 - - 1 - - - - 2 66 1 - 1 1 - - - - 3 67 1 - - 1 - - - - 2 68 1 - - - 1 - - 1 3 69 1 - - - 1 - - - 2 70 1 1 - - - 2 71 1 - - - 1 - - - 2 72 1 - - - 1 2 73 1 - 1 - - - 2 74 1 - - - 1 2 75 1 - - 1 1 - - - 3 76 1 - - - 1 77 1 - - - 1 78 1 - - - 1 79 1 - - - 1 80 1 - - - 1 81 1 - - - 1 82 1 - - - 1 83 1 - - - 1 84 1 - - - 1 Total 70 25 10 16 16 8 8 15 --
8
4. Enquadramento teórico
4.1) Mecanismos gerais de interação planta-fármaco
4.1.1) Interações farmacodinâmicas
As interações farmacodinâmicas são interações que provocam mudanças nas respostas farmacológicas, afetando o mecanismo de ação do fármaco e a relação entre a concentração do medicamento e o seu efeito. Estas interações podem resultar no aumento ou inibição da
atividade farmacológica de um fármaco coadministrado. Como tal, implicam,
consequentemente, alterações nos efeitos farmacológicos do fármaco, através de ações
aditivas, sinérgicas ou antagónicas. Contudo, considera-se que grande parte das interações
planta-fármaco, que resultam em efeitos clínicos graves ou mesmo fatais para o doente, acontecem devido a interações farmacocinéticas, isto é, devido a alterações na absorção, distribuição, biotransformação e/ou eliminação de determinado medicamento (6). Assim, um maior enfoque será dado a esse tipo de interações, ao longo desta revisão.
4.1.2) Interações farmacocinéticas
As interações farmacocinéticas compreendem alterações na forma como os fármacos chegam ao organismo e podem influenciar a quantidade ou concentração dos mesmos. Se estas interações levarem ao aumento dos níveis de determinado fármaco, podem levar a efeitos secundários graves e/ou toxicidade. Contrariamente, se houver diminuição da concentração de um fármaco, pode ter como consequência uma menor eficácia do medicamento ou possibilidade de resistência ao mesmo (7). As interações farmacocinéticas são as que ocorrem com maior frequência, estando relacionadas com os seguintes processos (6):
4.1.2.1) Absorção
É essencialmente ao nível do estômago e intestino que tanto plantas medicinais como fármacos são absorvidos, quando administrados por via oral (7). Dos efeitos desta coadministração podem resultar: aumento/diminuição do pH intestinal, aumento do fluxo sanguíneo entero-hepático e aumento/diminuição do trânsito gastrointestinal. No caso de haver atraso no esvaziamento gástrico, há um maior tempo de retenção do medicamento em pH ácido, podendo resultar na sua degradação (6). Em contrapartida, algumas plantas com propriedades laxantes, podem acelerar o processo digestivo, reduzindo a quantidade de
9 tempo que um medicamento está presente para ser digerido e posteriormente absorvido. Alterações fisiológicas geradas pela alimentação acabam por aumentar a absorção e concentração máxima do medicamento no organismo, podendo resultar numa situação de toxicidade. Uma forma de contornar esta situação é o alerta, cedido por parte do médico oncologista, de que os quimioterápicos antineoplásicos poderão ter que ser ingeridos no intervalo entre as refeições (7).
4.1.2.2) Distribuição
Uma vez na corrente sanguínea, independentemente da via de administração, há ligação do fármaco às proteínas plasmáticas (como a albumina, glicoproteínas e imunoglobulinas). Se o fitoterápico possuir princípios ativos com estrutura molecular semelhante à do medicamento, estes podem competir na ligação às proteínas plasmáticas, podendo ter como consequência uma maior biodisponibilidade dos medicamentos anticancerígenos (que não se ligam a estas proteínas) e, com isto, maior possibilidade de interações e reações de toxicidade (6).
4.1.2.3) Metabolização
Após a entrada na corrente sanguínea, muitos fármacos necessitam de ser metabolizados pelo fígado, havendo ativação farmacológica dos metabolitos ou remoção dos mesmos (7). A maioria das interações medicamentosas por fitoterápicos ocorre por indução ou inibição de enzimas de fase I ou fase II.
O metabolismo de fase I, geralmente resulta na introdução de um grupo funcional hidrofílico em compostos de caráter lipofílico ou no desvelamento de novos grupos funcionais. Nesta fase podem ocorrer vários tipos de reação, como a oxidação, redução e hidrólise (8). Como parte integrante desta classe, encontram-se todas as enzimas do complexo do citocromo P450, assim como as aldeído/álcool–desidrogenases, entre outras (6). As famílias CYP 1, 2 e 3 são as famílias de enzimas mais abundantes e as isoformas CYP1A2, CYP2C e CYP3A4 contribuem para aproximadamente 30% do metabolismo da maioria dos fármacos (9). Devido à falta de especificidade relativamente ao seu substrato, estas enzimas podem atuar tanto em substâncias endógenas como exógenas. Apesar de muitos medicamentos anticancerígenos não necessitarem de ativação metabólica para exercerem a sua ação ao nível das células neoplásicas, outros são pró-fármacos, necessitando de biotransformação para se tornarem ativos e terem o efeito farmacológico pretendido. Assim, após a indução destas enzimas, pode resultar: uma maior ativação dos pró-fármacos e, consequentemente, um aumento na biodisponibilidade dos metabolitos ativos levando a aumento da toxicidade; uma maior metabolização dos fármacos favorecendo uma excreção aumentada dos mesmos, resultando
10 numa diminuição de eficácia. Como tal, a coadministração de fitoterápicos e medicamentos anticancerígenos deve ser realizada com a noção de que as plantas medicinais podem ser potentes indutores ou inibidores das enzimas de fase I, associadas ao complexo do citocromo p450.
As enzimas de fase II têm como principal função a conjugação de xenobióticos ou metabolitos resultantes da fase I, com substratos endógenos com o objetivo final de desintoxicação (6). Estes substratos podem ser açúcares ou aminoácidos de modo a aumentar a polaridade do
composto e permitir a sua eliminação (9). As principais famílias de enzimas com atividade
nesta fase são as GSTs, UGTs, sulfotransferases e N-acetiltransferases. A família das GSTs é encontrada em diferentes tecidos, exercendo um papel central na destoxificação de xenobióticos, nos humanos. Assim, alterações nos seus níveis de expressão podem alterar a resposta dos doentes aos quimioterápicos antineoplásicos, sendo que, o aumento da expressão dessas enzimas de fase II pode resultar em perda de eficácia do agente antineoplásico. Contrariamente, a supressão destas enzimas pode desencadear uma reação de toxicidade. Deste modo, deve-se considerar o risco de interação medicamentosa pela ingestão concomitante de fitoterápicos com quimioterápicos em doentes oncológicos, uma vez que, estas plantas podem alterar a expressão ou mesmo competir pelas enzimas de fase II (6).
4.1.2.4) Eliminação
A excreção de xenobióticos do organismo está relacionada com a atividade de três órgãos principais: os rins, onde ocorre a eliminação dos medicamentos hidrofílicos; o fígado, onde, após a biotransformação, os metabolitos são eliminados pela bílis; os pulmões, responsáveis pela excreção de substâncias voláteis. A eliminação celular de xenobióticos requer a ligação destes a proteínas transportadoras, de modo a que sejam expulsos do meio intracelular para o meio extracelular. A expressão dos genes destas proteínas é essencial ao nível da terapia oncológica, pois muitos estão associados à resistência a múltiplos fármacos. A família ABC é um exemplo de uma família de proteínas transportadoras dependentes de ATP, envolvida tanto na absorção como na eliminação celular de agentes antineoplásicos. Como tal, estas proteínas estão localizadas tanto na membrana apical das células epiteliais intestinais, sendo responsáveis essencialmente pela absorção de substâncias, como na membrana proximal das células dos túbulos renais, estando associadas à sua eliminação do organismo (6). A proteína mais envolvida no transporte transmembranar de substâncias é a P-gp, que desempenha um papel fundamental no efluxo de fármacos e metabolitos, podendo resultar em interações farmacocinéticas (9). A importância do estudo dos mecanismos associados a estas proteínas, centra-se no facto de as células neoplásicas poderem tornar-se resistentes
11 aos quimioterápicos, por aumentarem a expressão destas proteínas, resultando na expulsão do fármaco antes de este chegar ao seu alvo biológico, (diminuindo, assim, a sua eficácia) (6).
4.2) Mecanismos específicos de interação entre agentes antineoplásicos e plantas medicinais
Tal como já foi referido anteriormente, as interações farmacocinéticas são as que ocorrem com maior frequência, envolvendo alterações na absorção, distribuição, metabolização e eliminação dos quimioterápicos.
4.2.1) Interações mediadas por enzimas
4.2.1.1) Sistema de isoenzimas do citocromo p450
A maioria das interações farmacocinéticas relacionadas com o metabolismo de fármacos quimioterápicos envolve, essencialmente, o complexo enzimático do citocromo P450 que se localiza nas membranas do retículo endoplasmático liso de diferentes tecidos, essencialmente no fígado. A baixa afinidade destas enzimas permite que sejam capazes de metabolizar um número quase ilimitado de substratos. Além dos xenobióticos, participam na metabolização de substratos endógenos como o colesterol, ácidos biliares, hormonas tiroideias e ácidos gordos (10). O metabolismo de agentes antineoplásicos encontra-se associado essencialmente às enzimas CYP: 1A1, 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1, 3A4 e 3A5. Na figura 1 podem observar-se algumas das isoformas de CYP450 e a sua contribuição na metabolização enzimática de fármacos. De todas estas famílias de enzimas, a que tem maior impacto no metabolismo de quimioterápicos antineoplásicos é a CYP3A4, como é possível
observar na tabela 2. No geral, a inibição das enzimas do CYP450 leva a níveis elevados de
fármaco citotóxico, a não ser que este seja um pró-fármaco inativo, tal como acontece com a ciclofosfamida ou a ifosfamida. Em contrapartida, a indução destas enzimas, terá como consequência uma falha na eficácia terapêutica, no caso dos fármacos metabolizados já se encontrarem farmacologicamente ativos (3).
12
Figura 1 – Isoformas do CYP450 e a sua contribuição no metabolismo enzimático (14).
Tabela 2 – Enzimas do CYP450 envolvidas no metabolismo de fármacos antineoplásicos e
13 4.2.2) Interações mediadas por transportadores
Embora a maioria dos estudos se foquem mais nas interações medicamentosas através da ação dos citocromos, a influência das proteínas transportadoras na presença de interações está cada vez mais a ser documentada, pois foi revelado que podem desempenhar um papel importante na modulação da absorção, distribuição, metabolismo e eliminação do fármaco, afetando, a farmacocinética (11).
4.2.2.1) Proteínas transportadoras dependentes de ATP (família ABC)
A superfamília de proteínas transportadoras ABC atua de modo a exportar o substrato correspondente, do interior da célula para o exterior, funcionando como uma bomba de efluxo, através do consumo de ATP. Deste modo, medeia o transporte de substâncias através de
membranas celulares (10). Estes transportadores afetam significativamente a
farmacocinética, eficácia e toxicidade de xenobióticos (incluindo fitoterápicos) e os fármacos
coadministrados podem inibir ou induzir estes transportadores (11). A tabela 3 resume alguns
dos transportadores ABC envolvidos no transporte de agentes antineoplásicos quimioterápicos. Dentro desta família, a P-gp é a mais estudada, sendo considerada a responsável pelo fenómeno de resistência a múltiplos fármacos na terapia antineoplásica. Para além de associada a células tumorais, esta proteína glicosilada também pode ser encontrada em tecidos normais de órgãos, nos humanos, tais como: fígado, rins, pâncreas, trato gastrointestinal e barreira hemato-encefálica (10). Outras subfamílias com relevância são: proteína de resistência ao cancro da mama (BCRP), bomba de exportação de sal biliar (BSEP), bem como várias proteínas de resistência associadas a múltiplos fármacos (MRPs) (11).
Tabela 3 – Proteínas transportadoras envolvidas no transporte de fármacos antineoplásicos.
14 4.2.2.2) Interações mediadas por transportadores de soluto (SLC)
Esta família engloba os transportadores associados ao processo de absorção de solutos e inclui: os polipéptidos transportadores de aniões orgânicos (OATPs), transportadores de catiões orgânicos (OCTs), transportadores de aniões orgânicos (OATs), transportadores de péptidos (PEPT) e transportadores de extrusão de múltiplos fármacos e compostos tóxicos (MATE). O complexo de transportadores SLC é conhecido por facilitar a absorção de fitoterápicos e xenobióticos na circulação sistémica. Como os transportadores são principalmente expressos nas células epiteliais intestinais e órgãos de eliminação (túbulos proximais do rim e hepatócitos), podem influenciar significativamente a disponibilidade dos medicamentos à base de plantas. Atualmente, verifica-se que ainda há poucos estudos sobre a influência desta família nas interações planta-fármaco, contrariamente ao que acontece com a família de transportadores ABC, onde o grande foco incide nas interações com a P-gp (11).
4.2.3) Interações “mistas”: mediadas por ação de enzimas e transportadores
Alguns fitoterápicos são conhecidos por influenciar a função enzimática do citocromo e do transportador. A P-gp e o CYP3A4 constituem uma barreira altamente eficiente para muitos fármacos oralmente administrados, com uma grande sobreposição ao nível dos seus substratos. Rhodiola rosea (raiz dourada) é um exemplo de um fitoterápico utilizado no tratamento da depressão e que demonstrou uma potente inibição tanto da P-gp como do CYP3A4. Contrariamente, Hypericum perforatum (hipericão), igualmente utilizado devido às
suas propriedades antidepressivas, induz tanto o CYP3A4 como o transportador P-gp (12).
Um estudo recente revelou que a quercetina e a rutina, flavonoides derivados de plantas medicinais conhecidas, induziram as funções de ambos P-gp e CYP3A4, diminuindo a biodisponibilidade da ciclosporina coadministrada (13). Estas alterações no efluxo normal da P-gp e na atividade do CYP450 têm um impacto na farmacocinética associada aos substratos do CYP3A4 e da P-gp. Assim, quando há interação entre plantas medicinais e antineoplásicos, surgem alterações, que podem resultar da indução/inibição de ambos os sistemas referidos (11).
15 4.2.4) A influência dos recetores nucleares
4.2.4.1) O recetor de pregano X (PXR)
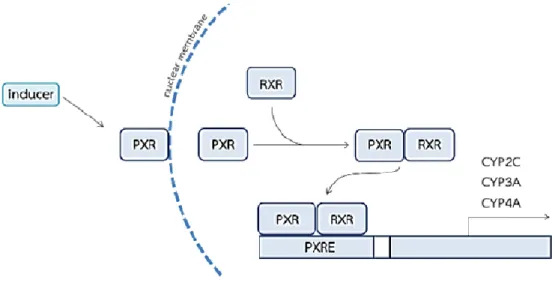
O PXR, também conhecido como recetor de esteroides e xenobióticos (SXR) ou recetor ativado pela proteinase humana (hPAR), emergiu como um dos principais reguladores do CYP3A4 e da P-gp (3). Consiste numa proteína nuclear responsável pela regulação da expressão do mRNA de várias isoformas de CYP450 (como o CYP3A4, 2B6 e 2C9) e o gene MDR-1. Quando um substrato se liga ao PXR (presente na membrana nuclear), o complexo substrato migra para o núcleo e liga-se ao RXR, tornando-se um heterodímero PXR-RXR (14). O heterodímero irá ativar elementos de resposta aos xenobióticos, PXRE, levando
ao processo de transcrição dos respetivos genes (Fig. 2).
Os ligandos da PXR humana atualmente conhecidos são todos indutores bem estabelecidos do CYP3A4, tais como os fármacos: rifampicina, dexametasona, clortrimazol e paclitaxel (3). Moore et al., demonstraram que a capacidade indutiva de SJW também é mediada pelo PXR (15). Em particular, o composto farmacologicamente ativo do SJW, a hiperforina, tem capacidade para ativar o PXR, induzindo a expressão do CYP3A4 e CYP2C9. Assim, verificou-se que doentes oncológicos que usavam SJW em combinação com irinotecano, os
níveis plasmáticos de SN-38, o metabolito ativo do irinotecano, foram 42% menores (Fig. 3)
(16). A hiperforina também demonstrou formar um complexo com o domínio de ligação ao ligando da PXR humana (3).
Estes recetores nucleares também foram referidos como capazes de induzir a expressão de enzimas de conjugação de fase II, como UDP-glucuronosil transferase, sulfotransferase e Glutationa-S-transferase (17).
Assim, como resultado de uma maior indução destes recetores nucleares, há uma expressão aumentada da P-gp e do CYP3A4 e uma consequente redução da taxa de absorção celular do fármaco e um aumento da sua taxa de eliminação.
16
Figura 2 – Mecanismo de indução do CYP450 via PXR. Quando um substrato se liga ao PXR,
este migra para o núcleo e liga-se ao RXR nuclear, formando o heterodímero PXR-RXR. De seguida, este complexo liga-se ao elemento de resposta PXRE, que atua como um promotor, resultando na transcrição dos genes envolvidos (14).
Figura 3 – O efeito da hiperforina na terapia antineoplásica com irinotecano. A hiperforina, a
substância ativa de SJW, liga-se ao PXR, de modo a ativá-lo. Após a sua ativação, o PXR forma um heterodímero com o RXR e este complexo liga-se ao PXRE no gene associado ao CYP450. A transcrição do gene é aumentada e mais CYP3A4 é formado. Consequentemente, há um aumento do metabolismo do irinotecano no seu metabolito inativo, o irinotecano oxidado. A quantidade restante de irinotecano para ser metabolizada em SN-38 (o seu
17 metabolito ativo) diminui, resultando em menos SN-38 ativo e uma menor eficácia terapêutica deste agente antineoplásico (3).
4.2.4.2) Recetor constitutivo do androstano (CAR)
Outro recetor nuclear identificado como indutor de enzimas metabolizadoras é o CAR que consiste num recetor capaz de produzir uma resposta biológica na ausência de um ligando, apresentando, assim "atividade constitutiva". Esta atividade constitutiva pode ser inibida por concentrações excessivas dos metabolitos da testosterona, o androstanol e androstenol. O CAR e PXR são membros da mesma subfamília de recetores nucleares (NR1) e partilham 40% de aminoácidos nos seus domínios de ligação ao ligando (LBD) (19).
Contrariamente ao PXR, o CAR localiza-se no citosol e, após sofrer ativação, sofre uma translocação para o núcleo onde se liga ao RXR nuclear, formando o heterodímero CAR-RXR. Assim, este complexo liga-se ao elemento de resposta CAR-RE, que atua como um promotor,
resultando na transcrição dos genes envolvidos (Fig. 4) (18). Os genes-alvo do CAR estão
envolvidos na expressão de enzimas de fase II, tais como: isoformas UGT (UGT1A1, UGT1A6 e UGT1A9), transportadores de efluxo incluindo os OATP’s (OATP1, OATP2 e OATP4), MRP’s (MRP-2, MRP-3), MDR1, o citocromo p450 (CYP2B6, CYP2C9, CYP3A4) e GST-A1 e -A2 (20). Assim, percebe-se que ao afetar e induzir tantos sistemas de enzimas e transportadores, o CAR desempenhe um papel fundamental no metabolismo de xenobióticos e que a sua indução/inibição resulte em interações planta-fármaco.
Figura 4 – Mecanismo de indução do CYP2B via CAR. Quando um substrato se liga ao CAR,
este migra para o núcleo e liga-se ao RXR nuclear, formando o heterodímero CAR-RXR. De seguida, este complexo liga-se ao elemento de resposta CAR-RE, que atua como um promotor, resultando na transcrição dos genes envolvidos (14).
18 4.2.4.3) Recetor de ligação à vitamina D (VDR)
VDR é um recetor que medeia o crescimento celular, a diferenciação e a morte celular, em resposta à 1,25-di-hidroxi-vitamina D3 (3). Schmiedlin-Ren et al. foram os primeiros a demonstrar que o VDR também está envolvido na regulação do CYP3A4 (21). Foi também estabelecida a relação entre o VDR e a indução da expressão do CYP2B6 e CYP2C9 (22). Os ligandos de VDR são, para além da 1,25-di-hidroxi-vitamina D3, o ácido litocólico (ácido biliar secundário), indicando um papel importante do VDR na desintoxicação de ácidos biliares hepatotóxicos (3).
19
5. Resultados
Análise da representatividade da amostra
A representatividade do total analisado está evidenciada na tabela seguinte, onde são quantificados os artigos que referem cada palavra-chave, assim como a respetiva percentagem.
Tabela 4 – Relação entre o número e respetiva percentagem de palavras-chave (e derivados)
e o nº de artigos que as apresentam no seu título.
P alavra -chave (P C ) P lan tas medic ina is Interação Fa rm ac oc iné ti ca A nti ne op lás ico C an cro Ind uç ão C Y P 45 0 R ev isã o S istemá ti ca Nº de artigos que referem a PC 70 25 10 16 16 8 8 15 % de artigos que referem a PC 83 30 12 19 19 10 10 18
A “análise da competência” dos artigos recolhidos para o estudo - que mede a efetividade da contribuição das palavras-chave para cada artigo - encontra-se no gráfico de dispersão que se segue.
Gráfico 1 – Relação entre o nº total de PC presentes e o nº do artigo que as apresenta no
seu título. 0 1 2 3 4 5 0 10 20 30 40 50 60 70 80 90 N º to ta l d e P C p re s e n te s e m c a d a a rt igo Nº do artigo
20 Após a conclusão da pesquisa, verificou-se que a PC com maior ocorrência no título dos artigos era a palavra “plantas medicinais”, quer em língua portuguesa como na sua forma linguística inglesa.
Assumindo este facto, foi ponderado o peso das restantes PC sobre a PC-mãe “plantas
medicinais”, objeto central das amostras, de onde resultou a tabela que se segue.
Tabela 5 – Nº de ocorrências de cada PC nos artigos que igualmente continham a PC-mãe.
Interação Fa rm ac oc iné ti ca A nti ne op lás ico C an cro Ind uç ão C Y P 45 0 R ev isã o S istemá ti ca Plantas medicinais 17 9 15 16 2 4 14
A tabela 6, presente no Anexo II, consiste numa Tabela-resumo que foi elaborada com o objetivo de reunir informações sobre 24 plantas medicinais e as suas possíveis interações com agentes antineoplásicos. Esta tabela surge como resultado de um cruzamento de dados obtidos através de estudos, revisões sistemáticas e literatura diversos.
A tabela 7 resume quais as famílias de enzimas do CYP450 que são induzidas ou inibidas no consumo dos diferentes constituintes isolados da Canábis.
Tabela 7 – Metabolismo dos canabinoides pelo CYP450. Adaptado (65).
Enzimas metabolizadoras Inibidores das enzimas Indutores das enzimas
Canábis fumada 2C9, 2C19, 3A4 3A4, 2B6, 2C9,
2D6 1A2 Tetrahidrocanabinol (THC) 2C9, 3A4 3A4 -- Canabidiol (CBD) 2C19, 3A4 2B6, 2C9, 2D6, 3A4 -- Nabilona 2C9 -- --
Dronabinol 2C9, 3A4 3A4 --
Na tabela 8 é possível observar as contraindicações e precauções associadas ao abuso de Tetrahidrocanabinol (THC) e Canabidiol (CBD), compostos psicoativos encontrados na Canábis.
21
Tabela 8 - Contraindicações e precauções associadas ao abuso de tetrahidrocanabinol (THC) e canabidiol (CBD). Adaptado (65).
Contraindicações Precauções
Idade <25 anos Condução de veículos motorizados
Gravidez ou lactação Uso de equipamento industrial
Esquizofrenia Uso de sedativos e hipnóticos
Psicose derivada de canábis quando
utilizado como estupefaciente recreativo Hipotensão
Função cardíaca comprometida Fumadores intensivos de tabacoa
História de álcool ou abuso de substâncias Uso de fortes inibidores do CYP3A4b
a Risco de artrite induzida por canábis.
b Claritromicina, cetoconazole, indinavir, lopinavir, ritonavir.
Na tabela 9 encontram-se algumas condições com potencial de resposta à terapia com os canabinoides THC e CBD.
A tabela 10 resume quais são os principais tipos de tumores sensíveis à inibição do seu crescimento, induzida pelo consumo de Canábis.
Tabela 9 – Condições com potencial de resposta à terapia com canabinoides. Adaptado (65).
Sintoma-alvo Tetrahidrocanabinol (THC) Canabidiol (CBD)
Dor neuropática +++
Induzido por quimioterapia: Neuropatia periférica Náuseas ou vómitos
++ +++
?
Modelos animais pré-clínicos
Náusea antecipatória + Modelos animais pré-clínicos
Estimulação do apetite ++ ?
Espasticidade / Espasmos +++ +
Inflamação + ++
“Ataque” epilético + +++
Ansiedade + ou - Situações simuladas
Depressão + (adjuvante) Modelos animais pré-clínicos
Condições “malignas” Pré-clínicos Clínicos ++ + ++ ?
22
Tabela 10 – Tumores sensíveis à inibição do seu crescimento induzida por canabinoides.
Adaptado (67).
Tipo de tumor Sistema
experimental Efeito Recetor
Carcinoma pulmonar In vivo (ratinho)
In vitro
↓ Tamanho do tumor;
Inibição do crescimento celular N.D.
Glioma In vivo (ratinho, ratazana) In vitro ↓ Tamanho do tumor; Apoptose CB1, CB2
Epitelioma da tiroide In vivo (ratinho)
In vitro
↓ Tamanho do tumor;
Paragem do ciclo celular CB1
Linfoma / leucemia In vivo (ratinho)
In vitro
↓ Tamanho do tumor;
apoptose CB2
Carcinoma da pele In vivo (ratinho)
In vitro
↓ Tamanho do tumor;
apoptose CB1, CB2
Carcinoma do útero In vitro Inibição do crescimento celular N.D.
Carcinoma da mama In vitro Paragem do ciclo celular CB1
Carcinoma da
próstata In vitro Apoptose CB1 ?
Neuroblastoma In vitro Apoptose VR1
N.D. – não determinado
VR1 – Recetor vaniloide do tipo 1
Tabela 11 - Efeitos biológicos recentemente relatados de Morinda citrifolia (Neem). Adaptado (73).
Efeitos biológicos
Bactericida - Promotor de saúde que inibe a atividade de Escherichia coli; adjuvante no tratamento da úlcera gástrica ao inibir a atividade de Helicobacter pylori
Supressão do efeito citopático das células MT-4 infetadas por HIV
Potencial inibidor da atividade da micobactéria causadora de tuberculose (estudos in vitro) Atividade anticancerígena
Aumento da eficácia terapêutica de fármacos anticancerígenos, como o Taxol Inibição da atividade do oncogene Ras
Inibição da atividade da tirosina quinase
Inibição da transformação celular nas células JB6 presentes na epiderme do ratinho Efeito analgésico
Efeito hipotensor Atividade antioxidante
Efeito antiangiogénico nas veias placentárias humanas Imunomodelador
23
6. Discussão
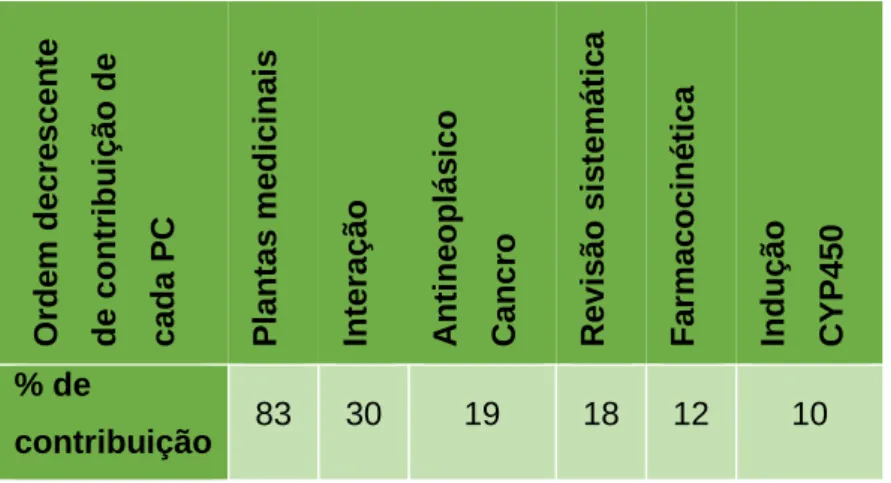
Através da elaboração da tabela 4, foi possível verificar que a maioria dos artigos que contribuíram para a realização deste estudo (cerca de 70 artigos), nomeadamente, da Tabela-resumo das 24 plantas (tabela 6), referia a PC “Plantas medicinais”, ou derivados, no seu título. Assim, este foi o maior universo de análise na amostra, representando 83% do total. A seguinte tabela resume a percentagem de contribuição de cada PC nos artigos selecionados, por ordem decrescente, de acordo com os resultados obtidos.
Tabela 12 – Percentagem de contribuição de cada PC nos artigos selecionados (ordem
decrescente). O rde m de cresc en te de co ntr ibu içã o de ca da P C P lan tas medic ina is Interação Anti ne op lás ico C an cro R ev isã o si s temá ti c a Fa rm ac oc iné ti ca Ind uç ão C Y P 45 0 % de contribuição 83 30 19 18 12 10
Através do gráfico 1, verifica-se que o máximo de PC reunidas no título de um único artigo, foram 4, no artigo nº 27, que contribuiu fortemente para a execução deste estudo. Contudo, a qualidade e efetividade da contribuição dos artigos não esteve diretamente relacionada com o nº de PC presentes no seu título.
A seguinte tabela resume o nº total de artigos que continham uma, duas, três ou quatro PC e derivados, reunidas num único artigo, sendo que a maioria (42%) continha duas PC.
Tabela 13 – Nº total de artigos contendo as PC e respetiva percentagem.
Nº de PC Total de artigos que as contêm % do nº total de artigos 1 25 30 2 35 42 3 23 27 4 1 1
24 A tabela 5 foi elaborada com o objetivo de ponderar o peso das restantes PC sobre a PC-mãe “plantas medicinais”, objeto central das amostras (presente em 83% dos artigos).
Cerca de 17% dos artigos contendo a PC-mãe referiam-se igualmente a interações dessas plantas medicinais, em situações de “cancro” (16%) e, consequentemente, agentes “antineoplásicos” (15%).
Cerca de 14% dos artigos selecionados com a PC-mãe eram “revisões sistemáticas” e cerca de 9% referiam-se a interações “farmacocinéticas”. Do universo de interações farmacocinéticas, 4% estavam associadas à atividade do CYP450, nomeadamente, a situações de “indução” (2%).
Tabela-resumo: 24 plantas medicinais e potenciais interações
A elaboração da tabela 6 (Tabela-resumo: 24 plantas e as suas potenciais interações), presente no Anexo II, foi baseada essencialmente em situações de indução ou inibição das isoenzimas do CYP450, recetores hormonais e proteínas transportadoras de xenobióticos. Toda a informação foi resumida e sintetizada após o cruzamento da informação de diferentes artigos.
Cada planta foi avaliada com base nos mesmos parâmetros: nome científico/comum, família, parte da planta utilizada, principais compostos ativos, indicações terapêuticas da planta medicinal, agente antineoplásico quimioterápico com potencial interação, principais tipos de cancro em que esse antineoplásico é utilizado, sistemas enzimáticos / transportadores / recetores envolvidos na interação, efeitos clínicos/subclínicos da interação, observações. Só assim, foi possível uma análise homogénea das 24 plantas.
As plantas escolhidas consistiram naquelas que, para além de serem as que apresentaram interações mais frequentes na literatura, são atualmente muito utilizadas na alimentação/fitoterapia na Europa, nomeadamente, em Portugal.
As plantas Canábis, Neem e Noni, não são muito utilizadas em Portugal como fitoterápicos. Contudo, o conhecimento dos seus mecanismos de interação com antineoplásicos poderá vir a ser bastante útil para futuras investigações e para os diferentes profissionais interessados por esta área, daí a sua inclusão nesta tabela.
25
7. Conclusão
Os produtos brutos e os produtos acabados à base de plantas medicinais são frequentemente
comercializados como “medicamentos” à base de plantas ou suplementos dietéticos mas,
infelizmente, estes produtos não estão livres de risco e as interações com medicamentos prescritos são uma preocupação crescente e podem ter consequências públicas significativas. Com o aumento do consumo de plantas medicinais para fins terapêuticos, aumenta igualmente a probabilidade de ocorrerem interações entre estas e agentes antineoplásicos quimioterápicos. Contudo, a perceção da interação, por parte do doente ou oncologista, pode não ser facilmente reconhecida.
Atualmente, os efeitos destas plantas sobre a indução ou inibição de enzimas metabolizadoras, transportadores ou recetores destes fármacos, ainda não são totalmente conhecidos e necessitam de mais estudos. Na maioria dos estudos publicados, as plantas foram utilizadas por um período de tempo relativamente curto. Em situações em que ocorre, por exemplo, indução de enzimas metabolizadoras, é fundamental que os estudos sejam feitos a longo prazo, avaliando o efeito do uso crónico destas plantas. Uma das dificuldades destes estudos consiste na correta extrapolação dos dados obtidos em voluntários saudáveis que consomem plantas medicinais, para doentes oncológicos submetidos a uma terapia antineoplásica quimioterápica. No entanto, com base nas informações atualmente disponíveis são várias as plantas que merecem especial cuidado quando tomadas concomitantemente com outra medicação, nomeadamente a antineoplásica, tais como a Erva de São João, Videira, Ginseng, Alho, Equinácea, entre outras, uma vez que estas têm uma forte ação indutora de enzimas metabolizadoras, o que, por um lado, pode causar diminuição da eficácia dos anticancerígenos, como uma maior toxicidade no caso de serem pró-fármacos.
A descoberta do papel dos recetores nucleares PXR, CAR, e VDR pode ser uma ajuda no desenvolvimento de novos métodos para estudar as potenciais interações destas plantas. A dificuldade reside no facto de que, em geral, as plantas medicinais conterem na sua composição uma mistura complexa de compostos farmacologicamente ativos, de composição variável e pouco definida. Outro aspeto relevante reside no facto de ainda existirem poucos estudos a avaliar qual a dose crítica a partir da qual ocorrem, necessariamente, interações planta-fármaco.
A avaliação dos dados obtidos com métodos in vitro e in vivo em ensaios clínicos bem desenhados é, portanto, de extrema importância. Por conseguinte, é necessária uma investigação mais aprofundada e que deve ser encorajada de modo a elucidar o papel das plantas medicinais nas interações medicamentosas indesejadas, de modo a evitar um tratamento insuficiente ou toxicidade indesejada em doentes oncológicos. Do mesmo modo, devem ser estabelecidas diretrizes para o uso destas plantas.
26 É fundamental que, nesta fase em que o cancro é apontado como “a doença” do século XXI, os médicos oncologistas sejam encorajados a discutir o uso das plantas medicinais com os seus doentes e terem consciência das possíveis interações planta-fármaco. Um dos exemplos mais citados e conhecidos é o caso da Erva de São João, que muitos doentes utilizam para o tratamento de depressão ligeira a moderada que, por vezes, surge como consequência de uma situação de cancro. O seu uso em simultâneo com a terapia antineoplásica pode ser crucial para a ineficácia do tratamento ou aumento da sua toxicidade.
Até agora, os produtos à base de plantas foram legalmente ignorados ou classificados como suplementos dietéticos. Isso isenta muitos destes produtos de requisitos de segurança, eficácia e regulação. Assim, é importante estar ciente de que a maioria das plantas medicinais está fora do quadro regulatório, havendo poucos estudos ao nível da sua segurança, eficácia ou padrões de fabrico e controlo.
Considerando o pouco conhecimento que ainda existe ao nível de como se processam as interações planta-fármaco, a correta comunicação de tais casos, a vigilância cuidadosa, a avaliação baseada em evidências e as revisões constantemente atualizadas são essenciais para promover uma melhor compreensão desta área.
27
8. Bibliografia
1. WHO. General Guidelines for Methodologies on Research and Evaluation of Traditional
Medicine. Geneva; 2000. p. 74.
2. Posadzki P, Watson L, Ernst E. Herb-drug interactions: An overview of systematic
reviews. Br J Clin Pharmacol. 2013;75(3):603–18.
3. Meijerman I, Beijnen JH, Schellens JHM. Herb-drug interactions in oncology: focus on
mechanisms of induction. Oncologist. 2007;11(7):742–52.
4. Brandão HN, David JP, Couto RD, Nascimento JAP, David JM. Química e farmacologia
de quimioterápicos antineoplásicos derivados de plantas. Quim Nova.
2010;33(6):1359–69.
5. Oliveira A, Costa T. Interações farmacocinéticas entre as plantas medicinais Hypericum
perforatum, Gingko biloba e Panax gingseng e fármacos tradicionais. Acta Farm Bonaer. 2004;23(4):567–78.
6. Fukumasu H, Latorre AO, Bracci N, Górniak SL, Dagli MLZ. Fitoterápicos e potenciais
interações medicamentosas na terapia do câncer. Rev Bras Toxicol. 2008;21(2):49.
7. Kansara M, Jani A. Possible interactions between garlic and conventional drugs : a
review. Pharm Biol Eval. 2017;4(2):73–81.
8. Cho HJ, Yoon IS. Pharmacokinetic interactions of herbs with cytochrome p450 and
p-glycoprotein. Evidence-based Complement Altern Med. 2015;10.
9. Mazzari A, Prieto J. Herbal medicines in Brazil: Pharmacokinetic profile and potential
herb-drug interactions. Front Pharmacol. 2014;1–12.
10. Martínez I, Garcia A, Rodeiro I, Morón F. Plantas medicinales reportadas con
reacciones adversas en Cuba: Potenciales interacciones con fármacos de uso convencional. J Pharm Pharmacogn Res. 2015;3(2):37–44.
11. Oga E, Sekine S, Shitara Y, Horie T. Pharmacokinetic Herb-Drug Interactions: Insight
into Mechanisms and Consequences. Eur J Drug Metab Pharmacokinet. 2016;41(2):93–108.
12. Rahimi R, Abdollahi M. An update on the ability of St. John’s wort to affect the
metabolism of other drugs. Expert Opin Drug Metab Toxicol. 2012;8(6):691–708.
13. Yu C, Wu P, Hou Y, Lin S, Tsai S, Chen C, et al. Quercetin and rutin reduced the
bioavailability of cyclosporine from Neoral, an immunosuppressant, through activating P-glycoprotein and CYP 3A4. J Agric Food Chem. 2011;59(9):4644–8.
14. Sukkasem N, Jarukamjorn K. Herb-drug interactions via modulation of cytochrome
P450 enzymes. 2016;12(3):1–15.
15. Moore L, Goodwin B, Jones S, Wisely G, Serabjit-Singh C, Willson T, et al. St. John’s
wort induces hepatic drug metabolism through activation of the pregnane X receptor. Proc Natl Acad Sci USA. 2000;97(13):7500–2.