CRISTIANE DE SOUZA CRUZ
AVALIAÇÃO DA ATENUAÇÃO NATURAL DE
HIDROCARBONETOS ALIFÁTICOS CLORADOS
EM UM AQÜÍFERO CONTAMINADO
Dissertação apresentada ao Departamento de Engenharia Ambiental da Universidade Federal de Santa Catarina para obtenção do título de Mestre em Ciências em Engenharia Ambiental na área de Tecnologia de Saneamento Ambiental.
Orientador: Henry Xavier Corseuil
FLORIANÓPOLIS
SANTA CATARINA
CRISTIANE DE SOUZA CRUZ
Dissertação submetida ao corpo docente do Programa de Pós-Graduação em Engenharia Ambiental da Universidade Federal de Santa Catarina como parte dos requisitos necessários para obtenção do grau de
MESTRE EM ENGENHARIA AMBIENTAL na Área de Tecnologias de Saneamento Ambiental.
Aprovado por:
Prof*. Di^jàejane Helena Ribeiro da Costa (Coordenadora)
(M * A 0. fo d iJ L â
Hugo Moreira Soares, PhD.
"Os homens da cidade dissevaM a éliseu: eis que é bent situada esia cidade,
como oê e Meu senho?, perém as águas são más, e a tewa é estéril.
£íe disse: trastei-Me m t ptate nooo e ponde nele sal. <£ lhe treuxefaM.
èntãe saiu ele ae Manancial das águas e deitou sal nele; e disse: assim diz o temei saudáoeis estas águas; fá não precederá daí Morte neM
esterilidade. cJ-iea*aM, pois, saudáoeis aquelas águas, até ae dia de hoje,
segunde a palaora que £liseu tinha dite."
A Deus por sua fidelidade comigo todos os dias da minha vida.
A meu pai {in memorium), minha mãe Josefina, meus irmãos Luiz Sérgio e Roberto, meu esposo Mario Sergio, que sempre me incentivaram e me apoiaram na carreira acadêmica.
À CETREL S/A, Empresa de Proteção Ambiental do Pólo Petroquímico de Camaçari - Ba sob a direção do Superintendente Carlos Eugênio de Menezes e Diretor Técnico Renato Vitoria, que, através de sua Política Empresarial: Programa de Complementação Educacional, financiou e apoiou este estudo.
Ao meu orientador, Prof. Henry Xavier Corseuil, por toda dedicação e orientação durante o período do mestrado.
À Prof2 e amiga, Iara Brandão de Oliveira, por toda ajuda, compreensão, incentivo e
apoio, antes durante e com certeza após o mestrado.
Ao Prof. Antônio José da Silva Saraiva por toda ajuda e atenção.
A Demosthenes de Carvalho, pela credibilidade, confiança, apoio e incentivo.
A Paulo Penalva, por toda ajuda, apoio, incentivo e atenção.
A todos os colegas e amigos da CETREL S/A: Gedison Vilela, Álvaro Goés, Washington Ventura, Artur Passos, Paulo Freire, Rosa Dantas, Elizabeth Couto, Neuza Neves, Célia Costa, Fernando Saback, Pedro Cavalcante, Eduardo Fontoura, Digas, Dasivônia, Maria do Carmo, Ana Pinho, Cristian, Herval, Eduardo Rosada, Maira... pelo constante apoio e incentivo.
A todos os professores, funcionários e colegas da Pós-Graduação e da Graduação de Engenharia Ambiental da Universidade Federal de Santa Catarina.
A colega de quase todos os trabalhos, Rosana Sales, pelo companheirismo e amizade essenciais principalmente quando estar-se longe da família.
Ao Prof, visitante David Franco, por sua disponibilidade em ajudar-me.
LISTA DE FIGURAS... ... i
LISTA DE QUADROS... iii
LISTA DE TABELAS... v
LISTA DE ABREVIATURAS... vi
LISTA DE SÍMBOLOS... viii
RESUMO... xi
ABSTRACT... xii
CAPÍTULO I 1 INTRODUÇÃO... 1
CAPÍTULO n 2. REVISÃO BIBLIOGRÁFICA... ... 3
2.1 Contaminantes... 3
2.1.1 Hidrocarbonetos alifáticos clorados... 3
2.1.2 Toxicologia... 6
2.2.Atenuação natural... 8
2.3 Mecanismos de atenuação natural não destrutivos... 9
2.3.1 Introdução... 9
2.3.2 Advecção... 9
2.3.3 Dispersão hidrodinâmica... 10
2.3.4 Sorção... 12
2.3.5 Diluição ou recarga... 15
2.3.6 Volatilização... 16
2.4 Mecanismos de atenuação natural destrutivos... 16
2.4.1 Introdução... 16
2.4.2 Transformações de compostos orgânicos em diferentes condições de oxidação.. 20
2.4.3 Transformações bióticas... 21
2.4.4 Transformações abióticas... 26
3.1 Área de contaminação... ... 32
3.1.1 Contextualização... 32
3.1.2 Histórico da área contaminada... 39
3.1.3 Informações hidrogeológicas... 42
3.2 Sistema de monitoramento... 44
3.2.1 Implantação de poços de monitoramento e furos de sondagens... 44
3.2.2 Definição de parâmetros para monitoramento... 44
3.2.3 Métodos de coleta... 45
3.2.4 Método de análise para compostos semi-voláteis... 45
3.2.5 Método de análise para compostos voláteis... 46
3.2.6 Método de análise para compostos inorgânicos... 46
3.3 Informações microbiológicas... 46
3.4 Modelo matemático... 47
CAPÍTULO IV 4. RESULTADOS E DISCUSSÕES... 48
4.1 Introdução... 48
4.2 Dados disponíveis da área de estudo... 49
4.2.1 Resultados analíticos para água subterrânea... 49
4.2.2 Contagem microbiana... 52
4.2.3 Hidrogeologia do aqüífero... 53
4.3.Considerações... 54
4.3.1 Fontes de contaminantes... 54
4.3 .2 Hidráulica da água subterrânea... 54
4.3 .3 Localização da pluma de contaminantes... 54
4.4 Análise de risco para distribuição e transporte do 1,2-dicloroetano... 55
4.5 Discussões... 59
4.5.1 Indicadores de biodegradação... 59
5.2 Recomendações... 69
CAPÍTULO VI
6. REFERÊNCIAS BIBLIOGRÁFICAS... 71
APÊNDICE A... 80 APÊNDICE B... 82 APÊNDICE C... 8 8
Figura 2.1 Comportamento de DNAPLs em aqüífero... 5
Figura 2.2 Reações de oxi-redução com diferentes receptores de elétrons considerando as condições, pH = 7, T = 25 °C e Eh (mV)... 19
Figura 2.3 Caminho teórico de oxidação de TCE por monoxioxigenase e dioxigenase.... 22
Figura 2.4 Oxidação aeróbia de 1,2-DCA... 23
Figura 2.5 Degradação aeróbia de clorobenzeno... 23
Figura 2.6 Caminho proposto para cometabolismo de 1,3-Diclorobenzeno por
Alcaligens OBB65... 24
Figura 2.7 Desclorinação redutiva de PCE... 25
Figura 2.8 Transformações em meio anaeróbio de 1,1,1-TCA, (A) abiótica e (B) biótica 27
Figura 3.1 Localização da Cetrel S/A, na seqüência, Brasil, Bahia, Região Metropolitana de Salvador, Pólo Petroquímico de Camaçari e Cetrel... 32
Figura 3.2 Disposição dos valos na área de estudo nos limites do SRS... 33
Figura 4.1 Extensão horizontal da pluma de contaminantes exibindo BTEX, alifáticos e aromáticos clorados no ano de 1998... 55
Figura 4.2 Tela/interface para entrada de dados do BIOSCREEN... 57
Figura 4.4 Resultado da análise de risco para o 22 caso... 58
Figura 4.5 Resultado da análise de risco para o 3- caso... 58
Figura 4.6 Resultado da análise de risco para o 4° caso... 59
Quadro 2.1 Identificação de alguns hidrocarbonetos alifáticos clorados e alguns
aromáticos clorados de interesse para este trabalho... 3
Quadro 2.2 Alguns microrganismos capazes de degradar compostos orgânicos... 17
Quadro 2.3 Tendências durante a biodegradação para concentrações de contaminantes, receptores de elétrons, produtos metabólicos e alcalinidade... 2 0 Quadro 2.4 Transformações bióticas e abióticas de compostos orgânicos sintéticos... 20
Quadro 3.1 Valo orgânico 6... 34
Quadro 3.2 Valo orgânico 7... 34
Quadro 3.3 Valo orgânico 8... 35
Quadro 3.4 Valo orgânico 9... 35
Quadro 3.5 Valo orgânico 10... 35
Quadro 3.6 Valo orgânico 11... 36
Quadro 3.7 Valo orgânico 12... 36
Quadro 3.8 Valo orgânico 13... 37
Quadro 3.9 Valo orgânico 14... 37
Quadro 3.11 Valo orgânico 18... 38
Quadro 3.12 Valo orgânico 20... 39
Quadro 3.13 Orientação para coleta de amostras de acordo com parâmetros a serem analisados... 45
Tabela 2.1 Propriedades físicas e químicas de alguns hidrocarbonetos alifáticos clorados e a água... 4
Tabela 2.2 Produção de alguns hidrocarbonetos alifáticos clorados, nos E.U.A. (tonelada x 1 04)... 6
Tabela 2.3 Dados toxicológicos de alguns hidrocarbonetos clorados... 7
Tabela 4.1a Resultados analíticos para contaminantes voláteis em amostras de água em poços de monitoramento e furos de sondagens no ano de 1998... 50
Tabela 4. lb Resultados analíticos para parâmetros físico-químicos e indicadores bio- geoquímicos em amostras de água em poços de monitoramento e furos de sondagens no ano de 1998... 51
Tabela 4.2 Contagem de microrganismos no solo da zona insaturada para furos de sondagens na área dos valos no SRS... 52
Tabela 4.3 Contagem de microrganismos na água subterrânea do aqüífero freático da área dos valos no SRS... 52
Tabela 4.4 Nutrientes e parâmetros físico-químicos na zona insaturada da área dos valos no SRS... 53
1.2-DC B 1,2 diclorobenzeno
1.2-DC A 1,2 dicloroetano
1.2-DC...E 1,2 dicloroeteno
1,4-DCB... 1,4 diclorobenzeno
B... benzeno
CA... cloroetano
CAHs... hidrocarbonetos alifáticos clorados
CAS... Chemical Abstracts Service
CB... clorobenzeno
CF... clorofórmio
Cond... condutividade
CT... tetracloreto de carbono
DNAPLs...dense nanoqueous-phase liquid
E... etilbenzeno
F... fenol
F-2EH... . ftalato de bis 2etil hexila
MC... cloreto de metileno
OD... oxigênio dissolvido
SMA... Sistema de Monitoramento Ambiental
SNC... sistema nervoso central
SRS... Sistema de Resíduos Sólidos
SSW... System of Solid Wastes
STD... sólidos totais dissolvidos
T... tolueno
TCA... tricloroetano
TCE... tricloroeteno
U.S. EPA... United States Environmental Protection Agency
VC... cloreto de vinila
Taxa de decaimento de primeira ordem [T 1]
Coeficiente empírico (adimensional, faixa 0 , 0 1 à 0,5).
Porosidade [L3/M]
Densidade da maior parte do aqüífero [M/L3]
Porosidade efetiva [L^/L^]
Nano molar
Velocidade de transporte na direção x [L/T]
Dispersividade [L]
Nível crítico de matéria orgânica (fração de massa)
Fração de carbono orgânico total (mg carbono orgânico/mg solo)
Área da superfície do componente mineralógico da matriz do aqüífero
Número de sítios de sorção (máxima quantidade de concentração sorvida)
Concentração do soluto [M]
Concentração do contaminante sorvido (massa contaminante / massa solo, (ig/g)
Concentração no ar (atm)
Ci... Concentração de contaminante dissolvido (jig/ml)
CO3 ' 2... alcalinidade expressa em carbonato
Cw... Concentração na água (mol/1)
D*... Coeficiente efetivo de difusão molecular [L2/T]
D... Dispersão hidrodinâmica
dC/dt... Gradiente de concentração variando com o tempo [M7T]
dC/dx... Gradiente de concentração variando com a distância [M/L3/L]
Df... Coeficiente de difusão [L2/T]
dH/dL... Gradiente hidráulico [L/L]
Dx... Dispersão hidrodinâmica na direção x [L2/T]
Eh... Potencial de oxi-redução
F... Fluxo de massa do soluto [M7T]
F-2EH... ftalato de bis 2etil hexila
Fe... ferro
HCO3'... alcalinidade expressa em bicarbonato
K... Constante de equilíbrio para reação de sorção (ng/g)
Kh... Constante da lei de Henry (atm m3/mol)
Khid... Condutividade hidráulica [L/T]
Kow... Coeficiente de partição octanol/água
Lp... Comprimento da pluma [L]
Mn... manganês
NO3... nitrato
pH... pH
ppb... ... Concentração em parte por bilhão
ppm... Concentração em parte por milhão
Qs... Termo para reações envolvendo perda ou produção de soluto [M3/T]
R... Coeficiente de retardação [adimensional]
SO4’2... sulfato
T (°C)... ... Temperatura em graus Célcius
T... Tempo [T]
RESUMO
Os hidrocarbonetos alifáticos clorados (CAHs) são encontrados na composição de diversos produtos petroquímicos além de serem usados como solventes. O inadequado manuseio e disposição desses químicos e dos seus resíduos levam à introdução dos CAHs no meio ambiente. Em sítios contaminados com CAHs, o caminho primário de contaminação é a água subterrânea, devido às propriedades destes compostos, conferindo-lhes baixa tendência a adsorverem-se e proporcionando-lhes transporte essencialmente vertical. A estas características são somados os diversos efeitos nocivos à saúde humana, causados pelos CAHs que são tóxicos carcinogênicos. Na remediação dos aqüíferos, contaminados por CAHs, têm sido desenvolvidos estudos e trabalhos que comprovam a ação de mecanismos naturais destrutivos ou não destrutivos físicos, químicos e biológicos na redução da massa, toxicidade, mobilidade, volume ou concentração destes contaminantes em solo e águas subterrâneas. Este conjunto de mecanismos é chamado de “atenuação natural”.
Chlorinated aliphatic hydrocarbons (CAHs) are found in the composition of several petrochemical products, besides they are used as solvents. Unsuitable handling and storage of such compounds and its residues lead to an input of CAHs in the environment. In sites contaminated by CAHs the primary contamination way is ground water, due to the properties of these compounds which have low tendency to be adsorbed and that provides them with essentially vertical transport. It is added to these features many effects harmful to human health caused by CAHs which are toxic carcinogenics. It has been developed studies and papers about remedial of aquifer contaminated by CAHs, which prove the action of destructive and non-destructive, physical, chemical and biological mechanisms on reduction of mass, toxicity, mobility, volume or concentration of these contaminants in soil and ground water. This set of mechanisms is called “natural attenuation”.
CAPÍTULO I
1 INTRODUÇÃO
Uma variedade de compostos químicos, potenciais contaminantes, inorgânicos e orgânicos compõem os resíduos industriais e municipais. Entre eles podem ser citados hidrocarbonetos alifáticos e aromáticos halogenados ou não.
Os hidrocarbonetos alifáticos clorados (CAHs) são componentes químicos significantes em resíduos perigosos industriais, sendo disseminados em aterros, lagoas de estabilização e sítios de disposição de resíduos (U.S. EPA, 1992). Os mais comuns são: tetracloreto de carbono (CT), tetracloroeteno (PCE) tricloroetano (TCA), tricloroeteno (TCE), dicloroetano (DCA), dicloroeteno (DCE), cloreto de vinila (VC), cloreto de metileno (MC), cloroetano (CA) e clorofórmio (CF).
O amplo uso industrial dos CAHs, como solventes e matéria prima na manufatura de diversos produtos petroquímicos, justifica sua alta produção. Como conseqüência aumenta a probabilidade de introdução de tais compostos como contaminantes no ambiente, seja por acidentes no processo de produção e utilização ou com o inadequado manejo dos resíduos municipais e industriais. No passado, os solventes clorados eram usados e descartados indiscriminadamente no ambiente, atualmente influenciam a qualidade de recursos hídricos potáveis; prevalecendo como contaminantes químicos em águas subterrâneas e solos contaminados.
Muitos dos CAHs exercem efeitos nocivos aos seres humanos, incluindo irritação e depreciação do sistema nervoso central (SNC) (REDD e KRISHNA, 1973). Na temperatura ambiente, esses compostos são líquidos que, em contato com a pele, podem causar irritações, mas por serem voláteis; seus vapores inalados podem causar irritação no trato respiratório e também nos olhos (REID e KRISHNA, 1973), por exemplo o CT é um tóxico livre potente e um hepatocarcinogênico (DOULL e KLAASSEN, 1993), cujo limite máximo tolerável em água potável nos EUA é 5 ng/L (REINHOLD, 1984) e no Brasil, 3 |J.g/L (BRASIL, 1990b). Esses compostos, quando metabolizados, podem também gerar produtos carcinogênicos como o cloreto de vinila (VC) (VOGEL e McCARTY, 1985).
relativa resistência a transformações por microrganismos naturais, acumulando-se no ambiente (U.S. EPA, 1992).
A produção e uso de CAHs e seus visíveis riscos à saúde humana têm por um século instigado o estudo de mecanismos naturais físicos, químicos e biológicos que influenciam no transporte e redução de massa destes contaminantes em aqüíferos; “atenuação natural” (RIFAI, 1998). Como conseqüência destes estudos, muitos trabalhos já foram publicados, onde a investigação da ocorrência e potencial da atenuação natural ou intrínseca remediação de CAHs têm sustentado o uso deste processo de remediação passiva e de baixo custo; como exemplo: BOSMA et al., (1997), LEETHEM e LARSON, (1997) e CHAPELLE e BRADLEY (1998). Contudo, se a investigação da atenuação natural não comprova sua existência com potencial para reduzir a contaminação a limites aceitáveis pela legislação vigente, as informações geradas na investigação subsidiam a escolha da tecnologia de remediação mais adequada e de menor custo (WIEDEMEIER et al., 1996), o que justifica a avaliação da atenuação natural.
CAPÍTULO n
2 REVISÃO BIBLIOGRÁFICA
2.1 Contaminantes
2.1.1 Hidrocarbonetos alifáticos clorados
Os hidrocarbonetos alifáticos clorados são compostos orgânicos da família dos alcanos e alcenos, possuindo entre um e dois átomos de carbono (haletos de alquil) que têm átomos de hidrogênio substituídos por átomos dé cloro (CHAPELLE, 1993), o Quadro 2.1 apresenta os nomes registrados no Chemical Abstract Service - CAS para alguns hidrocarbonetos alifáticos e aromáticos clorados, de interesse para este trabalho.
Quadro 2.1: Identificação de alguns hidrocarbonetos alifáticos clorados e alguns aromáticos clorados de interesse para este trabalho.
VlticM.itnr.i ( Imiiik.iI \ltsti.uIsSíhki
nonii' ((' \S) miincro( -\S Oufios noims molii lll.ll1 oi iniil.i
PCE tdracloroeteno 127-18-4 perclorodileno; tetracloroetileno c2cu
7>ans-l,2-DCE O s-U -D C E
(E)-l,2-ticloroeteno 156-60-5
156-59-2
/ra«í-l,2-dicloroàeno; rran.s-1,2-dicloroetileno cis-l,2-diclórodeno; c/i-l_,2-dicloroetileno
CjHjCIí
C2H,C12
VC cloroeteno 75-01-4 clord.o de vinila; cloroetileiio c2h3ci
1,1,1-TCA 1,1.1-tricloroetano 71-55-6 c2h3c i3
1,2-DCA 1,2-dicloroetano 107-06-02 c2h4c i2
CA cloroetano 75-00-3 c2h5c l
CF triclorometano 67-66-3 clorofórmio CHCU
CT t&raclorometano 56-23-5 tetracloreto de carbono CC14
MCW diclorometano 75-09-2 dicloro metileno; dicloreto de metileno c h2c i2
CB clorobenzeno 108-90-7 C6H;C1
1,2-DCB 1,2-dicloroben zeno 95-50-1 o-diclorobenzeno CfiH4Cl2
1,4-DCB 1,4-diclorobenzeno 106-46-7 p-diclorobenzeno C6H4C12
□ Alifáticos clorados □ Aromáticos clorados
Fonte: AFCEE (1996); °> NORRIS et al. (1993).
as reações de halogenação são exotérmicas, liberando energia que mantém a seqüência de reações até a substituição de três átomos de hidrogênio por átomos de cloro (CHAPELLE, 1993; LU, 1996).
A presença do átomo de cloro, nessas moléculas, determinará propriedades físicas e químicas regidas pela quantidade e posição ocupada por esses átomos. O cloro, sendo um halogênio altamente eletronegativo, causa uma polaridade na ligação cloro-carbono, propiciando certa solubilidade em água, mas, devido ao seu grande raio atômico, dificulta as transformações químicas e biológicas desses solventes. Os compostos policlorados, altamente oxidados, são susceptíveis à redução por microrganismos (VOGEL et al., 1987). O átomo de cloro também os toma mais densos do que a água, e são quase todos líquidos à temperatura ambiente, denominados DNAPLs (fase líquida não aquosa mais densa do que a água) (VOGEL et al., 1987; CHAPELLE, 1993). A tabela 2.1 lista algumas das propriedades físicas e químicas atribuídas aos DNAPLs.
Tabela 2.1: Propriedades físicas e químicas de alguns hidrocarbonetos alifáticos clorados e a água.
( orn postos DcnsiduiU' fetaiT )(° c )
l*oiito d f fusão
( " n
Ponto dc fhulicílo 760mtnHg (°C)
rro ssíi» do v:ipoi 760mrnIIg
(25°C)
S,iluhiliJ.uk-(mg/lj atin iiiViiiol 'CJK „ 0/KkK.«)(25°C) L o g K „ w
PCE 1,625 -19® 1 2 1® 1 8,4 9» 150 l,49.10'2<m) 359<0,c 2 , 8 8
trans- 1,2-DCE 1,214 d* o 3 48-48,5® 340<c) 400 6,72.10'3(i) 80,2(o)c 2,06w
d s-l,2-D C E 1,214 -80,5® 60,3® 2 0 0<C)A 400 3,37.10J(i) 80,2(o)c l ,8 6(c)
v c gás -153, S® -13,37(l’) 2660<c) 2.700(a) l,07.10‘2(i) 2,45w 0,60
1,1,1-TCA 1,325 -30,4® 74,1® 123,7(c) 950 8 . 1 0"3™ 183® 2,49
1,2-DCA 1,253 -35,36® 83,47<í) 78, 7®b 8.700 9,77.1o"4® 33-152® l,48(e)
CF 1,485 -63,5® 6 1 , ^ 246(l) 8 . 2 0 0 4,35. IO'3® <34® l,97(i)
CT 1,595 -23® 76,54® 113,8(l,) 800(a) 3,04.'2(k) 1 1 0®c 2,64®
M C 1,325 .9 7(b) -23,T*”’ 4309,T*00 13.000 2,4.\0'm 480» 0,91(e)
água l,0 0 0(n) 0(”) 1 0 0(n) 1 0 0(”> Infinitatn)
Fonte: NORRIS et al.(1993); ("'SAX, N. I. (1984). w H OW ARD , P . H (1990a) apud <c) RID DICK J.A. et al.(1986); <d) LYM AN, W . J. et al (1982); (tl H A N SC H C. e LEO A. J. (1985). (í) HOW ARD, P. H. (1990b; apud® B O U B L K T. K. etal(1984); DAUBERT T. E. e D AN N ER R. P. (1 9 8 5 );® D ILLIN G W. L. (1977); ® HINE J. e M OOKERJEE P. K.; J. (1975); <k) GOSSETT J. M . (1987); ® GALLANT R. W. (1966); (m> ROUBERTS P. V. et al.(1984). DAVID, R. L. (1 9 9 6 )<0) W IEDEM EIER et al. (1996) apud SENG et al.(1 9 9 2 );<w KNOX etal(1993); A 35 °C. B 20 °C. c 30 "C.
Kow), indicam baixa tendência em adsorverem-se em minerais do solo e matéria orgânica, e por possuírem relativa solubilidade em água, são levados a um caminho primário de concentração que é a água subterrânea, onde a taxa de volatilização é bastante reduzida. Esses DNAPLs seguem um transporte essencialmente vertical até atingir uma camada geológica de baixa permeabilidade ou impermeável, de difícil acesso para processos de remediação, elevando os custos para removê-los (SCHWARZENBACH et al., 1993). Havendo fraturas nas camadas impermeáveis ou de baixa permeabilidade, não se tem nenhuma certeza sobre o comportamento destas substâncias, que são transportadas por grandes profundidades no aqüífero, onerando a aplicação das tecnologias de remediação mais indicadas para as situações analisadas (U.S. EPA, 1992). A Figura 2.1 ilustra o comportamento durante a trajetória destas substâncias em um aqüífero arenoso seguido de argiloso.
Silte Cristalino Contaminantes
Dissolvidos
Residual
Fluxo da Água Sübterrânea
Saturado _ DNAPLParado AQÜÍFERO
ARENOSO
________________________ ARGILA
Fonte: NORRIS (1993) apud WATERLOO CENTER FOR GROUNDWATER RESEARCH (1989)
Figura 2.1: Comportamento de DNAPLs em aqüífero.
-é usado como inseticida e na manufatura de tintas; o cloroeteno - (cloreto de vinila) -é freqüentemente usado na manufatura de polímeros polivinílicos (LU, 1996). Devido ao seu vasto uso, esses compostos clorados eram fabricados anualmente em grandes quantidades nos países industrializados. Como exemplo, na Tabela 2.2, é apresentada a produção de alguns alifáticos clorados nos E.U.A..
Tabela 2.2: Produção de alguns hidrocarbonetos alifáticos clorados, nos E.U. A. (tonelada x 1 0^).
( (impostos 1961
1965
1966
1970 1971IIP ? 1976
1977 ; i |||||j l § |||
1978 l l l l l j l l l l l
1979 19X11 1981 1982
CF 3.6 9.1 11.6 13.2 13.7 15.8 16.1 16.0 18.3 13.5
CT 21.8 36.5 45.9 38.9 36.7 33.4 32.4 32.1 32.9 nd
1,2-DCA 82.1 234.8 379.2 264.6 498.7 498.9 534.9 503.7 452.3 nd
1,1,1-TCA nd 14.0 21.9 28.6 28.8 29.2 32.5 31.4 27.8 25.0
CA 26.6 23.1 28.1 30.4 27.8 24.5 26.4 17.9 14.7 13.1
VC 63.8 142.1 223.1 257.5 271.5 315.8 289.7 293.2 311.7 nd
PCE 14.2 27.0 32.3 16.3 27.8 32.9 35.1 34.7 31.3 nd
Fonte: U.S. EPA (1992).
2.1.2 Toxicologia
Os registros de danos á saúde humana oriundos de solventes orgânicos, alifáticos e aromáticos clorados são vastos.
As principais vias de contaminação por esses solventes orgânicos são respiratória e cutânea, devido às propriedades físicas de tais compostos, baixo ponto de fusão e alta pressão de vapor, conferindo-lhes o estado de líquido volátil em temperatura ambiente; havendo exceções como o cloreto de vinila e o cloreto de metila que; a temperatura ambiente, são gases. Desta forma, ficam vulneráveis a pele, as mucosas e o trato respiratório que sofrem irritações e lesões (REID e KRISHNA, 1973).
É possível que ocorram interações entre os diferentes solventes por biotransformações, quando simultaneamente presentes no organismo humano, elevando a atividade de citocromas e iso-ezimas; onde um solvente potencializa o efeito tóxico de outro, ou diminui este efeito (LU, 1996 apud ANDREWS etal., 1977).
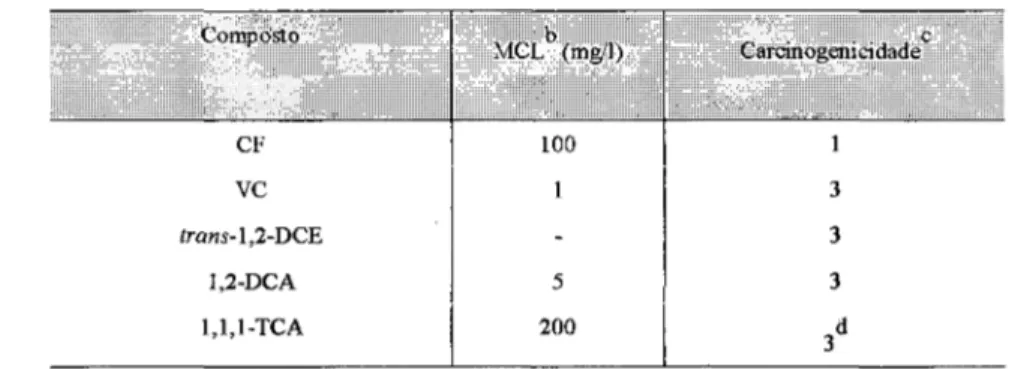
Alguns efeitos tóxicos específicos de solventes aromáticos e alifáticos clorados são comprovados. Sobre o fígado, necroses, cirroses e câncer, que são induzidos por metabólicos reativos desses solventes (e.g. o metabólico freqüente do tetracloreto de carbono é o radical triclorometil, hidrocarbonetos aromáticos clorados são seus epóxidos e o do clorofórmio é o fogênio) (REID e KRISHNA, 1973). Sobre os rins, o clorofórmio e o tetracloreto de carbono são nefrotóxicos em adição sendo hepatotóxicos. Sobre o sistema vascular, o clorofórmio causa arritmia cardíaca conseqüência da sensitização do miocardio (REID e KRISHNA, 1973). Os níveis máximos de contaminação e taxas de toxicidade para alguns alifáticos clorados são apresentados na Tabela 2.3.
O cloreto de vinila, que é encontrado como composto original em plumas de contaminantes de solventes clorados ou como produto intermediário da deshalogenação redutiva de etenos policlorados em condições anaeróbias, é classificado como tóxico e carcinogênico para humanos, sendo listado como poluente prioritário pela Environmental Protection Agency (U.S. EPA) nos Estados Unidos da América (EUA) (REID e KRISHNA,
1973).
Tabela 2.3: Dados toxicológicos de alguns hidrocarbonetos alifáticos clorados.
1 mnpt'Mo MCI (mg,l)h Caiomom.-iiiculadc’
CF 100 1
VC 1 3
Írafí.s-1,2-DCE - 3
1,2-DCA 5 3
1,1,1-TCA 200 3d
k Nível de contaminação máxima (NORRIS et al., 1993 apud Specia Bulletin EDB, 1984).
c (U.S. EPA, 1992) = é um químico carcinogênico; (DOULL e KLAASSEN, 1993) = o químico provavelmente é carcinogênico.
WIEDEMEIER et al., 1996 apud OSWER, 1996) como:
“(9 termo “atenuação natural" é referido a processos que ocorrem naturalmente no
ambiente em solos e águas subterrâneas sem que haja intervenção humana para reduzir a massa, toxicidade, mobilidade, volume ou concentração de contaminantes nestes meios. Esse processo em sítio inclui biodegradação, dispersão, diluição, adsorção, volatilização, e
estabilização ou destruição química ou biológica de contaminantes. ”
Alguns sinônimos são usados para atenuação natural: remediação intrínseca, biorremediação intrínseca, restauração natural e biorremediação passiva.
O processo específico de atenuação natural inclui mecanismos não destrutivos e destrutivos. Os não destrutivos reduzem as concentrações dos contaminantes sem diminuir a sua massa total: diluição, advecção, dispersão hidrodinâmica, sorção, adsorção, volatilização e recarga. Os mecanismos destrutivos reduzem as concentrações e massas dos contaminantes por degradações bióticas e abióticas. As transformações bióticas têm particular importância como referência para atenuação natural, por serem mais rápidas e oferecerem o maior potencial para remoção de massa e destruição de contaminantes; mas exigem condições ambientais favoráveis; além de nutrientes e população microbiana (BUSCHHECK e O’REILLY, 1997).
A contribuição de cada mecanismo de atenuação natural e suas taxas dependem das características físicas e químicas do local contaminado e do conhecimento prévio das propriedades dos contaminantes. Assim, é possível prever os processos físicos e químicos que governam o local contaminado. Usando protocolos baseados em princípios científicos corretos, é possível quantificar os mecanismos de atenuação natural, determinando entre eles o mais importante (WIEDEMEIER, 1997). Este caminho permite que cada mecanismo de atenuação possa ser avaliado quanto ao custo e efeito. Desta forma, o estudo pode subsidiar a decisão, se a atenuação natural é solução para a remediação (BUSCHHECK e O’REILLY, 1997).
dependem das características químicas da água, principalmente da presença de oxigênio dissolvido. Essa presença de oxigênio determinará as condições do meio para mineralização aeróbia ou anaeróbia, implicando em diferentes cinéticas de transformação (BRADLEY e CHAPELLE, 1997).
O foco primário de estudo e aplicação da atenuação natural tem sido a fase dissolvida em água subterrânea (GRAVES et al., 1997).
2.3 Mecanismos de atenuação natural não destrutivos
2.3.1 Introdução
O transporte dos contaminantes hidrocarbonetos alifáticos clorados em águas subterrâneas é regido por propriedades físicas e químicas dos contaminantes e do aqüífero, sendo importante considerar fatores do contaminante como coeficientes: de distribuição solo/água (Kd), partição carbono orgânico/água (Koc), partição octanol/água (Kow), partição ar/água ou constante da Lei de Henry (Kh), solubilidade em água e pressão de vapor, além de fatores do aqüífero: população bacteriana, condutividade hidráulica, porosidade, densidade, heterogeneidades geológicas e características geoquímicas da água subterrânea (WIEDEMEIER et al., 1996).
Os mecanismos de transporte, que serão apresentados, reduzem a concentração dos contaminantes, mas não reduzem a sua massa, sendo processos não destrutivos.
2.3.2 Advecção
Advecção é o transporte de soluto, através do movimento da água subterrânea, dependendo apenas das propriedades do aqüífero, sendo o processo mais importante que dirige a migração de contaminantes dissolvidos em águas subterrâneas, (WIEDEMEIER et al., 1996).
A componente unidimensional no transporte advectivo é dada por:
ÕCIÕT = -v xõC!âc onde, (eq.2.1)
3 C = concentração do contaminante ou soluto[M/L ] T = tempo [T]
vx = -KhiddH / r]edL onde, (eq. 2.2) Khid = condutividade hidráulica [L/T]
3 3 r|e = porosidade efetiva [L IL ] dH/dL = gradiente hidráulico [L/L]
O transporte por advecção produz uma frente de soluto com concentração constante igual à concentração inicial da contaminação. Na prática, o avanço da frente de contaminantes expande-se além da direção de fluxo da água subterrânea, pois atuam sobre ela os processos de dispersão, difusão, sorção e ainda a biodegradação.
2.3.3 Dispersão hidrodinâmica
Dispersão hidrodinâmica é o processo que espalha os contaminantes longitudinalmente e transversalmente à direção de migração, sendo causada por mecanismos de difusão molecular e dispersão mecânica, dominantes em águas subterrâneas, com velocidades normais e com velocidades extremamente baixas respectivamente. A variável D descreve a dispersão hidrodinâmica, conjugando dispersão mecânica e difusão molecular (WIEDEMEIER et al., 1996).
Dispersão mecânica
Segundo WIEDEMEIER et al. (1996) apud DOMENICO e SCHWARTZ (1990), dispersão mecânica é a mistura que ocorre como resultado da variação local da velocidade em tomo de alguma velocidade média de fluxo. Em geral as causas de variações na direção e velocidade de transporte são propriedades do aqüífero e heterogeneidades microscópicas e macroscópicas.
A dispersão mecânica contribui para dispersão hidrodinâmica com duas componentes bidimensionais, longitudinal e transversal, dada por:
Dispersão mecânica = axvx onde, (eq.2.3)
a x = dispersividade [L]
Difusão molecular
em águas subterrâneas de baixa velocidade, sendo ignorada quando há alta velocidade (DAVIS eta l, 1993).
As leis de Fick’s descrevem o fluxo difusivo de contaminantes dissolvidos. A primeira lei, para sistema unidimensional em condições de equilíbrio:
F --D jd C ld x onde, (eq.2.4)
F = fluxo de massa do soluto [M/T] Df = coeficiente de difusão [L2/T]
dC/dx = gradiente de concentração [M/L3/L]
A segunda lei, para sistema unidimensional com concentrações variando em função do tempo:
dC /dt = D d2C/cbc2 onde, (eq.2.5)
dC/dt = variação da concentração com o tempo [M/T]
O coeficiente de difusão específico é expresso quantitativamente como:
D* = coD onde, (eq.2.6)
o = coeficiente empírico determinado por experimentos laboratoriais (adimensional, variando entre 0,01 à 0,5).
Desta forma a equação para dispersão hidrodinâmica em fluxo unidimensional (WIEDEMEIER et al., 1996 apud FREEZE e CHERRY, 1979) é:
Dx = axvx + D* onde, (eq.2.7)
Dx = coeficiente longitudinal da dispersão hidrodinâmica na direção x [L2/T]
D* = coeficiente efetivo de difusão molecular [L2/T]
A dispersividade é a propagação de contaminantes ao longo de um dado comprimento em meio poroso. XU e ECKSTEIN (1995), desenvolveram a relação para estimar a dispersividade, a x:
ax = 0,83 (LogLp)2Ai4 onde, (eq.2.8) Lp = comprimento da pluma [L]
como 0,05ax (WIEDEMEIER et al., 1996 apud ASTM, 1995), ou como 0,025ax até 0,lax (WIEDEMEIER et al., 1996, apud U.S. EPA, 1986).
2.3.4 Sorção
Sorção é o processo onde o contaminante orgânico dissolvido, relativamente hidrofóbico, sofre partição na água subterrânea e adere a partículas que compõem a matriz do aqüífero (carbono orgânico ou argila mineral, dependendo das propriedades do aqüífero e dos contaminantes) (WIEDEMEIER etal., 1996). A sorção em aqüífero contaminados, retarda o contaminante em relação à velocidade média advectiva do fluxo de água subterrânea e também pode influenciar a relativa importância da volatilização e biodegradação (WIEDEMEIER et al., 1996 apud LYMAN et al., 1992).
A sorção é uma reação reversível que não remove permanentemente a massa de soluto da água subterrânea, mas retarda sua migração. Este retardamento deve ser entendido a fim de efetivamente predizer o destino do contaminante dissolvido.
O mecanismo de sorção é um fenômeno complexo, causado por vários mecanismos, tendo as ligações hidrofóbicas como um importante fator de controle do destino de poluentes orgânicos em solos (DEVINNY etal., 1990). Dois componentes do aqüífero têm grandíssimo efeito na sorção: matéria orgânica e a argila mineral. Em muitos aqüíferos a fração orgânica tende a controlar a sorção de contaminantes orgânicos.
Através do equilíbrio de sorção, à temperatura constante, obtêm-se as isotermas de Langmuir e isotermas de Freundlich ( incluindo o caso especial de isoterma linear).
No modelo de isotermas de sorção de Langmuir, a concentração do sorbato cresce linearmente com o crescimento da concentração de soluto em baixas concentrações e aproxima-se de um valor constante em altas concentrações. A equação de Langmuir descrita matematicamente por DEVINNEY etal. (1990) é:
Ca = KCfi i (1 + KCj) onde, (eq.2.9)
Ca = concentração do contaminante sorvido (massa contaminante / massa solo, ng/g) K = constante de equilíbrio para reação de sorção (|xg/g)
Ci = concentração de contaminante dissolvido (|j,g/ml)
b = número de sítios de sorção (máxima quantidade de concentração sorvida)
0 modelo de isotermas de Freundlich para sorção é uma modificação do modelo de Langmuir onde é considerado um número infinito de sítios de sorção, válido para soluções diluídas.
Sua expressão matemática (DEVINNEY et al., 1990) é:
Ca =Kd{Cl)Vn onde, (eq.2.1 0)
Kd = coeficiente de distribuição solo/água n = coeficiente químico específico
O valor de n na eq.2 . 1 0 é determinado experimentalmente. Os valores de l/n variam
entre 0,7 e 1,1, podendo ser menores que 0,3 e maiores do que 1,7 (WIEDEMEIER et al.,
1996 apud LYMAN et al, 1992).
Quando n = 1, tem-se a isoterma linear de sorção, caso especial de Freundlich, valido para concentrações de espécies menores do que a metade de sua solubilidade (LYMAN et al.,
1992). A expressão da isoterma linear por WIEDEMEIER et al. (1996) apud JURY et al.
(1991) é:
Ca =KdC, onde, (eq.2.1 1)
Ka = inclinação da isoterma, ml/g
O coeficiente Kd é comumente usado para expressar a partição do composto orgânico entre a matriz do aqüífero e a água, dado por:
Kd =Ca 1C, (eq.2.1 2)
O nível crítico de matéria orgânica em um aqüífero, implicará na predominância da interação mineral/soluto ou carbono orgânico/soluto, sendo representada pela equação
(McCARTY et cã., 1981):
f oe = ( 4 / 2 0 0 ) ( l / O 84) c onde, (eq.2.13)
f oc = nível crítico de matéria orgânica (fração de massa)
Normalizando-se o coeficiente de distribuição em relação ao carbono orgânico total contido na matriz do aqüífero são eliminadas as variações de Ka em solos diferentes (WIEDEMEIER et al., 1996 apwí/DRAGUN, 1988):
K0c = K d / f 0C onde, (eq.2.14)
Koc - coeficiente de sorção normalizado para carbono orgânico total contido no solo
f oc = fração de carbono orgânico total (mg carbono orgânico/mg solo)
Kd pode também ser normalizado para matéria orgânica total contida (Kom), relaciona- se com Koc pela equação (WIEDEMEIER et al., 1996 apud LYMAN ET et al, 1992):
Koc = \,124Kom (eq.2.15)
A sorção gera um coeficiente de retardação, usado para estimar a velocidade do contaminante retardado:
R = 1 + (pbK d / rf) onde, (eq.2.16) R = coeficiente de retardação
Pb = densidade da maior parte do aqüífero [M/L3] r| = porosidade [L3/M]
Sendo a velocidade de transporte do contaminante retardado, vc, dada por:
vc = v J R (eq.2.17)
A equação que relaciona advecção, dispersão hidrodinâmica e sorção para o transporte de contaminantes em águas subterrâneas, é dada por:
RâC/ ã = Dxâ2C/ âc2 - v xâC/ âc (eq.2.18)
A eq.2.18 não engloba mecanismos destrutivos, que reduzem a massa de contaminantes.
õC I ã = (Dxõ 2C / Rãc2 - vxõC / Rãc) + Qs onde, (eq.2.19) C = concentração do soluto [M]
T = tempo [T]
R = coeficiente de retardação [adimensional] X = distância ao longo do caminho de fluxo [L] vx = velocidade de transporte na direção x [L/T]
Qs = termo para reações, envolvendo perda ou produção de soluto [M3/T]
Como a degradação de contaminantes orgânicos geralmente segue uma cinética de primeira ordem (ALEXANDER, 1994; BRADLEY, P. M. e CHAPELLE, F. H , 1997), o termo, ± Qs, pode ser substituído por, -ÀC:
ÕC/ ã = (Dxâ 2C/Rãc2 - vxõC/Rãc)- ÀC onde, (eq.2.2 0)
X = taxa de decaimento de primeira ordem [T'1]
Quando considera-se o transporte tridimensional, são introduzidas na (eq.2.20) as componentes vertical e transversal da dispersão hidrodinâmica.
ÕC Dxâ 2C Dyõ2C Dzô2C v õCx vyõC i^ C _ ,
ÕT Rãc2 + Rõy2 + RÕz2 Rãc + RÕy + R â ^ ~ (eq.2.21)
2.3.5 Diluição ou recarga
Diluição ou recarga pode ser definida como a entrada de água disponível de superfícies externas na zona saturada (WIEDEMEIER et al., 1996 apud FREEZE e CHERRY, 1979), dependendo das propriedades do aqüífero e clima, incluindo infiltrações pluviométricas através da zona insaturada, e contribuições de mananciais superficiais em contato com o sistema de água subterrânea.
2.3.6 Volatilização
Volatilização é a passagem de um composto químico da fase líquida para a fase gasosa. Em águas subterrâneas a volatilização remove contaminantes dissolvidos transferindo-as para o gás do solo, dependendo de parâmetros como: concentração do contaminante, coeficiente de partição ar/água, coeficiente de difusão e transporte de massa do composto em água e gás do solo, da sorção e da temperatura da água (LARSON e WEBER,
1994).
A lei de Henry governa a partição do contaminante entre a fase líquida e a fase gasosa por (WIEDEMEIER et al, 1996 apud LYMAN et al., 1992):
Car = KhCw onde, (eq.2.22)
Kh = constante da lei de Henry (atm m3/mol)
Car = concentração no ar (atm) Cw = concentração na água (mol/1)
As propriedades físicas dos hidrocarbonetos alifáticos clorados e dos aromáticos benzeno, tolueno e xileno conferem a esses compostos baixos valores de Kh, exceto o cloreto
de vinila. A volatilização desses compostos, em água subterrânea, é relativamente lenta, devido à pequena exposição ao gás do solo (WIEDEMEIER et al, 1996). Para o BTX, CHEANG et al. (1989), constatou que menos de 5% é volatilizado em ambiente de água subterrânea saturada. Desta forma as perdas por volatilização de hidrocarbonetos alifáticos clorados e dos aromáticos é desprezada em águas subterrâneas. Mas, para o cloreto de vinila, a volatilização pode ser considerada um processo de remoção (RIVETT’S, 1995).
Em solos, a volatilização de hidrocarbonetos alifáticos clorados chega a valores de: 94% PCE, 89% 1,1,1-TCE, e acima de 50% para clorofórmio, 1,1-DCA e TCE (WIEDEMEIER et al, 1996 apud PIWONI et al, 1986).
2.4 Mecanismos de atenuação natural destrutivos
2.4.1 Introdução
redução de concentração e massa dos compostos. A biodegradação resulta em detoxicação ou ativação, tornando a molécula do composto químico menos ou mais tóxica para as espécies susceptíveis (ALEXANDER, 1994), exemplificando-se, no processo de mineralização de PCE a dióxido de carbono (inócuo) e a obtenção do VC (carcinogênico), como produto intermediário da redução anaeróbia do TCE (VOGEL e McCARTY, 1985).
Os resultados de muitos estudos na área de biorremediação, tornou conhecido alguns microrganismos responsáveis pela biodegradação de alguns contaminantes orgânicos recalcitrantes, que são apresentados no Quadro 2.2. associados aos respectivos substratos contaminantes.
Quadro 2.2: Alguns microrganismos capazes de degradar compostos orgânicos.
(
onüiminanU-.. Microrganismo Itiodi'gr-.idaliilidadr( oiiK-iitiirin<>,
Benzeno Pseudomonas putida, P. rhodochrous, P. aeruginosa, Acinetobacter sp„ Methylosinus
trichosporium OB3b, Nocardia sp„ methanogens, anaerobes Moderado a alto
Tolueno Methylosinus trichosporium OB3b, Bacillus sp„ Pseudomonas sp., P. putida, Cunninghamella
elegans, P. aeruginosa, P. mildenberger, P. aeruginosa, Achromobacter sp., methanogens, anaerobes
Alto
Etilbenzeno Pseudomonas putida Alto
Xilenos Pseudomonas putida, methanogens, anaerobes Alto
Jet Fuel Torulopsis, Candidatropicalis, Corynebacterium hydrocarboclastus, Candidaparapsilosis, C.
guilliermondii, C. lipolytica, Trichosporon sp., Rhosporidium toruloides, Cladosporium resinae Alto Etenos
clorados Dehalococcus entheogenes strain 195, Desulfltobacterium sp. Strain PCE1, PseudomonasDehalobacter restrictus, Dehalospirillum multivorans, Enterobacter agglomerans, putida (múltiplas dimensões), P. cepacia G4, P. mendocina, Desulfobacterium sp. Methanobacterium sp., Methanosarcina sp. Dimensão DCM, Alcaligenes eutrophus JMP 134Metylosinus trichosporium OB3b, Escherichia coli, Nitorsomonas europaea, Methylocystis parvus OBBP, Mycobacterium sp. Rhodococcus erythopolis
Moderado
Etanos
clorados Desulfobacterium sp. Methanobacterium sp., Pseudomonas putida, Clostridium sp., C. sp. StrainTCAIIB Moderado
Metanos
clorados Acetobacterium woodii, Desulfobacterium sp., Methanobacterium sp., Pseudomonas sp.dimensão KC, Escherichia coli K-12, Clostridium sp., Methanosarcina sp., Hyphomicrobium sp.
dimensão DM2
Moderado
Clorobenzeno Alcaligenes sp. (múltiplas dimensões), Pseudomonas sp. (múltipla dimensões), P. putida,
Staphylococcus epidemis Moderado a alto
Fonte: WIEDEMEIER et a l, 1996 apud RJSER-ROBERTS. 1992.
O processo de biodegradação requer a satisfação de necessidades essenciais, presença de microrganismo (biomassa, diversidade de população e especificidade enzimática), do
substrato/contaminante (estrutura molecular, solubilidade, concentração) e da variação de parâmetros ambientais (pH, temperatura, composição química do ambiente, potencial de oxi- redução, disposição de receptores de elétron e fontes de carbono e energia) (YOUNG e CERNIGLIA, 1995).
diferentes processos de biodegradação: o uso do composto orgânico como substrato primário (doador de elétrons) de crescimento de microrganismos, o uso do composto orgânico como receptor de elétrons e o cometabolismo. Os dois primeiros envolvem transferência microbial de elétrons dos doadores de elétrons (substrato primário de crescimento) para os receptores de elétron em condições aeróbias ou anaeróbias. Os doadores de elétron incluem matéria orgânica natural, hidrocarbonetos combustíveis, clorobenzenos e os etenos e etanos clorados menos oxidados. Receptores de elétrons são elementos ou compostos que ocorrem relativamente em estado oxidado. Os mais comuns são oxigênio dissolvido, nitrato, manganês (+4), ferro (+3), sulfato, e dioxido de carbono e em condições favoráveis os etenos e etanos clorados mais oxidados (PCE, TCE, DCE, TCA, DCA) e benzenos policlorados (WIEDEMEIER etal., 1996; CHAPELLE, 1993). Dentro de condições aeróbias, durante a respiração aeróbia, o oxigênio dissolvido é usado como elétron receptor terminal. Em condições anaeróbias são usados durante a desnitrificação os receptores de elétrons o manganês (+4), ferro (+3), sulfato e dioxido de carbono (VOGEL et al, 1987). No processo de cometabolismo, o contaminante é fortuitamente degradado, por enzimas ou co- fatores produzidos pelo microrganismo para outro processo, sem beneficiar o microrganismo (NORRIS etal., 1993).
Durante a biodegradação, os microrganismos passam por uma fase de aclimatação, período onde a biodegradação não é detectável, a duração deste período depende da concentração e da natureza do contaminante e das condições ambientais; sendo de uma hora a meses. O período de aclimatação pode ser longo em ambientes anaeróbios para moléculas cloradas (ALEXANDER, 1994 LINKFIELD etal, 1989).
A cinética de biodegradação é descrita através de modelos matemáticos que relacionam contaminante transformado por unidade de tempo, o mais usado é o modelo de taxa de produção (ALEXANDER, 1994 apud HAMAKER, 1972):
-d C / dt = kCn onde, (eq.2.23)
C = concentração de substrato/contaminante T = tempo
k = taxa constante de desaparecimento do contaminante n = parâmetro adaptador/ordem da reação
microrganismos utilizam primeiro o receptor de elétron que, durante o processo de respiração, liberar a maior quantidade de energia livre (NORRIS et al, 1993), Figura 2.2.
O *cd C3 O H u *0 e3 <U scdWh
2 73cd 73cd *-< <D X> CS U cd (D Q Eh (mV) 1000 Aeróbio
(oxigênio como elétron receptor) - 02 + 4H- + 4é
"2N03 + 12H+ + lOé Respiração aeróbia
-► 2H20 (Eh° = +820) Desnilrifícação
^ N2 + 6H20 (Eh° = +740)
500
Redução do manganês
-M n02(s) + H C03 - + 3H+ + 2é —► M nC03(s) + 2H20 (Eh° = +520)
Anaeróbio
o “T
Ótim a faixa para Desclorinação R e d u tiv a ^
v 500
Redução do ferro
-FeOOH(s) + HCO3- + 2H+ + é —>. FeCO, + 2H20 (Eh° = -50)
Redução do sulfato
SO/ 2 + 9H+ + 8é
-C 02 + 8H+ + 8é
► HS- + 4H20 (Eh° = -220) Respiração anaeróbia
" CH4 + 2H20 (Eh° = -240)
Figura 2.2: Reações de oxi-redução com diferentes receptores de elétrons considerando as condições, pH = 7, T = 25 °C e Eh (mV).
Quadro 2.3: Tendências de concentrações de contaminantes, receptores de elétrons, produtos metabólicos e alcalinidade durante a biodegradação.
Analisado Processo terminal de elétron receptor Tendências nu análise para concentrações durante a biodegradação
Hidrocarboneto
combustível Respiração aeróbia, Disnitrificação, Redução do manganês (+4), Reduçãio do ferro (+3),
Metanogenese
Diminui
Solventes altamente
clorados e subprodutos Desclorinação redutiva Diminui a concentração do composto original, inicialmente aumenta a
concentração dos subprodutos que pode diminuir
Solventes com baixa
cloraçâo Respiração aeróbia, Desnitrificação, Redução do manganês (+4), Redução do ferro (+3) (oxidação
direta)
Diminui a concentração do composto
Oxigênio dissolvido Respiração aeróbia Diminui
Nitrato Desnitrificação Diminui
Manganês (+2) Redução do manganês (+4) Aumenta
Ferro (+2) Redução do ferro (+3) Aumenta
Sulfato Redução de sulfato Diminui
Metano Metanogenese Aumenta
Cloro Desclorinação redutiva ou oxidação direta de
compostos clorados Aumenta
Potencial redox Respiração aeróbia, Desnitrificação, Redução de
manganês (+4), Redução de ferro (+3), Metanogenese
Diminui
Alcalinidade Respiração aeróbia, Desnitrificação, redução do
ferro (+3) e Redução de sulfato. Aumenta
Fonte: WIEDEMEIER etal. (1996).
2.4.2 Transformações de compostos orgânicos em diferentes condições de oxi-redução
Quadro 2.4: Transformações bióticas e abióticas de compostos orgânicos sintéticos.
Composto Mecanismo dc dc»r;idavfio
PCE desclorinação redutiva
TCE desclorinação redutiva, cometabolismo
DCE desclorinação redutiva, oxidação biológica direta
cloreto de vinila desclorinação redutiva, oxidação biológica direta
TC A desclorinação redutiva, hidrólises, deshidrohalogenação
1,2-DCA desclorinação redutiva, oxidação biológica direta
cloroetano hidrólises
tetracloreto de carbono desclorinação redutiva, cometabolismo, abiótica
clorofórmio desclorinação redutiva, cometabolismo
cloreto de metila oxidação biológica direta
clorobenzeno oxidação biológica direta, redutiva desclorinação, cometabolismo
benzeno oxidação biológica direta
tolueno oxidação biológica direta
etilbenzeno oxidação biológica direta
xilenos oxidação biológica direta
Fonte: WIEDEMEIER et al. (1996).
As transformações abióticas são lentas, mas significantes quando a escala de tempo é associada com o movimento das águas subterrâneas. E conhecendo-se as transformações abióticas, essas ajudam na compreensão das estruturas nas transformações bióticas. As bióticas procedem rapidamente desde que haja nutrientes e população microbial compatíveis (VOGEL etal., 1987).
2.4.3 Transformações bióticas
Compostos orgânicos como: carbono orgânico natural, hidrocarbonetos de petróleo, e os menos oxidados compostos orgânicos clorados (DCE, 1,2-DCA, clorobenzeno, cloreto de vinila) podem ser usados como substrato primário (elétron doadores) em condições aeróbias
e/ou anaeróbias.
Em condições aeróbias são oxidados:
- etenos clorados, apenas os compostos de baixa cloração tais como (DCE) e cloreto
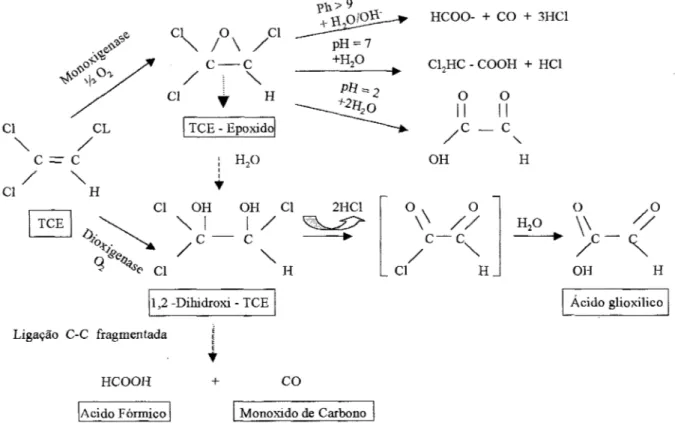
caracterizado por perda de massa de contaminante e presença de produtos intermediários (e.g. óxidos clorados, aldeidos, etanol e epóxidos) e outros produtos; cloro, dióxido de carbono e ácidos orgânicos, como mostra a Figura 2.3 (WIEDEMEIER et al., 1996 apud MILLER e GUENGERICH, 1982) (McCARTY e SEMPRINI, 1994);
HCOO- + CO + 3HC1
C12HC - COOH + HC1
O O
II - c
\
H
■yo Cl
h2o o
/ c
OH • s
o
H
1,2 -Dihidroxi - TCE Ácido glioxilico
Ligação C-C fragmentada s
í
t
HCOOH + CO
Acido Fórmico Monoxido de Carbono
Fonte: YOUNG e CERNIGLIA (1995); VOGEL et al. (1987)
Figura 2.3: Caminho teórico de oxidação de TCE por monoxigenase e dioxigenase.
- etanos clorados, somente o 1,2-DCA é oxidado em meio aeróbio e o mecanismo da
ci ci
I I
H ---C --- C --- H
I I
H H
1,2-DCA
I
C I H
I I
H ---C | --- -C | --- O H
H H
C l o r o e t a n o l
D i ó x i d o d e C a r b o n o
Fonte: WIEDEMEIER et al. (1996)
Figura 2.4: Oxidação aeróbia de 1,2-DCA.
- clorobenzenos A Figura 2.5, exibe a degradação aeróbia de clorobenzeno que
conjuntamente com os benzenos policlorinados têm suas biodegradações aeróbias registradas em alguns estudos (WIEDEMEIER et al, 1996 apud REINEKE e KNACKMUSS, 19840) (SCHR A A et al, 1986; SANDER et al, 1991).
C 1 C l o r o b e n z e n o
0 2 I
O H
Fonte: CHAPELLE (1993)
Em condições anaeróbias a oxidação ocorre em uma variação própria de pH, temperatura, salinidade e potencial de oxi-redução. Os elétron receptores são nitrato, manganês(+4), ferro (+3), sulfato e dióxido de carbono. Desta forma são oxidados:
- etenos clorados, os etenos de alta cloração não são freqüentemente oxidados em águas subterrâneas anaeróbias. BRADLEY e CHAPELLE (1997) mostram que o cloreto de vinila pode ser diretamente oxidado em água via redução de ferro (+3). Ver Figura 2.8;
- etanos clorados, WIEDEMEIER et al. (1996) afirmam que não existem evidências desta degradação;
- clorobenzenos, WIEDEMEIER et al. (1996) citam a existência de evidências de biodegradação por cometabolismo.
Fonte: BONT et al.. (1986)
Figura 2.6: Caminho proposto para catabolismo de 1,3-diclorobenzeno por
' Alcaligenes OBB65.
Hidrocarbonetos alifáticos clorados têm sido usados como elétron receptores e biodegradados em condições anaeróbias. Esse processo é conhecido como desclorinação redutiva (hidrogenólise), onde o átomo de cloro é substituído por átomos de hidrogênio, e
deshaloeliminação onde dois átomos de cloro adjacentes são removidos originando uma dupla ligação entre os respectivos átomos de carbono (formando um alceno); desta forma, o composto clorado serve como fonte de carbono para o crescimento microbiano. O mais importante processo de biodegradação natural para compostos altamente clorados é a desclorinação redutiva do PCE e 1,1,1-TCA (WIEDEMEIER et al., 1996), exibidas nas Figuras 2.7 e 2.8, respectivamente. Em algumas situações, a desclorinação redutiva pode ser um processo cometabólico, resultando em lentas e incompletas desclorinações (WIEDEMEIER et al., 1996 apud GOSSETT e ZINDER,1996).
- etenos clorados seguem a obtenção de produtos intermediários na seqüência: PCE, TCE, DCE, VC e eteno (TANDOL et al, 1994), onde, dependendo das condições ambientais,
essa seqüência pode ser interrompida, levando a outros produtos intermediários. Durante a desclorinação redutiva de alcenos, uma ou mais ocorrências são observadas, produção de eteno, metano ou ferro (+2), concentrações de hidrogênio entre 1-4 r)M (nano molar) e baixa concentração de oxigênio dissolvido (WIEDEMEIER et al, 1996);
P C E
4-C H 4-C 1= 4-C 4-C 1,
TCE
C 1
\ H
C = C
C 1 H
H C 1
c = c
✓ \
C 1 H
H H
c =c
/ \
Cl Cl
1 ,1 -D C E í r f l n j - 1 , 2 -D C E c is-1 , 2 - D C E
D i ó x i d o d e C a r b o n o Á c i d o C l o r í d r i c o
Fonte: VOGEL e McCARTY (1985)
Figura 2.7: Desclorinação redutiva de PCE.
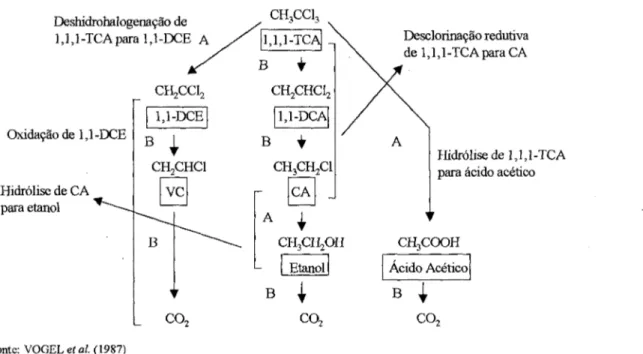
- etanos clorados, têm suas desclorinações redutivas mencionadas por TANDOL et al (1994), VOGEL et al. (1987), entre outros. A Figura 2.8 exibe a seqüência de degradação por desclorinação redutiva através de trasnformações bióticas do 1,1,1-TCA à CA;
- clorobenzenos, para os benzenos altamente clorados a desclorinação redutiva é o mais freqüente mecanismo de biodegradação; (HOLLIGER et al, 1992; RAMANAND et al.,
Hidrocarbonetos alifáticos dissolvidos em água podem ser abioticamente degradados de forma incompleta, gerando produtos intermediários que podem ser mais ou menos tóxicos do que o composto original. As mais comuns transformações abióticas, que não necessitam de transferência externa de elétrons, são a hidrólise (reação de substituição) e a
deshidrohalogenação (reação de eliminação) (JEFFERS et al., 1989; VOGEL et al., 1987). Hidrólise é a reação da molécula orgânica com a água ou um componente iônico da água. Para compostos orgânicos halogenados, um halogênio é substituído por um grupo hidroxila (OH'), a reação favorecida é para formação de álcool. Se os álcoois são halogenados, a hidrólise adicional pode ocorrer para ácidos ou diois. A adição do grupo hidroxila pode tornar o novo composto mais susceptível a biodegradação, por ser mais solúvel (WIEDEMEIER et al, 1996 apud NEELY, 1985). Na presença de argila, a taxa de hidrólise pode ser aumentada e geralmente descrita por cinética de primeira ordem (VOGEL. et al,
1987).
O 1,1,1-TC A tem sido estudado quanto à transformação abiótica, através de uma série de substituições, incluindo hidrólise, resultando em ácido acético, ou por deshalogenação redutiva, resultando em 1,1-DCA e então para cloroetano, que, por hidrólise, resulta em etanol (VOGEL et al. 1987) ou deshidrohalogenado para cloreto de vinila (JEFFERS et al, 1989). A Figura 2.8 mostra as transformações anaeróbias de alifáticos clorados por: hidrólise, oxidação, deshalogenação e deshidrohalogenação.
Fonte: VOGEL et al. (1987)
Figura 2.8: Transformações em meio anaeróbio de 1,1,1-TCA, (A) abiótica e (B) biótica.
Deshidrohalogenação é uma reação de eliminação, envolvendo alcanos halogenados, onde um átomo de halogênio é removido de um átomo de carbono seguido da subsequente remoção de um átomo de hidrogênio do átomo de carbono adjacente, produzindo um alceno. Em condições ambientais básicas, os alcanos policlorados são deshidrohalogenados (VOGEL
et al, 1987), conforme exibido na Figura 2.8. As taxas de deshidrohalogenação podem ser
aproximadas para cinética de primeira ordem (dependendo do número e tipo de halogênio substituído, da concentração de ions hidroxila e pH) (WIEDEMEIER et al., 1996).
2.5 Passos na avaliação da atenuação natural
A avaliação da atenuação natural tem por objetivo constatar a sua eficiência em reduzir concentrações de contaminantes em águas subterrâneas a níveis aceitáveis pela legislação, antes de atingir potenciais receptores. Com base em variações históricas ou modelos de disposição e transporte, é possível quantificar a taxa de atenuação de contaminantes e projetar suas concentrações no tempo e no espaço. Segundo WIEDEMEIER
et al. (1996) e U.S. EPA., (1997) uma seqüência de passos são necessárias para demonstrar e
1. Revisar os dados disponíveis do sítio (área de estudo) e desenvolver um modelo conceituai preliminar.
Deve-se verificar a existência de informações disponíveis que permitam: projetar o sítio, viabilizando a opção da atenuação natural e desenvolvendo modelo conceituai preliminar, (tridimensional, representando fluxo da água subterrânea e sistema de transporte de soluto) baseado em dados disponíveis, geológico, biológico, geoquímico, hidrogeológico, climatológico e dados analíticos. O modelo preliminar permite identificar falhas nos dados que facilitará a locação de novos pontos de coleta de dados, de modo a otimizar a relação custo eficiência
2. Projetar o sítio e avaliar o potencial para atenuação natural.
Com os dados existentes, a possibilidade da atenuação natural é avaliada quanto à suficiência para prevenir o completo caminho da pluma de contaminantes dissolvidos, até o receptor ou um ponto (pré determinado), fora da área da pluma, em concentrações acima das permitidas pela legislação local. Para realizar a estimativa preliminar e avaliar a eficiência da atenuação natural em reduzir as concentrações dos contaminantes, são necessários alguns parâmetros: propriedades dos contaminantes (volatilidade, propriedades sortivas e de biodegradabilidade); propriedades do aqüífero (gradiente hidráulico, condutividade hidráulica, porosidade, concentrações de carbono orgânico total) e a localização da pluma e da fonte de contaminante, relacionando a potenciais receptores e pontos de exposição.
3. Coleta de dados adicionais à caracterização do sítio para suportar a atenuação natural.
São necessários detalhes da caracterização do sítio para documentar o potencial da atenuação natural. A revisão da caracterização dos dados permite identificar falhas nos dados e mostrar o melhor ponto para coleta de dados adicionais.
Nesta fase, os dados coletados devem permitir determinar a ocorrência da atenuação natural em taxas suficientes para proteger o ambiente, a saúde humana e permitir a previsão futura da extensão e concentração dos contaminantes na pluma, sendo realizada através de modelagem de disposição e transporte de contaminantes. Isso requer a caracterização detalhada do sítio para alcançar esses objetivos, e apoiar a opção da atenuação natural. Os parâmetros específicos que precisam ser determinados são:
1. extensão e tipos de contaminação no solo e água subterrânea;
3. o potencial para uma fonte contínua, devido a vazamentos de tanques ou tubulações ou outros sítios ativos;
4. parâmetros geoquímicos do aqüífero;
5. hidrogeologia regional incluindo, aqüíferos de água potável e unidades confinadas regionais;
6. hidrogeologia específica do local;
7. identificação, no presente e no futuro, de potenciais caminhos de exposição, receptores e pontos de exposição.
4. Refino do modelo conceituai, complemento dos cálculos do pré-modelo, e documentação dos indicadores de biodegradação.
O refinamento do modelo conceituai envolve a integração de dados, recém reunidos, da caracterização para refinar o modelo conceituai preliminar, sendo desenvolvido com base em dados específicos previamente coletados. Durante o refinamento do modelo conceituai, todos os dados específicos disponíveis podem ser integrados para desenvolver uma precisa representação tridimensional do sistema hidrogeológico e de transporte de contaminantes. Esse modelo conceituai refinado pode ser usado para a modelagem de distribuição e transporte de contaminantes
5. Simular a atenuação natural usando modelos analítico ou numérico de distribuição e transporte de contaminante, permitindo a incorporação do termo de biodegradação quando necessário.
A simulação da atenuação natural permite a previsão da migração e atenuação de plumas de contaminantes, através do tempo. A modelagem da atenuação natural é uma ferramenta que permite o uso de dados específicos de um sítio para predizer a distribuição e transporte de contaminantes sob o governo de processos físicos, químicos e biológicos. O resultado do modelo não é suficiente para evidenciar a ocorrência da atenuação natural em um dado sítio, a menos que os dados de entrada do programa venham de uma investigação cuidadosa para caracterização do sítio. Em alguns casos, para simular a atenuação natural é adequado o uso direto dos modelos de transporte de contaminante.