UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE TECNOLOGIA
DEPARTAMENTO DE ENGENHARIA QUÍMICA
PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA QUÍMICA
ADRIANA DUTRA SOUSA
EFEITO DO MÉTODO DE EXTRAÇÃO E DA SECAGEM SOBRE O CONTEÚDO FENÓLICO E A COMPOSIÇÃO QUÍMICA DE QUEBRA-PEDRA
(PHYLLANTHUS AMARUS E PHYLLANTHUS NIRURI)
ADRIANA DUTRA SOUSA
EFEITO DO MÉTODO DE EXTRAÇÃO E DA SECAGEM SOBRE O CONTEÚDO
FENÓLICO E A COMPOSIÇÃO QUÍMICA DE QUEBRA-PEDRA (PHYLLANTHUS
AMARUS E PHYLLANTHUS NIRURI)
Tese apresentada ao Programa de Pós-Graduação em Engenharia Química da Universidade Federal do Ceará, como requisito parcial à obtenção do Título de Doutor em Engenharia Química. Área de Concentração: Processos Químicos e Bioquímicos
Orientador: Prof. Dr. Edy Sousa de Brito
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca Universitária
Gerada automaticamente pelo módulo Catalog, mediante os dados fornecidos pelo(a) autor(a)
S696e Sousa, Adriana Dutra.
Efeito do método de extração e da secagem sobre o conteúdo fenólico e a composição química de quebra-
pedra (Phyllanthus amarus e Phyllanthus niruri) / Adriana Dutra Sousa. – 2017.
119 f. : il. color.
Tese (doutorado) – Universidade Federal do Ceará, Centro de Tecnologia, Programa de Pós-Graduação
em Engenharia Química, Fortaleza, 2017. Orientação: Prof. Dr. Edy Sousa de Brito.
ADRIANA DUTRA SOUSA
EFEITO DO MÉTODO DE EXTRAÇÃO E DA SECAGEM SOBRE O CONTEÚDO
FENÓLICO E A COMPOSIÇÃO QUÍMICA DE QUEBRA-PEDRA (PHYLLANTHUS
AMARUS E PHYLLANTHUS NIRURI)
Tese apresentada ao Programa de Pós-Graduação em Engenharia Química da Universidade Federal do Ceará, como requisito parcial à obtenção do Título de Doutor em Engenharia Química. Área de Concentração: Processos Químicos e Bioquímicos
Aprovada em: _22_/_02_/_2017.
BANCA EXAMINADORA
________________________________________ Dr. Edy Sousa de Brito (Orientador)
Embrapa Agroindústria Tropical
_______________________________________ Prof. Dr. Fabiano André Narciso Fernandes
Universidade Federal do Ceará (UFC)
_________________________________________ Dr. Guilherme Julião Zocolo
Embrapa Agroindústria Tropical
_________________________________________ Drª. Henriette Monteiro Cordeiro de Azeredo
Embrapa Agroindústria Tropical
_________________________________________ Dr. Kirley Marques Canuto
AGRADECIMENTOS
A Deus, por sempre ter iluminado meus caminhos e por ter me proporcionado força e coragem durante toda a minha jornada de trabalho.
Aos meus pais, Helena e Flávio, pelo grande amor, carinho, estímulo, ensinamentos e dedicação em todas as etapas da minha vida.
Ao meu esposo Franzé Júnior, por sempre acreditar em minha capacidade e por todo apoio, amor, carinho e compreensão.
Ao meu orientador, Dr. Edy Sousa de Brito, pela paciência, amizade, confiança em meu trabalho e conhecimentos compartilhados, de grande importância para minha vida acadêmica.
Ao Dr. Kirley Marques Canuto, ao Dr. Guilherme Julião Zocolo, ao Prof. Dr. Fabiano André Narciso Fernandes, e à Dra. Henriette Monteiro Cordeiro de Azeredo, pelas orientações para o enriquecimento deste trabalho.
Ao Programa de Pós-graduação em Engenharia Química e a todos os seus professores, pela oportunidade de realização do doutorado e pelos ensinamentos transmitidos.
À Embrapa Agroindústria Tropical pelas instalações concedidas durante a realização da parte experimental da minha tese. Em especial aos amigos Dra. Isabel Maia, Caroline Gondim, Karine Nojosa, Dra. Tigressa Rodrigues, Dr. Paulo Riceli, Dra. Lorena Silva, Marcelo Victor, Dr. Jéfferson Malveira, Aline Cavalcante, Luiz Bruno, Paloma Lira, Náyra de Oliveira e Francilene Silva do Laboratório Multiusuário de Química de Produtos Naturais pela ajuda e bons momentos.
À turma de doutorado, em especial aos amigos, Maria de Fátima, Valéria Melo, Valéria Santos e Ana Cristina, pelo companheirismo.
À FUNCAP, pelo apoio financeiro.
“Os sonhos são como uma bússola,
RESUMO
O gênero Phyllanthus, conhecido popularmente no Brasil como quebra-pedra, é composto de plantas ricas em compostos bioativos, principalmente fenólicos. Na obtenção desses compostos de interesse, a secagem da matéria-prima e o processo de extração são fundamentais. Atualmente, tem se buscado a utilização de técnicas de
extração “verde” que reduzam o impacto ao meio ambiente. Dentre estas técnicas destacam-se a extração assistida por ultrassom (EAU) e a extração com líquido pressurizado (ELP). Neste estudo, a extração aquosa das partes aéreas de P. amarus e
P. niruri foi realizada por EAU, ELP e extração convencional. Foi avaliado o efeito do tempo, intensidade ultrassônica e razão líquido/sólido na EAU e do tempo e temperatura na ELP na extração de fenólicos totais e ácido gálico. A composição química dos extratos foi determinada por UPLC-QTOF-MS/MS em conjunto com técnicas quimiométricas (PCA e OPLS-DA). Também foram investigados parâmetros de secagem das plantas. Partes aéreas das duas espécies foram secas em estufa de circulação de ar e dados de cinética de secagem foram obtidos. O efeito da temperatura do ar de secagem (50, 60 e 70°C) sobre o conteúdo fenólico e a composição química também foi estudado. O maior conteúdo de fenólicos totais foi observado nos extratos obtidos por ELP em 192°C/15 min para as duas espécies, mas esta temperatura elevada levou à degradação de alguns compostos. Os extratos obtidos por ELP na temperatura de 120°C apresentaram um alto conteúdo fenólico e sem degradação química. As outras técnicas de extração promoveram menor rendimento de compostos fenólicos e maior consumo de solvente. Portanto, a ELP na temperatura de 120°C e pressão de 110 bar mostrou-se um método adequado para extrair compostos fenólicos, incluindo os compostos com importância medicinal. A composição química dos extratos apresentou principalmente taninos hidrolisáveis e flavonóides. Com relação à secagem, o aumento da temperatura do ar de secagem reduziu o tempo de secagem e aumentou a difusividade efetiva de umidade. A melhor temperatura testada para se obter um maior conteúdo fenólico para ambas as espécies foi de 60°C. Os resultados indicam a importância do controle da temperatura de secagem para manter a qualidade da matéria-prima e do processo de extração na obtenção dos compostos de interesse.
Palavras-chave: Fenólicos. Ultrassom. Líquido pressurizado. Quimiometria. Secagem
ABSTRACT
The genus Phyllanthus, popularly known as quebra-pedra in Brazil, is composed of plants rich in bioactive compounds, mainly phenolics. Drying of raw material and the extraction process are essential to achieve those compounds. Nowadays, "green" extraction techniques are required to reduce the environmental impacts. Among these techniques, ultrasound-assisted extraction (UAE) and pressurized liquid extraction (PLE) stand out. In this study, aqueous extraction from aerial parts of P. amarus and P. niruri was performed using UAE, PLE and conventional extraction. It was evaluated the effect of time, ultrasonic intensity, and liquid/solid (L/S) ratio in UAE and of time and temperature in PLE on total phenolics and gallic acid extraction. The chemical composition of the extracts was determined by UPLC-QTOF-MS/MS in conjunction with chemometric techniques (PCA and OPLS-DA). Also plants drying parameters were investigated. Aerial parts of the two species were dried in a circulating air-drying oven and drying kinetics data were obtained. The effect of air-drying temperature (50, 60 and 70°C) on phenolic content and on chemical composition was also studied. The highest total phenolics content was observed in the extracts obtained by PLE at 192°C/15 min for the two species, but this high temperature led to degradation of some compounds. The extracts obtained by the PLE at 120°C presented a high phenolic content without chemical degradation. The other extraction techniques produced a lower yield of phenolic compounds and higher solvent consumption. Therefore, PLE at a temperature of 120°C and pressure of 110 bar proved to be a suitable method to extract phenolics, including the compounds with medicinal relevance. The chemical composition of the extracts had mainly hydrolysable tannins and flavonoids. With regard to drying, the increase in air-drying temperature reduced the drying time and increased the effective moisture diffusivity. The best evaluated temperature to obtain a higher phenolic content for both species was 60°C. The results indicate the importance of the drying temperature control to maintain the quality of the raw material and the extraction process in obtaining the compounds of interest.
Keywords: Phenolics. Ultrasound. Pressurized liquid. Chemometrics. Convective
LISTA DE FIGURAS REVISÃO DE LITERATURA
Figura 1 Phyllanthus amarus... 16
Figura 2 Phyllanthus niruri... 19
Figura 3 Esquema de sistemas de aplicação de ondas ultrassonoras: a) sonda, b) banho... 26
Figura 4 Esquema de funcionamento de um extrator com líquido pressurizado (ELP)... 29
ARTIGOS
Ultrasound-assisted and pressurized liquid extraction of phenolic compounds from
Phyllanthus amarus and its composition evaluation by UPLC-QTOF
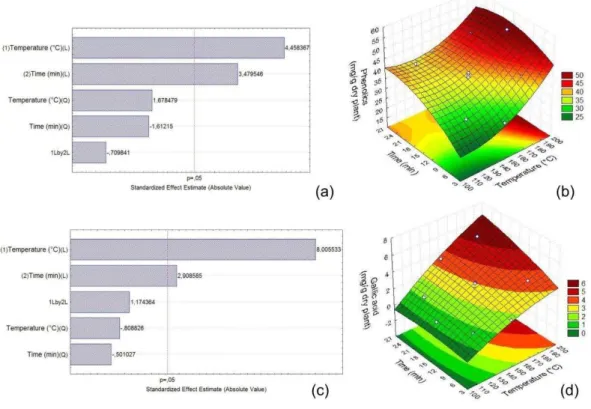
Figure 1 Estimated effects by Pareto plot and response-surface graphs for the phenolics content (mg/g plant) in ultrasound-assisted extraction... 47
Figure 2 Estimated effects by Pareto plot and response-surface graphs for the gallic acid content (mg/g plant) in ultrasound-assisted extraction……….. 48
Figure 3 Estimated effects by Pareto plot and response-surface graphs for the phenolics content (mg/g plant) (a) and (b) and gallic acid content (mg/g plant) (c) and (d) in pressurized-liquid extraction………. 50
Figure 4 LC-ESI(+)/MS and LC-ESI(−)/MS chromatograms of P. amarus aqueous extracts obtained through UAE (a) and (b), PLE (c) and (d), and CE (e)
and (f), respectively………... 52
Figure 5 Structures of the substances identified in P. amarus extracts…………... 53
Figure 6 Proposal of amariinic acid fragmentation with corilagin formation (m/z
633)……… 58
Figure 7 Possible formation of monogalloylhexoside through the loss of the HHDP
Figure 8 Proposal of the loss of the galloyl group by ellagitannins, generating the fragments observed in the positive mode……….. 60
Supplementary material HPLC chromatograms of the aqueous extracts from P. amarus obtained through PLE at 120°C (a) and 192.4°C (b) at 272 nm……… 65
UPLC-QTOF-MSE-based chemometric approach driving the choice of the best
extraction process for Phyllanthus niruri
Figure 1 UPLC-QTOF-MSE chromatograms of P. niruri aqueous extracts obtained through UAE (a), PLE 120 (b), PLE 192 (c) and CE (d)……... 74
Figure 2 PCA score plot generated by Pareto of P. niruri extracts obtained through CE (conventional extraction), PLE (pressurized liquid extraction in temperatures of 120°C and 192°C) and UAE (ultrasound assisted extraction). Ions in negative mode………... 79
Figure 3 OPLS-DA (S-plot) (A) PLE 192 and CE, (B) UAE and CE and ion intensity trend plots (C) of P. niruri extracts in negative mode. 5 (tr 1.78 min, m/z 125.0175), 6 (tr 2.04 min, m/z 247.0224), 10 (tr 2.47 min, m/z
667.0755), 11 (tr 2.64 min, m/z 463.0503), 12 (tr 2.86 min, m/z 649.0686),
13 (tr 2.94 min, m/z 169.0096), 16 (tr 3.23 min, m/z 969.0823), 17 (tr 3.30 min, m/z 951.0721), 20 (tr 3.59 min, m/z 925.0958), 21 (tr 3.70 min, m/z
969.0825), 23 (tr 3.90 min, m/z 951.0732), 25 (tr 4.23 min, m/z 463.0856),
27 (tr 4.74 min, m/z 447.0945) and 28 (tr 4.85 min, m/z 923.0792)……....81
Figure S1 Estimated effects by Pareto plot and response-surface graphs for the phenolics content (mg/g dry plant) in ultrasound-assisted extraction…... 88
Figure S2 Estimated effects by Pareto plot and response-surface graph for the phenolics content (mg/g dry plant) in pressurized liquid extraction……. 89
Figure S3 Structures of the substances identified in P. niruri extracts…………... 90
Figure S4 Major fragments observed in mass spectra of glycosylated flavonoids… 91
Drying kinetics and effect of air-drying temperature on chemical composition of
Phyllanthus amarus and Phyllanthus niruri
Figure 1 Variation of moisture ratio of (A) P. amarus and (B) P. niruri as a function of drying time at temperatures ranging from 50 to 70°C………..100
Figure 2 Arrhenius-type relationship between effective moisture diffusivity and temperature for P. amarus and P. niruri samples……….101
Figure 3 Effect of air-drying temperature on total phenolic content (mg gallic acid equivalent/g dry plant) of P. amarus and P. niruri samples. Data are the mean of three replicates. Different letters above the bars indicate significant difference (p<0.05)………..102
Figure 4 PCA score plot generated by Pareto of Phyllanthus extracts obtained from
P. amarus and P. niruri samples submitted to different drying temperatures. Ions detected in negative mode………….………. 103
Figure 5 OPLS-DA (S-plot) of Phyllanthus extracts obtained from samples submitted to different drying temperatures (A) P. amarus at 50°C and 70°C, (B) P. niruri at 50°C and 70°C. Ions in negative mode. a (tr 4.13 min, m/z 300.9967), b (tr 1.77 min, m/z 125.0233), c (tr 7.16 min, m/z
363.0160), d (tr 4.14 min, m/z 609.1443), e (tr 4.19 min, m/z 463.0852), f (tr 3.59 min, m/z 925.0939), g (tr 3.22 min, m/z 969.0835), h (tr 3.32 min,
m/z 951.0735), i (tr 3.81 min, m/z 593.1484), j (tr 4.11 min, m/z 577.1544),
k (tr 3.13 min, m/z 291.0126)………... 104
High-power ultrasound does not hydrolyze ellagitannins from Phyllanthus amarus Figure 1 UPLC-QTOF-MS/MS chromatograms of of the extracts (a) control, (b)
treated with 188 W/cm2 for 9 min and (c) treated with 373 W/cm2 for 9 min.………... 116
LISTA DE TABELAS REVISÃO DE LITERATURA
Tabela 1 Constituintes químicos de P. amarus... 18
Tabela 2 Constituintes químicos de P. niruri... 21
Tabela 3 Principais classes de compostos fenólicos... 22
Tabela 4 Estudos realizados sobre extração de compostos fenólicos em plantas utilizando ultrassom (melhores condições encontradas)... 27
Tabela 5 Estudos realizados sobre extração de compostos fenólicos em plantas utilizando líquido pressurizado (melhores condições encontradas)... 30
ARTIGOS
Ultrasound-assisted and pressurized liquid extraction of phenolic compounds from
Phyllanthus amarus and its composition evaluation by UPLC-QTOF
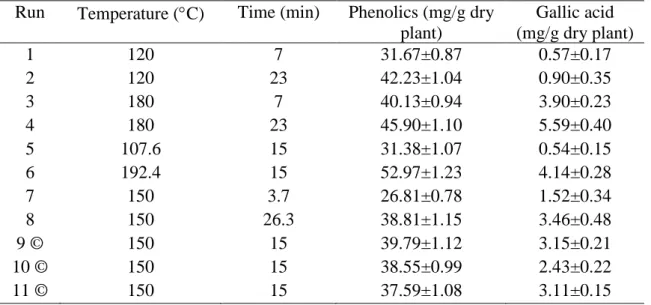
Table 1 Experimental design of ultrasound-assisted extraction and results obtained
in the P. amarus extracts……….. 46
Table 2 Experimental design of pressurized liquid extraction and results obtained
in the P. amarus extracts……….. 49
Table 3 Comparison of different extraction methods of P. amarus……….. 51
Table 4 Compounds determined by UPLC-ESI-QTOF-MS/MS in the P. amarus
aqueous extracts obtained from UAE, PLE and CE techniques………... 54
UPLC-QTOF-MSE-based chemometric approach driving the choice of the best
extraction process for Phyllanthus niruri
Table 1 Compounds tentatively determined by UPLC-QTOF-MS/MS in the P. niruri aqueous extracts obtained from UAE, PLE and CE techniques…. 75
Table S2 Analysis of variance (ANOVA) of the regression model (Eq. 1)………. 87
Table S3 Experimental design of pressurized liquid extraction and results obtained in the P. niruri extracts………...….. 88
Table S4 Analysis of variance (ANOVA) of the regression model (Eq. 2)………. 89
Drying kinetics and effect of air-drying temperature on chemical composition of
Phyllanthus amarus and Phyllanthus niruri
Table 1 Effective moisture diffusivities � and activation energies Ea of P. niruri
and P. amarus at temperatures from 50 to 70 °C at air velocity of 0.5 m/s
………...100
Table 2 The significantly changed components identified by UPLC-QTOF-MS/MS in the P. niruri and P. amarus extracts……… 105
High-power ultrasound does not hydrolyze ellagitannins from Phyllanthus amarus Table 1 Effects of ultrasonic intensity and exposure time on the gallic acid content
of the control extract (pressurized liquid extraction at 120°C/24 min) of P.
SUMÁRIO
1 INTRODUÇÃO ... 13
2 REVISÃO DE LITERATURA ... 16
2.1 O gênero Phyllanthus ... 16
2.1.1 Phyllanthus amarus ... 16
2.1.2 Phyllanthus niruri ... 19
2.2 Extração de compostos fenólicos em plantas ... 22
2.2.1 Extração assistida por ultrassom (EAU) ... 25
2.2.2 Extração com líquido pressurizado (ELP) ... 28
3 ARTIGOS………..38
3.1 Ultrasound-assisted and pressurized liquid extraction of phenolic compounds from Phyllanthus amarus and its composition evaluation by UPLC-QTOF………. 38
3.2 UPLC-QTOF-MSE-based chemometric approach driving the choice of the best extraction process for Phyllanthus niruri…... 66
3.3 Drying kinetics and effect of air-drying temperature on chemical composition of Phyllanthus amarus and Phyllanthus niruri…... 93
3.4 High-power ultrasound does not hydrolyze ellagitannins from Phyllanthus amarus…...110
1. INTRODUÇÃO
Por milênios, as plantas medicinais têm sido uma fonte valiosa de agentes terapêuticos, e muitos dos medicamentos encontrados atualmente são derivados de produtos naturais. Os vegetais representam as maiores fontes de substâncias ativas que podem ser usadas na terapêutica, devido à grande diversidade estrutural de metabólitos produzidos. Nos últimos anos tem havido um renascimento do interesse em fármacos naturais ou à base de plantas. Ao contrário das drogas modernas que geralmente incluem uma única espécie ativa, os extratos vegetais contêm múltiplos constituintes bioativos. Esses compostos podem agir de forma combinada ou sinérgica dentro do corpo humano, e podem fornecer propriedades terapêuticas únicas com efeitos colaterais indesejáveis mínimos ou inexistentes (ATANASOV et al., 2015; BRANDÃO et al., 2010; HUIE, 2002).
No Brasil, cerca de 80% da população utiliza produtos à base de plantas medicinais nos seus cuidados com a saúde, seja pelo conhecimento tradicional, ou nos sistemas oficiais de saúde, como prática de cunho científico, orientada pelos princípios e diretrizes do Sistema Único de Saúde (SUS) (RODRIGUES & DE SIMONI, 2010). Muitos foram os avanços nas últimas décadas com a formulação e implementação de políticas públicas, programas e legislação com vistas à valorização das plantas medicinais e derivados. A Relação Nacional de Plantas Medicinais de Interesse ao SUS (Renisus) apresenta plantas medicinais que possuem potencial para gerar produtos de interesse ao SUS. A finalidade da lista é orientar estudos e pesquisas que possam subsidiar a elaboração da relação de fitoterápicos disponíveis para uso da população, com segurança e eficácia para o tratamento de determinada doença. Dentre as 71 espécies que estão cadastradas no Renisus, constam quatro espécies do gênero
Phyllanthus: P. amarus, P. niruri, P. tenellus e P. urinaria (BRASIL, 2012).
seus constituintes ativos, como lignanas, alcalóides, taninos, terpenos e flavonóides (BAGALKOTKAR et al., 2006; CALIXTO et al., 1998; PATEL et al., 2011).
Para a produção de fitoterápicos, a qualidade é um aspecto importante que envolve todo o processo de produção, englobando tanto o estabelecimento rigoroso de padrões de qualidade da matéria-prima até os processos de preparação de extratos vegetais, a fim de se obter produtos com uniformidade química (CALIXTO, 2001). A composição e a bioatividade de extratos vegetais dependem fortemente do processo de extração utilizado. Atualmente, tem se buscado a utilização de técnicas e processos que reduzam ou eliminem os solventes, reagentes e outros produtos químicos que são perigosos para a saúde humana e para o ambiente. A extração verde baseia-se na descoberta e design de processos de extração que reduzam o consumo de energia, permitam o uso de solventes alternativos de menor impacto ambiental ou evitem o uso de solventes, e a utilização de produtos naturais renováveis e que garantam um extrato seguro e de alta qualidade (ARMENTA et al., 2015). Dentre as técnicas de extração verde aplicadas com sucesso temos a extração assistida por ultrassom e a extração com líquido pressurizado.
O ultrassom de potência é uma técnica que acelera consideravelmente o processo de extração e pode reduzir o consumo de energia. É um processo que utiliza baixa temperatura e de execução rápida, que geralmente não degrada o extrato. Também oferece vantagens em termos de produtividade, rendimento e seletividade, melhora o tempo de processamento, melhora a qualidade, reduz riscos físicos e químicos e é ecologicamente correto (ALEXANDRU et al., 2014). A extração com líquido pressurizado utiliza temperatura e pressão elevadas, que além de melhorar o rendimento de extração, diminui o tempo e consumo de solvente. É realizada em sistemas automatizados e possui alta reprodutibilidade (MUSTAFA & TURNER, 2011). Estas técnicas de extração podem ser aplicadas utilizando água como solvente.
para facilitar a interpretação do grande número de informações obtidas (RODRIGUES et al., 2006).
Um fator importante para a qualidade da matéria-prima vegetal é o processo de secagem. A secagem diminui a velocidade de deterioração do material, por meio da redução no teor de água, reduzindo ainda a ação de enzimas, possibilitando a conservação das plantas por maior tempo. Com a redução da quantidade de água, aumenta-se, também, a quantidade de princípios ativos em relação à massa seca (MELO et al., 2004). A secagem ao ar quente ou secagem convectiva é uma técnica amplamente adotada na indústria (KARAM et al., 2016). Dependendo das condições de secagem, como temperatura, velocidade do ar e tempo, o teor de fitoquímicos do material vegetal pode aumentar ou diminuir, por isso é importante se determinarem as melhores condições de secagem de cada material.
Com base nos fatores citados acima, esta tese de doutorado teve como objetivo geral contribuir para o estudo fitoquímico de duas espécies de quebra-pedra (P. amarus
e P. niruri), determinando as melhores condições de extração aquosa para obtenção de extratos padronizados com alto conteúdo fenólico e com perfil de metabólitos com relevância farmacológica e avaliando o efeito da temperatura de secagem das plantas sobre a composição química. Os objetivos específicos foram:
• Avaliar o efeito de algumas variáveis de extração sobre a extração assistida por ultrassom (EAU) e extração com líquido pressurizado (ELP) na obtenção de compostos fenólicos de P. amarus e P. niruri;
• Comparar conteúdo fenólico e composição química entre os extratos obtidos pelas técnicas de EAU, ELP e extração convencional nas duas espécies, a fim de se definir o método de extração mais adequado;
2. REVISÃO DE LITERATURA 2.1. O gênero Phyllanthus
O gênero Phyllanthus pertence à família Phyllanthaceae, táxon desmembrado da família Euphorbiaceae (APG III, 2009). As plantas pertencentes ao gênero Phyllanthus
estão amplamente distribuídas por países tropicais e subtropicais. Este gênero possui aproximadamente 750 espécies, sendo 200 delas encontradas nas Américas e cerca de 100 no Brasil. As espécies apresentam hábito variado, sendo principalmente herbáceo, havendo, contudo, espécies arbóreas de pequeno porte e arbustos (CALIXTO et al.,
1998; SECCO et al., 2010; SILVA & SALES, 2007).
Entre os representantes do gênero utilizados pelo homem destacam-se as espécies conhecidas no Brasil como quebra-pedra, arrebenta-pedra ou erva-pombinha, entre elas P. niruri L., P. amarus Schum. & Thonn, P. urinaria L. e P. tenellus Roxb. Müll. Arg. (TORRES et al., 2003).
2.1.1. Phyllanthus amarus
É uma erva ou subarbusto, de 14-70 cm. Possui ramificação filantóide, com ramos medindo de 3,2-9 cm, pinatiformes, angulosos. A lâmina foliar é membranácea, elíptica ou oblonga, base obtusa ou ligeiramente assimétrica, ápice obtuso, em geral mucronado, margem inteira com 0,4-1,1 cm de comprimento e 0,3-0,5 cm de largura. A inflorescência apresenta-se em cimeiras proximais onde se encontra uma flor feminina e outra masculina, todas protegidas por duas bractéolas escariosas, lineares (SILVA & SALES, 2007).
Figura 1. Phyllanthus amarus
P. amarus está distribuída pela India e China.Nas Américas é encontrada desde os Estados Unidos até a Argentina. No Brasil distribui-se da região Norte a Sul, crescendo em ambientes úmidos, ou ainda como ruderal ou invasora em áreas agricultáveis. É também comum em jardins e frestas de calçadas. Floresce e frutifica durante todo o ano (PATEL et al., 2011; SILVA & SALES, 2007).
Diversos estudos farmacológicos com P. amarus têm sido publicados. Lee et al. (2011) demonstraram que os extratos aquoso e metanólico inibiram o crescimento de células de câncer de mama e de pulmão. Segundo os autores, a capacidade de P. amarus
exercer atividades antimetastáticas é geralmente associada com a presença de compostos polifenólicos em seus extratos.
A atividade analgésica e anti-inflamatória do extrato aquoso das folhas de P. amarus foi investigada através de modelos térmicos e químicos de avaliação da dor em ratos. O extrato causou uma inibição significativa, de forma dose dependente, do edema de pata induzido por carragenina em ratos. Esse efeito inibitório produzido pelo extrato foi significativamente mais elevado do que a droga de referência (ácido acetilsalicílico). Além disso, o extrato aquoso de P. amarus também apresentou atividade analgésica nas fases precoce e tardia de modelo de dor induzida por injeção de formalina em pata de ratos (IRANLOYE et al., 2011).
O extrato aquoso das folhas de P. amarus bloqueou a ação das enzimas do vírus HIV-1 integrase, transcriptase reversa e protease em diferentes graus, inibindo a replicação do vírus HIV-1, e os elagitaninos isolados geranina e corilagina mostraram ser os mediadores mais potentes desta atividade antiviral (NOTKA et al., 2004).
Alli et al. (2011) avaliaram o efeito de extratos das partes aéreas de P. amarus
contra Bacillus subtilis, Escherichia coli, Pseudomonas aeruginosa, Salmonella typhi,
Staphylococcus aureus e Candida albicans e os extratos aquoso e metanólico foram ativos contra todos os microrganismos estudados.
significativamente reduzido no grupo tratado. As observações clínicas não revelaram efeitos colaterais.
Essas atividades farmacológicas se devem à presença de compostos bioativos. Muitos estudos têm isolado e identificado moléculas de P. amarus e diferentes classes de compostos orgânicos têm sido relatadas, como alcalóides, flavonóides, esteróis, terpenos, lignanas e taninos. A tabela 1 apresenta os metabólitos secundários presentes em P. amarus.
Tabela 1. Constituintes químicos de P. amarus
CLASSE COMPOSTO REFERÊNCIA
ALCALÓIDES 4-metoxi-norsecurinina, dihidrosecurinina, GUO et al. (2015);
epibubbialina, isobubbialina, niruroidina, PATEL et al. (2011);
norsecurinina, securinina QI et al. (2014)
ESTERÓIS amarosterol-A e amarosterol B PATEL et al. (2011);
QI et al. (2014)
FLAVONÓIDES astragalina, galocatequina, kaempferol, GUO et al. (2015);
kaempferol-3-O-rutinosídeo, luteolina, KUMAR et al. (2015);
miricetrina, quercetina, quercitrina, PATEL et al. (2011);
quercetina-3-O-glucosídeo, rutina SPRENGER & CASS,
2013; QI et al. (2014)
LIGNANAS 3-(3,4-dimetoxi-benzil)-4-(7-methoxi-benzo [1,3] GUO et al. (2015);
dioxol-5-il-metil)-dihidrofuran-2-onae KUMAR et al. (2015);
4-(3,4-dimetoxi-fenil)-1-(7-metoxi-benzo PATEL et al. (2011);
[1,3]dioxol-5-il)-2,3-bis-metoximetil-butan-1-ol QI et al. (2014)
5-demetoxinirantina, filantina, filtetralina,
hipofilantina, hinoquinina, isonirtetralina,
lintetralina, nirantina, nirtetralina,
virgatusina, pinoresinol
ÓLEOS VOLÁTEIS linalool e fitol PATEL et al. (2011)
TANINOS 1,6-digaloilglucopiranose, ácido 4-O-galoilquínico, GUO et al. (2015);
HIDROLISÁVEIS ácido amariínico, ácido geraniínico B, ácido KUMAR et al. (2015);
repandusínico A, amariina, amarulona, castalina, PATEL et al. (2011);
corilagina, elaeocarpusina, emblicanina A, furosina, SPRENGER & CASS
filantusiina A, B, C e D, geraniina, melatonina (2013); QI et al. (2014)
TERPENOS ácido oleanólico, ácido ursólico, filantenol, KUMAR et al. (2015);
filantenona, filanteol, lupeol PATEL et al. (2011)
OUTROS ácido carboxílico da brevifolina, GUO et al. (2015);
ácido gálico, ácido quínico SPRENGER & CASS
ácido tri-O-metilelágico (2013)
2.1.2. Phyllanthus niruri
Erva ou subarbusto, de 12-73 cm. Possui ramificação filantóide, com ramos medindo de 3-15,5 cm, angulosos. Limbo foliar 0,5-1,5×0,25-0,6 cm, membranáceo, oblongo a oblongo-elíptico, oval-oblongo ou oval-elíptico, base oblíqua, ápice obtuso a arredondado. Flores em címulas unissexuais, as estaminadas proximais com 3-7 flores, as pistiladas distais com uma única flor. Brácteas lineares a lanceoladas (SILVA & SALES, 2007). P. niruri diferencia-se de P. amarus pelas folhas assimétricas, inflorescências unissexuais e estiletes capitados, apresentando P. amarus folhas simétricas, inflorescências bissexuais e estiletes agudos (TORRES et al., 2003).
Figura 2. Phyllanthus niruri
Fonte: LORENZI & MATOS (2002).
P. niruri pode ser encontrada na Ásia, Índia e nas Américas, distribuída do Sul do Texas (Estados Unidos) à Argentina, incluindo Antilhas. No Brasil ocorre em todas as regiões, em diferentes tipos vegetacionais, em locais úmidos e sombreados ou em áreas ruderais. Encontrada florida e com frutos durante todo o ano (BAGALKOTKAR et al., 2006; SILVA & SALES, 2007).
crescimento e a agregação dos cristais de CaOx, evidenciando o seu potencial de interferir nas fases iniciais da formação de cálculos renais. P. niruri também modificou a estrutura do cálculo em ratos para uma forma mais suave e, possivelmente, mais frágil que poderia facilitar a remoção ou dissolução dos cálculos (BARROS et al., 2006). Um estudo clínico demonstrou que cápsulas contendo extrato aquoso liofilizado de P. niruri
reduziram o cálcio urinário em pacientes hipercalciúricos (NISHIURA et al., 2004). A atividade hepatoprotetora de P. niruri contra a cirrose hepática induzida por tioacetamida (TAA) em ratos foi avaliada. Os animais receberam injeções intraperitoneais de TAA três vezes por semana e tratamentos diários com o extrato de P. niruri por via oral durante oito semanas. Os resultados revelaram que o tratamento com
P. niruri reduziu significativamente o efeito de toxicidade de TAA, apresentando o extrato uma atividade hepatoprotetora eficaz. Na fração ativa de P. niruri foram isolados dois compostos: ácido 4-O-cafeoilquínico e quercetina-3-O-ramnosídeo (AMIN et al., 2013).
Couto et al. (2013) estudaram as atividades anti-inflamatória e antialodínica (analgésica) de extratos aquosos de diferentes partes de P. niruri. Os extratos das folhas ou de folhas+caules demonstraram um prolongamento da ação antialodínica. Além disso, o extrato das folhas diminuiu significativamente a inflamação. Foi observada uma relação direta entre os efeitos anti-inflamatórios e analgésicos com o teor de ácido gálico, mas a utilização do extrato de folhas+caules mostrou ser mais eficaz, o que sugere um efeito sinérgico entre os seus constituintes. A corilagina, que é encontrada em abundância em extratos de P. niruri, também foi identificada como um tanino anti-hiperalgésico (analgésico), que deriva a sua atividade a partir de seu envolvimento no sistema glutamatérgico (MOREIRA et al., 2013).
O potencial hipoglicêmico do extrato metanólico das partes aéreas de P. niruri
foi avaliado em ratos normais e diabéticos. A administração oral do extrato causou uma significativa redução nos níveis de glicose no sangue de um modo dose dependente, bem como nos níveis de colesterol total e triglicérides em ratos diabéticos e normoglicêmicos. Os resultados sugerem que o extrato das partes aéreas de P. niruri
tem grande potencial como fármaco antidiabético (OKOLI et al., 2010).
Tabela 2. Constituintes químicos de P. niruri
CLASSE COMPOSTO REFERÊNCIA
ALCALÓIDES 4-metoxi-norsecurinina, alosecurinina, BAGALKOTKAR et al.
Nirurina, norsecurinina, securinina (2006); CALIXTO et al.
(1998); QI et al. (2014)
ESTERÓIS β-sitosterol, estradiol CALIXTO et al. (1998)
FLAVONÓIDES astragalina, (-)-epigalocatequina, BAGALKOTKAR et al.
(-)-epigalocatequina-3-O-galato, (2006); CALIXTO et al.
eriodictiol-7-O-α-L-ramnopiranosídeo, (1998); QI et al. (2014);
kaempferol-4’-O-α-L-ramnopiranosídeo, SPRENGER & CASS
galocatequina, miricetrina, niruriflavona, (2013)
orientina, orientina-2”-O-ramnosídeo, quercetina, quercetina-3-O-β-D-glucopiranosil-(1→2)-β-D- xilopiranosídeo, quercetina-3-O-glucosídeo,
quercitrina, rutina, vitexina-2”-O-ramnosídeo
LIGNANAS 4-hidroxisecolintetralina, filantina, filnirurina, BAGALKOTKAR et al.
filtetralina, hidroxinirantina, hinoquinina, (2006); CALIXTO et al.
hipofilantina, isolintetralina, linantina, lintetralina, (1998); QI et al. (2014);
neonirtetralina, nirantina, nirfilina, nirtetralina,
secoisolariciresinol trimetil eter, sesamin-4-ol
TANINOS ácido repandusínico A, β-glicogalina, BAGALKOTKAR et al.
HIDROLISÁVEIS corilagina, filantusiina D, geraniina, (2006); QI et al. (2014);
Isocorilagina SPRENGER & CASS
(2013)
TERPENOS filantenol,filantenona, filanteol, limoneno, BAGALKOTKAR et al.
lupeol, ρ-cimeno (2006); QI et al. (2014)
OUTROS 1-O-galoil-6-O-luteoil-α-D-glucopiranosídeo, BAGALKOTKAR et al.
ácido carboxílico da brevifolina, ácido elágico, (2006); QI et al. (2014);
ácido gálico, brevifolina, filangina, nirurisídeo, SPRENGER & CASS
2.2. Extração de compostos fenólicos em plantas
Compostos fenólicos são importantes metabólitos secundários sintetizados por plantas durante o desenvolvimento normal e em resposta a condições de estresse como infecções, ferimentos, radiações UV, dentre outros. Eles são biossintetizados através de duas rotas metabólicas: a do ácido chiquímico e a do ácido malônico, que levam a diferentes classes de compostos que são resumidos na Tabela 3 (AZMIR et al., 2013; SANTOS-BUELGA et al., 2012). Eles podem ocorrer em suas fontes naturais de forma livre, como derivados glicosilados, e como estruturas oligoméricas ou polimerizadas, tais como os taninos hidrolisáveis e condensados. Eles também podem ser encontrados ligados aos componentes da matriz da planta, como constituintes de parede celular, carboidratos ou proteínas (SANTOS-BUELGA et al., 2012).
Tabela 3. Principais classes de compostos fenólicos
CLASSE ESQUELETO BÁSICO EXEMPLOS
FENÓLICOS SIMPLES
(C6)
OH Floroglucinol, catecol,
resorcinol, vanilina,
seringaldeído
ÁCIDOS FENÓLICOS
Ácidos hidroxibenzóicos
(C6-C1)
COOH
ácido salicílico, ácido
siríngico, ácido gálico
ácidos hidroxicinâmicos
C6-C3) e derivados
COOH
ácido cafeico, ácido
cumárico, ácido ferúlico
CUMARINAS (C6-C3) O O escopoletina,
umbeliferona,
aesculetin
NAFTOQUINONAS
(C6-C4)
O
O
juglona, pumblagina
XANTONAS (C6-C1-C6) O
O
ESTILBENOS (C6-C2-C6) resveratrol, piceid,
e-viniferina
FLAVONÓIDES
(C6-C3-C6)
Flavan-3-óis O OH epicatequina, epigalocatequina Flavonas O O apigenina, luteolina, crisina, escutelareína, diosmetina, crisoeriol Flavonóis O O OH quercetina, kaempferol, miricetina, galangina, fisetina, morina Flavanonas O O hesperidina, naringenina, taxifolina, eriodictiol, isosakuranetina Antocianinas O OH cianidina, delfinidina, malvidina, peonidina, pelargonidina, petunidina
Isoflavonas O
O genisteína, daidzeína, gliciteína, puerarina, formononetina, biochanina A Taninos condensados (proantocianidinas)
(C6-C3-C6)n
Taninos hidrolisáveis (galotaninos, elagitaninos) O O O O O O O OH O O OH OH OH OH HO HO HO HO OH HO O O OH OH OH O HO O
ácido amariínico, ácido
repandusínico A,
amariina, amarulona,
castalina, corilagina,
filantusiina D, furosina,
geraniina,emblicanina
A, pentagaloilglucose
Lignanas (C6-C2)2 filantina, hipofilantina,
nirantina, hinoquinina,
nirtetralina, filtetralina,
virgatusina
Ligninas (C6-C3)n
O O HO O HO O O O CH3
H3C
CH3
Fonte: adaptado de SANTOS-BUELGA et al. (2012).
Devido à complexidade da maioria das matrizes, o procedimento de preparação da amostra é uma etapa crítica de todo o processo. Secagem, moagem e homogeneização são pré-tratamentos comuns antes da extração. A secagem aumenta a estabilidade do material e a moagem frequentemente melhora a cinética da extração dos analitos (ONG, 2004; SANTOS-BUELGA et al., 2012).
Os métodos de extração geralmente indicados em farmacopeias são o aquecimento sob refluxo, extração por Soxhlet e a maceração. No entanto, tais métodos podem ser demorados, requerer o uso de grande quantidade de solvente orgânico e podem apresentar menor eficiência de extração (ONG, 2004). Assim, o uso de tecnologias verdes para reduzir e/ou eliminar o uso ou a produção de materiais perigosos e que sejam mais eficientes é altamente desejável. Algumas das técnicas mais promissoras são a extração assistida por ultrassom e a extração com líquido pressurizado.
2.2.1. Extração assistida por ultrassom (EAU)
Ultrassom é um tipo especial de onda sonora com frequência entre 20 e 100 KHz que promove vibrações em um meio líquido e causa o fenômeno de cavitação, onde há a produção, o crescimento e o colapso de bolhas. Esse colapso gera uma onda de choques que circulam pelo meio líquido e resultam em impacto e aumento da tensão de cisalhamento (PESSOA JÚNIOR & KILIKIAN, 2005). O principal benefício da EAU pode ser observado na amostra vegetal sólida, porque a energia de ultrassom facilita a lixiviação de compostos orgânicos e inorgânicos da matriz da planta (HERRERA & LUQUE DE CASTRO, 2005). O provável mecanismo do ultrassom é a intensificação da transferência de massa e acesso acelerado do solvente a materiais celulares de partes da planta. O teor de umidade da amostra, o tamanho de partícula e o solvente são fatores muito importantes para a obtenção de uma extração eficiente. Além disso, a temperatura, a frequência, a potência e o tempo de sonicação são fatores decisivos para a ação do ultrassom. As vantagens da EAU incluem a redução no tempo de extração, energia e utilização de solvente. A energia ultrassônica para a extração também facilita uma mistura mais efetiva, acelera a transferência de energia, reduz os gradientes térmicos e temperatura de extração, extração seletiva, reduzido tamanho do equipamento e aumento da produção (AZMIR et al., 2013).
diretamente preso no fundo da cuba do aparelho e a energia ultrassonora é transmitida através de um líquido, usualmente a água. A energia é irradiada verticalmente pelas ondas sonoras geradas na base do banho e transmitidas através das paredes do vaso para o frasco com a mistura extratora (TIWARI, 2015; VINATORU, 2001). Apresenta como vantagens uma melhor distribuição de energia através das paredes do vaso de extração e o fato de não requerer adaptação especial para o frasco extrator. Apresenta como desvantagens o fato de que a quantidade de energia fornecida para o frasco extrator não é facilmente quantificável, porque depende do tamanho do banho, do tipo de recipiente, da espessura das paredes do recipiente e da posição do frasco de extração no banho. É difícil controlar a temperatura do sistema, pois o equipamento tende a aquecer quando usado por longos períodos (a temperatura do meio extrator é mais alta que a temperatura do líquido no banho) (VINATORU, 2001).
Figura 3. Esquema de sistemas de aplicação de ondas ultrassonoras: a) sonda, b) banho
A sonda, por outro lado, encontra-se fixada na extremidade do amplificador do transdutor, em contato direto com o sistema extrator. Apresenta como vantagens a potência totalmente disponível (não há transferência de irradiação ultrassônica pelas paredes do vaso) e a possibilidade de ser ajustada para fornecer um melhor desempenho a diferentes potências. Como desvantagens apresenta: frequência fixa e dificuldade de controle de temperatura em sistemas sem refrigeração. A sonda ultrassônica permite melhores rendimentos de extração que o banho de ultrassom (TIWARI, 2015; VINATORU, 2001).
Tabela 4. Estudos realizados sobre extração de compostos fenólicos em plantas
utilizando ultrassom (melhores condições encontradas) Material Solvente Frequência
(KHz) Potência (W) Tempo (min) Razão L/S
(mL/g) Referência
Pistacia
lentiscus Etanol/ água 24 68 14 40 DAHMOUNE et al. (2015)
Cassia
auriculata Metanol/ água - 50 5 25 SHARMILA et al. (2016)
Garcinia
indica Água 24 200 35 10 NAYAK.& RASTOGI (2013)
Mangifera
indica Etanol/ água 40 200 19 38 ZOU et al. (2014)
Sparganii rizoma
Etanol/
água 25 300 40 19 WANG et al. (2013)
Garcinia
mangostana Etanol 20 100 25 20 CHEOK et al. (2013)
Psidium
Guajava Água - 1100 5 12 LIU et al. (2014)
Euryale ferox Etanol/ água 53 500 21 31 LIU et al. (2013)
Areca catechu
Acetona/
água 20 30 50 10 SINGHAL (2013) CHAVAN &
Origanum
majorana Água 20 1500 15 50
HOSSAIN et al. (2012)
(2016) quando se elevou a potência de 30 para 50 W a extração de polifenóis aumentou. De acordo com os autores, a potência de sonicação é um parâmetro chave para aumentar a eficiência da extração por promover o rompimento da célula da planta, permitindo que o solvente se difunda mais facilmente e extraia os compostos fenólicos. Wang et al. (2013) também observaram um aumento, de aproximadamente 40%, no rendimento de extração de fenólicos quando a potência passou de 150 para 300 W. Já Chavan & Singhal (2013) verificaram um efeito negativo da potência. O aumento da potência pode elevar a temperatura do meio de extração devido à geração de calor e diminuir o rendimento de extração de fenóis, provavelmente devido a decomposição. Outras variáveis estudadas foram: porporção de solvente (etanol, metanol, acetona) em água, temperatura, amplitude e ciclo de sonicação.
2.2.2. Extração com líquido pressurizado (ELP)
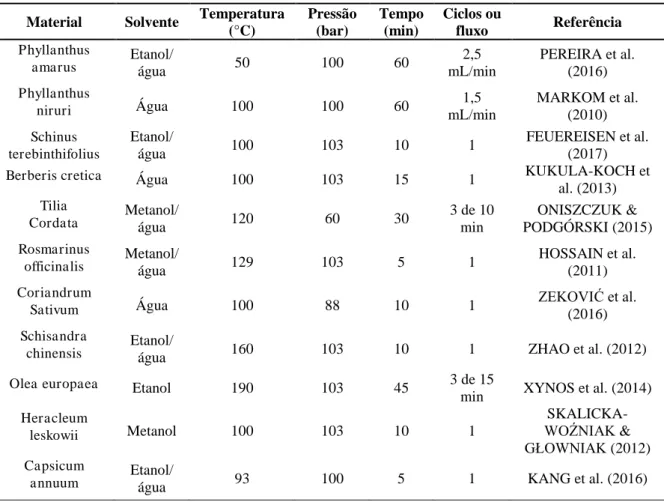
Este método é conhecido por vários nomes, extração com fluido pressurizado, extração com solvente acelerado e extração com solvente a alta pressão. A técnica é referida como extração com água quente pressurizada (PHWE), extração com água subcrítica ou extração com água superaquecida quando a água é utilizada como o agente de extração. O conceito de ELP é a aplicação de alta pressão, mantendo o solvente líquido em temperatura além do seu ponto de ebulição normal. A técnica de ELP requer pequenas quantidades de solventes, por causa da combinação de alta pressão e temperatura que permite extrair mais rápido. A temperatura de extração elevada pode promover uma maior solubilidade dos compostos e aumento da taxa de transferência de massa, além de diminuir a viscosidade e tensão superficial de solventes, melhorando assim a taxa de extração (HUIE, 2002; HENG et al., 2013).
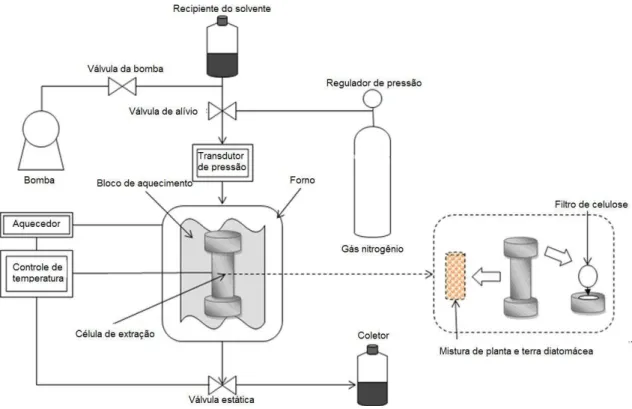
Por outro lado, para ELP em modo estático, uma vez que os parâmetros de temperatura e pressão são atingidos, a extração é realizada por um tempo predeterminado. A faixa comum é de 5-15 minutos que é feita em ciclos diferentes. Comparado a ELP em modo dinâmico, o processo de extração em modo estático compreende um ou vários ciclos de extração com a substituição do solvente entre os ciclos. A célula contendo a amostra é purgada com um gás inerte para lavar o solvente da célula. Uma ampla faixa de temperatura de extração desde a temperatura ambiente até 200C e a faixa de pressão de 35-200 bar podem ser aplicadas para ELP (MUSTAFA & TURNER, 2011; HENG et al., 2013). A figura 4 apresenta um diagrama esquemático do funcionamento de um extrator com líquido pressurizado.
Figura 4. Esquema de funcionamento de um extrator com líquido pressurizado (ELP)
Fonte: adaptado de KO et al. (2011)
já que a EFS é mais seletiva para compostos de baixa ou média polaridade (AZMIR et al., 2013).
Tabela 5. Estudos realizados sobre extração de compostos fenólicos em plantas
utilizando líquido pressurizado (melhores condições encontradas) Material Solvente Temperatura
(°C) Pressão (bar) Tempo (min) Ciclos ou
fluxo Referência
Phyllanthus
amarus Etanol/ água 50 100 60 mL/min 2,5 PEREIRA et al. (2016)
Phyllanthus
niruri Água 100 100 60 mL/min 1,5 MARKOM et al. (2010)
Schinus terebinthifolius
Etanol/
água 100 103 10 1
FEUEREISEN et al. (2017)
Berberis cretica Água 100 103 15 1 KUKULA-KOCH et
al. (2013) Tilia
Cordata Metanol/ água 120 60 30 3 de 10 min PODGÓRSKI (2015) ONISZCZUK &
Rosmarinus
officinalis Metanol/ água 129 103 5 1 HOSSAIN et al. (2011)
Coriandrum
Sativum Água 100 88 10 1 ZEKOVIĆ et al. (2016)
Schisandra
chinensis Etanol/ água 160 103 10 1 ZHAO et al. (2012)
Olea europaea Etanol 190 103 45 3 de 15
min XYNOS et al. (2014)
Heracleum
leskowii Metanol 100 103 10 1
SKALICKA-WOŹNIAK & GŁOWNIAK (2012) Capsicum
annuum Etanol/ água 93 100 5 1 KANG et al. (2016)
térmicas quando se utilizaram temperaturas elevadas, acima de 120°C, em compostos termosensíveis. A segunda variável mais estudada é o solvente de extração. Os mais utilizados são: água, etanol, metanol e a mistura de etanol ou metanol com água. 64% dos trabalhos apresentaram a mistura de álcool com água como melhor solvente para extração. De acordo com Mustafa & Turner (2011), o uso de uma mistura hidroalcoólica como solvente melhora a solubilização dos compostos alvo e sua dessorção da matriz vegetal. A utilização da água como solvente também é adequada neste sistema porque, com o aumento da temperatura a alta pressão, a água torna-se menos polar devido à diminuição da sua constante dielétrica, ficando com uma polaridade semelhante a dos álccois (MARKOM et al., 2010). Outra variável bastante avaliada é o tempo de extração. Nos estudos que utilizaram o sistema de extração em modo dinâmico (MARKOM et al., 2010; PEREIRA et al., 2016) o tempo total de extração foi de 60 min. Já nos trabalhos que utilizaram o processo de extração em modo estático, o tempo ótimo de extração variou de 5 a 15 min em 1 ou 3 ciclos.
REFERÊNCIAS
ALEXANDRU, L.; BINELLO, A.; MANTEGNA, S.; BOFFA, L.; CHEMAT, F.; CRAVOTTO, G. Efficient green extraction of polyphenols from post-harvested agro-industry vegetal sources in Piedmont. Comptes Rendus Chimie, v. 17, p. 212–217, 2014.
ALLI, A. I.; EHINMIDU, J. O.; IBRAHIM, Y. K. E. Preliminary phytochemical screening and antimicrobial activities of some medicinal plants used in Ebiraland.
Bayero Journal of Pure and Applied Sciences, v. 4, n. 1, p. 10–16, 2011.
AMIN, Z. A.; ALSHAWSH, M. A.; KASSIM, M.; ALI, H. M.; ABDULLA, M. A. Gene expression profiling reveals underlying molecular mechanism of hepatoprotective effect of Phyllanthus niruri on thioacetamide-induced hepatotoxicity in Sprague
Dawley rats. BMC Complementary and Alternative Medicine, 13:160, 2013. APG III. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG III. Botanical Journal of the Linnean Society, v. 161, p. 105–121, 2009.
ATANASOV, A. G.; WALTENBERGER, B.; PFERSCHY-WENZIG, E. M.; LINDER, T.; WAWROSCH, C.; UHRIN, P.; TEMML, V.; WANG, L.; SCHWAIGER, S.;
HEISS, E. H.; ROLLINGER, J. M.; SCHUSTER, D.; BREUSS, J. M.; BOCHKOV, V.; MIHOVILOVIC, M. D.; KOPP, B.; BAUER, R.; DIRSCH, V. M.; STUPPNER, H. Discovery and resupply of pharmacologically active plant-derived natural products: A review. Biotechnology Advances, v. 33, p. 1582-614, 2015.
AZMIR, J.; ZAIDUL, I. S. M.; RAHMAN, M. M.; SHARIF, K. M.; MOHAMED, A.; SAHENA, F.; JAHURUL, M. H. A.; OMAR, A. K. M. Techniques for extraction of bioactive compounds from plant materials: A review. Journal of Food Engineering, v. 117, n. 4, p. 426-436, 2013.
BAGALKOTKAR, G.; SAGINEEDU, S. R.; SAAD, M. S.; STANSLAS, J.
Phytochemicals from Phyllanthus niruri Linn. and their pharmacological properties: A review. Journal of Pharmacy and Pharmacology, v. 58, p. 1559-1570, 2006.
BARROS, M. E.; SCHOR, N.; BOIM, M. A. Effects of an aqueous extract from Phyllanthus niruri on calcium oxalate crystallization in vitro. Urological Research, v. 30, n. 6, p. 374–379, 2003.
BARROS, M. E.; LIMA, R.; MERCURI, L. P.; MATOS, J. R.; SCHOR, N.; BOIM, M. A. Effect of extract of Phyllanthus niruri on crystal deposition in experimental
urolithiasis. Urological Research, v. 34, n. 6, p. 351-357, 2006.
BRANDÃO, H. N.; DAVID, J. P.; COUTO, R. D.; NASCIMENTO, J. A. P.; DAVID, J. M. Química e farmacologia de quimioterápicos antineoplásicos derivados de plantas.
Química Nova, v. 33, n. 6, p. 1359-1369, 2010.
BRASIL. Ministério da Saúde. Secretaria de Atenção à Saúde. Práticas integrativas e complementares: plantas medicinais e fitoterapia na Atenção Básica. Brasília:
Ministério da Saúde, 2012.
CALIXTO, J. B.; SANTOS, A. R. S.; CECHINEL FILHO, V.; YUNES, R. A. A review of the plants of the genus Phyllanthus: their chemistry, pharmacology, and therapeutic potential. Medicinal Research Reviews, v.18, n. 4, p. 225-258, 1998.
CALIXTO, J. B. Medicamentos Fitoterápicos. Plantas Medicinais: sob a ótica da
química medicinal moderna. Chapecó, SC, Editora Argos, 2001. p. 500.
CHAVAN, Y. & SINGHAL, R. S. Ultrasound-assisted extraction (UAE) of bioactives from arecanut (Areca catechu L.) and optimization study using response surface
methodology. Innovative Food Science & Emerging Technologies, v. 17, p. 106-113, 2013.
CHEOK, C. Y.; CHIN, N. L.; YUSOF, Y. A.; TALIB, R. A.; LAW, C. L. Optimization of total monomeric anthocyanin (TMA) and total phenolic content (TPC) extractions from mangosteen (Garcinia mangostana Linn.) hull using ultrasonic treatments.
Industrial Crops and Products, v. 50, p. 1-7, 2013.
COUTO, A. G.; KASSUYA, C. A. L.; CALIXTO, J. B.; PETROVICK, P. R.
dried powders from Phyllanthus niruri leaves, stems, roots and whole plant. Revista
Brasileira de Farmacognosia, v. 23, p. 124-131, 2013.
DAHMOUNE, F.; REMINI, H.; DAIRI, S.; AOUN, O.; MOUSSI, K.; BOUAOUDIA-MADI, N.; ADJEROUD, N.; KADRI, N.; LEFSIH, K.; BOUGHANI, L.; MOUNI, L.; NAYAK, B.; MADANI, K. Ultrasound assisted extraction of phenolic compounds from
P. lentiscus L. leaves: Comparative study of artificial neural network (ANN) versus degree of experiment for prediction ability of phenolic compounds recovery. Industrial
Crops and Products, v. 77, p. 251-261, 2015.
FEUEREISEN, M. M.; GAMERO BARRAZA, M.; ZIMMERMANN, B. F.; SCHIEBER, A.; SCHULZE-KAYSERS, N. Pressurized liquid extraction of anthocyanins and biflavonoids from Schinus terebinthifolius Raddi: A multivariate optimization. Food Chemistry, v. 214, p. 564-571, 2017.
GUO, J.; CHEN, Q.; WANG, C.; QIU, H.; LIU, B.; JIANG, Z.-H.; ZHANG, W. Comparison of two exploratory data analysis methods for classification of Phyllanthus
chemical fingerprint: unsupervised vs. supervised pattern recognition technologies.
Analytical and Bioanalytical Chemistry, v. 407, p. 1389-1401, 2015.
HENG, M. Y.; TAN, S. N.; YONG, J. W. H.; ONG, E. S. Emerging green technologies for the chemical standardization of botanicals and herbal preparations. TrAC - Trends
in Analytical Chemistry, v. 50, p. 1-10, 2013.
HERRERA, M. C. & LUQUE DE CASTRO, M. D. Ultrasound-assisted extraction of phenolic compounds from strawberries prior to liquid chromatographic separation and photodiode array ultraviolet detection. Journal of Chromatography, v. 1100, n. 1, p. 1–7, 2005.
HOSSAIN, M. B.; BARRY-RYAN, C.; MARTIN-DIANA, A. B.; BRUNTON, N. P. Optimisation of accelerated solvent extraction of antioxidant compounds from rosemary (Rosmarinus officinalis L.), marjoram (Origanum majorana L.) and oregano (Origanum vulgare L.) using response surface methodology. Food Chemistry, v. 126, n. 1, p. 339-346, 2011.
HOSSAIN, M. B.; BRUNTON, N. P.; PATRAS, A.; TIWARI, B.; O'DONNELL, C. P.; MARTIN-DIANA, A. B.; BARRY-RYAN, C. Optimization of ultrasound assisted extraction of antioxidant compounds from marjoram (Origanum majorana L.) using response surface methodology. Ultrasonics Sonochemistry, v. 19, n. 3, p. 582-590, 2012.
HUIE, C. W. A review of modern sample-preparation techniques for the extraction and analysis of medicinal plants. Analytical and Bioanalytical Chemistry, v. 373, n. 1-2, p. 23-30, 2002.
IRANLOYE, B. O.; OWOYELE, V. B.; KELANI, O. R.; OLALEYE, S. B. Analgesic activity of aqueous leaf extracts of Phyllanthus amarus. African Journal of Medicine
and Medical Sciences, v. 40, p. 47–50, 2011.
KANG, J. H.; KIM, S.; MOON, B. Optimization by response surface methodology of lutein recovery from paprika leaves using accelerated solvent extraction. Food
KARAM, M. C.; PETIT, J.; ZIMMER, D.; DJANTOU, E. B.; SCHER, J. Effects of drying and grinding in production of fruit and vegetable powders: A review. Journal of
Food Engineering, v. 188, p. 32-49, 2016.
KO, M. J.; CHEIGH, C. I.; CHO, S. W.; CHUNG, M. S. Subcritical water extraction of flavonol quercetin from onion skin. Journal of Food Engineering, v. 102, p. 327–333, 2011.
KUKULA-KOCH, W.; ALIGIANNIS, N.; HALABALAKI, M.; SKALTSOUNIS, A. L.; GLOWNIAK, K.; KALPOUTZAKIS, E. Influence of extraction procedures on phenolic content and antioxidant activity of Cretan barberry herb. Food Chemistry, v. 138, n. 1, p. 406-413, 2013.
KUMAR, S.; CHANDRA, P.; BAJPAI, V.; SINGH, A.; SRIVASTAVA, M.; MISHRA, D. K.; KUMAR, B. Rapid qualitative and quantitative analysis of bioactive compounds from Phyllanthus amarus using LC/MS/MS techniques. Industrial Crops and
Products, v. 69, p. 143-152, 2015.
LEE, S. H.; JAGANATH, I. B.; WANG, S. M.; SEKARAN, S. D. Antimetastatic effects of Phyllanthus on human lung (A549) and breast (MCF-7) cancer cell lines.
PLoS ONE, v. 6, n. 6, e20994, doi:10.1371/journal.pone.0020994, 2011.
LIU, C. H.; WANG, Y. C.; LU, H. C.; CHIANG, W. D. Optimization of ultrasound-assisted extraction conditions for total phenols with anti-hyperglycemic activity from
Psidium guajava leaves. Process Biochemistry, v. 49, n. 10, p. 1601-1605, 2014. LIU, Y.; WEI, S.; LIAO, M. Optimization of ultrasonic extraction of phenolic compounds from Euryale ferox seed shells using response surface methodology.
Industrial Crops and Products, v. 49, p. 837-843, 2013.
LORENZI, H. & MATOS, F. J. A. Plantas Medicinais no Brasil: Nativas e Exóticas.
Instituto Plantarum, Nova Odessa, 2002.
MARKOM, M.; HASAN, M.; DAUD, W. R. W. Pressurized water extraction of hydrolysable tannins from Phyllanthus niruri Linn. Separation Science and
Technology, v. 45, p. 548-553, 2010.
MELO, E. DE C.; RADÜNZ, L. L.; ALVARENGA E MELO, R. C. Influência do processo de secagem na qualidade de plantas medicinais – revisão. Engenharia na
Agricultura, Viçosa, MG, v.12, n.4, 307-315, 2004.
MOREIRA, J.; KLEIN-JÚNIOR, L. C.; CECHINEL FILHO, V.; DE CAMPOS BUZZI, F. Anti-hyperalgesic activity of corilagin, a tannin isolated from Phyllanthus niruri L. (Euphorbiaceae). Journal of Ethnopharmacology, v. 146, n. 1, p. 318-323, 2013.
NAYAK, C. A. & RASTOGI, N. K. Optimization of solid–liquid extraction of
phytochemicals from Garcinia indica Choisy by response surface methodology. Food
Research International, v. 50, n. 2, p. 550-556, 2013.
NISHIURA, J. L.; CAMPOS, A. H.; BOIM, M. A.; HEILBERG, I. P.; SCHOR, N.
Phyllanthus niruri normalizes elevated urinary calcium levels in calcium stone forming (CSF) patients. Urological Research, v. 32, n.5, p. 362-366, 2004.
NOTKA, F.; MEIER, G. R.; WAGNER, R. Concerted inhibitory activities of
Phyllanthus amarus on HIV replication in vitro and ex vivo. Journal of Antiviral
Research, v. 64, p. 93–102, 2004.
OKOLI, C. O.; IBIAM, A. F.; EZIKE, A. C.; AKAH, P. A.; OKOYE, T. C. Evaluation of antidiabetic potentials of Phyllanthus niruri in alloxan diabetic rats. African Journal
of Biotechnology, v. 9, p. 248–259, 2010.
ONG, E. S. Extraction methods and chemical standardization of botanicals and herbal preparations. Journal of Chromatography B, v. 812, n. 1–2, p. 23-33, 2004.
ONISZCZUK, A. & PODGÓRSKI, R. Influence of different extraction methods on the quantification of selected flavonoids and phenolic acids from Tilia cordata
inflorescence. Industrial Crops and Products, v. 76, p. 509-514, 2015.
PATEL, J. R.; TRIPATHI, P.; SHARMA, V.; CHAUHAN, N. S.; DIXIT, V. K.
Phyllanthus amarus: ethnomedicinal uses, phytochemistry and pharmacology: a review.
Journal of Ethnopharmacology, v. 138, p. 286–313, 2011.
PEREIRA, R. G.; GARCIA, V. L.; NOVA RODRIGUES, M. V.; MARTÍNEZ, J. Extraction of lignans from Phyllanthus amarus Schum. & Thonn using pressurized liquids and low pressure methods. Separation and Purification Technology, v. 158, p. 204-211, 2016.
PESSOA JÚNIOR, A.; KILIKIAN, B. V. Purificação de Produtos Biotecnológicos. 1. ed. Barueri, SP: Manole, 2005.
QI, W; HUA, L; GAO, K. Chemical constituents of the plants from the genus
Phyllanthus. Chemistry Biodiversity, v. 11, p. 364-395, 2014.
RODRIGUES, A. G. & DE SIMONI, C. Plantas medicinais no contexto de políticas públicas. Informe Agropecuário, Belo Horizonte, v. 31, n. 255, p. 7-12, 2010. RODRIGUES, M. V. N.; REHDER, V. L. G.; SARTORATTO, A.; BOAVENTURA JÚNIOR, S.; SANTOS, A. S. O emprego de técnicas hifenadas no estudo de plantas medicinais. MultiCiência: Construindo a história dos produtos naturais, v. 7, 2006. SANTOS-BUELGA, C.; MANZANO, S.; DUEÑAS, M.; GONZALEZ-PARAMAS, A. M. Extraction and isolation of phenolic compounds. Methods in
Molecular Biology, v. 864, p. 427-464, 2012.
Andrea Jakobsson Estúdio: Instituto de Pesquisas Jardim Botânico do Rio de
Janeiro, v. 2, p. 1439-1442, 2010.
SHARMILA, G.; NIKITHA, V. S.; ILAIYARASI, S.; DHIVYA, K.; RAJASEKAR, V.; MANOJ KUMAR, N.; MUTHUKUMARAN, K.; MUTHUKUMARAN, C. Ultrasound assisted extraction of total phenolics from Cassia auriculata leaves and evaluation of its antioxidant activities. Industrial Crops and Products, v. 84, p. 13-21, 2016.
SILVA, M. J. & SALES, M. F. Phyllanthus L. (Phyllanthaceae) em Pernambuco, Brasil. Acta Botânica Brasílica, v. 21, n. 1, p. 79-98, 2007.
SKALICKA-WOŹNIAK, K. & GŁOWNIAK, K. Pressurized liquid extraction of coumarins from fruits of Heracleum leskowii with application of solvents with different polarity under increasing temperature. Molecules, v. 17, n. 4, p. 4133-4141, 2012. SPRENGER, R. F. & CASS, Q. B. Characterization of four Phyllanthus species using liquid chromatography coupled to tandem mass spectrometry. Journal of
Chromatography A, v. 1291, p. 97-103, 2013.
SRIVIDYA, N. & PERIWAL, S. Diuretic, hypotensive and hypoglycaemic effect of
Phyllanthus amarus. Indian Journal of Experimental Biology, v. 33, p. 861–864, 1995.
TIWARI, B. K. Ultrasound: A clean, green extraction technology. Trends in
Analytical Chemistry, v. 71, p. 100-109, 2015.
TORRES, D. S. C.; CORDEIRO, I.; GIULIETTI, A. M. O gênero Phyllanthus
L.(Euphorbiaceae) na Chapada Diamantina, Bahia, Brasil. Acta Botânica Brasílica, v. 17, n. 2, p. 265-278, 2003.
VINATORU, M. An overview of the ultrasonically assisted extraction of bioactive principles from herbs. Ultrasonics Sonochemistry, v. 8, p. 303-313, 2001.
WANG, X.; WU, Y.; CHEN, G.; YUE, W.; LIANG, Q.; WU, Q. Optimisation of ultrasound assisted extraction of phenolic compounds from Sparganii rhizoma with response surface methodology. Ultrasonics Sonochemistry, v. 20, n. 3, p. 846-854, 2013.
XYNOS, N.; PAPAEFSTATHIOU, G.; GIKAS, E.; ARGYROPOULOU, A.;
ALIGIANNIS, N.; SKALTSOUNIS, A.-L. Design optimization study of the extraction of olive leaves performed with pressurized liquid extraction using response surface methodology. Separation and Purification Technology, v. 122, p. 323-330, 2014.
ZEKOVIĆ, Z.; KAPLAN, M.; PAVLIĆ, B.; OLGUN, E. O.; VLADIĆ, J.; CANLI, O.;
VIDOVIĆ, S. Chemical characterization of polyphenols and volatile fraction of
coriander (Coriandrum sativum L.) extracts obtained by subcritical water extraction.
ZHAO, L. C.; HE, Y.; DENG, X.; YANG, G. L.; LI, W.; LIANG, J.; TANG, Q. L. Response surface modeling and optimization of accelerated solvent extraction of four lignans from fructus schisandrae. Molecules, v. 17, n. 4, p. 3618-3629, 2012.
ARTIGO 1
Ultrasound-assisted and pressurized liquid extraction of phenolic compounds from
Phyllanthus amarus and its composition evaluation by UPLC-QTOF
Adriana Dutra Sousa, Isabel Vitorino Maia, Tigressa Helena Soares Rodrigues, Kirley Marques Canuto, Paulo Riceli Vasconcelos Ribeiro, Rita de Cassia Alves Pereira, Roberto Fontes Vieira, Edy Sousa de Brito
Artigo publicado em: Industrial Crops and Products, Vol. 79, Páginas 91-103, 2016
Ultrasound-assisted and pressurized liquid extraction of phenolic compounds from
Phyllanthus amarus and its composition evaluation by UPLC-QTOF
Adriana Dutra Sousaa,b, Isabel Vitorino Maiaa, Tigressa Helena Soares Rodriguesa, Kirley Marques Canutoa, Paulo Riceli Vasconcelos Ribeiroa, Rita de Cassia Alves Pereiraa, Roberto Fontes Vieirac, Edy Sousa de Britoa,*
a Embrapa Tropical Agroindustry, R Dra Sara Mesquita, 2270, Fortaleza-CE 60511 110, Brazil.
b Departamento de Engenharia Química, Universidade Federal do Ceará, Brazil.
c Embrapa Genetic Resources and Biotechnology, Brasília-DF, Brazil.
* corresponding author at: Embrapa Tropical Agroindustry, R Dra Sara Mesquita, 2270, Pici, Fortaleza-CE, 60511 110, Brazil. Tel +55 85 33917393; Fax +55 85 33917109.
Abstract
Phyllanthus amarus Schum & Thonn is an herb rich in bioactive compounds, mainly phenols, and it is widely used for its medicinal properties. In this study, aqueous extraction from aerial parts of P. amarus was performed using ultrasound-assisted extraction (UAE), pressurized liquid extraction (PLE), and conventional extraction (CE). Response surface methodology was used to assess the effect of the time, ultrasonic intensity, and liquid/solid (L/S) ratio in UAE and of time and temperature in PLE on total phenolics and gallic acid extraction. The chemical composition of the extracts obtained through the three techniques was also analyzed using UPLC-ESI-QTOF-MS/MS. The UAE operational condition that afforded the highest phenolic content (27.23 mg/g plant) used time of 7 min, ultrasonic intensity of 301 W/cm2, and L/S ratio of 40 mL/g. This value was lower than the one obtained by the conventional extraction method (42.78 mg/g plant). However, PLE at 192.4°C and time of 15 min yielded the highest total phenolic content (52.97 mg/g plant).Regarding the extraction of gallic acid, the non-conventional methods yielded contents three times higher than the conventional extraction. The chemical composition of P. amarus extracts had mainly hydrolysable tannins, flavonoids, and lignans. The most significant difference was found in UAE, which proved to be inefficient to extract ellagitannins.
Keywords: Ellagitannin, Gallic acid, Lignan, Phyllanthus amarus, Response surface methodology.
1. Introduction