Fe
rna
nd
o
L
o
pe
s
Q
U ALID ADEE
SP ER M ÁT IC A:
U
ME
ST U DOI
N TE G R ADO EM66
A
M O ST R ASH
U M AN AS2012
Q
UALIDADE
E
SPERMÁTICA
: U
M
E
STUDO
I
NTEGRADO
E
M
66
A
MOSTRAS
H
UMANAS
Dissertação de Mestrado
2º Ciclo em Biotecnologia para as Ciências da Saúde
Fernando Manuel Carvalho Lopes
U
NIVERSIDADE
DE
T
RÁS
-
OS
-M
ONTES
E
A
LTO
D
OURO
Q
UALIDADE
E
SPERMÁTICA
: U
M
E
STUDO
I
NTEGRADO
E
M
66
A
MOSTRAS
H
UMANAS
(versão provisória)
Dissertação apresentada à Universidade Trás-os-Montes e Alto Douro para
cumprimento dos requisitos necessários à obtenção do grau de Mestre em
Biotecnologia para as Ciências da Saúde, realizada sob a orientação científica
da Professora Doutora Isabel Gaivão e da Doutora Rosário Pinto Leite.
Fernando Manuel Carvalho Lopes
U
NIVERSIDADE
DE
T
RÁS
-
OS
-M
ONTES
E
A
LTO
D
OURO
Júri de Apreciação
Presidente:
...1º Vogal:
...2º Vogal:
...Classificação:
...Data:
...iv
Aos meus Pais
Ao meu irmão
Ao meu sobrinho
À Daniela.
v
A
GRADECIMENTOS
Ao longo desta minha aventura muitas foram as pessoas que directa ou indirectamente, de forma abnegada e sincera, me apoiaram. A elas o meu profundo reconhecimento e agradecimento:
À Professora Doutora Isabel Gaivão, orientadora de tese de Mestrado, pela sua excelente orientação marcada pela paciência, empenho e imensa disponibilidade, pela sua competência científica, técnica e humana.
À Doutora Rosário Pinto Leite, co-orientadora da tese de Mestrado, pela sua competência e excelência em tudo o que faz. Por ter permitido que eu crescesse científica e tecnicamente ao meu ritmo sabendo que a exigência é o sustento do bom trabalho.
À Professora Doutora Maria Manuel Oliveira e ao Professor Doutor Francisco Peixoto que me acolheram sem reservas, possibilitando assim a realização deste trabalho. Foram um exemplo a todos os níveis. Um sincero muito obrigado.
Ao Pedro, Drª Marta e Regina que para além de exemplos de profissionalismo, dedicação e altruísmo tornaram-se verdadeiros amigos. Que conseguiram fazer com que fosse fácil aprender e estar motivado para trabalhar todos os dias.
À D. Rosa e D. Lurdes, do Laboratório de Citogenética do CHTMAD, pela amizade, disponibilidade, simpatia e colaboração.
Ao Marco e Jaqueline companheiros de “luta” que partilharam comigo as pequenas derrotas e vitórias do dia-a-dia, a humildade, o compromisso, a vontade de aprender e a boa disposição.
Ao Félix, Joana, Marisa, Vera, Kelly e Beatriz pela ajuda e boa disposição com que me receberam.
Ao pessoal do rugby.
Aos meus pais, Fernando Lopes e Maria Carvalho, que em todos os momentos, onde quer que estivesse, me apoiam incondicionalmente, que me fazem sentir a importância das pequenas coisas, e que possibilitam toda a minha vivência académica.
vi
A toda a minha família com especial relevo para a minha Madrinha e o meu tio Carlos por estarem ao meu lado sempre que preciso, pela amizade e carinho.
Ao meu irmão, Bruno, e à minha cunhada Gia, pela paciência e carinho, pelo estímulo e pela presença constante e efectiva na minha caminhada.
Ao meu sobrinho Bruno, e ao Samuel, Carlota e Tomás, pela alegria e amor, e por me mostrarem as coisas boas da vida, tornando-me todos os dias uma pessoa melhor.
À D. Amélia, Sr. Porfírio, Porfírio, Joana, Bela e Sónia pela ajuda, amizade e apoio.
Ao Nuno por ser muito mais do que amigo e primo, por ser um exemplo e um complemento.
Aos meus amigos Quintas, Maria, Isa, Sara, Carlos, Ana Raquel, Bibi, Ricardo, Zé Carlos, Duro, Rui, Nuno Machado, Sandra, Irene, Davide, Luís, Sérgio, Nuno, Tiago, e Jorge pela partilha, dedicação, amizade, apoio, alegria e companheirismo.
À Daniela que atura o meu mau feitio e mesmo assim é capaz, todos os dias, de me abraçar e só ver as coisas boas. Por tudo o que é hoje, foi ontem e há-de ser amanhã. Por me apoiar incondicionalmente seja qual for o meu passo e acreditar em mim mais do que eu próprio. Obrigado por me apoiares nos momentos de descrença e alegria, por me ouvires e aconselhares, por seres calma na tempestade e agitação na calmaria.
vii
R
ESUMO
Infertilidade é a falha na concepção após 2 anos de relações sexuais sem a utilização de qualquer método contraceptivo. Estima-se que aproximadamente 15% dos casais, em idade fértil, à procura da primeira gravidez, enfrentem esta situação.
Aproximadamente 1 em cada 15 homens têm problemas de fertilidade, a infertilidade masculina pode ter inúmeras causas como alterações anatómicas, hormonais, genéticas, imunológicas, infecções ou estilo de vida e exposição a factores ambientais.
Dependendo da concentração, localização e tempo de exposição, as espécies reactivas a oxigénio (ROS) podem ter efeitos benéficos ou prejudiciais sobre os espermatozóides. Níveis baixos de ROS são essenciais para a fertilização, reacção acrossómica, hiperativação, motilidade e capacitação. Níveis elevados podem levar a apoptose, peroxidação lipídica, dano no DNA e dano nas proteínas.
Neste trabalho foram analisadas 66 amostras de sémen por espermograma e para cada indivíduo realizada análise citogenética convencional. Destas foram escolhidas 25 amostras para detecção de aneuploidias espermáticas dos cromossomas sexuais. Foram avaliadas 48 amostras quanto à actividade da catalase (CAT) e glutationa S-transferase (GST) e 51 amostras foram avaliadas quanto à actividade da superóxido dismutase (SOD). Determinaram-se as concentrações de malonildialdeído (MDA) (n= 31), hidroperóxidos (n= 35) e tióis totais (n= 36) em amostras previamente seleccionadas. O dano no DNA foi determinado pela técnica de TUNEL em 53 amostras e pelo ensaio de Cometa com e sem incubação com a enzima FPG em 49 amostras.
Encontraram-se associações entre os parâmetros da qualidade espermática, e os resultados da concentração de MDA, hidroperóxidos e tióis totais, a actividade das enzimas antioxidantes (SOD, CAT e GST) e o dano no DNA proveniente dos ensaios de TUNEL e Cometa.
Em conclusão, o estudo do stresse oxidativo nos espermatozóides é extremamente importante para se perceber a etiologia da infertilidade masculina idiopática.
Palavras chave: Stresse oxidativo, peroxidação lipídica, enzimas antioxidantes, dano no DNA,
viii
A
BSTRACT
Infertility is a failure to conceive after at least one year of unprotected intercourse. It has been estimated that approximately 15% of the population in industrially developed countries are affected.
Approximately 1 in 15 men have fertility problems. Male infertility can have many causes such as anatomic changes, hormonal changes, immune alterations, infections, genetic or lifestyle and exposure to environmental factors.
Depending on the concentration, location and time of exposure, reactive oxygen species (ROS) can have beneficial or harmful effects on sperm. Low levels of ROS are essential for fertilization, acrosome reaction, hyperactivation, motility and capacitation. Elevated levels can lead to apoptosis, lipid peroxidation, DNA damage and damage to the proteins.
We studied 66 samples of semen for semen analysis and for each case performed conventional cytogenetic analysis. 25 were chosen for the detection of sex chromosomes aneuploidy in sperm. 48 samples were selected for evaluation of glutathione S-transferase (GST) and catalase (CAT) activity of 51 samples for the evaluation of superoxide dismutases (SOD) activity. We determined the amount of malondialdehyde (MDA) (n= 31), hydroperoxides (n= 35) and total thiols (n= 36). The DNA damage was determined by TUNEL technique in 53 samples and comet assay with and without FPG hybridization in 49 samples.
We have found associations between the parameters of sperm quality, and the results of MDA, hydroperoxides and total thiols concentration, the activity of antioxidant enzymes (SOD, CAT and GST) and DNA damage coming from Comet and TUNEL assays.
In conclusion, the study of oxidative stress in spermatozoa is extremely important to understand the etiology of idiopathic male infertility.
Keywords: Oxidative stress, lipid peroxidation, antioxidant enzymes, DNA damage, semen
ix
P
UBLICAÇÕES
Este trabalho encontra-se parcialmente publicado:
Artigo “Sperm quality, oxidative stress and seminal antioxidant activity” a ser preparado para publicação em revista científica, baseado no trabalho desenvolvido
Lopes F, Gomes Z, Moutinho O, Peixoto F, Gaivão I, Pinto Leite R (2012). “Tunel and comet assay: usefulness of these techniques in the study of the dna fragmentation in spermatozoa”, 17th World Congress on Controversies in Obstetrics, Gynecology and Infertility (COGI), 8-11 de Novembro, 2012, Lisboa, Portugal – Aceite para publicação em acta de encontro científico e comunicação em painel (“poster”)
Lopes F, Botelho P, Souto M, Gaivão I, Gomes Z, Martins M, Osvaldo O, Pinto Leite R (2012). "Human Infertility: the importance of cytogenetic analysis", European Conference of Human Genetics 2012, 23-26 de Junho, 2012, Nuremberga, Alemanha - Publicação em acta de encontro científico
Lopes F, Botelho P, Souto M, Gaivão I, Gomes Z, Martins M, Moutinho O, Pinto Leite R (2012). "A importância da equipa multidisciplinar no estudo da infertilidade - Avaliação Citogenética de 162 casais", 3rd Conference on Nursing Research of Ibero-American and Portuguese-speaking Countries, 13-15 de Junho, 2012, Coimbra, Portugal – Comunicação Oral
Lopes F, Botelho P, Souto M, Gaivão I, Gomes Z, Martins M, Moutinho O, Pinto Leite R (2012). "Detecção de uma translocação complexa num casal com infertilidade", IV National Conference of Genetics and Biotechnology, 1-3 de Março, 2012, Vila Real, Portugal – Comunicação Oral
Botelho P, Lopes F, Souto M, Gaivão I, Gomes Z, Martins M, Moutinho O, Pinto Leite R (2012). "Human Infertility: Cytogenetic analysis really matter", 2nd Congress of maternal and obstetric health, Centro Hospitalar de Trás-os-Montes e Alto Douro, 14-15 de Outubro, Vila Real, Portugal - Comunicação em painel (“poster”)
x
Í
NDICE
INTRODUÇÃO ... 1
1. ANATOMIA E FISIOLOGIA DO SISTEMA REPRODUTOR MASCULINO ... 2
1.1. Regulação da secreção das hormonas sexuais no homem ... 3
1.2. Espermatogénese... 4 1.3. Apoptose ... 8 2. ESPERMATOZÓIDE ... 9 2.1. Fisiologia e morfologia ... 9 2.2. Plasma Seminal ... 11 3. FECUNDAÇÃO ... 11
3.1. Processos conferentes de capacidade de fertilização ... 12
3.1.1. Maturação no epidídimo ... 13
3.1.2. Capacitação e hiperativação ... 14
4. INFERTILIDADE ... 14
4.1. Infertilidade masculina ... 15
4.1.1. Causas anatómicas e fisiológicas ... 15
4.1.2. Estilo de vida e exposição a factores ambientais ... 16
4.1.3. Anomalias genéticas e bioquímicas ... 18
OBJECTIVOS ... 26
MATERIAL E MÉTODOS ... 28
1. MATERIAL BIOLÓGICO ... 29
2. AVALIAÇÃO DOS PARÂMETROS ESPERMÁTICOS ... 29
2.1. Liquefacção ... 29 2.2. Viscosidade ... 29 2.3. Cheiro ... 30 2.4. Cor ... 30 2.5. Volume ... 30 2.6. pH ... 30 2.7. Motilidade... 30 2.8. Vitalidade ... 30 2.9. Teste Hipoosmótico ... 31 2.10. Concentração ... 31 2.11. Morfologia ... 33 2.12. Classificação... 34 3. ANÁLISE CITOGENÉTICA... 34
xi
3.1. Método de bandeamento GTL ... 35 3.2. Método de bandeamento CBL ... 35 4. PREPARAÇÃO DO ESPERMATOZÓIDES ... 36 5. ANEUPLOIDIAS ESPERMÁTICAS ... 36 6. STRESSE OXIDATIVO ... 37 6.1. Quantificação de proteína ... 376.2. Actividade das enzimas antioxidants ... 38
6.2.1. Superóxido dismutase (SOD) ... 38
6.2.2. Glutationa S-transferase (GST) ... 38
6.2.3. Catalase (CAT) ... 38
6.3. Determinação da peroxidação lipídica pelo método de Fox ... 39
6.4. Determinação da peroxidação lipídica avaliada pelo método dos TBARS ... 39
6.5. Determinação do conteúdo em tióis totais ... 40
7. MÉTODO DE ADIÇÃO DE NUCLEÓTIDOS MARCADOS COM FLUORESCEÍNA MEDIADA PELA ENZIMA DEOXINUCLEOTIDIL TRANSFERASE TERMINAL (TUNEL) ... 41
8. ENSAIO DE COMETA ... 42
9. ANÁLISE ESTATÍSTICA ... 43
RESULTADOS ... 44
1. ANÁLISE CITOGENÉTICA E ESPERMOGRAMA ... 45
2. ANEUPLOIDIAS ESPERMÁTICAS DOS CROMOSSOMAS SEXUAIS ... 47
3. TIÓIS TOTAIS ... 48
4. HIDROPERÓXIDOS ... 49
5. TBARS ... 50
6. ACTIVIDADE ENZIMÁTICA DAS ENZIMAS ANTIOXIDANTES ... 50
6.1. Superóxido Dismutase ... 51
6.2. Glutationa S-transferase ... 51
6.3. Catalase ... 52
7. ENSAIO DE TUNEL ... 53
8. ENSAIO DE COMETA ... 54
9. AVALIAÇÃO DE CORRELAÇÃO ENTRE AS DIFERENTES VARIÁVEIS ... 55
DISCUSSÃO DOS RESULTADOS ... 62
CONCLUSÕES ... 69
REFERÊNCIAS BIBLIOGRÁFICAS ... 71
ANEXOS ... 84
xii
A
BREVIATURAS
GnRH Hormona libertadora da gonadotrofina
LH Hormona luteinizante
FSH Hormona foliculostimulante
DNA Ácido desoxirribonucleico
SFC Factor estaminal
ATP Adenosina trifosfato
mtDNA Ácido desoxirribonucleico mitocondrial
ZP Zona pelúcida
RA Reacção acrossómica
AMPc Adenosina 3’,5’-monofosfato cíclico
OMS Organização Mundial de Saúde
ROS Espécies reactivas a oxigénio
HHT Hipotálamo-hipófise-testículo
ASA Anticorpos anti-espermatozóides
SHBG Globulina ligadora às hormonas sexuais
MSY Male-specific Y
AZF Factor de azoospermia
SCSA Ensaio de estrutura da cromatina do espermatozóide
TUNEL Método de adição de nucleótidos marcados com fluoresceína mediada pela
enzima deoxinucleotidil transferase terminal
SCGE Single cell gel electrophoresis
FPG Formamido pirimidina DNA glicosilase
PUFA Ácidos gordos polinsaturados
SOD Superóxido dismutase
LPO Peroxidação lipídica
MDA Malonildialdeído CAT Catalase GPX Glutatião peroxidase GST Glutatião S-transferase GR Glutatião redutase GSH Glutatião reduzido GSSG Glutationa dissulfeto
xiii
EPE Entidade pública empresarial
PR Progressivos rápidos
FISH Hibridação in situ por fluorescência
BSA Soro fetal de bovino
SDS Dodecil sulfato de sódio
NBT Cloreto de azul de nitrotetrazólio
CDNB 1-cloro-2,4-dinitrobenzeno
BHT Hidroxitolueno butilado
TBARS Método de quantificação de substâncias reactivas ao ácido tiobarbitúrico
DTNB 5,5’-ditiobis- (2-ácido nitrobenzóico)
SH Grupos sulfidrilo
SSA Ácido Sulfossalicílico
PBS Tampão fosfato-salino
DAPI 4'6-diamino-2-fenilindol
SPZ Espermatozóide
LMP Baixo ponto de fusão
DTT Ditiotreitol
Introdução
1
Introdução
2
1. A
NATOMIA EF
ISIOLOGIA DOS
ISTEMAR
EPRODUTORM
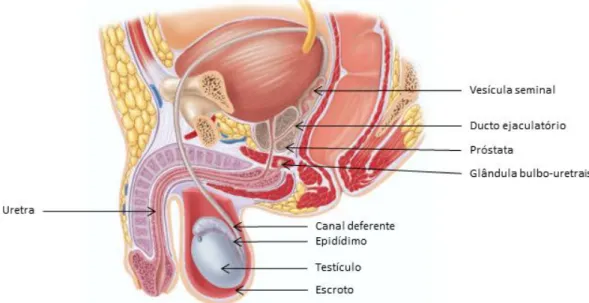
ASCULINOOs órgãos genitais masculinos são testículos, epidídimo, canais deferentes, vesículas seminais, canal ejaculador e uretra, sendo considerados anexos as bolsas, as glândulas, os músculos e as aponevroses (Seeley et al., 2011).
Figura 1. Anatomia do aparelho reprodutor masculino. Adaptado de Seeley et al., 2011
No aspecto anatómico o testículo divide-se em medula e córtex (albugínea), tendo este prolongamentos conjuntivos que dividem o testículo em lobos. Os lobos testiculares apresentam no seu interior os túbulos seminíferos (onde se dá o desenvolvimento dos espermatozóides, espermatogénese e espermiogénese), tecido conjuntivo laxo (que envolve os túbulos) que contém aglomerados de células endócrinas chamadas células intersticiais ou células de Leydig que segregam testosterona. Os túbulos seminíferos têm um trajecto tortuoso com um comprimento de 800m e terminam num conjunto de tubos rectos chamado rede testicular (rete testis). A rede testicular esvazia-se para os canais eferentes que levam as células espermáticas do testículo para o epidídimo (Seeley et al., 2011). Os testículos encontram-se fora da cavidade corporal no escroto, isto é vital para que estes se mantenham a uma temperatura entre a 4-7°C inferior à temperatura corporal (37°C), o que é determinante para uma óptima produção de espermatozóides (Meniru, 2001).
O epidídimo tem uma forma alongada e encontra-se sobre o bordo postero-superior do testículo, dividindo-se anatomicamente em cabeça, corpo e cauda, continuando-se esta com o canal deferente. É responsável pela maturação final dos espermatozóides (Seeley et al., 2011).
Introdução
3
Os canais deferentes são revestidos por epitélio cilíndrico pseudoestratificado rodeado por músculo liso cujas contracções peristálticas ajudam o movimento dos espermatozóides ao longo deste. A extremidade de cada canal deferente alarga-se formando a ampola do canal deferente. Contíguas a estes existem glândulas em forma de saco para onde os espermatozóides maduros são encaminhados – vesículas seminais. Estas estruturas são reservatórios de esperma nos intervalos das ejaculações, tendo no seu interior inúmeras câmaras que comunicam umas com as outras. Ao canal excretor destas dá-se o nome de canal ejaculador (Seeley et al., 2011).
A uretra masculina é uma via comum para a urina e para o esperma. Esta divide-se em uretra prostática, uretra membranosa e uretra esponjosa ou peniana (Seeley et al., 2011).
1.1. Regulação da secreção das hormonas sexuais no homem
Os mecanismos hormonais que condicionam o sistema reprodutor masculino são o hipotálamo, a hipófise e os testículos (Seeley et al., 2011).
A hormona libertadora da gonadotrofina (GnRH), um péptido que comporta 10 aminoácidos, é produzida pelo hipotálamo e libertada no sistema porta hipotálamo-hipofisário, sendo posteriormente transportada para a hipófise anterior e condiciona a libertação de duas gonadotrofinas, a hormona luteinizante (LH) e a hormona foliculostimulante (FSH). A GnRH é produzida intervaladamente a cada 1 a 3 horas. A intensidade do estímulo varia de duas formas: pelo número de ciclos de secreção ou pela quantidade de GnRH produzida em cada uma. A secreção de LH na adeno-hipófise é também cíclica com esta a ser determinada pelo estímulo provocado por GnRH. A libertação de FSH aumenta e diminui muito ligeiramente a cada flutuação de GnRH, em vez disso, a sua libertação é mais lenta, demorando horas, em resposta aos níveis de GnRH (Holdcraft and Braun, 2004, Hall and Guyton, 2011).
A LH liga-se às células de Leydig nos testículos e determina o aumento do ritmo de síntese e de secreção de testosterona. Esta é classificada como androgénio pois estimula o desenvolvimento dos órgãos sexuais e das características sexuais secundárias. A testosterona promove ainda a diferenciação sexual no embrião, a masculinização do hipotálamo, acções metabólicas proteicas e lipídicas e tem ainda acção sobre as secreções (acne) e eritropoiese (Hall and Guyton, 2011, Seeley et al., 2011).
A FSH liga-se a receptores específicos de FSH nas células de Sertoli nos túbulos seminíferos induzindo o seu crescimento e a segregação de substâncias espermatogénicas (tais como a inibina). Simultaneamente a testosterona e a dihidrotestosterona encontram-se
Introdução
4
difundidas nos túbulos seminíferos a partir das células de Leydig exercendo igualmente um factor determinante na espermatogénese (Holdcraft and Braun, 2004, Hall and Guyton, 2011).
A testosterona, no normal desenvolvimento fisiológico, despoleta um mecanismo de feedback negativo sobre o hipotálamo e hipófise para produzir uma diminuição da secreção de LH e FSH, a inibina inibe também a secreção de FSH (Seeley et al., 2011). Este mecanismo é essencial não só no desenvolvimento da linha celular germinativa masculina, mas também para a proliferação e funcionamento de tipos específicos de células somáticas necessárias para o normal desenvolvimento dos testículos (Holdcraft and Braun, 2004).
Figura 2. Regulação hormonal do sistema reprodutor masculino. Adaptado de Kamischke e Nieschlag, 2004
1.2. Espermatogénese
A espermatogénese é o total da soma de eventos que ocorrem no testículo e que levam à produção de espermatozóides. Esta ocorre nos túbulos seminíferos durante a vida sexual activa como resultado da estimulação da hipófise por hormonas gonadotróficas (LH e FSH) (Figura 2),
Introdução
5
começando aproximadamente aos 13 anos continuando durante toda a vida, mas diminuindo acentuadamente em idades avançadas (Hall and Guyton, 2011).
Apresenta-se como um processo com baixa eficiência, principalmente quando comparado com outros mamíferos. A título de exemplo por grama de parênquima testicular um homem produz em média 4-6x106 espermatozóides enquanto os touros produzem 12 x106, os macacos 23x106 ou os coelhos 25x106. Esta menor eficiência pode-se dever a uma maior duração da espermatogénese e/ou a uma menor densidade das células germinativas (Johnson et al., 2000).
É um processo lento em que uma célula estaminal (espermatogónia) se divide por mitose para ciclicamente produzir espermatócitos primários que através de meiose levam à produção de espermátides haplóides que se vão diferenciar, sem mais divisões, em espermatozóides (Johnson et al., 2000).
Durante o desenvolvimento embrionário as células germinativas parentais migram para os testículos e transformam-se em células germinativas imaturas chamadas espermatogónias, que se estratificam em 2 ou 3 camadas na camada interna dos túbulos seminíferos. Após a puberdade a espermatogónia migra entre as células de Sertoli para o lúmen central dos túbulos seminíferos. As células de Sertoli envolvem as espematogónias com excisões citoplasmáticas (Hall and Guyton, 2011). Espermatogónias tipo A “brancas” (mitoticamente activas) entram em divisões mitóticas sucessivas das quais resultam A1, A2, A3, A4, formas intermediárias culminando em espermatogónias tipo B. Mas nem todas se diferenciam, pois mantem-se um reservatório de espermatogónias designadas por tipo A “escuras” (Fauser, 1999).
A este evento sucede-se a meiose que é o processo pelo qual uma célula diplóide origina uma descendência haplóide (Figura 3. B).
Introdução
6
Figura 3. Espermatogénese. A- Diferenciação celular, Adaptado de Seeley et al., 2011; B- Meiose, Adaptado
de Hall e Guyton et al., 2011
Na espermiogénese as espermátides desenvolvem-se por acção das células de Sertoli, sendo que o seu núcleo fica mais individualizado e a cromatina mais condensada, a cauda forma-se a partir do centríolo distal e as mitocôndrias dirigem-forma-se para a peça intermédia (Johnson et al., 2008). Dentro da espermiogénese considera-se ainda um evento muito importante chamado de espermiação que consiste no último passo, no finalizar da célula germinativa no lúmen do túbulo e na remoção dos últimos vestígios de citoplasma e na passagem para o epidídimo (Lipshultz et al., 2009). Além da espermiação podem-se considerar fases como a formação do acrossoma a partir do complexo de Golgi. A biogénese desta estrutura, uma complexa vesícula secretora, não depende de uma configuração diplóide para a sua transcrição. No seu conteúdo encontram-se essencialmente enzimas hidrolíticas como protéases, hidroglicosilases e esterases (Moreno and Alvarado, 2006). Seguem-se mudanças nucleares e na compactação do DNA, mais propriamente, o DNA deixa de estar a rodear os nucleossomas composto por octâmeros de histonas e passa a ser organizado em loops toroidais com protaminas em substituição das histonas, isto confere
A
Introdução
7
maior condensação e menor probabilidade de desnaturação. E ainda a formação da cauda (Lipshultz et al., 2009).
Estima-se que a espermatogénese em humanos dure aproximadamente 64 dias (Misell et al., 2006).
Figura 4. Espermiogénese Adaptado de Gilbert, 2010
Em suma, a espermatogénese consiste em 3 fases, a fase proliferativa ou mitótica, em que existe a proliferação das espermatogónias; a meiose, que dá origem a células haplóides chamadas de espermátides e a transformação citológica ou espermiogénese, em que há a diferenciação que resulta em espermatozóides maduros (Figura 4) (Johnson et al., 2000, Misell et al., 2006).
A função testicular normal depende da actuação de hormonas que actuam através de vias endócrinas. As células de Sertoli providenciam factores essenciais para que a espermatogónia se diferencie em espermatozóide. Estas têm ainda receptores para FSH e testosterona que são os principais reguladores da espermatogénese. Vários trabalhos neste âmbito conseguiram determinar que estas hormonas, com especial relevo para FSH, têm um papel determinante para o destino celular, pois parecem estar associadas à prevenção da apoptose das células germinativas (Dunkel et al., 1997, Erkkila et al., 1997, Tesarik et al., 2001). Mas também proteínas como as da família Bcl-2 parecem ser fundamentais para a homeostasia das células germinais. Parecem existir ainda factores parácrinos provenientes das células de Sertoli das quais as células
Introdução
8
germinativas necessitam para o processo fisiológico. Ainda a Activina A e a folistatina têm um importante papel na maturação celular (Sofikitis et al., 2008).
1.3. Apoptose
Tão importante quanto a proliferação e a diferenciação é a morte celular, que no caso da espermatogénese ocorre maioritariamente via apoptose (Blanco-Rodriguez and Martinez-Garcia, 1998).
A apoptose é a morte celular programada de uma célula, activado de dentro da célula, em que existe fragmentação do DNA, vacuolização do citoplasma, alterações da membrana e consequente morte da célula sem implicações para as vizinhas (Alberts, 2008).
Nas células germinativas a apoptose pode acontecer de duas formas através da ausência da ligação do factor estaminal (SFC) (também conhecido como factor de Steel, produzido pelas células de Sertoli) ao receptor c-kit presente nas espermatogónias tipo A, que inicia as vias de sinalização que promovem a apoptose celular (Yan et al., 2000); ou através da via clássica com o FAS ligante a ser produzido pelas células de Sertoli que se liga ao receptor FAS das células germinativas, que vai induzir a tridimerização dos receptores FAS e o recrutamento de FADD. Este complexo FAS/FADD liga-se às caspases iniciadoras 8 e 10 que por sua vez vão activar as caspases 3, 6 e 7 que levam à apoptose (Tesarik et al., 2004).
A expressão anormal de proteínas pro- e anti-apoptóticas pode levar a uma alteração da espermatogénese e à infertilidade.
Introdução
9
2. E
SPERMATOZÓIDE2.1. Fisiologia e morfologia
Figura 5. Espermatozóide. Adaptado de Gilbert, 2010
Os espermatozóides são células altamente diferenciadas e especializadas com diferenças morfológicas, funcionais e de composição, quando comparadas com células somáticas. Apresentam, por exemplo, um núcleo altamente condensado com protaminas numa cabeça extremamente compacta e hidrodinâmica (que lhe garante mobilidade optimizada e uma melhor penetração no oócito) e têm ainda um longo flagelo, cauda, que lhes confere motilidade (Martinez-Heredia et al., 2006, Lishko et al., 2012). O espermatozóide divide-se em três partes distintas, a cabeça, o colo e a cauda (Figura 5).
A cabeça é uma estrutura achatada ovóide com 4 a 5 µm de comprimento e 2,5 a 3,5 µm de diâmetro, nesta identificam-se essencialmente dois componentes, o núcleo e o acrossoma. O acrossoma ocupa cerca de dois terços da cabeça e situa-se na região mais distal da cabeça. Este contém um aparelho enzimático semelhante ao encontrado nos lisossomas das células somáticas, incluindo hialurodinases (que têm a capacidade de digerir filamentos de proteoglicanos de tecidos) e potentes enzimas proteolíticas (Hall and Guyton, 2011). Além das características e componentes já apresentados a cabeça tem ainda o envelope nuclear que envolve o núcleo e teca perinuclear que lhe confere protecção (pois é uma amálgama de proteínas e pontes de dissulfito) (Jonge and Barratt, 2006).
Introdução
10
Projecção interna de dineína Mitocôndria Microtúbulos externos Microtúbulo central Projecção Radial Nexina Bainha interna Projecção externa de dineína
O colo é um local de articulação entre a cabeça e a cauda, pelo que alterações nesta estrutura podem levar a ciliopatias (que provocam imobilidade) ou acefalia nos espermatozóides. Compreende o centríolo, estrutura extremamente importante pois após a fecundação levará à formação do centrossoma do zigoto, que por sua vez dará origem ao primeiro fuso mitótico; e a peça de conecção (Chemes and Alvarez Sedo, 2012).
A cauda é uma estrutura flagelar com 40 a 50 µm de comprimento que apresenta um axonema central que está rodeado por estruturas especializadas, e pode dividir-se genericamente em 3 partes distintas, a peça intermédia (a qual diferenciamos na figura 5 devido à sua importância), que contém as mitocôndrias numa configuração espiral em torno do axonema; a peça principal, que é a responsável pela motilidade; e o segmento terminal, que contém alguns elementos estruturais. O axonema é composto por nove dobletos de microtúbulos que envolvem 2 singuletos de microtúbulos e está associado a proteínas motor como a dineína.
Figura 6. Axonema espermático. Adaptado de Shetty et al., 2007.
O movimento da cauda depende da capacidade do axonema dobrar o qual acontece pelo deslizamento das duas estruturas de microtúbulos, que obtêm energia a partir da hidrólise de ATP na cadeia pesada da dineína (Lishko et al., 2012). A peça intermédia contém aproximadamente 75-100 mitocôndrias que geram ATP que possibilita a motilidade flagelar. Cada espermatozóide transporta cópias de mtDNA paterno que parece ser eliminado por proteólise no ovo (Jonge and Barratt, 2006).
Introdução
11
2.2. Plasma Seminal
O plasma seminal, que é ejaculado durante o acto sexual, é uma mistura de espermatozóides (aproximadamente 20x106/mL) e secreções das glândulas do aparelho reprodutor masculino, que, no conjunto total, resulta num fluido viscoso. De referir que no plasma seminal 10% do total provém dos canais deferentes, 30% da próstata, 60% das vesículas seminais, 5% dos testículos e 5% das glândulas bulbo-uretrais (Hall and Guyton, 2011, Seeley et al., 2011). O fluído prostático (que tem um pH bastante alto) confere ao plasma seminal a aparência leitosa, já o fluido vindo das vesículas seminais (rico em frutose, fibrinogénio e prostaglandinas) dá-lhe um aspecto mucoso e ajudam a neutralizar o pH ácido proveniente da uretra e das secreções testiculares, sendo que o pH combinado do plasma seminal é de 7,5. As secreções provenientes da próstata são ricas em factores de coagulação que convertem o fibrinogénio em fibrina o que resulta na coagulação parcial do plasma seminal. 15-30min são normalmente o suficiente para que o coágulo se dissolva por acção da fibrinolisina (formado a partir da profibrinolisina prostática) (Hall and Guyton, 2011, Seeley et al., 2011).
O plasma seminal foi considerado durante muito tempo como o meio de transporte e sobrevivência dos espermatozóides humanos. Mas, a evidência científica tem mostrado que a introdução do plasma seminal no tracto genital feminino tem um papel importante na fertilização, sendo que este efeito parece estar relacionado com altas concentrações de agentes de sinalização como prostaglandinas, citocinas e factores de crescimento (Robertson, 2005, von Wolff et al., 2007).
O tempo de vida dos espermatozóides fora dos ductos genitais à temperatura corporal é de 24-48 horas (Hall and Guyton, 2011).
3. F
ECUNDAÇÃOA fertilização é um processo altamente regulado e sincronizado que envolve uma série de interacções extremamente complexas, e ainda pouco claras, entre o espermatozóide e o oócito, que terminam com a junção de ambos (Gupta and Bhandari, 2011, Vigil et al., 2011).
O sucesso do processo de fertilização depende de diversos factores físicos/mecânicos, bioquímicos, endócrinos, comportamentais e ambientais, em suma, o microambiente confere ao espermatozóide protecção e garante as condições necessárias à sua sobrevivência, capacitação e migração para a subsequente fusão com o oócito (Vigil et al., 2011).
Introdução
12
A fecundação tem duas etapas, a ligação do espermatozóide à zona pelúcida (ZP) que circunda o oócito, seguida da reacção acrossómica (RA). Diversos agentes fisiológicos têm sido envolvidos na indução da RA, tais como: progesterona, albumina, fluido folicular, hormonas, enzimas hidrolíticas, ácido hialurónico e glicoproteínas da ZP (Gupta and Bhandari, 2011).
A RA envolve a fusão da membrana plasmática do espermatozóide com a membrana acrossómica externa, resultando na perda de continuidade e estabilidade das membranas e subsequente libertação do conteúdo acrossómico para o meio externo que leva à exposição da membrana acrossómica interna (Moreno and Alvarado, 2006, Gupta and Bhandari, 2011). O conteúdo acrossómico compreende várias enzimas como acrosina, acrogranina, hialuronidases e outras enzimas encontradas em organelos clássicos como peroxissomas e lisossomas (Moreno and Alvarado, 2006, Zhao et al., 2007, Vigil et al., 2011).
Em cerca de 30 minutos as enzimas abrem um canal que permite a passagem do espermatozóide desde a zona pelúcida até ao oócito, as membranas da cabeça do espermatozóide e do fuso do oócito para formarem uma célula única e o material genético funde-se dando origem a um novo genoma (Hall and Guyton, 2011).
Quando o espermatozóide penetra o oócito (em metáfase II), este estimula-o a completar a segunda divisão meiótica, resultando num oócito maduro e num segundo corpo polar, em seguida dá-se a condensação dos cromossomas maternos e o núcleo do oócito evolui para pronúcleo (feminino). O núcleo do espermatozóide aumenta no interior do citoplasma do oócito, e irá compor o pronúcleo masculino e a cauda sofre degeneração. Posteriormente os pronúcleos juntam-se num conjunto único e diplóide, um zigoto. Os cromossomas presentes no zigoto rearranjam-se num fuso de clivagem, preparando-se para a divisão celular. Esta estrutura é geneticamente distinta, tratando-se obviamente da junção (metade de cada) de cromossomas materno e paternos, formando assim uma nova combinação cromossómica (Gardner, 2007, Moore et al., 2008).
3.1. Processos conferentes de capacidade de fertilização
Apesar de ser uma célula morfologicamente bem diferenciada, o espermatozóide é uma célula imatura encontrando-se em fase de espermatozoa até ao ponto em que se dá a sua maturação no epidídimo, sendo este um processo pré-ejaculatório (Visconti et al., 2002, Aitken et al., 2007). Assim, a célula espermática necessita posteriormente da ocorrência de outros processos pós-ejaculatórios também conferentes da capacidade de fertilidade assim como o processo denominado de capacitação, bem como o de hiperativação (Visconti et al., 2002, Lishko et al., 2012).
Introdução
13
3.1.1. Maturação no epidídimo
Ao longo da migração dos espermatozóides das regiões proximais para as regiões distais do epidídimo após serem libertados pelos túbulos seminíferos, ocorrem uma série de alterações morfológicas, bioquímicas e fisiológicas nos espermatozóides morfologicamente e metabolicamente imaturos, com motilidade deficiente e sem capacidade fecundante (Cornwall, 2009, Cooper, 2011).
O epidídimo é um órgão muito importante para a fertilidade, uma vez que funciona não só como condutor de esperma entre os testículos e o canal deferente, mas também contribui para a formação de um ejaculado fértil, uma vez que este é responsável pela concentração, maturação e armazenamento de esperma (Turner, 2008, Cornwall, 2009). Estudos têm vindo a demonstrar que a célula imatura apenas completa o seu processo de maturação quando atinge a cauda do epidídimo (Turner, 2008, 2011). Este facto é devido à diferente expressão genética e secreção proteica que ocorre ao longo do ducto epididimal, bem como alterações nos padrões característicos de electrólitos e pequenas moléculas orgânicas (Turner, 1995, Dacheux et al., 2006, Dubé et al., 2007, Turner, 2008). Turner, 2011 sugere que novos estudos deverão ser efectuados nas áreas de toxicologia e imunobiologia do epidídimo, uma vez que os espermatozóides armazenados na cauda ficam susceptíveis à exposição de agentes tóxicos e de stresse oxidativo (Turner, 2011).
Vários trabalhos foram realizados com o intuito de clarificar o papel deste órgão na maturação dos espermatozóides e estudos pioneiros em suínos postularam que apenas o tempo seria um factor importante para a ocorrência do processo de maturação, no entanto mais tarde outros trabalhos viriam a refutar esta hipótese, demonstrando que para a maturação do esperma são necessários factores extrínsecos do microambiente epididimal (Turner, 2008).
O processo de maturação do espermatozóide ocorre após a permanência de um ou vários dias do espermatozóide no epidídimo e consiste na remodelação da membrana plasmática da célula espermática (Dubé et al., 2007), na migração da gota citoplasmática ao longo da cauda, em alterações nos organelos citoplasmáticos, alterações no desenvolvimento do axonema e no desenvolvimento da capacidade de resposta ao Ca2+ e AMP cíclico (AMPc), bem como a vias de sinalização (Aitken et al., 2007, Cooper, 2011). Estas são alterações que conferem ao espermatozóide alguma capacidade de motilidade no entanto no epidídimo a célula tem um pH acídico e é essencialmente quiescente, estes associados ao facto de a célula espermática estar sob acção de proteínas inibitórias presentes no fluido do epidídimo constituem um obstáculo para a obtenção da motilidade total (Hall and Guyton, 2011, Lishko et al., 2012).
Introdução
14
3.1.2. Capacitação e hiperativação
Com a alcalinização do citoplasma dos espermatozóides, evento que lhes confere motilidade, estes ainda são pouco capazes ou incapazes de fertilizarem um oócito, para que estes se tornem capazes eles têm que passar por um fenómeno chamado de capacitação (Lishko et al., 2012).
Sumariamente a capacitação é caracterizada como sendo um conjunto de alterações estruturais e funcionais nos espermatozóides, que se inicia com a remoção de factores estabilizadores adquiridos no plasma seminal, que continua com a travessia do tracto genital feminino e culmina com o espermatozóide plenamente capaz de responder aos ligandos da zona pelúcida do oócito através da reacção acrossómica (De Jonge, 2005). A capacitação aumenta a fluidez da membrana plasmática e sensibiliza os espermatozóides aos sinais de fertilização. Para que isto aconteça existe um aumento de Ca2+, pH e AMPc (Fraser, 2010, Lishko et al., 2012).
A motilidade é hiperativada durante a capacitação. A hiperativação é definida por um aumento do ângulo da curvatura flagelar o que resulta em movimentos mais assimétricos e consequentemente numa maior capacidade de mobilização. A hiperativação é um ponto crítico na fertilização, pois é necessária para que o espermatozóide penetre na zona pelúcida (Suarez, 2008, Lishko et al., 2012).
4. I
NFERTILIDADEA capacidade de casais conceberem e terem filhos – fecundidade – depende de inúmeros processos biológicos que incluem espermatogénese, oogénese, transporte de gâmetas, fertilização do oócito, implantação do embrião e desenvolvimento subsequente do feto até ao nascimento do nado (te Velde et al., 2010). Tão complexa e vasta rede de interacções, onde são envolvidos um grande número de vias e centenas de genes, leva a um igualmente elevado número de oportunidades de que algo corra mal, levando assim à infertilidade (Hann et al., 2011). A Organização Mundial de Saúde (OMS) define infertilidade como a doença do sistema reprodutor traduzida pela falha da concepção após um ano de relações sexuais sem o uso de qualquer método contraceptivo, tal definição é corroborada pela Sociedade Americana de Medicina Reprodutiva (ASRM, 2008, Zegers-Hochschild et al., 2009).
A OMS assume ainda a infertilidade como sendo um problema de saúde pública à escala planetária. Isto deve-se ao facto de que aproximadamente 15% dos casais em idade fértil (que
Introdução
15
representam entre 60 e 80 milhões de casais), em todo mundo, padecerem desta situação (Templeton, 2000, Akgul et al., 2009, Dey, 2010).
Um trabalho de revisão relativamente recente de Boivin et al., 2007, tendo por base a população mundial, concluiu que existem aproximadamente 72,4 milhões de pessoas inférteis e que destas cerca de 40,5 milhões procuraram ajuda médica.
Durante muitos anos pensou-se que a infertilidade dependeria exclusivamente da incapacidade da mulher de conceber, mas a evidência científica veio mostrar que o factor masculino tem uma importância determinante para a infertilidade. Apesar de não existir consenso quanto ao peso do factor masculino na infertilidade, na literatura encontram-se valores entre os 30 e os 50% (Martin, 2008, Poongothai et al., 2009, Song et al., 2010, Pacey, 2012).
4.1. Infertilidade masculina
Aproximadamente 1 em cada 15 homens têm problemas de fertilidade. A infertilidade masculina pode ter inúmeras causas como alterações anatómicas, hormonais, genéticas, bioquímicas, imunológicas, infecções ou estilo de vida e exposição a factores ambientais (Curi et al., 2003, Lipshultz et al., 2009).
Vários factores podem contribuir para a disfunção dos espermatozóides como a produção de espécies reactivas a oxigénio (ROS), mutações genéticas, dano no DNA e defeitos nas enzimas metabólicas (Host et al., 1999a).
4.1.1. Causas anatómicas e fisiológicas
É aqui que se encontra a causa mais frequente de infertilidade – varicocele (dilatação das veias espermáticas) – que ocorre em cerca 40% dos homens inférteis enquanto só se encontra em 20% dos homens sem alteração da qualidade espermática. Apesar da sua incidência e dos diferentes trabalhos já realizados, o promotor exacto desta patologia ainda não foi isolado (pode tratar-se também de uma combinação de factores), pode estar relacionado com o aumento da temperatura testicular ou pela acção de substâncias que provocam o regurgitamento sanguíneo e levam ao detrimento da espermatogénese, outros mecanismos postulados é que devido à estase sanguínea não se dá a drenagem das gonadotoxinas e ainda a possibilidade de existir hipoxia e um aumento do stresse oxidativo (Lipshultz et al., 2009, Abdel Raheem et al., 2012).
A obstrução dos túbulos seminíferos, causada por vasectomia, infecções repetitivas, inflamação (orquite) ou problemas de desenvolvimento é também muito comum perfazendo cerca de 14% dos casos (Lipshultz et al., 2009).
Introdução
16
A criptorquidia (que é uma falha no desenvolvimento em que não se dá a descida completa dos testículos para a bolsa escrotal) afecta cerca de 3% dos recém nascidos sendo que é encontrada em 10% dos homens inférteis. Quando se trata de unilateral 13% dos homens têm azoospermia, já se for bilateral 98% dos homens apresentam azoospermia (Abdel Raheem et al., 2012).
Também lesões mecânicas como a torção testicular (que leva à necrose isquémica do tecido testicular e pode levar ainda à produção de anticorpos anti-espermatozóides que podem afectar o outro testículo) e o trauma testicular podem levar à infertilidade (Abdel Raheem et al., 2012).
O eixo hipotálamo-hipófise-testículo (HHT) é altamente complexo e deste depende a evolução normal do testículo e a produção de hormonas sexuais. Deficiências em qualquer ponto deste eixo levam a hipogonadismo.
O hipogonadismo masculino é definido como a produção inadequada de testosterona associada a uma também inadequada espermatogénese na presença de uma elevada ou reduzida quantidade de gonadotrofinas (Giannetta et al., 2012). Quando consideradas alterações ao nível do hipotálamo ou da hipófise estamos perante a forma hipogonadotrófica, quando as alterações são devidas à disfunção testicular estamos perante a forma hipergonadotrófica (Zitzmann and Nieschlag, 2000, Giannetta et al., 2012).
Níveis significativos de anticorpos anti-espermatozóides (ASA) foram detectados em 12% de amostras provenientes de homens inférteis e foram associadas a situações específicas como trauma testicular, cirurgias ou torsão testicular. Acredita-se que eles têm impacto na infertilidade de duas formas distintas, ou interferindo directamente com as acções da superfície dos espermatozóides (como a fertilização); ou indirectamente pela mediação de libertação de citocinas o que pode levar a alterações nas funções dos espermatozóides, podendo até levar ao dano no DNA (Bohring et al., 2001, Zini et al., 2010).
4.1.2. Estilo de vida e exposição a factores ambientais
O estilo de vida tem um peso importante na qualidade de vida, e como exemplo temos o tabagismo que aumenta o risco de doença cardiovascular ou a obesidade que leva a uma maior risco de doença cardiovascular, diabetes e alguns tipos de cancro; mas estes também têm um peso importante na capacidade reprodutiva (Homan et al., 2007).
Usando o supracitado exemplo do tabagismo como mote e reportando-nos à revisão feita por Pasqualotto et al. em 2004 este afirma que existem inúmeras substâncias que afectam a fertilidade masculina, entre elas drogas e medicamentos. Neste trabalho são apresentadas 4
Introdução
17
formas destes provocarem alterações na fertilidade, concretizando: pela acção de gonadotoxinas directamente sobre os testículos, por alteração do eixo HHT, por dificuldades na ejaculação ou disfunção eréctil ou ainda pela diminuição da líbido (Pasqualotto et al., 2004).
Destas substâncias o tabaco ganha especial relevância pelo número de consumidores, nos homens ele afecta negativamente a produção de espermatozóides, motilidade e morfologia bem como tem sido associado a um aumento no dano do DNA pela alteração do equilíbrio das espécies reactivas de oxigénio (Homan et al., 2007, Gaur et al., 2010), que se repercute numa menor capacidade de fertilização e em menores rácios de implantação (Mostafa, 2010). No caso do consumo do álcool, também ele muito vulgarizado, este parece não ter influência quando tomado “socialmente”, mas o uso crónico pode levar a alterações do eixo HHT (Pasqualotto et al., 2004). O consumo destas duas substâncias tem uma proporção directa com a deterioração dos parâmetros espermáticos (Gaur et al., 2010).
Também o consumo de outras substâncias como drogas ilícitas ou medicamentos têm impacto na fertilidade. Por exemplo os canabióides têm sido associados à diminuição da concentração e motilidade espermática, já os opiáceos além de provocarem a diminuição da líbido e disfunção eréctil também levam à supressão de libertação de LH levando a uma diminuição da produção de testosterona (Pasqualotto et al., 2004).
A obesidade e se no que concerne às mulheres esta tem um impacto determinante, nos homens ela não é tão mensurável mas pode provocar uma diminuição plasmática de SHBG, testosterona e FSH (Magnusdottir et al., 2005). Além da obesidade, também a alimentação tem um peso importante na fertilidade, sendo que frutas cereais e vegetais estão positivamente associados à qualidade espermática (Braga et al., 2012), as isoflavonas (presentes em derivados de soja) levam à falha no desenvolvimento dos órgãos reprodutivos (Chavarro et al., 2008) e a cafeína (mais de 3 cafés) leva a dano no DNA dos espermatozóides (Schmid et al., 2007).
Outro factor importante para a fertilidade tem que ver com a temperatura da bolsa escrotal, e também esta está muito dependente do nosso estilo de vida. A temperatura normal do escroto são 34°C e pensa-se que a temperatura nos testículos seja entre 0,1 e 0,6°C mais elevada. Se é controverso se o tipo de roupa que utilizamos, bem como banhos quentes ou saunas, tenham qualquer tipo de contributo para a infertilidade, vários estudos mostram inequivocamente que homens com um estilo de vida predominantemente sedentário, que passam muito tempo a dirigir ou ainda que trabalham com fontes de calor (como padeiros ou soldadores) têm uma temperatura escrotal mais elevada e como tal uma menor produção de espermatozóides e maior percentagem de anomalias morfológicas, levando a uma menor taxa de fertilização (Sharpe, 2000, Ivell, 2007, Paul et al., 2008).
Introdução
18
Também o factor ambiental tem um peso importante na fertilidade. De entre os poluentes identificados como capazes de provocar alterações na fertilidade temos os organocloretos que podem ser utilizados em pesticidas ou químicos industriais. Muitos destes têm propriedades de disrupção hormonal o que pode levar a alterações no eixo HHT (Magnusdottir et al., 2005), o que pode vir a provocar alteração dos parâmetros espermáticos, elevada incidência de criptorquidia e hipospadia (Queiroz and Waissmann, 2006).
Ao contrário do que se pensava até à relativamente pouco tempo também a idade paterna tem influência na fertilidade. Verificou-se que em homens com mais de 45 anos existe uma diminuição do volume de sémen, da motilidade dos espermatozóides e ainda de espermatozóides morfologicamente típicos (Hellstrom et al., 2006). Além disso homens mais velhos tendem a apresentar espermatozóides mais vacuolizados e com maior dano no DNA (Silva et al., 2012).
4.1.3. Anomalias genéticas e bioquímicas
Os factores genéticos relacionados com infertilidade são alterações cromossómicas, alterações monogénicas e deleções submicroscópicas do cromossoma Y (Griffin and Finch, 2005, Jonge and Barratt, 2006, Poongothai et al., 2009).
Alterações cromossómicas
As anomalias cromossómicas são uma das mais importantes causas de infertilidade. A incidência varia entre 2 e 8% com uma média de 5% (Foresta et al., 2002). Estas podem ser somáticas ou ligadas aos cromossomas sexuais, podem ser estruturais ou numéricas (Griffin and Finch, 2005, Martin, 2008, Poongothai et al., 2009). As anomalias estruturais incluem inversões (paracêntricas ou pericêntricas) e translocações equilibradas (Robertsonianas, reciprocas, dos autossomas ou dos cromossomas sexuais). As alterações numéricas incluem trissomias constitucionais como Síndrome de Down (trissomia 21) e as trissomias dos cromossomas sexuais (Síndrome de Klinefelter (XXY) ou Síndrome de Jacobs (XYY)). Um outro tipo de alteração numérica é aquela confinada aos espermatozóides (Griffin and Finch, 2005).
As alterações estruturais mais frequentes são as translocações Robertsonianas, estas em homens inférteis apresentam uma incidência de 0,7%, ou seja, 8,5 vezes superior à encontrada na população masculina em geral (Van Assche et al., 1996). Destas as mais comuns são entre os cromossomas 13-14 e 14-21, sendo que raramente estas afectam o fenótipo do indivíduo, mas que normalmente afectam a fertilidade devido a uma gametogénese errada ou devido a um rearranjo parental não equilibrado, estes problemas têm diferentes níveis e estão directamente
Introdução
19
ligados ao distúrbio no processo meiótico (Ferlin et al., 2007). Van Assche e colaboradores, 1996, concluíram que também as translocações recíprocas têm um peso mensurável sendo que têm uma incidência de 0,5% dos homens com infertilidade e de apenas 0,1% na população masculina em geral (Van Assche et al., 1996). Aparentemente estas também não afectam, normalmente, o fenótipo do portador, mas a evidência tem demostrado que alteram o processo espermatogénico (Ferlin et al., 2007).
Das alterações numéricas a mais frequente é o Síndrome de Klinefelter, esta é também a mais frequente de todas as anomalias cromossómicas nos casos de infertilidade, sendo que se encontra em aproximadamente em 5% dos homens com oligozoospermia severa e em 10% dos casos dos homens com azoospermia em contraponto com os 0,1-0,2% da população masculina em geral (Foresta et al., 2005). O cromossoma X extra pode ser originado de uma não disjunção de XY na meiose I paterna (em aproximadamente 50% dos casos), através da meiose materna I ou II (cerca de 40%) e os restantes serem pós zigóticos (Hirsh et al., 1996). Nos indivíduos XXY a espermatogénese pára no espermatócito primário mas, ocasionalmente, fases mais tardias podem ser observadas (O'Flynn O'Brien et al., 2010). Estes indivíduos podem tentar técnicas de fertilização in vitro, mas existe o risco da sua prole apresentar também anomalias cromossómicas, este medo foi consubstanciado por diversos estudos que mostravam que os indivíduos que padeciam da síndrome tinham vários gâmetas aneuplóides (Georgiou et al., 2006). Isto acontece quando a segregação anormal escapa aos checkpoints meióticos (Hassold et al., 1992).
Um espermatozóide normal tem 23 cromossomas, sendo que é monossómico para todos os autossomas e tem apenas um X ou um Y. Os espermatozóides anormais podem ser nulissómicos, em que um cromossoma é perdido; dissómico, tem um par de cromossomas; ou mesmo diplóide, em que todos os cromossomas estão em duplicado apresentando 46 cromossomas (Jamar et al., 2000). Na revisão feita por Martin em 2008 este encontrou uma taxa de aneuploidia para os cromossomas sexuais que variava entre 0,3 e 15% (Martin, 2008), valores bem diferentes dos que Gordeeva et al., 2011, apresentava no que concerne a homens sem patologia (1-2% de aneuploidias) (Gordeeva et al., 2011).
Alterações monogénicas
São poucos os genes não ligados ao cromossoma Y identificados como passíveis de alterarem a fertilidade mas temos alguns exemplos bem descritos como caso do locus da fibrose cística (gene CFTR) presente no braço longo do cromossoma 7, isto porque alterações neste gene são encontradas em 60-90% dos doentes com aplasia bilateral congénita dos canais deferentes
Introdução
20
(CBAVD) o que leva a azoospermia obstrutiva (Georgiou et al., 2006, Jonge and Barratt, 2006, Ferlin et al., 2007).
Também o gene da globulina ligadora às hormonas sexuais (SHBG), localizado no cromossoma 17 tem sido estudado por poder ter influência na espermatogénese, sendo que este tem influência no transporte das hormonas sexuais controlando a concentração dos androgénios (O'Flynn O'Brien et al., 2010).
Temos também distúrbios ligados ao cromossoma X como o syndrome Kallmann (o mais frequente) em que existe uma mutação no gene Kal-1 no braço curto do cromossoma X e que se caracteriza por uma associação entre hipogonadismo hipogonadotrófico e anosmia (Jonge and Barratt, 2006).
Existem outras síndromes de base genética que afectam a fertilidade como síndrome de Noonan, distrofia miotónica, hemoglobinopatias, síndrome de Prader-Willi ou a doença de Kennedy. Mas segundo Raheem et al., num trabalho recente (2012), a influência genética poderá ser muito maior com diversos genes responsáveis pela regulação da produção de espermatozóides, produção hormonal e receptores hormonais, que ainda não foram identificados, a serem a causa da infertilidade idiopática (Abdel Raheem et al., 2012).
Deleções submicroscópicas do cromossoma Y
O cromossoma Y é o mais implicado nos casos de infertilidade masculina. O gene SRY e um gene com ele relacionado, Sox9, levam à diferenciação das células de Sertoli na gónada bivalente, e à formação dos testículos (Kashimada and Koopman, 2010). Mutações nestes genes levam, respectivamente, a disgenesia gonadal e a displasia campomélica (Hanley et al., 2000).
Além do gene SRY, o cromossoma Y tem também uma região chamada de male-specific Y (MSY) cujos genes são indispensáveis à espermatogénese. Assim se parte do material se perder durante a mitose ou meiose, e como esta região não tem uma contraparte de material, pode haver alteração na espermatogénese (Abdel Raheem et al., 2012).
As regiões tipicamente envolvidas na infertilidade foram chamadas de factor de azoospermia ou AZF (onde se encontram AZFa, AZFb, AZFc e AZFd), localizam-se na região Yq11.23 e controlam a espermatogénese (Griffin and Finch, 2005, Navarro-Costa et al., 2010). Microdeleções (não se conseguem observar na citogenética convencional) nesta região são a mais importante causa de oligozoospermia severa e azoospermia não obstrutiva (Ferlin et al., 2007).
As deleções críticas podem-se dar em três regiões distintas AZFa, AZFb e AZFc. Deleções na região AZFa têm sido associadas à ausência de células germinativas ou síndrome das células de Sertoli; AZFb tem sido implicada na paragem da espermatogénese; já as deleções ao nível de AZFc
Introdução
21
originam uma maturação anormal dos espermatozóides (Navarro-Costa et al., 2010). Destas deleções as mais frequentes são as deleções em AZFc (cerca de 60% do total) seguidas das deleções em AZFb sozinhas ou com outras regiões AFZ (35% do total) e finalmente as deleções em AZFa (cerca de 5% do total) (Krausz et al., 2003).
Dano no DNA dos Espermatozóides
Durante a espermatogénese o núcleo dos espermatozóides sofre inúmeras alterações para que este fique num estado tipo cristalino e fique bioquimicamente inacessível. Esta inacessibilidade serve para que a informação genética fique protegida de factores ambientais como o stresse oxidativo ou alterações de pH no tracto genital masculino ou feminino (Ward, 2010).
O dano no DNA dos espermatozóides tem sido associado a alterações morfológicas (Nicopoullos et al., 2008), baixos níveis de implantação, elevada incidência de abortos, elevados níveis de morbilidade nos recém-nascidos e fertilidade diminuída quer in vivo como in vitro (Benchaib et al., 2007, De Iuliis et al., 2009, Ghazi and Abdelfattah, 2011).
Os factores responsáveis pela indução do dano no DNA continuam por ser descobertos, mas parecem existir tanto estímulos extrínsecos como factores físicos (como o calor e a radiação electromagnética), anomalias no metabolismo lipídico, leucócitos e idade; como intrínsecos, apoptose ou produção de radicais livres pelos espermatozóides (Benchaib et al., 2007, De Iuliis et al., 2009).
Aitken et al. em 2009 propôs um modelo passível de explicar os eventos que levariam ao dano no DNA, em que durante a espermatogénese acontecem erros na remodelação da cromatina que levam à produção de espermatozóides com o DNA nuclear pobre em protaminas, o que confere à célula um estado de susceptibilidade a ataques de ROS (Aitken et al., 2009).
Apesar de existirem vários estudos que demonstram a presença de DNA fragmentado em espermatozóides maduros, continua a não ser consensual se se tratam de células apoptóticas residuais que por alguma razão conseguiram chegar até ao evento ejaculatório, ou se se trata de apoptose tardia que ocorre já no espermatozóide maturo, ou ainda se esta fragmentação de DNA ocorre por um outro mecanismo (Evenson and Wixon, 2006). Para a detecção da fragmentação de DNA, têm vindo a ser usados diferentes ensaios como, dispersão de cromatina, estrutura da cromatina do espermatozóide (SCSA), ensaios cometa e método de adição de nucleótidos marcados com fluoresceína mediada pela enzima deoxinucleotidil transferase terminal (TUNEL) (Evenson et al., 2007, Lewis et al., 2008, Mitchell et al., 2011).
Introdução
22
O ensaio de TUNEL é um ensaio que foi desenvolvido para células somáticas, vindo mais tarde a ser adaptado para células espermáticas (Sailer et al., 1995). Este ensaio detecta fragmentações de DNA de cadeia simples e dupla, medida por um ponto terminal específico caracterizado pela presença de grupos hidroxilo livres 3’ (Sharma et al., 2010). O princípio deste ensaio assenta na transferência de um nucleótido marcado para o grupo 3OOH da cadeia de DNA fragmentado pela acção da enzima deoxinucleotidil transferase. Isto permite-nos definir se aquela célula apresenta ou não fragmentação do seu DNA (Evenson and Wixon, 2006).
Um defeito desta técnica é que ela depende da actividade da transferase terminal em aceder às quebras nas cadeias de DNA e catalisar a inserção das bases marcadas. E, se isto não é um problema nas células somáticas pode-o ser para os espermatozóides, visto estes serem extremamente especializados e terem uma cromatina altamente compacta que restringe este acesso (Mitchell et al., 2011).
O ensaio de cometa ou single cell gel electrophoresis (SCGE) é uma técnica em que os espermatozóides são suspensos em agarose de baixo ponto de fusão, em estado líquido, e posteriormente colocada numa lâmina de microscópio onde o gel solidifica. As células são lisadas e posteriormente sujeitas a electroforese horizontal (Evenson and Wixon, 2006). Esta técnica permite-nos (a pH> 12,6) detectar, em células individuais, rupturas em cadeias de DNA duplas e simples, sítios alquali-lábeis e ligações cruzadas (Collins, 2004, Kumaravel and Jha, 2006). Considera-se uma técnica sensível e rápida (Collins, 2004).
O DNA não fragmentado e com maior peso molecular permanece compacto enquanto as restantes partes, referidas anteriormente, migram formando uma espécie de cauda, daí o nome de cometa. Apesar dos diferentes protocolos utilizados a técnica tem passos comuns como preparação da suspensão, colocação no gel, lise celular, electroforese, neutralização, marcação e análise. A grande diferença dos protocolos para os espermatozóides e as células somáticas assenta na lise celular e descondensação do DNA, que como já foi referido é mais difícil nos espermatozóides. Então, torna-se necessária a incubação dos espermatozóides com proteínase K e detergentes (Shen et al., 1999).
É possível ainda detectar danos oxidativos pela incubação, após as lises celulares, com a enzima formamido pirimidina DNA glicosilase (FPG), que detecta guaninas 8-OH e outras purinas danificadas oxidativamente; quando incubado com FPG o ensaio torna-se mais sensíveis ao dano por alquilação que o ensaio de cometa convencional (Speit et al., 2004). Os danos oxidativos são determinados pela diferença de resultados entre o ensaio com incubação com a enzima FPG e o o ensaio sem incubação com a enzima FPG.
Introdução
23
Espécies reactivas de oxigénio (ROS) e stresse oxidativo
Os ROS são radicais livres e peróxidos que derivam do metabolismo do oxigénio e estão presentes em todos os organismos aeróbicos (Agarwal and Prabakaran, 2005). Eles são altamente instáveis e podem reagir com inúmeras substâncias como lípidos, aminoácidos, hidratos de carbono, proteínas ou DNA (Venkatesh et al., 2009). Elevados níveis de ROS são encontrados em 25-40% de homens inférteis (Linschooten et al., 2011).
Os três grandes tipos de ROS são o radical superóxido (02•-), que é formado quando existe
uma fuga da cadeia de transporte de electrões; o peróxido de hidrogénio (H2O2), que resulta da
dismutação de superóxidos ou pode ser gerado pela acção de algumas enzimas; e o radical hidroxilo (OH•), é formado a partir do peróxido de hidrogénio numa reacção catalisada por iões metálicos (Fe++ ou Cu+), é altamente reactivo e pode levar à modificação de purinas em pirimidinas e provocar quebras nas cadeias de DNA (Agarwal et al., 2005). Pode também levar à peroxidação de ácidos gordos polinsaturados (PUFA) e membranas celulares (peroxidação lipídica) (Lanzafame et al., 2009). Destes, o mais produzido pelos espermatozóides parece ser o radical superóxido, que pode gerar peróxido de hidrogénio pela acção da superóxido dismutase (SOD) ou espontaneamente (Lanzafame et al., 2009). O peróxido de hidrogénio parece estar intimamente associado à perda de motilidade pelos espermatozóides (Aitken and Baker, 2006).
Os ROS existentes no plasma seminal provêm essencialmente de leucócitos e de espermatozóides imaturos e morfologicamente anormais (Agarwal and Prabakaran, 2005, Makker et al., 2009).
Dependendo da concentração, localização e tempo de exposição, os ROS podem ter efeitos benéficos ou prejudiciais sobre os espermatozóides (Agarwal and Prabakaran, 2005). Níveis baixos de ROS são essenciais para a fertilização, reacção acrossómica, hiperativação, motilidade, capacitação (Agarwal and Prabakaran, 2005, Lanzafame et al., 2009, Saalu, 2010).
Níveis elevados de ROS podem levar a:
Apoptose, num processo em que os ROS levam à disrupção da membrana mitocondrial, que leva à libertação de citocromo c, que leva à cascata de caspases (Agarwal and Prabakaran, 2005);
Peroxidação lipídica (LPO), que é definida como a oxidação de PUFA, sendo que as membranas dos espermatozóides são muito sensíveis à LPO pois são ricas em PUFA. Em espermatozóides tem sido verificado o malonildialdeído (MDA), que é um produto final de LPO (Saalu, 2010);