Universidade de Trás-os-Montes e Alto Douro
Estudo da contaminação dos alimentos
confecionados em folha de alumínio
Dissertação de Mestrado em Biotecnologia e Qualidade Alimentar
Luciana Isabel Pereira dos Santos
Orientador: Professora Doutora Maria Cristina Fialho Oliveira
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
Estudo da contaminação dos alimentos
confecionados em folha de alumínio
Dissertação de Mestrado em Biotecnologia e Qualidade Alimentar
Luciana Isabel Pereira dos Santos
Orientador: Professora Doutora Maria Cristina Fialho Oliveira
Composição do Júri:
O orientador
v
Agradecimentos
Há contributos de natureza diversa que não podem e nem devem deixar de ser realçados nesta dissertação. Por essa razão, desejo expressar os meus sinceros agradecimentos:
À Professora Maria Cristina Fialho Oliveira, minha orientadora, por toda ajuda prestada, por toda a sabedoria que me transmitiu, e por ter sempre uma palavra amiga que, às vezes nas piores alturas, se tornou um grande apoio.
À minha querida, Dona Palmira Almeida, por ser a pessoa especial que é e por me ajudar em tudo.
Ao Senhor Carlos Matos, por toda a ajuda prestada no decorrer de todo este trabalho. À Lisete Fernandes, por todas as palavras amigas, pelo seu beijinho e abraço, e por todos os ensaios realizados para que este trabalho se finalizasse.
À minha querida Maria Inês Miranda, pela paciência, amizade, companheirismo, e todo o apoio que me deu nesta fase, sem ti, as coisas teriam sido bem mais complicadas.
À minha família, especialmente aos meus pais, Luísa e Luciano, por me apoiarem em todas as minhas decisões, apesar de não serem sempre as mais corretas, e por acreditarem, incondicionalmente em mim, por vezes mais do que eu própria, e por fazerem com que me tornasse a pessoa que sou.
Ao meu querido John, por todo o apoio, amizade, paciência e em especial, por todo o amor que me deu nesta fase.
vii
Resumo
O alumínio é um dos elementos mais abundantes da crosta terrestre e inúmeros estudos indicam que este metal é um neurotóxico, estando associado a neuropatias, tal como a doença de Alzheimer.
Sendo a ingestão de alimentos uma das principais fontes de exposição ao alumínio, é extremamente importante identificar possíveis fontes de contaminação dos alimentos por este elemento. Uma vez que é prática comum confecionar alimentos em papelotes deste mesmo metal, é objetivo geral deste trabalho investigar a contaminação de alimentos pelo alumínio que resulta da corrosão da folha de alumínio utilizada na confeção com papelotes.
Numa primeira fase foi estudada a dissolução oxidativa do alumínio sujeito a extração em refluxo em soluções modelo de quatro ácidos carboxílicos presentes nos alimentos: ácido cítrico, ácido málico, ácido ascórbico e ácido glutâmico. Verificou-se que o ácido cítrico, comparativamente aos outros ácidos carboxílicos, é o ácido com maior poder corrosivo, dando origem à corrosão por picadas. Tanto o ácido málico como o ácido ascórbico promovem um tipo de corrosão distinto, corrosão uniforme. Relativamente ao ácido glutâmico, os resultados obtidos sugerem que este ácido tem dois efeitos distintos: por um lado promove a dissolução do alumínio, por outro lado, a formação de uma camada de óxido na superfície da folha de alumínio.
Numa segunda fase deste trabalho foi estudada a dissolução oxidativa do alumínio em duas receitas modelo confecionados em papelotes, uma com truta e outra com legumes. As técnicas analíticas utilizadas na quantificação do alumínio transferido para as soluções e para os alimentos foram a espectrofotometria de absorção atómica em forno de grafite e com chama. A folha de alumínio foi caracterizada pelas técnicas de DRX, SEM e EDS.
Verificou-se que a diferença de concentração de alumínio nas trutas confecionadas com e sem alumínio foi de 17,1 mg Al.Kg-1 no molho; 3,82 mg Al.Kg-1 na pele superior; e 9,24 mg
Al.Kg-1 na pele inferior. Não se registaram diferenças estatisticamente significativas no caso
dos filetes de peixe e dos legumes. Com os resultados obtidos, conclui-se que a confeção dos alimentos em papelotes não oferece perigo para a saúde humana.
Palavras-chave: dissolução do alumínio; corrosão do alumínio; pitting; ácidos carboxílicos;
viii
Abstract
Aluminium is one of the most abundant elements in the earth's crust and numerous studies indicate that this is a neurotoxic metal, which is associated with neuropathies such as Alzheimer's disease.
Being the food intake the main source of exposure to aluminum, it is extremely important to identify possible sources of food contamination by this element. Since it is common practice cooking food in baggies of the same metal, the aim of this study is to investigate the contamination of food by aluminum resulting from corrosion of the aluminum foil used in quilting with baggies.
In the first phase, aluminum dissolution was studied in model solutions four carboxylic acids in foods: citric acid, malic acid, ascorbic acid and glutamic acid. Compared to other carboxylic acids, citric acid is the one with higher corrosive power (higher leaching amount of aluminum in the form of pitting corrosion). For malic and ascorbic acid, the mechanism of corrosion is uniform. For the glutamic acid, it suggests having two distinct mechanisms of action: firstly increases the dissolution of aluminum, and secondly forms an oxide layer on the surface of the aluminum foil.
In a second phase of this study, the dissolution of aluminum was studied in two model recipes cooked in baggies, one with trout and one with vegetables. The analytical techniques used in the quantification of aluminum leached into solutions were to the flame and graphite furnace atomic absorption spectrometry. The aluminum foil was characterized by the techniques of XRD, SEM and EDS.
Among the results, the difference between concentration of aluminum in cooked trout with and without aluminum was 17,1 mg Al.Kg-1 in sauce; 3,82 mg Al.Kg-1 in top skin; and 9,24 mg
Al.Kg-1 in bottom skin. There were no statistically significant differences in the case of fish fillets
and vegetables. With this results, it was concluded that cooking food in baggies is non-hazardous to human health.
Keywords: dissolution of aluminum; corrosion of aluminum; pitting; carboxylic acids; trout; vegetables.
ix
Índice Geral
Agradecimentos V Resumo VII Abstract VII Índice Geral……… IX Índice de Tabelas……….XIÍndice de Figuras………...XIII
Lista de Abreviaturas e Símbolos XVI
I. Introdução
1.1. Disponibilidade química e bioquímica do alumínio 2
1.2. Vias de Exposição ao alumínio 4
1.3. Absorção e distribuição do alumínio no organismo 5
1.3.1. Excreção 6
1.4. Consequências fisiológicas da exposição ao alumínio 8
1.5. O uso de materiais à base de alumínio na confeção de alimentos 10
1.6. Folha de alumínio 15
1.6.1. Classificação e composição das ligas de alumínio 16
1.7. Corrosão do alumínio 17
1.7.1. Tipos de corrosão 18
a) Corrosão uniforme 18
x
c) Corrosão em fendas (crevice) 20
d) Corrosão intergranular 20
e) Corrosão por esfoliação 21
1.8. Motivação/Objetivos do trabalho 22
II. Material e métodos
2.1. Alimentos confecionados em papelotes 24
2.1.1. Preparação das amostras 24
2.1.1.1. Truta 24
2.1.1.2. Legumes 24
2.1.2. Digestão das amostras 25
2.2. Simulação da confeção de alimentos em papelotes com soluções
modelo de ácidos carboxílicos 26
2.2.1. Preparação das soluções modelo 26
2.3. Quantificação do alumínio nas amostras alimentares e soluções
modelo 27
2.3.1. Método de espectrofotometria de absorção atómica com chama 27 2.3.2. Método de espectrofotometria de absorção atómica em forno de
grafite 27
2.4. Caracterização morfológica e estrutural da folha de alumínio 28
2.4.1. Microscopia eletrónica de varrimento (SEM) 28
xi
2.4.3. Difração de raios-X (DRX) 29
2.5. Análise estatística dos dados 30
III.Resultados e discussão
3.1. Caracterização inicial da folha de alumínio 32
3.2. Simulação da confeção em papelotes com soluções modelo de ácidos
carboxílicos 36
3.2.1. Solução modelo 1 - Ácido Cítrico 36
3.2.2. Solução modelo 2 - Ácido Málico 41
3.2.3. Solução modelo 3 - Ácido Ascórbico 44
3.2.4. Solução modelo 4 - Ácido Glutâmico 47
3.2.5. Comparação entre os diferentes ácidos carboxílicos 55 3.2.6. Solução modelo 5 - Mistura dos ácidos (cítrico, málico,
ascórbico e glutâmico) 58
3.3. Confeção em papelotes 61
3.3.1. Truta 61
3.3.2. Legumes 66
IV. Considerações finais 69
V. Bibliografia 71
xiii
Índice de Tabelas
Índice de Figuras
Figura 1 - Predominância das espécies de alumínio em soluções aquosas a diferentes
valores de pH. 3
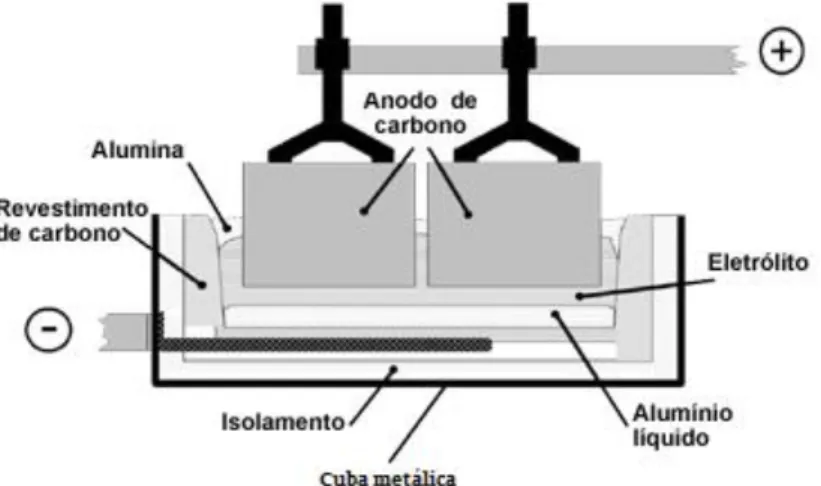
Figura 2 - Processo de Hall-Héroult. 15
Figura 3 - Diagrama de Pourbaix do Alumínio a 25 ºC. 18
Figura 4 - Mecanismo de corrosão por pitting. 19
Figura 5 – Corrosão intergranular. 20
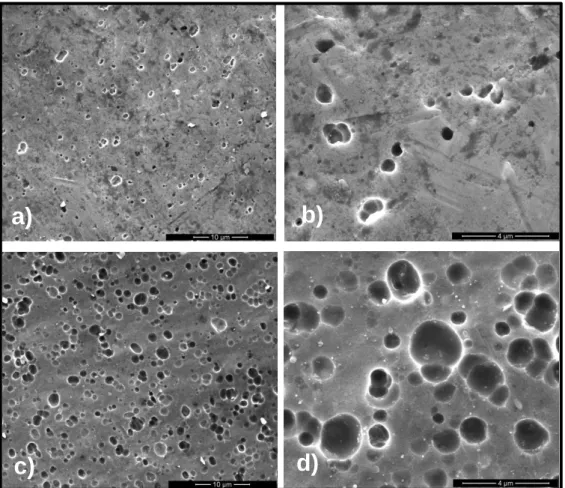
Figura 6 – Imagem SEM da folha de alumínio: a) ampliação 5000x, b) ampliação
20000x. 32
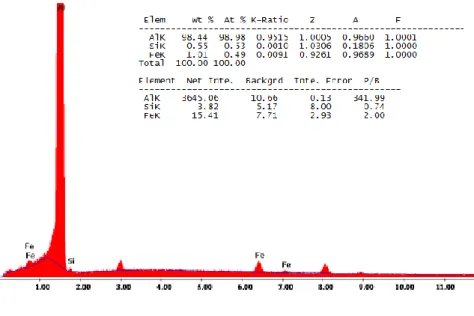
Figura 7 - Espectro de EDS da folha de alumínio. 33
Figura 8 – Difractogramas da folha de alumínio (azul), chapa de alumínio parcialmente oxidado (preto) e chapa de alumínio previamente polida (vermelho). 34
Figura 9 - Imagem de SEM (cross-section) da folha de alumínio (ampliação 5000x). 35 Figura 10 – Imagem de SEM da folha de alumínio após diferentes horas de extração sob refluxo na solução modelo 1 (ácido cítrico): a) 1 hora, ampliação 5000x; b) 1 hora, ampliação 20000x; c) 4 horas, ampliação 5000x; d) 4 horas, ampliação 20000x. 36 Tabela 1 - Ligas de alumínio – composição e diferentes aplicações. 16
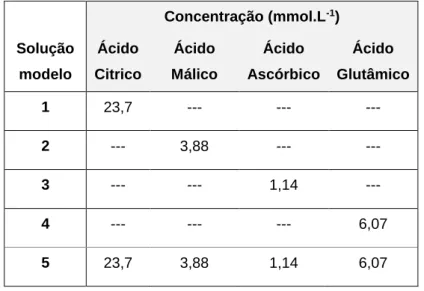
Tabela 2 - Composição das soluções modelo de ácidos carboxílicos na confeção de peixe e legumes em papelotes.
26
Tabela 3 - Concentração e pH das soluções de ácido cítrico, málico, ascórbico e glutâmico utilizadas neste estudo. Constantes de estabilidade (Kf (Al-X)), constantes de acidez (Ka) e estrutura dos diferentes ácidos carboxílicos.
56
Tabela 4 – Comparação da concentrações de alumínio obtida na extração sob refluxo nas diferentes soluções modelo de ácidos carboxílicos.
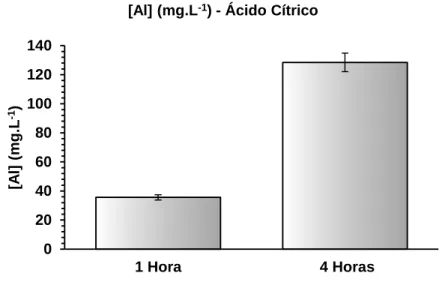
xiv Figura 11 – Concentração de alumínio em solução aquosa de ácido cítrico após 1 e 4
horas de extração sob refluxo. 38
Figura 12 - Variação da concentração de alumínio em função do tempo de extração sob
refluxo numa solução de ácido cítrico. 39
Figura 13 - Concentração de Al transferido para a solução de ácido cítrico após 1 e 4 horas de extração sob refluxo em função do fator de diluição da solução de ácido cítrico. 39 Figura 14 – Imagem SEM da folha de alumínio submetida a 1 h de extração sob refluxo em solução de diferentes concentrações de ácido cítrico: a) solução diluída 10x, ampliação 5000x; b) solução diluída 20x, ampliação 5000x. 40 Figura 15 - Imagem SEM da folha de alumínio após diferentes tempos de extração sob refluxo na solução modelo 2 (ácido málico): a) 1 hora, ampliação 5000x; b) 1 hora, ampliação 20000x; c) 4 horas, ampliação 5000x; d) 4 horas, ampliação 20000x. 41 Figura 16 - Concentração de alumínio em solução aquosa de ácido málico após 1 e 4
horas de extração sob refluxo. 42
Figura 17 – Variação da concentração de alumínio em função do tempo de extração
sob refluxo numa solução de ácido málico 43
Figura 18 – Imagem de SEM da folha de alumínio após diferentes tempos de extração sob refluxo na solução modelo 3 (ácido ascórbico): a) 1 hora, ampliação 5000x; b) 1 hora, ampliação 20000x c) 4 horas, ampliação 5000x; d) 4 horas, ampliação 20000x. 44 Figura 19 - Concentração de alumínio em solução aquosa de ácido ascórbico após 1 e
4 horas de extração sob refluxo. 45
Figura 20 - Variação da concentração de alumínio em função do tempo de extração sob
refluxo numa solução de ácido ascórbico. 46
Figura 21 – Imagem de SEM da folha de alumínio após diferentes tempos de extração sob refluxo na solução modelo 4 (ácido glutâmico): a)1 hora, ampliação 5000x; b)1 hora, ampliação 20000x; c) 4 horas, ampliação 5000x; d) 4 horas, ampliação 20000x.
47
Figura 22 – Imagem SEM de um filme de óxido de alumínio obtido por anodização. 48 Figura 23 – Imagem SEM de um filme de óxido de alumínio obtido por anodização não
eletrolítica de alumínio em água desionizada quente. 48
Figura 24 - Espectro de EDS da folha de alumínio submetida a extração sob refluxo
com ácido glutâmico após 4 horas. 49
Figura 25 - Estrutura cristalina de α-Al2O3: (a) estrutura hexaédrica; (b) vista superior
da estrutura hexaédrica. 50
Figura 26 - Representação esquemática das interfaces existentes na camada de óxido
de um metal em contacto com uma solução. 50
Figura 27 - Concentração de alumínio em solução aquosa de ácido glutâmico após 1 e
xv Figura 28 - Variação da concentração de alumínio em função do tempo de extração sob
refluxo numa solução de ácido glutâmico. 52
Figura 29 – Concentração de Al transferido para a solução de ácido glutâmico após 1 e 4 horas de extração sob refluxo em função do fator de diluição da solução de ácido
glutâmico. 53
Figura 30 – Imagem SEM da folha de alumínio submetida a 4 h de extração sob refluxo em solução de diferentes concentrações de ácido glutâmico: a) solução diluída 10x, ampliação 5000x; b) solução diluída 20x, ampliação 5000x; c) solução diluída 10x, ampliação 40000x; d) solução diluída 20x, ampliação 40000x.
54
Figura 31 – Comparação da variação da concentração de alumínio em função do tempo de extração sob refluxo nas diferentes soluções modelo. 55 Figura 32 - Diafratograma das folhas de alumínio quando submetidas a extração sob refluxo em diferentes soluções de ácidos carboxílicos (A – Ácido Ascórbico; M – Ácido Málico; G – Ácido Glutâmico; C – Ácido Cítrico; P – Folha de Alumínio Virgem; Cl – Cola de Carbono).
57
Figura 33 – Imagem de SEM da folha de alumínio após diferentes tempos de extração sob refluxo na solução modelo 5 (mistura dos ácidos): a) 1 hora, ampliação 5000x; b) 1 hora, ampliação 20000x c) 4 horas, ampliação 5000x; d) 4 horas, ampliação 20000x 58 Figura 34 - Variação da concentração de alumínio numa solução de mistura de ácidos
carboxílicos com o tempo de extração sob refluxo. 60
Figura 35 - Concentração de alumínio no molho e nos diferentes componentes da truta
confecionada com e sem folha de alumínio. 61
Figura 36 - Diferenças de concentração de alumínio nas amostras de truta
confecionadas em papelote e em Pyrex®. 62
Figura 37 – Imagem de SEM da folha de alumínio do processo de confeção, em contacto com truta: a) ampliação 5000x; b) ampliação 20000x; 63 Figura 38 – Imagem de SEM da folha de alumínio do processo de armazenamento e confeção, ampliação 20000x: a) confeção da truta em papelote b) temperatura
ambiente, 24 horas; c) 4 ºC, 24 horas. 65
Figura 39 - Concentração de alumínio nos ensaios de legumes confecionados com e
sem folha de alumínio. 66
Figura 40 – Imagem de SEM da folha de alumínio do processo de confeção dos legumes em papelote: a) ampliação 5000x; b) ampliação 20000x. 67
xvi
Lista de Abreviaturas e símbolos
WHO – World Health Organization
JECFA - Joint FAO/WHO Expert Committee on Food Additives
FAO - Food and Agriculture Organization of the United Nations
ABAL - Associação Brasileira do Alumínio
SEM - Scanning electron microscopy
EDS - Energy-dispersive X-ray spectroscopy
2
1.1. Disponibilidade química e bioquímica do alumínio
O alumínio está presente em grandes quantidades na litosfera, sendo o terceiro elemento mais abundante, precedido apenas pelo silício e pelo oxigénio (Woodburn, 2012; Ranau et al., 2001).
O alumínio tem uma vasta variedade de aplicações industriais nomeadamente em indústria aeronáutica, naval, transporte, na produção de utensílios culinários, eletrodomésticos e embalagem (Rajwanshi et al., 1997). O uso comercial do alumínio é ditado pelas suas atrativas propriedades físicas e químicas, tais como a baixa densidade específica, alta condutividade térmica e elétrica, ductibilidade e maleabilidade, resistência à corrosão, e relativamente baixo custo (Turhan, 2006; Ranau et al., 2001; Rajwanshi et al., 1997). A boa resistência à corrosão deve-se à estabilidade dos óxidos formados na superfície do metal, quer pela ação do oxigénio do ar, quer por anodização.
No ambiente, o alumínio encontra-se no estado oxidado (Al3+), ligado fortemente a ligantes
de oxigénio, como por exemplo a água (Martin, 1986), podendo também ligar-se a outros dadores de oxigénio, tais como citrato, fosfato, ácido láctico, ácido oxálico, ácido cítrico (Harris et al., 1996).
Em solução aquosa, a natureza das espécies formadas entre o alumínio e a água (ligante de oxigénio) é condicionada pelo pH do meio. A Figura 1 resume graficamente a predominância das várias espécies químicas de alumínio em soluções aquosas com diferentes valores de pH. A pH neutro e em meio básico o alumínio existe na forma aniónica, sob a forma de Al(OH)4-. No meio ácido o alumínio encontra-se na forma catiónica, por
exemplo Al3+, Al(OH)2+ e Al(OH)
2+ (Priest, 2004). A pH ácido mas próximo do neutro ocorre a
hidrólise do alumínio formando um precipitado insolúvel de hidróxido de alumínio (Al(OH)3)
3
Figura 1 - Predominância das espécies de alumínio em soluções aquosas a diferentes valores de pH. Adaptado de Priest (2004).
A biodisponibilidade e a biocinética do alumínio são típicos de outros metais trivalentes, incluindo os lantanídeos e alguns actinídeos. Estes metais possuem uma baixa solubilidade, formam hidróxidos solúveis a pH neutro, têm uma biodisponibilidade baixa e são retidos pelo esqueleto. No caso do alumínio, os estudos com 26Al têm mostrado que cerca de 2 % de
alumínio que entra no sangue é mantido dentro do corpo durante anos, mas que o restante é excretado, na grande maioria pelo sistema urinário. Dentro do sangue, o alumínio é ligado à proteína de transporte de ferro - transferrina, mas a força de ligação é baixa e o metal é facilmente removido do sangue pelos rins (Priest, 2004).
Alguns autores defendem que o teor de alumínio não é preocupante, pois o plasma sanguíneo tem um pH de 7,4, e a este pH a solubilidade do hidróxido de alumínio é bastante baixa (na ordem dos 10-11 mol/L) (Martin, 1986). Contudo o tema é controverso, Jugdaohsingh e
colaboradores (2004) verificaram que, a pH 7,0, apenas 20 µmol.L-1 de alumínio estariam
disponíveis em solução quando não existissem agentes quelantes. Todavia, na presença de agentes complexantes, tais como o citrato, o alumínio forma complexos aumentando a sua solubilidade, o que permite a sua passagem através das membranas biológicas. Com efeito, estes autores demonstram que os complexos alumínio-ligando, tal como citrato de alumínio, podem permanecer em solução a um pH fisiológico. Assim, estes estudos indicam que uma vez dentro do complexo biológico, o alumínio tem potencial para sofrer acumulação e ser distribuído no organismo (Jugdaohsingh et al., 2004).
4
1.2. Vias de exposição ao alumínio
Ao ser um metal ubíquo, existindo em variadas formas químicas, os organismos vivos são expostos ao alumínio quer por fontes naturais, como antropogénicas, (Woodburn, 2012), via inalatória (boca e nariz), oral (via ingestão de alimentos, água e medicamentos) e até mesmo cutânea (World Health Organization, 1997).
Uma exposição mínima de alumínio para o organismo não é um problema, pois o corpo humano pode excretar pequenas quantidades de forma muito eficiente. Durante muitos anos, o alumínio não foi considerado prejudicial para a saúde humana devido à sua baixa biodisponibilidade (Stahl et al., 2011). Contudo em 1965, experiências com animais sugeriram uma possível ligação entre o alumínio e a doença de Alzheimer (Crapper McLachlan et al., 1989; Katsetos et al., 1990; Hewitt et al., 1991; Gupta et al., 2005; Perl and Moalem, 2006).
Os alimentos são, sem dúvida, a principal fonte de ingestão de alumínio, onde a fonte pode ser considerada primária ou secundária. O conteúdo primário é o teor natural de alumínio dos alimentos causado pela absorção geológica circundante durante o crescimento e é, para todos os efeitos práticos, inevitável. O conteúdo secundário é o conteúdo principal acrescido de qualquer possível contaminação de alumínio.
Os sais de alumínio têm sido amplamente utilizados em diversas atividades do homem. Por exemplo, são muito utilizados como agentes anti-aglomerantes e na clarificação de água (Rajwanshi et al., 1997), como antiácidos (Becaria et al., 2002), anti-transpirantes (Sorenson et al., 1979), e coadjuvante para vacinas (Rajwanshi et al., 1997) e aditivos alimentares tais como queijos processados, produtos de panificação e produtos de grãos (por exemplo, cereais de pequeno almoço, farinhas, massas) (Becaria et al., 2002).
Particularmente na indústria alimentar, verifica-se um aumento exponencial na utilização de materiais de alumínio no processamento, embalagem e conservação de produtos alimentares. Assim sendo, uma das principais vias de ingestão deste metal ocorre através da contaminação dos alimentos pelos recipientes, como latas, panelas, utensílios de cozinha e embalagens de armazenamento (Ranau et al., 2001; Joshi et al., 2003). Na literatura encontram-se vários relatos sobre o efeito do cozimento de alimentos em panelas de alumínio no processo e transferência deste elemento para a dieta humana, sendo esta questão abordada detalhadamente no subcapítulo 1.5.
A concentração real do alumínio nos alimentos e nas bebidas varia de país para país, dependendo do produto alimentar, do tipo de processamento utilizado e, em particular, dos níveis de aditivos alimentares que contêm alumínio de acordo com a legislação em vigor na área geográfica em que são produzidos (World Health Organization, 1997).
5 O JECFA (Joint FAO/WHO Expert Committee on Food Additives) constituído pela Food and Agriculture Organization of the United Nations (FAO) e a World Health Organization (WHO) reduziu o valor semanal tolerável de ingestão do alumínio de 7 mg.Kg-1 de peso
corporal/semana para 1 mg.Kg-1 de peso corporal/semana. Mas é espectável que no futuro
estes valores sejam drasticamente reduzidos caso as suspeitas neurotoxicológicas se confirmem.
1.3. Absorção e distribuição do alumínio no organismo
Nos seres humanos, a maior ingestão diária de alumínio advém do consumo de alimentos e bebidas, desconhecendo-se, qual a percentagem de metal que é absorvido a partir de fontes alimentares pois a composição e a acidez da dieta confina a disponibilidade do metal (Becaria et al., 2002).
Uma das vias de absorção mais frequentes de alumínio é através do intestino (Ittel, 1993) mas por si só, é muito pobre (Flaten, 2001.) Contudo muitos dos componentes da dieta são potenciais agentes quelantes de alumínio e podem melhorar a sua absorção (Deng et al., 2000; Venturini-Soriano and Berthon, 2001) como por exemplo, a presença de pequenos ácidos orgânicos, tais como o lactato e o citrato, que aumentam a biodisponibilidade do alumínio, ao contrário do que acontece com o fósforo e o silício (Yokel and O'Callaghan,1997).
Atualmente crê-se que a absorção intestinal de alumínio inclui o transporte passivo por vias de passagem paracelular através dos enterócitos e por vias de passagem através dos enterócitos transcelulares envolvendo processos de transporte facilitado (Greger, 1993; Greger e Sutherland, 1997). A primeira via é não saturável, podendo ocorrer sempre sem risco de haver saturação, e é usada principalmente para a elevadas concentrações de alumínio, a qual é modificada por cálcio extracelular, enquanto a segunda via é saturável (Cunat et al., 2000).
As contribuições individuais desses processos para a absorção líquida de alumínio através do trato gastrointestinal são dependentes de um conjunto de fatores, incluindo a química do lúmen do intestino e da saúde do indivíduo exposto.
Em indivíduos saudáveis, o consenso geral é que o alumínio administrado oralmente não é facilmente absorvido a partir do tracto gastrointestinal após exposição a níveis dietéticos moderados (Greger and Baier, 1983; Powell and Thompson, 1993; Priest, 1993). Quando ingerido sob a forma de lactato de alumínio misturado com sumo de frutas, verifica-se que o alumínio é imediatamente excretado pelos voluntários saudáveis (Greger and Baier, 1983).
6 Estes dados são concordantes com os de Day e colaboradores, que demonstraram que apenas 1% do alumínio foi absorvido por ingestão de citrato de alumínio (Day et al., 1991). Neste estudo, verificou-se que a coadministração de citrato afeta não só a absorção como a acumulação de alumínio. O citrato ao estar presente no sumo de fruta complexa o alumínio, tornando-o solúvel com um pH neutro (Martin, 1986) e consequentemente aumenta o potencial para a sua absorção (Powell and Thompson, 1993). Uma vez no trato gastrointestinal, as glicoproteínas da mucosa intestinal ligam-se ao alumínio solúvel (Powell and Thompson, 1993), impedindo a absorção, o que explica os níveis elevados nas fezes.
Após a absorção do alumínio, este liga-se ao plasma, principalmente à glicoproteína transferrina e, com menos frequência, à albumina (Trapp, 1983; Bertholf et al., 1984; Martin, 1986). A distribuição de alumínio depende da espécie do animal utilizado, da via de administração e do composto de alumínio administrado. Day e colaboradores (1994) demostraram, em estudos com humanos utilizando o isótopo de 26Al, que um dia após a
administração intravenosa, 99% do alumínio está presente no plasma sanguíneo (80% do alumínio estava associado com a transferrina, 10% com a albumina e 10% com proteínas de baixo peso molecular) e os restantes 1% nos eritrócitos. Em contraste, 880 dias após a administração, 14% do alumínio foi associado aos eritrócitos, indicando a incorporação do metal nestas células, durante a eritropoiese.
Em 1996, Priest e seus colaboradores descobriram que 15 minutos após a administração intravenosa, apenas 50% do alumínio injetado é recuperável no sangue, sugerindo que o alumínio pode passar através das paredes dos vasos sanguíneos para estabelecer um equilíbrio entre a concentração de alumínio no sangue e a concentração de alumínio nos fluídos dos tecidos extravasculares (Priest et al., 1996).
1.3.1. Excreção
Nos animais o alumínio é eliminado eficazmente através da urina. Alguns estudos revelam que após a administração de doses únicas de alumínio até 100 µg.Kg-1 de peso corporal em
ratos, o alumínio é quantitativamente recuperado a partir da urina (Wilhelm et al., 1990). Os dados relativos à meia vida no plasma e na depuração renal foram obtidas, principalmente, através de administração intravenosa utilizando doses elevadas de alumínio (Wilhelm et al., 1990) sendo de 1 hora no caso do plasma.
A biocinética do alumínio no homem foi avaliada por Priest e seus colaboradores (Priest et
7 o padrão de excreção urinária do isótopo na sequência de administração intravenosa utilizando um único voluntário. Concluíram que o alumínio é esmagadoramente excretado por via urinária e que o alumínio presente no sangue é transferido para a excreção. Mais de metade do 26Al deixou o sangue após 15 minutos e o declínio continuou, deixando <1% no
sangue ao fim de 2 dias. Após 4 meses mais de 90% do alumínio tinha sido excretado. No final deste ensaio,1178 dias após a administração do 26Al apenas 4% permaneciam no corpo,
sendo estimada a excreção de 94% através da urina e 2% através das fezes.
Um outro estudo, realizado durante um período mais curto, mas utilizando seis voluntários do sexo masculino, revelou que após 5 dias, em média, 71,8% ± 7,3% (SD) do alumínio foi excretado na urina (intervalo 62,4-82,9%). Desse total, uma média de 59,1% foi excretada no primeiro dia, 7,2% no segundo dia, de 2,6% no terceiro dia, de 1,7% no dia quatro e de 1,1% no quinto dia. No mesmo período, uma média de 1,2% foi excretada nas fezes. No geral, os resultados do estudo foram consistentes com os gerados no estudo voluntário único.
8
1.4. Consequências fisiológicas da exposição ao alumínio
Tendo-se discutido o efeito da complexação química na biodisponibilidade do alumínio, identificado as várias vias de exposição a este elemento, o seu potencial de absorção e acumulação nos sistemas biológicos, importa agora compreender as implicações fisiológicas que podem ocorrer nos seres vivos sujeitos a uma elevada exposição ao alumínio.
Vários investigadores têm investigado as interações do alumínio a nível celular em particular em células neuronais, devido à neurotoxicidade do alumínio e à sua possível ligação com doenças neurodegenerativas (Katsetos et al., 1990; Hewitt et al., 1991; Gupta et al., 2005; Perl and Moalem, 2006).
Com efeito, várias manifestações neurológicas têm sido atribuídas à intoxicação por alumínio, em seres humanos. Estas incluem a perda de memória, tremores, movimentos espasmódicos, o movimento do motor lento, perda de curiosidade, ataxia e convulsões generalizadas com estado epilético (Zatta et al., 1991; Crapper McLachlan and Deboni, 1980). As neuropatias que têm sido associadas com alumínio elevado no cérebro incluem Alzheimer do tipo senil e demência pré-senil, síndrome de Down com a doença manifestada de Alzheimer, esclerose amiotrófica lateral (medula e cérebro), demência parkinsoniana com degeneração neurofibrilar, degeneração neurofibrilar adjacente ao hamartoma, síndrome da encefalopatia de diálise, demência alcoólica com desmielinização desigual, placas senis da doença de Alzheimer, e cérebro envelhecido (Zatta et al., 1991; Crapper McLachlan and Deboni, 1980). Estudos epidemiológicos, neuropatológicos e bioquímicos recentes têm sugerido uma possível ligação entre a neurotoxicidade do alumínio e da patogénese da doença de Alzheimer (Kawahara et al., 2001). No entanto, a relação entre esses transtornos patológicos e o alumínio é ainda bastante controversa.
Os padrões de potenciais de ação (também designados disparos) neuronais anormais observados em neurónios expostos a alumínio in vitro, foram atribuídos a uma depressão induzida pelo alumínio da acetilcolinesterase (Gulya et al., 1990), pelo qual a acetilcolina é incapaz de degradar o neurotransmissor da acetilcolina, levando à continuação da transmissão sináptica e, assim, ao potencial de ação irregular. No entanto, este efeito sobre a atividade da acetilcolinesterase não se observou in vivo (Gulya et al., 1990), pondo em causa a aptidão dos estudos in vitro para analisar a neurotoxicidade de alumínio em sistemas biológicos.
Os ensaios para elucidar os mecanismos de neurotoxicidade do alumínio são principalmente realizados in vitro, utilizando preparações de nervos ou células neuronais excisadas em cultura. Consequentemente, existe uma necessidade de expor os organismos
9 ao alumínio, in vivo, por exemplo através de alimentos contaminados com alumínio, seguido de análise da função neuronal.
No envenenamento mais crónico por alumínio, o esqueleto é o principal alvo (Kerr et al., 1992) apresentando um nível muito elevado de alumínio acumulado. Contudo mostram que o fígado, rim, músculo e coração também acumulam alumínio (Walker et al., 1994).
Gopalan (1996) sugeriu que o alumínio pode, numa fase inicial, ser depositado no osso, mas, durante a osteoporose da idade avançada, a desmineralização do osso pode transferir alumínio para outros órgãos, incluindo o cérebro (Gopalan, 1996). O excesso de alumínio ósseo está associado a taxas baixas de formação óssea e risco aumentado de fraturas (Kausz et al., 1999).
Após a exposição inalatória, os efeitos do alumínio são principalmente exercidos no sistema respiratório. Vários trabalhadores da indústria do alumínio desenvolveram asma, tosse e até mesmo diminuição da função pulmonar, contudo se estes efeitos são devidos apenas ao alumínio é questionável.
Os efeitos adversos do alumínio no fígado têm sido bem documentados (Nayan, 2002). A exposição intraperitoneal a hidróxido de alumínio induz o desenvolvimento de granulomas de reabsorção no fígado mas, apesar do elevado acúmulo de alumínio, a função hepática raramente é afetada devido à excreção biliar (Nayan, 2002).
A acumulação de alumínio no coração também ocorre e tem sido sugerido que a hipertrofia cardíaca observada em pacientes de hemodiálise pode ser causada, em parte, por alumínio (Birchall, 1991).
10
1.5. O uso de materiais à base de alumínio na confeção de alimentos
É prática comum utilizar utensílios de alumínio na cozinha, armazenar alimentos em folha de alumínio ou confecionar alimentos em papelotes deste mesmo metal. A suspeita de que este material poderá contaminar os alimentos está na origem de vários estudos que são reportados na literatura.
Rajwanshi e seus colaboradores (1999) realizaram um ensaio experimental que consistia em avaliar a influência do ião fluoreto (F-) na transferência de alumínio de placas de alumínio,
sob a influência de ácido acético, ácido cítrico, ácido oxálico, ácido tartárico e bicarbonato de sódio, a diferentes valores de pH. Os resultados obtidos indicam claramente que o grau de lixiviação (dissolução oxidativa) do metal aumenta com o aumento da concentração do ião fluoreto e com o abaixamento do valor de pH. A lixiviação de alumínio mostrou ser máxima a um pH=2 contendo uma concentração 10 mg.Kg-1 de F-, atingindo um máximo de
concentração de alumínio transferido de 138 mg.Kg-1 no caso do ácido oxálico, e variando
entre 25 e 30 mg.Kg-1 nos restantes ácidos. Para valores de pH superiores a 2, verificaram
que para a mesma concentração de F-, há um decréscimo significativo da transferência de
alumínio, em todos os ácidos. Na ausência do ião fluoreto existe lixiviação do alumínio sob a ação de todos os ácidos, contudo os valores são significativamente mais baixos do que na presença deste ião, podendo ser explicado pelo facto do ião fluoreto formar complexos relativamente fortes com o alumínio na forma de ião trivalente Al3+. Contudo, quando se testa
a lixiviação do alumínio apenas na presença do ião fluoreto e água destilada, a concentração transferida é muito baixa, o que leva a crer que os iões de fluoreto por si só não são capazes de quebrar a camada protetora de óxido de alumínio presente na superfície do metal, contrariamente ao que acontece com a presença de ácidos. Segundo o autor, a lixiviação do metal na presença dos ácidos carboxílicos e do ião fluoreto envolve dois processos: i) a dissolução da camada protetora de Al2O3 sob ação dos ácidos e ii) a complexação do Al3+ com
o ião F-.
O efeito da presença de ácidos carboxílicos, tais como ácido láctico, ácido oxálico e ácido cítrico) e respetivos sais (sais de lítio, sódio e potássio) também foi investigada por Karbouj (2007). Os resultados sugerem que a transferência de alumínio é maior com o ião citrato de que com os iões oxalato e lactato.
Os resultados indicam que a lixiviação do alumínio é dramaticamente superior a 100 0C do
que quando ocorre à temperatura ambiente indicando que a influência de catiões depende tanto do agente quelante e como da temperatura. Usando ácido láctico ou oxálico a 100 0C, a
11 os sais correspondentes, ao passo que os três sais, lítio, sódio e potássio, apresentam resultados semelhantes. Pelo contrário, com citrato, com sais de potássio, a transferência de alumínio é significativamente mais elevada a 100 0C do que com citrato de lítio, sódio ou ácido
cítrico (Karbouj, 2007).
Para avaliar a transferência de alumínio de placas de alumínio puro para alimentos, Veríssimo e seus colaboradores (2006) utilizaram couve roxa cozinhada em água com diferentes ingredientes adicionados: dois tipos de vinagre (vinho e vinagre de cidra) e sumo de limão, com ácido nítrico e dióxido de enxofre – e molho de tomate cozinhado com e sem açúcar. No caso da couve roxa, a concentração de alumínio variou entre 4,1 mg Al/100 g de alimento quando adicionado ácido nítrico e dióxido de enxofre e 5,1 mg Al/100 g de alimento quando adicionado sumo de limão. No ensaio com o molho de tomate, os investigadores concluíram que, quando cozinhado com açúcar, a transferência do alumínio é mais baixa 2,5 mg Al/100g de alimento face aos 4,5 mg Al/100g alimento no caso de molho de tomate cozinhado sem açúcar (Veríssimo et al., 2006).
Quando se utiliza alumínio puro para estudar a dissolução do alumínio podem surgir resultados muito díspares dos obtidos com utensílios de culinária, que usualmente são constituídos por ligas de alumínio. Assim diversos autores direcionam especificamente o seu estudo para a dissolução do alumínio a partir dos utensílios, como panelas, folha e latas de alumínio.
A transferência do alumínio de latas contendo diferentes molhos é investigada por Joshi (2003). Para o efeito utiliza o molho de frango dijon, molho de galinha fajita e de vitela marsala. Os investigadores concluíram que em todos os três tipos diferentes de amostras de molho, quando armazenados à temperatura ambiente, há um pequeno aumento da concentração de alumínio. Por exemplo, no caso do molho de frango de dijon, a concentração passou de 0,029 mg.Kg-1 de alumínio no dia 0 para 0,031 mg.Kg-1 no dia 45 (Joshi et al., 2003). As amostras
armazenadas a 50 0C apresentaram teores de alumínio apenas ligeiramente mais elevados
do que os que estão armazenados à temperatura ambiente (a concentração de alumínio do molho de frango de dijon aumentou de 0,029 mg.Kg-1 para 0,034 mg.Kg-1).
A contribuição do cozimento de alimentos em panelas de alumínio na dissolução e transferência desse elemento para a dieta humana tem sido avaliada por vários autores. Vários são os fatores que podem influenciar no aumento da dissolução do elemento da panela para o alimento, como o pH do alimento, o tempo de uso do utensílio, o tempo de cozimento, a presença de sal ou açúcar, etc. Embora alguns dados se diferenciem, em geral, a migração de alumínio é importante em alimentos ácidos e em casos de tempo de cozimento muito prolongado.
12 Liukkonen-Lilja e Piepponen (1992) concluíram no seu estudo experimental que os níveis de lixiviação de alumínio de panelas de alumínio para os alimentos são baixos. Ao ferverem leite em panelas de alumínio, resultou na lixiviação de alumínio de 0,2 ± 0,8 µg.mL-1. Este
valor é significativamente mais baixo que o encontrado quando ferveu água da torneira em panelas de alumínio, tendo o teor de alumínio aumentado de 0,54 ± 4,3 µg.mL-1 para 6,3 ±
17,0 µg.mL-1 (Rajwanshi et al., 1997).
Um estudo realizado por Fimreite (1997) e seus colaboradores teve por objetivo documentar níveis de alumínio em alimentos ácidos (sumo de groselha preta e ruibarbo estufado) e chá preparados em panelas de alumínio. O sumo de groselha preta foi preparado por dois procedimentos diferentes, com e sem açúcar. O chá foi preparado em dois recipientes diferentes, um feito de alumínio e o outro de aço-inox. O ruibarbo foi cozido em quatro recipientes diferentes, três de alumínio, e um de aço-inox. A transferência de alumínio no sumo de groselha preta aumentou de forma linear com o tempo de cozimento. Quando adicionado açúcar à mistura, a concentração de alumínio passou de 50 mg Al/L para 23 mg Al/L. A diminuição da concentração de alumínio foi atribuído ao facto de o açúcar poder ter formado uma espécie de filme que reduz o contato entre os ácidos no sumo e superfície de alumínio.
As concentrações de alumínio no ruibarbo cozido preparado nas panelas alumínio atingiram os 15-23 mg AL/Kg de alimento após 12 minutos de cozimento e foram aproximadamente proporcionais ao tempo de cozimento. Os níveis de alumínio nos alimentos preparados no recipiente de aço-inox foram, em média, de 0,8 mg Al/Kg de alimento e não aumentaram com o tempo de cozedura, indicando, assim, que o alumínio transferido tem apenas origem no próprio alimento (Fimreite et al., 1997). As concentrações de alumínio na infusão de chá preparada no recipiente de alumínio e de aço inox aumentaram com o tempo e atingiram concentrações entre 4 e 5 mg de Al/L após 10 minutos. Surpreendentemente, os níveis não dependeram do tipo de panela utilizada, (alumínio e aço inoxidável) levando à conclusão que a concentração de alumínio seria residual, não tendo havido qualquer transferência de alumínio a partir do recipiente (Fimreite et al., 1997).
O efeito da natureza do recipiente utilizado no cozimento dos alimentos também foi alvo de investigação por outros autores. Dantas e colaboradores (2007) compararam o teor de alumínio em sete produtos alimentícios (arroz, feijão, batata cozida, carne, macarrão e molho de tomate) cozinhados em dois tipos de panelas, de alumínio não fundido, sem revestimento interno e outra de alumínio não fundido, com revestimento antiaderente. Este estudo permitiu verificar que ocorre dissolução de alumínio durante a preparação de alimentos em panelas de alumínio sem revestimento. Os valores encontrados variaram de 0,144 mg.kg-1 para a batata
13 a 17,83 mg.kg-1 para o molho de tomate (maior dissolução nos produtos ácidos). (Dantas et
al., 2007).
Al Juhaiman (2010) também avaliou a transferência de alumínio de quatro tipos de panelas de alumínio, mas utilizando extratos de carne (peixe, frango e cordeiro) e leite (fresco e leite de longa vida). Há diferenças de lixiviação de Al (varia entre 8,16 e 12,75 mg Al/h), dependendo da composição da liga de alumínio presente nas diferentes panelas, o que reflete o efeito que os elementos de liga têm sobre a lixiviação do alumínio. Contudo estes autores não referem a composição das ligas de alumínio utlizadas, apenas o país originário das panelas de alumínio. Relativamente ao efeito da natureza do alimento os autores concluem que a contaminação com alumínio segue a seguinte ordem: peixe > cordeiro > leite fresco > leite de longa vida > frango. Isto mostra que a composição da comida determina a quantidade de alumínio que é transferido, indo de encontro ao demonstrado por outros trabalhos de investigação.
Os mesmos autores (Al Juhaiman, 2012) investigaram ainda a lixiviação de alumínio de quatro diferentes panelas de alumínio (originários de quatro países diferentes: China, Índia, Arábia Saudita e Síria) em soluções aquosas contendo seis diferentes extratos vegetais (cenoura, cebola, feijão verde, batata, tomate e courgette). Verificaram que a quantidade de alumínio lixiviado aumenta geralmente com o aumento da concentração extrato vegetal. Para cada extrato vegetal observaram uma diferença nas velocidades de corrosão, dependendo do tipo de ligas de alumínio. A ordem relativa do teor de alumínio lixiviado nos extratos vegetais foi: tomate> courgette> cebola> feijão-verde> cenoura> batata. Investigaram ainda o efeito da adição de cloreto de sódio nos extratos vegetais e constataram que a adição de sal de mesa aumentou indiscriminadamente a quantidade de alumínio em todas as soluções lixiviadas. Este comportamento foi atribuído ao papel dos iões de cloreto na dissolução da camada de óxido de alumínio existente na superfície do metal.
Outros autores investigaram o processo de corrosão de panelas de alumínio sob diferentes condições (pH, composição e concentração de alimentos) em carne de bovino picada, molho de tomate, ácido cítrico e sal (Mohammad et al., 2011). A experiência consistiu em cozinhar todos os alimentos misturados alterando a água de cozedura e a concentração de ácido cítrico em dois tipos de panelas diferentes (um proveniente da India outro do Egito, não distinguindo qual a composição da liga de alumínio). Os resultados demonstraram que há uma correlação entre a concentração de ácido e a taxa de corrosão de alumínio, no sentido em que, quando a concentração de ácido é mais baixa a taxa de corrosão é também mais baixa (por exemplo, na amostra indiana com 0,1 mol.L-1 de ácido cítrico, a concentração de alumínio é de 121
mg/pessoa enquanto que na amostra com 0,2 mol.L-1 de ácido cítrico a concentração de
14 Hoje em dia, é prática comum embrulhar carne, peixe ou vegetais em folha de alumínio quando se cozinham estes alimentos no forno. Devido à possível relação entre a absorção de alumínio e as doenças específicas mencionadas no subcapítulo 1.4. , a determinação da concentração de alumínio na comida embrulhada com folha de alumínio foi estudada por diversos autores.
Numa investigação realizada por Ranau e seus colaboradores (Ranau et al., 2001), determinaram-se os teores de alumínio nos filetes de peixe (cavala, perca, bacalhau e escamudo) grelhados e assados com e sem outros ingredientes (cebola e especiarias) envolvidos em folha de alumínio. Os filetes embrulhados foram cozinhados durante cerca de 20 minutos a 200 0C num forno convencional, sem ingredientes adicionais. A concentração de
alumínio, tanto nos filetes grelhados como os cozinhados no forno convencional, aumentou durante o aquecimento (por exemplo, nos filetes de escamudo assados sem ingredientes a concentração de alumínio passou de 0,10 mg.Kg-1 para 0,21 mg.Kg-1). Os teores de alumínio
nos filetes grelhados foram maiores do que os nos filetes cozinhados no forno o que é explicado pela maior temperatura de cozimento. Os resultados mostraram claramente que algum alumínio migra da folha de alumínio para o alimento dependendo de vários fatores, como por exemplo o tempo e a temperatura de aquecimento e o pH.
15
1.6. Folha de Alumínio
A folha de alumínio é um dos produtos mais utilizados a nível mundial, com especial destaque na área alimentar nomeadamente no fabrico de panelas, tabuleiros e embalagens. A folha de alumínio com uma fina espessura (tradicionalmente conhecida como folha de prata) é também muito utilizada na confeção de alimentos, especialmente peixes e legumes.
Tradicionalmente a folha de alumínio é obtida por processos metalúrgicos e a produção inicia-se com a matéria-prima bauxita, que contem óxido de alumínio hidratado (Al2O3.nH2O)
e diversas impurezas. Este composto dissolve-se em hidróxido de sódio, formando aluminato de sódio, que, por ser solúvel, passa através de filtros, deixando as impurezas insolúveis para trás. Depois de obtida a alumina pura, esta é fundida a cerca de 1000 0C juntamente com
criolita para baixar o seu ponto de fusão. A mistura fundida é depois colocada numa célula eletrolítica onde ocorre a redução catódica dos iões de alumínio. O alumínio é então obtido na forma líquida, uma vez que o seu ponto de fusão é 660 0C. Este processo é também
designado Processo de Hall-Héroult (Figura 2).
O alumínio líquido é posteriormente vazado em lingotes, seguindo posteriormente para a laminagem, ou misturado com outros elementos metálicos ou metaloides para a produção de ligas muito diversificadas: Al-Si, Al-Cu, Al-Zn-Mg, entre outras.
Figura 2 - Processo de Hall-Héroult. Adaptado de Associação Brasileira do Alumínio
16
1.6.1.
Classificação e composição das ligas de alumínio
O principal objetivo das ligas de alumínio é melhorar algumas das propriedades físico-químicas do alumínio (resistência mecânica, resistência à corrosão, fluidez no preenchimento de moldes, etc.), de forma a obter características tecnológicas que se ajustem a uma dada aplicação.
Não é fácil agrupar e classificar a grande variedade de ligas de alumínio. Assim, a partir dos anos 70, a Associação de Alumínio dos Estados Unidos da América desenvolveu um sistema de classificação das ligas de alumínio - International Alloy Designation System, atualmente utilizado a nível mundial. A designação é representada por 4 dígitos, dependendo dos elementos da liga e/ou a pureza da mesma.
Série Elemento da Liga Aplicações
1xxx Al Comercialmente puro Equipamentos para as indústrias alimentícias, químicas, bebidas e utensílios domésticos
2xxx Cobre Peças ou equipamentos de alta condutibilidade elétrica
3xxx Manganês Indústria aeronáutica, transportes, máquinas e equipamentos
4xxx Silício Metal de adição para soldas
5xxx Magnésio Carroçarias de veículos, elementos estruturais, indústria química e alimentar, construção civil
6xxx Magnésio e Silício Carroçarias de veículos, elementos estruturais, indústria química e alimentar, construção civil
7xxx Zinco Indústria aeronáutica, moldes e estruturas
8xxx Outros Elementos (Ferro,
Lítio) Variadas
Tabela 1 – Ligas de alumínio – composição e diferentes aplicações. Adaptado de Aluminium
17 A Tabela 1 identifica os tipos de ligas de alumínio usualmente utilizados para trabalhos mecânicos (Smith, 1998). Segundo o sistema de classificação da Aluminum Association, a série 1XXX identifica o alumínio comercialmente puro em diferentes graus de pureza, desde 99,00 % (denominado 1000) até 99,99 % (denominado 1099). Nesse sistema, os dois últimos algarismos referem-se ao grau de pureza da liga, ou seja, até à casa centesimal acima de 99,00 %. Assim sendo, o alumínio comercialmente puro com 99,50 % de alumínio é conhecido como 1050, já o alumínio com 99,70 % de pureza é denominado 1070 e assim por diante (ABAL, 2007).
1.7. Corrosão do Alumínio
O alumínio é um metal termodinamicamente reativo e com elevada afinidade para o oxigénio, contudo oferece uma grande resistência à corrosão (Aluminium Federation, 2005a; Cobden, 1994; Vereecken, 1994). Esta resistência, designada por passivação, é devida à proteção dada pela película de óxido de alumínio que se forma sobre a superfície do metal, que atua como barreira às trocas iónicas metal/solução necessárias para o desenvolvimento da corrosão (Feng et al., 2013; Casimiro, 2010). Embora esta película de óxido seja extremamente fina, entre 50 e 100 Angströms, forma uma barreira de proteção entre o metal e o meio circundante. A estabilidade físico-química da película de óxido determina a resistência à corrosão do alumínio. No diagrama de Pourbaix do alumínio (Figura 3) verifica-se que esta estabilidade é dependente do valor do pH do meio ambiente, uma vez que a pelicula de óxido é estável dentro do intervalo de pH 4 a 8. Abaixo do pH 4, ocorre dissolução ácida com produção de iões Al3+ e acima de pH 8 ocorre a dissolução alcalina provocando a
18
1.7.1.
Tipos de Corrosão
Embora o óxido de alumínio seja geralmente resistente à corrosão, a pequena espessura e fragilidade da camada protetora comprometem a passivação, em especial, por se poder fragmentar e dar origem a fenómenos de corrosão nesses locais. Importa conhecer as diferentes formas de corrosão do alumínio para poder saber como controlá-la. As principais formas de corrosão das ligas de alumínio, com interesse no presente trabalho, são:
a. Corrosão uniforme
Este tipo de corrosão caracteriza-se pela perda uniforme de massa e consequente diminuição da secção transversal do metal em toda a superfície do metal, ocorrendo em todos os locais a velocidades semelhantes (Casimiro, 2010; Loureiro, 2001). Ocorre em meios mais corrosivos (meios associados a regiões de corrosão dos diagramas de Pourbaix – Figura 3), usualmente, pH muito baixo, ou muito altos em que a camada de óxido é instável.
Figura 3 – Diagrama de Pourbaix do Alumínio a 25 0C. Adaptado de
19
b. Corrosão por picadas (pitting)
A corrosão por picadas ou pitting é uma forma de corrosão localizada que ocorre, geralmente por ação local de halogenetos, produzindo cavidades na superfície do metal, podendo estas tornarem-se preenchidas com produtos de corrosão (Aluminium Federation, 2005b; Szklarska-Smialowska,1999; Vereecken, 1994).
Este tipo de corrosão corre quando um metal protegido por película é quase, mas não completamente, resistente à corrosão, como no caso de alumínio e suas ligas.
A picada geralmente ocorre em metais que são cobertos com uma película muito fina, que pode formar-se durante os processos industriais ou ser produzido por reação com o meio ambiente (Aluminium Federation, 2005b). O processo pode ser dividido em duas fases: a inicial e a de propagação. Na primeira fase, a corrosão é iniciada por aniões, tais como cloreto, que penetram no óxido. As cavidades estão localizadas em ruturas locais do filme passivo ou onde o filme está enfraquecido devido a defeitos cristalinos (Gustafsson, 2011).
Na fase de propagação (Figura 4), o alumínio oxida-se na parte inferior das cavidades e o oxigénio ou a água reduz-se na parte exterior, à superfície do metal. Como em qualquer reação de redução, há consumo de iões H+, o pH do lado de fora da cavidade aumentará
resultando num pH alcalino. Na presença de iões cloreto, o ião alumínio (Al3+) irá formar uma
película de cloreto de alumínio ou oxicloreto de alumínio no interior da cavidade e estabilizá-la. Depois de algum tempo, o cloreto de alumínio irá hidrolisar-se levando a uma diminuição do valor de pH, isto é, a um ambiente mais acídico, o que aumenta a velocidade de corrosão no interior da cavidade (Gustafsson, 2011).
Figura 4 – Mecanismo de corrosão por pitting. Adaptado de Gustafsson,
20
c. Corrosão em fendas (crevice)
Também designada por corrosão em fendas, este tipo de corrosão é semelhante à corrosão por picadas, com a diferença que neste tipo de corrosão a picada já existe (geralmente uma fenda). Este tipo de corrosão ocorre quando algum componente metálico próximo desenvolve um processo de corrosão, por exemplo, corrosão uniforme ou por ação de partículas em suspensão que podem precipitar, contribuindo para a formação de uma solução estagnada sob si (Casimiro, 2010).
d. Corrosão intergranular
Este tipo de corrosão ocorre quando a corrosão ocorre nas zonas de fronteiras de grão (Figura 5), locais estes mais reativos que a matriz do metal, relacionando-se com fatores inerentes ao metal, tais como, impurezas na junta do grão e enriquecimento num ou mais elementos da liga nessas áreas (Casimiro, 2010).
O mecanismo é eletroquímico e é dependente da formação de células locais, resultantes de precipitados intermetálicos, nas juntas de grão. Durante a formação dos precipitados intermetálicos ao longo das juntas de grão, é formada uma zona de matriz adjacente que possui um potencial de solução diferente. O grau de suscetibilidade de uma liga ao ataque intergranular pode variar dependendo da sua microestrutura, em particular, a quantidade, tamanho e distribuição das fases, sendo resultado do processo metalúrgico e tratamento térmico. Os tratamentos térmicos que causam precipitação ao longo do grão tendem a diminuir o ataque intergranular (Aluminium Federation, 2005b).
Figura 5 – Corrosão intergranular(http:// http://www.laboratorios-tork.com.br/fotosme.asp)
21
e. Corrosão por esfoliação
A corrosão por lixiviação seletiva ocorre maioritariamente em ligas de metais nas quais a corrosão incide preferencialmente num dos elementos da liga, mais concretamente no metal mais anódico (Svenningsen,1994).
22
1.8. Motivação/Objetivos do trabalho
Com o aumento da expectativa de vida da população, aliado à evolução crescente do número de doentes com doenças degenerativas potencialmente fatais, torna-se cada vez mais importante avaliar as consequências de determinados estilos de vida e, em particular, de certos hábitos alimentares, na possível ingestão de elementos potencialmente nocivos.
Neste contexto, o alumínio presente nos alimentos e especialmente o alumínio transferido dos utensílios de cozinha torna-se o tema de estudo neste trabalho pela função que pode desempenhar a nível fisiológico, em especial na saúde humana.
Hoje em dia, é uma prática comum embrulhar alimentos em folha de alumínio antes de os cozinhar no forno. Devido à possível relação entre a absorção de alumínio e as doenças neurodegenerativas, importa pois avaliar o grau de contaminação dos alimentos confecionados em folha de alumínio.
Numa primeira fase do trabalho, pretendeu-se investigar o efeito de diferentes ácidos carboxílicos na dissolução oxidativa do papel de alumínio, utilizando para o efeito soluções modelo de ácidos carboxílicos usualmente existentes nos alimentos confecionados em papelotes de alumínio.
Numa segunda fase do trabalho, investigou-se a contaminação por alumínio em alimentos reais (truta e legumes) confecionados em papelotes de alumínio num forno convencional. Em ambas as situações, a dissolução do alumínio é analisada tanto na solução de lixiviação, como na própria folha, caracterizando-se a sua superfície por técnicas de DRX, SEM e EDS.
24
2.1. Alimentos confecionados em papelotes
2.1.1.
Preparação das amostras alimentares
2.1.1.1.
Truta
Neste trabalho experimental foram utilizadas 10 trutas arco-íris de viveiro (Oncorhynchus mykiss) obtidas num supermercado local, as quais foram evisceradas e descamadas.
As trutas foram divididas em dois grupos experimentais, 4 para o grupo controlo e 6 para o grupo teste. Todos os indivíduos foram devidamente pesados, antes de serem confecionados, aos quais foi adicionado posteriormente 22 g de sumo de limão a cada um.
As trutas do grupo controlo foram assadas individualmente num forno convencional à temperatura de 180 0C, durante 28 minutos, utilizando um recipiente de vidro borossilicatado
(Pyrex®).
As trutas do grupo teste foram embrulhadas individualmente em folha de alumínio (quadrado de 30x30 cm2), ao qual se adicionaram 22 g de sumo de limão, a cada um, e
assadas nas mesmas condições do grupo controlo.
Depois de assadas foram recolhidas amostras, sendo divididas em vários grupos: molho, filetes de peixe e pele. As amostras de filete de peixe e de pele foram ainda subdivididas em 2 grupos, face inferior e face superior, sendo a primeira atribuída à parte que ficou em contacto direto com o molho e a folha de alumínio. As amostras foram devidamente identificadas e guardadas num frigorífico a 4 0C para posterior análise.
2.1.1.2.
Legumes
Os legumes utilizados neste trabalho experimental foram comprados num supermercado local sendo devidamente lavados antes de qualquer procedimento.
Os legumes selecionados foram os seguintes: pimento verde, batata, cebola, tomate e cenoura.
Os legumes foram divididos em dois grupos experimentais, o grupo controlo e grupo teste, tendo cada réplica a mesma quantidade de legumes (3 réplicas em cada grupo experimental).
Os legumes do grupo controlo foram assados individualmente num forno convencional à temperatura de 180 0C, durante 50 minutos, utilizando um recipiente de vidro borossilicatado
25
Os legumes do grupo teste foram embrulhadas individualmente em folha de alumínio (quadrado de 30x30 cm2) e assados nas mesmas condições do grupo controlo.Depois de assados foram recolhidas amostras e devidamente congeladas, para futura digestão e análise.
2.1.2.
Digestão das amostras
Procedeu-se à digestão das amostras com ácido nítrico 65% PA (HNO3) e peróxido de
hidrogénio 30% PA (H2O2) numa proporção de 2:1. No caso do peixe, foi digerido 5 g de cada
uma das amostras com exceção do molho que se utilizou toda a amostra recolhida. Relativamente aos legumes foram também digeridos 5 g de cada uma das amostras. Em ambos os casos realizaram-se 5 réplicas.
Iniciou-se a digestão num termoreator à temperatura de 60º C durante 72 horas. A cada 24 horas aumentou-se a temperatura 20 0C, atingindo um máximo de 150º C. As amostras
permanecem a esta temperatura até ocorrer a total digestão do material orgânico. No final levou-se à total evaporação do ácido nítrico e do peróxido de hidrogénio.
26
2.2. Simulação da confeção de alimentos em papelotes com soluções modelo
de ácidos carboxílicos
2.2.1.
Preparação de soluções modelo
Tomando como base de partida uma receita modelo de confeção de truta (Anexo 3) e outra de legumes (Anexo 4) em papelotes, prepararam-se soluções individuais de quatro ácidos carboxílicos com uma concentração semelhante à existente no conjunto de ingredientes de cada receita, a fim de simular o efeito de ácidos carboxílicos no processo de dissolução oxidativa do alumínio nos papelotes (soluções 1 a 4 da Tabela 2) Preparou-se igualmente uma solução contendo uma mistura dos quatro ácidos carboxílicos (solução 5 da Tabela 2). Em ambas as receitas modelo, a concentração de ácido cítrico e ácido glutâmico são muito idênticas, portanto estabeleceram-se a mesma concentração destes ácidos carboxílicos para simular as duas soluções modelo.
A Tabela 2 resume a composição das soluções modelo utilizadas.
Na simulação do processo de confeção com papelotes, colocou-se 100 mL da solução-modelo num balão de destilação, na qual se introduziu pequenos quadrados de folha de alumínio (5x5 cm2). Esta quantidade de folha de alumínio foi determinada, tendo por base a
folha utilizada na confeção dos alimentos em papelotes. O balão foi mantido em refluxo à
Concentração (mmol.L-1) Solução modelo Ácido Citrico Ácido Málico Ácido Ascórbico Ácido Glutâmico 1 23,7 --- --- --- 2 --- 3,88 --- --- 3 --- --- 1,14 --- 4 --- --- --- 6,07 5 23,7 3,88 1,14 6,07
Tabela 2 – Composição das soluções modelo de ácidos carboxílicos na confeção de peixe e legumes em papelotes
27
temperatura de ebulição durante 1 a 4 horas. Foram também efetuadas soluções controlo (soluções aquosas dos diferentes ácidos carboxílicos sem folha de alumínio) a fim de podermos avaliar o teor de alumínio em solução proveniente do vidro.2.3. Quantificação do alumínio nas amostras alimentares e soluções
modelo
2.3.1.
Método de espectrofotometria de absorção atómica com chama
Na determinação da concentração do alumínio utilizou-se a técnica de absorção atómica com chama. A espectrofotometria de absorção atómica é um método de análise quantitativa com base na medição da absorção de radiação UV-Vis por átomos livres. O espectro de absorção de átomos é um espectro de linhas conferindo uma elevada seletividade ao método de análise. Assim sendo, a probabilidade de outros elementos absorverem ao mesmo comprimento de onda é muito baixa, pelo que vários elementos podem ser analisados sem ser necessária uma prévia a separação. Este procedimento tem a grande vantagem em relação aos métodos de espectroscopia de absorção moleculares, em que geralmente, a análise dos sistemas complexos só é possível após a aplicação de técnicas de separação. A relação entre a absorção da radiação ao comprimento de onda característico do metal a ser quantificado e a concentração do analito na amostra é descrita pela lei de Lambert-Beer. A concentração é determinada a partir de uma curva de calibração em que se utilizam padrões de concentração conhecida. Os parâmetros operacionais utilizados estão descritos no Anexo 1.
Usualmente, na espectrofotometria de absorção atómica por chama utiliza-se uma chama de ar/acetileno, contudo nos ensaios realizados utilizou-se uma chama acetileno/protóxido de azoto de forma a evitar a formação de óxidos refratários de alumínio na chama.
2.3.1.1.
Método de espectrofotometria de absorção atómica em forno de
grafite
Na determinação da concentração do alumínio utilizou-se também a técnica de espectrofotometria de absorção atómica em forno de grafite. Esta técnica foi aplicada no caso das soluções conterem um teor de alumínio não passível de ser quantificado por espectrofotometria de absorção atómica por chama (na ordem dos ppb).