UNIVERSIDADE FEDERAL DE OURO PRETO NÚCLEO DE PESQUISAS EM CIÊNCIAS BIOLÓGICAS PROGRAMA DE PÓS-GRADUAÇÃO EM BIOTECNOLOGIA
CARACTERIZAÇÃO DE LEVEDURAS TERMOTOLERANTES
PARA PRODUÇÃO DE ETANOL CELULÓSICO
DANIELA ARRUDA COSTA
OURO PRETO MINAS GERAIS – BRASIL
DANIELA ARRUDA COSTA
CARACTERIZAÇÃO DE LEVEDURAS TERMOTOLERANTES
PARA PRODUÇÃO DE ETANOL CELULÓSICO
Dissertação apresentada à Universidade Federal de Ouro Preto, como parte das exigências do Programa de Pós-Graduação em Biotecnologia, para obtenção do título de Magister Scientiae.
OURO PRETO MINAS GERAIS – BRASIL
Catalogação: sisbin@sisbin.ufop.br
C837c Costa, Daniela Arruda.
Caracterização de leveduras termotolerantes para produção de etanol celulósico [manuscrito] / Daniela Arruda Costa. - 2011.
xiii, 61f.: il., color; graf.; tabs.
Orientador: Prof. Dr. Luciano Gomes Fietto.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Núcleo de Pesquisas em Ciências Biológicas. Programa de Pós-Graduação em Biotecnologia. Área de concentração: Biotecnologia Aplicada a Processos e
ao Tratamento de Doenças.
1. Fermentação - Teses. 2. Leveduras - Teses. 3. Álcool como combustível - Teses. 4. Biocombustíveis - Teses. I. Fietto, Luciano Gomes. II. Universidade Federal de Ouro Preto. III. Título.
Aos meus pais Elza e Simeão. Aos meus irmãos, Dri, Fred e Rafa.
DEDICO.
“Sonho que se sonha só, é apenas um sonho que se sonha só, mas sonho que se sonha junto é realidade.”
AGRADECIMENTOS
À Deus por guiar meus passos nesta caminhada e me iluminar nos momentos difíceis.
À Universidade Federal de Ouro Preto e ao Programa de Pós-Graduação em Biotecnologia pela oportunidade e pelo apoio acadêmico e institucional.
À Universidade Federal de Viçosa e ao Departamento de Bioquímica e Biologia Molecular pela acolhida e suporte.
À Capes pela bolsa concedida.
Ao CNPq e FAPEMIG pelo fomento à pesquisa.
Aos meus pais Elza e Simeão, pelo amor, dedicação e por não medirem esforços para que eu pudesse seguir sempre em frente.
Aos meus irmãos Adriana, Frederico e Rafael, pelo incentivo, amor e alegria de viver.
Ao Professor Dr. Luciano Gomes Fietto pela orientação, apoio e amizade. Às professoras Dra. Andréa Barros Ribon e Dra. Juliana Lopes Rangel Fietto, pela amizade e conselhos para o aprimoramento desde trabalho.
Aos amigos Carlos e Zamira por terem acompanhado todo o trabalho, fazendo valiosas críticas e sugestões.
À Patrícia e Fernanda, pelo auxílio nos experimentos.
Aos amigos e colegas do Laboratório de Biotecnologia Molecular, por tornar a estadia em Viçosa mais agradável: Adíverson, Ananda, Ancély, Aline, Carlos, Daiane, Danielle, Felipe, Fernanda, Glauco, Héllida, Mary, Mariana, Marina, Mário, Patrícia, Priscilla, Raphael, Silvana, Zaira e Zamira.
Aos amigos Matheus e Ramon pelo grande incentivo, apoio nos momentos difíceis e pelos maravilhosos momentos de descontração.
Aos queridos amigos do Mestrado em Biotecnologia: Bruna, Bruno, Cris, David, Franciny, Iara, Luciana, Rodrigo, Val e Zamira, além da Doutoranda Pauline, pelos maravilhosos momentos que passamos juntos.
À grande amiga Val e sua família, pelo suporte, companhia e torcida. À família Toka por estar sempre presente na minha vida.
A todos os meus amigos, pela torcida e apoio em todas as horas. À Vó Guida, pelo carinho e orações.
SUMÁRIO
LISTA DE FIGURAS, TABELAS E QUADROS ... vii
RESUMO ... ix
ABSTRACT ... xi
1. INTRODUÇÃO... 1
2. REVISÃO DE LITERATURA ... 3
2.1 Biocombustíveis ... 3
2.2 Etanol celulósico ... 3
2.2.1 Biomassa lignocelulósica ... 4
2.3 Processo de obtenção de etanol de segunda geração ... 7
2.3.1 Pré-tratamento ... 7
2.3.2 Hidrólise ... 8
2.3.3 Fermentação da biomassa hidrolisada ... 9
2.3.3.1 Hidrólise e fermentação em separado (SHF) ... 10
2.3.3.2 Sacarificação e fermentação simultâneas (SSF) ... 10
2.4 Micro-organismo fermentador ... 11
2.4.1 Fermentação de pentoses e hexoses ... 12
2.4.2 Tolerância a inibidores ... 13
2.4.3 Termotolerância ... 13
2.4.4 Tolerância a etanol ... 14
2.4.5 Levedura: Saccharomyces cerevisiae ... 15
2.4.6 Levedura: Kluyveromyces marxianus ... 16
3. OBJETIVOS ... 18
3.1 Objetivo geral ... 18
3.2 Objetivos específicos ... 18
4. MATERIAL E MÉTODOS ... 19
4.1 Linhagens e meios de cultura ... 19
4.2.1 Extração do DNA total ... 20
4.2.2 Amplificação utilizando os iniciadores NL1 e NL4 ... 20
4.2.3 Purificação dos produtos de PCR e reação de seqüenciamento... 21
4.2.4 Análise das seqüências ... 21
4.3 Fotomicrografias das leveduras ... 21
4.4 Caracterização fisiológica ... 22
4.4.1 Crescimento em placas ... 22
4.4.2 Crescimento em microplacas ... 22
4.5 Ensaios de fermentação ... 24
4.5.1 Ensaios de fermentação com glicose ... 25
4.5.2 Ensaios SSF com bagaço de cana de açúcar... 25
4.5.2.1 Pré-tratamento ácido-básico ... 25
4.5.2.2 Sacarificação e fermentação simultânea a 37°C e a 42°C ... 25
4.6 Parâmetros fermentativos ... 26
4.7 Métodos analíticos – Concentrações de Glicose e Etanol ... 26
5. RESULTADOS E DISCUSSÃO ... 28
5.1 Identificação molecular da levedura ... 28
5.2 Fotomicrografia das leveduras ... 28
5.3 Avaliação do crescimento das leveduras em meio sólido ... 29
5.4 Avaliação do crescimento das leveduras em meio líquido ... 312
5.5 Ensaios de fermentação em glicose ... 44
5.6 Ensaios de SSF com bagaço de cana de açúcar ... 48
6. REFERÊNCIAS BIBLIOGRÁFICAS ... 53
vii LISTA DE FIGURAS, TABELAS E QUADROS
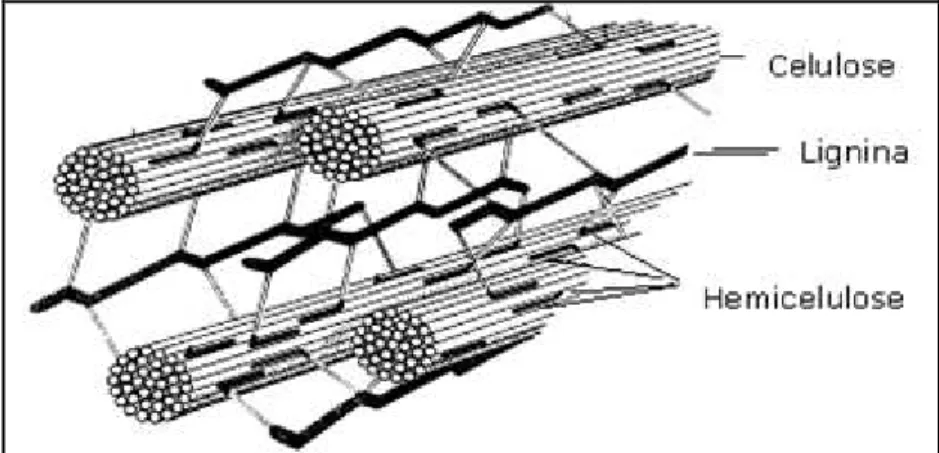
Figura 1 – Esquema estrutural simplificado das fibras do material lignocelulósico . ... 5
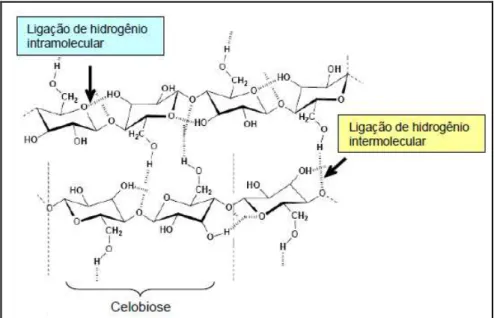
Figura 2 – Estrutura química da celulose . ... 6
Figura 3 – Componentes da fração da hemicelulose . ... 6
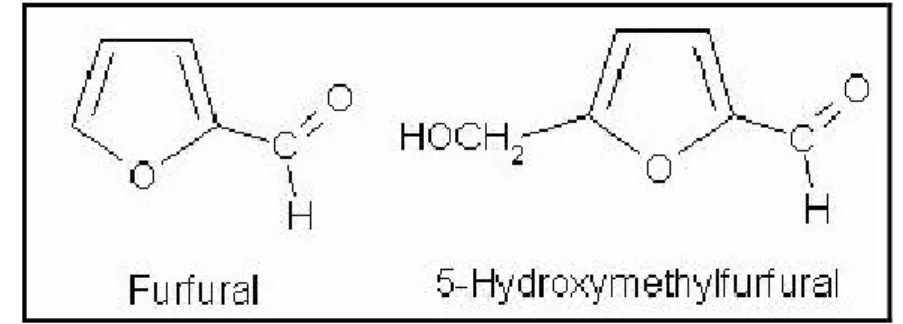
Figura 4 – Estrutura química do furfural e 5- hidroximetil-furfural ... 8
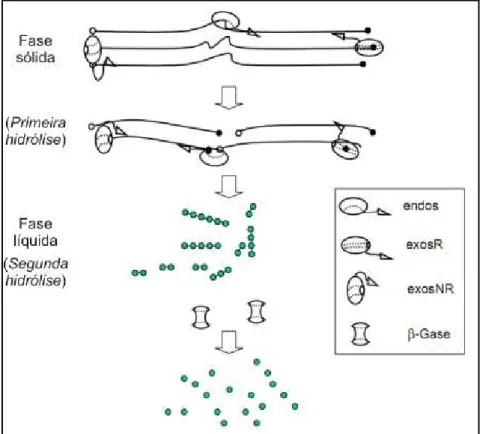
Figura 5 – Esquema mecanístico da hidrólise enzimática da celulose. ... 9
Figura 6 – Desenho experimental do crescimento em placas. ... 22
Figura 7 – Representações esquemáticas das microplacas geradas pelo programa SoftMax Pro 5.3.. ... 24
Figura 8 – Fotomicrografias utilizando o microscópio óptico Nikon Eclipse Ti-S com objetiva de 100X e abertura numérica de 1.4.. ... 29
Figura 9 - Curvas de crescimento das leveduras em função de diferentes concentrações de glicose a 37°C. ... ... 33
Figura 10 - Curvas de crescimento das leveduras em função de diferentes concentrações de glicose a 42°C. ... ... 35
Figura 11 - Curvas de crescimento das leveduras em função de diferentes concentrações de glicose a 45°C.. ... ... 36
Figura 12 - Curvas de crescimento das leveduras em função de diferentes concentrações de etanol a 30°C. ... ... 40
Figura 13 - Curvas de crescimento das leveduras em função de diferentes concentrações de etanol a 37°C. ... ... 41
Figura 14 - Curvas de crescimento das leveduras em função de diferentes concentrações de etanol a 42°C. ... ... 42
Figura 15 - Curvas de crescimento das leveduras em função de diferentes concentrações de etanol a 45°C. ... ... 43
Figura 16 - Fermentação a 37°C com D.O.(600) inicial correspondente a 2, em 50 mL de meio de fermentação acrescido de glicose 4% (v/v). ... 46
viii
Tabela 1 – Linhagens de leveduras utilizadas... 19 Tabela 2 - Velocidade específica de crescimento ( ) e D.O.(600) máxima em microplacas contendo meio YPD 4% em diferentes temperaturas. ... 38 Tabela 3 – Fermentação a 37°C com D.O.(600) inicial correspondente a 0,1, em 50 mL de meio de fermentação acrescido de glicose 4% (v/v). ... 44 Tabela 4 - Fermentação a 42°C com D.O.(600) inicial correspondente a 0,1, em 50 mL de meio de fermentação acrescido de glicose 4% (v/v). ... 45 Tabela 5 - Fermentação a 37°C com D.O.(600) inicial correspondente a 2, em 50 mL de meio de fermentação acrescido de glicose 4% (v/v). ... 48 Tabela 6 - Fermentação a 42°C com D.O.(600) inicial correspondente a 2, em 50 mL de meio de fermentação acrescido de glicose 4% (v/v). ... 48 Tabela 7 – SSF a 37°C com D.O.(600) inicial correspondente a 2, em 50 mL de meio de fermentação acrescido de bagaço de cana de açúcar 8% (p/v). ... 50 Tabela 8 - SSF a 42°C com D.O.(600) inicial correspondente a 2, em 50 mL de meio de fermentação acrescido de bagaço de cana de açúcar 8% (p/v). ... 50 Tabela 9 - Rendimento em etanol obtido com a utilização de linhagens termotolerantes de K. marxianus e S. cerevisiae, em relação a diferentes biomassas pré-tratada ... 52
ix RESUMO
COSTA, Daniela Arruda, M. Sc. Universidade Federal de Ouro Preto, fevereiro de 2011. Caracterização de leveduras termotolerantes para produção de etanol celulósico. Orientador: Luciano Gomes Fietto.
A conversão de material lignocelulósico em açúcares fermentáveis é considerada uma alternativa promissora para aumentar a produção de etanol. Neste contexto tem sido demonstrado que maiores rendimentos em etanol são obtidos por meio do acoplamento das etapas de sacarificação e fermentação, processo chamado sacarificação e fermentação simultâneas (SSF). No entanto, um dos entraves do processo é a temperatura ótima para a realização das duas etapas; uma vez que, a ação ótima das celulases ocorre em torno de 50°C, e nquanto que a maioria dos organismos fermentativos cresce entre 30° e 37°C. Com o objetivo de viabilizar o processo SSF foi isolada e identificada uma linhagem termotolerante de
x
xi ABSTRACT
COSTA, Daniela Arruda, M. Sc. Universidade Federal de Ouro Preto, February 2011.
Characterization of thermotolerant yeasts for ethanol cellulosic production. Advisor: Luciano Gomes Fietto.
The lignocellulosic material conversion, such as sugar cane bagasse, into fermentable sugars has been considered a promising alternative to increase ethanol production. In this context, it has been shown that higher ethanol yields are obtained by coupling two stages, through the simultaneous saccharification and fermentation, process called simultaneous saccharification and fermentation (SSF). However, one of the barries the process is the optimum temperature for carrying out the two steps, the optimal action of cellulases occurs around 50°C, while most of the fe rmentative organisms grows between 30° and 37°C. Aiming to enable the process SSF has increased considerably in recent years the isolation of thermotolerant yeasts, especially strains belonging to the species Saccharomyces cerevisiae and Kluyveromyces marxianus. In this context, our group has isolated and identified molecularly a thermotolerant strain of S. cerevisiae, called LBM-1. In order to select the appropriate micro-organism and the ideal conditions for the realization of the SSF process, was performed the physiological characterization of yeast strains of S. cerevisiae (LBM-1, CAT-1 and PE-2) and K. marxianus (UFV-3, ATCC 8554 and CCT 4086), as to use of carbon source, ethanol tolerance and thermotolerance by comparing the growth profile and the values of specific growth rate. Take into account the physiological characterization, fermentation tests were performed to establish the optimum amount of inoculum to be used and the micro-organism suitable for fermentation. These tests were conducted using glucose as substrate and at two different temperatures, in which the yeast had a good growth. Knowing the optimal concentration of inoculum used to be carried to the fermentation efficiency comparative analysis of the strains in SSF process using sugar cane bagasse as substrate. The sequencing of the D1/D2 region confirmed that the isolated LBM-1 is a yeast strain belonging to species S. cerevisiae. Physiological characterization showed that strains of S.cerevisiae are more tolerant to ethanol, whereas the strains of K. marxianus are more thermotolerant. Furthermore, strains of
xii
1 1. INTRODUÇÃO
As mudanças climáticas e a elevação nos custos do petróleo aliadas às necessidades estratégicas de produção de energia têm motivado uma corrida sem precedentes à produção de combustíveis alternativos, preferencialmente de fontes renováveis. A conversão de material lignocelulósico, como bagaço de cana de açúcar, em açúcares fermentáveis vem sendo considerada uma alternativa promissora para aumentar a produção de etanol (Rocha e Buckeridge, 2009). A utilização de materiais lignocelulósicos para produzir etanol envolve quatro etapas: pré-tratamento, hidrólise enzimática, fermentação e destilação (Sun e Cheng, 2002). Tem sido demonstrado que os maiores rendimentos em etanol são obtidos por meio do acoplamento de duas etapas, por meio da sacarificação e fermentação simultâneas (SSF) (Ballesteros et al., 2004; Sanchez e Cardona, 2008). No entanto, um dos entraves do processo é a temperatura ótima para a realização das duas etapas; uma vez que, a ação ótima das celulases ocorre em torno de 50°C, enquanto que a m aioria dos organismos fermentativos cresce entre 30 e 37°C (Olsson et al., 2006).
Com o objetivo de viabilizar o processo SSF tem aumentado consideravelmente nos últimos anos o isolamento de leveduras termotolerantes, especialmente de linhagens pertencentes às espécies Saccharomyces cerevisiae e Kluyveromyces marxianus (Singh et al., 1998; Abdel-Fattah et al., 2000; Sree et al., 2000; Hari Krishna
et al., 2001; Basso et al., 2008; Fonseca et al., 2008). Neste âmbito, o grupo de pesquisa do Laboratório de Biotecnologia Molecular da Universidade Federal de Viçosa isolou e identificou molecularmente uma linhagem termotolerante de S. cerevisiae, denominada LBM-1.
A fim de selecionar o micro-organismo adequado e as condições ideais para a realização do processo SSF, foi feita a caracterização fisiológica de linhagens de leveduras das espécies S. cerevisiae e K. marxianus, quanto à utilização de fonte de carbono, tolerância a etanol e termotolerância, por meio da comparação do perfil de crescimento e dos valores da velocidade específica de crescimento. A comparação foi feita utilizando três linhagens de leveduras pertencentes a cada espécie, da seguinte forma:
• Saccharomyces cerevisiae:
o LBM-1: novo isolado a partir de dorna de fermentação de cachaça
2
de Bioquímica e Biologia Molecular/ Universidade Federal de Viçosa);
o CAT-1 e PE-2: linhagens isoladas de usinas de produção de
etanol de primeira geração pela empresa Fermentec, e amplamente utilizadas por usinas do setor sucro-energético (Basso et al., 2008);
• Kluyveromyces marxianus:
o UFV-3: linhagem isolada do soro de queijo pelo Laboratório de
Fisiologia de Micro-organismos (BIOAGRO/Universidade Federal de Viçosa) (Silveira et al., 2005);
o ATCC 8554: linhagem pertencente à coleção biológica American
Type Culture Collection;
o CCT 4086: linhagem pertencente à coleção biológicaColeção de
Culturas Tropicais - André Tosello Tropical Culture.
Para confirmar o isolado LBM-1 como pertencente à espécie S. cerevisiae foi feita a caracterização molecular por meio do seqüenciamento da região D1/D2 da subunidade 26S do rDNA.
3 2. REVISÃO DE LITERATURA
2.1 Biocombustíveis
As mudanças climáticas aliada às necessidades estratégicas de produção de energia têm motivado uma corrida sem precedentes à produção de combustíveis alternativos, preferencialmente de fontes renováveis (Rocha e Buckeridge, 2009). Por meio do uso de recursos energéticos renováveis, o mundo pode encontrar parte da solução para as suas necessidades energéticas, de uma maneira ambientalmente sustentável (Hahn-Hagerdal et al., 2006).
O bioetanol é um dos mais importantes combustíveis renováveis, contribuindo para a redução dos impactos ambientais negativos gerados pela utilização mundial dos combustíveis fósseis (Cardona e Sanchez, 2007). Isso porque ele é produzido a partir de biomassa que é uma matéria renovável e não contribui para o acúmulo de dióxido de carbono na atmosfera terrestre, ou seja, o CO2 liberado durante o uso da biomassa é absorvido novamente no processo de fotossíntese para a sua formação (Hall, 1984;Ohgren et al., 2006).
O processo de produção do etanol ocorre por meio da fermentação microbiana de açúcares derivados de matérias-primas agrícolas, principalmente de amido e de sacarose. Os Estados Unidos e o Brasil detêm cerca de 70% da produção mundial de etanol por meio de amido de milho e caldo da cana de açúcar, respectivamente (Argueso et al., 2009).
O interesse mundial na utilização de bioetanol como fonte de energia tem estimulado os estudos sobre o custo e a eficiência dos processos industriais para sua produção (Siqueira et al., 2008). Neste sentido, pesquisas têm sido conduzidas para a obtenção de eficientes organismos fermentativos, baixo custo de substratos e ótimas condições ambientais para o processo(Cysewski e Wilke, 1978).
2.2 Etanol celulósico
4
Na década de 1970, o Brasil iniciou o programa Pró-Álcool a fim de substituir a gasolina pelo etanol e visando diminuir a dependência política e econômica em períodos de oferta variável. A cana de açúcar foi escolhida como matéria-prima para produzir etanol, e como conseqüência, estudos agrícolas e tecnológicos foram intensificados, levando o Brasil a uma posição muito favorável em termos de segurança energética. Atualmente, o Brasil possui mais de 80% de seus veículos rodando com bioetanol, e está desenvolvendo motores para pequenos aviões utilizarem o etanol como combustível (Soccol et al., 2010).
No entanto, deve-se notar que apenas uma parte da biomassa produzida é utilizada para a produção de bioenergia; um terço da planta é utilizado para a produção de álcool, um terço é o bagaço, que é queimado para produção de eletricidade e o terço restante é deixado no campo, que é decomposta pelos micro-organismos (Cortez et al., 2008). Portanto, um significativo aumento na produção de etanol seria possível se tecnologias fossem desenvolvidas para converter em açúcares fermentáveis os polissacarídeos das folhas, palha e bagaço, que juntos representam dois terços da biomassa (Soccol et al., 2010). Atualmente, esta tecnologia vem sendo considerada como uma alternativa promissora para aumentar a produção de etanol necessária para atender à demanda mundial (Rocha e Buckeridge, 2009).
A implantação da tecnologia de etanol do bagaço de cana no Brasil é favorecida pelo fato do processo de produção poder ser anexado às unidades já existentes de indústrias de açúcar e álcool, exigindo investimentos mais baixos, infra-estrutura, logística e fornecimento de energia. Além disso, o bagaço é gerado nas unidades industriais, e como tal, livre de custos de transporte. Este é um cenário promissor, pois a cada 10 milhões de toneladas de biomassa seca, 600 milhões de galões de etanol poderiam ser produzidos, considerando o uso somente da parte celulósica (Soccol et al., 2010).
2.2.1 Biomassa lignocelulósica
Existe uma grande variedade de matérias-primas potenciais para a produção de etanol combustível. Gramíneas, madeiras, subprodutos de colheitas e outros resíduos que contenham celulose (incluindo resíduos agrícolas, florestais e da indústria de papel), são todos exemplos de fontes de material lignocelulósico (Figura 1) (Van Maris
5
ambientais, práticas agrícolas e desenvolvimento tecnológico (Claassen et al., 1999). A biomassa consiste em um complexo emaranhado composto por três principais polímeros: celulose, hemicelulose e lignina; dependendo da matéria-prima, também possui pectina (Van Maris et al., 2006).
A celulose, principal constituinte da biomassa (33-51%), é um polímero linear composto de milhares de subunidades de D-glicose unidas por ligações glicosídicas β
-(1-4) (Ingram et al., 1999). Normalmente polímeros lineares de celulose ocorrem como cadeias paralelas com extensas ligações de hidrogênio, como mostrado na Figura 2 (Lee, 1997). A estrutura linear, conferida pela configuração das ligações glicosídicas, possibilita a formação de ligações de hidrogênio intra e intermoleculares e acarreta na agregação das cadeias celulósicas em “fibrilas elementares” com alto grau de cristalinidade. Estes agregados conferem elevada resistência à tensão, tornam a celulose insolúvel em um grande número de solventes e explicam, pelo menos em parte, a sua resistência à degradação microbiana (Ding e Himmel, 2006; Matthews et al., 2006; Canilha et al., 2010; Canilha et al., 2011).
A hemicelulose, o segundo maior constituinte da biomassa (19-34%) mostrado na Figura 3, é um heteropolissacarídeo complexo composto por hexoses (D-glucose, D-galactose, D-manose, L-ramnose, L-fucose), pentoses (D-xilose e L-arabinose) e ácidos urônicos (ácido D-glucurônico e ácido D-galactourônico) (Van Maris et al., 2006).
6 Figura 2 – Estrutura química da celulose (Morais, 2005).
Figura 3 – Componentes da fração da hemicelulose (Morais, 2005).
A lignina, que constitui 10-20% em peso da biomassa seca, é um polímero aromático contendo resíduos fenólicos, tais como álcool trans-ρ-coumaril, álcool trans-ρ-coniferil e álcool trans-ρ-sinápico. A lignina, fração da biomassa não fermentável, é
7
Do ponto de vista tecnológico, os açúcares contidos nas frações celulósicas (glicose) e hemicelulósicas (xilose, arabinose, glicose, manose e galactose) representam os substratos que podem ser utilizados para a produção de etanol por via fermentativa. Entretanto, conforme ilustrado na Figura 1, a íntima associação entre as três frações principais (celulose, hemicelulose e lignina) é tal que impõe dificuldades para a recuperação dos monômeros constituintes com elevado grau de pureza (Sun e Cheng, 2002).
2.3 Processo de obtenção de etanol de segunda geração
Os processos para obter etanol a partir de materiais lignocelulósicos baseados na hidrólise enzimática são métodos promissores para produzir biocombustíveis. Estes consistem basicamente em quatro fases: pré-tratamento, hidrólise enzimática, fermentação e destilação (Tomas-Pejo et al., 2009). O processo biológico para a conversão de lignocelulose em etanol combustível requer: deslignificação para liberar a celulose e hemicelulose a partir de seu complexo com lignina, despolimerização da celulose para produzir açúcares livres e fermentação da misturas de açúcares hexoses e pentoses para produzir etanol.
2.3.1 Pré-tratamento
O objetivo da etapa de pré-tratamento é remover a hemicelulose e a lignina, reduzir a cristalinidade da celulose e aumentar a porosidade dos materiais; sem que haja perda de carboidratos e a formação de bioprodutos que possam inibir os passos subseqüentes, em especial a fermentação (Sun e Cheng, 2005). Um pré-tratamento eficiente resulta em um aumento significativo do rendimento em açúcares fermentáveis.
8 2.3.2 Hidrólise
Durante a etapa de sacarificação, a celulose pode ser hidrolisada por tratamento ácido ou enzimático, liberando as unidades de glicose a serem assimiladas pela levedura na etapa de fermentação. A hidrólise ácida da celulose foi a primeira alternativa a ser testada e apresentou inconvenientes como a produção de compostos furfúricos (Figura 4), inibidores da fermentação e a degradação de açúcares por exposição prolongada ao meio reacional (Zhang et al., 2006). Frente aos empecilhos de utilização da hidrólise ácida, a hidrólise enzimática da celulose tem recebido a atenção dos pesquisadores.
Figura 4 – Estrutura química do furfural e 5- hidroximetil-furfural (Disponível em http://tecalim.vilabol.uol.com.br/chemitryfood.html acesso 20/01/2011)
A hidrólise enzimática da celulose é catalisada por enzimas altamente específicas que são chamadas de celulases. A hidrólise enzimática tem apresentado melhores resultados do que a hidrólise ácida, uma vez que não ocorre a formação de subprodutos da glicose, embora o processo seja mais lento. A maioria das celulases comerciais é obtida a partir de Trichoderma reesei, embora uma pequena parcela seja obtida a partir de Aspergillus niger (Zhang e Lynd, 2004).
Três classes de enzimas constituem o complexo celulolítico: 1) exo-1,4-β
-D-glucanases (EC 3.2.1.91), que hidrolisam a cadeia celulósica a partir de suas extremidades liberando celobioses, 2) endo-1,4-β-D-glucanases (EC 3.2.1.4), que
hidrolisam a cadeia celulósica internamente de maneira aleatória, e 3) 1,4-β
9
criando sítios acessíveis umas para as outras e aliviando problemas de inibição pelos produtos (Eriksson et. al., 2002; Vialjamae et. al., 2003; Canilha et al., 2010).
Figura 5 – Esquema mecanístico da hidrólise enzimática da celulose (Adaptado de Zhang et al., 2006).
Quando comparada com a hidrólise ácida, a hidrólise enzimática da celulose geralmente é conduzida em condições mais brandas (pH 4,8 e temperatura entre 45° e 50°C), não causa problemas de corrosão e permite ma iores rendimentos (75- 85%), além de possibilitar a fermentação simultânea à sacarificação (processo SSF, sacarificação e fermentação simultâneas) que será discutido posteriormente. Neste sentido, as pesquisas têm se concentrado em hidrólise enzimática como a chave para a produção de etanol de segunda geração a um custo competitivo em longo prazo (Philippidis e Smith, 1995; Lynd et al., 2002; Mosier et al., 2005; Alvira et al., 2010).
2.3.3 Fermentação da biomassa hidrolisada
10
(Separated Hydrolysis and Fermentation – SHF). Uma alternativa ao SHF é a realização de hidrólise e fermentação em um mesmo reator, processo conhecido como sacarificação e fermentação simultâneas (Simultaneous Saccharification and Fermentation – SSF) (Sanchez e Cardona, 2008).
2.3.3.1 Hidrólise e fermentação em separado (SHF)
No processo seqüencial SHF, a fração de material pré-tratado que contém celulose é submetida à hidrólise (sacarificação) por meio do uso de ácidos ou enzimas. Uma vez que a hidrólise é completada, o hidrolisado de celulose resultante é fermentado e convertido em etanol em um reator separado (Sanchez e Cardona, 2008).
A principal vantagem dessa estratégia é permitir que a hidrólise e a fermentação possam ser conduzidas nas condições ótimas. Geralmente, a temperatura ótima para as celulases está entre 45°C e 50°C, dependendo do micro-organismo produtor. E a temperatura ótima para a maior parte dos micro-organismos produtores de etanol está entre 30°C e 37°C (Olsson et al., 2006).
Por outro lado, a principal desvantagem é a inibição do complexo celulolítico pelos açúcares liberados na hidrólise, principalmente celobiose e glicose que se acumulam no meio, conferindo uma hidrólise incompleta da celulose e rendimentos não muito altos (Wingren et al., 2005). Segundo Taherzadeh e Karimi (2007), outra desvantagem do SHF é a possibilidade de contaminação. Como o tempo envolvido na etapa de hidrólise é muito longo, a solução de glicídios torna-se uma fonte disponível para os micro-organismos indesejados.
2.3.3.2 Sacarificação e fermentação simultâneas (SSF)
11
Essa estratégia de processo apresenta inúmeras vantagens, dentre elas: a redução da inibição das celulases pelos seus produtos de hidrólise, uma vez que os glicídios não se acumulam no meio; menor complexidade e custo do processo, comparado ao SHF, pois reduz o número de reatores; minimização dos riscos de contaminação, devido às baixas concentrações de açúcar livre no meio; e maiores rendimentos de hidrólise, já que o equilíbrio das reações enzimáticas é deslocado no sentido de formação de mais produto, visto que a glicose é concomitantemente consumida (Vasquez et al., 2007).
No entanto, um dos entraves do processo é a temperatura ótima para a realização das duas etapas; uma vez que, a ação ótima das celulases ocorre em torno de 50°C, enquanto que a maioria dos organismos ferm entativos cresce entre 30 e 37°C (Hari Krishna et al., 2001; Olsson et al., 2006). Com o objetivo de viabilizar o processo SSF tem aumentado consideravelmente nos últimos anos o isolamento de leveduras termotolerantes, especialmente de linhagens pertencentes às espécies
Saccharomyces cerevisiae e Kluyveromyces marxianus (Singh et al., 1998; Abdel-Fattah et al., 2000; Sree et al., 2000; Hari Krishna et al., 2001; Basso et al., 2008; Fonseca et al., 2008).
2.4 Micro-organismo fermentador
Tanto para a produção de etanol de primeira geração, a partir do caldo da cana de açúcar, quanto de segunda geração, a partir de biomassas de composição lignocelulósica, a via fermentativa é a via mais importante para a obtenção do álcool etílico no Brasil. Um dos fatores que torna a produção de bioetanol por fermentação a forma mais econômica de sua obtenção, é o grande número de matérias-primas naturais e residuais, como o bagaço de cana de açúcar, existentes em todo país (Pereira Jr. et al., 2008).
O micro-organismo predominante no processo de fermentação alcoólica é a levedura S. cerevisiae, devido à sua capacidade de hidrolisar sacarose presente no caldo da cana, em glicose e frutose, duas hexoses facilmente utilizadas por esta levedura, ao alto rendimento fermentativo, mesmo na presença de oxigênio, e ao fato desta levedura ser muito tolerante ao etanol em comparação com outras leveduras (Sanchez e Cardona, 2008).
12
ao etanol, resistentes a inibidores liberados durante o pré-tratamento do material lignocelulósico e capazes de utilizar um amplo espectro de substratos, produzindo grandes quantidades de etanol na temperatura ótima para a realização da sacarificação.
Leveduras industriais devem detectar e responder rapidamente às condições de estresse, adaptando-se aos fatores ambientais adversos por meio do ajuste de suas atividades metabólicas a fim de evitar uma perda substancial de viabilidade. A capacidade de tolerar vários estresses é um dos importantes critérios para selecionar uma linhagem que seja eficiente no processo fermentativo (Zhao e Bai, 2009).
2.4.1 Fermentação de pentoses e hexoses
Linhagens de S. cerevisiae são capazes de fermentar glicose a altas taxas, até mesmo em condições aeróbicas. Em condições anaeróbicas, a taxa de produção de etanol em meio definido é tão alta quanto 30 mmol g biomassa -1 h -1 a 30°C (Bakker et
al., 2000). Entretanto, S. cerevisiae são incapazes de assimilar ou fermentar xilose, o principal constituinte da fração hemicelulósica da biomassa.
As primeiras observações sobre fermentação de xiloses por leveduras datam do início de 1980, com as espécies Pachysolen tannophilus (Slininger et al., 1982) e
Candida tropicalis (Gong et al., 1981). Pesquisas posteriores demonstraram que outras espécies de leveduras também são capazes de fermentar xilose em etanol, incluindo diversas espécies dos gêneros Pichia e Candida bem como algumas linhagens de Kluyveromyces marxianus (Yablochkova et al., 2003; 2004). Cadete et al., (2009) descreveram uma nova espécie de levedura fermentadora de D-xilose, isolada de madeira em decomposição, e nomeada Spathaspora arborariae.
Muitos avanços foram alcançados na engenharia genética de leveduras e bactérias para a fermentação de xilose e arabinose em etanol e outros produtos como o ácido láctico. No entanto, a bioconversão de pentoses a etanol é ainda considerada um desafio econômico e tecnológico (Jeffries e Shi, 1999; Jeffries e Jin, 2004).
13 2.4.2 Tolerância a inibidores
Durante o pré-tratamento da biomassa lignocelulósica vários subprodutos químicos são gerados, e estes inibem os micro-organismos fermentativos. Entre muitos compostos inibidores, o 2-furaldeído (furfural) e o 5-hidroximetil-2-furaldeído (5-hidroximetilfurfural, HMF) são produzidos durante o pré-tratamento da biomassa, especialmente com ácido diluído. Estes inibidores danificam as paredes e membranas celulares, inibem o crescimento celular, reduzem atividades enzimáticas, causam danos ao DNA, inibem a síntese de proteínas e RNA, e reduzem a produção de etanol (Liu et al., 2004; Van Maris et al., 2006; Liu et al., 2009).
A maioria das leveduras, incluindo linhagens industriais, é suscetível a furfurais derivados do pré-tratamento, e especialmente suscetível a combinação destes inibidores. Embora o furfural seja mais tóxico do que o 5-HMF, ambos compostos atuam sinergicamente para suprimir o crescimento da levedura. Neste sentido, para atenuar os efeitos dos inibidores, tratamentos adicionais são requeridos, incluindo detoxificação química, física ou bioquímica. No entanto, esses passos adicionais adicionam custo e complexidade ao processo e geram resíduos. Portanto, o desenvolvimento de linhagens engenheiradas geneticamente com maior tolerância a inibidores, especialmente aos furfurais, é uma alternativa promissora à etapa de detoxificação adicional (Liu et al., 2004).
2.4.3 Termotolerância
Uma das principais aplicações propostas para leveduras termotolerantes é o processo de sacarificação e fermentação simultâneas da biomassa. Linhagens termotolerantes têm sido isoladas de diversos ambientes, principalmente de regiões tropicais. Por exemplo, isolados de S. cerevisiae que podem tolerar temperaturas superiores a 44°C têm sido selecionados com sucesso , entretanto as taxas de crescimento e de produção de etanol nestes casos são menores nestas temperaturas (Sree et al., 2000).
14
melhor desempenho em termos de fermentação em altas temperaturas, uma vez que não existem estudos sobre esta comparação. A temperatura parece ser um fator físico que determina o desempenho do micro-organismo, mas isso varia de acordo com os biorreatores e incubadoras. Para comparar linhagens candidatas de uma forma mais precisa condições experimentais controladas de crescimento são essenciais, tal como o uso dos mesmos biorreatores ou incubadoras (Abdel-Banat et al., 2010).
2.4.4 Tolerância a etanol
O custo efetivo da produção de etanol depende, entre outros fatores, do alto rendimento e da rápida conversão dos carboidratos a etanol. Entretanto, o etanol acumulado no meio de cultura pode se tornar um fator de estresse significativo durante a fermentação (Stanley et al., 2010).
Etanol é um inibidor do crescimento de leveduras em concentrações relativamente baixas, inibe a divisão celular, diminuindo o volume celular e a específica taxa de crescimento, enquanto em altas concentrações pode reduzir a viabilidade celular e aumentar a morte (Birch e Walker, 2000).
Os principais sítios para os efeitos do etanol em leveduras são membranas celulares, algumas proteínas hidrofóbicas e hidrofílicas e o retículo endoplasmático (Walker, 1998). A exposição das leveduras ao etanol resulta em um aumento da fluidez da membrana e conseqüente diminuição da sua integridade (Mishra e Prasad, 1989).A diminuição da disponibilidade de água, devido à presença do etanol causa a inibição de enzimas chaves na via glicolítica e essas proteínas podem ser desnaturadas (Hallsworth, 1998).
15
O pré-tratamento das leveduras com baixas concentrações de etanol tem sido utilizado para aumentar a taxa de adaptação a concentrações mais altas de etanol (Vriesekoop e Pamment, 2005). Neste contexto, estudos têm se concentrado na investigação do estresse em etanol usando leveduras mutantes que alteraram sua tolerância ao etanol devido à pré-exposição (Stanley et al., 2010).
2.4.5 Levedura: Saccharomyces cerevisiae
Devido a sua tradicional importância biotecnológica, como panificação, produção de cerveja e vinho, as pesquisas historicamente tem se focado em S. cerevisiae
(Barnett, 2003). Desta forma, acumulou-se um profundo conhecimento sobre a genética, fisiologia, bioquímica, engenharia genética e tecnologia fermentativa desta levedura (Nevoigt, 2008). A popularidade da pesquisa básica e aplicada em S. cerevisiae deve-se ao fato de algumas linhagens possuírem um staus GRAS (generally regarded as safe) de segurança concedido pelo órgão de segurança alimentar americano U.S. Food and Drug Administration (FDA).
Saccharomyces cerevisiae foi o primeiro organismo eucariótico cuja seqüência genômica completa foi determinada (Goffeau et al., 1996). Vários bancos de dados como o Saccharomyces Genome Database (http://www.yeastgenome.org/) e o Comprehensive Yeast Genome Database (http://mips.gsf.de/genre/proj/yeast/) contêm uma enorme quantidade de informação sobre seus genes, janelas de leituras (open reading frames – ORFs) e produtos gênicos.
A maioria das linhagens de S. cerevisiae é tolerante a baixos valores de pH, altas concentrações de açúcares e de etanol, propriedade que contribui para a diminuição do risco de contaminação durante a fermentação industrial (Nevoigt, 2008).
16
2007/2008, as linhagens PE-2 e CAT-1 foram usadas em cerca de 150 destilarias, representando cerca de 60% do etanol combustível produzido no Brasil (Basso et al., 2008).
Buscando obter importantes informações sobre o micro-organismo adequado ao processo SSF, foi feito neste trabalho um estudo comparativo entre os dois isolados mais amplamente utilizados pelas usinas nacionais, PE-2 e CAT-1, e um isolado obtido de uma destilaria de cachaça pelo Laboratório de Biotecnologia Molecular e denominado LBM-1. Deve-se ressaltar que as linhagens comerciais PE-2 e CAT-1 utilizadas neste trabalho foram adquiridas junto à empresa Fermentec (www.fermentec.com.br).
2.4.6 Levedura: Kluyveromyces marxianus
Linhagens pertencentes à espécie K. marxianus têm sido isoladas de uma grande variedade de habitats, o que resulta em uma alta diversidade metabólica e um substancial grau de polimorfismo intra-específico. Como conseqüência, diversas aplicações biotecnológicas têm sido investigadas com esta levedura: produção de enzimas (β-galactosidase, β-glicosidase, e poligalacturonases, entre outros), de
proteína para alimentação animal ou humana, de compostos de aroma, e de etanol (incluindo processos SSF a temperaturas superiores a 37°C); redução do teor de lactose em alimentos; produção de bioingredientes de soro de queijo; biorremediação; como um agente anticolesterolêmico; e como um vetor para produção de proteína heteróloga (Fonseca et al., 2008).
Comparando-se K. marxianus e K. lactis, organismo modelo, o conhecimento acumulado sobre a primeira é muito menor e, aquele existente, se distribui por um amplo número de diferentes linhagens. Sabe-se que K. marxianus e K. lactis
pertencem à mesma família, Saccharomycetacea, de S. cerevisiae (Llorente et al., 2000). Uma importante característica de K. marxianus, compartilhada com K. lactis, é a capacidade de assimilar lactose e usar este açúcar como fonte de carbono. Esta característica leva à freqüentes isolamentos destas leveduras a partir de fontes de leite; por exemplo leites fermentados, iogurte e queijos (Fonseca et al., 2008). Neste contexto, uma linhagem de K. marxianus denominada UFV-3 foi isolada da indústria de laticínios em Minas Gerais (Silveira et al., 2005).
17
18 3. OBJETIVOS
3.1 Objetivo geral
Caracterizar linhagens de leveduras termotolerantes pertencentes às espécies S. cerevisiae e K. marxianus para produção de etanol celulósico por meio da sacarificação e fermentação simultâneas.
3.2 Objetivos específicos
• Identificar molecularmente um isolado de S. cerevisiae LBM-1 obtido pelo Laboratório de Biotecnologia Molecular (Universidade Federal de Viçosa);
• Caracterizar fisiologicamente linhagens das espécies S. cerevisiae (LBM-1, CAT-1 e PE-2) e de K. marxianus (UFV-3 , ATCC 8554 e CCT 4086), quanto à utilização de fonte de carbono, termotolerância e tolerância a etanol;
• Comparar as velocidades específicas de crescimento e a capacidade fermentativa das linhagens testadas em meio com fonte de carbono definida;
19 4. MATERIAL E MÉTODOS
4.1 Linhagens e meios de cultura
As linhagens de leveduras que foram utilizadas neste experimento estão listadas na Tabela 1. O meio de cultura para manutenção e ativação foi YPD (2% extrato de levedura, 1% peptona e 2% glicose (p/v)), se sólido foi acrescentado 2 % ágar (p/v). Todas as linhagens foram estocadas e mantidas em glicerol 20% a -80°C.
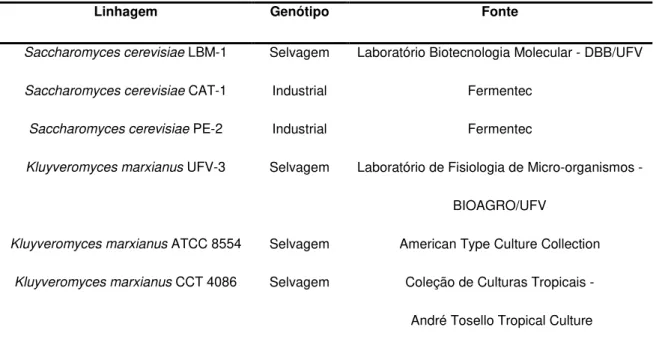
Tabela 1 – Linhagens de leveduras utilizadas.
Linhagem Genótipo Fonte
Saccharomyces cerevisiae LBM-1 Selvagem Laboratório Biotecnologia Molecular - DBB/UFV
Saccharomyces cerevisiae CAT-1 Industrial Fermentec
Saccharomyces cerevisiae PE-2 Industrial Fermentec
Kluyveromyces marxianus UFV-3 Selvagem Laboratório de Fisiologia de Micro-organismos -
BIOAGRO/UFV
Kluyveromyces marxianus ATCC 8554 Selvagem American Type Culture Collection
Kluyveromyces marxianus CCT 4086 Selvagem Coleção de Culturas Tropicais -
André Tosello Tropical Culture
4.2 Identificação molecular da levedura
O grupo de pesquisa do Laboratório de Biotecnologia Molecular (Departamento de Bioquímica e Biologia Molecular, UFV), sob orientação do Prof. Dr. Luciano Gomes Fietto, isolou uma linhagem de levedura termotolerante de uma dorna de fermentação de cachaça de Minas Gerais. Esta levedura foi isolada pelo método descrito por Oliveira et al. (2008) e denominada S. cerevisiae LBM-1.
20
(Departamento de Microbiologia, UFMG), sob coordenação do Prof. Dr. Carlos Augusto Rosa, e o seqüenciamento foi realizado no Laboratório de Biodiversidade e Evolução Molecular (Departamento de Microbiologia, UFMG).
4.2.1 Extração do DNA total
Para extração do DNA total, uma alçada de levedura foi incubada em tampão de lise (50 mL de Tris-HCl 1M, pH 8,0; 10 mL de EDTA 0,5M, pH 8,0; 20 mL de NaCl 5M; 50 mL de SDS a 10% (p/v)) a 65°C por um tempo mínimo de 30 minutos. Após este período foi adicionado 100 µl de fenol:clorofórmio:isopropílico na proporção 25:24:1, a amostra foi agitada vigorosamente por 3 minutos e submetida à centrifugação a 6.000 g por 15 minutos. Em seguida, o sobrenadante foi transferido para outro tubo e foi adicionado um volume de 100 µl de etanol 70% gelado. A amostra foi homogeneizada por inversão e novamente submetida a centrifugação a 6.000 g por 3 minutos. O sobrenadante foi descartado e o tubo contendo o DNA genômico foi deixado a temperatura ambiente secando por 16 horas. A amostra foi ressuspendida em 100 µl de tampão TE pH 8,0 (10 mL de Tris-HCL1M, pH 8,0; 2 mL de EDTA 0,5M, pH8,0).
A integridade do DNA genômico foi avaliada em gel de agarose 1% (p/v) em tampão TBE (54 g de tris-base; 27,5 g de ácido bórico; 20 mL de EDTA 0,5M, pH 8,0). O gel foi corado com solução de brometo de etídio e visualizado sob luz ultravioleta. O DNA genômico total foi quantificado em NanoDrop ND 1000 (NanoDrop Technologies).
4.2.2 Amplificação utilizando os iniciadores NL1 e NL4
A reação de PCR (reação em cadeia da polimerase) foi realizada em um volume final de 50 µl, utilizando a Taq DNA Polymerase Fermentas e 10 pmoles dos iniciadores NL1 GCATATCAATAAGCGGAGGAAAAG-3’) e NL4 (5’-GGTCCGTGTTTCAAGACGG-3’) (MWG Biotech), segundo (Rosa e Lachance, 1998). A reação de amplificação foi realizada utilizando-se o termociclador PCR Express
21
4.2.3 Purificação dos produtos de PCR e reação de seqüenciamento
Os amplicons gerados pela reação de PCR com os iniciadores NL1 e NL4 foram purificados por meio da técnica com Polietilenoglicol (PEG), descrita por Santos (2010). O produto purificado foi quantificado em NanoDrop ND 1000 (NanoDrop Technologies).
As reações de seqüenciamento foram realizadas utilizando-se o DYEnamicTM
(Amershan Biosciences, USA) em combinação com o sistema de seqüenciamento automatizado MegaBACETM 1000.
4.2.4 Análise das seqüências
As seqüências de DNA foram analisadas utilizando o programa BLASTn (Basic Local Alignment Search Tool- versão 2.2.24 do BLAST 2.0) disponível no portal NCBI desenvolvido pelo National Center for Biotechnology (Altschul et al., 1997). As seqüências obtidas foram comparadas com as seqüências já depositadas no GenBank. O alinhamento das seqüências foi realizado por meio do programa CLC Main Workbench 5.7.1.
4.3 Fotomicrografias das leveduras
22 4.4 Caracterização fisiológica
4.4.1 Crescimento em placas
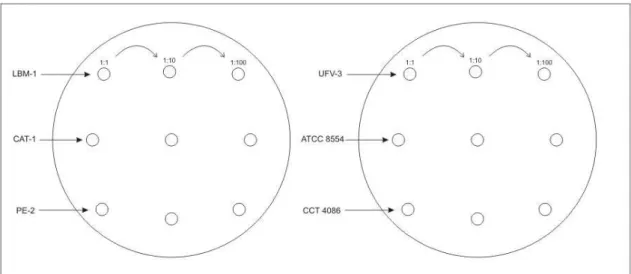
O crescimento em placas foi utilizado para fazer testes de tolerância à temperatura, ao etanol e às concentrações de fonte de carbono. As linhagens de S. cerevisiae (LBM-1, CAT-1 e PE-2) e K. marxianus (UFV-3, ATCC 8554 e CCT 4086) foram previamente crescidas em meio YPD2%, sob agitação de 180 rpm a 28°C. Diluições seriadas (1:1, 1:10 e 1:100) foram preparadas, em solução salina (0,85% NaCl), a partir de culturas com densidade ótica (D.O.) a 600 nm correspondente a 0,5. Um volume de 5µl de cultura de cada diluição (1:1, 1:10 e 1:100) foi aplicado em placas YPD sólido, como mostrado na Figura 6. Os testes foram realizados em placas com diferentes concentrações de fonte de carbono (glicose 2, 4, 8 e 16%) e na presença ou ausência de etanol (etanol 2, 4, 6 e 8% em YPD4%). As placas foram vedadas com parafilme e incubadas nas seguintes temperaturas: 28°C, 37°C, 42°C e 45°C por 3 dias.
Figura 6 – Desenho experimental do crescimento em placas.
4.4.2 Crescimento em microplacas
23
marxianus (UFV-3, ATCC 8554 e CCT 4086) foram previamente crescidas em meio YPD2%, sob agitação de 180 rpm a 28°C. A partir do pré-inóculo foram feitas diluições em solução salina para que a D.O(600nm) inicial de todas as linhagens fosse 0,1. Cada linhagem foi inoculada em condições específicas na microplaca, sendo que o volume final do meio foi 200 µl e cada ensaio foi feito em triplicata. Os testes foram feitos variando as concentrações de fonte de carbono (glicose 2, 4, 8 e 16%) e na presença ou ausência de etanol (etanol 2, 4, 6 e 8% em YPD4%). As placas foram vedadas usando plástico (Platemax- axysel sealing film, Axygen) e incubadas na leitora Versamax (microplate reader, Molecular Devices) nas temperaturas de 28°C, 37°C, 42°C e 45°C, por 16 horas.
O programa SoftMax Pro 5.3 utilizado pelo computador acoplado à leitora Versamax foi o seguinte:
• Comprimento de onda para as leituras de densidade ótica: 600nm;
• Pré-leitura da placa vazia na D.O(600nm);
• Tempo da curva de crescimento: 16 horas;
• Temperatura de incubação definida: 28°C, 37°C, 42° C ou 45°C;
• Leituras da D.O(600nm): a intervalos de 15 minutos;
• Agitação da placa: 5 segundos antes da leitura e 5 segundos entre as leituras.
24
Figura 7 – Representações esquemáticas das microplacas geradas pelo programa SoftMax Pro 5.3. A) Microplaca com as linhagens de S. cerevisiae, e B) Microplaca com as linhagens de K. marxianus.
4.5 Ensaios de fermentação
As linhagens de leveduras utilizadas no presente trabalho foram submetidas a ensaios de fermentação utilizando como substrato glicose e bagaço de cana de açúcar pré-tratado, em duas temperaturas diferentes 37°C e 42°C. As linhagens de S. cerevisiae (LBM-1, CAT-1 e PE-2) e K. marxianus (UFV-3, ATCC 8554 e CCT 4086) foram pré-ativadas pelo crescimento em frascos erlenmeyers de 50 mL contendo 20 mL de meio mínimo de fermentação sob agitação a 180 rpm por 16 horas a 28°C. O meio mínimo de fermentação é composto por: tampão citrato 50 mM pH 4,8; extrato levedura (2,5 g L-1); peptona (2,5 g L-1); NH
25 4.5.1 Ensaios de fermentação com glicose
As leveduras foram testadas quanto à concentração inicial de inóculo, com D.O.(600) inicial correspondente a 0,1 e a 2, em duas temperaturas diferentes, 37°C e 42°C, utilizando como substrato 4% (p/v) de glicose . As leveduras foram inoculadas em 50 mL de meio mínimo de fermentação, descrito anteriormente, em frascos erlenmeyers de 125 mL. Amostras foram retiradas a intervalos de 2 horas, para posteriores dosagens de glicose e etanol por cromatografia líquida de alta eficiência (CLAE).
4.5.2 Ensaios SSF com bagaço de cana de açúcar
4.5.2.1 Pré-tratamento ácido-básico
O bagaço de cana de açúcar (Saccharum spp.) foi cedido pelo Prof. Dr. Márcio Henrique Pereira Barbosa (Departamento de Fitotecnia, UFV). O bagaço de cana de açúcar triturado na concentração 10% (p/v) foi submetido a um pré-tratamento em solução de ácido sulfúrico 0,5% a 121ºC em autoclave por 30 minutos. Em seguida, o líquido foi coletado por filtração a vácuo e o resíduo sólido foi submetido ao pré-tratamento básico em solução de NaOH 4% (p/v) por 30 minutos a 121ºC em autoclave. Posteriormente o bagaço foi lavado com 500 mL de água deionizada quente seguido de secagem a 50ºC por 24 horas. O sólido obtido foi denominado celulose.
4.5.2.2 Sacarificação e fermentação simultânea a 37°C e a 42°C
26
intervalos de 2 horas, para posteriores dosagens de glicose e etanol por cromatografia líquida de alta eficiência (CLAE).
4.6 Parâmetros fermentativos
O rendimento de etanol por celulose consumida (Y E/C) foi calculado ao final de 12 horas de fermentação dividindo-se a diferença da massa final e inicial de etanol pela massa inicial de celulose, ambas expressas em gramas (g).
Y E/C= (massa final de etanol (g) – massa inicial de etanol(g))/ massa inicial de celulose (g))
O rendimento de etanol por glicose consumida (Y E/G) foi calculado ao final de 12 horas de fermentação dividindo-se a diferença da massa final e inicial de etanol pela massa inicial e final de glicose, ambas expressas em gramas (g).
Y E/G= (massa final de etanol (g) – massa inicial de etanol(g))/ massa inicial de glicose (g) – massa final de glicose (g))
4.7 Métodos analíticos – Concentrações de Glicose e Etanol
A quantificação de glicose e etanol foi realizada por cromatografia líquida de alta eficiência (HPLC), utilizando uma coluna de troca iônica Aminex HPX-87H (Bio-Rad), mantido a 60°C. O eluente para a separação foi ácid o sulfúrico 5 mM, aplicado a uma taxa de eluição 0,7 mL min-1. A coluna foi acoplada ao detector de índice de refração HP 1047 A.
27
28 5. RESULTADOS E DISCUSSÃO
5.1 Identificação molecular da levedura
Tradicionalmente, a classificação e identificação de linhagens e espécies de leveduras têm sido baseadas em características morfológicas e habilidades fisiológicas, sendo um processo laborioso e que consome tempo. Dadas as dificuldades deste processo, técnicas moleculares utilizando a amplificação de fragmentos específicos de DNAs têm sido utilizadas como métodos alternativos para identificação de leveduras (Kurtzman e Robnett, 1998).
Atualmente, o método molecular mais utilizado para estudos em taxonomia e identificação de leveduras baseia-se na comparação de seqüências da região D1/D2 do gene rDNA 26S e/ou do gene rDNA 18S. Organismos que exibem 99% ou mais de identidade nesta região são considerados como pertencentes à espécie conhecida e depositada no GenBank (Kurtzman e Robnett, 1998; Kawahata et al., 2007).
Neste sentido, foi feito o sequenciamento da região D1/D2 da subunidade 26S do DNA ribossomal do novo isolado LBM-1. O resultado do seqüenciamento foi submetido à comparação com seqüências do banco de dados GenBank utilizando o programa BLASTn. A análise confirmou o novo isolado como pertencente à espécie S. cerevisiae. Outras técnicas para melhor caracterizar o isolado estão em andamento no Laboratório de Biotecnologia Molecular, como por exemplo, a determinação do cariótipo.
5.2 Fotomicrografia das leveduras
29
Figura 8 – Fotomicrografias utilizando o microscópio óptico Nikon Eclipse Ti-S com objetiva de 100X e abertura numérica de 1.4. A) LBM-1, B) CAT-1, C) PE-2, D) UFV-3, E) ATCC 8554 e F) CCT 4086.
5.3 Avaliação do crescimento das leveduras em meio sólido
30
Quadro 1 – Avaliação do crescimento de linhagensde leveduras em meio YP contendo diferentes concentrações de glicose e em diferentes temperaturas *.
Linhagens de
Leveduras
Temperatura 30°C Temperatura 37°C Temperatura 42°C Temperatura 45°C
Concentrações de glicose
(p/v) Concentrações de glicose (p/v) Concentrações de glicose (p/v) Concentrações de glicose (p/v)
2% 4% 8% 16% 2% 4% 8% 16% 2% 4% 8% 16% 2% 4% 8% 16%
S. cerevisiae LBM-1 +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ - + +++ +++
S. cerevisiae CAT-1 +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ - - ++ +++
S. cerevisiae PE-2 +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ - - ++ +++
K. marxianus UFV-3 +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++
K. marxianus ATCC 8554 +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++
K. marxianus CCT 4086 +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++
Quadro 2 - Avaliação do crescimento de linhagensde leveduras em meio YPD 4% contendo diferentes concentrações de etanol e em diferentes temperaturas *.
Linhagens de
Leveduras
Temperatura 30°C Temperatura 37°C Temperatura 42°C Temperatura 45°C
Concentrações de etanol (v/v) Concentrações de etanol (v/v) Concentrações de etanol (v/v) Concentrações de etanol (v/v)
2% 4% 6% 8% 10% 2% 4% 6% 8% 10% 2% 4% 6% 8% 10% 2% 4% 6% 8% 10%
S. cerevisiae LBM-1 +++ +++ +++ +++ + +++ +++ +++ ++ - +++ +++ - - - +++ - - - -
S. cerevisiae CAT-1 +++ +++ +++ +++ + +++ +++ +++ +++ - +++ +++ - - - +++ - - - -
S. cerevisiae PE-2 +++ +++ +++ +++ + +++ +++ +++ ++ - +++ +++ - - - +++ - - - -
K. marxianus UFV-3 +++ +++ +++ - - +++ +++ - - - +++ + - - - +++ - - - -
K. marxianus ATCC 8554 +++ +++ +++ + - +++ +++ - - - +++ +++ - - - +++ +++ - - -
31
Pode-se observar que as linhagens testadas cresceram em todas as diluições e em todas as concentrações de glicose até 42°C. No e ntanto, a 45°C observa-se que as linhagens de S. cerevisiae somente foram capazes de crescer em meios com maiores concentrações de glicose, 8 e 16% (p/v), enquanto as K. marxianus
cresceram nas quatro concentrações de glicose testadas, evidenciando a maior termotolerância desta espécie (Singh et al., 1998; Abdel-Fattah et al., 2000; Ballesteros et al., 2004; Hong et al., 2007; Nonklang et al., 2008; Suryawati et al., 2008).
O fato das linhagens de S. cerevisiae crescerem em meio sólido até 45°C em altas concentrações de glicose, fato este não relatado ainda para leveduras desta espécie, nos levou a testar o crescimento destas linhagens em meio líquido com agitação, uma vez que a agitação provoca um maior estresse nas células, pelo maior contato delas com o meio e, portanto o efeito osmótico poderia ser mais pronunciado. Concomitantemente, esta observação foi instigante, uma vez que o aumento da concentração de açúcares leva a um estresse osmótico das leveduras (Lima et. al., 2001), apesar de que para as condições testadas este estresse não exerceu um efeito de inibir o crescimento das leveduras como pode ser observado no Quadro 1. Curiosamente, quando o experimento foi realizado a 45 °C, foi observado que as linhagens de S. cerevisiae somente cresciam em concentrações de 8 e 16% (p/v) de glicose. Este fato pode ter ocorrido devido a um mecanismo chamado de “tolerância cruzada” (cross-tolerance), no qual um tipo de estresse como o estresse por temperatura dá uma proteção parcial contra outros estresses como o osmótico ou salino (Koedrith et al., 2008). Como um dos principais efeitos da temperatura é o aumento da fluidez da membrana plasmática pode se especular que um meio hipertônico impeça a entrada de água evitando a lise das leveduras em temperaturas mais altas, mas este possível mecanismo de tolerância cruzada sugerido pelos experimentos está sendo investigado.
Assim como descrito anteriormente, foram feitas análises do estresse provocado pelo etanol nas leveduras em diferentes temperaturas. No Quadro 2 pode-se observar que o estresse provocado pelo etanol nas leveduras é mais drástico do que o estresse provocado pela variação na concentração de glicose.
A uma temperatura de 30°C, linhagens de S. cerevisiae apresentaram bom crescimento até 8% (v/v) de etanol e um fraco crescimento em 10% (v/v) de etanol. Nesta mesma temperatura, as linhagens de K. marxianus somente cresceram até uma concentração de 6% (v/v) de etanol, confirmando a maior tolerância de S. cerevisiae
32
No entanto, a combinação do estresse do etanol com a temperatura foi mais relevante para S. cerevisiae, que teve um decréscimo na tolerância de 10% (v/v) de etanol a 30°C para 4% (v/v) a 42°C, enquanto que pa ra as linhagens de K. marxianus
foi observado um decréscimo bem menor, de 6% (v/v) de etanol a 30°C para 4% (v/v) a 42°C. Supõe-se que a combinação dos estresses ten ha um efeito maior para S. cerevisiae, uma vez que as linhagens de K. marxianus são mais termotolerantes que as linhagens selvagens de S. cerevisiae, embora a concentração máxima de etanol suportada pelas linhagens não tenham sido diferentes.
5.4 Avaliação do crescimento das leveduras em meio líquido
Para melhor caracterizar o crescimento destas linhagens em diferentes condições, foram feitos experimentos em microplacas contendo meio líquido e por meio destes foram traçadas curvas de crescimento, utilizando o programa SigmaPlot
(versão 11.0). A curva de crescimento permitiu que fosse observado o desenvolvimento dos micro-organismos em diferentes condições, sob temperatura controlada e agitação adequada (Hiss, 2001).
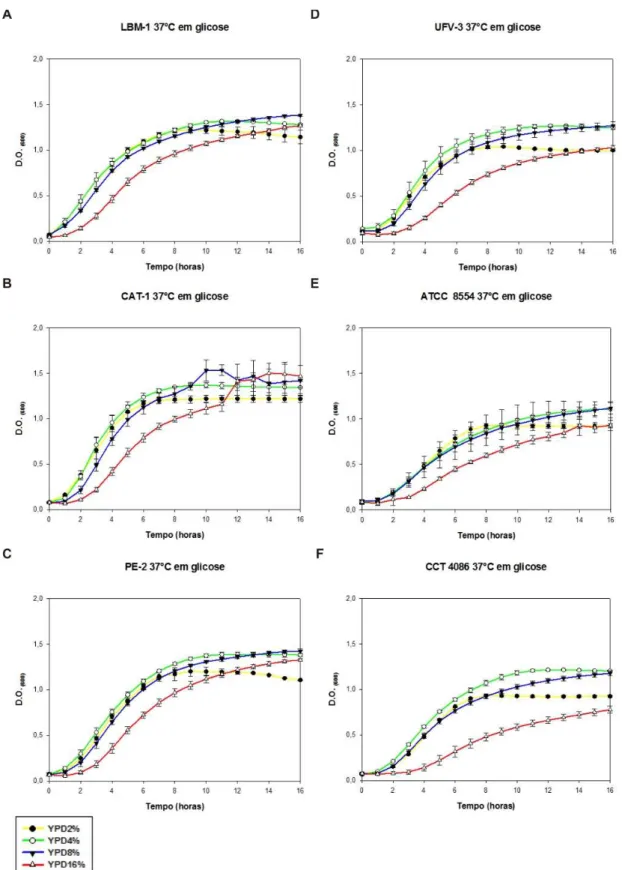
A 30°C (Anexo 3) e a 37 °C (Figura 9) todas as linh agens apresentaram um bom crescimento em todas as concentrações de glicose. Foi considerado bom crescimento, possuir uma fase lag (fase de adaptação) com um período curto de duração, cerca de 2 horas, seguida de uma fase exponencial com D.O.(600) variando entre 1,0 e 1,5. Era esperado que todas as linhagens crescessem nestas condições, uma vez que a maioria dos micro-organismos fermentativos cresce numa temperatura ótima entre 30°C e 37°C (Olsson et al., 2006). Pode-se observar que as linhagens de K. marxianus
33
34
A 42°C (Figura 10) as linhagens de K. marxianus apresentaram um melhor crescimento em relação as linhagens de S. cerevisiae comprovando a sua já descrita termotolerância. As linhagens LBM-1 (Figura 10-A) e CAT-1 (Figura 10-B) não conseguiram crescer a 42°C em 2% (p/v), de glicose, entretanto, em concentrações de glicose mais altas, 4, 8 e 16% (p/v), cresceram normalmente. A linhagem PE-2 teve um crescimento menor quando comparada à LBM-1 e CAT-1, nas mesmas condições (Figura 10-C). Normalmente, linhagens de S. cerevisiae não são capazes de crescer em temperaturas maiores que 40°C (Sree et al., 2000), isto faz com que LBM-1, assim como as linhagens CAT-1 e PE-2, sejam boas candidatas ao processo SSF.
Na Figura 11 pode-se observar que as linhagens de K. marxianus cresceram em diferentes concentrações de glicose a 45°C, enquant o que as linhagens de S. cerevisiae não foram capazes de crescer em qualquer concentração de glicose com exceção de LBM-1 que apresentou um crescimento residual em 4, 8 e 16% de glicose (Figura 11-A). Para a linhagem UFV-3 (Figura 11-D) foi observado o mesmo fenômeno descrito para LBM-1 (Figura 11-A) e CAT-1 (Figura 11-B), ou seja, quando há um estresse por altas temperaturas, as linhagens necessitaram de maiores concentrações de açúcar para crescer.
35
36
37
Para verificar a capacidade termotolerante das linhagens, foi feita uma comparação das velocidades específicas de crescimento ( h-1) em diferentes temperaturas. Desta forma, foi escolhida uma concentração de glicose (4% (p/v)) na qual as linhagens cresceram melhor em diferentes temperaturas para os cálculos dos valores de .
Na Tabela 2 pode-se observar que a velocidade específica de crescimento das linhagens de S. cerevisiae foi similar a 30°C. À temperatura de 37°C as linha gens CAT-1 e PE-2 apresentaram o maior valor de , 0,368 e 0,318 respectivamente, quando comparadas a LBM-1. A 42°C as três linhagens de S. cerevisiae apresentaram comportamento semelhante, com alta velocidade específica de crescimento. A 45°C o crescimento das linhagens de S. cerevisiae cai substancialmente, sendo que a única linhagem que ainda apresentou um crescimento foi LBM-1. Com isto, pode-se concluir que a temperatura máxima tolerada por estas linhagens de S. cerevisiae é 42°C. Outro fato a ser destacado, é o comportamento termotolerante da linhagem LBM-1. Isto porque, esta linhagem é um isolado novo, diferentemente das linhagens, CAT-1 e PE-2, que estão passando por pressão seletiva há muitos anos nos processos fermentativos industriais.
As linhagens de K. marxianus apresentaram valores de velocidade de crescimento bem superiores aos das linhagens de S. cerevisiae. A linhagem UFV-3 apresentou valores similares de para temperaturas de 30°C, 37°C e 42°C, sendo que a 45°C apresentou uma diminuição na velocidade de crescimento. Por outro lado, as linhagens de coleções biológicas ATCC 8554 e CCT 4086 apresentaram valores similares de velocidade de crescimento independente das temperaturas. Estes dados de termotolerância estão consistentes com a literatura, uma vez que já foi demonstrado que K. marxianus cresce rapidamente mesmo em temperaturas acima de 40°C (Fonseca et al., 2008).
38
Tabela 2 - Velocidade específica de crescimento ( ) e D.O.(600) máxima em microplacas contendo meio
YPD 4% em diferentes temperaturas.
Linhagens Velocidade de Crescimento µ h-1
D.O.(600)
Temperaturas Temperaturas
30°C 37°C 42°C 45°C 30°C 37°C 42°C 45°C
LBM-1 0,126 0,218 0,274 0,114 1,18 1,08 0,61 0,15
CAT-1 0,181 0,368 0,230 0,033 1,28 1,24 0,86 0,15
PE-2 0,151 0,318 0,195 0,055 1,27 1,10 0,34 0,13
UFV-3 0,456 0,401 0,384 0,174 0,79 1,05 0,87 0,34
ATCC 8554 0,407 0,386 0,375 0,317 0,56 0,72 0,75 0,63
CCT 4086 0,358 0,353 0,377 0,332 0,73 0,89 1,17 0,68
Processos fermentativos requerem micro-organismos que possuam boa capacidade fermentativa e que sejam tolerantes a altas concentrações de etanol. Dessa forma, experimentos de caracterização quanto a tolerância ao etanol foram realizados em microplacas e por meio destes foram feitas curvas de crescimento, utilizando o programa SigmaPlot (versão 11.0).
A Figura 12 mostra a variação do crescimento em diferentes concentrações de etanol em função da temperatura 30°C. As linhagens de S. cerevisiae apresentaram um perfil de tolerância até 8% (v/v), de etanol sendo que o novo isolado LBM-1 (Figura 12-A) mostrou-se tão tolerante ao etanol quando as linhagens industriais CAT-1 (Figura 12-B) e PE-2 (Figura 12-C). Por outro lado, as linhagens de K. marxianus
apresentaram uma menor tolerância ao etanol, sendo que as linhagens de coleções biológicas ATCC 8554 (Figura 12-E) e CCT 4086 (Figura 12-F) toleraram concentrações mais altas de etanol, até 6% (v/v), do que a linhagem UFV-3 (Figura 12- D), crescendo somente até 4% (v/v) de etanol.
Na Figura 13 pode-se verificar que o aumento da temperatura para 37°C não alterou significativamente o crescimento das linhagens de S. cerevisiae (Figura 13-A, B, C), entretanto quando o crescimento foi avaliado em temperaturas mais elevadas, 42°C (Figura 14- A, B, C) e 45°C (Figura 15-A, B, C ), pode-se observar uma grande redução no crescimento das mesmas, sendo que a 42°C nenhuma linhagem conseguiu crescer nas concentrações mais altas de etanol, 6 e 8% (v/v). Portanto, a 45°C o ensaio não foi realizado nestas condições (F igura 15-A, B, C). As linhagens de
39
40
41
42
43