i Universidade Federal de Ouro Preto
Núcleo de Pesquisas em Ciências Biológicas Programa de Pós Graduação em Biotecnologia
Thalita Macedo Araújo
CARACTERIZAÇÃO BIOQUÍMICO-MOLECULAR DE CEPAS DE Saccharomyces cerevisiae ISOLADAS DE DORNAS DE FERMENTAÇÃO DE CACHAÇA PARA
PRODUÇÃO DE CERVEJAS.
Dissertação de Mestrado
Ouro Preto 2013
PPGBIOTEC
ii Thalita Macedo Araújo
CARACTERIZAÇÃO BIOQUÍMICO-MOLECULAR DE CEPAS DE Saccharomyces cerevisiae ISOLADAS DE DORNAS DE FERMENTAÇÃO DE CACHAÇA PARA
PRODUÇÃO DE CERVEJAS.
Dissertação de Mestrado
ORIENTADOR: PROF. DR. ROGELIO LOPES BRANDÃO CO-ORIENTADORAS: DRª LYGIA FÁTIMA DA MATA CORREA
E DRª FLORÊNCIA ALVAREZ
Dissertação de Mestrado apresentada ao programa de pós-graduação do Núcleo de Pesquisas em Ciências Biológicas da Universidade Federal de Ouro Preto, como parte integrante dos requisitos para obtenção do título de Mestre em Biotecnologia, área de concentração Biotecnologia aplicada a processos e ao tratamento de doenças.
iv Dedicatória
v Agradecimentos
Agradeço ao Prof. Dr. Rogélio Brandão pela oportunidade, estímulo e pelo exemplo de pesquisador.
Às minhas queridas co-orientadoras Lygia e Florência, que tornaram as longas jornadas de experimentos muito mais prazerosas, que tiveram toda a paciência do mundo nos momentos em que eu precisei e que estiveram comigo na alegria e na tristeza.
Ao Prof. Dr. Ieso Castro, pela disponibilidade e apoio.
Aos amigos Diogo e Rafaela pelas trocas de experiência, pela força e pelos bons momentos de diversão.
À Anna Clara pela disponibilidade, vontade de ajudar e entusiasmo de aprender.
Aos colegas de laboratório Bruno, Luis, Juliana, Thiago, Magalhães, Edilene, Eduardo, Aninha, Marcos, Filipe, Talita, Bruna, Gabriela, Regiane, Gustavo, Guto, Débora, Heloá, Karol pela convivência saudável e prazerosa.
Aos amigos Ana Paula e Júlio pela ajuda, sabedoria e dedicação.
Aos colegas do mestrado José Augusto, Cyntia, Maurício, Bruna, Walmir, Cintia, Cristina, Rafaela... pelo companheirismo e excelente convivência.
À Zezé, sempre disposta a ajudar, com alegria e satisfação.
Aos professores dos Laboratórios de Imunoparasitologia e de Caracterização Molecular e Espectrometria de Massas da UFOP, pela disponibilização de equipamentos.
Aos professores do NUPEB, pelos ensinamentos e pela presteza. À UFOP, exemplo de ensino público de qualidade.
Ao IFMG –Campus Ouro Preto pelo apoio à minha qualificação. Aos meus familiares, pelo incentivo.
À minha mãe, pelo carinho, paciência e pelo apoio incondicional a todas as minhas empreitadas, pessoais e profissionais.
Ao meu marido pela compreensão, carinho e companheirismo.
vi RESUMO
CARACTERIZAÇÃO BIOQUÍMICO-MOLECULAR DE CEPAS DE Saccharomyces cerevisiae PARA PRODUÇÃO DE CERVEJAS.
A cerveja é uma bebida alcoólica produto da fermentação do malte de cevada por leveduras que vem sendo produzida desde, aproximadamente, 6000 anos a.C. Além de gás carbônico e etanol, as leveduras produzem durante a fermentação, compostos secundários que são responsáveis pela formação do flavour e consequente qualidade sensorial da bebida. Por isso o uso de leveduras selecionadas tem sido um aspecto de grande importância na obtenção de bebidas. Na fabricação da cerveja, podem ser utilizadas leveduras do tipo ale ou lager, que pertencem à espécie Saccharomyces
vii Além disso, 9 foram capazes de crescer a 20°C e 7 a 15°C. Quanto ao perfil de floculação, 9 cepas apresentaram percentuais de floculação maior que 36% e responderam com um fenótipo New-Flo. A presença dos genes FLO1, FLO5 e FLO11 foi verificada por PCR e quantificada por qPCR, sendo relevante a presença dos genes
FLO5 e FLO11 na maioria das cepas. Em geral, as cepas mais floculantes foram também as que apresentaram maior hidrofobicidade na sua superfície celular. Quanto aos testes complementares, as cepas apresentaram resistência a altas concentrações de etanol (20% (v/v)), baixa ou nenhuma produção de H2S (off flavour) e síntese de 4-VG em concentrações semelhantes às apresentadas pelas cepas comerciais tipo ale. Considerando a importância do consumo total dos açúcares presentes no mosto, em especial a maltotriose, o transporte de α-glicosídeos foi avaliado. As cepas apresentaram um transporte de α-glicosídeos semelhante aos valores revelados pelas cepas cervejeiras comerciais. Finalmente, as cepas foram submetidas a testes de produção e resistência a micocinas, considerando o uso de fermentações consorciadas. Os resultados revelaram que todas as cepas experimentais não são sensíveis, tampouco prejudiciais a outras espécies. Com base nos resultados dos testes complementares, foram selecionadas as cepas experimentais LBCM 45 e 78 para a produção de cervejas german pilsner e
weissbier, respectivamente. As cervejas produzidas foram submetidas a análises físico-químicas, cujos resultados mostraram que as cepas em estudo, LBCM 45 e 78 apresentaram comportamento semelhante às cepas cervejeiras comerciais W-34/70 e WB-06. Portanto, os resultados do presente trabalho contribuíram para uma melhor caracterização da grande diversidade de linhagens de S. cerevisiae isoladas da produção de cachaça, visando sua potencial utilização na produção de outras bebidas alcoólicas fermentadas, tais como as cervejas, além da sua possível utilização em fermentações consorciadas.
viii ABSTRACT
BIOCHEMICAL AND MOLECULAR CHARACTERIZATION OF Saccharomyces cerevisiae STRAINS TO BEER PRODUCTION.
Beer is an alcoholic beverage derived from fermentation of barley malt by yeasts that had been produced since approximately 6000 years BC. In addition to carbon dioxide and ethanol, during fermentation yeasts produce secondary compounds responsible for the flavour formation and consequent sensory quality of beer. The use of selected yeast has been an important aspect in beverages production. According to biochemical tests and differential behavior during wort fermentation, brewery yeast can be classified as ale or lager, which belongs to Saccharomyces cerevisiae and Saccharomyces
pastorianus species, respectively. Our lab, LBCM, has a collection of S. cerevisiae strains isolated from fermentation yeasts of cachaça’s distilleries and selected for their high capacity of volatile compounds production and high resistance to different stress conditions. This study aimed to the biochemical and molecular characterization of 21 strains from LBCM collection as well to the use of selection criteria for their application to beer production. Among these 21 strains, 11 were able to ferment maltose presenting similar specific growth rate in media containing glucose. Molecular identification based on ITS-5.8S rDNA regions confirmed that 10 strains are S. cerevisiae. Two sets of tests were applied on 10 selected strains and 4 commercial brewery yeasts. The first group was based on ale and lager classification, flocculation profile and low temperature fermentation. The second one included additional testes such as ethanol tolerance, H2S and 4-VG production, α-glucosides transport and synthesis of killer toxins. The results showed that three from 10 strains were able to ferment melibiose and to secret melibiase, a typical lager profile, even though all strains grew at 37°C. In addition, 9 were able to grow at 20°C and 7 at 15°C. Nine strains showed flocculation percentages greater than 36% consistent with the NewFlo-phenotype. The flocculation genes FLO1,
ix flavor) and 4-vinilguaiacol synthesis in concentrations similar to ale commercial strains. Considering the importance of total consumption of sugars present in the wort, particularly maltotriose, we evaluated α-glycosides transport. The strains showed α -glycosides transport rate similar to brewery commercial ones. Finally, the strains were tested for killer toxins production and resistance, considering the possibility of fermentation consortium. The results showed that all strains are not sensitive and unable to produce killer toxins. Based on the results of additional tests, we selected LBCM 45 and LBCM 78 strains to beer production. Physical and chemical assays revealed similar patterns between beers produced by each selected strain and the corresponding commercial strain. Therefore, this study contributed to a better characterization of the diversity of natural S. cerevisiae strains isolated from cachaça production environments and reveals their potential use in other fermented products like beer as well as a possible use in fermentation consortium.
x LISTA DE FIGURAS
Figura 1: Diagrama esquemático da produção de cervejas. ... 4 Figura 2: Modelo de formação das espécies S. pastorianus e S. bayanus. (Libkind et al., 2011). ... 7 Figura 3: Vias biossintéticas de compostos voláteis em Saccharomyces cerevisiae (Kobayashi et al, 2008). ... 13 Figura 4: Escala de intensidade de coloração das colônias para classificação do nível de
produção de H2S. ... 30
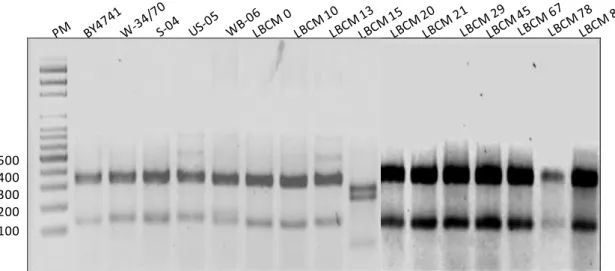
Figura 5: Curvas de crescimento em meio sintético contendo glicose (2%) ou maltose (2%).. 43 Figura 6: Fragmentos amplificados da região ITS-5.8S das cepas: laboratorial BY 4741,
comerciais W-34/70, S-04, US-05 e WB-06 e experimentais LBCM 0, 10, 13, 15, 20, 21, 29, 45, 67, 78 e 80, em gel de agarose 1%, corado com brometo de etídeo (1 µg/mL) e visualizado sob luz UV.. ... 45 Figura 7: Fragmentos de restrição das regiões ITS-5.8S, em gel de agarose 3%, corado com brometo de etídeo (1 µg/mL) após digestão com a enzima CfoI . ... 46 Figura 8: Fragmentos de restrição das regiões ITS-5.8S, em gel de agarose, corado com
xi Figura 22: Linearidade e análise de regressão obtidos para os compostos voláteis por CG-DIC. ... 91 Figura 23: Linearidade e análise de regressão obtidos para etanol por CG-DIC. ... 92
Figura 24: Detecção por PCR das regiões intragênicas repetitivas FLO utilizando primers
xii LISTA DE TABELAS
Tabela 1: Micro-organismos utilizados neste trabalho. ... 21 Tabela 2: Primers utilizados na identificação dos genes FLO para análise por PCR. ... 28 Tabela 3: Primers utilizados para avaliação da expressão dos genes FLO. ... 33 Tabela 4: Condições cromatográficas para análise do 4-vinilguaiacol (4-VG) por CG-EM. .... 35 Tabela 5: Condições de produção das cervejas german pilsner pelas leveduras LBCM 45 e W-34/70. ... 37 Tabela 6: Condições de produção das cervejas weissbier pelas leveduras LBCM 78 e WB-06. ... 37 Tabela 7: Condições cromatográficas para análise de compostos voláteis presentes nas cervejas produzidas por CG-DIC. ... 38 Tabela 8: Velocidades específicas de crescimento das leveduras em meio sintético contendo glicose 2% ou maltose 2%. ... 42 Tabela 9: Sensibilidade ao EDTA e percentual de floculação das cepas controle comerciais W-3470, S-04, US-05 e WB-06 e das cepas em estudo LBCM 0, 10, 13, 20, 21, 29, 45, 67, 78 e 80, nas temperaturas de crescimento 15 e 30°C e na presença de glicose 0,5 M e manose 0,5 M. .. 55 Tabela 10: Presença (+) ou ausência (-) dos genes FLO1, FLO5 e FLO11 no genoma das leveduras comerciais e da coleção LBCM, utilizando primers desenhados por Verstrepen e colaboradores (2005) que amplificam regiões intragênicas repetitivas. Os números entre
xiii LISTA DE ABREVIATURAS
4-VG 4-vinilguaiacol
ASBC American Society of Brewing Chemists
BJCP Beer Judge Certification Program
CG Cromatografia Gasosa / Gas chromatography
CG-EM Cromatografia Gasosa-Espectrometria de Massas / GC-MS Gas Chromatography - Mass Spectrometry
CG-DIC Cromatografia Gasosa - Detecção por Ionização em Chama / GC-FID Gas Chromatography - Flame Ionization Detector
DGGE Denaturing Gradient Gel Electrophoresis / Eletroforese em Gel com Gradiente de Desnaturação
D.O. Densidade óptica
HS Headspace
ITS Internal Transcribed Spacer Region/Região Intergênica do rDNA
LBCM Laboratório de Biologia Celular e Molecular
MHI Modified Hydrofobic Index / Índice de Hidrofobicidade Modificado
NUPEB Núcleo de Pesquisas em Ciências Biológicas
PCR Reação em Cadeia da Polimerase
ρNPαG ρ-nitrofenil-α-D-glicopiranosídeo PSA-FITC Pisum sativum-agglutinate-FITC
p/v Peso por volume
RFLP Restriction Fragments Length Polymorphism / Polimorfismo dos Fragmentos de Restrição
SRM Standard Reference Method
UFOP Universidade Federal de Ouro Preto
v/v Volume por volume
xiv Índice
RESUMO ...vi
ABSTRACT ... viii
LISTA DE FIGURAS... x
LISTA DE TABELAS ... xii
LISTA DE ABREVIATURAS ... xiii
1. INTRODUÇÃO ... 1
1.1 Bebidas fermentadas ... 1
1.2 A produção de cervejas ... 2
1.3 Leveduras das cervejas ... 6
1.4 Processo de floculação ... 8
1.5 Conteúdo de carboidratos do mosto cervejeiro e metabolismo de açúcares durante a fermentação ... 9
1.6 Transportadores de maltose e maltotriose ... 11
1.7 Compostos voláteis na produção de cervejas ... 12
1.7.1 Concentração de sólidos solúveis ... 15
1.7.2 Temperatura ... 15
1.7.3 Tamanho do inóculo - pitching rate... 16
2. JUSTIFICATIVA ... 17
3. OBJETIVOS ... 19
3.1 Objetivo geral ... 19
3.2 Objetivos específicos ... 19
4. MATERIAIS E MÉTODOS ... 20
4.1 Cepas utilizadas ... 20
4.2 Meios de cultura ... 22
4.2.1 Meio YP ... 22
4.2.2 Meio Bismuth Sulfite Agar (DIFCO Laboratories) ... 22
4.2.3 Meio YEPD-MB (Yeast Extract Peptone Dextrose – Methylene Blue) ... 22
4.2.4 Meio mínimo YNB (Yeast Nitrogen Base) ... 22
4.2.5 Meio Basal Agar ... 22
xv
4.4 Identificação de espécie ... 23
4.4.1 Extração do DNA genômico ... 23
4.4.2 Amplificação da região ITS-5.8S ... 24
4.4.3 Digestão com enzimas de restrição ... 24
4.5 Testes bioquímicos para diferenciação de cepas ale e lager ... 25
4.6 Avaliação do crescimento em diferentes temperaturas ... 26
4.6.1 Avaliação do crescimento a 15, 20 e 30ºC ... 26
4.6.2 Avaliação do crescimento a 25 e 37ºC ... 26
4.7 Avaliação da capacidade de floculação ... 26
4.7.1 Teste quantitativo de floculação ... 26
4.7.2 Presença dos genes FLO ... 27
4.7.3 Teste de hidrofobicidade da superfície celular ... 28
4.7.4 Detecção de resíduos de manose e glicose na parede celular por citometria de fluxo 29 4.8 Teste de produção de sulfeto de hidrogênio (H2S) ... 30
4.9 Análise de agrupamento ... 30
4.10 Expressão dos genes FLO ... 31
4.10.1 Extração de RNA ... 31
4.10.2 Construção do cDNA ... 32
4.10.3 Análise por PCR quantitativo (q-PCR) ... 32
4.11 Teste de tolerância ao etanol ... 33
4.12 Teste de produção de compostos fenólicos (4-VG) ... 33
4.13 Determinação do transporte ativo de α-glicosídeos ... 35
4.14 Teste de produção e resistência à micocinas ... 36
4.15 Produção das cervejas ... 36
4.16 Análises físico-químicas das cervejas produzidas ... 38
4.16.1 Análise de alcoóis superiores, ésteres, acetaldeído e diacetil ... 38
4.16.2 Análise de etanol ... 39
4.16.3 Classificação de cor pelo Standard Reference Method (SRM) e dosagem de pH ...39
4.17 Análise estatística ... 40
4.18 Análise sensorial ... 40
5 RESULTADOS E DISCUSSÃO ... 41
5.1 Avaliação do metabolismo de açúcares ... 41
xvi
5.2.1 Amplificação da região ITS-5.8S ... 44
5.2.2 Perfil de restrição do fragmento amplificado ITS-5.8S ... 45
5.3 Testes para diferenciação bioquímica de cepas ale e lager ... 49
5.4 Avaliação do crescimento em diferentes temperaturas ... 51
5.4.1 Avaliação do crescimento a 15, 20 e 30ºC ... 51
5.4.2 Avaliação do crescimento a 25 e 37ºC ... 53
5.5 Avaliação da capacidade de floculação ... 54
5.5.1 Teste quantitativo de floculação ... 54
5.5.2 Presença dos genes FLO ... 56
5.6 Teste de hidrofobicidade da parede celular ... 57
5.7 Perfil dos açúcares glicose e manose da parede celular ... 59
5.8 Teste de produção de sulfeto de hidrogênio (H2S) ... 61
5.9 Agrupamento das cepas ... 62
5.10 Testes complementares ... 63
5.10.1 Expressão relativa dos genes FLO ... 63
5.10.2 Teste de tolerância ao etanol ... 66
5.10.3 Teste de produção de compostos fenólicos (4VG) ... 67
5.10.4 Determinação do transporte ativo de α-glicosídeos ... 69
5.10.5 Teste de produção e resistência à micocinas ... 70
5.11 Produção das cervejas ... 71
5.11.1 Seleção das cepas para produção de cerveja ... 71
5.11.2 Produção das cervejas wiessbier e german pilsner ... 71
5.11.3 Análises físico-químicas das cervejas ... 73
6 CONCLUSÕES E PERSPECTIVAS ... 78
7 REFERÊNCIAS BIBLIOGRÁFICAS ... 80
ANEXO 1 – Curva de calibração determinada para 4-vinilguaiacol por CG-EM. ... 88
ANEXO 2 – Curva de calibração determinada para ρ-nitrofenol no ensaio de atividade do transportador AGT1. ... 89
ANEXO 3 – Curvas de calibração determinadas para alcoóis superiores, ésteres, acetaldeído e diacetil no headspace. ... 90
ANEXO 4: Curva de calibração determinada para etanol. ... 92
ANEXO 5: Membros da ACERVA/MG responsáveis pela análise sensorial das cervejas produzidas com as cepas LBCM 45 e LBCM 78. ... 93
ANEXO 6: Ficha de avaliação traduzida recomendada pela BJCP ... 94
1 1. INTRODUÇÃO
1.1 Bebidas fermentadas
Há mais de 12 mil anos o homem consome alimentos fermentados, mas a identificação dos micro-organismos como responsáveis pelo processo fermentativo aconteceu apenas em 1665. Bioquimicamente é chamado fermentação o processo de produção de energia, a partir de compostos orgânicos, por micro-organismos. O processo da fermentação na produção de alimentos gera diversos benefícios, como a conservação dos alimentos pela produção de compostos que inibem a proliferação de outros micro-organismos; o aumento da segurança alimentar, pela inibição de patógenos; o incremento do valor nutricional, além da melhoria da qualidade sensorial do produto, pela produção de substâncias aromatizantes (Bourdichon et al., 2012).
As leveduras constituem o principal grupo de micro-organismos eucariotos utilizados na fermentação de alimentos e bebidas. Das mais de 600 espécies de leveduras conhecidas, merecem destaque as espécies do gênero Saccharomyces (Sicard & Legras, 2011). A espécie Saccharomyces cerevisiae é o agente fermentativo utilizado na produção de vinho, saquê, cerveja, cachaça, pão, entre outros. A comparação entre cepas selvagens e domesticadas de S. cerevisiae revelou que as linhagens selvagens são mais antigas e detêm maior variabilidade genética. Desse modo, através de intervenção humana, algumas cepas foram selecionadas pelo ambiente de produção por apresentarem características que favoreciam o processo e/ou o produto final (Sicard & Legras, 2011).
Além da utilização na produção de vinho, saquê e pão, leveduras da espécie S.
cerevisiae são também responsáveis pela fermentação do caldo de cana para fabricação da cachaça. De acordo com a legislação brasileira, cachaça é a bebida obtida pela destilação do mosto fermentado de cana-de-açúcar, com graduação alcoólica de 38 a 54% (v/v), à temperatura de 20°C, com características sensoriais peculiares (Brasil, 2005).
2 utilização de leveduras selecionadas, contribuindo para a padronização do processo (Pataro et al., 1998).
Estudos conduzidos no Laboratório de Biologia Celular e Molecular (LBCM) do Núcleo de Pesquisas em Ciências Biológicas (NUPEB) da Universidade Federal de Ouro Preto (UFOP), coordenado pelo Prof. Rogelio Lopes Brandão, permitiram o desenvolvimento de uma estratégia de isolamento e seleção de cepas de Saccharomyces
cerevisiae com características adequadas à produção de cachaça de alambique de qualidade. Esta metodologia, patenteada por Vicente e colaboradores (2003), combina a seleção de cepas com características de interesse, como a alta resistência a diferentes tipos de estresse (temperatura; alta osmolaridade; presença de etanol), a capacidade de floculação, a incapacidade de produzir ácido sulfídrico e a alta atividade invertásica. Além disto, são utilizados testes de resistência a drogas específicas (trifluor-D,L-leucina e cerulenina) com a finalidade de selecionar cepas com alta capacidade de produção de alcoóis superiores e seus ésteres. Cerca de uma centena de leveduras já foram isoladas, utilizando este procedimento, a partir de diferentes unidades produtoras de cachaça existentes em Minas Gerais, Bahia, Rio de Janeiro e Espírito Santo.
Além da cachaça, a cerveja é outra bebida fermentada produzida por leveduras do gênero Saccharomyces. Acredita-se que a cerveja tenha surgido no Oriente Médio ou no Egito. Muitos indícios sugerem que o estabelecimento e a organização do processo de fabricação da cerveja tenham ocorrido por volta de 6000 anos a.C. (Morado, 2009). Sendo uma bebida obtida pela fermentação de grãos, a cerveja exercia um importante papel na alimentação diária da população, por ser fonte de nutrientes, além de apresentar reduzida carga de micro-organismos (Morado, 2009).
1.2 A produção de cervejas
Até a Idade Média, a produção de cerveja não passava de uma atividade caseira destinada ao consumo doméstico. A partir do século VI, os mosteiros passaram a fabricar a bebida, que adquiriu o seu sabor característico pelas mãos dos monges, os quais introduziram também na formulação o lúpulo, ingrediente usado como fator de amargor e também por suas propriedades antimicrobianas (Morado, 2009).
3 conhecimento da existência das leveduras, estas não foram citadas. Além da preocupação com o estabelecimento de padrões para o processo de fabricação da cerveja, a lei também tinha o objetivo de controlar a demanda de trigo, pois o grande consumo de trigo para a fabricação de cerveja estaria encarecendo o pão. A aceitação da
Reinheitsgebot se espalhou gradativamente da Baviera para regiões vizinhas. Porém, ao final do século XX, a competição no mundo globalizado forçou a adição de adjuntos (milho, arroz) para garantia da produção de grandes volumes de cerveja a um baixo custo (Morado, 2009). A legislação brasileira permite o uso dos seguintes adjuntos: arroz, trigo, milho, aveia e sorgo, desde que a cerveja contenha, no mínimo, 20% de malte de cevada (Brasil, 1997).
4 Figura 1: Diagrama esquemático da produção de cervejas.
Na etapa seguinte, conhecida como brassagem, será realizada a moagem do malte, a mosturação, a filtração do mosto, sua fervura e resfriamento. O malte é moído para que seja liberado o conteúdo dos grãos de cevada, que, durante a mosturação, serão suspensos em água e aquecidos para solubilizar o conteúdo e permitir a ação das amilases. Na sequência, os sólidos são removidos e o mosto é clarificado, fervido e resfriado antes que seja iniciada a fermentação (Morado, 2009). Vale ressaltar que a água é um ingrediente fundamental na produção de cervejas, e compõe até 90% do produto final. Até o século XIX, a disponibilidade de água de boa qualidade (insípida,
Malte
Maceração
Germinação
Secagem
Cevada
Maltagem
Água
Lúpulo
Adjuntos
Brassagem
Fervura
Moagem
Mosturação
Filtração
Fervura
Resfriamento
Mosto
Fermentação principal
Leveduras
Fermentação secundária
Filtração
Cerveja verde
Pasteurização
Envase
5 inodora, com pH e quantidade apropriada de minerais) favoreceu o estabelecimento das cervejarias em determinadas regiões. Hoje, existem técnicas que permitem modificação da água, através da remoção ou adição de minerais (Morado, 2009).
No passo seguinte, o mosto é fervido com lúpulo. A etapa de fervura tem como objetivos esterilizar o mosto e inativar as enzimas do malte. Depois de fervido, o mosto é resfriado e colocado no tanque de fermentação (Morado, 2009). A adição do lúpulo (Humulus lupulus) é fundamental para conferir às cervejas o amargor característico. Além disso, seus aromas também podem conferir às cervejas notas herbais, florais e frutais (Morado, 2009). Outra importante função do lúpulo nas cervejas é sua ação antimicrobiana, uma vez que bactérias gram-positivas são sensíveis aos seus α- e iso-α -ácidos (Hazelwood et al., 2010).
Antes da fermentação, o mosto é oxigenado para favorecer a multiplicação das células de leveduras. No momento em que as leveduras são adicionadas, se inicia a fermentação principal e esta termina quando a maior parte dos açúcares fermentáveis já tenha sido utilizada. Em alguns casos, a fermentação pode parar mesmo que ainda haja açúcares fermentáveis mas, por alguma razão, as leveduras não são capazes de metabolizá-los (Morado, 2009).
A fermentação é resultado do metabolismo das leveduras que são capazes de converter açúcares fermentáveis em dióxido de carbono e etanol. Além destes, outros subprodutos metabólicos podem ser gerados durante a fermentação, os quais, juntamente com aqueles provenientes do malte e do lúpulo, serão os responsáveis por formar o flavour (aroma e sabor) das cervejas (Olaniran et al., 2011; Lei et al., 2012).
Durante a etapa fermentativa da produção de cervejas, as leveduras são expostas a diversas condições de estresse que podem afetar sua viabilidade. Dentre elas, podemos citar: alta pressão osmótica, alta pressão hidrostática, altas concentrações de etanol, anaerobiose, oscilações de temperatura e limitação de nutrientes (Tarapel et al., 2008; Lei et al., 2012).
6 sensorial (threshold) (Duong et al., 2011). A redução da presença do diacetil é o passo limitante da velocidade de maturação da cerveja (Dassari & Kolling, 2011).
Além da redução da concentração de diacetil, a maturação também contribui para a clarificação das cervejas pela sedimentação das células e de outros componentes que causam turbidez à bebida, além da saturação de gás carbônico. Após a maturação, o produto obtido é filtrado, pasteurizado e engarrafado. Algumas cervejarias realizam o processo de re-fermentação nas garrafas através da introdução de açúcares fermentáveis ao produto obtido, durante o envase. Os objetivos da re-fermentação são o enriquecimento do perfil aromático, a carbonatação e o aumento do teor alcoólico das cervejas (Morado, 2009).
1.3 Leveduras das cervejas
As cervejas podem ser agrupadas em estilos e uma das classificações mais aceitas mundialmente é a do Beer Judge Certification Program (BJCP), que desenvolveu um Guia de Estilos de cervejas, hidromel e sidra. De modo geral, os estilos de cervejas podem ser agrupados em: ale, lager e estilos mistos. A denominação ale e lager também é empregada na classificação das leveduras responsáveis pela fermentação da bebida.
As primeiras cervejas produzidas eram do tipo ale e alguns parâmetros de produção as diferenciam das cervejas lager. Tradicionalmente, cervejas ale são fermentadas entre 16 e 25°C, enquanto as lager fermentam em mais baixas temperaturas, entre 6 e 15°C (Morado, 2009; Vidgren et al., 2010). Além disso, cervejas ale apresentam maiores concentrações de ésteres e alcoóis superiores (Zhimin
et al., 2012). O período e a temperatura da maturação também são distintos, sendo que para cervejas lager, a maturação acontece a 0°C por cerca de 1 a 3 semanas, enquanto para cervejas ale essa etapa dura de 3 a 4 dias a 4°C (Morado, 2009).
7 advento do comércio transatlântico. Portanto, S. pastorianus trata-se de uma espécie exclusiva do meio produtivo, e ausente naturalmente no ambiente.
Figura 2: Modelo de formação das espécies S. pastorianus e S. bayanus. (Libkind et al., 2011).
O genoma híbrido parece ter conferido um elevado grau de resistência, da levedura lager, à diferentes condições de estresse impostas pelo meio, como a capacidade de fermentar em baixas temperaturas, pH baixo, concentrações elevadas de etanol, elevada pressão osmótica e anaerobiose (Querol & Bond, 2009).
Algumas características fisiológicas permitem a diferenciação das espécies S.
cerevisiae e S. pastorianus. Esses critérios de diferenciação, aplicados a cepas cervejeiras, são descritos pela American Society of Brewing Chemists (ASBC). De acordo com a ASBC, cepas ale são capazes de crescer a 37°, mas as lager, não. Conforme descrito por Giudici et al., (1998), a temperatura ideal para o crescimento das cepas ale é maior do que para as cepas lager. Cepas ale fermentam melhor a temperaturas mais elevadas (aproximadamente 20°C), enquanto cepas lager apresentam melhor desempenho entre 6 e14°C. Esta diferença pode, pelo menos em parte, ser explicada pela diferença na capacidade de utilização de açúcares em baixas temperaturas.
8 O perfil de floculação também contribui para diferenciação de cepas ale e lager. O processo de floculação é definido como assexual, reversível e cálcio dependente no qual as células de leveduras se agregam e sedimentam no fundo do tanque de fermentação (Bony et al., 1997; Stratford, 1989).
1.4 Processo de floculação
O processo de floculação é importante durante a fabricação de cervejas, pois facilita a remoção da biomassa celular, reduzindo os custos de produção. A floculação é um processo complexo, sujeito à expressão dos genes FLO e fortemente influenciado por fatores ambientais tais como a presença de nutrientes, pH, aeração, temperatura e presença de cátions (Sampermans et al., 2005; Soares, 2010; Panteloglou & Smart, 2012). No genoma de S. cerevisiae S288C foram identificados 33 genes associados à floculação, entre os quais se destacam os genes FLO localizados nos extremos dos cromossomos próximos aos telômeros, a exceção do gene FLO11 (Heine et al., 2009; Soares, 2010).
Estruturalmente os genes FLO apresentam três domínios. O domínio amino-terminal contém os sítios de ligação aos receptores de carboidratos (mananas), seguido pelo domínio central extremamente rico em resíduos de serina e treonina e, por último, o domínio carboxi-terminal, que contém o sítio de ligação covalente ao glicosil fosfatidil inositol, molécula de ancoragem. Os genes FLO contêm repetições intragênicas em tandem e a intensidade da floculação é proporcional ao número dessas repetições (Verstrepen et al., 2004; He et al., 2012). Enquanto os genes FLO1,
Lg-FLO1, FLO5, FLO9 e FLO10 têm sido relacionados à formação de flocos macroscópicos, o gene FLO11 tem sido relacionado também ao crescimento adesivo e invasivo, à formação de pseudo-hifas e a formação de biofilmes (VanMulders et al., 2010; Bauer et al., 2010; Goossens & Willaert, 2010). O produto do gene FLO8 é um ativador transcricional de FLO1 e FLO11. A cepa laboratorial S288C apresenta uma mutação no gene FLO8 e devido a isso, não é floculante (Liu et al., 1996).
9 a correta conformação das lectinas. Assim, as floculinas, sintetizadas somente por leveduras floculantes, são exportadas até a porção externa da parede celular e interagem com mananas que estão presentes na parede mesmo de células não floculantes (Soares, 2010; Bauer et al., 2010). Além das interações específicas floculina-açúcar, existem outras interações inespecíficas, tais como ligações de hidrogênio e interações hidrofóbicas, que reforçam e estabilizam a floculação (Soares, 2010).
Por outro lado, o domínio N-terminal da floculina Flo11p, não apresenta ligação com manose e sim pode apresentar uma auto-ligação com outro domínio N-terminal Flo11p (interação homotípica) como foi demonstrado por microscopia de fluorescência por Goosens & Willaert (2011).
Em S. cerevisiae, foram caracterizados dois fenótipos principais de floculação: Flo1 e NewFlo. Cepas de fenótipo Flo1 apresentam floculação constitutiva, sendo que a presença de manose ou de seus derivados no meio é capaz de inibir a floculação. O fenótipo Flo1 está associado à expressão dos genes FLO1, FLO5 e FLO9, presentes nas cepas laboratoriais S. cerevisiae. Por outro lado, a floculação de células cujo fenótipo é NewFlo, ocorre na fase estacionária e é sensível à presença de manose, glicose, sacarose e maltose no meio. O gene Lg-FLO1 (ou FLONS), homólogo ao FLO1, é o responsável pelo fenótipo New-Flo em cepas lager (Kobayashi et al., 1998). A característica mais importante da floculação tipo NewFlo é sua inibição durante a fermentação, ou seja, quando a concentração dos carboidratos presentes no mosto (maltose e glicose) é suficientemente alta. Neste caso, se estabelece uma união competitiva dos carboidratos pelas floculinas, assegurando que a floculação ocorra no momento apropriado, quando os açucares fermentáveis tenham diminuído (Van Mulders et al., 2010).
Um terceiro fenótipo, MI, foi descrito em células cuja floculação é insensível à presença de manose, devido a uma aparente falta de especificidade para ligação a este açúcar, além de ser independente da presença de cálcio. Sugere-se que, neste caso, a floculação ocorra por interações hidrofóbicas ou outras interações que não envolvam manose, como no caso de Flo11p (Bauer et al., 2010; Panteloglou & Smart, 2012).
1.5 Conteúdo de carboidratos do mosto cervejeiro e metabolismo de açúcares durante a fermentação
10 ligação α-1,4. A maltose representa 50 a 60% dos açúcares totais fermentáveis do mosto. Dois outros açúcares, a maltotriose e a glicose, podem ser encontrados no mosto em uma proporção de 15 a 20% e 10 a 15%, respectivamente (Saerens et al., 2010). A maltotriose é um trissacarídeo que consiste de três subunidades de glicose, unidas através de ligações α-1,4. Ambos, maltose e maltotriose, são hidrolisados pelas leveduras em subunidades de glicose, por uma α-glicosidase intracelular (maltase), que tem a mesma afinidade para ambos os açúcares (Zastrow et al., 2000).
A fração não fermentável dos açúcares do mosto é constituída principalmente por dextrinas, que são carboidratos com quatro ou mais subunidades de glicose. Além das dextrinas, o mosto também contém uma fração de β-glucanos e uma pequena fração de pentoses como, por exemplo, a arabinose e a xilose. As dextrinas não são utilizadas pelas leveduras, contribuindo para o sabor das cervejas (Zastrow et al., 2000).
A barreira entre o exterior e o interior das células de leveduras é formada pela parede celular, a membrana plasmática e o espaço periplasmático, localizado entre estas duas. A parede celular das leveduras é porosa e os açúcares são capazes de passar através dela. Assim, a entrada de açúcares para o interior das células está relacionada à sua capacidade de transpor a membrana plasmática através de transportadores. Esses transportadores se ligam especificamente aos açúcares do meio, transportando-os para dentro das células de leveduras. Alguns dos transportadores de açúcar são altamente específicos, enquanto que alguns possuem uma vasta gama de substratos (Bisson et al., 1993).
Leveduras de cervejas podem utilizar uma grande variedade de açúcares, mas quando estão presentes vários açúcares simultaneamente, as leveduras tendem a utilizá-los de forma sequencial. O açúcar mais facilmente assimilado é a glicose, que é transportada para dentro das células pelos transportadores de hexose (HXTs) (Wieczorke et al., 1999). A glicose é o substrato preferencial dentre todos os outros carboidratos e, quando presente, é capaz de reprimir a captação de outros açúcares, como a maltose e maltotriose. Geralmente, a presença de glicose no meio provoca a denominada repressão catabólica, permitindo que a absorção de maltose só inicie, quando cerca de 60% da glicose tenha sido utilizada (Bisson et al., 1993).
11 A maltotriose não possui os seus próprios transportadores específicos, mas é transportada por alguns, mas não todos, os transportadores de maltose. A competição pelos transportadores de maltose faz com que a maltotriose seja utilizada depois que a maior parte da maltose foi assimilada (Salema Oom et al., 2005).
1.6 Transportadores de maltose e maltotriose
Vários estudos têm mostrado que a taxa de fermentação de maltose e maltotriose está mais relacionada com seu transporte do que com a atividade da maltase (Meneses et
al., 2002; Rautio & Londesborough, 2003). Portanto, o fator limitante na utilização destes dois açúcares é o transporte, e não a hidrólise.
Nem todas as cepas de S. cerevisiae são capazes de metabolizar toda a maltotriose presente no meio, resultando em uma cerveja com baixo teor de etanol e alta concentração de açúcar residual (Saerens et al., 2010), o que é considerado um problema industrial. A utilização de maltotriose se difere para cepas ale e lager. Essas últimas apresentam maior eficiência e consequentemente menores valores de maltotriose residual (Alves Jr. et al., 2008).
Vale ressaltar que, o perfil de absorção de açúcar apresentado por leveduras de cervejas se difere acentuadamente do apresentado por cepas laboratoriais. Cepas de laboratório geralmente não são capazes de metabolizar maltose ou maltotriose (Dietvorst et al., 2005; Meneses et al., 2002).
No final da fermentação, o aumento da concentração de etanol e a redução da abundância de nutrientes no meio promovem a redução do metabolismo das leveduras. Guimarães e colaboradores (2006) mostraram que o transporte de maltose é afetado pela composição lipídica das membranas celulares das leveduras. O funcionamento adequado dos transportadores de maltose requer quantidades adequadas de ergosterol nas leveduras. Este efeito pode explicar, em parte, a baixa taxa de absorção de maltose e maltotriose na segunda metade das fermentações de cervejas, quando o teor de esteróis da levedura decrescem. Uma vez que outras causas também podem reduzir a captação de maltose e maltotriose no final da fermentação, é importante que a utilização desses açúcares inicie o mais rapidamente possível e aconteça a uma alta taxa.
12 velocidades de absorção de maltose e maltotriose também são dependentes do pH do meio. O aumento do pH do mosto reduz a absorção de maltose, sendo 5,0, o pH ótimo para absorção de maltose e maltotriose (Meneses et al., 2002).
Atualmente, são conhecidos quatro tipos diferentes de transportadores de maltose e/ou maltotriose caracterizados em S. cerevisiae e/ou S. pastorianus. São eles: Malx1, Agt1, Mphx e Mtt1.
Em S. cerevisiae, os genes MAL (MAL1, MAL2, MAL3, MAL4 e MAL6), MPH2 e MPH3 estão relacionados ao transporte de maltose e turanose. Já o gene AGT1 codifica para um transportador de α-glicosídeos, como a trealose, sacarose e maltotriose (Vidgren et al., 2010). Praticamente todas as cepas cervejeiras possuem o gene AGT1 e altos níveis de expressão do mesmo, durante a fermentação do mosto (Alves Jr. et al., 2008). De acordo com Vidgren e colaboradores (2010), cepas lager possuem stop
codons (códons de parada) prematuros no gene AGT1. Por outro lado, estas cepas apresentam o gene MTT1, que codifica para um transportador de alta afinidade para maltotriose e maltose e cuja atividade está relacionada à baixas temperaturas. A presença do gene MTT1 permite que cepas lager apresentem maior eficiência de fermentação em baixas temperaturas em relação às cepas ale.
1.7 Compostos voláteis na produção de cervejas
As duas maiores características desejadas para leveduras empregadas no processo de fabricação de cervejas são: alta eficiência no processo produtivo e alto padrão de qualidade do produto final. A qualidade sensorial de bebidas alcoólicas está estritamente relacionada às concentrações equilibradas de compostos secundários que podem ser provenientes, tanto das matérias primas, quanto do metabolismo das leveduras utilizadas (Saerens et al., 2010).
13 Figura 3: Vias biossintéticas de compostos voláteis em Saccharomyces cerevisiae (Kobayashi et al, 2008).
Os principais compostos secundários que influenciam positivamente o aroma das bebidas obtidas por fermentação são os álcoois superiores e os ésteres (Kobayashi et al., 2008). Os alcoóis superiores são constituídos de mais de dois átomos de carbono, formados durante o processo fermentativo como subprodutos do metabolismo de aminoácidos. Estes alcoóis são diretamente responsáveis pelo flavour da bebida, possuindo aromas característicos, destacando-se os alcoóis propílico, isoamílico e o isobutílico. Em cervejas, o álcool isoamílico é capaz de conferir à bebida o flavour de banana. Existem, ainda, álcoois superiores aromáticos, como o 2-feniletil etanol e tirosol. A formação dos álcoois superiores é proveniente do desvio do metabolismo dos aminoácidos pelas leveduras, quando o cetoácido envolvido é descarboxilado a aldeído, com posterior redução a álcool superior. Os cetoácidos podem ser formados a partir de duas vias metabólicas distintas: a via catabólica de Erlich, pela degradação de aminoácidos, e a via anabólica envolvendo a síntese de aminoácidos ramificados. A formação dos alcoóis superiores é favorecida pela presença de leveduras lager, por baixo pH e por altas temperaturas do mosto. (Horak et al, 2008).
14 Comparado aos alcoóis superiores, os ésteres são produzidos em concentrações muito baixas, muito aquém do limite de percepção olfativa humana. Ainda assim, e devido ao efeito matrix, ocorre uma sinergia entre as substâncias, provocando uma sensação olfativa agradável ao consumidor (Saerens et al, 2008b).
Em bebidas, os ésteres de acetato têm recebido maior atenção, pois encontram-se em maior concentração, se comparados com os ésteres de ácidos graxos de cadeia média, sendo, portanto, mais facilmente caracterizados pelos métodos de detecção disponíveis. Além disto, os genes que codificam para enzimas envolvidas em suas sínteses foram descobertos há mais tempo, sendo essas proteínas mais facilmente secretadas por células de leveduras. Do ponto de vista sensorial, destacam-se: acetato de etila, acetato de isoamila e acetato de feniletila (Saerens et al, 2008b).
A formação dos ésteres de acetato acontece pela transferência de grupo acetil (a partir do acetil-Coa) para um álcool superior, numa reação catalisada pela enzima álcool acetil transferase (Atf1 e Atf2). Alternativamente, esta síntese pode ocorrer pela transferência de grupo acetil (a partir do ácido acético) para o álcool superior, numa reação catalisada pela enzima álcool acil transferase ou pela esterificação do etanol com um ácido graxo (Verstrepen et al, 2003).
Os ésteres de ácidos graxos de cadeia média têm merecido progressivamente maior destaque, devido ao fato de que os genes que codificam para as enzimas envolvidas na sua biossíntese terem sido descritos apenas recentemente. Estes ésteres apresentam como características marcantes o fato de que são produzidos em concentrações muito baixas, sendo sua secreção, por parte das leveduras, fortemente influenciada pela extensão da cadeia do ácido graxo constituinte. Os principais representantes são: hexanoato de etila, octanoato de etila e decanoato de etila, que, em cervejas, apresentam flavour de maçã, ou frutado (Kobayashi et al, 2008).
15 Como mencionado, durante a etapa de maturação das cervejas, o diacetil é metabolizado pelas leveduras, gerando subprodutos com menor impacto no flavour da bebida. Por outro lado, o acetaldeído, produto intermediário da conversão de piruvato a etanol, também pode ser encontrado em cervejas e considerado um off flavour, por conferir à bebida o aroma de folhas verdes (Kobayashi et al.,2008).
Nas cervejas, também podem ser encontrados outros compostos como o sulfito e o sulfeto de hidrogênio. O sulfeto de hidrogênio é considerado um off flavour, sendo indesejável sua presença no produto final. Como estes compostos são subprodutos da fermentação, a capacidade de produção dos mesmos pode ser considerada uma característica indesejável, durante a seleção de cepas para a produção de bebidas (Ikushima et al., 2012).
Alguns aspectos relativos à produção de cervejas pode influenciar a formação de compostos secundários durante a fermentação, como, por exemplo:
1.7.1 Concentração de sólidos solúveis
As concentrações iniciais de açúcares presentes no mosto são chamadas de gravidade específica original (OG). A densidade do mosto cervejeiro é medida em graus Plato (°P), ou percentual de sólidos solúveis em 100g de mosto (Saerens et al., 2008a). É considerado um mosto com gravidade normal (normal gravity), aquele que contém entre 11 e 12°P, com alta gravidade (high gravity), entre 14 e 17°P e com muito alta gravidade (very high gravity) um mosto que contenha entre 18 e 25°P (Huuskonen et
al.,2010).
A alta concentração de sólidos solúveis aumenta a produção de ésteres de acetato, tanto para leveduras ale, quanto para leveduras lager, promovendo um claro aumento nas concentrações finais de acetato de etila, acetato de isoamila e hexanoato de etila. Para cepas do tipo ale, a concentração de alcoóis superiores também aumenta quando a concentração de sólidos solúveis é maior (Saerens et al, 2008a).
1.7.2 Temperatura
16 elevadas (22,5 a 30ºC), lembrando que caracteristicamente estas leveduras fermentam a temperaturas mais baixas (7 a 15ºC). Por outro lado, quando utilizadas cepas ale, somente a concentração do éster acetato de feniletila parece aumentar com o aumento da temperatura (Olaniran et al, 2011).
1.7.3 Tamanho do inóculo - pitching rate
Tendo em vista que a fermentação durante a produção de cervejas é uma etapa que consome muito tempo (cerca de 1 a 2 semanas), várias estratégias têm sido estudadas para superar esta dificuldade. Dentre elas, destacam-se a realização de fermentação contínua usando leveduras imobilizadas e a utilização de uma maior quantidade de células em suspensão nos fermentadores (Smogrovicova & Domeny, 1999).
O aumento do tamanho do inóculo reduz consideravelmente o chamado tempo de atenuação, ou seja, o tempo necessário para que as leveduras fermentem e reduzam os açúcares presentes no mosto. Muito embora o aumento do tamanho do inóculo, durante a produção de cervejas, não afete a produção de substâncias on flavours, observa-se grande aumento na produção de dicetonas vicinais (compostos considerados
off flavours) (Verbelen et al, 2009).
17 2. JUSTIFICATIVA
A cerveja é a bebida alcoólica mais consumida no mundo e, quando comparada às não alcoólicas, ocupa a terceira posição, ficando atrás apenas da água e do chá. Mais de 80% de toda a cerveja consumida mundialmente são do estilo lager, seguida das cervejas especiais (11,01%) (Morado, 2009). Segundo dados divulgados pela The Barth
Report (http://www.barthhaasgroup.com/images/pdfs/Barth_Bericht_2012_Englisch .pdf), em 2011 o Brasil figurou na terceira posição entre os maiores produtores mundiais de cerveja, com 133 mil hectolitros, perdendo apenas para China (489,88 mil hectolitros) e para os Estados Unidos (225,33 mil hectolitros).
Hoje, o mercado brasileiro é dominado pelas mega-cervejarias comerciais que são capazes de comercializar volumes expressivos de diversas marcas. Em contraposição, na segunda metade da década de 1980, dezenas de micro-cervejarias foram criadas no Brasil. Com origem doméstica ou a partir de estabelecimentos comerciais, essas micro-cervejarias passaram a produzir cervejas mais personalizadas, com qualidade diferenciada. Esse produto diferenciado é também resultado do anseio de parte do público consumidor que busca sabores peculiares (Morado, 2009).
Três, dos quatro principais ingredientes da cerveja, não são produzidos no Brasil: cevada, lúpulo e fermento (leveduras). Juntos, Europa, Rússia e Canadá são responsáveis por 70% de toda a produção de cevada do mundo e 80% da produção de lúpulo é realizada na Alemanha, Estados Unidos, China e República Tcheca.
As leveduras comerciais utilizadas hoje para fabricação de cerveja são o resultado de centenas de anos de seleção em mosto cervejeiro. No entanto, esta seleção parou há cerca de 40 anos atrás, e os mestres cervejeiros passaram a armazenar suas linhagens como culturas puras. Hoje em dia, essas culturas são propagadas para produção em grande escala e, nas cervejarias, podem se recicladas de 5 a 20 vezes, dependendo da fábrica (Huuskonen et al., 2010).
19
3. OBJETIVOS
3.1 Objetivo geral
Caracterizar bioquímica e molecularmente cepas de S. cerevisiae, isoladas de dornas de fermentação de cachaça, visando à produção de cervejas.
3.2 Objetivos específicos
a) Avaliar bioquimicamente as cepas de leveduras provenientes de dornas de fermentação de cachaça, frente às condições esperadas para o ambiente de produção de cervejas, tais como a composição do meio e a temperatura de fermentação.
b) Caracterizar molecularmente as espécies de leveduras isoladas de dornas de fermentação de cachaça.
c) Caracterizar as cepas quanto ao comportamento ale ou lager, a partir de critérios bioquímicos e moleculares.
d) Estudar características específicas das cepas, como a produção de compostos off flavours, resistência à altas concentrações de etanol e consumo de maltotriose, visando a melhoria da qualidade do produto final.
20
4. MATERIAIS E MÉTODOS
4.1 Cepas utilizadas
As cepas de S. cerevisiae utilizadas neste trabalho integram a coleção do Laboratório de Biologia Celular e Molecular/UFOP e foram selecionadas de dornas de fermentação de cachaça conforme a metodologia descrita por Vicente e colaboradores (2003) (Tabela 1).
A cepa S. cerevisiae BY 4741 foi utilizada como controle laboratorial e as cepas comerciais W-34/70, S-04, US-05 e WB-06 foram utilizadas como controles industriais da produção de cerveja.
21 Tabela 1: Micro-organismos utilizados neste trabalho.
Cepas Espécie Origem
LBCM 0 Saccharomyces cerevisiae Coleção LBCM LBCM 01 Saccharomyces cerevisiae Coleção LBCM LBCM 06 Saccharomyces cerevisiae Coleção LBCM LBCM 10 Saccharomyces cerevisiae Coleção LBCM LBCM 12 Saccharomyces cerevisiae Coleção LBCM LBCM 13 Saccharomyces cerevisiae Coleção LBCM LBCM 15 Pichia guilliermondii Coleção LBCM LBCM 20 Saccharomyces cerevisiae Coleção LBCM LBCM 21 Saccharomyces cerevisiae Coleção LBCM LBCM 29 Saccharomyces cerevisiae Coleção LBCM LBCM 32 Saccharomyces cerevisiae Coleção LBCM LBCM 37 Saccharomyces cerevisiae Coleção LBCM LBCM 45 Saccharomyces cerevisiae Coleção LBCM LBCM 67 Saccharomyces cerevisiae Coleção LBCM LBCM 78 Saccharomyces cerevisiae Coleção LBCM LBCM 80 Saccharomyces cerevisiae Coleção LBCM LBCM 89 Saccharomyces cerevisiae Coleção LBCM LBCM 90 Saccharomyces cerevisiae Coleção LBCM LBCM 91 Saccharomyces cerevisiae Coleção LBCM LBCM 92 Saccharomyces cerevisiae Coleção LBCM LBCM 96 Saccharomyces cerevisiae Coleção LBCM BY 4741 Saccharomyces cerevisiae Cepa laboratorial
W-34/70 Saccharomyces pastorianus Cepa comercial cervejeira S-04 Saccharomyces cerevisiae Cepa comercial cervejeira US-05 Saccharomyces cerevisiae Cepa comercial cervejeira WB-06 Saccharomyces cerevisiae Cepa comercial cervejeira BY4741 Saccharomyces cerevisiae Coleção Euroscarf
NCYC 388 Candida glabrata Coleção LBCM
NCYC 1006 K2 Saccharomyces cerevisiae UFMG
22 4.2 Meios de cultura
4.2.1 Meio YP
O meio YP é composto por extrato de levedura 1% (p/v) e peptona 2% (p/v). Para o meio sólido, foi acrescentado ágar 2% (p/v). Foram utilizadas diferentes fontes de carbono, como por exemplo, glicose e maltose.
4.2.2 Meio Bismuth Sulfite Agar (DIFCO Laboratories)
O meio Bismuth Sulfite Agar (DIFCO Laboratories) foi preparado conforme indicado pelo fabricante.
4.2.3 Meio YEPD-MB (Yeast Extract Peptone Dextrose – Methylene Blue)
O meio YEPD-MB (Yeast Extract Peptone Dextrose – Methylene Blue) é composto por extrato de levedura 1% (p/v), peptona 2% (p/v) e ágar 3% (p/v) em tampão citrato-fosfato 0,1M, pH 4,5. No momento do plaqueamento adicionou-se 0,01% de azul de metileno (Morais et al., 1997; Pataro et al., 1998; Vicente et al., 2007).
4.2.4 Meio mínimo YNB (Yeast Nitrogen Base)
O meio mínimo YNB, composto por 6,7 g/L de base nitrogenada sem aminoácidos e sem sulfato de amônio, foi preparado adicionando-se glicose 2% (p/v).
4.2.5 Meio Basal Agar
O meio basal é composto por glicerol 20 g/L, D-galactose 2g/L, extrato de levedura 10 g/L, peptona 20g/L e ágar 15g/L.
23 µ= 1 x dX = dlnX
X dt dt
As leveduras foram crescidas em tubos contendo 5mL de YP glicose 2% e YP maltose 2%, separadamente, sendo incubadas a 30°C por 48 horas sob agitação a 200 rpm (incubador rotatório New Brunswick Model G25). Foi calculado o volume necessário de cultura para ser inoculado em frasco Erlenmeyer com capacidade para 125 mL contendo 50 mL de YP glicose 2% e YP maltose, de modo que a D.O.600nm inicial estivesse entre 0,15 e 0,20, para cada fonte de carbono utilizada. Os frascos foram mantidos a 30°C, sob agitação a 200 rpm (incubador rotatório New Brunswick Model G25), por 72 horas, sendo recolhidas amostras e realizadas leituras de D.O.600nm a cada 2 horas. Foi calculada a velocidade de crescimento específica definida como a variação do número de células em relação ao tempo, definida pela seguinte equação:
onde: µ corresponde à velocidade específica de crescimento, X refere-se à biomassa celular, dX corresponde à variação da biomassa, dt representa a variação do tempo, e lnX é igual ao logaritmo neperiano do valor da biomassa celular.
4.4 Identificação de espécie
4.4.1 Extração do DNA genômico
24 permaneceram a -18°C overnight. Os tubos foram centrifugados por 20 minutos a 16000g (Micro-centrífuga Eppendorf 5415D). O sobrenadante foi transferido para um novo tubo e igual volume de isopropanol foi adicionado. Os tubos permaneceram a temperatura ambiente por 30 minutos e, em seguida, foram centrifugados por 10 minutos a 16000g (Micro-centrífuga Eppendorf 5415D). O sobrenadante foi descartado e o DNA foi lavado com etanol 70% (v/v). O pellet foi seco e em seguida ressuspendido em 20 µL de água purificada (Sistema Milli-Q Millipore).
4.4.2 Amplificação da região ITS-5.8S
Para amplificação da região ITS (internal transcribed spacer region) que corresponde à região intergênica do DNA ribossomal de leveduras, dois primers foram utilizados:ITS1 (5’ G TAG GTG AAC CTG CGG 3’) e ITS4 (5’ T CCG CTT ATT GAT ATG C 3’) conforme Oliveira e colaboradores (2008). A reação foi procedida em um volume final de 25 µL, o qual continha 3 µL de DNA genômico (3500 nM/µL), 1 µL de cada primer, Fw e Rv, (10 mM), 1 µL de dNTP (2,5 mM), 1,5 µL de Cloreto de magnésio 25 mM, 15,8 µL de água purificada (Sistema Milli-Q Millipore), 2,5 µL do tampão 10X (Fermentas) e 0,2 µL da Taq DNA polimerase (Fermentas). A amplificação passou por uma etapa inicial de desnaturação a 94°C durante 3 minutos, seguida por 39 ciclos de desnaturação a 94°C por 1 minuto, anelamento a 55°C por 1 minuto e extensão a 72°C por 2 minutos. Depois do último ciclo, houve uma extensão final a 72°C por 10 minutos. A análise do produto amplificado foi realizada por eletroforese em gel de agarose 1% (p/v) em tampão TAE 1X. O gel foi corado com brometo de etídeo (1 µg/mL) por 30 minutos e logo após, foi fotografado (Fotodocumentador AlphaImager® Mini). O marcador de 1KB DNA (Invitrogen) foi usado como padrão (Oliveira et al., 2008).
4.4.3 Digestão com enzimas de restrição
25 amplificado, 2 µL do tampão recomendado pelo fabricante, 0,7 µL da enzima HaeIII e 6,3 µL de água purificada (Sistema Milli-Q Millipore). Ao terceiro tubo epperdorf foram adicionados: 11 µL do fragmento amplificado, 2 µL do tampão recomendado pelo fabricante, 0,7 µL da enzima HinfI e 6,3 µL de água purificada (Sistema Milli-Q Millipore). A digestão com as enzimas de restrição foi conduzida a 37°C overnight. Após esse tempo, o produto da digestão foi submetido à eletroforese em gel de agarose 3% (p/v) em tampão TAE 1X. O gel foi corado com brometo de etídeo (1 µg/mL) por 30 minutos e em seguida, fotografado (Fotodocumentador AlphaImager® Mini). O marcador de DNA 100-3000bp (Axygen Biosciences) foi usado como padrão (Oliveira
et al., 2008).
4.5 Testes bioquímicos para diferenciação de cepas ale e lager
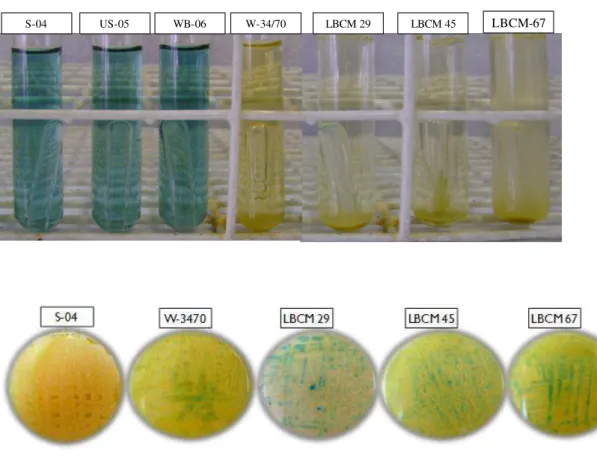
Para verificar a capacidade de fermentação de melobiose, as leveduras foram crescidas em placas de Petri contendo YP glicose 2% e incubadas a 30°C por 72 horas. Uma colônia isolada foi inoculada em tubo contendo 6 mL de meio YNB acrescido de 0,002% de verde de bromocresol, 280 mg de melobiose e um tubo de Durhan invertido. Os tubos foram incubados a 30°C por 8 dias. A presença de gás dentro dos tubos de Durhan e a mudança de coloração do meio, de amarelo para verde, devido à acidificação, representam resultado positivo para fermentação de melobiose (ASBC, 1998).
26 leveduras ale se apresentarão brancas, enquanto colônias de leveduras lager se tornarão azuis (ASBC, 1998).
4.6 Avaliação do crescimento em diferentes temperaturas
4.6.1 Avaliação do crescimento a 15, 20 e 30ºC
As leveduras foram crescidas em tubos contendo 4 mL de YP maltose 2% por 24 horas, sob agitação a 200 rpm (incubador rotatório New Brunswick Model G25). Em microplacas de 96 poços contendo 300 µL de YP maltose 2% foram inoculados os volumes necessários de cultivo para que a D.O.595nm inicial estivesse entre 0,1 e 0,15. As placas foram incubadas a 15°C. Outras 5 microplacas de 96 poços foram preparadas desse mesmo modo. Foram realizadas leituras de D.O.595nm nos tempos 0, 6, 12, 24, 48 e 72 horas, ou seja, a cada tempo, uma das placas preparadas foi submetida à leitura de D.O.595nm (Emax Precision Microplate Reader, Molecular Devices) para avaliação do crescimento das leveduras. O mesmo procedimento foi adotado para avaliação do crescimento a 20 e 30°C.
4.6.2 Avaliação do crescimento a 25 e 37ºC
As leveduras foram crescidas em tubos contendo 4 mL de YP glicose 2% por 24 horas sob agitação a 200 rpm (incubador rotatório New Brunswick Model G25). Os cultivos foram semeados em placas contendo YP glicose 2%. As placas foram incubadas a 25°C por 5 dias. O mesmo procedimento foi adotado para avaliação do crescimento a 37°C. As placas foram fotografadas (Fotodocumentador AlphaImager® Mini) (ASBC, 1998).
4.7 Avaliação da capacidade de floculação
4.7.1 Teste quantitativo de floculação
27 de EDTA 5M (pH 7,0) e ressuspendidas em tampão de lavagem, contendo sulfato de cálcio (0,5 g/L). Após centrifugação, as células foram ressuspendidas em tampão de suspensão, contendo sulfato de cálcio (0,5 g/L), acetato de sódio (6,8 g/L), ácido acético glacial (4,5g/L), e etanol 4% a um pH final de 4,5. Como controle, as células foram ressuspendidas em EDTA 0,5M (pH 7,0). Após agitação e um período de sedimentação de 15 minutos, foram coletadas alíquotas de 100 µL de sobrenadante de cada amostra, suspendidas em 900 µL de água destilada e realizada leitura de absorbância a D.O.600nm. Para cada cepa, foram realizadas seis réplicas e o percentual de floculação foi determinado para três determinações independentes pela seguinte fórmula:
% floculação = D.O.600nm Controle – D.O.600nm Experimental x 100 D.O.600nm Controle
A fim de verificar os fenótipos de floculação, conforme sua inibição pela presença de açúcares, também foram realizadas adições de manose 0,5 M ou glicose 0,5 M às soluções de lavagem e de suspensão, utilizadas durante o teste de Helm’s modificado.
Também foi determinada a capacidade de floculação a 15°C. Para tanto, os mesmos procedimentos foram aplicados, ajustando-se a temperatura de crescimento das cepas para 15°C.
4.7.2 Presença dos genes FLO
28 Tabela 2: Primers utilizados na identificação dos genes FLO para análise por PCR.
A reação de amplificação foi realizada em um volume final de 25 µL, o qual continha 3 µL de DNA genômico (3,5 µM/µL), 1 µL de cada primer, 1 µL de dNTP (2,5 mM), 1,5 µL de cloreto de magnésio 25 mM, 15,8 µL de água purificada (Sistema Milli-Q Millipore), 2,5 µL do tampão 10X (Fermentas) e 0,2 µL da Taq DNA polimerase (Fermentas). As condições de amplificação foram: uma etapa inicial de desnaturação a 94°C durante 3 minutos, seguida por 39 ciclos de desnaturação a 94°C por 1 minuto, anelamento a 55°C por 1 minuto e extensão a 72°C por 2 minutos. Depois do último ciclo houve uma extensão final a 72°C por 10 minutos. A análise do produto amplificado foi realizada por eletroforese em gel de agarose 1% (p/v) em tampão TAE 1X. O gel foi corado com brometo de etídeo (1 µg/mL), por 30 minutos e, em seguida, fotografado (Fotodocumentador AlphaImager® Mini). O marcador de DNA 1KB (Invitrogen) foi usado como padrão.
4.7.3 Teste de hidrofobicidade da superfície celular
A hidrofobicidade da superfície de células de leveduras é determinada pela taxa de distribuição dessas células em uma sistema bifásico composto por uma solução tamponada e um solvente orgânico (Van Holle et al., 2012). As leveduras foram crescidas em YP glicose 2% a 30°C, por 48 horas, sob agitação a 200 rpm (incubador rotatório New Brunswick Model G25). As células foram centrifugadas por 5 minutos a 2885g (Berkman Coulter Allegra X-12R) e, em seguida, lavadas com EDTA 100 mM (pH 7,0) (Govender et al.,2008; Van Holle et al., 2012). As cepas floculantes insensíveis ao EDTA (floculação cálcio independente), foram submetidas a 6 ciclos de 30 segundos em sonicador (Sonifier 250, Branson). As células foram centrifugadas por 5 minutos a 2885g (Berkman Coulter Allegra X-12R), o sobrenadante foi descartado e
Primer Sequencia (5’→ 3’)
FLO1- rep-FW CT AAG TCA ATC TAA CTG TAC TGT CCC TGA FLO1- rep-RV G ATA GAG CTG GTG ATT TGT CCT GAA
29 as células foram ressuspendidas em EDTA 100mM em volume suficiente para a concentração de 106 células/mL, contadas em Câmara de Neubauer. As células foram lavadas por 2 vezes em tampão PUM (fosfato de potássio, diidrogenofosfato de potássio, ureia e sulfato de magnésio, pH 7,0). Em seguida, as células foram ressuspendidas em 20 mL de tampão PUM. Foi retirada uma alíquota, diluída 10 vezes em água destilada e realizada a leitura da D.O.660nm, sendo esta considerada a D.O. inicial. Das células ressuspendias em tampão PUM, foi coletada uma alíquota de 2,4 mL e armazenada em tubos de borosilicato. Nestes tubos também foram adicionados 200 µL de xileno. Os tubos foram agitados (Vórtex 2 Genie) durante 30 segundos e posteriormente deixados em repouso, por 15 minutos. A fase aquosa da mistura foi retirada, diluída 10 vezes em água destilada e realizada a leitura da D.O.660nm, sendo esta considerada a D.O. final. O índice de hidrofobicidade modificado (MHI) foi calculado da seguinte forma:
MHI = 1 – (D.O. Final/ D.O. Inicial)
4.7.4 Detecção de resíduos de manose e glicose na parede celular por citometria de fluxo