FACULDADE DE
ME DICINA VE TE R INÁ R IA
E FICIÊNCIA
R E PR ODUTIVA
DE
MATR IZE S
DE
FR ANGO
DE
COR TE
S UPLE ME NTADAS
COM
CANTAXANTINA
É rica
Crosara
Ladir
de Lucca
Médica Veterinária
FACULDADE DE
ME DICINA VE TE R INÁ R IA
E FICIÊNCIA
R E PR ODUTIVA
DE
MATR IZE S
DE
FR ANGO
DE
COR TE
S UPLE ME NTADAS
COM
CANTAXANTINA
É rica
Crosara
Ladir
de Lucca
Orientador:
Prof.
Dr.
Marcelo
E mílio
Beletti
Tese apresentada à Faculdade de Medicina Veterinária - UFU, como parte dasexigê nciasparaa obtençã o do título de Doutor em Ciê ncias Veterinárias (Produçã o Animal).
L934e
2017 Lucca,Eficiê ncia ÉricaCrosara reprodutivaLadir dede, matrizes 1984 defrangode corte suplementadas com cantaxantina/ ÉricaCrosara Ladir deLucca.- 2017.
85p. : il.
Orientador:Marcelo Emílio Beletti.
Tese (doutorado) - Universidade Federal de Uberlândia, Programa dePós-GraduaçãoemCiê ncias V eterinárias.
Incluibibliografia.
1. V eterinária - Teses. 2. Frango de corte - Teses.3. Cromatina - Teses. 4. Carotenoides - Teses. I. Beletti, Marcelo Emílio. II. Universidade Federal de Uberlândia. Programa de Pós-Graduação em Ciê nciasV eterinárias. III. Título.
Primeiramente,agradeço a Deus pela oportunidade diáriade estar comminha família,amigos,nomeutrabalho e desenvolvendo minhas atividades.
Aos meus Pais, R egina e J amel, por toda os ensinamentos, princípios e pela luta. E aos meus irmã os Fernanda, pela singularidade de ser e pela amizade e ao J uliano, pela alegriade viver e por noster dado a Alice.
Ao meu marido R onald pela compreensã o, incentivo, parceria e por dividir comigotodos os momentos.
Aos meus avós Hermenegildo e Teresinha, que sã o mais do que presença física epor muitas vezesforam mais doque meus avós.
Á s minhas amigas, Patrícia Calixto, PatríciaTeixeira, Paula Braga, por serem mais queamigas,e simgrandes parceiras profissionais.
Aos meus colegas doIFTM, por toda a compreensã o e apoionesta etapa a ser concluída.
Aomeu orientador Prof. Beletti, por todo o aprendizado,paciê ncia,incentivoe parceria.
A Granja R egina, em especial ao E duardo Butolo, pelo apoio e incentivo a pesquisas emelhoriasno setor.
AoCentro de Microscopia da Universidade Federal deMinas Gerais. Ao Prof. E dnaldo, pelagrandeajuda e pelos ensinamentos.
Aoscolegas de laboratório, em especial aoS áviopelagrandeajuda.
A Célia, pela sua excelê ncia em atender-nos, mesmos nos momentos mais adversos.
Agradeço aosmembros da banca, que se disponibilizaram a ler este trabalho e auxiliar com seus conhecimentos.
Aos que me inspiram. Nã o consigo citar todos, sã o muitos(as), e certamente eles(as)sabem que tenhocomo referê ncia estes grandes mestres.
suplementadas com cantaxantina.Tese de doutorado em Ciê ncias Veterinárias. UFU. Uberlândia, MG.
R E S UMO
nas semanas 30 e 50 foi analisado o grau de compactaçã o de cromatina dos espermatozoides, na semana 40, o desenvolvimento testicular dos machos, e a fertilidade a partir das 50 semanas de vida do lote. Foram encontradas diferenças, entre o número de perfurações espermáticas, obtidos nas, 30, 40 e 50 semanas de idade, sendo que nas trê s idades observadas, a maior taxa de perfuraçã o dos espermatozoides ocorreu no lote suplementado com cantaxantina. Também foi verificado, neste estudo,melhores taxasdeeclosã onaidadede35a45 semanas de vida das aves, e maior taxa de fertilidade após as 50 semanas de vida, período em que a análise de fertilidade foi possível de ser realizada a campo. Com relaçã o ao tempo de vida analisado, o comportamento da média de perfurações na membrana perivitelínea dos ovos foi semelhante, apresentando queda proporcional na última semana testada. Os resultados da compactaçã o de cromatina dos espermatozoides indicarammaior grau de descompactaçã o parcialou total de galosnã o suplementados com a cantaxantina. Quando se analisou a idade, o tratamento que recebeu o antioxidante na dieta apresentoumenores alterações na compactaçã o de cromatina nas 50 semanas de vida, comparado a semana 30. Isto sugere que a adiçã o do antioxidante foi importante para a proteçã o dos efeitos da idadesobre os padrões de eficiê ncia reprodutiva. Na semana 30 de vida dos galos, a probabilidade de se observar alteraçõesna compactaçã o dacromatinade espermatozoides dosgalos nã o suplementados com cantaxantina é de 1,82 vezes maior do que nos galos suplementados, jánasemana50, essa probabilidade aumenta para 5,78 vezes, sendo nestecaso,maiora chance de se observaralterações na compactaçã o da cromatina dos espermatozoides de galos que nã o receberam oantioxidante na dieta. Concluiu-se que o uso da cantaxantina como agente antioxidante na dieta, pode minimizar os efeitos deletérios dos radicais livres sobre os espermatozoides, incluindoalterações nacromatina espermática.
supplemented with canthaxanthin. Doctoral thesis in Veterinary S ciences. UFU. Uberlândia, MG.
ABS TR ACT
weeks of age, and at the three ages observed, the highest sperm perforation rate occurred in the batch supplemented with canthaxanthin. In this study, we also observed better hatch rates at the age of 35 to 45 weeks of bird life, and a higher fertility rate after 50 weeks of life, during which fertility analysis was possible to be performed in the field. R egarding the life time analyzed, the behavior of the mean perforations in the peri-egg membrane of the eggs was similar, presenting a proportional drop in the last week tested. The results of chromatin compaction of spermatozoa indicated a higher degree of partial ortotal decompression of roosters notsupplementedwithcanthaxanthin. When analyzedfor age, antioxidant treatment in the diet showed smaller changes in chromatin compaction at 50 weeks of age compared to week 30. Thissuggests thatthe addition ofthe antioxidant was important in protecting the effectsofage on the Patterns of reproductive efficiency. At week30 of rooster life, the probability of observing changes in sperm chromatin compactionof roosters not supplemented with canthaxanthin is 1.82 times higher than in supplemented roosters at week 50, this probability increases to 5, 78 times, in this case, thegreaterthe chance of observing changes inthe chromatin compaction of the spermatozoa of roosters that did not receive the antioxidant in the diet. It was concluded that the use of canthaxanthin as an antioxidant in the diet can minimizethe deleterious effects of free radicals on spermatozoa, including changes in sperm chromatin.
I. INTRODU ÇÃO... 11
II. OB JETIV OS...15
III. REV ISÃODE LITERA TU RA ... 16
IV . M A TERIA L E M É TODOS ... 41
V . RESU LTA DOS...47
V I. DISC U SSÃO...54
V II. C ONC LU SÃO ...63
1. INTR ODUÇ Ã O
O agronegócio brasileiro cresce a cada ano, representando cerca de 23% do Produto Interno Bruto. De janeiro a setembro de 2016, por exemplo, acumulou crescimento de 4%, devido ao crescimento de alguns produtos comoo frango abatido que cresceu em média 3,8%. A avicultura corresponde a 20% deste PIB do agronegócio brasileiro(CNA,2017).
Neste contexto, temos o destaque para a cadeia de produçã o de carne de frango de corte brasileira como uma das mais importantes do mundo. O Brasil é o terceiromaior produtor mundial de carne defrango, ficandoatrás apenas dosE UA e da China. E , desde 2010, ocupa a liderança mundial na exportaçã o de carne de frango. (ABPA, 2017).
A oferta de carne de frango brasileira tem acompanhado o crescimento da demanda interna e externa, graças ao aumentoda competitividade e produtividade. Para atender aos mercados, as empresas de genética tê m trabalhado a fim de melhorar os índices zootécnicos do setor, como os de fertilidade e eclosã o das matrizes.
DUAR TE et al (2015), afirmaramque para maximizar a rentabilidade da cadeia de produçã o de frangos de corte, é necessário aumentar a produçã o de ovos e as taxas deeclosã opara obter descendentes maisviáveis.
Para a avicultura moderna, atender ótimos padrões de fertilidade é fundamental, pois uma das metas da indústria avícola éa produçã o de progê nie de alta qualidade:tantono setor deavesde corte quantono de postura, pois cada pinto produzido possui grande valor econômico(BONGALHAR DO, 2013).
Todo este avanço na avicultura industrialdeve ser acompanhado por práticas adequadas de manejo, sanidade e nutriçã o, para que o máximo potencial genético seja expresso.
Os radicais livres sã o elementos presentes nos processos produtivos e reprodutivos da avicultura, podendo causar danos através do processo de oxidaçã o dos sistemas biológicos.Os lipídeos presentes nos sistemas biológicos sã o oxidáveis em diferentes graus(NE LS ON&COX, 2006). Da mesma forma é importante salientar que os radicais livres podem causar danos diretos e indiretos à cromatina, variando desde alterações na compactaçã o a alterações no DNA (OPUWAR I e HE NKE L, 2016).
As reações de oxidaçã ode lipídeos em sistemasvivos, ocorrem principalmente em ácidos graxos que compõem os fosfolípideos presentes nas membranas e nas estruturas sub-celulares,levando ao seurompimento e causando disfunções e morte celular(LAGUE R R E et al.2007;WÓJ CIAK& DOLATOWS KI, 2012).
ROCHA etal,(2013), em sua pesquisarelatouqueapesar dos ovosem casca serem considerados resistentes à oxidaçã o lipídica, os lipídios da gema sofrem oxidaçã o durante o período de armazenamento, podendo resultar em reduçã o da energia disponível para o desenvolvimento do embriã o, além de apresentar compostostóxicos que poderia provocaramorte embrionária, fator esteque impactou negativamente na taxade eclosã o dosovos.
Outrosautores também descrevemoefeitodeletério nos ovos, no períodode armazenamento, sendo quanto maior o período de armazenamento dos ovos, maior é a oxidaçã o, tanto em condições refrigeradas(4°C) quantoem temperatura ambiente (25°C), sendo marcante o efeito da temperatura mais alta (FRANCHINI et al., 2002; CHE RIAN etal.,2007; GIAMPIE TR O et al., 2008).
OPUWARI e HE NKE L(2016) que além das alterações nos lipídeos, osradicais livres podemcausar danos diretos e indiretosno DNA de espermatozoides.
Tendo em vista que no processo de incubaçã o artificial, que ocorrenas granjas de matrizes pesadas, uma prática de manejo comum é o armazenamento de ovos, para a formaçã odos lotes de incubaçã o, se faz necessário uma atençã o especiala práticas demanejo e nutriçã o que possamminimizar os efeitos negativos da prática de armazenamento, nos resultadosde eclosã o.
E m outro aspectodosresultadosreprodutivos,temos a fertilidade dosovos. A infertilidade geralmente é medida como forma de se fazer gestã o a campo e ainda experimentalmente, como resultado de testes de manejo ou nutriçã o que visam identificar oportunidades de melhoriana reproduçã o (TR IQUE S , 2016).
fertilidade, estã o os lipídeos constituintes de sua membrana. E m todas asespécies, os fosfolipídios sã o os principais componentes lipídicos dos espermatozoides, caracterizados por conter grandes quantidades de ácidos graxos poliinsaturados -PUFA, o que sugere que a composiçã o de lipídios e ácidos graxos dos espermatozoides pode ser um fatordeterminante das taxas de fertilidade(MAR TIN R ILLO et al., 1996), uma vez que esse tipo de constituiçã ofavorece a peroxidaçã o
lipídica.
Quando se trata dos efeitos oxidantes na taxa de fertilidade, é sabido que o plasma seminal e os espermatozoides contê menzimas e vitaminas antioxidantesque protegem a membrana espermática, rica em PUFA, da peroxidaçã o (MAKKE R et al., 2009). J á após ejaculado, as galinhas assumem o papel de proteçã o contra a oxidaçã o, enquanto os espermatozoides permanecem estocados nos túbulos de estocagem seminal (BAKS T et al ,2015). E sta atividade enzimática antioxidante dos espermatozoides se torna menorcom o envelhecimento dos galos e galinhas, o que pode contribuir para o declíniodafertilidade (R OCHA, 2013).
A presença de agentes oxidantes que podem ser deletérios aos processos de eclosã o e fertilidade éconhecida (FE R R E IR A etal, 2010). S endoassim, é ideal adotar práticas mitigatórias como a utilizaçã o de substâncias antioxidantes na dieta de reprodutores, para que, além de uma adequada transferê ncia de nutrientes via ovo, a quantidade destes elementos, também, seja suficiente para reduzir os processos de oxidaçã o em sistemas vivos (R OCHA et al, 2013), como o espermatozoide dos machos.
Os carotenoides sã o umexemplo desse tipo de substância porque possuem atividadesantioxidantes, pigmentares, provitamínicas e imunomoduladoras (S UR AI et al., 2003).
A cantaxantina, pertencente ao grupo dos carotenoides desempenham um importante papel antioxidante porque removem os radicais livres, absorvem e dissipamo excesso deenergia e reciclamavitamina E (R OCHA et al.,2013).
Oefeitoda cantaxantina sobrea fertilidade é observado tanto nagalinha quanto no galo. A melhoria na fertilidade por parte do galo pode ser devida a dois fatores: proteçã o antioxidante dos espermatozóides e aumento da vitamina A (R UTZ et al., 2007). J ánas galinhas auxilia o mecanismo antioxidante dos túbulos de estocagem seminal de armazenamento do esperma. (BAKS T, 2011).
TR IQUE S et al (2016), comprovou que a adiçã o de cantaxantina na dieta de machos reprodutores de frango de corte na fase pós-pico pode ser uma ferramenta paramelhoraroíndice defertilidadedolotede matrizes velhos, porproporcionar maior percentual de espermatozoides normais,além de características biométricas de crista, barbela e testículos serem superiores quando os machos receberam a suplementaçã o.
Nesta perspectiva, o uso da cantaxantina adicionada à dieta de galos e galinhas, pode exercer seu papel antioxidante de trê s formas: 1) no embriã o -protegendo os tecidos embrionários na incubaçã o, 2) no ovo - protegendo os nutrientes da gema duranteoarmazenamento para o embriã o em desenvolvimento e, 3) nas matrizes pesadas - auxiliando nos mecanismos antioxidantes do sê men e ovidutoe reduzindo oestresse oxidativo dos espermatozoides (R OCHA et al, 2013).
2. OBJ E TIVOS
2.1. Objetivogeral
Avaliar a eficiê ncia reprodutiva de matrizes de frango de corte suplementadas e nã o suplementadas com cantaxantina na dieta.
2.2Objetivos específicos
Verificar o númerode perfurações espermáticas na membrana perivitelínea de ovosprovenientes de lotes de matrizespesadas suplementadas e nã o suplementadas com cantaxantina;
Quantificar alterações na compactaçã o de cromatina dos espermatozoides de galos suplementados e nã o suplementados com cantaxantina, através das técnicas de microscopia eletrônica;
Analisar o desenvolvimento testicular através de mensurações do diâmetro e altura deepitéliodos túbulos seminíferos;
3. R E VIS Ã ODE LITE R ATUR A
3.1. R eproduçã o na avicultura
O sistema reprodutivo das fê meas é formado por ovário esquerdo desenvolvido, oviduto, que compreende as porções do infundíbulo, magno, istmo, úteroe vagina.
O ovário das aves difere dos mamíferospelo seu tamanho e sua organizaçã o hierárquica. Nos mamíferos, diversos folículos podem ovular em um determinado momento dentro de um intervalo de vários dias ou semanas, enquanto que em aves umúnico folículo ovula e oóvuloéliberado dentro de umintervalomais curto.Além disso, como as aves nã o sofrem gestaçã o, o embriã odeve obter todos os nutrientes para o seudesenvolvimento fora do corpo maternal. E ste fato faz com que o óvulo maturo das aves sejamuito maior que ode mamíferos, servindocomo fonte energética e proteica durante o período inicial de desenvolvimento. Nas aves, os folículos grandes e amarelos, destinados a ovulaçã o, estã o organizados dentro de uma hierarquia (R UTZ et al., 2007).
Uma das principais funções dos ovários é a produçã o de hormônios esteroides, essenciais para o crescimento e funçã o do trato reprodutivo. Dentre esses, está a progesterona, a qual estimula a secreçã o de albúmen no magno e induçã o do pico de LH. Os androgê nios atuam em características sexuais secundárias (crista e barbela). Os estrogê niosdesencadeiam a síntese dagema pelo fígadoe amobilizaçã o decálcio dos ossos medulares para aformaçã o da casca. Ao contrário de mamíferos, as células da granulosa sã o aprincipalfonte de progesterona e de pequenas quantidades de androgê nios, enquanto que as células da teca produzem androgê niose estradiol.É importantesalientar queas células da granulosa nã o luteinizam, pois nã o existe a necessidade de formaçã o de corpo lúteo, já que nã oháprenhesparamanter(BAHR & J OHNS ON, 1991).
membranas e casca, as quais conferem proteçã o ao embriã o (DY CE , 1997). E sta estrutura também tema funçã o de transportar espermatozoides para a fertilizaçã o, podendo servircomolocal de armazenagempara estes, já queuma inseminaçã o é suficientepara fertilizar os ovos liberados poraté 21 dias (R ODR IGUE S et al., 2011).
Anatômica e funcionalmente oovidutopodeser dividido emcinco regiões:
- Infundíbulo: A estrutura chamada infundíbulo é a extremidade caudal do oviduto,formada por uma porçã o deparede delgada, comformatode funil, e um tubo mais espesso - a regiã o tubular. O seu óstio é posicionado pelo saco aéreo abdominal esquerdo, oque facilitaa apreensã o do ovócito recém liberado. O ovócito leva aproximadamente 15 min para passar pelo infundíbulo e, durante este período as glândulas infundibulares fornecem-lhe a camada calazífera ou calazas. As calazas, por sua vez, correspondem a dois espessamentos dealbúmenretorcidos no sentido horário, os quais mantê m a gema no centro do ovo e permitem-na girar, para que o disco germinativo permaneça sempre no lugar mais alto, independentemente da posiçã o do ovo (DY CE , 1997).
- Magno: S uas paredes apresentam pregas mucosas maciças, cobertas por glândulas que tem a funçã o de adicionar cerca de metade do albúmen total ao ovo. Na extremidade distal do magno,as pregas mucosas sã o mais baixas, levando o ovo aproximadamente trê s horas para atravessar este segmento do magno (DY CE , 1997).
- Istmo: O istmo está situado entre o magno e o útero, é curto e estreito. Nesse segmento sã o secretadas as duas membranas da casca e o ovo permanece por cerca de umahora e meia nesse local (BULL, 1994).
- Útero: O útero ou glândula da casca é uma regiã o curta e dilatada em forma de bolsa. S ua parede mucosa apresenta pregas longitudinais e transversais que abrigamglândulas tubulares de estrutura semelhanteà s glândulas do magno (DY CE , 1997). É nessa porçã o que o ovo permanece o maior tempo, cerca de 20horas. O processo mais importante que acontece nesta regiã o é a calcificaçã o da casca. O crescimentodos cristais de cálcio se dáa uma taxa de 300 mg de cálcio porhora. As tarefas finais do útero sã o a pigmentaçã o e a formaçã oda cutícula, camada externa à casca que tem funçã o protetora (HAFE Z,2004).
através doânus, reduzindo ocontatodestecom as fezes (DY CE , 1997).
As espécies avícolas apresentamsemelhanças no trato reprodutivocom outras espécies animais (ex. répteis) devido a presença de sítios especializados no trato feminino, no qual os espermatozoides residem durante períodos prolongados após uma cópula. E xistem dois sítios distintos nas espécies avícolas, um localizado na junçã o útero-vaginale ooutrona porçã oinferior do infundíbulo.
Os espermatozoidesresidem nestes Túbulos de E stocagem S eminal(TE S ), que é uma invaginaçã o doepitélio que reveste a superfície dolúmen do oviduto (BAKS T et al., 1994; BAKS T, 2011; FR OMAN, 2011). O período de armazenamento de espermatozoides em galinhas é de no mínimo 21 dias, como constatado por RODRIGUE S et al. (2011).
Normalmente células espermáticas entram nos TE S e se orientam paralelamente. A aglutinaçã o de cabeça com cabeça dos espermatozoides é uma das possíveis explicações para a manutençã o prolongada in vivo dos espermatozoidesnos TE S (TINGARI &LAKE , 1973). E ssa afirmaçã o foi comprovada recentemente por FROMAN (2013), que constatou que dentro dos TE S , os aglomerados de espermatozoidesapresentaram ummovimento sincronizado e lento, provavelmente para manter a sua posiçã o contra um fluido (flowdirected - para o orifício de TE S ), como também descrito por BAKS T (1994). E sse fluído pode ser gerado por aquaporinas, que tenham sidoimunocitoquimicamente localizada nazona apical das células epiteliais daTE S (ZANIBONI, 2004).
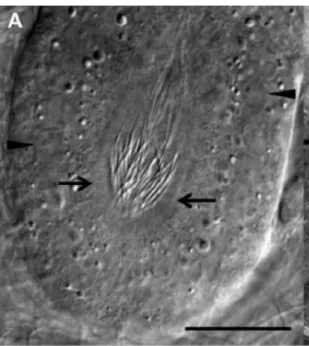
Figura 1.J unçã o útero-vaginal nã ofixada e analisada em microscópio de contraste, mostrando aporçã o final distaldo TE S com sptz no lúmen. O aglomerado de sptz está alinhado cabeça a cabeça conectado com a base da microvilosidadedos S S T (setas). (Barra20mm). BAKS T etal (2015).
Na figura2, está ilustradaa fusã o de macromoléculas presentes nos TE S , que servem de suprimentos para o metabolismo dos espermatozoides dos galos, durante a sua permanê ncia no ovidutodafê mea.
Ao avançar a idade, a duraçã o da fertilidade é reduzida após uma única inseminaçã o ter sido realizada. Nopassado foi postulado que isto ocorria emfunçã o de uma reduçã o na capacidade de armazenamento espermático nos TE S (VAN KR E Y et al., 1967). Alternativamente, BRILLARD (1993) sugere que o declínio na duraçã o dafertilidade com a idade resulta de uma maior facilidade da liberaçã o dos espermatozoides dos TE S .
O sistema reprodutivo dos galos éconstituído portestículos,epidídimo,ductos deferentes, falos.
Os testículos de galos, em número de dois, correspondem a 1% do peso vivo das aves (S TURKI &OPE L, 1976) e apresentam algumas particularidades que os diferem dos mamíferos. E les estã o localizados dentro da cavidade abdominal. E sta apresenta uma temperaturade 41-43oC emesmo assim ocorre aespermatogê nese. A hipótese que explica a formaçã o espermatogê nica nestas condições é a de que poderia haver umresfriamento dostestículos através dos sacos aéreos abdominais (R UTZ etal, 2007).
Diferente da disposiçã o em mamíferos, os túbulos seminíferos nã o estã o agrupados em lóbulos bem delineados circundados portecidoconjuntivo, mas sim ramificam-se e anastomosam-se livremente dentro da túnica albugínea. No galo adulto, extensões da túnica penetram entre os túbulos para agirem como estrutura de suporte. O tecido intersticial édesprezível, porém contémas células de Leydig, que sã o secretoras de androgê nios. Os túbulos seminíferos de galos imaturos sã o alinhados por uma camada simples de células de S ertolie espermatogônias. J áos machos maduros possuem túbulos de forma irregular alinhados por um epitélio germinativo de múltiplas camadas. As espermatogônias dã o origem aos espermatócitos primários, secundários e espermátides. E stas últimas progressivamente se transformam em espermatozoides, por um processo denominado espermiogê nese (BAKS T & BAHR, 1995).
Assim, a regiã o epididimária compreende os túbulos retos, dutos eferentes distais e proximais (dutos eferentes), um túbulo curto de conexã o e o duto do epidídimo (HE S S et al., 1976). Em aves, ductos compõe mais doque 70% da regiã o epididimária, sugerindo que os ductos eferentes representam um componente mais importante da regiã o epididimária que o túbulo reto ou duto epididimário (CLULOW & J ONE S , 1988). O epitélio dos dutos eferentes apresenta convoluções para aumentara área de superfície do lúmen do duto e consiste de células ciliadas e nã o ciliadas (E TCHE S , 1996). As principais funções dos dutos eferentes em todas as espécies incluem reabsorçã o de fluído, transporte, concentraçã o espermática e secreçã oproteica(ILIO & HE S S , 1994).
O duto do epidídimo abre-se dentrodo duto deferente o qual é o primeiro local de armazenamento de espermatozoides no galo. O duto deferente é um tubo bastante enrolado, o qual na sua extremidade distal, torna- se reto e dilata-se levemente, passa através da parede da cloaca e termina como extensã o semelhante a uma papila que se projeta dentroda cloaca.
Nã o existem órgã os acessórios tais como vesícula seminal, próstata e glândula bulbouretral associados ao duto deferente. No galo que nã o tenha ejaculado, os espermatozoides atravessamo duto deferente em cerca de 84 horas, ao passoque em machos que jáejacularam, os espermatozoides requerem 24 a 48 horas para atravessar (E TCHE S , 1996).
O macho nã o tem um órgã o penetrador (ex. pê nis), porém um falo que faz contato com a vagina em eversã o durante a cópula. A ereçã o do falo resulta em engurgitamento com um fluído semelhante a linfa derivado do corpo vascular paracloacal, uma extensã o do falo localizado na parede da cloaca (E TCHE S , 1996),
inibina eactivina sã o produzidas nos testículos e regulam a atividade do FS H através de feedback e açã o parácrina. A inibina controla a açã o de androgê nios e inibe a secreçã o de FS H. A activina estimula a secreçã o de FS H (R UTZ et al., 2007). Ainda, a melatonina,hormônio produzido pela pineal, reduz a atividade gonadal ao inibir a secreçã o de LH, sugerindo a açã o da melatonina no hipotálamo e/ou hipófise (R OZE MBOIM et al., 2002).
A formaçã o do plasma seminal e a concentraçã o do sê men de galos resultam da reabsorçã o de líquidos no epidídimo, onde os espermatozoides permanecem pormais de 100 minutos (R ITCHS ON, 2013). Devido à ausê ncia de glândulas acessórias, o ejaculado é composto por uma grande quantidade de células espermáticas suspensas em um pequeno volume de plasma seminal (WHITTOW,2000), resultando em um sê men muito concentrado, apresentando de um a cincobilhões de espermatozoides por mL de ejacu lado. Comparativamente, o suíno apresenta de 200 a 300 milhões de espermatozoides pormL, enquanto que no touro essa quantidade nã o passa de 1,2milhões de espermatozoides por mL.O volume desê men produzido dependeda linhagem etamanho do galo,uma vez que, segundo E tches (1996), o volume de sê men depende do tamanho do testículo e este, porsua vez, está relacionado com o peso corporaldo galo.
3.2. E spermatozoides degaloecromatina
O espermatozoide de galos é composto por acrossoma, cabeça, peça intermediária e cauda (BUR KE , 1996). A diferença dos espermatozoides de aves para os de mamíferos, segundo GILBE R T (1982), é o fato de aqueles serem menores, com cabeças filamentosas e longas, e por nã o possuírem gota citoplasmática. E ste autor descreve que a cabeça dos espermatozoides de galos é curva e mede de 12 a 13 pm de comprimento, e recoberta pelo capuchã o do acrossoma (2pm). A peça intermediária da cauda mede cerca de 4pm de comprimento e o restante do comprimento do espermatozoide de 100 pm é composto pela peça principal da cauda. A porçã o mais larga do espermatozoide do galo mede aproximadamente 0,5 pm.
(LUKAS ZE WICS , 1988), seleçã o de machos e também para definiçã o de armazenamento em meios líquidos ou criopreservaçã o para propósitos e inseminaçã o artificial (DONOGUE & WIS HAR T, 2000; LUKAS ZE WICS , 2002). A morfologia espermática pode também servircomo um indicador de desordens na espermatogê nese. Noentanto,a avaliaçã o da morfologia aindanã oé utilizadacomo rotina de campo. S egundo Maciel (2006), as anomalias espermáticas sã o incompatíveis com a boa fertilidade e qualquer alteraçã o nas características morfológicas dos espermatozoides pode comprometeramotilidade e sobrevivê ncia espermática.
S egundo R UTZ et al (2007), os espermatozoides devem apresentar motilidadee sobreviver no ambiente vaginal para atravessara vagina ealcançar as glândulas armazenadoras de espermatozoides, assegurando a disponibilidade espermática ea probabilidade defertilizaçã o,fatores fundamentais parao sucesso da reproduçã o. Outros autores ratificam a importância da motilidade espermática para a fertilizaçã o (ALLE N & GR IG, 1957; FR OMAN & FE LTMAN, 1998; HOLS BE R GE R et al., 1998; KING et al., 2000). BOWLINGE T al. (2003) correlacionarama o menor percentual de anomalias espermáticas em galos com maior motilidade espermática.
Um dos fatores quemaisinterferem nas características seminais é a idade. É muito comum em granjas comerciais observar declínio progressivo da fertilidade após as 40 semanas de idade. O avançarda idade emummacho é acompanhado por uma reduçã o no número de espermatozoides no ejaculado e no volume de sê men, além de reduçã o da motilidade, viabilidade e integridade do espermatozoide. Consequentemente, essas mudanças levam a um declínio da capacidade fertilizante do machoepodetambémafetarsua preservaçã odurante o armazenamento (IAFFALDANO etal., 2003).
al. (1998) nada mais sã o que orifícioshidrolisados pelos quais os espermatozoides penetraram no ovócito. E sse método é importante para comparar a fertilidade em situações experimentais oudecampo submetidas a diferentesvariáveis.
Medidas nã o tã o diretas também costumam ser aplicadas no campo para verificar a eficiê ncia reprodutiva dos lotes, como avaliaçã o das características sexuais secundárias. MCGAR Y BR OUGHE R et al. (2005), relacionando características sexuais secundárias a fatores comofertilidade, peso dos testículos e penetraçã o de espermatozoides na membrana perivitelínica concluíram que há correlaçã o positivaentre peso testicular e áreade crista, assim como alturadecrista e comprimento de barbela com penetraçã o de espermatozoides na membrana perivitelínica.
Além dosfatores jácitados que influenciam na fertilidade, como linhagem e idade, outros fatores correlacionam-se positivamente ou negativamente com a fertilidade. O peso corporal de machos tem influê ncia negativa direta na fertilidade quando se encontra muito acima ou muito abaixo do padrã o estabelecido pela linhagem (MCDANIE Let al., 1981; DUNCAN et al., 1990). A própria dificuldade em realizar a cópula devido ao peso corporal elevado é um fator que faz com que a fertilidade do lote seja ruim. Uma maneira eficiente de manter o peso do macho próximo ao preconizadopela linhagemé fornecer ao machouma raçã oexclusiva (e nã o a mesma que da fê mea) e garantir os procedimentos de manejo de arraçoamento, como fornecimentoda quantidade ótima dealimento para os machos (BR ANDALIZE , 2005) eespaço de comedouro para os machos em funçã o daidade das aves (BITTAR FILHO& RIBE IRO, 2005). A alta temperatura ambientaltambém diminui a fertilidade do lote, seja causando morte espermática (HOOD, 1999), provocando alterações na qualidade seminal ou reduzindo a concentraçã o intracelular deíons(KAR ACA et al., 2002).
dessas proteínas interagem com a fita de DNA através de seus grupos fosfatos, neutralizando o esqueleto fosfodiéster(LOIR ; LINNE AU,1978; E VE NS ON et al.,1980; COUR TE NS ; LOIR , 1981; CHIVA etal.,1987;LE WIN etal.,1999; BE LE TTI;ME LLO, 2004). No caso das aves, a protamina presente no núcleo da célula espermática é conhecida como galline(NAKANO etal., 1975e 1989, S OAR E S ; BE LE TTI, 2006b).
A condensaçã o do material nuclear é um importante evento da diferenciaçã o nuclear durante a espermatogê nese. Acreditava-se que a permanê ncia de histonas somáticasou ocorrê ncia de anormalidadesnas protaminas poderiam levar à formaçã o de distúrbios de condensaçã o da cromatina dos espermatozoides, o que leva a consequê ncias sobre a fertilidade (GLE DHILL, 1966; E VE NS ON et al. 1980; ME LLO, 1982; BE LE TTI; ME LLO, 1996; BE LE TTI; ME LLO, 2004; BE LE TTI et al, 2004). Contudo, hoje sabe-se que existem regiões específicas da cromatina espermática de mamíferos que permanecem com histonas, contendo provavelmente sinais epigenéticos importantes para o desenvolvimento embrionário. Portanto, apenas quantidade e localizaçã o errôneas dehistonas na cromatina espermática interfeririam na fertilidade (BE LE TTI, 2013)
Quando o dano no DNA é mais severo, este persiste durante o desenvolvimento embrionário, induzindo apoptose e fragmentaçã o do embriã o recente ou levando à morte mais tardiamente (TWIGG et al. 1998; E LLINGTON et al., 1998). E m estudo avaliando programas de inseminaçã o artificial em equinos, WATS ON (2000) apontou os espermatozoides apresentando DNA danificado como uma das causas do insucesso desta técnica. E m bovinos, DOBR INS KI et al. (1994) mostraram que reprodutores com baixa taxa de fertilidade possuíam altas taxas de espermatozoides com DNA danificado.
DNA mais sensível à hidrólise. Portanto, a reaçã o de Feulgen consegue identificar os espermatozoides com cromatina mais frouxa, o que interfere na fertilidade do macho.
Vários outros estudos foram realizados na confirmaçã o destes testes. Assim, BE LE TTI e ME LLO (1996), estudando touros que apresentavam alta porcentagem de espermatozoides com patologia de cabeça do tipo “pouch formation” (touros subférteis), observaram que alguns destes animais apresentavam a frequê ncia de espermatozoides com cromatinas anômalas semelhantes à de touros altamente férteis. Assim, embora o achado de níveis mais elevados de metacromasia induzida se associe a subfertilidade, nem toda situaçã o de subfertilidade é caracterizada pela presença de núcleos com essa propriedade citoquímica.
MOS S et al. (1978), afirmamque todas as amostras de sê men dediferentes espécies animais contê m uma proporçã o de células anormais. LUKAS ZE WICS (2008), avaliandodiferentes métodos de coloraçã o de diferentes aves, mostrou que o percentual médio de espermatozoides normais no sê men é entre70 e 80%.
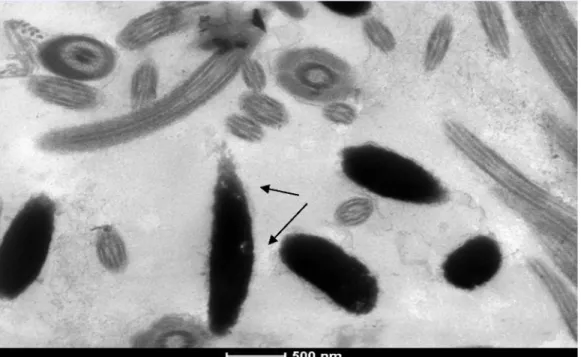
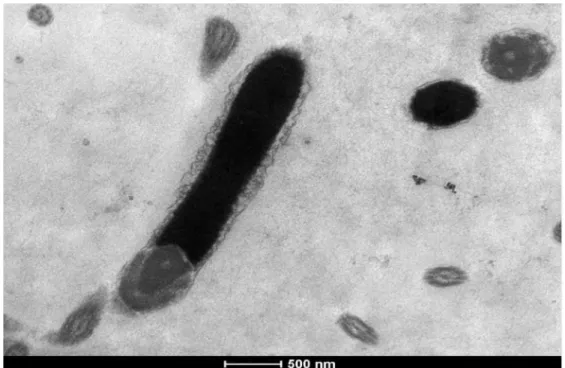
A partir de estudos em microscopia eletrônica de transmissã o, S OAR E S & BE LE TTI (2006b) observaram que o acrossoma dos espermatozoides de galo é composto por material homogê neo ou levemente granular. No interior do núcleo, a cromatina geralmente apresenta-se densa e levemente granular. Contudo, foram observados espermatozoides com cromatina apresentandovários tipos de granulaçã o etonalidades de cinza, ou seja, com várias intensidades de compactaçã o. As células com deficiê ncia de compactaçã o da cromatina apresentavam todo o núcleo oumesmo pequenos pontos mais claros.
As alterações morfológicas nos espermatozoides de galos dividem-se como em outras espécies, em defeitos de cabeça e de peça intermediária, sendo os mais frequentes descritos por J AE NIS H(1989):cabeça enrolada, cabeçagrande, emanzol, tumefeita, zigue-zague, membrana irregular, acrossoma ausente e acrossoma dobrado. Os defeitos de cabeça espermática estã o relacionados a transtornos na espermatogê nese, decorrentes principalmente de processos degenerativos das gônadas.Os achados maisfrequentes na peça intermediáriaespermática foram: peça intermediária dobrada e peça intermediária tumefeita. J á a detecçã ode anomalias na cromatina dos espermatozoides éfrequentemente negligenciada, por falta de estudos (S OAR E S & BE LE TTI, 2006a).
que no lote com os galos mais férteis foi encontrado maior número de espermatozoides com alterações morfológicas, enquanto no lote com menor fertilidade foi encontrado um maior número de alterações na compactaçã o da cromatina, mostrando a importância da compactaçã o cromatínica na fertilidade dos galos.
R ODR IGUE S et al. (2009) demonstraram que um dos fatores que podem influenciar a fertilidadede galos mais idosos sã o as alterações na compactaçã o da cromatina espermática. E stes pesquisadores identificaram que os sê mens de galos velhos apresentam mais alterações na cromatina, tanto na homogeneidade como na intensidade de compactaçã o, do que galos jovens. A condensaçã o do material nuclear é um importante evento da diferenciaçã o nuclear durante a espermatogê nese.
AR AÚJ O (2013) utilizou microscopia eletrônica de transmissã o para avaliar alterações na cromatina de sê men de perus, classificando estas alterações em fracas, médias e fortes. E le concluiuque a microscopia eletrônica de transmissã o é eficiente na avaliaçã o de alterações de cromatina em espermatozoides de peru.
3.3. R adicais livres e E stresseoxidativo
Um radical livre nada mais é do que qualquer átomo, molécula ou íon que possui umou mais elétrons livres na sua órbita externa. E ssas partículas, formadas por elétrons livres ou nã o pareados tem uma instabilidade elétrica muito grande, e por esta razã o, mesmo tendo meia vida curta, apresentam grande capacidade reativa, o que pode acontecercom qualquer composto que esteja próximo, a fim de captar um elétron desse composto para a sua estabilizaçã o, independentemente de ser uma molécula, uma célula, ou um tecido do organismo, partindo para uma reaçã o em cadeia de lesã o celular. Devido a esta característica, é denominado de substância oxidante. O oxigê nio tem a sua atividade fundamental no metabolismo celular aeróbico. Desta forma, a formaçã o de radicais livres pelo organismo em condições normais é inevitável, pois sã o necessários no processo de respiraçã o celular que ocorre nas mitocôndrias das células, a fim de gerar energia (KUS S , 2005).
levando auma série de eventos que podem culminar com a morte celular (BE NZIE , 1996).
S UR AI (2002) relatou que os espermatozoides de galos apresentam umalto conteúdode ácidos graxos polinsaturados (PUFA). Tal concentraçã o de PUFA se dá principalmente na membrana plasmática da cabeça do espermatozoide (BONGALHAR DO et al., 2002). E sta composiçã o favorece a peroxidaçã olipídica, pois as duplas ligaçõesdos PUFA formam radicaislivres ao se juntarem ao oxigê nio metabólico, caracterizando os PUFA como materiais oxidáveis (MCDOWE LL, 1989). S egundo AITKE N (1995), a fluidez espermática e a capacidade fertilizante do galo diminuem no espermatozoide peroxidado.
Vários autores dividem a peroxidaçã o lipídica em 3 fases bem definidas: iniciaçã o, propagaçã o e terminaçã o (HS IE H et al., 1989; S PITE LLE R , 1998; LIMA et al., 2001; HALLIWE LL, 2006) e ocorrem como cadeia. Na fase de iniciaçã o, o PUFAsofreataquede oxigê nio reativo,que abstrai um átomode hidrogê nio a partir deumgrupometileno,formandoumradicalde carbono. E steradical é estabilizado porum rearranjo molecular para formar umdienoconjugado, ou seja, duas duplas ligações intercaladas por uma ligaçã o simples (HALLIWE LL, 2006). E m meio aeróbio, o radical alquila inicialmente formado se combina como oxigê nioformando o radical peroxila,oqualpodeabstrair um hidrogê nio alílico deum outro ácido graxo, gerando outro radicalde carbono, e promovendo aetapa de propagaçã o. A reaçã o do radical peroxila com o átomo de hidrogê nio abstraído gera um hidroperóxido lipídico. Peróxidos cíclicos também podem serformados, quandoo radical peroxila reagecom uma duplaligaçã onamesma cadeia de ácido graxo,o quetambém pode propagara peroxidaçã olipídica (LIMA, 2001).
A terceira etapa dareaçã o (terminaçã o)dá-se pelaaniquilaçã o dosradicais formados originando produtos nã o radicalares (GAR DNE R , 1989; HALLIWE LL, 2006).Os radicaisperoxilae alcoxila tambémpodem sofrerdismutaçã oou clivagem formando aldeídos; formar uma ligaçã o covalente com resíduos de aminoácidos; sofrer um rearranjo formando produtos secundários da peroxidaçã o (S PITE LLE R , 1998). HOGG & KALY ANAR AMAN (1999) citam os alcanos, aldeídos, álcoois e hidroperóxidos comoprodutosresultantesda peroxidaçã o lipídica.
oxidativos causados pelas ROS decorrem da alta quantidade de PUFA presentes na sua membrana plasmática. E stes ácidos graxos sã o altamente predispostos ao ataque dos radicais livres e consequentemente, a peroxidaçã o dos lipídios. O oxigê nio é a maior fonte de ROS produzidas em reações metabólicas para as células obterem energia pela oxidaçã o denutrientes. As células possuem sistemas pró-oxidantes e antioxidantes que constantemente geram e detoxificam ROS durante metabolismo aeróbico. O estresse oxidativo pode sercausadoquando o balanço de pró-oxidantes e antioxidantes está alterado em células com eventos oxidativos aumentados (OR TE GA, 2003). As ROS incluem todos os radicais do oxigê nio,como o ânion radical superóxido, radicalhidroxila, radical alquila, alcoxila e peroxila(BAR BE R et al., 1967; CHANGE et al.,1979; HALLIWE LL, 2006).
A produçã o aumentada de oxidantes causa danos em ácidos nucleicos, PUFAde membranas, tióis em proteínas, podendolevar até a morte das células. A peroxidaçã o lipídica pode causar injúrias à s membranas celulares, a oxidaçã odo DNA pode levar à mutações e a oxidaçã o proteica pode levar a diminuiçã o da atividade enzimática eaumentaro turnoverproteico, o que em conjunto pode levar desde a disfunçã o até a morte celular.As células usam antioxidantes armazenados comoa glutationa e a vitamina E para remover oxidantes sob condições médias e crônicas deestresse oxidativo (KIMet al.,2010).
LUCHE S E et al. (2007), também comentam os efeitos da peroxidaçã o lipídica, destacando que este processo oxidativo pode induzir dano ao DNA espermático, acelerando o processo de apoptose da célula germinativa, diminuindo a concentraçã ode espermatozoides edeteriorandoaqualidade seminal.
Os espermatozoides estã o constantemente expostos a ambientes oxidativosdesdeomomento em que osespermatozoidessã o formados no testículo atéa ejaculaçã o e passagempelo trato reprodutivo da fê mea(WE IR & ROBAIRE , 2007). Vários autores descrevem a importância de um sistema antioxidante no sê men como forma de preservaçã o da integridade espermática e manutençã o da fertilidade do galo (AITKE N, 1995; S URAI, 2002; RUTZ et al., 2007; HAMMADE H et al., 2009; KIM et al., 2010). De acordo com RUTZ et al. (2007), a proteçã o antioxidante do sê men confere manutençã o da fluidez de membrana, além de flexibilidade e permeabilidade necessária para o processo de fertilizaçã o.
eficiê ncia reprodutiva.
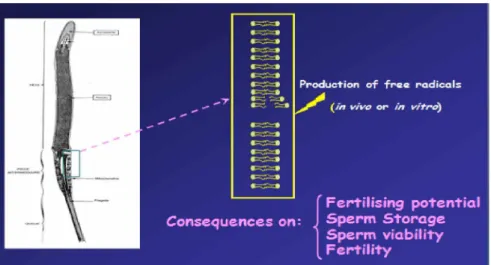
Production of fr« « radicals
s (in vivo or in vitro)
Consequences on:
F ertilising potential
Sperm Storage
Sperm viability F ertility
Figura 3. E squema representativo dos efeitos dos radicais livres, causadores de peroxidaçã o lipídica, com consequê ncia na eficiê ncia reprodutivas (BR ILLAR D, 2011).
Para proteger-se do efeito letal da formaçã o excessiva de R OS , a célula possuium sistema de defesa antioxidante, enzimático enã o enzimáticoque pode atuar tanto removendo o agente antes que ele cause lesã o, quanto reparando a lesã o ocorrida (FE R R E IR A & MATS UBAR A, 1997; HALLIWE LL & GUTTE R IDGE , 1999).
O espermatozoide conta com um sistema enzimático de defesa antioxidante, que inclui superóxido dismutase (S OD), catalase, glutationa peroxidase (GPx) e glutationa redutase (GR ), bem como antioxidantes nã o enzimáticos como: ácido ascórbico e a-tocoferol (AITKE N, 1995). No meio extracelular, ele é protegido pelo plasma seminal que contém redutores de ROS , enzimáticos e nã o enzimáticos, como: ácido ascórbico, ácido úrico, albumina e outras proteínas, catalase, S OD, glutationa e outros tiois, taurina, hipotaurina e vitamina E. Como a capacidade biosintéticado espermatozoideé limitada, o plasma seminal é particularmente importante na proteçã o do espermatozoide contra os danos causadospelasR OS geradas pelo próprio espermatozoide e pelos fagócitos presentes no ejaculado (AITKE N, 1995).
redução do H2O2 a água e O2 (NOR DBE R G & AR NÉ R , 2001). E nzimas removedoras de R OS , como a superóxido dismutase, glutationa redutase (GR ), glutationa peroxidase ou catalase, já foram detectadas no espermatozoide e/ou no plasma seminal de várias espécies, incluindo ovinos (KAS IMANICKAN et al., 2006; BUCAKetal., 2008;MAR TÍetal., 2008), caprinos (ATE S S AHIN et al.,2008; BUCAK et al., 2009), bovinos (BILODE AU et al., 2000; O'FLAHE R TY et al., 2003; S ARIOZKAN et al., 2009) e homem (AITKE N et al., 1996; ZINI et al., 2000; MIS RO et al., 2004).
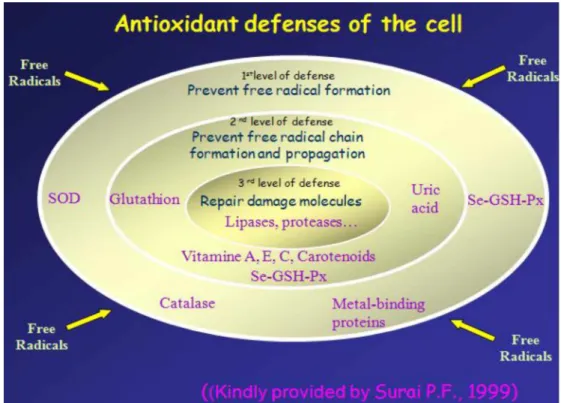
A Figura 4 representa os níveis de defesa antioxidantes das células proposto por S URAI (1999).
1stlevelof defense
Prevent freeradical formation
2 level of defense
Prevent freeradicalchain formation and propagation
3 level of defense
Glutathion Repair damage molecules Lipases, proteases...
V itamine A. E.C.Carotenoids Se-GSH-Px
Metal-binding proteins
Ant ioxidant
def enses
of
t he
cell
Free R adica Free
R adicals
Free '
R adicals Free
R adicals
Figura 4. E squema representativo de níveis de defesa antioxidante das células, indicando os carotenoides como sendo um dos elementos antioxidantes, propostopor S URAI (1999).
R UTZ et al. (2005) afirmou que esta proteçã o é temporária, uma vez que o plasma seminal érapidamente substituído pelo fluido secretado pelo oviduto. Ainda assim, os espermatozoides continuam sob proteçã o de enzimas e vitaminas (C e E). WE IR & R OBAIR E (2007) compararam a atividade enzimática antioxiodantedos espermatozoides e a produçã o de R OS na maturaçã ode espermatozoides de ratos velhos e novos e observaram queda na capacidade antioxidante associada ao aumento na produçã o de R OS com o envelhecimento dos animais. Os autores concluíram que a queda na qualidade espermática de animais velhos está associada à maior susceptibilidade dos espermatozoides aos danos oxidativos.
Contudo, uma vez que a quantidade de enzimas antioxidantes no citoplasma dos espermatozoides é limitada e a presença destes antioxidantes é fundamental para proteçã o espermática (HAMMADE H et al., 2009). MAKKE R et al. (2009) e BANS AL & BILAS PUR I (2010) destacaram antioxidantes adicionados a dieta de machos com a finalidade de reduzir o estresse oxidativo dos espermatozoides. Dentre os antioxidantes citados, estã o as vitaminas C e E , beta- carotenos, carotenoides e flavonoides.
A peroxidaçã o lipídica nas aves éinfluenciada pela qualidade da matéria-prima (consumo de lipídios oxidados), alta presença de ácidos graxos insaturados nos tecidos e ingestã o inadequada de nutrientes envolvidos no sistema de defesa antioxidante. Desta forma, a utilizaçã o de antioxidantes nos insumos e na raçã o das aves, visa preservar a qualidade e os níveis nutricionais do alimento e consequentemente proteger os tecidos daave viva e o produto finaldas matrizes que sã o os ovos férteis e pintos (R OCHA et al, 2013).
3.4 Cantaxantina
MAKKE R et al. (2009) e BANS AL & BILAS PUR I (2010) destacaram os antioxidantesdietéticos na reduçã o do estresseoxidativo dos espermatozoides, sendo estes constituídos pelas vitaminas C, E, beta-carotenos, carotenóides e flavonóides.
Vários autores descrevem a ingestã o de antioxidantes, como os carotenoides e as vitaminas C e E, como maneira de auxiliar o sistema enzimático de proteçã o contrao ataque de radicais livres em diferentes espécies, como humanos (S OUTHON, 2000), aves (S URAI, 2002) e ratos (ARRUDA, 2004).
Os carotenoides sã o comumente associados com sua funçã o pigmentante devido à sua ampla distribuiçã o na natureza conferindo as cores laranja, amarela e vermelha em frutas, hortaliças, flores, algas, bactérias fungos, leveduras e animais (R IBE IR O & S E RAVALLI, 2004). Avaliando o efeito de carotenoides na atividade avícola, Baiã o (1996) e ANGE LE S & S CHE IDE LE R (1998) perceberam diferenças significativas na pigmentaçã ode gemas após o uso desses compostos. Contudo, há o conhecimento de que os carotenoides possuem outras propriedades além da pigmentante, como atividade pró-vitaminas (WILLIAMS et al., 1998) e antioxidantes (FOOTE et al., 1970; DI MAS CIO et al., 1989; MCBRIDE , 1996; BOHM et al., 1997; RIBE IRO e S E RAVALLI, 2004).
S egundo ME LÉ NDE Z-MAR TINE Z et al. (2004), os carotenoides a-caroteno, p-caroteno, e(3-criptoxantina sã o carotenoides que possuemaltaatividade pró- vitamina A, pois apresentam ao menos umanel ionona no final de sua estrutura. E nquanto isso, a luteína, o licopeno e a cantaxantina tem pouca ou nenhuma atividade pró-vitamina A, pois nã o apresentam o anel ionona nas suas estruturas químicas.
Nutricionalmente, estes podem ser classificados como pró- vitamínicos (aqueles com atividade pró-vitaminaA)ou carotenoides inativos, quando apresentam apenas atividade antioxidante ou corante (OLS ON, 1999). De acordo com o caráter químico, estes compostos sã o classificados em dois grupos: hidrocarbonados, denominados carotenos, e oxigenados, denominados xantofilas (GOODWIN, 1965). E stes dois grupos sã o subdivididos deacordo com sua estrutura, destacando-se o os subgrupos hidrocarbonetos (como o licopeno) e as cetonas (comoa cantaxantina).
ser gerados no citoplasma, nas mitocôndrias ou na membrana, atacando lipídios, proteínas, carboidratos e DNA. Os carotenoides sã ocapazes de sequestrar as ROS , como o radical peroxil e o oxigê nio singleto, estabilizando o elétron desemparelhado do radical por ressonância (FOOTE et al., 1970). Por conseguinte, os carotenoides sã o capazes de retirar do meio espécies altamente reativas (BURTON e INGOLD, 1984). E ntretanto, a capacidade de interagir com o oxigê nio e neutralizar os radicais livres varia entre os carotenoides, cuja atuaçã o depende do tipo de carotenoide, da sua natureza, quantidadede oxigê niono meio e da interaçã o com outros antioxidantes (ROCK et al., 1997; E DGE et al., 1997).
Dentre os carotenoides mais intensamente oxigenados destaca-se a cantaxantina pigmento das plumas do flamingo, do guará maranhense e do champignon (Cantharellus cinnabarinus). O consumo desses carotenoides está crescendo devido à s atividades industriais de aquicultura e avicultura (FONTANA et al., 2000;GAR CIA et al., 2002).
E m relaçã o à utilizaçã o da cantaxantina na atividade avícola, como agente antioxidante, alguns estudos sugerem que esses compostos sã o capazes defuncionar eficazmente como antioxidantes durante a incubaçã o, mesmo na presença de oxigê nio atmosférico. E m experimentos com matrizes de corte onde todas as aves foram alimentadas com dietas ricas em vitamina. E, observou-se que os efeitos antioxidantes podem ser alcançados através de interações entre carotenoides e vitamina E (E DGE etal., 1997). O nível de vitamina E no fígado de pintos de um dia foi também significativamente elevado quando as matrizes receberam alta quantidade de carotenoides na dieta. S endo reflexo das propriedades antioxidantes dos carotenoides, impedindo a depressã o de níveis de vitamina E durante períodos de estresseoxidativo, tais como o processo incubaçã o (S URAI et al., 1999). Trabalhando com pintos provenientes de ovos incubados enriquecidos com carotenoides, S UR AI & S PE AKE (1998), observaram uma maior resistê ncia à peroxidaçã o lipídica nos tecidos dessas aves.
E m relaçã o ao papel dos carotenóides como substâncias pró-vitamina A, S URAI etal. (2001) afirmaram que menos de 10% desses podemser convertidos em vitamina A, sendo que nas aves somente o alfa e beta-carotenos e a criptoxantina presentes nos alimentos naturais sã ocapazes de contribuircom o suprimento desta vitamina, portanto a cantaxantina nã o estáincluída neste grupo provitamínico. Ainda segundoestes autores, uma porçã o dos carotenóidescom atividadepró-vitaminaA é convertida em vitamina A na mucosa intestinal e uma pequena parte escapa à conversã o eentranacorrentesanguíneaparaser depositada nagemaouna pele.
De acordo com E UROPE AN COMIS S ION (2002), a cantaxantina é absorvida no intestino delgado e transportada pelosangue ao fígado, onde parte é transformada em substâncias intermediárias precursoras de vitamina A, como 4-oxoretinol, e o restante permanece íntegrotransportado pelas lipoproteínas aos depósitos alvos.
BE AR DS WOR TH & HE NÁ NDE Z (2003) relataram que a atividade pró-vitamina A da cantaxantina tem sido reconhecida e que esta pode ser transformada em vitaminaA nas aves quando o nível desta última élimitadona dieta.
A cantaxantina e a vitamina E também podem ser sintéticas. No caso da vitamina E, a diferença entre a forma natural e a sintética está na sua origem. Para diferenciá-las, os nomes comerciais das vitaminas E iniciam com “d”ou “dl”, que referem-se a diferenças na estrutura química, e representam a forma natural e sintética, respectivamente. Aformanatural émaisativa e melhor absorvida. S egundo ACUFF et al. (1994), aformasintética precisa ser primeiramente hidrolisada no lúmen intestinal, para entã o ser absorvida. Diferentemente da forma natural, a vitamina E sintética só é encontrada naestruturaalfa.
3.5.Perfuraçã o espermática
Oprocesso defertilizaçã o, que pode ser resumidocomo a entradado gameta masculino no ovócito feminino, é composto porvários passos que incluem: o contato ou a interaçã o entre as membranas do ovócito e do espermatozoide; a entrada do espermatozoide noovócito, a ativaçã o metabólicadoovócito,oreinícioda meiose no ovócito e a formaçã o e fusã o dos pró-nucleos masculino e feminino(HAFE Z2004). O encontro entre os gametas acontece na regiã o afunilada do infundíbulo onde, um ou vários espermatozoides atravessam a membrana perivitelínica externa, preferencialmente na regiã odo disco germinativo, e digerem um orifício de 10-20 pm, penetrando no ovócito feminino (BAKS T & HOWARTH, 1977). No momento da ovulaçã o, o pró-núcleo feminino está na fase de metáfase, da segunda divisã o meiótica (E TCHE S , 1998).
Após 15 minutos da ovulaçã o, os espermatozoides penetram na membrana perivitelínica externa (BAKS T & HOWARTH, 1977). A ligaçã o do espermatozoide com a membrana perivitelínica (MP) doovócito e a subsequente reaçã oacrossômica é um importante evento que define o sucesso da fertilizaçã o em aves. O resultado desta interaçã o é um orifício hidrolizado pelo qual o espermatozoide penetrou no ovócito. (BAKS T & HOWARTH, 1977; WACLAWE K et al., 1998).
O espermatozoide das aves penetra na membrana perivitelínica do ovócito de forma digestiva (BE LLAIR S et al., 1963; FUGII, 1976), assim como acontece nos mamíferos. OKAMUR A & NIS HIY AMA (1978) relataram que no momento em que o espermatozoide das aves entra em contato com a membrana perivitelínica, ele é submetido a uma reaçã o acrossomal, resultando na fusã o da membrana acrossomal externa do espermatozoide, do plasmalema, sua vesiculaçã o e posterior liberaçã o das enzimas acrossomais, principalmente a acrosina. E sta reaçã o permite a digestã o de um caminho ou orifício na membrana preivitelínica pelo qual o espermatozoide entrará.
Nas aves, a polispermia, ou seja, a penetraçã ode mais de um espermatozoide na membrana perivitelínica, é um evento fisiológico. As aves nã o possuem o mecanismo dos mamíferos em que, imediatamenteapós afertilizaçã o,a superfície do ovócitosofre modificações que impedem a penetraçã o de espermatozoides adicionais (E TCHE S , 1998).
A ocorrê ncia de múltiplas penetrações e a formaçã o de vários orifícios na membrana perivitelínica do ovócito recém fertilizado é normal. A maioria desses orifícios estã o concentrados em uma área circular de 2,6 mm ao redor do disco germinativo. Uma possível atraçã oquimiostáticados espermatozoides para essa área foidiscutida por R OTHS CHILD (1956) emseus escritos sobreas regras quimiotáxicas doprocesso de fertilizaçã o. Outros autores sugerem que este fato se deve à ausê ncia de cálcio na regiã odo disco germintativo.
E mbora ocálcio nã o seja o responsável pela atraçã odos espermatozoidespara esta área, ele é necessário a ativaçã o do espermatozoide,possivelmente induzindo a reaçã o acrossoma do espermatozoide com o ovócito (HOLM et al. 2000). BAKS T (1988) utilizando a microscopia eletrônica, encontrou diferença no tamanho e no númerode vilosidades na área ao redor do disco germinativo e nas áreas adjacentes a esta estrutura. Isso sugere que as vilosidades na regiã o do disco germinativo estejam associadas a ligaçã o espermática nas aves. Ao redor do disco germinativo há, aproximadamente, 20-25 vezes mais perfurações que nas outras áreas da membrana perivitelínica (BR ANWE LL etal., 1995; WIS HAR T,1997), sendo esta uma relaçã o linear.
Poucos minutos após a ovulaçã o, no magno, a membrana perivitelínica externa é secretada sobre a membrana perivitelínica (BE LLAIR S et al., 1963). E spermatozoides encontrados nesse local estã o aderidos a estrutura proteinácea da membrana perivitelínica externa. Há aproximadamente 10 vezes mais espermatozoides aderidos na membrana perivitelínica externa do que orifícios na membrana perivitelínica.
de determinar a possível correlaçã o entre esses parâmetros e a probabilidade de um ovode galinha estar fertilizado.
Dentre essas, WIS HAR T (1997) relata que um ovotem50% de probabilidade de estar fertilizado se possuir mais que 0,1 espermatozoides na membrana perivitelínica externa por mm2. E m adiçã o, o autor concluiu que um ovo tem 50% de chance de estarfértil se, no mínimo, trê s espermatozoides penetrarem na membrana perivitelínica sobre o disco germinativo, sendo que as maiores taxas de fertilidade foram obtidas quando houve seis perfurações nesta mesma regiã o. R esultados semelhantes foram encontrados por BR ANWE LL et al. (1995) ao pesquisarem a frequê ncia de perfurações espermáticas na membrana perivitelínica, sobre o disco germinativo.
É assumido que o número de espermatozoides aderidos sobre a membrana perivitelínica externa está relacionado com o número de espermatozoides presentes no infundíbulo e na porçã o inicial do magno, no momento da fertilizaçã o (WIS HART, 1997).
Os túbulos de estocagem seminal sã o os principais locais de armazenagem de espermatozoides no oviduto, o número de espermatozoides aderidos na membrana perivitelínica externa ou o número de orifícios da membrana perivitelínica sã o altamente correlacionados com o número de espermatozoides disponíveis para fertilizaçã o de umovo (BAKS T, 1994).
S TAINE S (1998) concluiu que a contagem tanto de orifícios espermáticos na membrana perivitelínica quanto do número de espermatozoides aderidos na membrana perivitelínica externa podem ser utilizadas para estimar a fertilidade deum lote de aves comerciais. A contagem de perfurações espermáticas na membrana perivitelínica também pode ser utilizada para avaliaçã o de sê men de aves e mostra ter, para esta espécie, mais sensibilidade e acurácia em diagnosticar danos as membranas espermáticas que os testes usuais de motilidade e viabilidade (KAS AI, et al. 2000).
eventos citados acima, o que confere ao teste ampla capacidade de avaliaçã o da fertilizaçã o aviária.
A avaliaçã o da quantidade de perfurações espermáticas na membrana perivitelínica é feita por meio de uma técnica descrita, inicialmente, porBRAMWE LL (1992) e modificado em alguns aspectos porDONOGHUE (1996). A técnica consiste na separaçã o e colheitada gema, queépassada cuidadosamente em papel filtro para remoçã o do albúmem remanescente ao redor desta. Uma porçã o de aproximadamente 1 cm2 da membrana perivitelínica na regiã o do disco germinativo é retirada e imersa em soluçã o salina para remoçã o do restante de albúmeme gema. O pedaço da membrana é colocado sobre uma lâmina com auxílio de pinça e agulha e fixado com formalina 20%, retirando-se o excesso logo em seguida. A seguir, algumas gotas do reativode S chiffsã o depositadas sobre esta membrana para cora-la. Após este procedimento, coloca-se uma lamínula sobre a membrana e visualiza a estrutura e perfurações espermáticas em microscópio ótico em aumento de 100 vezes. A contagem é realizada em 5 campos de 0,27 mm2
A proporçã o entre machos e fê meas em um lote parece afetar significativamente o númerode perfurações espermáticas na membrana perivitelínica. Comparando as taxas de fertilidade de matrizes pesadas de trê s idades distintas, HAZARY et al. (2001) encontraram resultados de fertilidade superiores nos lotes nos quais havia um menor número defê meas para cada macho alojado.
Em pesquisas realizadas foi possível determinara correlaçã o entre o número deperfurações espermáticas e a probabilidade de um ovode galinha estarfertilizado. WIS HAR T (1997) relatou que um ovo tem 50% de probabilidade de estar fertilizado se possuir mais que 0,1 espermatozoides na membrana perivitelínica externa por mm2. Em adiçã o, o autor concluiu que um ovo tem 50% de chance de estar fértil se, no mínimo, trê s espermatozoides penetrarem na membrana perivitelínica sobre o disco germinativo, sendo que as maiores taxas de fertilidade foram obtidas quando houve seis perfurações nesta mesma regiã o.
E stes resultados foram semelhantes a uma pesquisa anterior, onde BRANWE LL et al. (1995) pesquisaram a frequê ncia de perfurações espermáticas na membrana perivitelínica, sobre o disco germinativo e correlacionaram com a fertilidade.
estocagemseminal, localizados na junçã o útero-vaginal (BOBR et al.,1964)e podem permanecer viáveis por períodos de até32 dias, sendo emperuas, este tempo pode chegara70 dias (HAFE Z,2004). Osespermatozoides sã o expostos a vários fatores, nos túbulos de estocagem seminal, que suprimem a motilidade, o metabolismo espermático, a enzima acrosina, a imunogenicidade espermática e estabilizam as membranas plasmáticas. Acredita-se que possa haverinfluê nciado zinco, cálcioe do ácido glutâmico nestas mudanças fisiológicas dos espermatozoides nesselocal.
4. MATE R IAL E MÉ TODOS
A pesquisa foi conduzida em galpã o convencional de produçã o de matrizes pesadas, da empresa Pole Alimentos, localizada no Município de Uberlândia, Minas Gerais. As coletas ocorreram entre os meses de J aneiro a J ulho de 2015.
A metodologia utilizada foi aprovada pelo Comitê de É tica em E xperimentaçã o Animal (CE UA) da UFU, e o númerodo certificadodo protocolo CE UA é 012/15.
Neste experimento, foram alojados no total 24.000 pintinhos de um dia da linhagemR oss® AP95, sendo 20.500 fê meas e3.500 machos, que permaneceram no período de recria emdois galpões blackout, de pressã onegativa, em boxes separados específicos para fê meas e machos.
No momento em que as aves atingiram a idade reprodutiva, por volta da 22° semana de vida, as mesmas foram transferidas para os galpões convencionais de produçã o, de pressã o positiva, com cortinas amarelas e ninhos convencionais.
As rações experimentais foram ofertadas a partir da 22° semana de vida. A formulaçã o nutricional da dieta foi a de rotina da granja para machos e fê meas, de acordo com a tabela de recomendaçã o da linhagem (ANE XO 1 e 2). Para o experimento houve a suplementaçã o ou nã o de 6ppm de cantaxantina, segundo os tratamentos:
Tratamento 1 - 10.500 fê meas e 1.500 machos, alojados em um galpã o com suplementaçã o de cantaxantina (6ppm), a partirda22 semana de vida;
Tratamento 2 - 10.500 fê meas e 1.500 machos, alojados em um galpã o sem cantaxantina na raçã o;
A raçã ofornecida para ambos os tratamentos era produzida na mesma fábrica de raçã o. Portanto, a única variávelentre os tratamentos foi a suplementaçã o com6 ppmde cantaxantina nas partidas que se destinaram ao lote teste.
Os galpões tanto da recria, quanto da produçã o eram iguais em estrutura, equipamentos, tratadores e estavam localizados na mesma granja.
As coletas se iniciaram na 30° semana de vida do lote e se repetiram nas semanas 40 e50 de vida das aves.
cromatina dos espermatozoides, além de também, serem obtidasas taxas de eclosã o e fertilidade como medidas de rotina da granja.
4.1. Contagem da Perfuraçã o espermáticada membranaperivitelínea
Para a realizaçã o do teste de contagem das perfurações da membrana perivitelínea, foram coletados cerca de 60 ovos, em cada uma das idades de coleta (30, 40 e 50 semanas de vida das aves). Dos 60 ovos coletados, foi esperado obter- se uma média de resultado de 10 ovos, devido ao alto índice de perdas no processamento das amostras para esta técnica. Portanto, o n amostral para esta análise foi de 10 ovos, por tratamento e poridade.
Portanto, ao final do processamento os resultados contaram com dois tratamentos (T1 - sem cantaxantina e T2 - com cantaxantina), sendo 10 repetições cada, em trê s idades distintas:30,40e50 semanas de vida.
Os ovos foram retirados de forma aleatória da segunda coleta de ovos do dia. Após a coleta, foram encaminhados ao laboratório onde se iniciava o processamento.
A técnica para contagem das perfurações utilizada no experimento foi descrita inicialmente por BR ANWE LL (1992) e modificado em alguns aspectos por DONOGHUE (1996).
Cada ovo teve sua gema cuidadosamente separada da clara. Uma porçã o de aproximadamente 1 cm2 da membrana perivitelínica na regiã o do disco germinativo foiretirada eimersaemPBS para remoçã o do restante de albúmem e gema. O pedaço da membrana foi colocado e posicionado esticado sobre uma lâmina com auxílio de pinça e fixado com formalina 20%. Posteriormentefoi utilizado comocorante algumas gotas do reativo de S chiff. Colocou-se lamínula sobre a membrana corada e fixada e seguiu-se para a análise em microscópio de luz em aumento de 100vezes.
De cada lâmina foi localizada a regiã o onde havia ocorrido as perfurações espermáticas e a contagem no número de perfurações foi realizada.
4.2. Mensurações de túbulos seminíferos detestículos de galos
Fragmentosde 0,5 cm3 foram obtidos do testículo, de cada galo, efixados em soluçã o de formol 10% porno mínimo 24horas.
Após este período foram submetidos à s técnicas histológicas de rotina (desidrataçã o, diafanizaçã o e inclusã o em parafina), seguindo metodologia proposta por MAIA (1979). Cortes de 5pm foram preparados em micrótomo antes de serem submetidos à coloraçã o por hematoxilina-eosina.
Posteriormente as lâminas confeccionadas foram observadas ao microscópio de luz,e microfotografadas para análisese mensurações do diâmetro total e da altura do epitélio dos túbulos seminíferos, utilizando-se o software HL Image®. Foram fotografados emedidosemmédia doze túbulos seminíferos por animal.
4.3.Análise dacompactaçã odacromatinados espermatozoides
Nas idades de 30, 40 e50 semanas,foiselecionadodemaneira aleatória cerca de 20 galos de cada tratamento. E stes galos eramcolocados em boxes separados das fê meas, por 3 diasantes da coleta de sê men.
O sê men foi coletado conforme descrito por BUR R OWS & QUINN (1937), comométodo de massagens abdominais, conformerepresentadonaFigura5.
Para avaliaçã o em microscopia eletrônica de transmissã o, aproximadamente 0,5 mL de sê men de cada amostrafoi colocado em microtubo de 2 mL e o volume foi completado com a soluçã o fixadora Glutaraldeído 5%. E stas amostras foram centrifugadas (100 x g) por 5 minutos e o sobrenadante foi descartado. Posteriormente, o pellet foi ressuspendido em tampã o fosfato e novamente centrifugado nas mesmas condições anteriores, descartando-se o sobrenadante. E sse procedimento foi repetido trê s vezes para eliminar o máximo de resíduo de glutaraldeído. O pellet da última centrifugaçã o foi ressuspendido em 300 pL de agar 4% liquefeito a 55oC. Após o resfriamentoemtemperatura ambiente o agartornou-se sólido e foi retirado do tubo e recortado em fragmentos de aproximadamente 1 mm3. E sses fragmentos foram pós-fixados em soluçã o de tetróxido de ósmio 1% por 30 minutos e em detetróxidode ósmio 1% e ferrocianetode potássio 1,25% pormais de 30 minutos. E stes fragmentos foram desidratados em séries crescentes deacetona a 50%, 70%, 80%, 90%, 95%, 100%, 100% e 100% ficando 5 minutos nos cinco primeiros banhos e 10 minutos nos trê s últimos. Posteriormente, o material foi colocado em soluçã ode resina E pon e acetona na proporçã o 1:1 por 12 horas. Após esse período, a soluçã o contendo o materialfoi colocada na estufa a 37°C por 12 e posteriormente em soluçã o pura por mais 4 horas. E m seguida os blocos foram incluídos em resina pura e mantidos durante 2 dias em estufa a 60°C. Finalmente, os blocos foram submetidos a cortes ultrafinos em ultra-micrótomo, os quais foram colocados em telas de cobre de 200 mesh e contrastados com acetato de uranila e nitrato de chumbo (BOZZOLA;RUS S E LL, 1998).
Todas as amostrasforamanalisadas em microscópioeletrônico de transmissã o Microscópio E letrônico de Transmissã o Tecnai G2-12 - S piritBiotwin FE I - 120 kV, quando foram avaliadas 80 cabeças de espermatozoides de cada amostra.
4.4. Eclosã oe Fertilidade
Os dados de eclosã o foram obtidos pela empresa PoleAlimentos, responsável pela incubaçã o dos ovos, de acordo com a formula de eclosã o:
n°pintos nascidos x 100 E closã o=_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
n°ovos incubados total
Os ovos foram incubados em máquinas do modelo de estágio múltiplo, com período de estocagem médio de sete dias. No 19° dia de incubaçã o, ocorreu a transferê ncia dos ovos para nascedouros, onde permaneceram atécompletarem 21 dias.
Para a análise de fertilidade, os ovos foram submetidos a quebra e análise visual do disco germinativo e classificados como fértil ou nã ofértil, no segundo dia de estocagem, após as 50 semanas de idade, semanalmente, 50 ovos por tratamento, conforme padrã o da empresa.
n°de ovos férteis x 100 Fertilidade=_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
n°ovos avaliadaos
4.5. Análise estatística
Para a análise estatística, os dados foram verificados quanto à presença de valores discrepantes (outliers).
Os dados referentes aos testes de perfuraçã o espermática da membrana perivitelínea, e eclosã o, foram submetidos ao teste de normalidade e homocedasticidade de variância e posteriormente ao teste de Kruskal - Wallis (RODRIGUE S , 2016).
O nível de significância foi estabelecido em 0,05, em um teste bilateral.
O nível de significância foi estabelecido em 0,05, em um teste bilateral.
Para verificar a existê ncia ou nã o de diferenças, estatisticamente significantes, entreas medidas testiculares, foi também aplicado após averificaçã o da normalidade dos dados, o teste T para duas médias.
O nível de significância foi estabelecido em 0,05, em um teste bilateral.
5. R E S ULTADOS
Os resultados do teste de perfuraçã o espermática na membrana perivitelínea (PE MP) estã o demostrados na tabela 1.
Tabela 1 - Número médio de perfurações espermáticas na membrana perivitelínea de ovos provenientes de lote suplementado com cantaxantina (T1) e nã o suplementado com cantaxantina (T2) em trê s idades distintas.
S emana T1 T2 p valor
30 266 a 71 b 0.049*
40 344 a 114 b 0.041*
50 190 a 75 b 0.021*
Letras distintas indicam diferenças significativas entre os valores (p < 0.05).
De acordo com os resultados demonstrados na tabela 1, foram encontradas diferenças, entre o número de perfurações espermáticas, obtidos nas, 30, 40 e 50 semanas de idade, sendo que nas trê s idades observadas, a maior taxa de perfuraçã o dos espermatozoides ocorreuno lote suplementado com cantaxantina.
O grupo que recebeu o aditivo antioxidante apresentou maiorquantidade de perfurações espermáticas na membrana perivitelínea, indicando também possíveis melhorias nas taxas de fertilidade e eclosã o.
Os resultados do teste estatístico para verificar ou nã o a diferença entre o númerode PE MP com relaçã o a idade dos lotes está representada na tabela 2.
Tabela2. Teste de probabilidades para as variáveis tempo de análise - 30, 40 e 50 semanas - e tratamento, com cantaxantina (T1) e sem cantaxantina (T2), para oteste de perfuraçã oda membrana perivitelínea.
Tratamentos S emanas P valor
T1 30 a 50 a 0.42
T2 30 a 50 a 0.96
Letras distintas indicam diferenças significativas entre os valores (p < 0.05).