UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE TECNOLOGIA
DEPARTAMENTO DE ENGENHARIA QUÍMICA
PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA QUÍMICA
JANAINA MARIA MARTINS VIEIRA
MACERAÇÃO ENZIMÁTICA DA CASCA RESIDUAL DO DESPOLPAMENTO DOS FRUTOS DA CAJAZEIRA
MACERAÇÃO ENZIMÁTICA DA CASCA RESIDUAL DO DESPOLPAMENTO DOS FRUTOS DA CAJAZEIRA
Tese apresentada ao Programa de Pós-Graduação em Engenharia Química da Universidade Federal do Ceará, como requisito parcial à obtenção do título de Doutor em Engenharia Química. Área de concentração: Processos Químicos e Bioquímicos.
Orientador: Dr. Gustavo Adolfo Saavedra Pinto.
JANAINA MARIA MARTINS VIEIRA
MACERAÇÃO ENZIMÁTICA DA CASCA RESIDUAL DO DESPOLPAMENTO DOS FRUTOS DA CAJAZEIRA
A Deus.
AGRADECIMENTOS
A Deus, por me permitir estar aqui.
À Universidade Federal do Ceará pela oportunidade de realizar a graduação em Engenharia de Alimentos, o Mestrado em Engenharia Química e agora o Doutorado também em Engenharia Química.
Ao Dr. Gustavo Saavedra, pela orientação durante a pesquisa e também pelo exemplo de profissional, ajudando sempre no experimento e também orientando para o futuro profissional.
À Embrapa Agroindústria Tropical, pela oportunidade de realização da parte experimental deste trabalho nas dependências do Laboratório de Bioprocessos e do Laboratório de Processos Agroindustriais.
À Drª. Kally Alves, pelos ensinamentos, paciência e colaboração dada, principalmente no tratamento estatístico.
À pesquisadora da Embrapa Ana Paula Dionísio, pela grande ajuda nas análises de carotenoides.
Ao Prof. Dr. José Maria pela colaboração na fase final do trabalho.
À Prof. Drª. Rossana Figueirêdo, pela participação na banca e considerações feitas na finalização da tese.
À Prof. Drª. Lucicléia Barros, pela disponibilidade e pela colaboração.
À Natália Moura pela ajuda constante na organização dos meus trabalhos, como também pela amizade e pelos momentos maravilhosos de companheirismo.
Ao pesquisador da Embrapa, Lindbergue Araújo Crisóstomo, que a cada safra de cajá de seu sítio, cedia parte de sua safra para a obtenção de polpa e película comestível para serem utilizadas em diferentes trabalhos de Pós-Graduação do Laboratório de Bioprocessos.
À Novozymes, pela disponibilização das preparações enzimáticas.
À Universidade Federal de Campina Grande pela flexibilização dos horários e pelo entendimento para que eu conseguisse seguir o doutorado.
À Funcap, pelo apoio financeiro com a manutenção da bolsa de auxílio durante 2 anos do doutorado.
Aos professores do Programa de Pós-graduação do Departamento de Engenharia Química pela convivência, paciência e ricos ensinamentos.
A todos do Laboratório de Bioprocessos da Embrapa Agroindústria Tropical que estiveram ao meu lado nas etapas mais importantes deste trabalho. Agradeço em especial a Adriana Crispim, Carina Lemos, Andréa Cardoso, Cyntia Ladyane, Renata Débora, Cívita Sousa, Suzanne CQ, Natália Lima, Helder Levi, Ruann Janser, Genilton Faheina, Caroline Gondim, Rakel Hina, Mariza Vieira e Ana Paula Colares. A vida e o trabalho ao lado de vocês é bem mais leve e divertida.
À Virna Luiza, pela amizade sincera, pela ajuda sempre constante, pelas dúvidas tiradas via email, facebook, telefone ou mensagens e por compartilhar dos vários momentos, sejam eles alegres ou tristes.
Aos meus pais, Itamar e Margaret, por sempre pensarem em mim antes de pensar em si mesmos. Por terem renunciado de muitas coisas e momentos para que eu realizasse esta etapa tão importante para mim e para minha vida. Muito obrigada por simplesmente tudo que fizeram e fazem por mim.
À minha irmã Marieta, pelos conselhos, pelas brigas, discussões, crises existenciais, tudo foi importante para as minhas decisões e para que continuasse a minha caminhada.
À minha irmã Luciana, e minhas queridas sobrinhas Ana Letícia e Lavínia pelos finais de semana de descontração e alegria que me fortaleciam.
À tia Marta, por simplesmente existir e sempre estar disponível a ajudar sem medir esforços.
À minha irmã Neide e sua família, obrigada por sempre me ajudar e me escutar quando eu precisei.
Ao Gerson, pela tranquilidade passada, pela paciência prestada, por sempre ter a solução dos meus problemas e me ajudar de toda forma possível para que eu não sentisse tanto a distância entre o meu trabalho e o Doutorado, além de entender o meu cansaço e a minha indisposição principalmente. Enfim, obrigada por tudo que tem feito.
Aos amigos Carlos Eliardo, Marina Rebouças, Ilane Ximenes, Juliana Aderaldo, Guilherme Sobral, Jéfferson Malveira, Francisca Maria, Milena Maria, Patrícia Barreto, Karine Macedo e Joaquim Sotero, pela amizade, por aguentar meus desabafos, pelas palavras de apoio. Tudo isso se transformou em força e me fez chegar até aqui.
O que vale na vida não é o ponto de partida, e sim a caminhada. Caminhando e semeando,
no fim terás o que colher."
RESUMO
O Brasil é um dos países que mais produz resíduos agroindustriais, como os resíduos de frutas pelas indústrias de polpas, o que tem contribuído para o aumento da produção do lixo orgânico provocando graves problemas ambientais. O Nordeste se destaca devido à enorme diversidade de frutos considerados exóticos, sendo o cajá (Spondias mombin L.) um forte exemplo. Este fruto contém substâncias antioxidantes, presença de compostos fenólicos, tais como flavonoides, ácidos fenólicos, antocianinas, carotenoides, além das vitaminas A e C. Desta forma, este estudo propôs caracterizar e quantificar a película comestível de cajá a fim de direcionar o processo de extração de carotenoides por maceração enzimática e assim determinar a melhor condição, através de um planejamento experimental, além de avaliar a influência de fatores físicos e físico-químicos na maceração enzimática de película comestível de cajá, e por fim realizar a maceração enzimática de película de cajá em reator de bancada e obter um produto em pó através de secagem por atomização. A película de cajá apresentou-se como uma boa fonte de carotenoides, onde a melhor condição para recuperação de carotenoides foi ao utilizar 300 µL do complexo enzimático Pectinex XXL durante o período de 3 horas de incubação, conseguindo o teor de 120,94 µg/g. Dentre os fatores físicos e físico-químicos, a utilização de preparações enzimáticas de caráter celulolíticos junto às preparações pectinolíticas, para a recuperação de carotenoides de película comestível de cajá, não se mostrou eficiente e o ajuste do pH próximo à neutralidade (pH 6,0), antes de iniciar a maceração mostrou-se eficiente para uma maior recuperação de carotenoides, isto a nível laboratorial. A quantidade de água adicionada no processo não altera a recuperação de carotenoides, podendo ser utilizada nas proporções película: água de 1: 2, 1: 3 ou 1: 4. O emprego do ultrassom associado à maceração enzimática funcionou em escala laboratorial. A utilização de reator de bancada foi tecnicamente viável especialmente pela melhora das condições de homogeneização da mistura reacional, o que por sua vez levou à obtenção de maior teor de carotenoides recuperados na fase aquosa, não sendo necessário ajuste do pH do meio reacional. A secagem por atomização foi possível sendo necessária uma adequação dos fatores que influenciam a secagem para que se encontre a melhor condição.
ABSTRACT
Brazil is one of the countries that most produces organic residues, such as residues of fruit pulp industries, which have contributed to the increased production of organic waste causing serious environmental problems. The Brazilian Northeast stands out due to the huge diversity of fruits considered exotic, where the yellow mombin (Spondias mombin L.) is a good example. This fruit contains antioxidants, phenolic compounds such as flavonoids, phenolic acids, anthocyanins, carotenoids, and also vitamins A and C. Thus, this study aimed to characterize and quantify the yellow mombin edible peel, in order to direct the process of extraction of carotenoids by enzymatic maceration and then determine the best condition, through an experimental design, and also to evaluate the influence of physical and physico-chemical factors on enzymatic maceration of the yellow mombin edible peel, and finally performing enzymatic maceration in the the yellow mombin edible peel in a batch reactor and obtain a product powder through spray drying. The yellow mombin edible peel presented himself as a good source of carotenoids, where the best condition for recovery of carotenoids was using 300 µL of the Pectinex enzymatic complex XXL during 3 hours of incubation, reaching the level of 120.94 µg/g. Among the physical and physico-chemical factors, the use of enzyme preparations of cellulolytics status with the pectinolytic preparations for the recovery of carotenoids yellow mombin edible peel was not efficient, and adjusting the pH to neutrality (pH 6.0) before starting maceration proved efficient for a greater recovery of carotenoids, that in the laboratory level. The amount of water added in the process does not alter the recovery of carotenoids, used in proportions skin: water of 1: 2, 1: 3 or 1: 4. The use of ultrasound associated with enzymatic maceration worked at the laboratory scale. The use of batch reactor was technically feasible especially for the improvement of the conditions of homogenization of the mixture, which in turn led to obtaining higher levels of carotenoids recovered in the aqueous phase, not being necessary to adjust the pH of the reaction environment. Spray drying was possible being necessary suitability of the factors that influence drying to find the best condition necessary.
LISTA DE ILUSTRAÇÕES
Figura 1- Fruto da cajazeira em diversos tamanho (A), fruto da cajazeira em tamanho médio
(B) e fruto em corte transversal (C). ... 17
Figura 2 - Estrutura de alguns carotenoides. ... 25
Figura 3 – Estrutura da parede celular vegetal. ... 27
Figura 4 - Fluxograma de obtenção da película comestível de cajá. ... 39
Figura 5 - Obtenção da película comestível de cajá: cajás congelados (A), tanque para separação da película e caroços (B) e película comestível (C)... 39
Figura 6 – Esquema do tratamento enzimático da película comestível de cajá. ... 42
Figura 7 – Diagrama de Pareto para a variável dependente grupos redutores totais (GRT). ... 51
Figura 8 – Diagrama de pareto para a variável dependente sólidos solúveis totais (SST). ... 53
Figura 9 – Diagrama de Pareto para a variável dependente resíduo seco. ... 55
Figura 10 – Diagrama de Pareto para a variável dependente teor de carotenoides na fase aquosa. ... 56
Figura 11 – Preparação da maceração enzimática da película comestível de cajá com associação do ultrassom... 67
Figura 12 – Reator de bancada utilizado na maceração enzimática de película comestível de cajá (A) e a dorna utilizada (B). ... 84
Figura 13 – Fases da maceração enzimática da película comestível de cajá. Película comestível de cajá (A), trituração realizada antes da maceração enzimática em reator (B), dorna vazia (C), dorna com película triturada e água (D), dorna após a maceração durante 3h (E) e líquido obtido na maceração enzimática da película comestível de cajá, após a separação da fase sólida (F e G). ... 87
Figura 14 – Secagem em spray dryer dos extratos de carotenoides obtidos por maceração enzimática de película comestível de cajá. Secagem do extrato direto em spray dryer (A), secagem do extrato adicionado do adjuvante maltodextrina De 4,0 – 7,0 (B). ... 90
LISTA DE TABELAS
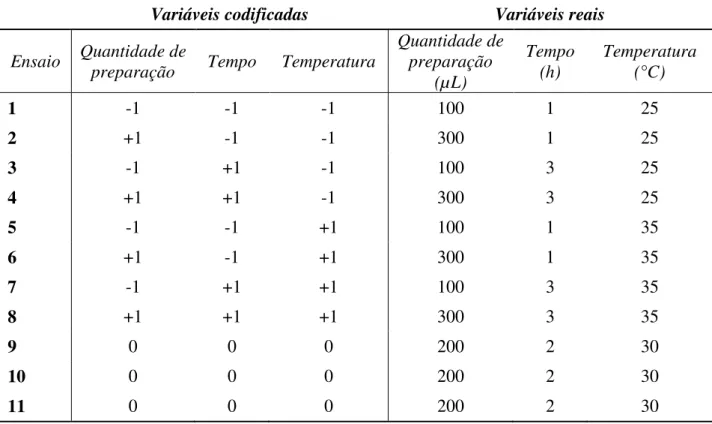
Tabela 1 – Matriz do planejamento fatorial 2k completo, com valores reais e codificados das
variáveis independentes. ... 43
Tabela 2 – Rendimento das frações após o processamentode cajá... 45
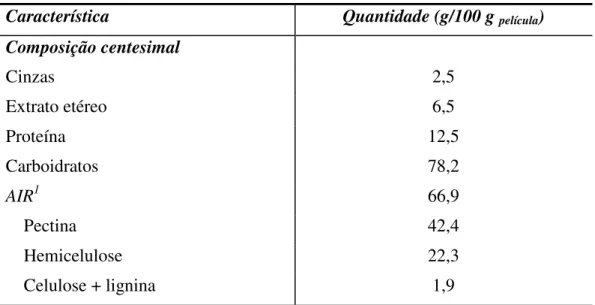
Tabela 3 – Caracterização da película comestível de cajá, em base seca. ... 46
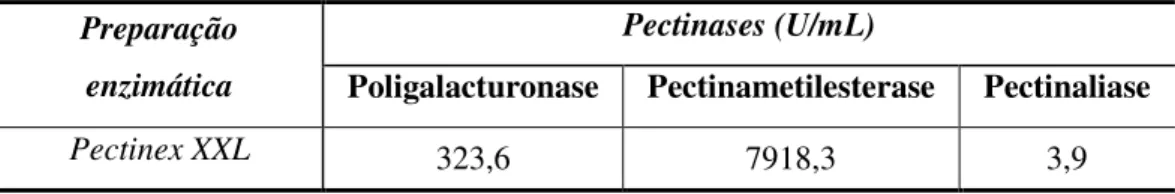
Tabela 4 – Atividade enzimática do complexo enzimático Pectinex XXL. ... 47
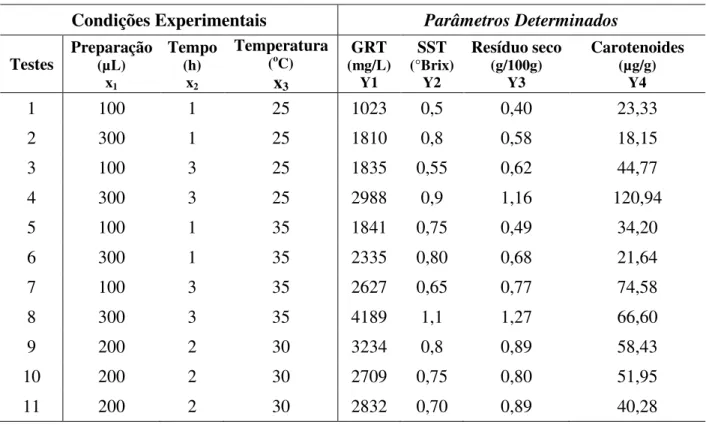
Tabela 5 – Variáveis dependentes determinadas em cada condição experimental. ... 49
Tabela 6 – Análise da variância para as respostas Y1, Y2, Y3 e Y4. ... 50
Tabela 7 – Combinações das enzimas Pectinex XXL e Celluclast. ... 64
Tabela 8 – Atividade enzimática do complexo enzimático Pectinex XXL e Celluclast. ... 70
Tabela 9 – Resultados das análises de grupos redutores totais (GRT), resíduo seco e teor de carotenoides totais para as macerações enzimáticas utilizando combinações das preparações comerciais Pectinex XXL e Celluclast. ... 71
Tabela 10 – Valores de pH das amostras de maceração enzimática. ... 72
Tabela 11 – Teor de grupos redutores totais (GRT), sólidos solúveis totais (SST), resíduo seco e teor de carotenoides totais para amostra controle e amostra com ajuste de pH. ... 73
Tabela 12 – Teor de grupos redutores totais na fase líquida de película de cajá. ... 74
Tabela 13 – Teor de carotenoides na fase líquida e na fase sólida determinados na película de cajá, com diferentes quantidades de água adicionada. ... 74
Tabela 14 – Porcentagem de recuperação de carotenoides na fase líquida de película de cajá. ... 75
Tabela 15 – Teor de carotenoides na fase aquosa e na fase sólida determinados na película de cajá, utilizando maceração enzimática associada à utilização do ultrassom. ... 76
Tabela 16 – Teor de grupos redutores totais na fase aquosa de película de cajá. ... 77
Tabela 17 – Resultados das análises realizadas após a maceração em reator de bancada de película comestível de cajá. ... 88
SUMÁRIO
INTRODUÇÃO ... 14
CAPÍTULO 1. REVISÃO BIBLIOGRÁFICA ... 16
1.1. Cajá ... 16
1.2. Resíduos agroindustriais ... 19
1.3. Carotenoides ... 22
1.4. Maceração enzimática ... 26
CAPÍTULO 2. CARACTERIZAÇÃO E MACERAÇÃO ENZIMÁTICA DA PELÍCULA COMESTÍVEL DE CAJÁ (Spondias mombin L.) ... 37
2.1. INTRODUÇÃO ... 37
2.2. MATERIAL E MÉTODOS ... 38
2.2.1. Obtenção e preparação da película comestível de cajá... 38
2.2.3. Caracterização da película comestível de cajá ... 40
2.2.4. Maceração enzimática da película comestível de cajá ... 42
2.2.5. Atividade enzimática do complexo Pectinex XXL ... 43
2.2.6. Determinações analíticas na maceração enzimática ... 44
2.3. RESULTADOS E DISCUSSÃO ... 45
2.4. CONCLUSÃO ... 57
REFERÊNCIAS BIBLIOGRÁFICAS ... 58
CAPÍTULO 3. INFLUÊNCIA DE FATORES FÍSICOS E FÍSICO-QUÍMICOS NA MACERAÇÃO ENZIMÁTICA DE PELÍCULA COMESTÍVEL DE CAJÁ ... 62
3.1. INTRODUÇÃO ... 62
3.2. MATERIAL E MÉTODOS ... 63
3.2.1. Teste 1: Avaliação de duas diferentes preparações enzimáticas comerciais na maceração enzimática da película comestível de cajá ... 64
3.2.2. Teste 2: Ajuste de pH para a maceração enzimática da película comestível de cajá ... 64
3.2.3. Teste 3: Proporção película:água utilizada na maceração enzimática da película comestível de cajá ... 65
3.2.5. Determinações analíticas ... 67
3.3. RESULTADOS E DISCUSSÃO ... 69
3.3.1. Teste 1: Avaliação de duas diferentes preparações enzimáticas comerciais na maceração enzimática da película comestível de cajá ... 69
3.3.2. Teste 2: Ajuste de pH para a maceração enzimática da película comestível de cajá ... 72
3.3.3. Teste 3: Proporção película: água utilizada na maceração enzimática da película comestível de cajá ... 73
3.3.4. Teste 4: Efeito do uso do ultrassom associado à maceração enzimática da película comestível de cajá ... 75
3.4. CONCLUSÃO ... 78
REFERÊNCIAS BIBLIOGRÁFICAS ... 79
CAPÍTULO 4. MACERAÇÃO ENZIMÁTICA DE PELÍCULA COMESTÍVEL DE CAJÁ EM REATOR DE BANCADA ... 82
4.1. INTRODUÇÃO ... 82
4.2. MATERIAL E MÉTODOS ... 83
4.2.1. Maceração enzimática em reator de bancada ... 83
4.2.2. Secagem do extrato ... 84
4.2.3. Determinações analíticas ... 85
4.3. RESULTADOS E DISCUSSÃO ... 86
4.3.1. Maceração enzimática ... 86
4.3.2. Secagem do extrato ... 89
4.4. CONCLUSÃO ... 94
REFERÊNCIAS BIBLIOGRÁFICAS ... 95
INTRODUÇÃO
As tendências do mercado mundial de alimentos apontam para alto crescimento no consumo de produtos naturais, como as frutas e verduras. Nos últimos anos, o Brasil apresentou expressivo crescimento no comércio internacional do agronegócio, consolidando sua posição como um dos maiores produtores e exportadores de alimentos (BUENO; BACCARIN, 2012). A fruticultura brasileira teve um ano de manutenção do desempenho geral, 2011 apresentou volumes praticamente iguais aos obtidos anteriormente, 42.101 milhões de toneladas. O Brasil exporta 25 espécies de frutas frescas, no entanto, a produtividade aumentou sem ocupar extensão maior. Nesse sentido, os produtores dos polos estão buscando soluções para elevar a rentabilidade, investindo em variedades mais produtivas (ANUÁRIO FRUTICULTURA, 2012).
O desenvolvimento da indústria conduz à produção de resíduos e no processo de obtenção de alimentos, além do produto desejado são gerados subprodutos residuais. A maioria dessas indústrias não tem qualquer plano para gerir os subprodutos formados devido ao custo elevado da reutilização. Estes resíduos, quando gerados a partir de frutas podem ser reutilizados em alimentos e rações, fertilizantes, biocombustível, óleos essenciais, pectinas, recuperação de compostos como carotenoides e flavonoides, entre outros (DAMODARAN; PARKIN; FENNEMA, 2010; YEPES; NARANJO; SÁNCHEZ, 2008). Os carotenoides, especificamente, são compostos lipossolúveis que formam um dos mais importantes grupos de pigmentos naturais encontrados na natureza e são insolúveis em meio aquoso. Embora as principais fontes dos carotenoides sejam as plantas, eles são também encontrados nos micro-organismos e nos animais, sendo armazenados em diferentes tecidos. No entanto, o conteúdo de carotenoides nos frutos depende da espécie, variedade, safra e grau de maturação. A distribuição destes compostos também apresenta variações consideráveis, sendo geralmente mais concentrados na película do que na polpa de alguns frutos (RODRIGUEZ-AMAYA; KIMURA, 1989).
econômica ainda está em fase de domesticação. Essa espécie sofre diversos tipos de exploração, dentre os quais se destaca o extrativismo que é a forma mais comum de obtenção. O sabor característico deve-se ao elevado teor de glicídios e de vitamina C. O conhecimento do valor nutritivo do cajá assume importância considerável, uma vez que a aplicação de métodos eficientes de processamento é diretamente vinculada ao entendimento das propriedades nutricionais desse fruto (RODRIGUES et al., 2010; ALMEIDA et al., 2009).
A aplicação de enzimas é utilizada para a extração de uma variedade de compostos, incluindo a extração de carotenoides a partir de frutos ou resíduos de plantas. Essa nova tecnologia é objeto de estudo contínuo e tem potencial para ser comercialmente atraente (PURI; SHARMA; BARROW, 2012). O processo de maceração e liquefação é considerado uma tecnologia limpa, a qual consiste em tratar o triturado com preparações enzimáticas compostas por poligalacturonases e celulases a uma temperatura ótima por um determinado período de tempo e promover uma hidrólise da parede celular (GRANERO et al., 2012).
Sabendo-se da presença de carotenoides no cajá, e principalmente em seus resíduos, investigou-se a maceração enzimática na recuperação de carotenoides da película comestível de cajá. A grande vantagem seria a transformação de um resíduo, sem valor comercial, em ingredientes para utilização e aproveitamento em outros ramos da indústria.
Como objetivos específicos foram definidos:
• Caracterizar e quantificar o rendimento da película comestível de cajá a fim de
direcionar o processo de extração de carotenoides por maceração enzimática e assim determinar a melhor condição para a realização da maceração enzimática de película comestível de cajá.
• Avaliar a influência de fatores físicos e físico-químicos na maceração enzimática de
película comestível de cajá, como a adição de celulases à maceração, ajuste do pH, quantidade de água adicionada e o uso do ultrassom associado à maceração enzimática na extração de carotenoides presentes na película comestível de cajá.
• Realizar a maceração enzimática de película de cajá em reator de bancada e obter um
CAPÍTULO 1. REVISÃO BIBLIOGRÁFICA
1.1. Cajá
O gênero Spondias é um fruto tropical da família Anacardiaceae, com cerca de 14 espécies em todo o mundo. Existem relatos de sua origem na Ásia e sua dispersão para as Américas ocorreu no Eoceno Atlântico Norte ou por dispersões de longa distância através do Pacífico. No Brasil, os representantes mais significativos têm como centro de diversidade o bioma Caatinga e as florestas úmidas, sendo a Spondias mombin uma das espécies espontâneas regionais com potencial socioeconômico promissor no cenário agroindustrial do Nordeste brasileiro. Isso, devido sua qualidade sensorial e diversidade de formas de consumo dos frutos, muito embora, em razão do seu caráter essencialmente extrativista, ainda permaneça na condição de cultivos não domesticados, para os quais inexistem sistemas de produção definidos (DUVALL, 2006; LEDERMAN; LIRA JÚNIOR; SILVA JÚNIOR, 2008).
A cajazeira é conhecida na Amazônia como taperebá e cajazeira miúda e em São Paulo, Minas Gerais e Bahia como cajá pequeno ou mirim. As plantas são de porte alto com frutos nuculânios perfumados, com mesocarpo carnoso, amarelo, de sabor agridoce e que se desprendem da planta quando maduros, possuindo até 6 cm de comprimento, formato ovóide ou oblongo, casca fina e lisa, polpa pouco espessa e ácida (GOMES, 2007; CAVALCANTE, 1996; SACRAMENTO; SOUZA, 2000).
comercialização dos frutos é feita em feiras livres, às margens de rodovias próximas às unidades de produção e nas indústrias de processamento de polpas.
Figura 1- Fruto da cajazeira em diversos tamanho (A), fruto da cajazeira em tamanho médio (B) e fruto em corte transversal (C).
A cajazeira ainda não é cultivada em escala comercial e de exploração extrativa, sendo considerada planta em domesticação, mesmo assim tem participação crescente no agronegócio da região Nordeste. Para que se promova a viabilidade econômica a nível comercial da cajazeira, é necessário que a pesquisa se aprofunde no conhecimento de caracteres específicos da planta visando a solução de problemas tecnológicos que resultem na otimização do rendimento e qualidade dos frutos, tanto para consumo ao natural como para processamento agroindustrial (LIRA JUNIOR et al., 2005).
Apesar do impacto das frutas na economia brasileira e, com o conhecimento de seus atributos como fontes de diversas vitaminas, carboidratos, sais minerais e lipídios, aliado às suas qualidades organolépticas, pouco se sabe sobre o potencial de uso de algumas frutíferas e sua importância no agronegócio brasileiro (MOREIRA et al., 2002).
O cajá, por ser considerado um fruto muito perecível, tem na extração da sua polpa um menor desperdício de matéria-prima, entre as operações mais comumente empregadas na indústria de alimentos para a utilização de frutas (MATTIETTO et al., 2010). No entanto, por melhor que seja o método aplicado, ocorrem perdas de nutrientes. Os carotenoides, por exemplo, se concentram nas camadas mais externas e são perdidos em processos que exigem a retirada da casca (MATTIETTO et al., 2010, apud SGARBIERI, 1987). Segundo Rodriguez-Amaya (2008), a retirada da casca de frutas e a extração de seu suco resultam em perdas substanciais de carotenoides, podendo superar as perdas em tratamentos térmicos.
beneficiamento de frutas como o cajá nos estados do Ceará e Rio Grande do Norte, e diagnosticaram que mesmo com o aumento crescente de indústrias de polpa de frutas no Nordeste, estas ainda se enquadram como micro empresas e não dispõem de equipamentos necessários para produção elevada de polpas. Assis et al. (2006) realizaram um trabalho de medição das propriedades termofísicas como condutividade térmica, difusividade térmica, densidade e viscosidade aparente de suco de cajá. Cavalcante et al. (2009) avaliaram as características físicas e químicas de cajás oriundos de plantas espontâneas localizadas na Microrregião do Brejo Paraibano, visando o consumo in natura e verificaram que os frutos possuíam grande variação nas suas características físicas, sendo necessário uma caracterização em relação a cada município em que as plantas estão disseminadas. As características físico-químicas e a composição centesimal da polpa de cajá congeladas foram estudadas por Monção et al. (2010), onde os autores detectaram grande heterogeneidade do produto final.
Rodriguez-Amaya e Kimura (1989) determinaram a composição de carotenoides e o valor de vitamina A do cajá, detectando e identificando 7 carotenoides como o -caroteno, -caroteno, -caroteno, zeinoxantina, criptoxantina, criptoflavina e luteína. A polpa com casca apresentou um conteúdo total de carotenoides de 25,8 µg/g, o conteúdo total da polpa foi de 17 µg/g. Em termos de vitamina A, a remoção da casca causa um decréscimo de aproximadamente 30%. Desta forma, estes autores sugerem que em termos nutricionais é melhor se consumir o cajá com a casca, que segundo Silva et al. (1997) também é chamada de película comestível.
Tiburski et al. (2011) avaliaram a composição centesimal, conteúdo de minerais, compostos fenólicos totais, atividade antioxidante e caracterizaram os carotenoides da polpa congelada do cajá. Os resultados indicaram uma quantidade importante de potássio e cobre, e identificaram cinco carotenoides, -criptoxantina, luteína, zeinoxantina, e caroteno, sendo -criptoxantina a principal, representando o nível elevado de atividade pró-vitamínica A na polpa. Os autores afirmam que uma porção de 100 g de polpa de cajá pode fornecer mais de 37% da dose diária recomendada de vitamina A.
Outros estudos também estão sendo realizados com componentes do cajá. Silva et al. (2012b) investigaram a secagem do bagaço de cajá usando um secador de bandejas de convecção com a finalidade de avaliar a influência da temperatura, velocidade do ar de secagem e a espessura do material no teor de umidade do bagaço de cajá. Vieira (2010) estudou os parâmetros para a maceração enzimática de película comestível de cajá com o intuito de recuperar carotenoides. Ferreira et. al. (2011) utilizaram o resíduo do cajá como meio de fermentação em estado sólido para verificar o efeito do tempo de fermentação e umidade sobre a atividade específica da enzima endoglucanase produzida, sob a ação do fungo Aspergillus niger, concluindo que a biotransformação do resíduo de cajá sob fermentação em estado sólido é uma forma viável de obtenção da enzima endoglucanase.
Silva et al. (2012a) determinaram a composição química, antioxidante e atividade antimicrobiana de espécies de Spondias para justificar seu uso etnofarmacológico, enfatizando que as folhas de Spondias tuberosa e Spondias mombin L. tem sido utilizada para fins medicinais. O resultado do trabalho foi satisfatório verificando dentre os fatores estudados que os extratos de Spondias demonstraram alto rendimento de flavonoides.
Apesar de existirem poucas informações tecnológicas a respeito do seu processamento. A literatura especializada apresenta poucos trabalhos, não muito abrangentes, cujos resultados são de pouco alcance em função da restrita divulgação (MENDONÇA et al., 2008).
1.2. Resíduos agroindustriais
As normas que definiam e regulavam a gestão de resíduos sólidos, até 2010, tinham como características sua dispersão em corpos legais diferentes, às vezes, conflitantes entre si, emanados de órgãos públicos também diferentes, com normas estabelecidas com objetivos diversos nos três níveis de poder e nos três poderes da República (GODOY, 2013).
d’água, ou exijam para isso soluções técnicas ou economicamente inviáveis em face da melhor tecnologia disponível.
Della, Kühn e Hotza (2005) avaliaram os processos de reciclagem de resíduos agroindustriais e sugeriu que estes resíduos não podem mais ser definidos como lixo, e sim como substâncias residuais possíveis de serem utilizadas como matéria-prima ou como fonte de energia.
Dentro do contexto da legislação os resíduos da indústria de frutas, podem ser classificados como resíduos industriais, pois são gerados nos processos produtivos e instalações industriais. Ultimamente a pesquisa esteve centrada no aumento da capacidade e sofisticação dos sistemas de gestão dos resíduos, onde uma vertente em crescimento é a conversão ou isolamento de compostos bioativos ou produtos químicos de alto valor dos resíduos agrícolas, principalmente provenientes da indústria de frutas e vegetais (SUDTO; PORNPAKAKUL; WANICHWECHARUNGRUANG, 2009).
Nas últimas três décadas ocorreram grandes transformações na relação do homem com o meio ambiente, em especial no processo produtivo. Desta forma, as empresas foram impulsionadas a buscar uma resposta e uma adequação às questões ambientais. Até pouco tempo, as exigências relacionadas com proteção ambiental eram consideradas como empecilhos ao crescimento da produção. No entanto, é possível evidenciar que ocorreu um processo evolutivo em relação aos aspectos ambientais, e o que antes era considerado como ameaça passou a ser visto como oportunidade empresarial (BERTOLINO, 2012).
Existem consideráveis perdas de produtos agrícolas nas diversas etapas da cadeia produtiva desde a produção no campo até o momento de consumo. O aproveitamento das matérias-primas vegetais pode chegar até 85% e a quantidade de resíduos gerados podem chegar a 30%. A geração de resíduos sólidos deve ser prevenida, mas se for inevitável é necessário que seja minimizada o quanto possível. A implementação de um sistema de reciclagem para resíduo sólido gerado pelo processamento de frutas na indústria é importante, uma vez que agrega valor econômico ao bagaço de frutos reduzindo problemas ambientais e resultando em atividade industrial (OLIVEIRA et al., 2012; BERTOLINO, 2012; SILVA et al., 2012b).
normalmente apresentam valor nutricional relevante. As cascas das frutas e verduras possuem grande quantidade de vitaminas e sais minerais e muitas vezes auxiliam em tratamentos e prevenções de doenças (DAMIANI et al., 2011).
Na indústria de processamento de frutas e hortaliças o principal entrave está associado à significativa quantidade de resíduos orgânicos que são gerados. Inúmeros procedimentos são criados para utilização desses materiais, transformando-os em bagaços para produção de enzimas lignocelulolíticas ou produtos como etanol, enzimas, ácidos orgânicos, aminoácidos e metabólitos secundários biologicamente ativos (MIGUEL et al., 2008; ALEXANDRINO, 2007).
A gestão agroindustrial apoia uma tecnologia limpa com o gerenciamento adequado dos resíduos produzidos. Este tipo de tecnologia aplicado ao processamento de frutas pode minimizar a produção de bagaço/resíduos/cascas e ainda otimizar o processo para que o máximo de suco seja extraído, diminuindo as perdas do processo, bem como a utilização do resíduo para obtenção de produtos com maior valor agregado (OLIVEIRA et al., 2006).
Resíduos do cacau, por exemplo, possuem grande viabilidade para utilização, o farelo e a casca do fruto do cacaueiro constituem os resíduos gerados em maior quantidade. Normalmente são aproveitados para produção de biogás, biofertilizantes, briquetes e também como substrato na produção de enzimas (PIRES et al., 2004; GONZALES et al., 2013).
Li et al. (2006) afirmam que a romã é uma importante fonte de compostos bioativos e tem sido usada na medicina popular por muitos séculos. Em estudos realizados pelos autores foi descoberto que a casca de romã teve a maior atividade antioxidante das frações de casca, polpa e sementes de 28 tipos de frutas comumente consumidas na China, além de grande quantidade de compostos fenólicos sendo responsável pela sua capacidade antioxidante.
Alcântara, Almeida e Silva (2007) avaliaram a caracterização físico-química do bagaço seco do pedúnculo do caju para sua utilização em um processo de fermentação com a finalidade de produzir pectinases. Os autores afirmam que o aproveitamento integral do caju (Anacardium occidentale L) é uma meta a ser alcançada pela indústria do beneficiamento da castanha, que considera o pedúnculo dessa fruta um resíduo.
importantes de vitamina C e apresentam alto índice de fibra bruta e alimentar e que, de forma geral, os pós alimentícios obtidos de resíduos de frutas são ricos em fibras e outros componentes, podendo ser aproveitados na formulação de novos produtos alimentícios.
Sousa et al. (2011) realizaram um estudo visando a caracterização nutricional dos resíduos de polpas de frutas tropicais e a quantificação dos principais compostos antioxidantes. O foco principal era a perspectiva de uma melhor utilização destes resíduos, agregando valor. Os frutos avaliados foram goiaba, acerola, abacaxi, cupuaçu, bacuri e graviola. Com este estudo foi possível perceber que os resíduos industriais apresentaram quantidades variáveis de macro nutrientes, apresentando elevado teor de água e reduzido teor de calorias; e os resíduos das polpas de acerola e goiaba se destacaram como fontes potenciais de carotenoides totais, fenólicos totais e vitamina C, possibilitando a inserção destes resíduos no desenvolvimento de novos produtos alimentícios, agregando valor nutricional e antioxidante e diminuindo a contaminação ambiental por resíduos industriais.
Ainda existem poucas alternativas para a utilização da maior parte dos resíduos vegetais, sendo esses dispostos no ambiente, utilizados como fertilizantes orgânicos ou na alimentação animal. Os consumidores estão exigindo cada vez mais a extinção do uso de produtos químicos em frutas e hortaliças com a intenção de aproveitar melhor as substâncias que ocorrem naturalmente nestes alimentos. A composição dos resíduos do processamento de alimentos é extremamente variada e depende tanto da natureza da matéria-prima como da técnica de produção empregada, as cascas, por exemplo, são constituídas basicamente por carboidratos, proteínas e pectinas, o que possibilitaria seu aproveitamento dentro da indústria, podendo-se tornar uma alternativa viável para resolver o problema da eliminação dos resíduos, além de aumentar seu valor comercial (MIGUEL et al., 2008; KALPNA; MITAL; SUMITRA, 2011).
1.3. Carotenoides
livres durante os processos metabólicos levou ao desenvolvimento de muitos mecanismos de defesa antioxidante para limitar os níveis intracelulares e impedir a indução de danos. Os antioxidantes são agentes responsáveis pela inibição e redução das lesões causadas pelos radicais livres nas células (BIANCHI; ANTUNES, 1999). As frutas, verduras e legumes, principalmente, contêm agentes antioxidantes, tais como as vitaminas C, E e A, a clorofilina, os flavonoides, carotenoides e outros que são capazes de restringir a propagação das reações em cadeia e as lesões induzidas pelos radicais livres.
Os alimentos de origem vegetal são produtos de grande interesse quando relacionados ao fornecimento de macro e micronutrientes, pois contêm uma série de substâncias consideradas essenciais para a saúde humana. A dieta habitual fornece também alguns compostos químicos, presentes, em sua maioria, em frutas e hortaliças, que exercem uma potente atividade biológica. Alguns autores nomeiam estes compostos como bioativos, e podem desempenhar diversos papéis em benefício da saúde humana. Estes compostos bioativos são constituintes extras nutricionais e ocorrem tipicamente em pequenas quantidades nos alimentos. Estudos baseados em dietas ricas em alimentos de origem vegetal apresentam resultados interessantes sugerindo que esses alimentos são capazes de exercer influência na redução do risco do desenvolvimento de doenças crônicas como cardiovasculares, cânceres, distúrbios metabólicos, doenças neurodegenerativas e enfermidades inflamatórias (MARTÍNEZ-NAVARRETE; VIDAL; LAHUERTA, 2008; COZZOLINO, 2005).
Os carotenoides são pigmentos naturais amplamente distribuídos, responsáveis pelas cores amarela, laranja e vermelha de frutas, raízes, flores, pescados, invertebrados e pássaros, que apesar de não sintetizarem tais moléculas, podem obtê-las a partir do consumo de alimentos de origem vegetal (RIBEIRO; SERAVALLI, 2004).
em um, ou ambos, extremos da molécula, formando um ou dois anéis , ou anéis (RODRIGUEZ-AMAYA; KIMURA; AMAYA-FARFAN, 2008; RODRIGUEZ-AMAYA, 1999).
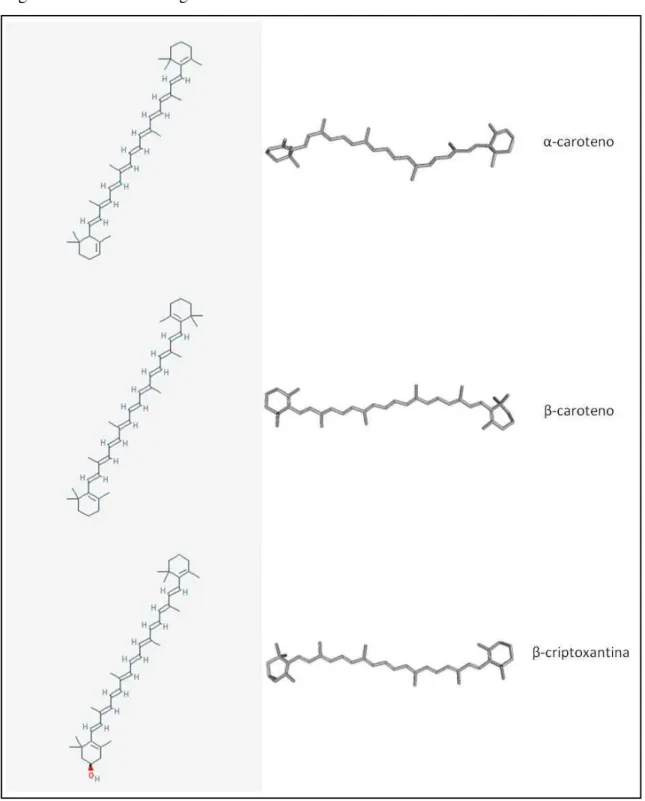
Figura 2 - Estrutura de alguns carotenoides.
Fonte: pubchem.ncbi.nlm.nih.gov (2013)
resposta do sistema imune (CASTENMILLER et al., 1999; UENOJO; MARÓSTICA JUNIOR; PASTORE, 2007).
Rodriguez-Amaya e Kimura (1989) determinaram a composição de carotenoides e o valor de vitamina A do cajá, onde a polpa com a casca apresentou um conteúdo total de 25,8 µg/g de carotenoides, onde 64% era constituído por -criptoxantina.
Lima, Mélo e Lima (2002) realizaram estudos com pitanga roxa e vermelha e observaram que o teor de carotenoides totais do fruto maduro foi maior do que no semi maduro, entretanto a quantidade deste fitoquímico foi significativamente mais elevada na pitanga roxa do que na vermelha. Em polpa de acerola recém-processada não congelada, foram identificados -caroteno, -criptoxantina e -caroteno (AGOSTINI-COSTA; ABREU; ROSSETI, 2003). Na polpa in natura e farinha de bacuri foram encontrados, por ordem decrescente de concentração, -caroteno, -caroteno e -zeacaroteno (HIANE et al., 2003).
Sentanin e Rodriguez-Amaya (2007) determinaram os principais carotenoides presentes em três cultivares de mamão e três cultivares de pêssego. Nas variedades de mamão foi encontrado licopeno, -criptoxantina e -caroteno como principais carotenoides, sendo o primeiro majoritário. Fonseca et al. (2007) objetivaram explicar as diferenças na coloração da polpa e da casca entre os frutos dos mamoeiros Sunrise Solo e Golden, e ao realizarem a análise de carotenoides totais perceberam que a casca possuía um teor superior à polpa.
Huber et al. (2012) investigaram a caracterização química e o potencial antioxidante de resíduos de manga Ubá e concluiu que o resíduo agroindustrial da casca de manga tem um expressivo potencial de utilização como fonte alternativa de compostos antioxidantes.
1.4. Maceração enzimática
A maceração enzimática, também tratada como liquefação enzimática, tem por objetivo degradar os polissacarídeos da parede celular e favorecer o rendimento da extração do suco, assim como a liberação de compostos funcionais presentes nos frutos, como carotenoides, antocianinas, vitaminas, polifenois, entre outros (GRASSIN; FAUQUEMBERGUE, 1996; RODRIGUES; FERNANDES, 2012).
pectinas. A parede celular primária localiza-se após a lamela média e a secundária liga-se imediatamente do lado de dentro da parede primária, ambas consistem de microfibrilas de celulose trançadas em conjunto num padrão irregular, embebidas numa matriz amorfa composta de hemiceluloses, pectinas e proteínas (CHITARRA; CHITARRA, 2005).
Figura 3 – Estrutura da parede celular vegetal.
Fonte: nature.com (2013)
A celulose encontrada na parede celular das plantas é a biomolécula mais abundante na natureza. É produzida na forma de microfibrilas de celulose, (semi)-cristalina em cadeias lineares de -1,4-D-glicose ligadas por pontes de hidrogênio. Cada microfibrila de celulose consiste de aproximadamente 36 cadeias lineares de glicose, cuja organização determina as propriedades mecânicas da célula e promovem o suporte e resistência à parede celular. Em geral, a parede primária contém de 10 a 40% de celulose e a secundária aproximadamente 40 a 60%. As hemiceluloses são formadas por diversos grupos de polissacarídeos, interligados às microfibrilas de celulose. (DELMER, 1999; MACNEIL et al., 1984).
reduzir o amargor excessivo em cascas de citrus, restaurar o aroma perdido durante secagem e melhorar a firmeza de pêssego e picles processados. A infusão de pectinase e -glicosidase aumentam o aroma e as substâncias voláteis de frutas e vegetais e aumenta a quantidade de agentes antioxidantes em óleo de oliva extra virgem (UENOJO; PASTORE, 2007).
Enzimas são catalisadores biológicos, de natureza principalmente proteica, que participam de várias reações bioquímicas, tendo como fundamental o controle metabólico. Estas moléculas aceleram reações termodinamicamente favorecidas, sendo extremamente versáteis e de elevada importância nos processos biotecnológicos (COELHO; SALGADO; RIBEIRO, 2008).
As pectinases são enzimas hidrolíticas, cuja definição e classificação se faz com base na parte galacturano da molécula de pectina que é atacada. Embora o ácido D-galacturônico seja o principal constituinte das substâncias pécticas, proporções variáveis de outros açúcares, tais como D-galactose, L-arabinose, D-xilose, L-ramnose, L-fucose e traços de 2-O-metilfucose também podem ser encontrados (LEITÃO et al., 1995).
Tais enzimas são produzidas e vendidas por diversas empresas industriais. Os componentes majoritários das pectinases são a pectinesterase, pectinaliase e poligalacturonase (COELHO; SALGADO; RIBEIRO, 2008).
A influência da adição de preparações comerciais de celulase e pectinase na fermentação natural de raízes de mandioca para produção da puba foi avaliada por Menezes, Sarmento e Daiuto (1998). Os autores constataram que atividades de celulases, xilanase e poligalacturonase aumentaram durante a fermentação natural e ao adicionar os preparados comerciais, o aumento foi maior do que o esperado pela fermentação natural.
Com o objetivo de aumentar o rendimento durante o processo de extração da polpa de cupuaçu, estudos foram realizados utilizando dois tipos de preparações enzimáticas de ação pectolítica (Citrozym-L e Rohament PL) adicionados à polpa bruta. Após todo o processo, obteve-se a polpa, e o rendimento foi comparado com a polpa-controle, obtendo assim um rendimento próximo a 60%, quando adicionada a preparação enzimática Citrozym-L acima da concentração de 300 ppm (BASTOS et al., 2002).
Granero et al. (2012) objetivaram diminuir a produção de resíduos no processamento de sucos de maçã e caracterizar os perfis dos bagaços em relação ao teor de fibras totais, cinzas e lignina após os tratamentos com a preparação enzimática. Utilizaram as preparações Novozym 33102 e Ultrazym®AFP-L, onde a melhor condição de trabalho foi encontrada a 50°C com rendimento de 2,13% em relação à amostra inicial.
Em estudo com resíduos sólidos de framboesa a hidrólise com mistura de água e álcool e aplicação 12 preparações enzimáticas comerciais demonstrou que uma concentração mais elevada de enzima melhora significativamente a extração de antioxidantes fenólicos (LAROZE; SOTO; ZÚÑIGA, 2010). Papaioannou e Karabelas (2012) realizaram um estudo para extrair o licopeno de cascas de tomate, os autores utilizaram a associação da maceração enzimática e extração com surfactante. Os resultados mostraram que a recuperação de licopeno a partir da casca de processamento de tomate pode ser maior ao associar as duas tecnologias (maceração enzimática e extração com surfactante). Ao utilizar o pré-tratamento com enzimas o rendimento aumentou cerca de seis vezes.
Sabajanes et al. (2012) utilizaram hidrólise enzimática para extrair oligossacarídeos a partir da pectina da casca de laranjas. Para isso realizaram o processo em duas etapas: a extração de açúcar dos resíduos e posteriormente a hidrólise enzimática do sólido extraído. Na hidrólise enzimática utilizaram duas preparações comerciais de enzimas, Celluclast e Viscozyme. Foram desenvolvidos modelos matemáticos para esta finalidade, conseguindo rendimento de 7,5 kg de gluco-oligossacarídeos, 4,5 kg de galacto-oligossacarídeos, 6,3 kg de arabino-oligossacarídeos e 13 kg de oligogalacturonídeos, isso ao utilizar 100 kg de substrato.
REFERÊNCIAS BIBLIOGRÁFICAS
AGOSTINI-COSTA, T.S.; ABREU, L.N.; ROSSETTI, A.G. Efeito do congelamento e do tempo de estocagem da polpa de acerola sobre o teor de carotenoides. Revista Brasileira de Fruticultura, v. 25, n. 1, p. 56-58, 2003.
ALCÂNTARA, S.R.; ALMEIDA, F.A.C.; SILVA, F.L.H. emprego do bagaço seco do pedúnculo do caju para posterior utilização em um processo de fermentação semi-sólida. Revista Brasileira de Produtos Agroindustriais, v.9, n.2, p.137-142, 2007.
ALEXANDRINO, A. M. Aproveitamento do resíduo de laranja para a produção de enzimas lignocelulolíticas por Pleurotus ostreatus (Jack:Fr), Ciência e Tecnologia de Alimentos, v. 27, n. 2, p. 364-368, 2007.
AQUINO, A.C. Otimização da maceração enzimática da polpa de bacuri (Platonia insignis mart.). 2008. 116f. Dissertação (Mestrado em Ciência e Tecnologia de Alimentos) –
Centro de Ciências Agrárias, Universidade Federal do Ceará, Fortaleza, 2008.
ASSIS, M.M.M.; LANNES, S.C.S.;·TADINI, C.C.; TELIS, V.R.N. TELIS-ROMERO, J. Influence of temperature and concentration on thermophysical properties of yellow mombin (Spondias mombin L.). European Food Research Technology, n. 223, n. 5, p. 585-593, 2006.
BASTOS, M.S.R; FEITOSA, T.; OLIVEIRA, M.E.B.; PIMENTEL, C.R.M. Check-list da produção de polpa congelada de frutos tropicais (cajá, caju e acerola) nos estados do Ceará e Rio Grande do Norte. Boletim do Centro de Processamento de Alimentos, v. 15, n. 2, p. 143-148, 1997.
BASTOS, M.S.R.; GURGEL, T.E.P.; SOUSA FILHO, M.S.M; LIMA, I.F.B.; SOUZA, A.C.R.; SILVA, J.B. efeito da aplicação de enzimas pectinolíticas no rendimento da extração de polpa de cupuaçu. Revista Brasileira de Fruticultura., v. 24, n. 1, p. 240-242, 2002. BERTOLINO, M.T. Sistemas de gestão ambiental na indústria alimentícia. Ed. Artmed, Porto Alegre, 157p., 2012.
BIANCHI, M.L.P. ; ANTUNES, L.M.G. Radicais livres e os principais antioxidantes da dieta. Revista de Nutrição, v. 12, n. 2, p. 123-130, 1999.
BOSCO, J.; SOARES, K.T.; FILHO, S.P.A.; BARROS, R.V. A cultura da cajazeira. João Pessoa: EMEPA-PB. Documentos, 28, 2000.
<http://www.planalto.gov.br/ccivil_03/_ato2007-2010/2010/lei/l12305.htm>. Acesso em: 12 jul. 2013.
BRITO, C. H. Termoterapia para o controle de patógenos em pós-colheita em frutos de cajazeira. Acta Scientiarum, Agronomy, v. 30, n. 1, p. 19-23, 2008.
CASTENMILLER, J.J.M.; WEST, C.E.; LINSSEN, J.P.H.; VAN HET HOF, K.H.; VORAGEN, A.G.J. The food matrix of spinach is a limiting factor in determining the bioavailability of β-carotene and to a lesser extent of lutein in humans. The Journal of Nutrition, v. 129, n. 2, p. 349-355, 1999.
CAVALCANTE, L.F.; LIMA, E.M.; FREIRE, J.L.O., PEREIRA, W.E.; COSTA, A.P.M.; CAVALCANTE, I.H.L. Componentes qualitativos do cajá em sete municípios do brejo paraibano. Acta Scientiarum. Agronomy, v. 31, n. 4, p. 627-632, 2009.
CAVALCANTE, P. B. Frutas comestíveis da Amazônia. 6. ed. Belém: CNPq/Museu Paraense Emílio Goeldi, 1996.
CHITARRA, M.I.F.; CHITARRA, A.B. Pós-colheita de Frutos e Hortaliças: Fisiologia e Manuseio. 2ª ed. revista e ampliada, Lavras: UFLA, 2005.
COELHO, M.A.Z.; SALGADO, A.M.; RIBEIRO, B.D. Tecnologia Enzimática. EPUB, FAPERJ, Petrópolis, RJ, 2008.
COZZOLINO, S. M. F. Biodisponibilidade de nutrientes. Barueri: Manole, 2005. 878p. DAMIANI, C.; SILVA, F.A.; RODOVALHO, E.C.; BECKER, F.S.; ASQUIERI, E.R.; OLIVEIRA, R.A.; LAGE, M.E. Aproveitamento de resíduos vegetais para produção de farofa temperada. Alimentos e Nutrição, v. 22, n. 4, p. 657-662, 2011.
DELLA, V.P.; KÜHN, I. ; HOTZA, D. Reciclagem de resíduos agroindustriais: cinza de casca de arroz como fonte alternativa de sílica. Cerâmica Industrial, v. 10, p. 22-25, 2005. DELMER, D.P. Cellulose biosynthesis: Exciting times for a difficult field of study. Annual Review of Plant Physiology and Plant Molecular Biology. Palo Alto, v.50, p.245-276, 1999.
DUVALL, C.S. On the origin of the tree Spondias mombin in Africa. Journal of Historical Geography, v. 32, n. 2, p. 249-266, 2006.
FERREIRA, A.N.; PACHECO, C.S.V.; TAVARES, I.M.C.; ROCHA, T.J.O.; FRANCO, M. Aplicação da fermentação em estado sólido na biotransformação do resíduo do cajá. Revista Acadêmica: Ciências Agrárias e Ambientais, v. 9, n. 2, p. 207-213, 2011.
FONTANA, J. D.; MENDES, S. V.; PERSIKE, D. S.; PERACETTA, L. F.; PASSOS, M. Carotenoides - cores atraentes e ação biológica. Biotecnologia Ciência e Desenvolvimento, v. 13, n. 1, p. 40-45, 2000.
GRANERO, J.C.; BARBOSA, R.; ALMEIDA, D.M.; PINHEIRO, L.A.; SAUER, E.; WOSIACKI, G.; PRESTES, R.A. Mudanças no perfil do bagaço de maçã tratado com
enzimas industriais. Revista Brasileira de Tecnologia Agroindustrial, v. 6, n. 2, p. 864-875, 2012.
GRASSIN, C.; FAUQUEMBERGUE, P. Apple pomace liquefaction: a new technology. Fruit Processing, Oberhonnerfeld, v. 12, p. 490-495, 1996.
GODOY, M.R.B. Dificuldades para aplicar a Lei da Política Nacional de Resíduos Sólidos no Brasil. Caderno de Geografia, v.23, n.39, p. 1-12, 2013.
GOMES, R. P. Fruticultura brasileira. São Paulo: Nobel, 2007.
GONZALES, A.D.F.; VITAL, A.V.D.; LIMA, J.M.; RODRIGUES, M.B.S. Desenvolvimento sustentável para o resgate da cultura do cacau baseado no aproveitamento de resíduos.
Interfaces Científicas - Saúde e Ambiente , v.1, n. 2, p. 41-52, 2013.
GOODWIN, T. W. The compative biochemistry of carotenoids. Chapmn & Hall LTD., 1ª edition, London, 1952.
HIANE, P.A.; BOGO, D.; RAMOS, M.I.L.; FILHO, M.M.R. Carotenoides pró-vitamínicos e a composição em ácido graxos do fruto e da farinha do bacuri (Scheelea phalerata Mart.). Ciência e Tecnologia de Alimentos, v.23, n.2, p. 206-209, 2003.
HUBER, K.; QUEIROZ, J.H.; MOREIRA, A.V.B.; RIBEIRO, S.M.R. Caracterização química do resíduo agroindustrial da manga ubá (Mangifera indica L.): uma perspectiva para a obtenção de antioxidantes naturais. Revista Brasileira de Tecnologia Agroindustrial, v. 6, n. 1, p. 640-654, 2012.
JIAO, Y.; CHANG, Y.; YU, S.; SUN, X.;SONG, C. Optimization of enzyme assited extraction technology of flavonoids from seabuckthorn fruit peel marc. Advanced Materials Research, v. 550-553, p. 1826-1830, 2012.
KALPNA, R.; MITAL, K.; SUMITRA, C. Vegetable and fruit peels as a novel source of Antioxidants. Journal of Medicinal Plants Research, v. 5, n. 1, p. 63-71, 2011.
LAROZE, L.; SOTO, C.; ZÚÑIGA, M.E. Phenolic antioxidants extraction from raspberry wastes assisted by-enzymes. Electronic Journal of Biotechnology, v. 13, n. 6, 2010. LEDERMAN, I.E.; LIRA JÚNIOR, J.S.; SILVA JÚNIOR, J.F. Spondias no Brasil: umbu, cajá e espécie afins. Recife: IPA-UFRPE, 2008.
LI, Y.; GUO, C.; YANG, J.; WEI, J.; XU, J.; CHENG, S. Evaluation of antioxidant properties of pomegranate peel extract in comparison with pomegranate pulp extract. Food Chemistry, v. 96, p. 254-260, 2006.
LIRA JUNIOR, J. S.; MUSSER, R. S.; MELO, E. A.; MACIEL, M. I. S.; LEDERMAN, I. L.; SANTOS, V. F. Caracterização física e físico-química de frutos de cajá- umbu. Ciência e Tecnologia de Alimentos, v. 25, n. 4, p. 757-761, 2005.
MACNEIL, M.; DARVILL, A.G.; FRY, S.C.; ALBERSHEIM, P. Structure and function of the primary cell walls of plants. Annual Review of Biochemistry. Palo Alto, v.53, p. 625-663, 1984.
MARTÍNEZ-NAVARRETE, N.; VIDAL, M.M.C.; LAHUERTA, J.J.M. Los compuestos bioactivos de las frutas y sus efectos en la salud. Act. Diet., v. 12, n. 2, p. 64-68, 2008. MATA, M.E.R.M.C.; DUARTE, M.E.M.; ZANINI, H.L.H.T. Calor específico e densidade da polpa de cajá (Spondias lutea L.) com diferentes concentrações de sólidos solúveis sob baixas temperaturas. Engenharia Agrícola, v. 25, n. 2, p. 88-498, 2005.
MATTIETTO, R. de A. Estudo tecnológico de um néctar misto de cajá (Spondias lutea L.)
e umbu (Spondias tuberosa Arruda Câmara). 2005. 299 f. (Doutorado em Tecnologia de
Alimentos) - Universidade Estadual de Campinas, Campinas, 2005.
MENDONÇA, R. U.; MOURA, C. F. H.; ALVES, R. E.; FIGUEIREDO, R. W.; SOUZA, V. A. B. Caracterização física de frutos da cajazeira (Spondias mombin L.) oriundos da Região Meio-norte do Brasil. In: XX Congresso Brasileiro de Fruticultura. 2008, Vitória-ES, Anais…, 2008.
MENEZES, T.J.B.; SARMENTO, S.B.S.; DAIUTO, E.R.. Influência de enzimas de
maceração na produção de puba. Ciência e Tecnologia de Alimentos, Campinas, v. 18, n. 4, 1998.
MIGUEL, A.C.A.; ALBERTINI, S.; BEGIATO, G.F.; DIAS, J.R.P.S.; SPOTO, M.H.F. Aproveitamento agroindustrial de resíduos sólidos provenientes do melão minimamente processado. Ciência e Tecnologia de Alimentos, v. 28, n. 3, p. 733-737, 2008.
MONÇÃO, E.C.; SILVA, E.F.; SOUSA, P.B.; SILVA, M.J.M.; SOUSA, M.M. Avaliação físico-química e centesimal de polpas congeladas de cajá (Spondias mombin L.) e de manga (Mangifera indica L.) consumidas em Teresina-PI. In: CONGRESSO DE PESQUISA E INOVAÇÃO DA REDE NORTE NORDESTE DE EDUCAÇÃO TECNOLÓGICA, 5., 2010, Maceió. Anais... Maceió: IFAL, 2010.
MORAIS, F.L. Carotenoides: Características Biológicas e Químicas. 2006. 60 f. (Curso de Especialização em Qualidade de Alimentos) – Universidade de Brasília, Brasília, 2006. MOREIRA, M. A. B.; SOUZA, F. X.; RITZINGER, C. H. S. P.; FILGUEIRAS, H. A. C. Cajá (Spondias mombin L.). In: Frutíferas potenciais para os tabuleiros costeiros e baixadas
NATURE.COM. Disponível em:<http://www.nature.com/scitable/content/plant-plasma-membrane-and-cell-wall-structure-14713218>. Acesso em: 17 julho 2013.
NESTEL, P.; NALUBOLA, R. -carotene in fruits is more bioavailable than that in vegetables. ILSI Human Nutrition Institute, 2003. Disponível em:
http://www.foodsecurity.gov.kh/docs/ENG/FS12-Beta-Carotene-Fruits%20vs%20Veges-ENG.pdf> Acesso: 08/01/2010.
OLIVEIRA, L.C.; SANTOS, J.A.B.; NARAIN, N.; FONTES, A.S.; CAMPOS, R.S.S.; SOUZA, T.L. Caracterização e extração de compostos voláteis de resíduos do processamento de maracujá (Passiflora edulis Sims f. flavicarpa Degener), Ciência Rural, v.42, n.12, 2012. OLIVEIRA, M.C.S.; SILVA, N.C.C.; NOGUEIRA, A.; WOSIACKI, G. Avaliação do método de liquefação enzimática na extração de suco de maçã. Ciência e Tecnologia de Alimentos, Campinas, v. 26, n. 4, p. 906-915, 2006.
PAPAIOANNOU, E.H.; KARABELAS, A.J. Lycopene recovery from tomato peel under mild conditions assisted by enzymatic pre-treatment and non-ionic surfactants. Acta Biochimica Polonica, v. 59, n. 1, p. 71-74, 2012.
PEREIRA, R.J.; CARDOSO, M.G. Metabólitos secundários vegetais e benefícios antioxidantes. Journal of Biotecnology and Biodiversity, v. 3, n. 4, p. 146-152, 2012. PUBCHEM.NCBI.NLM.NIH.GOV. Disponível em:
<http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=5281235&loc=ec_rcs>. Acesso em 17 julho 2013.
RAMOS-DE-LA-PEÑA, A.M.; RENARD, C.M.G.C.; LOUISE WICKER, L.; MONTAÑEZ, J.; REYES-VEGA, M.L.; VOGET, C.; CONTRERAS-ESQUIVEL, J.C. Enzymatic
liquefaction of jicama (Pachyrhizus erosus) tuberous roots and characterization of the cell walls after processing. Food Science and Technology, v. 49, n. 2, p. 257-262, 2012. RIBEIRO, E. P.; SERAVALLI, E. A. G. Química de Alimentos. Instituto Mauá de Tecnologia. Editora Edgard Blücher Ltda, 1ª edição, São Paulo, p.155-157, 2004.
ROGRIGUES, S.; FERNANDES, F.A.N. Advances in fruit processing technologies. Boca Raton: CRC Press, 472p., 2012.
RODRIGUEZ-AMAYA, D.B. A Guide to carotenoid analysis in foods. Washington (DC): International Life Sciences Institute Press; 2001.
RODRIGUEZ-AMAYA, D. B., Carotenoides y Preparación de Alimentos: La Retención de los Carotenoides Provitamina A em Alimentos Preparados, Procesados y
Almacenados. Tradução: Saturnino de Pablo, Universidade Estadual de Campinas, Campinas, SP, 1999.
RODRIGUEZ-AMAYA, D.B.; KIMURA, M. Carotenoides e valor nutritivo de Vitamina A em cajá (Spondias lutea L.).Ciência e Tecnologia de Alimentos , v.9, n.2, p.148-162, 1989. SABAJANES, M.M.; YÁÑEZ, R.; ALONSO, J.L.; PARAJO, J.C. Pectic oligosaccharides production from orange peel waste by enzymatic hydrolysis. International Journal of Food Science and Technology, v. 47, p. 747-754, 2012.
SACRAMENTO, C. K.; SOUZA, F. X.; Cajá (Spondias mombin L.), Jabuticabal: Funep
(Série Frutas Nativas, 4), 42 p., 2000.
SAXENA, D.; SABIKHI, L.; CHAKRABORTY, S.K.; SINGH, D. Process optimization for enzyme aided clarification of watermelon juice. Journal of Food Science and Technology, DOI 10.1007/s13197-012-0720-1, 2012.
SENTANIN, M.A.; RODRIGUEZ-AMAYA, D.B. Teores de carotenoides em mamão e
pêssego determinados por cromatografia líquida de alta eficiência. Ciência e Tecnologia de Alimentos, Campinas, v. 27, n. 1, p. 13-19, 2007.
SGARBIERI, V. C. Efeitos dos vários processamentos sobre a qualidade dos alimentos. In: SGARBIERI, V. C. Alimentação e nutrição: fator de saúde e desenvolvimento. São Paulo: Almed, cap. 14, p. 295-297, 1987.
SILVA, A.P.V; MAIA, G.A.; OLIVEIRA, G.S.F.; FIGUEIREDO, R.W.; BRASIL, I.M. Características de qualidade do suco polposo de cajá (Spondias lutea L.) obtido por extração mecânico-enzimático. Ciência e Tecnologia de Alimentos, v.17, n.3, p.233-236, 1997. SILVA, A.R.A.; MORAIS, S. M.; MARQUES, M.M.M.; OLIVEIRA, D.F.; BARROS, C.C.; ALMEIDA, R.R.; VIEIRA, I.G.P.; GUEDES, M.I.F. Chemical composition, antioxidant and antibacterial activities of two Spondias species from Northeastern Brazil. Pharmaceutical Biology, v. 50, n. 6, p. 740-746, 2012a.
SILVA, A.S.; OLIVEIRA, E.L.; SANTOS, E.S.; OLIVEIRA, J.A. Characterization and drying of caja bagasse (Spondias mombin L.) in a tray dryer using a factorial planning. Rev. Bras. Frutic., v. 34, n. 1, p. 239-247, 2012b.
SILVA, F.V.G.; SILVA, S.M.; SILVA, G.C.; MENDONÇA, R.M.N.; ALVES R.E.;
DANTAS, A.L. Bioactive compounds and antioxidant activity in fruits of clone and ungrafted genotypes of yellow mombin tree. Ciência e Tecnologia de Alimentos, v. 32, n. 4, 2012c. SOUSA, M.S.B.; VIEIRA, L.M.; SILVA, M.J.M.; LIMA, A. Caracterização nutricional e compostos antioxidantes em resíduos de polpas de frutas tropicais. Ciência e
Agrotecnologia, v. 35, n. 3, p. 554-559, 2011.
UENOJO, M.; MARÓSTICA JUNIOR, M.R.; PASTORE, G.M. Carotenoides: propriedades, aplicações e biotransformação para formação de compostos de aroma. Quimica Nova, v. 30, n. 3, p. 616-622, 2007.
UENOJO, M.; PASTORE, G.M. Pectinases: aplicações industriais e perspectivas. Química Nova, v. 30, n. 2, p. 388-394, 2007.
UCHOA.M.A.; COSTA, J.M.C.; MAIA, G.A.; SILVA, E.M.C.; CARVALHO, A.F.F.U.; MEIRA, T.R. parâmetros físico-químicos, teor de fibra bruta e alimentar de pós alimentícios obtidos de resíduos de frutas tropicais. Segurança Alimentar e Nutricional, v. 15, n. 2, p. 58-65, 2008.
VIEIRA, J. M. M., Maceração enzimática de película comestível de cajá (Spondias mombin L.) para a extração de carotenoides. 2010. 53 f. (Mestrado em Engenharia
CAPÍTULO 2. CARACTERIZAÇÃO E MACERAÇÃO ENZIMÁTICA DA PELÍCULA COMESTÍVEL DE CAJÁ (Spondias mombin L.)
2.1. INTRODUÇÃO
O consumo de frutas e hortaliças é prioridade mundial para a melhoria da saúde da população. Várias investigações evidenciaram o efeito protetor das frutas e hortaliças e nesse sentido, a Organização Mundial da Saúde (OMS) recomenda o consumo diário de 400g de frutas (RAMALHO; DALAMARIA; SOUZA, 2012).
No Nordeste do Brasil, há muitas áreas onde o clima e as características do solo são particularmente favoráveis para a produção de frutos tropicais. A atratividade do sabor e do aroma destes frutos é o principal responsável pela elevada aceitação. No entanto, o conhecimento do valor nutricional também tem uma grande participação nessa popularidade e contribui para o aumento do consumo, considerando-se a grande preocupação dos consumidores em manter hábitos alimentares saudáveis (TIBURSKI et al., 2011).
Um forte exemplo dentre estas frutas exóticas, é o fruto da cajazeira (Spondias mombin L.), uma árvore frutífera da família Anacardiaceae, que se encontra dispersa nas regiões tropicais da América, África e Ásia. No Brasil, a cajazeira é encontrada principalmente nos estados do Norte e Nordeste. O fruto é constituído de polpa, casca e semente, mas apenas a polpa assume posição de destaque no tocante ao aspecto comercial. (SACRAMENTO; SOUZA, 2000; BOSCO et al., 2000). Mendes et al. (2008) afirmaram que a polpa de cajá, além das propriedades nutricionais, apresenta propriedades funcionais bastante desejáveis, principalmente pelos expressivos teores de carotenoides encontrados. Isto torna o cajá uma promissora fonte de compostos antioxidantes, cujo consumo deveria ser estimulado. Esses compostos encontram-se nos vegetais na forma livre ou ligadas a açúcares e proteínas polifenólicas (CATANEO et al., 2008). É importante salientar que as evidências desse alto potencial antioxidante não está restrito à polpa das frutas; tem sido demonstrado que tal atividade é frequentemente superior em cascas, pelo fato destas possuírem teor elevado de compostos fenólicos (HUBER et al., 2012).
preparação enzimática, tempo e temperatura. Pesquisas indicaram que a maceração enzimática foi influenciada pela preparação utilizada, a concentração das enzimas, o tempo de incubação e temperatura durante o tratamento (SUN et al., 2006). A concentração da preparação enzimática está associada à quantidade de preparação usada e à atividade das enzimas específicas contidas na preparação.
Desta forma o objetivo deste trabalho foi caracterizar e quantificar o rendimento da película comestível de cajá a fim de direcionar o processo de extração de carotenoides por maceração enzimática e assim determinar a melhor condição.
2.2. MATERIAL E MÉTODOS
2.2.1. Obtenção e preparação da película comestível de cajá
A obtenção de película comestível de cajá foi realizada de acordo com o fluxograma ilustrado na Figura 4. Os frutos de cajá foram colhidos em pequena propriedade rural no município de Pecém/CE, situado a 60 km da capital Fortaleza. Foram congelados a - 18ºC e armazenados em caixas de poliestireno expandido para serem transportados até o Laboratório de Processos Agroindustriais da Embrapa Agroindústria Tropical em Fortaleza/CE.
Figura 4 - Fluxograma de obtenção da película comestível de cajá.
2.2.2. Quantificação dos resíduos
Nesta etapa realizou-se a medida da quantidade de resíduos gerados na despolpa dos frutos da cajazeira ao utilizar a peneira com furos de 1 mm de diâmetro. Quantificou-se o rendimento em porcentagem de polpa, caroços e película.
2.2.3. Caracterização da película comestível de cajá
As análises físico-químicas da película comestível de cajá foram realizadas em duplicatas e determinadas de acordo com a Associations of Official Analytical Chemists, AOAC (2005):
Resíduo seco: conforme método 920.151; Cinzas: conforme método 923.03;
Extrato etéreo: conforme método 922.06;
Teor de proteínas: de acordo com a determinação do nitrogênio total, conforme método 920.123.
sobrenadantes e ajustou-se o pH para 6,5. A solução foi colocada na diálise em membranas de diálise Dyalises membrane cellulose de espessura 33 mm (SIGMA-ALDRICH) com água destilada por 48h. Após a diálise, o líquido das membranas foi coletado e adicionou-se álcool comercial na proporção 3:1 (álcool:líquido), deixando em repouso por 24h. Após o descanso foi colocado em estufa a 60°C e pesou-se o resíduo determinando assim pectina. O resíduo reservado na etapa anterior foi colocado sob agitação em 50 mL de solução de NaOH 16% por 5h. Em seguida realizou-se centrifugação a 15.000g por 20 minutos. Foi realizada filtração à vácuo, coletando o resíduo e lavando com água destilada por duas vezes. O resíduo foi reservado para quantificar celulose + lignina. Juntou-se os sobrenadantes e o pH foi ajustado para 6,5. A solução foi colocada na diálise da mesma forma que quantificou pectina. Após a diálise, o líquido das membranas foi coletado e adicionou-se álcool comercial na proporção 3:1 (álcool:líquido), deixando em repouso por 24h. Após o descanso foi colocado em estufa a 60°C e pesou-se o resíduo determinando assim hemicelulose. Ao resíduo reservado na etapa anterior adicionou-se 100 mL de água destilada e colocou-se a solução na diálise da mesma forma que quantificou pectina e hemicelulose. Após a diálise, o líquido das membranas foi coletado e adicionou-se álcool comercial na proporção 3:1 (álcool:líquido), deixando em repouso por 24h. Após o descanso foi colocado em estufa a 60°C e pesou-se o resíduo. Após a pesagem, a amostra foi incinerada em mufla a 550ºC. Para determinar celulose + lignina, retirou-se a diferença de peso referente às cinzas. Os resultados foram determinados através da relação de peso de cada fração com o peso do AIR total da amostra e expressos em g/100g película.
2.2.4. Maceração enzimática da película comestível de cajá
A maceração enzimática da película comestível de cajá foi realizada de acordo com Vieira (2010). Os ensaios de maceração foram conduzidos em Erlenmeyers com capacidade de 250 mL, onde 20 g de película de cajá foram trituradas em 80 mL de água destilada com o auxílio de um Mixer Walita durante 30 segundos. A maceração enzimática da película ocorreu utilizando a preparação enzimática Pectinex XXL, sob a agitação de 150 rpm (Figura 6). Realizou-se uma maceração controle, sem adição de enzima, para comparação. Ao término das macerações, a película (fase sólida) foi separada da água (fase aquosa) e descartada. Esta separação foi feita com o auxílio de peneiras de malha com diâmetro de 1 mm.
Figura 6 – Esquema do tratamento enzimático da película comestível de cajá.