UNIVERSIDADE FEDERAL DO CEARÁ
FACULDADE DE MEDICINA
DEPARTAMENTO DE SAÚDE COMUNITÁRIA
CURSO DE DOUTORADO EM SAÚDE PÚBLICA
CLAUDIA MENDONÇA BEZERRA
ECOEPIDEMIOLOGIA DE TRIATOMÍNEOS APÓS
CONTROLE QUÍMICO RESIDUAL EM TAUÁ (CE),
SEMIÁRIDO DO CEARÁ, NORDESTE DO BRASIL
CLAUDIA MENDONÇA BEZERRA
ECOEPIDEMIOLOGIA DE TRIATOMÍNEOS APÓS CONTROLE
QUÍMICO RESIDUAL EM TAUÁ (CE), SEMIÁRIDO DO CEARÁ,
NORDESTE DO BRASIL
Tese apresentada ao Programa de Pós-Graduação em Saúde Pública da Universidade Federal do Ceará, Faculdade de Medicina, Departamento de Saúde Comunitária como requisito parcial à obtenção do título de Doutora em Saúde Coletiva, Área de concentração: Epidemiologia e Vigilância de Doenças Transmissíveis.
Orientador: Prof. Dr. Alberto Novaes Ramos Júnior
Coorientadora: Prof. Dra. Liléia Gonçalves Diotaiuti
ECOEPIDEMIOLOGIA DE TRIATOMÍNEOS APÓS CONTROLE
QUÍMICO RESIDUAL EM TAUÁ (CE), SEMIÁRIDO DO CEARÁ,
NORDESTE DO BRASIL
Tese apresentada ao Programa de Pós-Graduação em Saúde Pública da Universidade Federal do Ceará, Faculdade de Medicina, Departamento de Saúde Comunitária como requisito parcial à obtenção do título de Doutora em Saúde Coletiva, Área de concentração: Epidemiologia e Vigilância de Doenças Transmissíveis.
Aprovada em: ____/____/____
BANCA EXAMINADORA
_____________________________________________________ Prof. Dr. Alberto Novaes Ramos Júnior (Orientador)
Universidade Federal do Ceará – UFC
_____________________________________________________ Profa. Dra. Liléia Diotaiuti (Co-orientadora)
Instituto Rene Rachou – FIOCRUZ / MG
_____________________________________________________ Prof. Dr. Ricardo José Soares Pontes
Universidade Federal do Ceará – UFC
_____________________________________________________ Profa. Dra. Carlota Josefovicz Belisário
Instituto Rene Rachou – FIOCRUZ / MG
_____________________________________________________ Profa. Dra. Jaqueline Caracas Barbosa
Dedico,
A Deus e às forças do bem que nos auxiliam na jornada dessa vida.
À Secretaria da Saúde do Estado do Ceará, em especial aos supervisores do Núcleo de Controle de Vetores que viabilizaram minha liberação para participar do curso, bem como o apoio institucional para o trabalho de campo e laboratório.
Ao Prof. Dr. Alberto Novaes Ramos Júnior pela confiança, orientação, apoio e dedicação.
À Dra. Liléia Diotaiuti (minha querida Lileinha), uma sonhadora na busca por um mundo mais justo e humano. Uma super mãezona, a quem agradeço os ensinamentos e oportunidades; à compreensão, amizade e ao amor.
A Valeska de Figueiredo Guimarães, uma incansável incentivadora, que deseja e acredita que podemos sempre mais, meu muito obrigada.
A todos os funcionários da 14ª Coordenadoria Regional de Saúde – Tauá que sempre nos receberam de braços abertos, em especial a Maria Dulce Feitosa (coordenadora) e a José Silvério do Nascimento Júnior um entusiasta no controle vetorial da doença de Chagas e um grande amigo.
As amigas Dra. Silvia Ermelinda, Dra. Rita de Cássia Moreira, Dra. Grasielle Caldas D‟avila Pessoa e Dra. Carlota Josefovicz Belisário sem as quais seria impossível concluir esse trabalho.
À Aline Cristine Luiz Rosa e Carla Patrícia Barezani equipe guerreira de bancada, imprescindíveis para o processamento dos microssatélites.
Aos colegas de trabalho Relrison Dias Ramalho, Estevão Curado Domingues e Helder Pereira da Costa, fiéis de coração, amantes da natureza, cães de guarda no desafio ao trabalho. Peças essenciais no árduo processo das atividades de campo e laboratório.
Aos agentes de controle de endemias do município de Tauá.
À população das localidades por nós trabalhadas que acreditaram e permitiram o nosso estudo. Além dos muitos ensinamentos e as amizades fraternas.
Ao Departamento de Saúde Comunitária da UFC, pela oportunidade e apoio ao curso de Doutorado.
As instituições de fomento: OMS, CAPES, CNPq, IRR, SES-Ce, FAPEMIG.
Ao Instituto Rene Rachou – FIOCRUZ/Minas.
As bancas de qualificação e defesa da Tese, que aceitaram o convite em contribuir com o projeto de estudo.
“Sou o gibão do vaqueiro, sou cuscuz, sou rapadura Sou vida difícil e dura
Sou nordeste brasileiro
Sou cantador violeiro, sou alegria ao chover
Sou doutor sem saber ler, sou rico sem ser granfino Quanto mais sou nordestino, mais tenho orgulho de ser Da minha cabeça chata, do meu sotaque arrastado Do nosso solo rachado, dessa gente maltratada Quase sempre injustiçada, acostumada a sofrer Mais mesmo nesse padecer eu sou feliz desde menino Quanto mais sou nordestino, mais orgulho tenho de ser
Terra de cultura viva, Chico Anísio, Gonzagão, de Renato Aragão Ariano e Patativa. Gente boa, criativa
Isso só me dá prazer e hoje mais uma vez eu quero dizer Muito obrigado ao destino, quanto mais sou nordestino Mais tenho orgulho de ser”
A doença de Chagas é uma doença infecciosa crônica negligenciada que persiste com elevada carga de morbimortalidade, sendo responsável por aproximadamente 6-7 milhões de infecções no mundo e 12 mil mortes/ano. O município de Tauá (CE) está localizado na região do Sertão dos Inhamuns, semiárido nordestino, cujo bioma predominante é a Caatinga. Região reconhecida como de alto risco na transmissão domiciliar de Trypanosoma cruzi, possui localidades rurais com alta dispersão
e infestação por Triatoma brasiliensis brasiliensis e Triatoma pseudomaculata, principais espécies
de importância epidemiológica no nordeste brasileiro. O objetivo desse trabalho foi caracterizar a ecoepidemiologia de triatomíneos e diversidade genética de T. b. brasiliensis e T. cruzi em áreas de
caatinga do município de Tauá (CE), de 2009 a 2015. Foi realizado estudo transversal baseado em pesquisa triatomínica manual em ambiente silvestre e domiciliar conforme normas do Programa de Controle da Doença de Chagas no período de 2009 a 2015. T. b. brasiliensis foi a espécie mais importante, com ampla distribuição nas localidades analisadas, e ocupando diferentes ecótopos naturais e artificiais. As “telhas, tijolos e pedras” foram os ecótopos peridomiciliares mais infestados ao longo das capturas. O intradomicílio foi o ambiente com o maior índice de infecção natural 10,3% (18/175), seguido pelo ambiente silvestre 3,3% (32/979) e peridomicílio 3,1% (51/1.629). O índice de colonização intradomiciliar foi de 39,5% (49/124) e peridomiciliar 59% (271/459). Utilizando iniciadores universais (regiões conservadas do loco 12S do rRNA) foram identificadas fontes alimentares em 76,3% (213/279) dos triatomíneos amostrados em 2015. Os taxa
mais frequentes foram: 58%-roedores (123/213); 30%-ruminantes (64/213) e 6%-felinos (12/213), totalizando 20 espécies de vertebrados. Das amostras de T. cruzi, 49% (44/89) foram caracterizadas considerando o COII, a amplificação do espaçador intergênico SL-IL do mini-exon e o polimorfismo do domínio divergente D7 do gene 24αrDNA-LSU rDNA, cujo resultado foi: TcII (43%-19/44), TcI (41%-18/44) e TcIII (16%-7/44). Marcadores de microssatélites foram usados para caracterizar T. b. brasiliensis referentes às cinco capturas realizadas (649 insetos genotipados). As análises mostraram que não há populações isoladas (intradomicílio, peridomicílio e silvestre), assim como não há diferença populacional entre os períodos estudados. Resultados sugerem a multicausalidade como responsável pela reinfestação das unidades domiciliares, com intercâmbio de insetos entre os ecótopos domiciliares e naturais e entre as diferentes localidades. A ampla distribuição, ecletismo alimentar, adaptabilidade aos diversos ecótopos e infectividade ao T. cruzi
enfatizam a importância epidemiológica do T. b. brasiliensis. Somente com um sistema de
vigilância vetorial bem estruturado e com conhecimento técnico será possível garantir a redução do risco real de transmissão da infecção ao ser humano.
Palavras-chave: Doença de Chagas; Triatoma brasiliensis brasiliensis; Trypanosoma cruzi;
Chagas disease is a neglected chronic infectious disease that persists with a high morbidity and mortality burden, accounting for approximately 6-7 million infections worldwide and 12,000 deaths / year. Tauá municipality - Ceará is located in Inhamuns area, semi-arid northeast, whose predominant biome is Caatinga. A high - risk region in the Trypanosoma cruzi home transmission
has rural areas with high dispersion and infestation by Triatoma brasiliensis brasiliensis and Triatoma pseudomaculata, the main species of epidemiological importance in the northeast of
Brazil. The objective of this work was to characterize triatomine ecoepidemiology and genetic diversity of T. b. brasiliensis and T. cruzi in caatinga areas of Tauá municipality from 2009 to 2015.
A cross-sectional study was conducted based on manual triatominal research in wild and domiciled according to norms of the Chagas Disease Control Program from 2009 to 2015. T. b. brasiliensis
was the most important species, with a wide distribution in analyzed localities, and occupying different natural and artificial ecotypes. "Tiles, bricks and stones" were the most infested peridomiciliary ecotypes throughout the catches. Intradomiciliary was the environment with the highest index of natural infection 10,3% (18/175), followed by the wild environment 3.3% (32/979) and peridomicílio 3.1% (51/1,629). The index of intra-household colonization was 39.5% (49/124) and 59% (271/459) peridomiciliary. Using universal primers (conserved regions of rRNA 12S locus) food sources were identified in 76.3% (213/279) of triatomines sampled in 2015. The most frequent taxa were: 58%-rops (123/213); 30%-ruminants (64/213) and 6%- felines (12/213), totaling 20 species of vertebrates. From T. cruzi samples, 49% (44/89) were characterized
considering COII, amplification of the mini-exon SL-IL intergenic spacer and D7 divergent domain polymorphism of 24αrDNA-LSU rDNA gene, whose result was: TcII (43%-19/44), TcI (41%-18/44) and TcIII (16%-7/44). Microsatellite markers were used to characterize T. b. brasiliensis for
five catches made (649 genotyped insects). Analyzes showed that there are no isolated populations (intradomicile, peridomicile and wild), as well as there is no population difference between studied periods. Results suggest that multi-causality is responsible for reinfestation of domiciliary units, with insect exchange between domiciliary and natural ecotypes and between different localities. The broad distribution, food eclecticism, adaptability to various ecotypes and T. cruzi infectivity
emphasize the epidemiological importance of T. b. brasiliensis. Only with a well structured vector
surveillance system and with technical knowledge will be possible to reduce the real risk of transmitting the infection to humans.
Key Words: Chagas Disease; Triatoma brasiliensis brasiliensis; Trypanosoma cruzi; Reinfestation;
Figura 1 - Exemplares de Triatoma brasiliensis brasiliensis em ecótopos naturais (rochas
graníticas). A e B: Formas adultas, C: Ninfa de 4º estádio. ... 28 Figura 2 - Distribuição geográfica real e potencial de Triatoma brasiliensis no Brasil. ... 29
Figura 3 - Localização do município de Tauá (CE), com destaque para a área de estudo: ( ) Ambiente antrópico; ( ) Ambiente silvestre ... 35 Figura 4 - Área de estudo para pesquisa triatomínica no município de Tauá (CE). ... 41 Figura 5 - Localização geográfica dos pontos de coleta silvestre de Triatoma brasiliensis, Tauá/CE.
... 46 Figura 6 - Localização, proximidade em relação às residências e área do conglomerado de pedras
(Mutuca – Pedra da Cruz / MPC), município de Tauá (CE). ... 47 Figura 7 - Localização, proximidade em relação às residências e área do conglomerado de pedras
(Mutuca – Seu Evangelista / ME), município de Tauá (CE). ... 48 Figura 8 - Localização, proximidade em relação às residências e área do conglomerado de pedras
(Cachoeira do Júlio / CJ), município de Tauá (CE). ... 49 Figura 9 - Localização, proximidade em relação às residências e área do conglomerado de pedras
(Morada Nova do Tomaz / MNT), município de Tauá (CE). ... 50 Figura 10 - Localização, proximidade em relação às residências e área do conglomerado de pedras
(Juá / JUA), município de Tauá (CE). ... 51 Figura 11 - Localização, proximidade em relação às residências e área do conglomerado de pedras
(Caraúbas / CB), município de Tauá (CE). ... 52 Figura 12 - Localização, proximidade em relação às residências e área do conglomerado de pedras
(Monte Cristo / MC), município de Tauá (CE). ... 53 Figura 13 - Localização, proximidade em relação às residências e área do conglomerado de pedras
(Aroeira / ARO), município de Tauá (CE). ... 53 Figura 14 - Localização, proximidade em relação às residências e área do conglomerado de pedras
(Pedra D‟água / PA), município de Tauá (CE). ... 55 Figura 15 - Localização dos pontos silvestres de captura com distância entre si em quilômetros,
Tabela 1 - Localidades, número de insetos utilizados (n), número de unidades domiciliares (UDs) e ecótopo dos triatomíneos capturados em 2009 e 2010 utilizados para análise de
clusterização. ... 63 Tabela 2 - Localidades, número de insetos utilizados (n), número de unidades domiciliares (Uds) e
ecótopo dos triatomíneos capturados por período, utilizados para análise de infestação. ... 64 Tabela 3- Iniciadores utilizados para a caracterização populacional de Triatoma brasiliensis, suas
AMOVA Análise de variância molecular
ANS Açude Novo do Sátiro
ARO Aroeira
BLAST Basic Local Alignment Search Tool
BET Betânia
BI Benfica do Incra
BHA Belo Horizonte do Alfredo
BHC Hexaclorociclohexano
CAN Canadá
CB Caraúbas
CJ Cachoeira do Júlio
CNPQ Conselho Nacional de Desenvolvimento Científico e Tecnológico
COPROM Coordenadoria de Promoção e Proteção à Saúde
COX II Citocromo Oxidase II
CP Cachoeira dos Pedrosas
IRR Instituto René Rachou
DNA Ácido desoxirribonucleico
DNERu Departamento Nacional de Endemias Rurais
dNTPs Deoxinucleotideos trifosfatos
DTUs I-VI Discrete Typing Units I-VI / Pequenas diferenças nas Unidades I-VI
DTT Dithiothreitol
EDTA Ácido etilenodiamino tetra-acético
ELISA Ensaio Imunoensimático
EUA / USA Estados Unidos da América
FINSOCIAL Fundo de Investimento Social
FIOCRUZ Fundação Oswaldo Cruz
Fis Variabilidade Interpopulacional
HSP60 Heat shock proteins 60
GNChE Rede Global para Eliminação da doença de Chagas
HCl Ácido Clorídrico
He Heterozigosidade Esperada
Ho Heterozigosidade Observada
HW Equilíbrio de Hardy-Weinberg
ICMBio Instituto Chico Mendes da Conservação da Biodiversidade
IDHM Índice de Desenvolvimento Humano Médio
INCOSUL Iniciativa do Cone Sul
INSIC Inquérito da soroprevalência da infecção chagásica em crianças de 0 a 5 anos incompletos
JA Jasmim do Aluísio
JUA Juá
K Potássio
KCl Cloreto de Potássio
Km2 Quilômetro quadrado
LATEC Laboratório de Triatomíneos e Epidemiologia da Doença de Chagas
LIT Liver Infusion Tryptose / Infusão de fígado triptose
M Mol
MA Merejo do Angico
MC Monte Cristo
ME Mutuca Evangelista
MG Minas Gerais
MgCl2 Cloreto de Magnésio
mL Mililitros
mM Milimolar
Mm3 Milímetros cúbicos
MMA Ministério do Meio Ambiente
MPC Mutuca Pedra da Cruz
MUTU Mutuca
MUTQ Mutuquinha
nM Nanomolar
NUVET Núcleo de Controle de Vetores
OMS / WHO Organização Mundial de Saúde
OPAS Organização Pan-Americana de Saúde
PA Pedra D‟água
pb Pares de bases
PBS Tampão fosfato-salino / Phosphate Buffered Saline
PCDCh Programa de Controle da Doença de Chagas
PCR Polymerase Chain Reaction / Reação em cadeia da polimerase
PCR-RFLP Polymerase Chain Reaction – Restriction fragment length polymorphism /
Reação em Cadeia da Polimerase - Polimorfismo dos fragmentos de restrição
pH Potencial Hidrogeniônico
RPM Rotação por minuto
rRNA Ácido nucléico ribossomal
SBI São Bento do Incra
SC São Cristovão
SC Suspensão Concentrada
SDS Sulfato Dodecil de Sódio
SF Santa Fé
SES-CE Secretaria de Saúde do Estado do Ceará
SINE Short Interspersed Elements
SISBIO Sistema de Autorização e Informação em Biodiversidade
SL-IL Espaçador intergênico do mini-exon
SNP Single Nucleotide Polymorphisms
STR Short Tandem Repeats
SUS Sistema Único de Saúde
T. cruzi Trypanosoma cruzi
TcI Trypanosoma cruzi grupo I
TcII Trypanosoma cruzi grupo II
TcIII Trypanosoma cruzi grupo III
TcIV Trypanosoma cruzi grupo IV
TcV Trypanosoma cruzi grupo V
TcVI Trypanosoma cruzi grupo VI
TDR Special Programme for Research and Training in Tropical Diseases
UD Unidade Domiciliar
UMB Umburana
VT Várzea do Touro
μL Microlitro
1.1. Perfil epidemiológico da doença de Chagas ... 21
1.2. Vigilância e Controle Vetorial da Doença de Chagas ... 23
1.3. Triatomíneos ... 26
1.4. Triatoma brasiliensis... 27
1.5. Trypanosoma cruzi ... 30
1.6. Marcadores moleculares microssatélites ... 32
1.7. Identificação de Fontes Alimentares em Triatomíneos ... 33
1.8. O município de Tauá ... 34
2. JUSTIFICATIVA ... 39
3. OBJETIVOS ... 40
3.1. Objetivo geral ... 40
3.2. Objetivos específicos ... 40
4. METODOLOGIA ... 41
4.1. Tipo de Estudo ... 41
4.2. Área de estudo ... 41
4.3. Caracterização da infestação por triatomíneos ... 42
4.3.1. Pesquisa de triatomíneos no ambiente artificial ......... 42
4.3.2. Indicadores entomológicos do PCDCh ......... 43
4.3.3. Pesquisa de triatomíneos silvestres ......... 44
4.4. Diagnóstico da infecção pelo Trypanosoma cruzi ... 56
4.4.1. Parasitológico ......... 56
4.4.2. Caracterização de Trypanosoma cruzi segundo DTUs ......... 57
4.4.2.1. Amostras ... 57
4.4.2.2. Extração de DNA ... 57
4.4.2.3. Caracterização pela PCR do gene Mitocondrial Citocromo Oxidase subunidade II (CO II) ... 58
4.4.2.4. Caracterização pela região do espaçador intergênico do gene mini-exon (SL- IR)... 59
4.4.2.5. Caracterização pela amplificação da região 3’ do gene 24sα rDNA - LSU rDNA ... 60
4.5. Identificação de fonte alimentar ... 61
4.5.1. Amplificação por PCR e sequenciamento do gene 12S do rRNA ... 62
4.5.2. Identificação das sequências ... 62
4.6.2. Extração e amplificação de DNA ... 65
4.6.3. Genotipagem ... 65
4.6.4. Análise de dados ... 65
4.7. Análise Geo-espacial ... 67
4.8. Comitê de Ética .......... 67
5. RESULTADOS ... 69
5.1. Artigo 1 - Reinfestação domiciliar por triatomíneos após controle químico residual: Complexidade ecoepidemiológica no semiárido do Ceará, Nordeste do Brasil... 69
5.2. Artigo 2 - Variabilidade genética de Triatoma brasiliensis brasiliensis Neiva, 1911 do semiárido do Nordeste do Brasil utilizando microssatélite ... 100
5.3. Artigo 3 -Triatoma brasiliensis (Neiva, 1911): fontes alimentares e diversidade de Trypanosoma cruzi nos ambientes silvestre e artificial do semiárido do Ceará, Nordeste do Brasil ... 143
6. DISCUSSÃO ... 182
6.1 Limitações do Estudo ... 185
7. CONCLUSÃO ... 187
8. CONSIDERAÇÕES FINAIS ... 190
9. REFERÊNCIAS ... 192
10. APÊNDICES ... 210
A tese de doutorado aqui apresentada possui como objeto de estudo a complexidade ecoepidemiológica de Triatoma brasiliensis, principal espécie de triatomíneo do Nordeste
brasileiro. Espécie de competência vetorial reconhecida é responsável pela manutenção do risco de transmissão do Trypanosoma cruzi, agente etiológico da doença de Chagas no ambiente domiciliar
da Caatinga nordestina.
A doença de Chagas, enfermidade crônica com elevada magnitude, considerada negligenciada pela Organização Mundial da Saúde, vem passando por alterações em seu contexto epidemiológico, no qual demonstra a necessidade de adequação no modelo de vigilância epidemiológica, considerando os modos de transmissão e área geográfica. Assim, a compreensão das relações ecológicas relacionadas aos ecossistemas, diversidade de ecótopos, espécies de triatomíneos, hospedeiros e complexidade das sociedades devem ser consideradas nesse processo, sobretudo, buscando contribuir com evidências que possam subsidiar políticas de saúde, voltadas para a vigilância e controle da doença de Chagas em regiões de caatinga.
A abordagem inicial é constituída de uma introdução onde uma revisão da literatura nos traz a contextualização da epidemiologia e do controle da doença de Chagas, de seus vetores em especial o T. brasiliensis e conceitos metodológicos a serem desenvolvidos no decorrer do trabalho.
Em seguida descrevem-se as justificativas, relevâncias do estudo, perguntas de partida, objetivos, descrição da área de estudo, métodos e aspectos éticos.
Dessa forma estruturou-se o trabalho em eixos temáticos relacionados aos objetivos específicos propostos. As considerações iniciais contextualizam o leitor quanto ao objeto de estudo e servem de base para o desenvolvimento dos temas estudados. Seguem-se os artigos científicos que apresentam os resultados alcançados. Obviamente, cada artigo traz seus métodos, resultados, discussão e conclusão dos objetivos.
Os eixos abordados foram:
Eixo 1 - Estudo descritivo de série temporal dos indicadores entomológicos e operacionais de controle da doença de Chagas em ambientes intradomiciliares e peridomiciliares a partir da intervenção química residual, considerando o ambiente silvestre como ecótopo natural do T.
brasiliensis.
Eixo 2 - Estudo molecular da variabilidade populacional de T. brasiliensis.
Eixo 3 - Caracterização de populações de T. cruzi e fontes alimentares associadas ao T. brasiliensis
da tese. Ressalta-se o compromisso com a manutenção das ações de controle vetorial para a doença de Chagas, com critérios técnicos claros, particularidades regionais e qualidade operacional, fundamentados nos valores e princípios que regem o Sistema Único de Saúde (SUS).
O presente trabalho é parte integrante do Projeto WHO/TDR A70596 que buscou estudar os padrões de reinfestações por vetores da doença de Chagas em quatro países da América Latina: Brasil, Paraguai, Bolívia e Argentina sob coordenação do Prof. Dr. Ricardo Gürtler da Universidad de Buenos Aires na Argentina. No Brasil, as espécies de triatomíneos contempladas foram o Triatoma sordida, espécie importante no Cerrado e o Triatoma brasiliensis cuja
importância foi citada anteriormente. A profa. Dra. Liléia Diotaiuti do Laboratório de Triatomíneos
e Epidemiologia da Doença de Chagas (LATEC) do Instituto René Rachou - FIOCRUZ/Minas foi responsável pela etapa brasileira.
Conheci a Dra. Liléia em 2002, na ocasião de um trabalho de campo que aconteceria em Sobral (CE). Eu, a época, já respondia pela Vigilância e Controle da Doença de Chagas na Secretaria da Saúde do Estado do Ceará, vínculo profissional que me possibilita aproximação com pesquisadores, instituições de pesquisa de âmbito internacional e o Ministério da Saúde. Dessa forma, além do conhecimento técnico, primei pelo conhecimento científico, cujo projeto acima citado nos faz retomar a uma área de estudo no município de Tauá (CE), contexto representativo do
T. brasiliensis na caatinga nordestina. E assim, foi possível desenvolver o projeto que culminou em
1. INTRODUÇÃO
1.1 Perfil epidemiológico da doença de Chagas
A doença de Chagas ou Tripanosomíase Americana é uma enfermidade potencialmente mortal causada pelo protozoário Trypanosoma cruzi (Chagas, 1909), cuja
forma primária de transmissão é através das fezes de triatomíneos (insetos vetores) infectadas. É uma doença infecciosa que apresenta um curso clínico bifásico, composto por uma fase aguda, assintomática ou sintomática, e uma fase crônica, que pode se manifestar de forma indeterminada, cardíaca, digestiva ou cardiodigestiva. É classificada como enfermidade negligenciada pela Organização Mundial da Saúde (OMS) (WHO, 2012b; 2013; BRASIL, 2017; WHO, 2018).
A antropozoonose surgiu a partir de relações bioecológicas (entre vetores, agente etiológico e reservatórios), culturais (tipos de habitações e modo de vida) e socioeconômicos (ocupação de territórios e mercado), representadas pela ação direta do homem sobre o ambiente, com ênfase nas relações de classe e trabalho (MARTINS, 1968; DIAS, 2000; Noireau et al., 2009).
A infecção humana é resultado da colonização de triatomíneos nas habitações rurais de baixa qualidade e a utilização dos mamíferos ali presentes, incluindo o homem, como fonte de alimentação, incorporando-os ao ciclo da enfermidade (ARAGÃO, 1983; Dias e Coura, 1997; COURA, 2007; Coura e Borges-Pereira, 2010).
A distribuição da zoonose acontece do sul dos Estados Unidos à Patagônia, percorrendo 40°N a 45°S. Aproximadamente 180 espécies de mamíferos domésticos, sinantrópicos e silvestres, principalmente roedores e marsupiais (Noireau et al., 2009) e,
cerca de 100 espécies de triatomíneos, já foram descritas como partícipes do ciclo de transmissão de Trypanosoma cruzi (CHAGAS, 1909; Silveira e Rezende, 1994; OPAS,
2006).
endêmicos ao redor do mundo (DIAS, 2007; SCHMUNIS, 2007; Moncayo e Silveira, 2009; BRASIL, 2011). Portanto, países não endêmicos que recebem imigrantes de áreas de risco devem desenvolver políticas, principalmente de educação permanente, programas de triagem em bancos de sangue e transplantes, bem como realizar a prevenção da transmissão da doença de Chagas por via congênita (Requena-Méndez et al., 2017).
A OMS estima em aproximadamente 6 a 7 milhões o número de pessoas infectadas em todo o mundo, a maioria na América Latina (WHO, 2015b; 2018). Estimativas recentes para 21 países Latino-Americanos, com base em dados de 2010, indicavam 5.742.167 pessoas infectadas por T. cruzi, das quais 3.581.423 (62,4%) eram
residentes em nações da Iniciativa dos Países do Cone Sul, destacando-se a Argentina (1.505.235), o Brasil (1.156.821) e o México (876.458), seguidos da Bolívia (607.186) (WHO, 2015a). É a terceira enfermidade tropical de maior prevalência no planeta, responsabilizada por 14 mil mortes ao ano (WHO, 2010). O número de infectados chegou a estar próximo a 20 milhões no início da década de 1980, com 100 mil novos casos por ano (WHO, 2002a; 2010), e uma incidência anual de 41.200 casos por via vetorial (OPAS, 2006). A redução no surgimento de novos casos se deu por motivos como: melhoria das condições de vida, um melhor acesso aos sistemas de saúde e implementação de programas de controle vetorial e transfusional (WHO, 2010; Molina et al., 2016). De
maneira geral 13% de toda a população da América Latina encontra-se em risco de adquirir a doença de Chagas (Molina et al., 2016).
Estimativas da Organização Panamericana da Saúde (OPAS) afirmam que 21,8 milhões de pessoas estão expostas ao risco de contrair a infecção no Brasil. E que o número de infectados é de 1,9 milhão de pessoas (1,019% da população nacional) (OPAS, 2006).
Martins-Melo et al. (2014) publicaram o primeiro estudo com revisão
Independente do número real de infectados existe a necessidade de que a atenção primária à saúde, através da territorialização e intersetorialidade desenvolva de forma integrada e ética ações voltadas para as famílias atingidas pela doença de Chagas, às quais devem incluir a promoção, prevenção e atenção à saúde para diagnóstico e tratamentos oportunos, inclusive reabilitação física, psicológica e social. O mesmo deve acontecer com as ações de vigilância epidemiológica transversais nestes territórios. Para tanto, novas pactuações e agendas devem ser construídas, inserindo a doença de Chagas como tema relevante, visando à garantia do acesso aos insumos necessários para vigilância, controle, diagnóstico e tratamento da doença no Sistema Único de Saúde (SUS) (Dias et al., 2016)
1.2.Vigilância e Controle Vetorial da Doença de Chagas
A luta contra os triatomíneos teve seu início na década de 1940, com a descoberta da ação dos inseticidas clorados sobre esses insetos e as melhorias nas condições de moradias rurais (Dias et al., 2008).
Desde essa época, o controle do triatomíneo domiciliado era o principal objetivo das estratégias que estavam sendo desenvolvidas para evitar transmissão da doença de Chagas. Inseticidas clorados como hexaclorociclohexano (BHC), alguns fosforados (diazin® e malathion®) e carbamatos (propoxur® e bendiocarb®) foram bem eficazes (Dias et al., 2008).
O município de Bambuí (MG) (1950 e 1960) e o estado de São Paulo (1960 e 1970) colocaram em prática, com sucesso, a “luta anti-triatomínica”, baseada na desinsetização extensiva e regular das cafuas com BHC, ora infestada por Triatoma
infestans Klug, 1834, principal espécie vetora da doença de Chagas e responsável por mais
de 80% das transmissões. Este modelo foi copiado e institucionalizado para as áreas de risco do país e outras regiões endêmicas da América Latina, a partir da década de 1970 (DIAS, 2015).
A sistematização e organização das ações de controle foram norteadas a partir dos inquéritos de soroprevalência da infecção na população humana realizado em 24 estados com aproximadamente 1.800.000 amostras e o inquérito entomológico, iniciados em 1975 (Silveira et al., 2002). Das mais de 42 espécies de triatomíneos catalogadas no
domiciliar da doença: T. infestans, Triatoma brasiliensis Neiva, 1911, Triatoma
pseudomaculata Correa and Espinola, 1964, Triatoma sordida Stål, 1859 e Panstrongylus
megistus Burmeister, 1835(Camargo et al., 1984; Silveira e Rezende, 1994; Carcavallo et
al., 1997; Vinhaes e Dias, 2000). A prevalência na população rural era, então, de 4,4%,
correspondendo a 6,5 milhões de indivíduos infectados. O inquérito demonstrou bolsões de doença de Chagas no Brasil, com transmissão variável, relacionados aos graus de infestação domiciliar dos triatomíneos e condições socioeconômicas da população (Silveira et al., 2002; Silveira et al., 2011).
O Programa de Controle da Doença de Chagas (PCDCh) era realizado originalmente por equipes de agentes de endemias federais, pertencentes sucessivamente ao Departamento Nacional de Endemias Rurais (DNERu), à Superintendência de Campanhas de Saúde Pública (SUCAM) e à Fundação Nacional de Saúde (FUNASA), em São Paulo, esses servidores pertenciam à Superintendência de Controle de Endemias (SUCEN), do Governo Estadual (Silveira et al., 2002).
O PCDCh foi expandido a toda a região delimitada como endêmica nos inquéritos citados anteriormente até 1983, financiado pelo Fundo de Investimento Social (FINSOCIAL). As primeiras epidemias de dengue aconteceram em 1986 e 1987, ocasião em que os servidores e recursos financeiros foram direcionados para combater a emergência do momento, iniciando uma prática comum até os dias atuais (Dias, 2002).
Na década de 1990, osegundo inquérito nacional foi proposto com o objetivo de avaliar os avanços no controle da transmissão vetorial e transfusional nas novas gerações. O público alvo desse inquérito eram escolares de 7 a 14 anos. Participaram 17 estados e o distrito federal, com aproximadamente 236.788 amostras e prevalência nacional de 0,14%(DIAS, 2002).
Ainda no início da década de 1990 foi criada a iniciativa dos países do Cone Sul (INCONSUL) como o objetivo de controlar a transmissão da doença de Chagas pelo
T. infestans e a transmissão por via transfusional, com participação do Brasil, Argentina,
Chile, Paraguai, Bolívia e Uruguai. Essa iniciativa contribuiu para a preservação da prioridade da doença de Chagas entre os problemas de saúde no Brasil (Silveira e Pimenta Jr, 2011).
Aos municípios cabem à execução das ações de vigilância e controle vetorial; aos estados o suporte técnico, supervisão e avaliação das atividades desenvolvidas; e ao Ministério da Saúde à normalização, seguimento, avaliação e cooperação técnica a estados e municípios (Silveira e Pimenta Jr, 2011). Respeitando, portanto, a concepção organizacional do setor de saúde no Brasil, de acordo com os dispositivos constitucionais, onde o município é o responsável pela gestão e execução das ações e serviços prestados em seu território, cabendo aos Estados e à União competências distintas, complementares e suplementares (BRASIL, 1990).
Dessa forma, o desafio do controle da doença de Chagas compreende a formulação de uma política organizacional aliada aos aspectos técnicos administrativos e, sobretudo o fortalecimento municipal, a fim de instituir um sistema em processo de construção permanente e sustentável de vigilância epidemiológica, com características de descentralização, constante supervisão e ampla participação comunitária (Coura e Dias, 2009).
Entre 2001 e 2008, foi realizado o último inquérito nacional da soroprevalência da infecção chagásica (INSIC), em crianças de 0 a 5 anos incompletos, onde foram processadas 104.954 amostras provenientes de 26 estados. O resultado demonstrou uma prevalência de 0,03%, com especial ênfase à transmissão congênita, que apresentou a prevalência de 0,02% (Silveira et al., 2002; Ostermayer et al., 2011).
Em 2006, o Brasil, após consolidar os objetivos do INCOSUL, recebeu da OPAS/OMS, a Certificação Internacional de Interrupção da Transmissão Vetorial da Doença de Chagas pelo T. infestans e a Interrupção da Transmissão pela via Transfusional
(OPAS, 2006; SILVEIRA, 2011). Essa conquista deve ser vista com cautela, pois é comum a errônea interpretação de seu significado, principalmente por gestores e imprensa, achando que a doença de Chagas é um problema resolvido. Espécies autóctones de triatomíneos com potencial de colonização são responsáveis pela manutenção do ciclo doméstico do T. cruzi, e, portanto, necessitam de uma vigilância contínua, íntegra e
responsável para minimizar os riscos de transmissão domiciliar da doença de Chagas (Ramos e Maul De Carvalho, 2001; SILVEIRA, 2011).
depende da manutenção das atividades de controle da doença por tempo indefinido, salientando que o principal objetivo da vigilância é a redução da incidência a níveis tão baixos que a doença deixe de ser problema de saúde pública (Tauil, 1998).
1.3.Triatomíneos
Os triatomíneos, hemípteros hematófagos obrigatórios, da família Reduviidae e subfamília Triatominae, estão subdivididos em cinco tribos, quinze gêneros e 149 espécies (Justi e Galvao, 2017), das quais 44% (65/149) com ocorrência no Brasil (Schofield e Galvão, 2009; Galvão, 2014). Na Caatinga, bioma exclusivamente brasileiro, existe uma elevada diversidade triatomínica com 18 (27%) das espécies descritas no Brasil (Gurgel-Gonçalves, Galvão, Costa, et al., 2012; GALVÃO, 2014).
Teoricamente todas as espécies de triatomíneos são consideradas capazes de transmitir as seis linhagens descritas de T. cruzi (Breniere et al., 2016), participando na
manutenção do ciclo enzoótico ou veiculando-o no ambiente domiciliar (Silveira e Rezende, 1994; OPAS, 2006). A compreensão das características ecológicas, epidemiológicas e dos processos que contribuem para a diversificação e domesticação desses insetos, bem como sua relação com os diferentes animais, facilitará o entendimento do ciclo de transmissão do T. cruzi e auxiliará o desenvolvimento de estratégias de
controle mais eficazes (OPAS, 2006; Justi e Galvao, 2017).
No ambiente silvestre, os triatomíneos associam-se a animais, como marsupiais, xenartros, roedores, carnívoros, morcegos e aves, abrigando-se em seus ninhos ou próximo a estes (Carcavallo et al., 1997).
A estrutura peridomiciliar possibilita a persistência da infestação por triatomíneos, onde são capazes de se abrigar em diversos locais: madeiras, telhas, pedras e tijolos; paredes e tetos de abrigos de animais; árvores; etc. O peridomicílio é o local responsável pela manutenção desses insetos no ambiente humano, pois sua complexa organização e esconderijos diversos favorecem sua colonização. Para isso é necessário apenas à manutenção de um microclima com variações aceitáveis, principalmente de temperatura e umidade, visando à integridade fisiológica dos triatomíneos (Diotaiuti et al.,
2000; Lorenzo et al., 2000; Sarquis et al., 2004; Abad-Franch et al., 2005; Noireau et al.,
2005; Diotaiuti et al., 2015).
reboco; entulhos; ninhos de aves; e/ou a manutenção de animais dentro de casa, propiciam abrigo e alimentação a esses insetos (ALENCAR, 1987; Diotaiuti et al., 2015). A
adaptação destes aos ecótopos artificiais e habilidade de se alimentar nas fontes de sangue disponíveis na casa é o que determina a sua condição vetorial de importância epidemiológica do T. cruzi. (Lent e Wygodzinsky, 1979; Lorenzo et al., 2000). Além
disso, as alterações ambientais realizadas pelo homem favorecem a dispersão dos triatomíneos (FORATTINI, 1980) e a invasão dos domicílios com fontes luminosas (Carbajal De La Fuente et al., 2007).
Atualmente são descritas 65 espécies no Brasil, 28 (43%) estão no Nordeste, com 20 (71%) encontradas dentro do domicílio, demonstrando a capacidade de invasão e muitas vezes domiciliação desses vetores (Schofield e Galvão, 2009; GALVÃO, 2014).
No Nordeste, quatro espécies são as mais importantes: P. megistus (nas áreas
úmidas serranas (Diotaiuti et al., 2015); T. infestans (focos residuais na Bahia)
(Gurgel-Gonçalves, et al., 2012); T. brasiliensis e T. pseudomaculata na região da caatinga, com
ampla distribuição, potencial invasivo e participação no ciclo doméstico, peridomiciliar e silvestre da doença de Chagas (Forattini et al., 1981; Dias et al., 2000).
1.4.Triatoma brasiliensis
Figura 1 - Exemplares de Triatoma brasiliensis brasiliensis em
ecótopos naturais (rochas graníticas). A e B: Formas adultas, C: Ninfa de 4º estádio
Fontes: A-Cyro José; B e C-Liléia Diotaiuti.
Segundo Galvão (1956), existia três subespécies de Triatoma brasiliensis: T.
brasiliensis brasiliensis Neiva, 1911; Triatoma brasiliensis melanica Neiva & Lent, 1941
e Triatoma brasiliensis macromelasoma Galvão, 1956. Em 1979, Lent e Wygodzinsky
(1979) sinonimizaram as três subespécies como T. brasiliensis, afirmando que as
diferenças existentes entre elas eram apenas cromáticas. Em 2006 a subespécie T.
brasiliensis melanica foi redefinida como espécie Triatoma melanica (Costa et al., 2006).
O mesmo acontecendo com o Triatoma juazeirensis em 2007 (Costa e Felix, 2007).
Assim, o complexo T. brasiliensis inclui atualmente duas subespécies (T. b. brasiliensis e
Triatoma brasiliensis macromelasoma Galvão, 1956 (Costa et al., 2013)) e seis espécies
(Triatoma lenti Sherlock & Serafim, 1967, Triatoma juazeirensis Costa & Felix, 2007,
Triatoma melanica Costa, et al., 2006, Triatoma bahiensis Sherlock & Serafim, 1967
Barata, 2002 (Mendonça et al., 2009) e Triatoma petrocchiae Pinto & Barreto, 1925
(Schofield e Galvão, 2009; Oliveira et al., 2017).
O T. brasiliensis foi descrito por Arthur Neiva em 1911. É a principal espécie
transmissora do T. cruzi no Nordeste brasileiro. Seu centro de dispersão está relacionado
ao do bioma da caatinga (FORATTINI, 1980) (Figura 2). No ambiente silvestre encontram-se normalmente em locas de pedras, associados às várias espécies de quirópteros, marsupiais e roedores (ALENCAR, 1987; Carcavallo et al., 1997; Borges et
al., 2005) com elevadas taxas de infecções, facilitando a transmissão de T. cruzi entre eles.
Em planícies sedimentares onde não existem rochas, podem estar associados ao cacto
Pilosocereus gounellei (Valença-Barbosa et al., 2014).
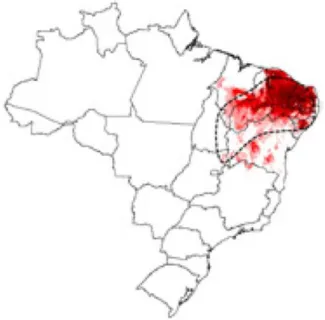
Figura 2 - Distribuição geográfica real e potencial de Triatoma brasiliensis no Brasil
Fonte: Galvão, 2014. Modelo utilizando o algoritmo Maxent (Phillips et al., 2006). Vermelho claro: menores condições ambientais para a ocorrência da espécie; Vermelho-escuro: alta adequação ambiental para a ocorrência da espécie; Linhas pontilhadas:
limites da distribuição geográfica conhecida da espécie.
Segundo Alencar (1987), o primeiro registro de T. brasiliensis no Ceará foi em
cruzi em 44% dos municípios. Relatórios técnicos da Secretaria da Saúde de Estado do
Ceará mostram que entre 2000 e 2016 foram capturados 288.025 exemplares em 87% (161/184) dos municípios do estado, com infecção natural por tripanosomatídeos presentes em 65% (119/184) dos municípios cearenses infestados.
A partir da reconhecida distribuição geográfica de T. brasiliensis, análises de
indicadores entomológicos usuais mostraram a importância epidemiológica da espécie na Bahia (BA), Ceará (CE), Piauí (PI), Paraíba (PB), Pernambuco (PE) e Rio Grande do Norte (RN), enfatizando suas altas taxas de infestação intradomiciliar, alta densidade populacional e porcentagens variáveis de infecção natural por tripanosomatídeos (ALENCAR, 1987; Dias et al., 2000; Costa et al., 2003; Borges et al., 2005; Sarquis et al.,
2010; Lima et al., 2012; Sarquis et al., 2012; Costa et al., 2014).
Diotaiuti et al. (2000) avaliaram o processo de domiciliação e reinfestação de
T. brasiliensis na região dos sertões de Crateús (CE) e identificaram 48% de unidades
domiciliares infestadas. O tratamento químico subsequente controlou as populações domésticas de triatomíneos, porém os ecótopos peridomiciliares reinfestaram após um ano. Concluiu-se que a abundância desta espécie no ambiente silvestre e a complexidade do peridomicílio contribuíram para a precoce reinfestação.
A disponibilidade de alimentos é um fator determinante para o tamanho das populações de triatomíneos (Schofield, 1980). Nesse contexto, o ambiente antrópico proporciona não apenas uma vasta disponibilidade de fontes alimentares, mas também ampla gama de abrigos. A variação microclimática domiciliar, semelhantes aos ecótopos naturais do T. brasiliensis, é um dos fatores que favorece a adaptação destes insetos ao
intradomicílio (Lorenzo et al., 2000; Catalá et al., 2015). A ação antrópica sobre o
ambiente, além de promover o desequilíbrio ambiental, favorece a entrada ativa e passiva de triatomíneos no ambiente domiciliar, onde a reinfestação se dará através dos insetos recém ingressos, dos remanescentes das borrifações residuais ou da combinação das duas situações (Borges et al., 2005; Sarquis et al., 2006; Cortez et al., 2007; Guhl et al., 2009;
Sarquis et al., 2010; Sarquis et al., 2012).
A avaliação da suscetibilidade do T. brasiliensis aos inseticidas piretroídes
(Pessoa et al., 2015) demonstrou que as populações domésticas dessa espécie podem ser
1.5.Trypanosoma cruzi
T. cruzi (Protozoa, Sarcomastigophora, Kinetoplastida, Trypanosomatidae) é
um protozoário flagelado, digenético e polifilético (RASSI, 1979; DIAS, 2006) com ampla distribuição na natureza, circulando primitivamente entre mamíferos silvestres e triatomíneos (HOARE, 1972; Brener e Andrade, 1979).
Dentre os parasitas, T. cruzi possui elevado sucesso adaptativo, apresentando
diversidade intraespecífica que resulta em diferentes graus de tropismo tissular, virulência, formas sanguíneas, patogenicidade, propriedades imunológicas infectividade a humanos e animais, bem como na sensibilidade a agentes quimioterapêuticos. (BRENER, 1973; Devera et al., 2003).
O ciclo do T. cruzi possui duas fases distintas, uma no tubo digestivo dos
triatomíneos e outra no hospedeiro vertebrado. Sua replicação se dá por divisão binária, ocorrendo nas formas epimastigotas presentes no tubo digestivo do vetor e nas formas amastigotas encontradas no interior das células de mamíferos. Os tripomastigotas metacíclicos, são encontrados nas fezes e urina do triatomíneo e os tripomastigotas circulantes no sangue de mamíferos (REY, 2008; COURA, 2008.).
As denominações utilizadas na nomenclatura do T. cruzi sempre apresentaram
divergência entre os diversos grupos de estudo, buscando revisar e padronizar essa nomenclatura, em 2009 foi proposto um consenso onde à comissão reconheceu que as seis DTUs (Discrete Typing Units) descritas por (Brisse et al., 2000; Brisse et al., 2001)
passassem a ser reconhecidas como T. cruzi I-VI (Zingales et al., 2009). A DTU I
corresponde à linhagem T. cruzi I e a DTU IIb ao T. cruzi II, grupos classicamente
associados aos ciclos silvestre e doméstico, respectivamente (ANONYMOUS, 1999). A evolução dos outros grupos de T. cruzi (TcIII, TcIV, TcV, TcVI), correspondentes às
DTUs IIc, IIa, IId e IIe, respectivamente, ocorrem por hibridação, mas ainda não estão bem caracterizados (Sturm et al., 2003; Westenberger et al., 2005; De Freitas et al., 2006;
Tomazi et al., 2009; Zingales et al., 2012). Alem destes, (Marcili et al., 2009)descreveu o
TcBat associados a morcegos e geneticamente próximo ao TcI. Mas, a compreensão das correlações entre DTUs, distribuição geográfica, habitats, ecologia, espécie hospedeira e patogenicidade ainda é controversa, mostrando que a eco-epidemiologia do T. cruzi está
A caracterização das linhagens do T. cruzi auxilia no entendimento do
intercâmbio dos ciclos silvestre e doméstico do parasito e de como este circula por estes ambientes. Algumas técnicas como: perfil isoenzimático do parasita (Tibayrenc et al.,
1984; Bogliolo et al., 1986; Barnabe et al., 2000; Acosta et al., 2001); caracterização
molecular usando o gene do mini-éxon (Souto et al., 1996; Brisse et al., 2001; O'connor et
al., 2007); gene LSU rDNA (amplificação do domínio D7 do gen da 24sαrRNA) (Brisse et al., 2001); RFLP-PCR baseado em SNP„s (single nucleotide polymorphisms) dos genes
HSP60; histona H1 (Sturm et al., 2003); G1 (Gaunt et al., 2003) e por polimorfismos de
microssatélites (Oliveira et al., 1998; Oliveira et al., 1999; Macedo et al., 2001) são
utilizadas na diferenciação destas cepas.
O PCR multiplex amplifica fragmentos de DNA satélite (Liarte et al., 2009) e
são úteis para identificação das linhagens I-I, II-IIb e Trypanosoma rangeli (parasito não
patogênico que possui vetores e hospedeiros comuns ao T. cruzi). Os polimorfismos
intergênicos são utilizados para caracterizar o padrão de T. cruzi I a VI (Fernandes et al.,
2001; Lewis et al., 2009; Zingales et al., 2009; Aliaga et al., 2011). A resolução segura
dos isolados do parasito em seus seis subgrupos requer a combinação de diferentes metodologias, devido à existência dos grupos híbridos (Zingales et al., 2012)
1.6. Marcadores moleculares microssatélites
Marcadores moleculares são sequências de DNA que identificam polimorfismos e podem ser usados como indicadores de variação genética entre indivíduos relacionados (Pereira e Lee, 1995; Ferreira e Grattapaglia, 1998).
Os microssatélites (Short Tandem Repeats– STR ou Simple Sequence Repeats
- SSR) são pequenas sequências de DNA (2 a 6 pares de base) repetidas em tandem, que
são amplamente encontradas em todo o genoma (Ferreira e Grattapaglia, 1998). Os marcadores microssatélites apresentam padrão de herança codominante, são altamente polimórficos, com taxa de mutação variando de 10-6 a 10-2, por locus, por gameta, por
geração. Entretanto, são flanqueados por sequências únicas, possibilitando reprodutibilidade por meio da técnica de Reação em Cadeia da Polimerase (PCR) (Li et
al., 2002; Oliveira et al., 2006).
gênico entre populações, dispersão vetorial, avaliação taxonômica dos vetores e estudos populacionais (Martins et al., 2006; NASS, 2007).
Podemos citar o alto custo, o tempo para se determinar regiões repetidas in
tandem no genoma e o desenvolvimento de novos iniciadores que flanqueiam estes loci
como as principais desvantagens da utilização dos microssatélites. Mas, a partir de análises populacionais é possível usar marcadores descritos para uma espécie em outras filogeneticamente relacionadas (Harry, Roose, et al., 2008a; Belisário et al., 2015). Para
triatomíneos já foram descritos e caracterizados primers para Rhodnius pallescens (10
loci) (Harry et al., 1998), Triatoma dimidiata (8 loci) (Anderson et al., 2002), T. infestans
(19 loci) (Garcia et al., 2004; Marcet et al., 2006), T. pseudomaculata (6 loci) (Harry et
al., 2008b), R. prolixus (20 loci) (Fitzpatrick et al., 2008; Harry et al., 2008), R. robustus
(10 loci) (Harry et al., 2008), T. brasiliensis (9 loci) (Harry et al., 2009; Almeida et al.,
2016) e T. sordida (10 loci) (Belisário et al., 2015).
Estudos como o de Richer et al. (2007), Piccinali e Gurtler (2015), Almeida et
al. (2016), Piccinali et al. (2018) mostram a utilização de marcadores microssatélites no
monitoramento da origem das reinfestações em áreas previamente tratadas com inseticidas. Foley et al. (2013) utilizaram microssatélites para avaliar o processo de
urbanização do T. infestans no Peru. Belisário et al. (2017) para mostrar a estrututração
populacional das populações residuais de T. infestans do Brasil. Dessa forma, marcadores
microssatélites vem sendo usados para identificar fluxo gênico ou isolamento populacional, contribuindo com os sistemas de vigilância e controle vetorial no tocante a identificação da persistência de focos residuais de triatomíneos, falhas operacionais e a existência de populações de insetos resistentes ao(s) inseticida(s) utilizado(s).
1.7. Identificação de Fontes Alimentares em Triatomíneos
A identificação de fontes alimentares utilizadas pelos triatomíneos é útil para auxiliar no entendimento de sua relação com os diferentes ecótopos e hospedeiros, incluindo sua dinâmica de dispersão e nicho ecológico. (Schofield et al., 1999; Almeida et
al., 2000). O ecletismo alimentar e o oportunismo são características que ajudam a
determinar a importância epidemiológica dos triatomíneos, conforme capacidade de adaptação para se alimentar da maior variedade de vertebrados, em especial os sinantrópicos, condição tida como pré-adaptativa ao processo de domiciliação (Forattini et
Estratégias de controle vetorial também podem ser beneficiadas, principalmente o controle de espécies autóctones como T. brasiliensis, que representa um
desafio operacional importante, devido, a constante recolonização e risco de transmição do
T. cruzi no ambiente domiciliar (Schofield et al., 1999; Silveira e Vinhaes, 1999; Diotaiuti
et al., 2000; Lorenzo et al., 2000; Sarquis et al., 2012; Diotaiuti et al., 2015).
Alencar (1987) mostrou que o T. brasiliensis é capaz de se alimentar do
homem, o cão e gato onde os encontra, seja em ambiente artificial ou ecótopos naturais. Bezerra et al. (2014) identificaram roedores, répteis, mamíferos e aves como fontes
alimentares em amostras de T. brasiliensis silvestres. Sarquis et al. (2010) estudando essa
espécie no ambiente silvestre em períodos de chuva e seca, concluíram que as taxas de infecção por T. cruzi e a quantidade de fontes alimentares identificadas diminuíam
conforme o período de seca se prolongava. Nesse mesmo estudo, as principais associações alimentares do T. brasiliensis foram com aves (33,1%) e tatus (18,8%). Valença-Barbosa
et al. (2015) e Almeida et al. (2016) identificaram DNA de galinhas e caprinos em
amostras de conteúdo estomacal de T. brasiliensis no Ceará e Rio Grande do Norte,
respectivamente. Os resultados evidenciaram que o modo de criação extensivo dessas espécies favorece a aproximação do ciclo silvestre de T. cruzi com o ambiente domiciliar.
O primeiro método utilizado para identificar o conteúdo estomacal dos
triatomíneos foi o teste de precipitina por Romaña (1939), posteriormente aplicado por Correa e Aguiar (1952) até ser padronizado por Siqueira (1960). Outro teste imunológico amplamente utilizado foi ELISA Duarte (1997). Atualmente o uso de técnicas moleculares como o sequenciamento de DNA ribossomal (Kitano et al., 2007; Waleckx et al., 2014;
Wong et al., 2016), Citocromo b (Mota et al., 2007; Valença-Barbosa et al., 2015; Villacis
et al., 2015; Almeida et al., 2016), PCR-Multiplex da região intergênica do gene
mini-exon (Bosseno et al., 2006) e DNA mitocondrial SINE (Short Interspersed Elements)
(Pizarro et al., 2007) estão sendo utilizados.
1.8. O município de Tauá
oscila entre 26ºC e 28ºC e pluviometria média de 597,2mm3, com período chuvoso de fevereiro a abril. Os municípios limítrofes são: ao norte Pedra Branca e Independência, ao sul Parambu e Arneiroz, ao leste Mombaça e Pedra Branca, ao oeste Quiterianópoles e Parambu. Possui 13,9 (hab/Km²) de densidade demográfica (IPECE, 2016).
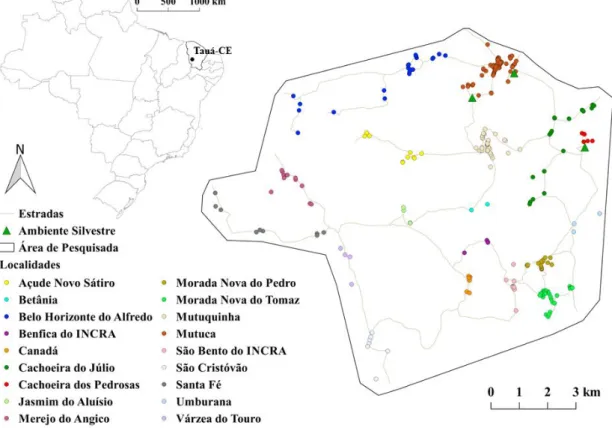
Figura 3 - Localização do município de Tauá (CE), com destaque para as áreas pesquisadas: ( ) Unidades domiciliares; ( ) Ambiente silvestre
Fonte: Adaptado a partir dos programas Google Earth e QGis 2.14. Essen. A: Localização do Estado do Ceará. B: Área do município de Tauá, Ceará, Brazil. C: Área de estudo. D: Detalhe da área de estudo.
e 0,699). A dimensão que mais contribui para o IDHM do município é Longevidade, com índice de 0,773, seguida de Renda, com 0,585, e de Educação, com 0,560 (BRASIL, 2013). Segundo dados da Secretaria da Saúde do Estado do Ceará, a região é considerada historicamente como uma das mais importantes no contexto ecoepidemiológico da transmissão da doença de Chagas no estado do Ceará, (Apêndices 1 a 13).
A cobertura vegetal da caatinga encontra-se fortemente degradada, apresentando sucessão secundária em seus padrões fisionômicos, onde predomina a caatinga arbustiva-arbórea. A vegetação caducifólia e garranchenta, inserida em solos rasos e quase sempre pedregosos possui elevada deficiência hídrica na maioria dos meses do ano (OLIVEIRA, 2006; Trigueiro et al., 2009).
A floresta caducifólia espinhosa é representada por Cactaceae (Mandacaru, Palma e Xique-xique) e caatinga arbustiva aberta, com espécies lenhosas das famílias Fabaceae (Angico, Pau-ferro, Imburana, Catingueira e algumas espécies de Juremas); Apocynaceae (Pereiro); Euphorbiaceae (Favela, Velame, Pinhão-bravo e Marmeleiro); Anacardiaceae (Aroeira e Mangueira); Mimosaceae (Jurema-branca e Algarobas) e espécies perenifólias como Rhamnaceae (Juazeiro) (Trigueiro et al., 2009; IBGE, 2012).
Conforme as unidades morfoestruturais do estado do Ceará (Souza, 1988) o Município de Tauá possui as seguintes unidades: Coberturas Sedimentares Cenozóicos com planícies e terraços fluviais; Maciços Residuais e Depressão Sertaneja Dissecada e Aplainada. O embasamento cristalino Pré-cambriano é o substrato rochoso mais abundante. Os maciços residuais estão situados nos limites geográficos de Tauá, entre as cotas altimétricas de 550m a 800m, no Maciço de Pedra Branca e Serra da Joaninha (OLIVEIRA, 2006).
A Depressão Sertaneja Dissecada encontra-se entre 450m e 550m, local de abundante extrativismo vegetal e pecuária. A caatinga arbórea densa, arbustiva aberta e arbóreo-arbustiva são as principais coberturas vegetais. Os relevos dissecados em colinas rasas de topografia suave e ondulados são intercalados por vales abertos, apresentando cristas em alguns setores, que possuem textura arenosa média, fase pedregosa e rochosa, relevo forte ondulado e montanhoso, substrato gnaisse e granito (Oliveira et al., 2000).
É nesse contexto de rochas do embasamento cristalino, marcado principalmente por rochas graníticas com fraturas expressivas, vegetação caducifólia e arbustiva, que vivem pequenos mamíferos, répteis e insetos. Dentre eles o T. brasiliensis,
que possui nesse ambiente o seu ecótopo primário (FORATTINI, 1980).
Inhamuns foi o primeiro nome dado ao município de Tauá por ter sido habitado pelos índios Jucás, que segundo José de Alencar significava “irmão do diabo”. A palavra Tauá origina-se no Tupi, e quer dizer “barro amarelo e argiloso”. Entretanto, a existência de três sítios paleontológicos e 15 arqueológicos, com inúmeras manifestações de populações rupestres atribuem a Tauá o significado de “cidade antiga”. A utilização dos conjuntos de pedras graníticas como habitação pelos primeiros habitantes da região pode supor o quão antigo é o contato desse povo com os triatomíneos ali existentes. Em 3 de maio de 1802, o povoado foi elevada à vila, com o nome de São João do Príncipe, estimulando a ocupação das regiões dos Inhamuns (IBGE, 2008).
O Serrote Quinamuiú, cujo significado em Tupi quer dizer “serra perto da água” é um dos afloramentos rochosos mais belos do Ceará, localizado a Oeste da sede municipal e pode ser visto de qualquer ponto da cidade. Na Serra da Joaninha nasce o rio Jaguaribe, com o nome de Trici (IBGE, 2008).
O município de Tauá iniciou as atividades do PCDCh em 1983, com a vasta implantação ocorrida nesse período, como citado anteriormente. As prevalências populacionais da infecção pelo T. cruzi no município de Tauá foram estudadas por duas
ocasiões em inquéritos nacionais: 1) Inquérito sorológico realizado em escolares, com crianças de 7 a 14 anos, entre 1991 e 1993, com 1.732 amostras processadas (4,5% - 1732/38.429) da amostra coletada no estado, sem reações positivas (BRASIL, 1996); 2) Inquérito da Soroprevalência da Infecção Chagásica (INSIC), entre 2001 e 2008, em crianças de 0 a 5 anos incompletos, ondeforam coletadas 231 (2,4% - 231/9.797) do total de amostras estadual, também sem positividade (Ostermayer et al., 2011).
Dados do Laboratório Central de Saúde Pública (LACEN) da Secretaria da Saúde do Estado do Ceará identificaram uma prevalência em Tauá de 6,2% (70 /1.123) no período de 2013 até agosto de 2018. Segundo o Sistema de Mortalidade (SIM), Tauá representou 1,9% (5/258) das mortes por doença de Chagas no Ceará como causa básica e associada, no mesmo período analisado (dados não publicados).
consolidação da descentralização das ações de controle vetorial do nível federal para o municipal (DIAS, 2000). A consolidação do PCDCh, após a descentralização é um processo tecnicamente viável, mas depende de aprimoramentos administrativos em sua estrutura, e de real vontade política dos governantes (Villela et al., 2007). Tauá é um
2. JUSTIFICATIVA
Diante do exposto, este estudo justifica-se pelos seguintes motivos:
O limitado conhecimento sobre os elementos que constituem a dinâmica de infestação e reinfestação de triatomíneos e a transmissão de T. cruzi no semiárido
nordestino.
A intensidade do processo de reinfestação das unidades domiciliares, em especial o peridomicílio, após borrifação residual por espécies autóctones de triatomíneos é um tema de fundamental compreensão para o sucesso do controle vetorial (SCHOFIELD, 2000; WHO, 2002b; Picollo et al., 2005; Carbajal De La Fuente et al., 2007; Feliciangeli et al.,
2007).
O desenvolvimento do estudo aqui proposto poderá fornecer subsídios para se avaliar a importância dos ecótopos naturais e artificiais no processo de colonização e recolonização das unidades domiciliares, principalmente pelo T. b. brasiliensis,
colaborando com informações úteis para auxiliar na elaboração de estratégias adequadas ao controle dos vetores da doença de Chagas.
O município de Tauá foi escolhido por representar a região do Sertão dos Inhamuns, localizado no semiárido nordestino, cujo bioma predominante é a Caatinga. Possui localidades rurais com alta dispersão e infestação por T. b. brasiliensis e T.
pseudomaculata.
As perguntas de partida para a construção do objeto de estudo foram:
i) Ocorreu alteração nos índices de infestação por triatomíneos ao longo do período de estudo nas localidades rurais trabalhadas no município?
ii) Ocorreu alguma alteração no perfil de infecção por T. cruzi nestes triatomíneos?
iii) Houve diferença de infestação por triatomíneos no ambiente silvestre em relação às espécies e abundância do vetor?
iv) Houve diferença no perfil de infecção por T. cruzi nestes triatomíneos silvestres?
v) Como provavelmente ocorre o processo de infestação nas localidades estudadas? vi) Quais as fontes alimentares as populações de triatomíneos se utilizam e qual seu significado eco-epidemiológico?
3. OBJETIVOS
3.1.Objetivo geral
Caracterizar a ecoepidemiologia de triatomíneos e diversidade genética de
Triatoma brasiliensis brasiliensis e de Trypanosoma cruzi em áreas de caatinga do
município de Tauá (CE), de 2009 a 2015.
3.2.Objetivos específicos
a) Descrever os indicadores entomológicos do Programa de Controle da Doença de Chagas na área de estudo no município de Tauá (CE) nos anos de 2009, 2010 e 2015.
b) Identificar quais espécies de triatomíneos estavam presentes na área de estudo no município de Tauá (CE) nos anos de 2009, 2010 e 2015.
c) Identificar o perfil de infestação pelo Triatoma brasiliensis brasiliensis em
ambientes naturais identificados no município de Tauá (CE) ao longo do estudo.
d) Descrever a infecção pelo Trypanosoma cruzi em triatomíneos no ambiente
intradomiciliar, peridomiciliar e silvestre na área de estudo no município de Tauá (CE) nos anos de 2009, 2010 e 2015.
e) Descrever os padrões de infestação e colonização após controle químico residual realizado em 2009 e 2010 em ambiente intradomiciliar e peridomiciliar na área de estudo no município de Tauá (CE) 6, 14, 20 e 78 meses após a primeira borrifação.
f) Descrever as fontes alimentares associadas a T. b. brasiliensis em ambientes
intradomiciliar, peridomiciliar e silvestre de localidades no município de Tauá (CE) em 2015.
g) Caracterizar a dinâmica de infestação e reinfestação de T. b. brasiliensis.
h) Caracterizar o perfil molecular de T. cruzi em ambientes intradomiciliar,
4. METODOLOGIA
4.1.Tipo de Estudo
Trata-se de um estudo transversal descritivo com cortes temporais.
4.2.Área de estudo
Para a pesquisa triatomínica domiciliar foram selecionadas 18 localidades integrantes do distrito Carrapateiras, totalizando 252 unidades domiciliares (UDs), são elas: Açude Novo do Sátiro (AS) (10 UDs), Belo Horizonte do Alfredo (BHAL) (24 UDs), Benfica do INCRA (BI) (2 UDs), Betânia (BET) (2 UDs), Cachoeira do Júlio (CJ) (17 UDs), Cachoeira dos Pedrosas (CP) (5 UDs), Canadá (CANA) (6 UDs), Jasmim do Aluísio (JA) (3 UDs), Merejo do Angico (MA) (12 UDs), Morada Nova do Pedro (MNP) (17 UDs), Morada Nova do Tomaz (MNT) (27 UDs), Mutuca (MUTU) (61 UDs), Mutuquinha (MUTQ) (36 UDs), Santa Fé (SF) (8 UDs), São Bento do INCRA (SBI) (8 UDs), São Cristóvão (SC) (7 UDs), Umburana (UMB) (3 UDs) e Várzea do Touro (VT) (4 UDs) (Figura 3).
Figura 4 - Área de estudo para pesquisa triatomínica no município de Tauá (CE)