REVISTA
BRASILEIRA
DE
ANESTESIOLOGIA
PublicaciónOficialdelaSociedadeBrasileiradeAnestesiologiawww.sba.com.br
ARTÍCULO
CIENTÍFICO
El
meloxicam
subaracnoideo
no
inhibe
la
hipernocicepción
mecánica
en
el
test
de
la
carragenina
en
ratones
夽
Lanucha
Fidelis
da
Luz
Moura
a,∗,
Silvana
Bellini
Vidor
b,
Anelise
Bonilla
Trindade
b,
Priscilla
Domingues
Mörschbächer
b,
Nilson
Oleskovicz
cy
Emerson
Antonio
Contesini
daUniversidadeFederaldoRioGrandedoSul(UFRGS),PortoAlegre,RS,Brasil
bProgramadePostgradoenCienciasVeterinarias,UniversidadeFederaldoRioGrandedoSul(UFRGS),PortoAlegre,RS,Brasil cUniversidaddelEstadodeSantaCatarina,Florianópolis,SC,Brasil
dFacultaddeVeterinaria,UniversidadeFederaldoRioGrandedoSul(UFRGS),PortoAlegre,RS,Brasil
Recibidoel21deagostode2013;aceptadoel28deoctubrede2013 DisponibleenInternetel13deenerode2015
PALABRASCLAVE
AINE; Carragenina; Dolor;
Médulaespinal
Resumen
Justificaciónyobjetivo:Evaluar los efectos antinociceptivos del meloxicam subaracnoideo sobrelahipernocicepciónmecánicainducidaporlacarrageninaenratones.
Métodos: Estudioaleatorizadoycontrolado.DieciochoratonesWistar,machosadultos,fueron sometidos ala implantación de unacánula subaracnoideay aleatoriamente distribuidos en 2grupos:elgrupoi recibió5ldesoluciónsalina, mientrasqueal grupoiiseleadministró 30gdemeloxicam,ambosporvíasubaracnoidea.Lahipernocicepciónmecánicafueinducida medianteinyecciónintraplantardecarrageninayfuecalculadaconelusodeunanalgesímetro digitalcada30minduranteunperíodo de4h.Los resultadosfueron registradoscomo el
delumbralderetirada(g),calculadorestándoseelvalordelasmedidasposteriormentealos tratamientos,delvalorbasal.
Resultados: Losvaloresmediosdeldelumbralderetiradafueronmenoresenelgrupotratado conmeloxicamentodoslosmomentosdeevaluaciónentre45y165min,sinembargo,nose demostrósignificaciónestadística(p=0,835)paraesadiferencia.
Conclusión:Laadministraciónsubaracnoideadelmeloxicamenladosisde30g/animal---1no
fuecapazdesuprimirlahipernocicepciónmecánicaenunmodelodedolorinflamatorioinducido porla administraciónintraplantardecarrageninaenratones. Losdatossugierenquedeben investigarseotrasdosisantesdedescartarelefectodelfármaco.
©2014SociedadeBrasileiradeAnestesiologia.PublicadoporElsevierEditoraLtda.Todoslos derechosreservados.
夽 Trabajorealizadoenel
HospitaldeClínicasdePortoAlegre(HCPA),PortoAlegre,RS,Brasil.
∗Autorparacorrespondencia.
Correoelectrónico:lanuchamoura@terra.com.br(L.F.L.Moura).
http://dx.doi.org/10.1016/j.bjanes.2013.10.018
KEYWORDS
NSAIDs; Carrageenan; Pain;
Spinalcord
Subarachnoidmeloxicamdoesnotinhibitthemechanicalhypernociception oncarrageenantestinrats
Abstract
Backgroundandobjective: Evaluatetheantinociceptiveeffectsofsubarachnoidmeloxicamon themechanicalhypernociceptioninducedbycarrageenaninrats.
Methods:Randomizedcontrolledtrial.EighteenadultmaleWistarratsunderwentacannula implantationintothesubarachnoidspaceandwererandomlydividedintotwogroups:groupi receivedsalinesolution5L,whilegroupiireceivedmeloxicam30g.Themechanical hyper-nociceptionwasinducedbyintraplantarinjectionofcarrageenanandevaluatedusingadigital analgesymeterevery30minduringa4hperiod.Theresultswererecordedasthewithdrawal threshold(ing),calculatedbysubtractingthemeasurementvalueafter.
Results:Thewithdrawalthresholdmeanvalueswerelowerinthegroupofpatientstreated withmeloxicamoveralltimepointsbetween45and165min,however,therewasnostatistical significance(P=.835)forthisdifference.
Conclusion: Subarachnoidmeloxicamatadoseof30g.animal---1didnotsuppressthe
mecha-nicalhypernociceptioninamodelofinflammatorypaininducedbyintraplantaradministration ofcarrageenaninrats.The datasuggestthatotherdosagesshouldbeinvestigatedthedrug effectisdiscarded.
© 2014SociedadeBrasileirade Anestesiologia.Publishedby ElsevierEditoraLtda.Allrights reserved.
Introducción
Las evidencias han demostrado que los antiinflamato-rios no esteroideos (AINE) tienen, además de la acción periférica reconocida, un poderoso efecto en los esta-dos de dolor experimental que es independiente de sus efectos antiinflamatorios1. Adicionalmente a su acción
de inhibición de la síntesis de prostaglandinas
periféri-camente, ha sido mostrada una acción central de los
AINE mediante estudios experimentales en los cuales
esos fármacos demuestran una mayor potencia por la
vía subaracnoidea cuando se compara con la
adminis-tración sistémica2,3. Varios estudios han evidenciado que
ambas formas de la ciclooxigenasa (COX) están
consti-tutivamente expresadas en el cerebro y en la médula
espinal de los ratones4, siendo COX-2 la isoforma
predo-minante en el cuerno dorsal de la médula espinal5. La
administración espinal de los fármacos antiinflamatorios
ha demostrado suprimir el reflejo de las fibras C,
inhi-bir la sensibilización neuronal en el cuerno dorsal de la
médula espinal y atenuar el dolor inflamatorio de larga
duración2,6---11.
El meloxicam es un analgésico y antiinflamatorio no
esteroideoquepertenecealaclasedelácidoenólico,
pre-sentandopreferenciaporlaisoenzimaCOX-212.Adiferencia
de muchos otros AINE, tiene una alta biodisponibilidad
oral y una larga vida media, aunque no esté exento de
efectos colaterales13. Hay pocos estudios que abordan la
administración del meloxicam por las vías espinales14---17
y no calculan sus efectos sobre el dolor inflamatorio
agudo.El objetivodela presenteinvestigaciónfue
calcu-lar elpoder antinociceptivodelmeloxicam subaracnoideo
sobreel dolor agudoinducido por lacarragenina en
rato-nes.
Materiales
y
métodos
El protocoloexperimental utilizado fueanalizado y
apro-badoporlaComisióndeÉticaenelUsodeAnimalesdela
Institución.Los ratonesfueron alojados individualmentea
unatemperaturacontrolada(21-24◦C)ycicloluz-oscuridad
de 12h, con agua y alimento ofertados ad libitum como
mínimodurante14días.
Los animales fueron preparados para cirugía bajo
anestesia con quetamina y xilazina (100 y 10mg/kg---1
vía intraperitoneal, respectivamente), y a continuación,
sometidosalaimplantacióndelacánulaenelespacio
suba-racnoideo deacuerdo con unamodificación de la técnica
previamente descrita en la literatura18. En resumen, los
animales fueron colocados en decúbito ventral, con
losmiembrosanterioresyposterioresfijadosenabducción
ycon la cabeza levemente elevada con relaciónal resto
del cuerpo. Después de desinfectar la piel de la región
atlantooccipital,serealizóunaincisiónverticalde
aproxi-madamente2cmdeextensiónenlalíneamediadelaregión,
iniciándose en el punto entrelas orejas y extendiéndose
hasta la cola. El tejido subcutáneo ylos músculos
biven-tercervicisyrectuscapitisdorsalismayorfueronapartados
pordisecciónroma.Conlaretraccióndelamusculatura,la
duramadreylacisternamagnafueron visualizadas,y
des-puésdelaexposicióndelamembranaatlantooccipital,se
usóunaaguja18Gparaperforarsuregióncentral,hastaque
ocurrieselasalidadellíquidocefalorraquídeo. Unacánula
depolietilenoPE-10(#BB31695-PE/1, Scientific
Commodi-ties,LakeHavasu City-AZ,EE. UU.)seinsertóatravésdel
orificio y se dirigió 8,5cm caudalmente en el interior
delespaciosubaracnoideo,hastallegaralaregióndel
alar-gamiento lumbar. La medida, el corte y la marcación de
períodoprevioalexperimento, siendoesematerial
indivi-dualmenteempaquetadoyesterilizadoconóxidodeetileno.
Laporcióncranealdelacánulaseinsertóatravésdeuna
aguja18G,permitiendosuacomodacióneneltejido
subcu-táneo,parapodersalirdelapielcercadelapartesuperior
delacabeza.Losmúsculosylapielfueronsuturadosyel
extremo externo del catéter fue ocluido con la inserción
deunpeque˜nofragmentodeagujadental(30G×21mm).
Finalmente,laporciónexternadelacánulasefijóalapiel
conuna sutura.Duranteel períodoposterior a la
implan-tación de la cánula, los animales fueron mantenidos en
unascajasplásticasindividualesbajolasmismas
condicio-nes del período previo. El día siguiente a la colocación
de la cánula, los animales fueron evaluados, de modo
que los déficits neurológicos se pudiesen comprobar. Los
quepresentaronalteracionesneurológicasfueronexcluidos
delestudio.
DieciochoratonesWistar,conunpesode300-450g,
fue-ronpreparadosconéxitoparaelestudio,yundíadespués
delacolocacióndelacánula,fueron sometidosaltestde
evaluación de la hipernocicepción mecánica inducida por
la carragenina. Para eso, se usó un analgesímetro digital
(InsightLtda Equipamentos Científicos,Ribeirão Preto-SP,
Brasil),deacuerdocon latécnica previamentedescrita19,
enlacualuntransductordepresiónequipadoconunapunta
depolipropilenode7mm2fueaplicadoperpendicularmente
a la superficie plantar derecha de los animales, con una
presiónlinealmentecreciente.Elequipamientoregistróla
fuerza ejercida, expresada en gramos (g), con una
exac-titud de 0,1g. La estimulacióndel miembro fue repetida
hastaqueelanimalpresentase3medidassimilares(la
dife-renciaentreel valormásaltoyel másbajofueseinferior
a 10g). Así, el comportamiento nociceptivo se cuantificó
atravésdelpromediode3valoresexpresadosengramos,
querepresentaelumbralderetiradadelapataalestímulo
mecánico,encadamomentodelaevaluación.Fueron
consi-deradoscomorespuestapositivalaretiradadelmiembroal
contactoconlapuntaoelcomportamientodesacudiry/o
lamerelmiembro almomento oinmediatamentedespués
delaestimulación(flinch).Laambulaciónfueconsiderada
una respuesta ambigua, por tanto, cuando ocurrió en el
momentodelaaplicacióndeltest,esteserepitió.
Aproximadamente30minantesdeliniciodelas
evalua-ciones,losratonesfuerontransferidosallugardondeseiban
a realizar los test: cajas acrílicas con un suelo de
alam-bresno maleable, en una sala silenciosa, permitiendosu
climatización,constatadaporel cesedelcomportamiento
de limpieza y la exploración de la región. A lo largo de
eseperíodo,fueronrealizadasaproximadamente5
estimu-lacionesdelosmiembrosdelosanimales,parapermitirsu
familiarización con el estímulo aplicado. A continuación,
fueronestablecidoslosvaloresbasalesdecadaanimal.
Unavez registradoslosvaloresbasales,secogieronlos
animalesyseprocedióalaretiradadelfragmentometálico
oclusivodelcatéter.Acontinuación,losanimalesfueron
dis-tribuidosaleatoriamenteen2 grupos. Los delgrupoi (GI,
n=9) fueron sometidos ala administración subaracnoidea
de5L de soluciónsalina, mientrasque los animalesdel
grupoii(GII, n=9)recibieron30gdemeloxicam diluidos
enunasoluciónsalinahastaunvolumenfinalde5L,por
la misma vía. Las soluciones fueron administradas con la
ayudade una micro jeringuillaHamilton de 10L (701N,
HamiltonCompany, Reno-NV,EE: UU.)durante unperíodo
de30seg. Realizadotal procedimiento, fueroninyectados
10Ldesoluciónsalinaestérilparaellavadodelcatéter.
Inmediatamentedespuésdelaadministracióndelas
sus-tancias en el espacio subaracnoideo, carragenina-lambda
(0,1ml decarragenina2,5%)seinyectó enlaregión
intra-plantardelmiembroderecho,siguiendolatécnicadescrita
previamente en la literatura20. El momento de la
inyec-cióndela carrageninafueregistrado comotiempo 0(T0),
ylasevaluacionesposterioresfueronrealizadascada30min
durantelas4hposterioresalaadministracióndelfármaco,
paraobtenerse unperfiltemporaldeaccióndelamisma.
Todaslasevaluacionesfueronrealizadasporuncomponente
delequipoquenoconocíaeltratamientoalcualcada
ani-malsesometió. Unavezque losanimales fuerontestados
enlosperíodosanterioresyposterioresalaadministración
delosfármacos,losresultadosfueronregistradoscomo el
delumbralderetirada(g),calculadorestándoseelvalor
delasmedidasdespuésdelostratamientos,delvalorbasal,
yconfrontadoesosvalores.
Los datos aparecencomo media±desviación estándar.
Losvaloresdeldelumbralderetiradafueroncomparados
con el uso del análisis de variancias con medidas
repeti-das y 2 factores, siendo el grupo (GI o GII) el factor fijo
yelmomento(tiempocada30min)elfactorderepetición.
Para el análisis sepresupuso unamatriz de correlaciones
no estructuradas entre los momentos de evaluación. Los
análisis fueron realizados con el softwareSAS versión 8.0
paraWindowsyelniveldesignificaciónfuedeterminadoen
p<0,05.
Resultados
Conelpasodeltiemposediounaumentopromediodel
delumbralderetirada,siendosusvaloresestadísticamente
mayoresenlasevaluacionescon210y240minconrelación
alasdemás(p<0,05).Pudieronserconstatadasdiferencias
entre otros momentos de evaluación, siempre existiendo
unaumentopromediodeldelumbralderetiradaconel
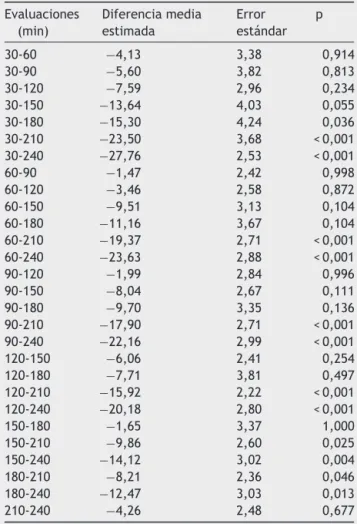
transcurrirdelexperimento,comosemuestraenlatabla1.
Losvalorespromediodeldelumbralderetirada
fue-ronmenoresenelgrupotratadoconmeloxicamentodoslos
momentosdeevaluaciónentre45y165min,apesardeno
haber sido demostrada significaciónestadística (p=0,835)
paraesa diferencia(fig. 1).Diferencias promedioenel
del umbral de retirada se dieron entre losmomentos de
evaluacióndentrodecadagrupo(p<0,001).
Durantelaevaluacióndelaantinocicepción,2ratones,
ambos pertenecientes al GI, tuvieron respuestas
clíni-camente diferenciadas después de la inducción de la
hiperalgesia.Esosanimalesmostraronlapresenciade
secre-ción ocular, un significativo cansancio,con vocalizaciones
en reposo y negativa a apoyar el miembro sometido a la
aplicacióndecarragenina,sugiriendolapresenciadedolor
intenso.Laevaluaciónantinociceptivadeesosratonestuvo
un grado de dificultad elevado con relación a losdemás,
vistoquelosanimalesnopermitíanqueunafuerzase
ejer-ciesecontralasuperficieplantardurantelacomprobación.
Enesoscasos,losanimaleslevantabanelmiembroafectado,
seguido del movimiento dela punta, noejerciendo
Tabla1 Diferenciamedia,errorestándaryvalordepdel
delumbral deretirada(g)enlosratones delosgrupos GI y GII,en losdiferentes momentos deevaluación dela hipernocicepcióninducidaporla inyecciónintraplantar de carragenina
Evaluaciones (min)
Diferenciamedia estimada
Error estándar
p
30-60 −4,13 3,38 0,914
30-90 −5,60 3,82 0,813
30-120 −7,59 2,96 0,234
30-150 −13,64 4,03 0,055
30-180 −15,30 4,24 0,036
30-210 −23,50 3,68 <0,001
30-240 −27,76 2,53 <0,001
60-90 −1,47 2,42 0,998
60-120 −3,46 2,58 0,872
60-150 −9,51 3,13 0,104
60-180 −11,16 3,67 0,104
60-210 −19,37 2,71 <0,001
60-240 −23,63 2,88 <0,001
90-120 −1,99 2,84 0,996
90-150 −8,04 2,67 0,111
90-180 −9,70 3,35 0,136
90-210 −17,90 2,71 <0,001
90-240 −22,16 2,99 <0,001
120-150 −6,06 2,41 0,254
120-180 −7,71 3,81 0,497
120-210 −15,92 2,22 <0,001
120-240 −20,18 2,80 <0,001
150-180 −1,65 3,37 1,000
150-210 −9,86 2,60 0,025
150-240 −14,12 3,02 0,004
180-210 −8,21 2,36 0,046
180-240 −12,47 3,03 0,013
210-240 −4,26 2,48 0,677
60
50
40
30
20
10
0
90 60
30 120 150 180 210
∆
umbral de retirada
Tiempo (minutos)
240
Placebo Meloxicam
Figura 1 Valores promedios del del umbral de reti-rada±desviación estándar(g)enlosdiferentesmomentosde evaluacióndelahipernocicepciónmecánica,enratones some-tidosalaadministraciónSAdesoluciónsalina(GI)omeloxicam (GII).
tuvieronaltosvaloresdelumbralderetirada,quenoestaban atonoconloquepudoserclínicamenteobservado.
Discusión
LaefectividaddelosAINEconvencionales,delosinhibidores delaCOX-2ydelosanticuerposmonoclonales antiprosta-glandinaE2comoagentesantiinflamatoriosenlosmodelos
experimentalesutilizandolacarrageninaestáhoy porhoy muybiendescritaenlaliteratura20---22.Susaccionesfueron
tradicionalmenteatribuidasalainhibicióndelas
prostaglan-dinasperiféricas,lascualesejercenunimportantepapelen
lasensibilizacióndelosnociceptoresenelsitiodelesión23,
unavezquelainyecciónintraplantardecarrageninainduce
unsignificativo aumentoen la expresión deCOX-2, como
también en la producción de prostaglandina E224. Las
cantidadesrelativas decada isoformaque están
expresa-dasenlosdiferentestejidospueden sinembargo variar y
sermoduladasencondicionespatológicas.Así,contrastando
conotrosórganos,elcerebronormaldelratón,como
tam-biénlamédula espinal,expresanmásCOX-2que COX-125,
yhay datosque confirman su papel en el procesamiento
sensorialdel dolor26. Así, una serie deevidencias
experi-mentales nos sugieren actualmente que los AINE ejercen
suacciónanalgésicatambiénporsuactividadsobreel
sis-temanerviosocentral,pora˜nadiduraasureconocidaacción
periférica25.
Diversosfármacoshansidoadministradosporvíaespinal
enunintento decomprobartalmecanismo, ylaausencia
deefectosconsistentesdelmeloxicamsubaracnoideosobre
lanocicepcióninducidaenelmodeloexperimentalutilizado
secontraponealoshallazgosdeotrosautores,que
repor-tanunaactividadantinociceptivadespuésdelusoespinalde
otros AINE2,14,15,20,27---32. Resaltamos sin embargo, que
aun-quehayunavariedad detrabajosque investiganelpoder
antinociceptivodelosinhibidoresdela COX-2
administra-dosporvíasubaracnoidea,losqueabordanespecíficamente
los efectos del meloxicam son todavía escasos. Esos
tra-bajos ya fueron capaces de demonstrar, sin embargo, un
efectoinhibitoriosobreelfenómenodewind-upinvitro33,
comotambiénsobrelanocicepcióninducidaporla
capsai-cinaoformalina34. Adicionalmente,quedódemostradoun
efecto analgésico sinérgicocon la morfina después de su
administraciónsubaracnoideaenanimalescondolor
visce-ralexperimental15.Enunestudioprevio17,unadosissimilar
aladelpresentetrabajo(30g/animal---1)fueutilizadapara
investigarlosefectosantialodínicosdelmeloxicamporvía
subaracnoidea.Losautores,sinembargo,usaronunmodelo
dedolorneuropáticoexperimentalenratonescaseros
dia-béticos,siendodiferentedelmodelodedolorinflamatorio
deestainvestigación.Losefectosdelfármaco,sinembargo,
fuerondemostradosconladosisusada,loquenosedioen
esteestudio.Observandoatentamentelosdatos
presenta-dosenlafigura1,sepuedesinembargonotarqueelgrupo
sometido a la administración del meloxicam tuvo valores
promediosdeldelumbralderetiradainferioresalos
mos-tradosporel grupoquerecibiólasoluciónsalina,durante
todoslosmomentosdeevaluaciónentre45y165min.
La inflamación generadapor la aplicación intraplantar
de carragenina se caracteriza por mostrar un
(0-1h) ha sido atribuida a la liberación de histamina,
5-hidroxitriptamina y bradicinina, de modo que la
efica-ciadelosAINE enese períodoha sido cuestionada.Enla
fasetardía(1-6h),porotrolado,sehaverificadouna
ele-vadaproducción deprostaglandinas35. Lahiperalgesia,sin
embargo,parecedesarrollarseenparaleloconlaelevación
delosnivelesespinalesdeCOX-2ysupicosoloocurre
des-puésde4hdelainyeccióndecarragenina36.Noobstante,
alobservarla figura 1 podemos notarque los efectosdel
meloxicamsobrelahiperalgesiasedieronjustamenteenel
períodoanterioralas4hdeevaluación,convalores
signifi-cativamenteelevadosdeldelumbralderetiradadespués
de165mindelaadministración,contraponiéndoseatales
afirmaciones.
Ese comportamiento de la curva de respuesta, sin
embargo, tambiénse observó entrabajos que, usando el
modelodelacarragenina,constataronefectos
antihiperal-gésicostérmicoscuandoseadministróporvíasubaracnoidea
elSC58125(uninhibidorselectivodelaCOX-2)solamente
durante los 170min iniciales de la evaluación37. Visto
que la hiperalgesia térmica ha demostrado ser mediada
deformasimilarporlaaccióndelaCOX-2espinal38,
estu-diosquecaractericenelestándardeexpresiónmedularde
laCOX-2 enla inflamacióninducida porla carragenina, y
hasta la fecha aparentemente inexistentes,podrán
eluci-dartales observaciones. En ambos grupos experimentales
fueobservadounsignificativoaumentoenlaintensidadde
lahipernocicepción, caracterizadoporla elevación del
delumbralderetirada,especialmenteenlasevaluaciones
con210y240min.Talesconstatacionespuedenser
explica-dasporlasafirmacionesdeotrosautores,segúnlascuales
la repetición del estímulo mecánico puede producir una
elevaciónenlasensibilidaddeláreaestimulada39.La
admi-nistracióndelmeloxicam,portanto,tampocofuecapazde
impedireseaumentodelahipernocicepcióneneltranscurso
deltiempo.
Entrelosdiferentesfactoresque puedenhaberinfluido
en la obtención de los presentes resultados, el
esta-blecimiento de una dosis adecuada surgió como una
necesidad esencial cuya importancia puede haber sido
decisiva para los datos aquí reflejados. Actualmente,
los escasos trabajos con el meloxicam por vía
subarac-noidea traen protocolos de administración distintos del
preconizado en ese estudio, como técnicas de infusión
contínua16 o su asociación con opióides15. La
nece-sidad de determinar una dosis capaz de demonstrar
efectos consistentes, o incluso la ausencia de tales
efec-tos, estuvo fundamentada en la extrapolación de los
resultados obtenidos en tales estudios, con su
adecua-ción a las necesidades de este trabajo. Así, tomando
comobaseinvestigaciones previasquetuvieronresultados
satisfactorios con el uso de30g/animal---1 de meloxicam
subaracnoideosobreeldolorneuropáticoexperimental en
animalesdiabéticos17,fuepreconizadalautilizacióndeuna
dosissimilarparapoderobservarsusefectossobrela
hipe-ralgesiainflamatoria.
Eldolorneuropático,sinembargo,esunsíndrome
com-plejo que involucra teorías inflamatorias e inmunes que
todavíaestánpococlarificadas,ycuyahiperalgesiaresulta
tanto en el compromiso de los tejidos neurales como no
neurales,estandoasociadaconlaactivacióndefibrasA,
ademásdelasfibrasA␦40.Sinembargo,lacomplejidaddel
sistemanociceptivohademostradoquedespuésdelas
alte-racionesmínimasenlanaturalezadelprocesodolorosose
activandiferentesvíassensoriales41,loquenoshacecreer
quepuedensernecesariasdosisdiferenciadasdeunmismo
fármaco para la supresiónde losdolores de distintos
orí-genes.Esaposibilidadpuedeserrápidamentecontemplada
enelpresenteestudio,yaqueunadosiscapazdecontrolar
lahiperalgesianeuropáticanoobtuvolosmismosresultados
sobreladeorigeninflamatorio.Así,demostramosla
necesi-daddehacerfuturasinvestigacionesconlasdiferentesdosis
delfármaco.
Conflicto
de
intereses
Losautoresdeclarannotenerningúnconflictodeintereses.
Agradecimientos
LeagradecemosalCNPQ/CAPES laasignacióndeincentivo
alainvestigación.
Bibliografía
1.VinegarR,TruaxJF,SelphJL,etal.Pathwayto carrageenan-inducedinflammationin thehind limbof therat.Fed Proc. 1987;46:118---26.
2.MalmbergAB,YakshTL.Antinociceptiveactionsofspinal nons-teroidalanti-inflammatoryagentsontheformalintestinthe rat.JPharmacolExpTher.1992;263:136---46.
3.MalmbergAB,YakshTL.Hyperalgesiamediatedbyspinal gluta-mateorsubstancePreceptorblockedbyspinalcyclooxygenase inhibition.Science.1992;257:1276---9.
4.BrederCD,DewittD,Kraig RP.Characterizationof inducible cyclooxygenaseinratbrain.JCompNeurol.1995;355:296---315.
5.BurianM,GeisslingerG.COX-dependentmechanismsinvolved intheantinociceptiveactionofNSAIDsatcentralandperipheral sites.PharmacolTher.2005;107:139---54.
6.Beiche F, Scheuerer S, Brune K, et al. Up-regulation of cyclooxygenase-2mRNAintheratspinalcordfollowing perip-heralinflammation.FEBSLett.1996;390:165---9.
7.BianchiM,PaneraiAE.Thedose-relatedeffectsof paraceta-molonhyperalgesiaandnociceptionintherat.BrJPharmacol. 1996;117:130---2.
8.BustamanteD,PaeileC,WillerJC,etal.Effectsofintrathecal orintracerebroventricularadministrationofnonsteroidal anti-inflammatorydrugsonaC-fiberreflexinrats.JPharmacolExp Ther.1997;281:1381---91.
9.HerreroJF,ParradoA,CerveroF.Centralandperipheralactions oftheNSAIDketoprofenon spinalcordnociceptivereflexes. Neuropharmacology.1997;36:1425---31.
10.McCormackK.Non-steroidalanti-inflammatorydrugsandspinal nociceptiveprocessing.Pain.1994;59:9---43.
11.WillingaleHL,GardinerNJ,McLymontN,etal.Prostanoids synt-hesizedbycyclo-oxygenaseisoformsinratspinalcordandtheir contributiontothedevelopmentofneuronalhyperexcitability. BrJPharmacol.1997;122:1593---604.
12.Leal LB, Silva MCT, Bedor DCG, et al. Desenvolvimento de testededissoluc¸ãoparaomeloxicamutilizandooplanejamento fatorial:estudocomparativodeprodutosindustrializadosx pro-dutosmagistrais.RevBrasFarm.2008;89:160---3.
14.Pinardi G, Sierralta F, Miranda HF. Atropine reverses the antinociception of nonsteroidal anti-inflammatory drugs in the tail-flick test of mice. Pharmacol Biochem Behav. 2003;74:603---8.
15.PinardiG,PrietoGC,MirandaHF.Analgesicsynergismbetween intrathecalmorphineandcyclooxygenase-2inhibitorsinmice. PharmacolBiochemBehav.2005;82:120---4.
16.TakedaK,SawamuraS,TamaiH,etal.Roleforcyclooxygenase 2inthedevelopmentandmaintenanceofneuropathicpainand spinalglialactivation.Anesthesiology.2005;103:837---44.
17.KimuraS,KontaniH.Demonstrationofantiallodyniceffectsof thecyclooxygenase-2inhibitormeloxicamonestablished diabe-ticneuropathicpaininmice.JPharmacolSci.2009;110:213---7.
18.YakshTL,RudyT.Chroniccatheterizationofthespinal subara-chnoidspace.PhysiolBehav.1976;17:1031---6.
19.Vivancos GG, Verri WA Jr, Cunha TM, et al. An electronic pressure-meternociceptionpawtestforrats.BrazJMedBiol Res.2004;37:401---7.
20.FrancischiJN,ChavesCT,MouraAC,etal.Selectiveinhibitors ofcyclo-oxygenase-2(COX-2)inducehypoalgesiainaratpaw modelofinflammation.BrJPharmacol.2002;137:837---44.
21.Zhang Y, Shaffer A, Portanova J, et al. Inhibition of cyclooxygenase-2 rapidly reverses inflammatory hyperalge-siaand prostaglandin E2 production. J PharmacolExp Ther. 1997;283:1069---75.
22.Riendeau D, Percival MD, Brideau C, et al. Etoricoxib (MK-0663): preclinical profile and comparison with other agents thatselectivelyinhibitcyclooxygenase-2.JPharmacolExpTher. 2001;296:558---66.
23.KellyDJ,AhmadM,BrullSJ.PreemptiveanalgesiaI: physiolo-gicalpathwaysandpharmacologicalmodalities.CanJAnaesth. 2001;48:1000---10.
24.NantelF,DenisD,GordonR,etal.Distributionandregulation ofcycloocygenase-2incarrageenan-inducedinflammation.BrJ Pharmacol.1999;128:853---9.
25.Martin F, Fletcher D, Chauvin M, et al. Constitutive cyclooxygenase-2isinvolvedincentralnociceptiveprocesses inhumans.Anesthesiology.2007;106:1013---8.
26.VanegasH,SchaibleHG.Prostaglandinsandcyclooxygenasesin thespinalcord.ProgNeurobiol.2001;64:327---63.
27.WangBC,HillerJM,SimonEJ,etal.Analgesiafollowing subara-chnoidsodiumibuprofeninrats.Anesthesiology.1992;79:856.
28.WangBC,LiD,HillerJM,etal.Theantinociceptiveeffectof S-(+)-ibuprofeninrabbits:epiduralversusintravenous adminis-tration.AnesthAnalg.1995;80:92---6.
29.ParrisWC,JanickiPK,JohnsonBJr,etal.Intrathecal ketoro-lactromethamineproducesanalgesiaafterchronicconstriction injuryofsciaticnerveinrat.CanJAnesth.1996;43:867---70.
30.MassueT,DohiS,AsanoT,etal.Spinalantinociceptiveeffect ofepiduralnonsteroidalantiinflammatorydrugsonnitricoxide inducedhyperalgesiainrats.Anesthesiology.1999;91:198---206.
31.Miranda HF, Pinardi G. Lack of effectof naltrexone on the spinal synergism between morphine and non steroidal anti-inflammatorydrugs.PharmacolRep.2009;61:266---74.
32.Eisenach JC, Curry R, Tong C, et al. Effects of intrathe-cal ketorolac on human experimental pain. Anesthesiology. 2010;112:1216---24.
33.Lopeza-Garcia JA, Laird JM. Central antinociceptive effects of meloxicam on rat spinal cord in vitro. Neuroreport. 1998;9:647---51.
34.SantosAR,VedanaEM,deFreitasGA.Antinociceptiveeffectof meloxicam,inneurogenicandinflammatorynociceptivemodels inmice.InflammRes.1998;47:302---7.
35.DiRosaM,SorrentinoL.Somepharmacodynamicpropertiesof carrageeninintherat.BrJPharmacol.1970;38:214---20.
36.HilárioMO,TerreriMT,LenCA.Nonsteroidalanti-inflammatory drugs:cyclooxygenase2inhibitors.JPediatr.2006;82:S206---12.
37.Dirig DM, Isakson PC, Yaksh TL. Effect of COX-1 and COX-2 inhibition on induction and maintenance of carrageenan-evoked thermal hyperalgesia in rats. JPharmacol Exp Ther. 1998;285:1031---8.
38.YamamotoT,Nozaki-TaguchiN.Roleofspinalcyclooxygenase (COX)-2onthermalhyperalgesiaevokedbycarageenan injec-tionintherat.Neuroreport.1997;8:2179---82.
39.LeBarsD,GozariuM,CaddenSW.Animalmodelsofnociception. PharmacolRev.2001;53:597---652.
40.Kraychete DC,GozzaniJL, Kraychete AC.Dor neuropática ---aspectosneuroquímicos.RevBrasAnestesiol.2008;58:492---505.