Atividade inibitória de extratos vegetais do cerrado sobre α-milases
Texto
(2) 2. ALINE FERNANDA ANTUNES. ATIVIDADE INIBITÓRIA DE EXTRATOS VEGETAIS DO CERRADO SOBRE α-AMILASES Dissertação apresentada ao Programa de PósGraduação. em. Ciências. da. Saúde. da. Universidade de Brasília, como requisito parcial para a obtenção do título de Mestre em Ciências da Saúde. Orientadora: Prof.a Dr.a Laila Salmen Espindola. BRASÍLIA 2008.
(3) 3. TERMO DE APROVAÇÃO. ALINE FERNANDA ANTUNES. ATIVIDADE INIBITÓRIA DE EXTRATOS VEGETAIS DO CERRADO SOBRE α-AMILASES. Dissertação aprovada pela seguinte banca examinadora como requisito parcial para obtenção do grau de Mestre em Ciências da Saúde pelo Programa de Pós Graduação em Ciências da Saúde da Universidade de Brasília:. __________________________________________________________________________. Prof.a Dr.a Laila Salmen Espíndola – Universidade de Brasília Presidente __________________________________________________________________________. Dr. Thales Lima Rocha – Cenargen / Embrapa Examinador __________________________________________________________________________. Prof. Dr. José Realino de Paula – Universidade Federal de Goiás Examinador __________________________________________________________________________. Prof.a Dr.a Maria Fátima Grossi de Sá – Cenargen / Embrapa Examinador. Brasília, 4 de julho de 2008..
(4) 4. Este trabalho reflete a realização de um sonho triplo. Por isso, é dedicado às duas pessoas que sempre o compartilharam comigo: meus pais, Sebastiana e Osmar..
(5) 5. AGRADECIMENTOS. Agradeço muito a Deus, pela oportunidade e eterna companhia. Aos meus pais, Sebastiana e Osmar, irmãos Lusi, Neide, João e Denise e à tia Neusa, por todo amor, por quem sou, pela confiança e apoio. A todos os amigos, pela paciência, carinho, incentivo e, principalmente, pela amizade. Aos amigos e companheiros de pós graduação Arnúbio, Jorge, Ellen e Everton, pelo constante apoio e ajuda, tão essenciais na realização deste trabalho. E aos demais colegas que também me incentivaram e contribuíram com os trabalhos. A todos os professores envolvidos, especialmente às professoras Laila e Fátima e aos Professores José Elias, Edilberto, Carlos Bloch, Thales e José Realino, pela acolhida, orientação, colaboração e confiança. Ao Laboratório de Interação Molecular Planta-Praga / Cenargen / Embrapa, que sempre disponibilizou todas as suas estruturas, recursos, pessoal e conhecimento para a realização deste estudo. À CAPES, pela bolsa de pesquisa concedida e ao Programa de Pós Graduação em Ciências da Saúde..
(6) 6. RESUMO. As α-amilases, enzimas produzidas por animais, vegetais e microrganismos, participam de etapas extremamente importantes no metabolismo de carboidratos. A sobrevivência dos seres vivos que dependem do aproveitamento de carboidratos como fonte energética está associada à atividade das amilases. A atividade dessas enzimas também está envolvida com a progressão da cárie e da placa dentária, com a formação do pico de concentração posprandial de glicose e com a velocidade do esvaziamento gástrico. Por isso, pesquisas no sentido de se conseguir uma inibição efetiva de α-amilases têm ganhado expressão internacional, já que inibidores de αamilases podem ser aplicados, dentre outras áreas: (i) no desenvolvimento da resistência de culturas agrícolas a pragas que utilizam amilases endógenas para se alimentar de grãos ou raízes alimentícias, provocando depreciação comercial desses produtos; (ii) no tratamento do diabetes mellitus e da obesidade; (iii) na prevenção de cáries dentárias e outros distúrbios odontológicos; (iv) na investigação do papel antinutricional de alimentos que contêm inibidores de amilases; (v) no processamento industrial de alimentos e bebidas que contêm carboidratos, bem como de papéis e tecidos; e (vi) no diagnóstico e tratamento de distúrbios que envolvem condições de hiperamilasemia. O Cerrado, segundo maior bioma brasileiro, suporta uma enorme variedade de espécies, até então pouco estudadas quanto a seus efeitos terapêuticos e no controle de insetos-praga. Então decidiu-se pela realização deste trabalho, que teve como objetivo verificar a atividade inibitória de extratos vegetais do Cerrado sobre alfa-amilases. Cento e noventa extratos de diferentes polaridades foram preparados a partir de 31 espécies oriundas de 13 famílias botânicas. Os extratos a 1 mg/mL foram pré-incubados com α-amilases extraídas de Zabrotes subfasciatus Boheman e de Acanthoscelides obtectus Say, insetos-praga de feijão, utilizando-se amido solúvel como substrato e ácido dinitrossalicílico reativo como reagente cromogênico. Os extratos também foram testados sobre α-amilase salivar humana, na concentração de 125 µg/mL. Os resultados mostram atividade inibitória sobre amilases de extratos etanólicos pertencentes às famílias Monimiaceae, Meliaceae, Sapotaceae, Burseraceae e Sapindaceae, com destaque especial à espécie Matayba guianensis Aublet. O extrato etanólico da casca da raiz de M. guianensis exibiu CI50 de 88,30 µg/mL, 140,09 µg/mL e 42,04 µg/mL sobre as amilases de Z. subfasciatus, A. obtectus e salivar humana, respectivamente. A quantificação de compostos fenólicos e de taninos totais na fração metanólica oriunda do fracionamento do extrato etanólico da casca da raiz de M. guianensis, contendo os compostos maiores que 30 kDa, aponta para a atribuição da atividade inibitória a taninos condensados. E os resultados obtidos mostram a importância de se explorar o Cerrado brasileiro na busca por moléculas ativas biologicamente.. Palavras-chave: Cerrado. Amilase. Zabrotes subfasciatus. Acanthoscelides obtectus. Amilase salivar humana. Taninos..
(7) 7. ABSTRACT. Alpha-amylases, enzymes produced by animals, plants and microorganisms, participate in several important carbohydrate metabolism steps. The survival of the living beings that depend on carbohydrate use as an energy supply source is associated with amylases activity. The activity of these enzymes is also involved with the progression of dental caries and plaques, with the formation of the postprandial peak of glucose concentration and with the speed of gastric emptying. Consequently, researches aiming to obtain an effective α-amylase inhibition have become of extremely important worldwide, once α-amylases inhibitors can be used, among other fields: (i) on the resistance development of agricultural cultures against pests that use endogenous amylases to feed on eatable grains or roots, causing a commercial depreciation on these products; (ii) on diabetes mellitus and obesity treatments; (iii) on the prevention of dental caries and other odontological diseases; (iv) on the investigation of the antinutritional role of foods that contain amylases inhibitors; (v) on the industrial processing of foods and drinks that contain carbohydrates, as well as paper and textiles; and (vi) on diagnostic and treatment of diseases that involve hiperamylasemy. Cerrado, the second biggest Brazilian’s bioma, supports a variety of species, few studied regarding your therapeutic effects and against agricultural pests. Thus, was decided about the realization of this research work, which has the objective of verify the inhibitory activity of the Cerrado plants extracts against alphaamylases. One hundred and ninety extracts of different polarities were made from 31 species from 13 botanical families. The extracts containing 1 mg/mL were preincubated with α-amylases extracted from Zabrotes subfasciatus Boheman and Acanthoscelides obtectus Say, common bean pest insects, using soluble starch as a substrate and the chromogenic reagent dinitrosalicylic acid. The extracts were also tested against human salivary α-amylase, at concentration of 125 µg/mL. The results showed inhibitory activity on amylases from ethanolic extracts of Monimiaceae, Meliaceae, Sapotaceae, Burseraceae and Sapindaceae, with special attention to Matayba guianensis Aublet. The ethanolic extract of M. guianensis root bark showed IC50 of 88,30 µg/mL, 140,09 µg/mL and 42,04 µg/mL on the Z. subfasciatus, A. obtectus and human salivary amylases, respectively. The quantification of phenolic compounds and total tannins present in the methanolic fraction, originated from the M. guianensis root bark ethanolic extract fractioning, that contained molecules bigger than 30 kDa, points to an inhibitory activity by condensed tannins. The results obtained in this work demonstrate the relevance in explore the Brazilian Cerrado as a source of biologically active molecules.. Key-words: Cerrado. Amylase. Zabrotes subfasciatus. Acanthoscelides obtectus. Human salivary amylase. Tannins..
(8) 8. LISTA DE ILUSTRAÇÕES. FIGURA 1 – Estrutura química da amilose ................................................................18 FIGURA 2 – Estrutura química da amilopectina ........................................................18 FIGURA 3 – Especificidade de algumas enzimas que participam da digestão de carboidratos ..........................................................................................20 FIGURA 4 – Digestão de carboidratos da dieta .........................................................21 FIGURA 5 – Broca do feijão mexicano, Zabrotes subfasciatus .................................22 FIGURA 6 – Estrutura tridimensional da amilase pancreática porcina (APP) ...........23 FIGURA 7 – Estrutura química da acarbose .............................................................28 FIGURA 8 – Área de distribuição do Cerrado no Brasil .............................................38 FIGURA 9 – Vegetação típica do Cerrado .................................................................39 FIGURA 10 – Distribuição da espécie Matayba guianensis ......................................41 FIGURA 11 – Exemplar de M. guianensis .................................................................41 FIGURA 12 – Quatro éteres glicosídicos isolados do extrato hexânico da casca da raiz de M. guianensis .................................................................................................42 FIGURA 13 – Obtenção dos extratos brutos .............................................................44 FIGURA 14 – Ensaio de inibição das amilases .........................................................46 FIGURA 15 – Diversidade de formas, cores e texturas dos extratos vegetais obtidos ............................................................................................................55 FIGURA 16 – Vias utilizadas na tentativa de purificação de inibidores de amilases a partir do extrato etanólico da casca da raiz de M. guianensis ...........70 FIGURA 17 – Primeira cromatografia em coluna aberta de sephadex LH20 ............72 FIGURA 18 – Fracionamento líquido-líquido .............................................................75 QUADRO 1 – Classificação dos compostos fenólicos ...............................................78 FIGURA 19 – Características estruturais de taninos hidrolisáveis ............................80 FIGURA 20 – Características estruturais de taninos condensados ...........................80.
(9) 9. LISTA DE TABELAS. TABELA 1 – Atividade inibitória (AI) dos extratos vegetais sobre α-amilases de Zabrotes subfasciatus (AZS) e Acanthoscelides obtectus (AAO) a 1 mg/mL e sobre α-amilase salivar humana (ASH) a 125 µg/mL ........57 TABELA 2 – Concentração dos extratos vegetais capaz de inibir 50% da atividade total (CI50) das amilases de Zabrotes subfasciatus (AZS), Acanthoscelides obtectus (AAO) e salivar humana (ASH) ..................68 TABELA 3 – Atividade inibitória (AI) sobre as α-amilases de Zabrotes subfasciatus (AZS) das frações obtidas do fracionamento do extrato etanólico da casca da raiz de M. guianensis em coluna cromatográfica aberta de sílica gel G60 ........................................................................................71 TABELA 4 – Atividade inibitória (AI) sobre as α-amilases de Zabrotes subfasciatus (AZS) dos grupos obtidos do primeiro fracionamento do extrato etanólico da casca da raiz de M. guianensis (2g) em coluna cromatográfica aberta de sephadex LH20 ...........................................73 TABELA 5 – Atividade inibitória (AI) sobre as α-amilases de Zabrotes subfasciatus (AZS) dos grupos obtidos do segundo fracionamento consecutivo do extrato etanólico da casca da raiz de M. guianensis (702 mg) em coluna cromatográfica aberta de sephadex LH20 ...........................................74.
(10) 10. LISTA DE SIGLAS α-AI. - inibidor de α-amilases isolado de espécies do gênero Phaseolus. AAI. - inibidor de α-amilases isolado de Amaranthus hypochondriacus. AAO. - α-amilase de Acanthoscelides obtectus. AI. - atividade inibitória. APH. - α-amilase pancreática humana. APP. - α-amilase pancreática porcina. ASH. - α-amilase salivar humana. AZS. - α-amilase de Zabrotes subfasciatus. BASI. - inibidor de α-amilases isolado da cevada. C. - caule (madeira + casca). CC. - casca do caule. CCD. - cromatografia em camada delgada. CNP-G3. - 2-cloro-4-nitrofenil maltotriosídeo. CR. - casca da raiz. DM. - diabetes mellitus. ADNS. - ácido dinitrossalicílico. EC. - classe enzimática. F. - folha. FL. - flor ou capítulo floral. FR. - fruto. FS. - fruto com semente. Gal-G2-CNP - 2-cloro-4-nitrofenil-4-O-β-D-galactopiranosilmaltosídeo G-TH. - glucopiranosilideno-espiro-tioidantoína. CI50. - concentração do extrato vegetal capaz de inibir 50% da atividade da enzima. MC. - madeira do caule. MR. - madeira da raiz. p-NPM. - p-nitrofenil-α-D-manopiranosídeo. PTS-G-T. - acarviosinil-glucopiranosilideno-espiro-tioidantoína. PvCAI. - inibidor de amilase de P. vulgaris com atividade quitinolítica. R. - raiz (madeira + casca). RASI. - inibidor de α-amilases isolado do arroz. RBI. - inibidor bifuncional isolado de Eleusine coracana.
(11) 11. SIα. - inibidores isolados de Sorghum bicolor. WASI. - inibidor de α-amilases isolado do trigo. DMSO. - dimetilsulfóxido. UnB. - Universidade de Brasília. UB. - sigla do Herbário da Universidade de Brasília. U. - unidade de atividade.
(12) 12. LISTA DE ABREVIATURAS. Asp. - asparagina. Da. - Dalton. kDa. - quiloDalton. pH. - potencial hidrogeniônico. Prof. - professor. rpm. - rotações por minuto. LISTA DE SÍMBOLOS. α - alfa β - beta.
(13) 13. SUMÁRIO. 1 INTRODUÇÃO ........................................................................................................13 1.1 ASPECTOS GERAIS ...........................................................................................14 1.2 OBJETIVO GERAL ..............................................................................................15 1.3 OBJETIVOS ESPECÍFICOS ................................................................................15 2 REVISÃO BIBLIOGRÁFICA ..................................................................................16 2.1 AS AMILASES .....................................................................................................17 2.1.1 Definição e função ............................................................................................17 2.1.2 Caracterização molecular .................................................................................22 2.1.3 Importância das amilases como alvo biológico..................................................24 2.2 OS INIBIDORES DE AMILASES .........................................................................24 2.2.1 Inibidores protéicos ...........................................................................................25 2.2.2 Inibidores não protéicos ....................................................................................27 2.3 APLICABILIDADE DOS INIBIDORES DE AMILASES ........................................29 2.3.1 Tratamento do Diabetes mellitus e da obesidade .............................................29 2.3.2 Aplicações agronômicas ...................................................................................31 2.3.3 Outras aplicações .............................................................................................32 2.4 MÉTODOS UTILIZADOS NA VERIFICAÇÃO DA ATIVIDADE DE α-AMILASES ....................................................................................................................................33 2.5 RAZÕES PARA A BUSCA DE NOVOS INIBIDORES DE AMILASES ................36 2.6 O BIOMA CERRADO ...........................................................................................37 2.6.1 Características gerais .......................................................................................37 2.6.2 Matayba guianensis Aublet ...............................................................................40 3 MATERIAL E MÉTODOS .......................................................................................43 3.1 ESTUDO DA ATIVIDADE INIBITÓRIA DE EXTRATOS VEGETAIS SOBRE AMILASES..................................................................................................................44 3.1.1 Obtenção dos extratos brutos ...........................................................................44 3.1.2 Obtenção das enzimas .....................................................................................45 3.1.3 Teste de inibição sobre α-amilases ..................................................................45 3.1.4 Seleção do tampão de atividade ......................................................................48 3.1.5 Concentração do extrato vegetal capaz de inibir 50% da atividade total da AZS, AAO e ASH (CI50).......................................................................................................48 3.2 PRIMEIRA VIA DE PURIFICAÇÃO .....................................................................49.
(14) 14. 3.2.1 Fracionamento em coluna cromatográfica aberta de sílica gel G60 .................49 3.3 SEGUNDA VIA DE PURIFICAÇÃO .....................................................................50 3.3.1 Primeira cromatografia em coluna aberta de sephadex LH20 ..........................50 3.3.2 Segunda cromatografia em coluna aberta de sephadex LH20 .........................50 3.4 TERCEIRA VIA DE PURIFICAÇÃO ....................................................................51 3.4.1 Fracionamento líquido-líquido ..........................................................................51 3.4.2 Exclusão molecular em membrana filtrante ......................................................52 3.4.3 Quantificação de compostos fenólicos totais ....................................................52 3.4.4 Quantificação de taninos totais .........................................................................53 3.4.5 Comprimento de onda de máxima absorbância e termoestabilidade ...............53 4 RESULTADOS E DISCUSSÃO .............................................................................54 4.1 OBTENÇÃO DOS EXTRATOS BRUTOS ............................................................55 4.2 SELEÇÃO DO TAMPÃO DE ATIVIDADE ...........................................................55 4.3 ATIVIDADE INIBITÓRIA DOS EXTRATOS VEGETAIS SOBRE αAMILASES ...56 4.4 CONCENTRAÇÃO DO EXTRATO VEGETAL CAPAZ DE INIBIR 50% DA ATIVIDADE TOTAL DA AZS, AAO E ASH (CI50) ......................................................67 4.5 VIAS DE PURIFICAÇÃO .....................................................................................69 4.5.1 Primeira via de purificação ................................................................................70 4.5.2 Segunda via de purificação ...............................................................................71 4.5.2.1 Primeira cromatografia em coluna aberta de sephadex LH20 .......................71 4.5.2.2 Segunda cromatografia em coluna aberta de sephadex LH20 ......................73 4.5.3 Terceira via de purificação ................................................................................74 4.5.3.1 Fracionamento líquido-líquido ........................................................................74 4.5.3.2 Exclusão molecular em membrana filtrante ...................................................75 4.5.3.3 Caracterização da fração ativa ......................................................................76 a. Comprimento de onda de máxima absorbância e termoestabilidade ....................76 b. Quantificação de compostos fenólicos totais .........................................................78 c. Quantificação de taninos totais ..............................................................................82 5 CONCLUSÃO E PERSPECTIVAS .........................................................................83 5.1 CONCLUSÃO ......................................................................................................84 5.2 PERSPECTIVAS .................................................................................................85 REFERÊNCIAS. .......................................................................................................86.
(15) 13. 1 INTRODUÇÃO.
(16) 14. 1.1 ASPECTOS GERAIS. Os carboidratos constituem a classe de substâncias de maior importância na dieta dos ocidentais. Entretanto, os carboidratos são moléculas complexas e, para que sejam aproveitados como fonte energética pelos seres vivos, precisam ser degradados em moléculas menores capazes de serem absorvidas pelo trato gastrintestinal. Posteriormente, essas moléculas menores penetram nas células e participam de reações catabólicas intracelulares de liberação de energia. Por serem moléculas complexas, os carboidratos dependem de várias enzimas para a sua degradação e posterior absorção. Dentre essas enzimas encontram-se as α-amilases, que clivam as ligações glicosídicas α-1,4 dos carboidratos e que foram selecionadas como objeto deste estudo. Vegetais dependem de α-amilases para a mobilização dos carboidratos, que armazenam especialmente sob a forma de amido. Muitas plantas também as utilizam durante a germinação de sementes. Vários insetos, inclusive os que se alimentam de sementes e outros órgãos vegetais agricultáveis e economicamente importantes, também utilizam α-amilases para degradar carboidratos de suas fontes alimentares e, por causa disso, causam sérios prejuízos à economia agrícola de vários países. Microrganismos e outros animais que também utilizam carboidratos como fonte de energia, como o homem, também dependem de amilases. Em humanos, a amilase é produzida tanto pelas glândulas salivares, sendo denominada amilase salivar humana (ASH), quanto pelo pâncreas exócrino, denominada amilase pancreática humana (APH). Além dessas duas isoformas da enzima contribuírem para o aproveitamento energético de carboidratos, elas também estão relacionadas a alguns distúrbios orais e metabólicos. Como exemplo, sabe-se que a ASH pode estar diretamente envolvida na progressão da cárie e na formação da placa dentária; a APH, principalmente, está relacionada a condições de hiperamilasemia; e a inibição de amilases humanas leva à diminuição no pico de glicemia pós-prandial e ao retardamento do esvaziamento gástrico..
(17) 15. Por isso, tem-se investigado a aplicabilidade de inibidores de amilases para o. tratamento. de. distúrbios. metabólicos. como. diabetes. e. condições. de. hiperamilasemia, bem como no controle da obesidade e no desenvolvimento de espécies agricultáveis resistentes a insetos-praga dependentes de amilases. O Cerrado, com sua enorme diversidade vegetal, possibilitou realizar a prospecção de inibidores das amilases de Zabrotes subfasciatus, Acanthoscelides obtectus e salivar humana.. 1.2 OBJETIVO GERAL. O objetivo geral deste trabalho consiste em buscar nos extratos de plantas do Cerrado inibidores de α-amilases, devido à sua potencial utilização agronômica como bioinseticidas e clínica como adjuvante no tratamento de diabetes mellitus, obesidade e cáries dentárias, dentre outras aplicações.. 1.3 OBJETIVOS ESPECÍFICOS. -. Obter extratos vegetais de plantas do bioma Cerrado para favorecer. seu estudo e contribuir com a conservação do patrimônio genético vegetal brasileiro, por meio da ampliação da coleção de extratos do Laboratório de Farmacognosia / UnB, produzidos a partir de espécies do Cerrado; -. Verificar a capacidade de extratos vegetais em inibir in vitro a atividade. de α-amilases; -. Identificar possíveis extratos de plantas com atividade inibitória. isoforma-específica; -. Realizar o fracionamento químico biomonitorado de extratos ativos,. visando purificar as moléculas responsáveis pela atividade biológica..
(18) 16. 2 REVISÃO BIBLIOGRÁFICA.
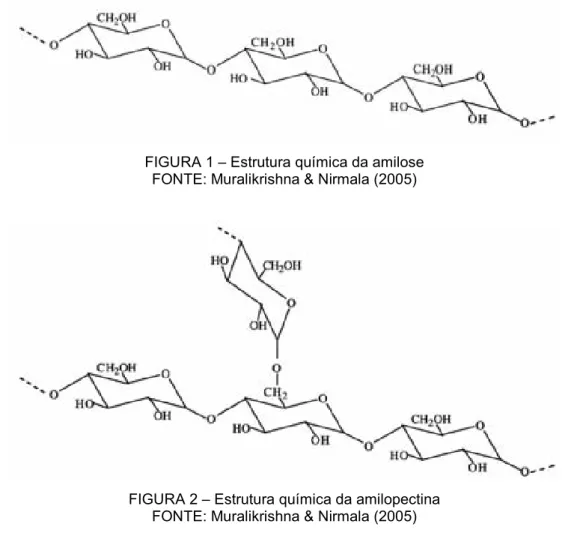
(19) 17. 2.1 AS AMILASES. 2.1.1 Definição e função. Amilases são algumas das enzimas produzidas por animais, microrganismos e plantas que podem participar da degradação de carboidratos de forma a permitirem sua utilização como fonte energética. Os carboidratos, substâncias produzidas durante o processo de fotossíntese realizado por plantas e outros organismos autotróficos, constituem a principal forma de armazenamento da energia do sol (PAYAN, 2004). Entretanto, para que a energia solar armazenada na forma de carboidratos possa ser utilizada pelos seres vivos, os carboidratos precisam ser hidrolisados a monômeros e absorvidos (WHITCOMB & LOWE, 2007; PAYAN, 2004; IULEK et al., 2000). Só assim podem participar dos processos catabólicos intracelulares, fornecendo a energia que armazenam. Dessa forma, justifica-se: (i) a importância primordial das amilases no processo de digestão dos carboidratos, pois é esta enzima que permite a sua utilização como fonte energética por organismos autotróficos e heterotróficos (WANG et al., 2006; SILVA et al., 2001); e (ii) a ampla distribuição destas enzimas na natureza (YOON & ROBYT, 2003), ocorrendo em microrganismos, plantas e animais (STROBL et al., 1998). No ocidente, os carboidratos correspondem a cerca de 40 a 50% das calorias ingeridas (WHITCOMB & LOWE, 2007) e constituem o principal componente da dieta, na forma de amido ou de açúcares simples (PAYAN, 2004). O amido, principal forma de armazenamento de carboidratos nas plantas, inclusive naquelas utilizadas como alimento pelos humanos, é um carboidrato complexo de reserva nutritiva, formado por dois tipos de polímeros de glucose: amilose e amilopectina (WHITCOMB & LOWE, 2007; MURALIKRISHNA & NIRMALA, 2005; SORENSEN et al., 2004). A amilose (Figura 1) é um polímero linear de moléculas de glucose unidas por ligações glucosídicas α-1,4 (WHITCOMB & LOWE, 2007; MURALIKRISHNA & NIRMALA, 2005; RAMASSUBU et al., 2003) e.
(20) 18. corresponde a aproximadamente 20% do amido da dieta (WHITCOMB & LOWE, 2007). A amilopectina (Figura 2), que corresponde a 80% do amido da dieta (WHITCOMB & LOWE, 2007), é um polímero ramificado: possui cadeias principais de glucoses unidas por ligações α-1,4 interligadas por ligações α-1,6 (WHITCOMB & LOWE, 2007; MURALIKRISHNA & NIRMALA, 2005) a cada 20 a 25 resíduos de glucose (WHITCOMB & LOWE, 2007).. FIGURA 1 – Estrutura química da amilose FONTE: Muralikrishna & Nirmala (2005). FIGURA 2 – Estrutura química da amilopectina FONTE: Muralikrishna & Nirmala (2005). Consequentemente,. muitas. enzimas. são. necessárias. para. a. despolimerização completa do amido e para a sua conseqüente absorção e utilização pelos seres vivos como fonte energética (MURALIKRISHNA & NIRMALA, 2005). Basicamente, essas enzimas podem ser divididas em três grupos principais, de acordo com seu mecanismo de ação: endo-amilases, exo-amilases e enzimas de desramificação (MURALIKRISHNA & NIRMALA, 2005). As endo-amilases, também conhecidas como α-amilases (α-1,4-glucan-4glucanoidrolase, enquadradas na classe enzimática EC 3.2.1.1), clivam as ligações.
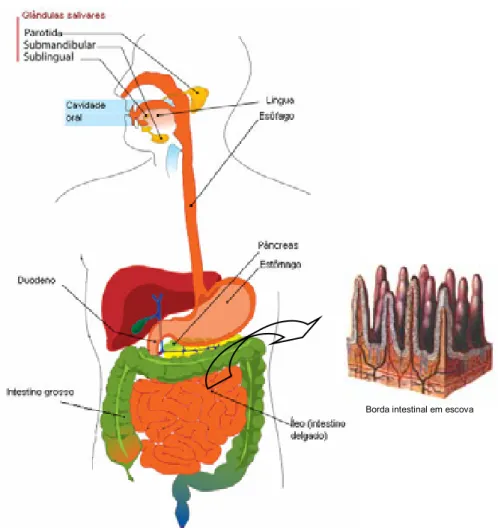
(21) 19. glucosídicas α-1,4 presentes na parte interna da amilose ou da amilopectina (YOON & ROBYT, 2003). As exo-amilases podem clivar as ligações glucosídicas α-1,4 externas da amilose, amilopectina e polissacarídeos relacionados (SORENSEN et al., 2004), removendo gradativamente maltoses ou glucoses. Exemplos dessas enzimas são as β-amilases, encontradas em bactérias, cereais e fungos, e αglucosidases. As enzimas desramificantes clivam as ligações glucosídicas α-1,6 presentes nos pontos de ramificação do amido, que são resistentes ao ataque por α e por β-amilases. Como exemplos destas enzimas, temos as glucoamilases, isoamilases e pululanases (MURALIKRISHNA & NIRMALA, 2005). α-glucosidases também são capazes de clivar ligações α-1,6, desde que possuam ligação α-1,4 adjacente (Figura 3). O grupo das endo ou α-amilases está largamente distribuído em microrganismos, plantas e secreções de animais (MURALIKRISHNA & NIRMALA, 2005; PAYAN, 2004; YOON & ROBYT, 2003) e os produtos resultantes da sua ação sobre o amido são oligossacarídeos de vários comprimentos de cadeia (MURALIKRISHNA & NIRMALA, 2005; HILL & MACGREGOR, 1988) chamados dextrinas, uma mistura de maltose, maltotriose e oligossacarídeos ramificados de 6 a 8 unidades de glucose, que contêm ligações α-1,4 e α-1,6 (WHITCOMB & LOWE, 2007). Em humanos, as α-amilases são produzidas pelas glândulas salivares parótidas (80% da amilase presente na saliva), submandibulares e sublinguais (20% da amilase presente na saliva) (BUSCH et al., 2002) e pelo pâncreas. É a amilase salivar humana (ASH) que inicia a digestão do amido na boca (WHITCOMB & LOWE, 2007; YOON & ROBYT, 2003) (Figura 4), mas a sua efetividade enzimática depende do tempo que o alimento permanece na cavidade oral e da fonte do amido (WHITCOMB & LOWE, 2007). Embora a ASH lançada na cavidade oral seja degradada pelo baixo pH do estômago (YOON & ROBYT, 2003), ela pode ainda ser detectada no duodeno, contribuindo significativamente para a hidrólise de amido em alguns casos (WHITCOMB & LOWE, 2007; GYÉMÁNT et al., 2003). Com a passagem do bolo alimentar para o intestino delgado, onde este é neutralizado, a digestão do amido é continuada pela amilase pancreática humana.
(22) 20. (APH) (YOON & ROBYT, 2003) (Figura 4). Em indivíduos com deficiências de APH, a efetividade da ASH em digerir o amido na boca pode ser maior. Adiante, as enzimas da borda intestinal em escova, como a maltase e a isomaltase, terminam a digestão das dextrinas (WHITCOMB & LOWE, 2007) (Figura 4).. FIGURA 3 – Especificidade de algumas enzimas que participam da digestão de carboidratos. Algumas das várias enzimas que participam deste processo estão apontadas na figura, bem como a região do substrato onde haverá a clivagem decorrente da ação da enzima (setas pretas). FONTE: http://www.sigmaaldrich.com/Area_of_Interest/Biochemicals/Enzyme_Explorer/Key_Resources/Carbo hydrate_Analysis.html (adaptado).
(23) 21. Borda intestinal em escova. FIGURA 4 – Digestão de carboidratos da dieta. Na boca, a amilase salivar humana produzida pelas glândulas salivares inicia a digestão do amido. Com a deglutição, o bolo alimentar passa pelo esôfago e atinge o estômago, onde o baixo pH pode inativar as amilases salivares. Entretanto, em alguns casos, a atividade dessa enzima ainda pode ser detectada no duodeno, onde o bolo alimentar se mistura à amilase pancreática, que continua a digestão do amido. No intestino delgado, enzimas da borda em escova intestinal terminam a degradação dos carboidratos, para que os monossacarídeos possam ser absorvidos pelo intestino. FONTE: http://commons.wikimedia.org/wiki/Image:Digestive_ system_diagram_en.svg e http://www.juntadeandalucia.es/averroes/~29701428/salud/intestino.gif (adaptado). Além dos humanos, alguns insetos também se beneficiam da ação de amilases para consumirem órgãos de plantas ricos em amido, como sementes e raízes, o que os tornam severas pragas agrícolas por causarem a depreciação comercial destes produtos (WANG et al., 2006; TITARENKO & CHRISPEELS, 2000). Como exemplo, a broca do feijão mexicano Zabrotes subfasciatus Boheman (Figura 5), dentre outras pestes de armazenamento, são extremamente dependentes de amido e conseqüentemente de amilases, alimentando-se das sementes de feijão e causando severas perdas econômicas (DAYLER et al., 2005)..
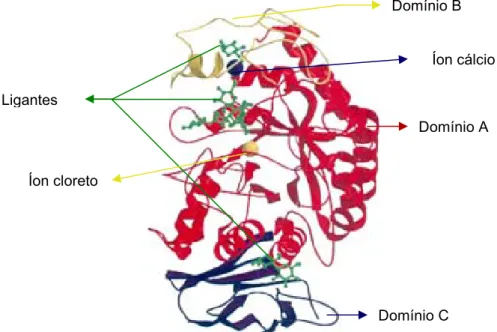
(24) 22. FIGURA 5 – Broca do feijão mexicano, Zabrotes subfasciatus. FONTE: http://www.mard.gov.vn/ PPDHCMC/html/KDTV/imageKDTV/contrungmotdaumexico-truongthanh.gif e http://www.mard.gov.vn/ PPDHCMC/html/KDTV/imageKDTV/contrungmotdaumexico-trieuchung.gif. Outros mamíferos, bactérias e fungos (YOON & ROBYT, 2003) também possuem dieta rica em amido, sendo altamente dependentes desta fonte de energia e, consequentemente, da efetividade de α-amilases para sua sobrevivência (TITARENKO & CHRISPEELS, 2000). Nas plantas, particularmente, as amilases também exercem um papel significante na germinação e na maturação de sementes (MURALIKRISHNA & NIRMALA, 2005).. 2.1.2 Caracterização molecular. A área de conhecimento sobre α-amilases foi bastante beneficiada com a determinação recente de muitas estruturas, inibidores e complexos (PAYAN 2004; GERRARD et al., 2000), do ponto de vista bioquímico e molecular (TITARENKO & CHRISPEELS, 2000; STROBL et al., 1998). Estudos revelam que a APH é uma glicoproteína de 57 kDa e, provavelmente, 512 resíduos de aminoácidos, com três domínios: A, B, e C. O local de ligação ao substrato encontra-se em uma fenda entre os domínios A e B. Resíduos de aminoácidos existentes nos domínios A e B ligam um átomo de cálcio, enquanto um átomo de cloreto se liga ao domínio A perto do sítio ativo. O domínio C dá forma a uma β-estrutura completa e parece ser um domínio independente com função desconhecida. Há ainda sugestões de que os resíduos Asp197 e Asp300 participam da catálise (WHITCOMB & LOWE, 2007)..
(25) 23. A ASH, por sua vez, possui 496 resíduos de aminoácidos, um íon cálcio e um íon cloreto, também constituindo 3 domínios: A, B e C (KANDRA et al., 2005). Existe uma justaposição bastante similar dos resíduos catalíticos presentes no domínio A das isoformas salivar e pancreática da α-amilase (RAMASUBBU et al., 1996), além do fato de que estas isoformas exibem estruturas cristalográficas quase idênticas (WHITCOMB & LOWE, 2007). Entretanto, as seqüências de aminoácidos preditas para elas diferem entre 1% (RAMASUBBU et al., 1996) e 6% (WHITCOMB & LOWE, 2007), o que pode justificar as diferentes ações na modificação de oligossacarídeos (NAGAMINE et al., 1988) e na sua potência: segundo Guyton (1997) por exemplo, a APH é várias vezes mais potente que a ASH. Comparando-se a estrutura físico-química das amilases de mamíferos e de insetos, sabe-se que elas mostram alta similaridade em suas estruturas primárias e terciárias (STROBL et al., 1998), e é provável que possuam um mecanismo de ação similar. Como a arquitetura das amilases de mamíferos e de insetos é bastante parecida (PAYAN, 2004), uma ilustração da estrutura tridimensional das amilases está representada pela amilase pancreática porcina (APP) na Figura 6. Domínio B. Íon cálcio Ligantes Domínio A. Íon cloreto. Domínio C FIGURA 6 – Estrutura tridimensional da amilase pancreática porcina (APP). O domínio A está mostrado em vermelho, o domínio B em amarelo e o domínio C em roxo. O íon cálcio (esfera azul) e o íon cloreto (esfera amarela) também estão mostrados no centro catalítico. Ligantes da enzima estão representados em verde (representação de traços-e-bolas) na superfície do sítio ativo e na sua fenda. FONTE: Payan (2004).
(26) 24. 2.1.3 Importância das amilases como alvo biológico. Para humanos, o processo de digestão e absorção rápida de carboidratos, do qual participam as amilases, tem benefícios em alguns aspectos da nutrição esportiva. Mas geralmente isso não é considerado desejável devido à sua relação com a progressão da cárie dentária (KANDRA et al., 2005) e com respostas glicêmicas elevadas, especialmente para indivíduos com diabetes (ENGLYST & ENGLYST, 2005). Como o amido também constitui a dieta de insetos pragas de culturas extensivas, é com base na atividade das amilases que esses animais se desenvolvem e causam a depreciação comercial de sementes cultivadas (PAYAN, 2004; SORENSEN et al., 2004). Por isso, a efetividade das amilases nestes animais também não é desejável.. 2.2 OS INIBIDORES DE AMILASES. Diversas plantas produzem inibidores de amilases, especialmente em sementes e tubérculos (SIVAKUMAR et al., 2006; WANG et al., 2006), e o número desses inibidores isolados e identificados é extremamente grande (PAYAN, 2004). Existem diversas especulações a respeito do motivo da síntese desses inibidores pelo vegetal, dentre elas (i) a hipótese destes inibidores participarem em processos de desenvolvimento da planta, incluindo a programação da morte celular (SOLOMON et al., 1999); (ii) de controlarem a atividade de amilases durante a germinação prematura de sementes, por prevenir a mobilização do amido armazenado (NIELSEN et al., 2004); (iii) de exercerem papel importantíssimo na defesa das plantas que os produzem contra patógenos (SIVAKUMAR et al., 2006; SOLOMON et al., 1999). Entretanto, apesar da forte presença de inibidores de amilases em plantas superiores, eles também ocorrem em microrganismos e em animais. Esses inibidores endógenos podem ser divididos em dois grandes grupos, a saber:.
(27) 25. inibidores protéicos (proteínas e peptídeos) e inibidores não protéicos (representados principalmente pelos agentes complexantes, compostos fenólicos e açúcares) (SORENSEN et al., 2004).. 2.2.1 – Inibidores protéicos. Inibidores proteináceos de α-glicosidases são descritos desde 1930. Décadas depois, essas proteínas foram purificadas e sua estrutura e função caracterizadas (SORENSEN et al., 2004). Hoje, acredita-se que os inibidores proteináceos oriundos de plantas superiores possam ser agrupados pela similaridade em sua seqüência primária e por sua estrutura terciária em seis classes de inibidores, tipo: lectina, knotina, cereal, kunitz, g-purotionina e taumatina (PAYAN, 2004; SVENSSON et al., 2004). A superfamília dos inibidores tipo lectina é tipicamente representada pelos inibidores de feijões comuns, Phaseolus vulgaris L. (PAYAN, 2004). Segundo Gibbs & Alli (1998), P. vulgaris teve sua atividade inibitória sobre α-amilases descrita pela primeira vez em 1945 por Bowman e foi posteriormente confirmada por diversos investigadores. Hoje, sabe-se tratar de quatro isoformas de inibidores de amilases no gênero Phaseolus, α-AI-1, α-AI-2, α-AI-3 e tipo nulo (SILVA et al., 2001), além de um inibidor chamado “inibidor de amilase de P. vulgaris com atividade quitinolítica” (PvCAI) (DAYLER et al., 2005). Esses inibidores exibem diferenças tanto na sua seqüência primária de resíduos de aminoácidos quanto na sua atividade inibitória sobre as enzimas de mamíferos e de insetos broquídeos (DAYLER et al., 2005; PAYAN, 2004). O inibidor α-AI-1, a forma mais comumente encontrada, está envolvido na antibiose contra brocas do Velho Mundo (SILVA et al., 2001; ISHIMOTO & CHRISPEELS, 1996), mas não inibe in vitro as amilases de uma preparação bruta de intestinos das larvas de Z. subfasciatus nem de Acanthoscelides obtectus, da mesma região geográfica, e que atacam estas espécies. Entretanto, α-AI-2, uma forma do inibidor derivada do feijão selvagem, é capaz de inibir a atividade de amilase de extratos brutos do intestino de Z. subfasciatus e causa antibiose contra esta espécie (SILVA et al., 2001). Também.
(28) 26. é descrita atividade de inibidores de feijões comuns sobre amilases de mamíferos (SVENSSON et al., 2004). Esta atividade inibitória sobre α-amilases encontrada em P. vulgaris rendeu a esta espécie uma atenção considerável devido à sua elevada potência inibitória comparada com os inibidores de outras espécies e ao fato de conter tipos distintos de inibidores (GIBBS & ALLI, 1998). Os inibidores protéicos de α-amilases da superfamília dos cereais podem ser representados pelo inibidor bifuncional de α-amilase e de tripsina RBI, isolado de Eleusine coracana Gaertneri (SIVAKUMAR et al., 2006; PAYAN, 2004; STROBL et al., 1998) e pelos inibidores de 12, 24 ou 60 kDa isolados do trigo (Triticum aestivum L.) (PAYAN, 2004). A superfamília de inibidores protéicos do tipo Knotina é bem representada pelo inibidor AAI isolado do amarante (Amaranthus hypochondriacus L.), também conhecido como pau-roxo. Com 32 resíduos aminoácidos, AAI é o menor inibidor de α-amilase já descrito e inibe as α-amilases de insetos, mas não as de mamíferos (PAYAN, 2004; SVENSSON et al., 2004). A. superfamília. tionina. é. representada pelos inibidores. do. sorgo. (Sorghum bicolor L.) (SIα1, SIα2, SIα3), ativos sobre amilases de insetos, enquanto a superfamília Kunitz tem como representantes os inibidores da cevada (BASI), do trigo (WASI) e do arroz (RASI) ativos sobre amilases de insetos e de cereais. A família taumatina tem como representante o inibidor do milho zeamatina, ativo sobre insetos (SVENSSON et al., 2004). Além dos exemplos apontados acima, a presença de inibidores proteináceos de α-amilases também é abundante em outras plantas leguminosas e em cereais (SIVAKUMAR et al., 2006; PAYAN, 2004), sendo descrita também para Phaseolus coccineus L. (VALENCIA-GIMÉNEZ et al., 2007), centeio (GIBBS & ALLI, 1998), amendoim (GIBBS & ALLI, 1998), bulbo de Colocasia esculenta (L.) Schott (REKHA et al., 2004; GIBBS & ALLI, 1988), batata doce (REKHA et al., 2004) e Cajanus cajan (L.) Millsp. (GIRI & KACHOLE, 1998), dentre outras espécies. Entretanto, segundo Sorensen e colaboradores (2004), a maioria dos compostos isolados mostra-se ativo sobre amilases de origem animal ou vegetal, sendo que poucos trabalhos descrevem efeitos em α-amilases de origem microbiana..
(29) 27. Além dos inibidores protéicos de plantas, também há relatos na literatura da obtenção de substâncias proteináceas inibitórias da enzima a partir do sobrenadante de culturas de bactérias do gênero Sreptomyces (SVENSSON et al., 2004; SUMITANI et al., 2000): tendamistat, haim e paim, que inibem α-amilases de animais, de algumas outras espécies do gênero Streptomyces e Bacillus. (SVENSSON et al., 2004; SUMITANI et al., 2000). Alguns análogos sintéticos mais curtos do tendamistat também mostraram inibição sobre amilases de mamíferos (HEYL et al., 2005).. 2.2.2 Inibidores não-protéicos. Dentre os inibidores não protéicos de α-amilases destacam-se os inibidores carboidratos.. Essas. substâncias. correspondem. a. compostos. pseudo-. oligossacarídicos que contêm uma entidade estrutural específica chamada acarviosina (unidade ciclitol insaturada ligada a uma 4,6-dideoxi-4-amino-D-glucose) ligada por uma ligação α-(1,4)-O-glucosídica a um número variável de resíduos de glicose. Um composto desta classe em particular, o pseudotetrassacarídeo acarbose (Figura 7), no qual a unidade acarviosina está ligada a uma molécula de maltose (PAYAN, 2004; YOON & ROBYT, 2003), é um potente inibidor de α-amilases usado para tratar diabetes (PAYAN, 2004; GYÉMÁNT et al., 2003; GERRARD et al., 2000). Muitos de seus derivados análogos exibem atividade inibitória superior à da acarbose sobre amilases de diversas fontes (YOON & ROBYT, 2003). Contudo, a acarbose, uma molécula pequena, é o inibidor de α-amilase melhor caracterizado (GERRARD et al., 2000). No intestino, a acarbose é degradada por enzimas digestivas e/ou por microrganismos e os seus produtos de degradação causam diarréia e desconforto abdominal. Estes efeitos colaterais que surgem com a utilização terapêutica da acarbose têm despertado o interesse médico no desenvolvimento de novos agentes ou estratégias terapêuticas (KANDRA et al., 2005), como os inibidores alternativos açúcar-miméticos aza, isoxazoles e aminoaçúcares (SEO et al., 2005)..
(30) 28. FIGURA 7 – Estrutura química da acarbose. FONTE: http://commons.wikimedia.org/wiki/Image: acarbose.svg. Um polissacarídeo sintético contendo unidades repetidas de hexapiranose 3-insaturada foi obtido por policondensação de unidades 3,6-di-O-acetil-D-glucal seguida de desacetilação e também mostrou atividade inibitória sobre a ASH (KÉKI et al., 2006). Uma outra classe de inibidores não-protéicos de amilases recentemente descrita (GERRARD et al., 2000; ABELL et al., 1998) é constituída por derivados do ácido ascórbico, cujo grupo farmacofórico essencial para a inibição, de caráter competitivo, é a sua metade eno-diol (GERRARD et al., 2000). A. substância. sintética. glucopiranosilideno-espiro-tioidantoína. (G-TH). também mostrou atividade inibitória sobre a ASH (GYÉMÁNT et al., 2003), bem como seu análogo mais longo acarviosinil-glucopiranosilideno-espiro-tioidantoína (PTS-G-T) (KANDRA et al., 2005). Por sua vez, aminochalconas e chalconas-sulfonamidas sintéticas (cujo grupo chalcona é precursor de flavonóides e isoflavonóides) mostraram efeito inibitório sobre amilases de Bacillus licheniformis (SEO et al., 2005). Também há relatos na literatura de extratos brutos vegetais e de metabólitos secundários isolados de diversas plantas que possuem propriedades inibitórias sobre as α-amilases: (a) cinco 3-metoxiflavonas isoladas do extrato etanólico das partes aéreas de Varthemia iphionoides Boss foram ativas sobre a APP (AL- DABBAS et al., 2006);.
(31) 29. (b) taninos com núcleo de ácido quínico mostraram atividade inibitória sobre α-amilases, com destaque para um galotanino isolado da noz do carvalho, que mostrou atividade in vitro sobre a ASH (ZAJÁCZ et al., 2007); (c) o óleo essencial da madeira de Cedrus libani A. Rich mostrou atividade in vitro sobre α-amilase (CI50 = 0,14 mg/mL), sugerindo que o composto imacalol seja o responsável por esta atividade (LOIZZO et al., 2007) (d) os extratos brutos acetônicos das plantas marinhas brasileiras Spatoglossum. schroederi. (C.. Agardh). Katzing. (CI50. =. 0,58. mg/mL). e. Caulerpa racemosa (Forsskäl) J. Agardh (CI50 = 0,09 mg/mL) também inibiram a αamilase (TEIXEIRA et al., 2007), dentre outros vários exemplos de inibidores de amilases descritos na literatura.. 2.3 APLICABILIDADE DOS INIBIDORES DE AMILASES. Devido à ampla distribuição das amilases nos seres vivos e ao importante papel fisiológico que exercem nestes organismos, os inibidores destas enzimas são especulados para aplicações clínicas, agropecuárias e biotecnológicas.. 2.3.1. Tratamento do Diabetes mellitus e da obesidade. O Diabetes mellitus (DM) é uma desordem do metabolismo de carboidratos caracterizada por hiperglicemia. É uma doença clinicamente complexa: sua natureza crônica envolve uma diminuição substancial na qualidade e na expectativa de vida, visto que a doença está associada com muitas complicações sérias incluindo falência renal, cegueira e doença cardiovascular (AYDIN, 2007). A prevalência de diabetes aumenta com a idade (PASSOS et al., 2005) e tem crescido rapidamente (AYDIN, 2007), sendo previsto um aumento de 35% entre 1995 e 2025 em pessoas de 20 anos ou mais (PASSOS et al., 2005). No ano 2000,.
(32) 30. a estimativa foi de 170 milhões de pacientes acometidos por DM no mundo (AYDIN, 2007). Apesar da atividade da α-amilase não estar diretamente envolvida na etiologia do DM, estudos recentes tentaram avaliar a fisiopatologia desta doença investigando a composição da saliva em pacientes diabéticos e em animais experimentais. Não houve conclusão consensual, havendo relatos de concentrações de ASH em pacientes diabéticos mais elevadas, menores ou as mesmas (AYDIN, 2007) que nos grupos controle. Apesar da discordância literária quanto à razão entre a quantidade de ASH em indivíduos diabéticos e saudáveis, um outro ponto de relação entre o DM e as amilases tem sido discutido. Esse ponto refere-se à utilização de inibidores específicos de enzimas digestivas como alternativa para o tratamento desta doença, por interromperem rapidamente a absorção de nutrientes (MURAI et al., 2002). Como exemplo disso, vários trabalhos podem ser citados. Estudos mostram que os inibidores de amilases retardam a digestão e a absorção geral de amido (LAYER et al., 1986a), além de aumentarem a tolerância à glicose em pacientes diabéticos (LOIZZO et al., 2007), reduzirem os picos de glucose pós-prandiais, induzindo à tolerância a carboidratos, e aumentarem a sensação de saciedade, prolongando o tempo de esvaziamento gástrico (SEO et al., 2005; PAYAN, 2004; MURAI et al., 2002; GERRARD et al., 2000; LAYER et al., 1986a; 1986b). Para pacientes com DM não dependente de insulina (DM tipo II) um inibidor da amilase poderia retardar a absorção de carboidratos, de forma que esta coincida com a secreção retardada da insulina endógena. Assim, preveniria níveis posprandiais de glicose excessivos (LAYER et al., 1986b). Em pacientes com DM dependente de insulina (DM tipo I), o retardo posprandial da digestão e da absorção de carboidratos poderia reduzir a quantidade de insulina exógena, hoje único tratamento efetivo disponível, necessário para controlar o pico de hiperglicemia posprandial (LAYER et al., 1986b). Inibidores de amilases também poderiam ser utilizados no tratamento da obesidade (GERRARD et al., 2000). Essas substâncias diminuem os níveis posprandiais de insulina e aumentam a sensação de saciedade, por meio do retardamento do esvaziamento gástrico, além de reduzirem importantes fatores adipogênicos (LAYER et al., 1986a)..
(33) 31. Os trabalhos citados, dentre outros descritos na literatura, mostram o potencial clínico da utilização de inibidores de amilases em pacientes com diabetes ou obesos. Assim, com o objetivo de se obter um melhor controle destes distúrbios, esforços extensivos são feitos desde a década passada para encontrar um inibidor de amilase clinicamente efetivo (LOIZZO et al., 2007).. 2.3.2 Aplicações agronômicas. O amido constitui a dieta de insetos-praga de culturas extensivas, fato que os tornam altamente dependentes de amilases para sua sobrevivência (SIVAKUMAR et al., 2006). Os inibidores de alfa-amilase tornaram-se, portanto, agentes promissores no controle destes insetos (SIVAKUMAR et al., 2006; WANG et al., 2006;) e de micróbios-praga fitófagos (WANG et al., 2006). Esses inibidores poderiam ser utilizados na biotecnologia moderna de plantas, com o desenvolvimento de transgênicos geneticamente resistentes a brocas, capazes de expressar heterologamente inibidores específicos para enzimas de patógenos. Isso protegeria as culturas contra insetos predadores (SIVAKUMAR et al., 2006; WANG et al., 2006; TITARENKO & CHRISPEELS, 2000). Apesar de diferentes formas de α-amilases serem encontradas em uma única espécie de inseto para garantir a eficiência de seu processo digestivo (SIVAKUMAR et al., 2006), alguns testes in vitro e in vivo confirmam o potencial crescente de inibidores de amilases para estes fins. O gene que codifica o inibidor α-AI-1 de P. vulgaris foi transferido a outros dois legumes, Pisum sativum L. (ervilha comum) e Vigna angularis (Willd.)Ohwi & H.Ohashi (feijão azuki). As sementes das plantas transgênicas mostraram resistência completa às brocas Bruchus pisorum (broca da ervilha) (KLUH et al., 2005; SILVA et al., 2001; TITARENKO & CHRISPEELS, 2000), Callosobruchus chinensis e Callosobruchus maculatus (brocas do feijão azuki) (KLUH et al., 2005; SILVA et al., 2001; TITARENKO & CHRISPEELS, 2000). In vitro, os inibidores isolados das sementes transformadas de feijão azuki mostraram atividade sobre as amilases de C. chinensis, Z. subfasciatus, Tenebrio molitor e Tribolium confusum (YAMADA et al., 2005)..
(34) 32. Metabólitos sencundários vegetais com atividade inibitória sobre α-amilases também poderiam ser utilizados para modificar geneticamente os organismos, mediante a utilização da engenharia de metabolismo. A partir da identificação dos genes e das rotas metabólicas envolvidas com a produção desses compostos, elas poderiam ser manipuladas visando aumentar a produção do metabólito de interesse ou a expressão heteróloga desses compostos em organismos geneticamente modificados (AHARONI et al., 2005). Além da aplicação dos inibidores em transgenia e em engenharia metabólica, eles ainda poderiam ser utilizados para controlar a atividade de αamilases vegetais endógenas presentes na farinha de grãos pré-colhidos, ajudando a assegurar sua boa qualidade (SORENSEN et al., 2004).. 2.3.3 Outras aplicações. A ASH tem ao menos mais duas funções biológicas distintas na cavidade oral. Primeiramente, diversas linhas de evidência indicam que a ASH se liga ao esmalte dentário ou à hidroxiapatita, podendo exercer papel na formação da placa dentária. Em segundo lugar, a ASH em solução se liga com alta afinidade a Estreptococcus que colonizam a cavidade oral. A amilase ligada à bactéria conserva a sua atividade e é capaz de hidrolisar o amido, formando produtos que podem ser usados como fonte de alimento pela bactéria e metabolisados em ácido lático. A produção ácida localizada pode conduzir à dissolução do esmalte do dente, uma etapa crítica na progressão da cárie dentária (ZAJÁCZ et al., 2007; KANDRA et al., 2005; KANDRA et al., 2004). Desta forma, inibidores das amilases também têm aplicabilidade como potenciais ferramentas no controle de cáries (KANDRA et al., 2004; GYÉMÁNT et al., 2003; RAMASUBBU et al., 2003). Ainda, devido à relação das amilases com o diagnóstico de doenças do pâncreas (como pancreatites e outros tipos de hiperamilasemia) e de doenças das glândulas salivares, esta enzima ou mesmo seus inibidores também são de interesse nesta área. Eles poderiam ser utilizados no diagnóstico destes distúrbios (KANDRA et al., 2004; YOON & ROBYT, 2003; TURCOTTE et al., 1994) e na investigação dos.
(35) 33. mecanismos fisiopatológicos e das conseqüências que ocorrem durante a máabsorção de carboidratos (LAYER, 1986b). Outra aplicação para os inibidores de amilase seria no auxílio aos testes de resistência ao amido nos animais e em humanos (YOON & ROBYT, 2003). Outro alvo é a aplicação de inibidores de amilases como agentes antivirais, pela sua interferência na formação de glicoproteínas essenciais requeridas para a sobrevivência, replicação ou infectividade do conjunto viral. Desta forma, os inibidores de amilases seriam úteis no tratamento de doenças virais e de cânceres relacionados à expressão de glicoproteínas (SEO et al., 2005). As amilases e seus inibidores exercem um papel importante nos aspectos nutricionais e toxicológicos de alimentos (IULEK et al., 2000). A expressão gênica destas enzimas está relacionada com a germinação de sementes (NIELSEN et al., 2004) e a presença de inibidores de amilases neste órgão está relacionada ao controle de sua germinação. Sementes comumente utilizadas na alimentação humana, como o feijão (GIBBS & ALLI, 1998) e o trigo (PAYAN, 2004), possuem inibidores de amilases, que podem exercer um papel antinutricional ou até mesmo tóxico quando ingeridos. Além da importância fisiológica in vivo, as amilases e seus inibidores também têm usos industriais importantes, como, por exemplo, no processamento de alimentos e bebidas, na produção industrial de maltodextrinas, na modificação do amido em papéis, tecidos e outros produtos comerciais (SORENSEN et al., 2004; YOON & ROBYT, 2003).. 2.4 MÉTODOS UTILIZADOS NA VERIFICAÇÃO DA ATIVIDADE DE α-AMILASES. Diferentes métodos eletroforéticos têm sido testados para a visualização, isolamento e caracterização de inibidores de enzimas. Muitos deles incluem imunofixação após eletroforese, o que requer anticorpos específicos que, em alguns casos, levam a falsos resultados devido a reação cruzada com outras moléculas relacionadas (VALENCIA-JIMÉNEZ et al., 2007)..
(36) 34. Além da imunofixação, técnicas zimográficas também são utilizadas. Esses métodos consistem na separação de inibidores proteináceos em um gel nativo de poliacrilamida 1% contendo o substrato da enzima (amido, por exemplo) copolimerizado no gel. Após a eletroforese, o gel é enxaguado e incubado com a solução da amilase alvo para permitir que o substrato seja digerido pela enzima. O substrato permanece não-digerido pela enzima nas áreas do gel onde as moléculas inibidoras estão situadas. Essas áreas podem ser reveladas usando uma solução de iodeto de potássio / iodo, que produz bandas azuis escuras quando em contato com o amido não digerido (VALENCIA-GIMENEZ et al., 2007; GIRI & KACHOLE, 1998). Zimografia reversa também pode ser utilizada. Neste método, após a corrida dos inibidores, o gel é incubado com uma solução de amido, enxaguado, mantido em contato com a solução da enzima alvo e posteriormente incubado em solução de iodeto de potássio / iodo. A utilização de gradiente de pH no gel de corrida permite uma melhor resolução e separação dos inibidores de amilases, favorecendo a detecção de inibidores com pequenas diferenças em seus pontos isoelétricos (VALENCIA-JIMÉNEZ et al., 2007; SIVAKUMAR et al., 2006; TITARENKO & CHRISPEELS, 2000). Além da eletroforese para a identificação e caracterização de inibidores, vários métodos quantitativos também são usados. A maioria deles envolve a quantificação de novos grupos reduzidos formados a partir da hidrólise do amido (MURALIKRISHNA & NIRMALA, 2005). Nesses métodos quantitativos, o potencial inibidor pode ou não ser préincubado com a amilase por determinado período. Posteriormente, a amilase é colocada em contato com um substrato por determinado tempo. Após este tempo de incubação com o substrato, adiciona-se um reagente cromogênico e o doseamento dos grupos reduzidos liberados pode ser realizado pela leitura direta da absorbância da solução em comprimento de onda específico. Como substrato de α-amilases em ensaios de detecção da atividade dessas enzimas podem-se utilizar substâncias de cadeia longa como o amido (LOIZZO et al., 2007; AL-DABBAS et al., 2006; SIVAKUMAR et al., 2006; DAYLER et al., 2005; KLUH et al., 2005; YAMADA et al., 2005; REKHA et al., 2004; GIBBS & ALLI, 1998) ou a amilose (ZAJÁCZ et al., 2007; YOON & ROBYT, 2003). Após a reação de hidrólise do substrato, utiliza-se um reagente cromogênico para a quantificação dos.
(37) 35. grupos reduzidos liberados, como o cobre alcalino, ferrocianato alcalino ou o 3,5dinitrossalicilato alcalino (MURALIKRISHNA & NIRMALA, 2005), também conhecido como solução de ácido dinitrossalicílico reativo (ADNS). O cobre e o ferrocianato fornecem valores de equimolares de redução equivalentes aos valores de equimolares de redução fornecidos pelas extremidades reduzidas de maltooligossacarídeos (MURALIKRISHNA & NIRMALA, 2005). No entanto, o ADNS é mais comumente usado como reagente de cor (LOIZZO et al., 2007; SIVAKUMAR et al., 2006; DAYLER et al., 2005; YAMADA et al., 2005; GIBBS & ALLI, 1998;) devido à sua confiabilidade e simplicidade (MURALIKRISHNA & NIRMALA, 2005). Outro reagente cromogênico utilizado em métodos semi-quantitativos é a solução de iodeto / iodo (KI/I2) (AL-DABBAS et al., 2006; REKHA et al., 2004). Este método visa medir a diminuição da cor azul produzida quando o amido se complexa com o iodeto (MURALIKRISHNA & NIRMALA, 2005). Substratos cromogênicos de cadeia curta como o CNP-G3 (AL-DABBAS et al., 2006), o GalG2-CNP (ZAJÁCZ et al., 2007; KANDRA et al., 2005; KANDRA et al., 2004; GYÉMÁNT et al., 2003) e o p-NPM (HEYL et al., 2005), que são derivados pnitrofenil de oligossacarídeos, foram desenvolvidos e também podem ser utilizados para a determinação da atividade de amilases. Apesar desses substratos serem bastante específicos e precisos, eles não são muito usados como análises de rotina devido ao seu alto custo. Nesses métodos, o reagente de cor é covalentemente ligado ao amido ou a oligossacarídeos para fornecer um composto insolúvel. Quando a amilase age sobre estes substratos, fragmentos contendo o reagente de cor são solubilizados e o substrato insolúvel remanescente é removido por centrifugação. Então, a absorbância do sobrenadante é tomada como a medida da atividade da amilase (MURALIKRISHNA & NIRMALA, 2005). Estudos mostram que a utilização de substratos oligossacarídicos diferentes leva a resultados de atividade inibitória diferentes, sendo que quando se utiliza substratos de cadeia curta como o CNP-G3 ou GalG2-CNP a atividade inibitória pode ser maior que quando se utiliza substratos de cadeia longa, como o amido (ZAJÁCZ et al., 2007; Al-DABBAS et al., 2006)..
(38) 36. 2.5 RAZÕES PARA A BUSCA DE NOVOS INIBIDORES DE AMILASES. Clinicamente, diversas substâncias são capazes de reduzir os níveis posprandiais de glicose. Contudo, várias delas exibem características que inviabilizam sua real utilização clínica. Os inibidores da α-glucosidase intestinal por exemplo, como a acarbose, o miglitol e a voglibose (MURAI et al., 2002), diminuem efetivamente e de forma dosedependente a absorção dos carboidratos da dieta (LAYER et al., 1986a), com redução nos níveis posprandiais de glicose e na resposta insulinêmica, tendo também efeito benéfico na resistência à insulina. Entretanto, a forte ação inibitória provoca acúmulo excessivo de polímeros de carboidratos de cadeia curta, como os dissacarídeos, e da própria acarbose no intestino distal (WOLEVER et al., 1995), resultando na alteração dos fluidos osmóticos e em desordens intestinais que podem reduzir o tempo de contato entre a mucosa e os nutrientes existentes no intestino. Diarréias e outros efeitos colaterais, como flatulência e cólica abdominal estão associados ao uso destes inibidores (MURAI et al., 2002), além do desenvolvimento de tumores renais, danos hepáticos graves e hepatite aguda (CHARPENTIER et al., 2000). Diferentemente de inibidores de dissacaridases, os inibidores da α-amilase não provocam o acúmulo de dissacarídeos, já que a microbiota colônica é capaz de metabolizar grandes quantidades de amido não absorvidos presentes no lúmen intestinal sem produzir diarréia. Desta forma, a má-absorção de amido induzida por inibidor da α-amilase não aumenta a carga osmótica, não causando os efeitos adversos associados a este fato (LAYER et al., 1986a). Apesar de haver muitos inibidores protéicos de amilases descritos e bem caracterizados, sua potencial aplicação farmacológica como auxiliar no tratamento de diabetes, obesidade, cáries dentárias ou outros distúrbios pode ser questionada. A dúvida é se as proteases, abundantemente presentes no trato gastrintestinal humano, poderiam clivar as ligações peptídicas destes compostos protéicos inibidores de amilases, levando à perda de sua atividade antes que sua ação terapêutica ocorresse, como acontece em insetos (SILVA et al., 2001; GIRI & KACHOLE, 1998; ISHIMOTO & CHRISPEELS, 1996)..
(39) 37. Quanto à efetividade do uso de inibidores protéicos na agronomia, a literatura relata a possibilidade de desenvolvimento de resistência por alguns insetos a inibidores protéicos de amilases. Eles podem se adaptar à ingestão de proteínas tóxicas expressas em plantas pela sua detoxificação por proteólise (SILVA et al., 2001; GIRI & KACHOLE, 1998; ISHIMOTO & CHRISPEELS, 1996;). Podem ainda promover um aumento da quantidade de enzimas secretadas para compensar a presença de um inibidor, ou induzir enzimas que são insensíveis às proteínas inibidoras (SILVA et al., 2001). Por isso, há poucos relatos de controle bem sucedido de insetos usando plantas transgênicas sob condições de campo (SILVA et al., 2001). Então, considerando-se a efetividade duvidosa de inibidores protéicos disponíveis e o potencial dos metabólitos secundários de plantas ativos sobre diversos modelos biológicos, bem como a perspectiva da utilização de inibidores de amilases nas várias áreas de aplicação, decidiu-se pela prospecção de inibidores de amilases a partir de extratos de plantas do bioma Cerrado. Outro fato que corrobora para a busca de inibidores em plantas é que todos os vegetais possuem um determinado grau de resistência aos insetos (TITARENKO & CHRISPEELS, 2000). Segundo Payan (2004), essa resistência pode ser devido à produção de substâncias que impedem a ação das enzimas intestinais dessas pragas. Essas substâncias poderiam constituir metabólitos secundários da planta, já que as substâncias químicas resultantes do metabolismo secundário das plantas com atividade inibitória sobre enzimas são importantes em muitos de seus papéis de defesa (REKHA et al., 2004).. 2.6 O BIOMA CERRADO. 2.6.1 Características gerais. O Cerrado é o segundo maior bioma brasileiro (KLINK & MACHADO, 2005). Estima-se que a área nuclear do Cerrado tenha aproximadamente 1,5 milhão de km2.
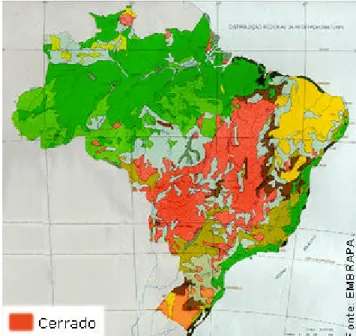
(40) 38. (COUTINHO, 2008; PIVELO, 2008). Ele ocorre desde o Amapá e Roraima até o Paraná, e de Pernambuco, Alagoas e Sergipe até o Pará e o Amazonas (Figura 8), concentrando-se na região do Planalto Central (COUTINHO, 2008). O clima típico do Cerrado é quente, semi-úmido e notadamente sazonal, com verão chuvoso e inverno seco (PIVELO, 2008). Os solos são ricos em íons alumínio, ferro e manganês, o que os tornam bastante ácidos, com pH que pode variar de menos de 4 a pouco mais de 5 (COUTINHO, 2008). Sobre esses solos, podem-se distinguir de modo geral dois estratos na vegetação: o lenhoso, constituído por árvores e arbustos, e o herbáceo, formado por ervas e subarbustos (PIVELO, 2008). As raízes das espécies do estrato lenhoso do Cerrado são normalmente pivotantes e podem atingir até 20 m de profundidade, alcançando camadas de solo permanentemente úmidas mesmo no período de seca, o que não torna a água um fator limitante para essa vegetação (COUTINHO, 2008).. FIGURA 8 – Área de distribuição do Cerrado no Brasil. FONTE: http://eco.ib.usp.br/cerrado/aspectos_ area.htm.. Já as espécies do estrato herbáceo normalmente são perenes e nãoumbrófilas. Na época de seca, os seus ramos aéreos secam e morrem, formando toneladas de palha por hectare. Esse “combustível” se inflama facilmente, favorecendo a ocorrência e a propagação de queimadas, naturais (causadas por raios, por exemplo) ou antrópicas (COUTINHO, 2008). Mas grande parte das.
Imagem


Documentos relacionados
Condições insalubres no ambiente de trabalho Superexploração do trabalho feminino e infantil Ausência completa de qualquer assistência
Taking up and unfolding into more detail the four general objectives that guided the analysis -- an interdisciplinary study informed by intersectionality,
Nos restantes casos, a ocorrência de materiais campaniformes é quase sempre esparsa e excepcional; é difícil, na maioria, a atribuição segura de todas as peças a um determinado
— these walls are solidly put together”; and here, through the mere frenzy of bravado, I rapped heavily with a cane which I held in my hand, upon that very portion of
Neste panorama, o principal objetivo desse estudo é entender a importância da competitividade de destinos turísticos pontuando quais políticas tem sido adotadas
ajuizou AÇÃO CAUTELAR contra GLACIR GOMES, também qualificado nos autos, relatando que realizou reunião na sede da Secretaria de Saúde em 30 janeiro de 2014, tendo convidado
Contemplando 6 estágios com índole profissionalizante, assentes num modelo de ensino tutelado, visando a aquisição progressiva de competências e autonomia no que concerne
As reações de alcoólise da hexabromoacetona formaram os respectivos ésteres com álcoois primários pouco impedidos estericamente, sendo que todos os produtos formados foram