CENTRO DE CIÊNCIAS DA SAÚDE
DEPARTAMENTO DE ESTOMATOLOGIA
CENTRO DE ESTUDOS E PESQUISAS EM IMPLANTES DENTÁRIOS
CURSO DE ESPECIALIZAÇÃO EM IMPLANTODONTIA
ISABEL
CRISTINADA COSTA
PLASMA RICO EM PLAQUETAS- PRP
PLASMA RICO EM PLAQUETAS- PRP
Trabalho de conclusão apresentado ao Curso de Especialização em Implantodontia da Universidade Federal de Santa Catarina, como requisito para obtenção do titulo de Especialista em Imp I antodonti a.
Orientador: Prof. Dr. Ricardo de Souza Magini.
PLASMA RICO EM
PLAQUETAS
Este trabalho de conclusão foi julgado adequado para obtenção do titulo de Especialista em lmplantodontia e aprovado em sua forma final pelo Curso de Especialização em Implantodontia da Universidade Federal de Santa Catarina.
Florianópolis, 18 de dezembro de 2003.
Banca Examinadora:
Prof Dr. Ricardo de Souza Magini Orientador
Prof. Dr. Antônio Carlos Cardoso Membro
Prof. Dr. Marco Aurélio Bianchini Membro
Prof Dr. José Nazareno Gil Membro
A Deus, meu criador. A meu pai (in memorian) e minha mãe, sem os quais jamais
1 INTRODUÇÃO 7
2 REVISÃO DE LITERATURA 8
3 DISCUSSÃO 30
3.1
Considerações iniciais 303.2 Técnicas de obtenção do PRP 31
3.3 Composição do PRP 34
3.4 Produtos utilizados como anticoagulantes 35
3.5 Processo de geliflcação do PRP 36
3.6 Aplicação/utilização do PRP 37
3.7 Níveis dos fatores de crescimento no PRP 43
3.8 Influência de sexo e idade no PRP 45
3.9 Tempo para utilização do PRP 45
3.10 Vantagens X riscos 46
CONCLUSÃO 49
conclusão (Especialização em Implantodontia)- Curso de Especiali7ação em Implantodontia, Universidade Federal de Santa Catarina, Florianópolis.
RE SUMO
Este trabalho tem como objetivo revisar a literatura sobre o Plasma Rico em Plaquetas (PRP), abrangendo alguns artigos que datam de 1998 a 2002. HA uma procura constante de técnicas ou materiais que possam melhorar a reconstrução óssea de Areas atróficas com enxertos autógenos, alógenos ou xenógenos e o PRP, produto derivado do sangue autógeno, está tomando seu espaço a cada dia. Trata-se de uma técnica que concentra plaquetas autógenas provenientes do sangue, as quais contém no seu interior fatores de crescimento responsáveis pela aceleração da regeneração óssea e tecidual, minimizando o tempo necessário para a reabilitação oral de nossos pacientes. Abordou-se alguns tópicos que envolvem as técnicas de elaboração do PRP, assim como uma gama de fatores relacionados à sua aplicação e seus efeitos, positivos ou não. A maior parte da literatura demonstra os efeitos positivos do PRP, mas pouco se sabe a respeito de seu verdadeiro efeito, pois a maior parte dos resultados apresentados são provenientes de experiências clinicas isoladas e não de estudos longitudinais, demonstrando a carência que ainda existe de resultados cientificos concretos que confirmem os estudos clínicos. Os parâmetros abordados neste trabalho visam fornecer informações iniciais, que estimulem a utilização do PRP de forma rotineira pelos cirurgiões-dentistas, especialmente os implantologistas orais.
conclusão (Especialização
emImplantodontia)-
Curso deEspecialização
emImplantodontia,
Universidade Federal de Santa Catarina,Florianópolis.
!
Ilt/Se
:diltIneoca i.."JoCe,vI•1
I'd
¡(J 011.0
tro...,—.
ABSTRACT
The purpose of this study was to review the literature on platelet rich plasma (PRP), including papers from
1998
to2002.
There is a continuous search for techniques or materials that can improve the bone reconstruction of atrophic areas, through the use ofautogenous, alogenous
orxenogenous
grafts, as well as PRP, a product derived fromautogenous
blood, which is being used more every day. It is a technique that concentrates bloodautogenous
platelets, which, in their interior, contain growth factors responsible for the acceleration of the bone and tissue regeneration, minimizing the time needed for oral rehabilitation of patients. This study approached some topics that involve techniques of PRP elaboration, as well as a range of factors related to its application and effects, either favorable or not. Most of the literature demonstrates the favorable effects of PRP, but little is known regarding its unfavorable effects, because most of the results presented are from isolated clinical experiments and not from longitudinal studies, demonstrating the lack of objective scientific results that still exists to support clinical studies. The parameters approached in this study try to supply initial information to stimulate the routine use of PRP by dentists,partcularly
oralimplantodontists.
I
INTRODUÇÃO
Um
avanço notável tem ocorridonos
últimos anos na odontologia. Com o ad-ventodos
implantes osseointegrados,a
terapêutica protética e cirúrgica foi ampliada significativamente e os implantesse
tornaram parte integrante da reabilitação bucal.Infelizmente nem todos os pacientes apresentam condições ósseas compatíveis com
a
colocaçãode
implantes, necessitando para tanto, procedimentosde
regeneração óssea.O
enxerto ósseo aut6geno éa
alternativa mais indicada para solucionar estes ca-sos e apesarde
ser uma técnica previsível muitose
tem estudado para incrementar tal procedimento. Uma tendência atual éa
associaçãodos
"fatoresde
crescimento" em busca da obtençãode
formaçãode
osso emareas
atróficas mais rapidamentedo
que normalmente ocorre pela induçãode
células responsáveis pela formação óssea.A forma
mais acessívelde se
beneficiardos
fatoresde
crescimento é através da utilizaçãodo Plasma Rico
em Plaquetas (PRP), que éum
produto autólogo, proveni-entede
processo laboratorial,no
qualse
consegue tomar uma quantidadede
sangue rica em células e pobre em plaquetas e transformar, atravésde um
processo denominado centrifugação, emum
concentrado rico em plaquetas e pobre em células.A
finalidadede
tal procedimento é que diversos fatoresde
crescimento jáforam
encontrados dentrodos
grânulos a das plaquetas, os quais são liberadosno
momentode
sua ativação.Os
fatoresde
crescimento mais importantes encontrados nas plaquetas são o PDGF (fatorde
crescimento derivado das plaquetas), o TGF-I3 (fatorde
crescimentode
transformaçãobeta)
e o IGF (fatorde
crescimentosimilar à
insulina), mas existem mui-tos outros sintetizados, não somente nas plaquetas como também em outras células.2 REVISÃO
DE LITERATURA
'
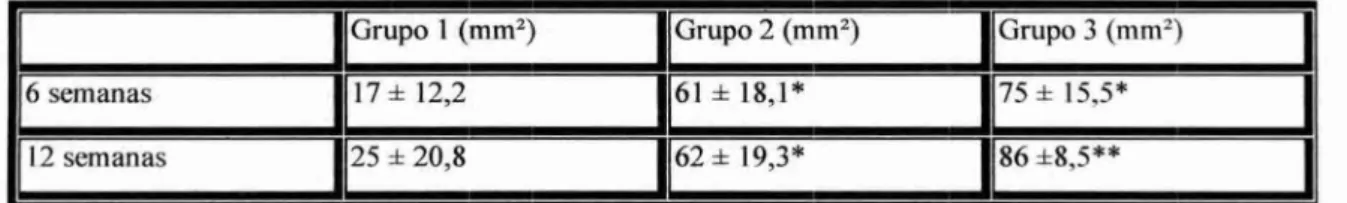
Marx et al.(1998) realizaram um estudo para demonstrar que o PRP aumenta a concentração de plaquetas, possui pelo menos 3 fatores de crescimento (fator de cresci-mento derivado de plaquetas [PDGF ], fator de crescicresci-mento transformador beta 1 [TGF-131] e fator de crescimento transformador beta 2 [TGF-P2]) e que células da medula es-ponjosa têm receptores para estes fatores. Objetivaram também demonstrar como explo-rar o potencial do PRP em aumentar a taxa de formação óssea e a densidade do osso, através da análise do enxerto após 6 meses, e também apresentar um modelo de regene-ração óssea em enxertos. Foram obtidos 88 enxertos ósseos de medula celular esponjosa do iliac° para reconstrução de defeitos mandibulares em humanos, onde um grupo rece-beu enxerto sem adição de PRP e outro grupo enxerto com PRP. Nos testes de anticor-pos monoclonais para PDGF e TGF-P, o PRP mostrou presença intensa de ambos. 0 enxerto autógeno coletado mostrou resultados positivos aos testes para receptores de PDGF e TGF-P. A contagem de plaquetas no PRP quantificou sua concentração em 338% sobre a contagem inicial. A maturidade radiográfica do enxerto com adição de PRP foi avaliada como ligeiramente acima do dobro, com taxa de 2,16 em 2 meses, 1,88 em 4 meses e 1,62 em 6 meses. Após 6 meses, pelo menos um implante foi colocado em cada area enxertada e o osso removido foi submetido a testes de anticorpos monoclonais que demonstraram uma produção continua de TGF-I3, porém, raras células foram cora-das para PDGF e por isso interpretacora-das como não reativas. 0 osso removido foi também submetido A. análise histomorfométrica, a qual indicou que os enxertos ósseos em geral produzem uma área de osso trabecular maior que a área original (média de 55,1%), en-tretanto, enxertos ósseos com adição de PRP demonstraram Area óssea bem maior que enxertos sem PRP (média de 74%). As células capazes de cicatrização diminuem no decorrer da vida do indivíduo para economia de energia do organismo, mas, durante uma injúria os fatores de crescimento PDGF e TGF-I3 estimulam rapidamente uma in-tensa atividade destas células, permitindo a formação de um tecido ósseo imaturo, po-rém, auto-sustentado, o qual posteriormente sera substituído por osso lamelar organiza-do. 0 PDGF e o TGF-I3 não são os únicos fatores de crescimento que influenciam na regeneração óssea e não são os únicos contidos no PRP, porém foi apresentado um e-xemplo simplificado que enfoca a ação destes 2 fatores de crescimento na regeneração óssea.
cimento que é extinguida de 7 a 10 dias. Testes de anticorpos monoclonais demonstra-ram a presença de PDGF, TGF-13 e IGF no PRP, assim como células do enxerto ósseo e osteoblastos possuem receptores na membrana celular para PDGF e TGF-I3 nas regiões perivasculares, enquanto receptores de IGF foram mais verificados nos osteoblastos end6sseos. Um aumento de 338 % na contagem de plaquetas foi verificado quando comparado A. contagem de plaquetas do sangue inicial o que demonstra que o PRP de fato concentra plaquetas. Foram executados enxertos ósseos em 88 pacientes com e sem PRP e avaliados radiograficamente em 2, 4 e 6 meses, os quais demonstraram que os enxertos com PRP foram 2,16 x mais maduros em 2 meses, 1,88 x mais maduro em 4 meses e 1,62 x mais maduro em 6 meses quando comparado com os enxertos sem PRP. As células osteoprogenitoras apresentam-se com valores em torno de 1 para 400.000 na idade de 50 anos, enquanto que nos enxertos beneficiados com PRP estas mesmas célu-las estão calculadas em 1 para cada 2 células. 0 índice de regeneração óssea é mais rá-pido quando do uso do PRP o que permite uma função antecipada e a colocação de im-plante mais breve quando solicitado. Além disso, análise histomorfométrica de enxertos com PRP demonstraram maior maturidade histológica tanto em 4 como em 6 meses. 0 PRP é um avanço em relação a técnicas de enxerto padrão, pois é autógeno, não tóxico,
não imunogênico e melhora o caminho normal da regeneração óssea, porém, ainda é necessário identificar todos os fatores de crescimento das plaquetas, explorar sua intera-ção com outros fatores de crescimento e com suas células alvo e seqüestrar maior quan-tidade e mais rapidamente as plaquetas.
Jiang et al. (1999) avaliaram, in vitro, a dinâmica de adsorção do PDGF-BB e
estatisticamente significativa em relação aos 15, 60 e 120 min, porém, entre estes, não houve diferença estatisticamente significativa, mas a maior adsorção foi atingida aos 15 mim A percentagem do PDGF-BB liberado da matriz óssea demonstrou um aumento dependente do tempo: em 1h 18% foi liberado, e 10 em dias aproximadamente 50% foi liberado, porém entre 1 e 24 h e entre 48 h e 10 dias a diferença não foi estatisticamente significativa. JA a percentagem de IGF-I não sofreu alteração com o transcorrer do tem-po: após 1 h aproximadamente 10% foi liberado e a quantidade liberada em 1, 24, 48 h ou 10 dias não foi estatisticamente diferente. A proliferação de osteoblastos cultivados sobre o material da matriz e tratados com PDGF-BB demonstrou maior proliferação quando comparado ao não tratado. Por outro lado, as células ostebasticas tratadas com IGF-I demonstraram um aumento leve da proliferação sem significância estatística. Nas primeiras 24 h nenhum aumento significativo da proliferação celular ocorreu. Visto que o IGF-I é mais importante na remodelação óssea, sua liberação vagarosa pode ser clini-camente benéfica. Pelo estudo os autores sugeriram uma possível utilização de fatores de crescimento com uma matriz mineral óssea anorgdnica para estimular a regeneração óssea, podendo aumentar a eficiência clinica deste material no tratamento de defeitos ósseos visto ter demonstrado a adsorção do PDGF-BB à matriz óssea e o efeito mitogê-nico sobre as células osteoblásticas. Estudos futuros devem examinar esta terapia com-binada.
Em 15 a 20 min um gel de PRGF estava formado e foi usado como preenchimento dos defeitos após a extração. Dez ou 16 semanas após, no momento da colocação do im-plante, o tecido foi tomado para biópsia com uma broca trefma e enviado para análise. A região tratada com PRGF, no geral, exibiu epitelização muito boa ou excelente, osso mais maduro, trabéculas organizadas e maior regeneração óssea quando comparada áreas controle que exibiam epitelização normal e tecido conjuntivo isolado ou associado a osso trabecular. Melhores resultados de áreas tratadas com PRGF quando comparada a áreas controle demonstraram que esta é unia técnica previsível, de fácil utilização, sem contra-indicação e sem risco de infecção ou transmissão de doenças ao paciente.
ce
vantagens sobreo
ossoxenógeno
nos casos tratados com membrana semPRP.
De qualquer forma este estudo revelou que aaplicação
de PRP pode aceleraro
crescimentoósseo,
especialmente em locais com densidadeóssea precária.
Landesberg;
Roy; Glickman(2000)
compararamo
preparo do plasma rico em plaquetas (PRP) utilizando paracoagulação
o
agente degelificação ITA (Natrex
Tech-nologies Inc, Greenville, NC) com cloreto decálcio
num grupoe
atrombina
bovina com cloreto decálcio
em outro grupo. Fizeram umaanálise
dosníveis
do fator decres-cimento
derivado das plaquetas(PDGF)
e
fator beta detransformação
do crescimento(TGF-P)
gerados na formação docoágulo
com as2
formas de preparo.0
sangue foi colhido de3
pacientes em tubosvacuotainer
de5 ml
contendo0,5 ml
de citrato desódio
ou
0,048 ml
deAcido etilenodiaminotetracético
a15% (EDTA).
Uma parte foi separada para contagem de plaquetas. Os tubos foram centrifugados e, em seguida,o
plasmafoi
separado
e
centrifugado novamente.Após
a centrifugação,o
PRP de cada doador foi dividido em2
partes, onde uma recebeu aadição
do agenteITA
degelificação
e
cloreto decálcio
a10%
e
a outra a mistura de cloreto decálcio
a10%
comtrombina
bovina. Ambos foram deixadosgelificar
em banhomaria
a37 °
C e
depois mantidos em4°
C
durante uma noite para sofrermáxima retração
docoágulo e
mais umacentrifugação
foi executada. Os estudos demonstraramque
o
uso deEDTA
comoanticoagulante
nospre-paros
de PRPé
mais prejudicial, embora apresente maiorprodução
de plaquetas elas parecem sofrer danos, enquantoo
citrato obteve plaquetas em quantidades suficientes para formar bonscoágulos.
0
melhor enriquecimento de plaquetas(200 %)
foi obtido emcentrifugações
com200
e
250
G
por10
min. Os géis de PRP,após 24
h
deretração
do
coágulo,
apresentaram quantidades significativase
similares dosníveis
dePDGF
e
TGF-I3,
independente do método de preparo.0
PRP foi também analisadoapós
aremo-cão
das plaquetas residuaise
as quantidades dePDGF
e
TGB-13
presentes foramMarx
(2000)
redigiu umcomentário
a respeito do artigo deLandesberg;
Roy; Glickman.Afirmou
que o uso doEDTA
(ácidoetilenodiaminotetracético)
paraanticoa-gular
o sanguenão
é recomendado porquefragmenta
plaquetas e aCPD
(dextrose de citrato de fosfato) é a preferida devido àpreservação
da membranaplaquetdria.
A força G, que é umafunção
da forma e tamanho do recipiente, é o principal fator deinfluencia
no enriquecimento das plaquetas.Forças
G excessivas, além de produzir umenriqueci-mento
reduzido dasplaquetas,
também podefragmentar
as partículas.0
PRPcorres-ponde
a20 %
dafração
total de plasma e deveria aproximar-se de400 %
da contagem das plaquetas do sangue, poisconcentração
menor é PRP diluído. Quanto àtrombina
bovina, casos decoagulopatia
relatados no passado tinham de50
a100 p.g/m1
de fator de contaminaçãoV
bovino e foram aplicados diretamente em vasossangUineos
maiores, enquanto que atrombina
usada atualmente é segura, pois contém apenas0,2 pg/m1
de fator decontaminação V
bovino, portanto não apresenta risco decoagulopatia,
além de ser usada paragelificar
fora do corpo.0
agente degelificação ITA,
utilizado pelosauto-res
supra citados, como substituto detrombina
nagelificação
do PRPnão
é seguro, visto que sua químicanão
foi revelada e que3
doadores foram apenas voluntários, semrece-ber
PRP eITA internamente,
portanto, seu uso em humanosnão
pode ser recomenda-do.Kassolis;
Rosen; Reynolds(2000)
relataram casosclínicos
onde15
pacientes(10
mulheres,5
homens, com idade entre25
e72
anos) foram tratados comaloenxerto
ósseo congelado a seco
(FDBA-
LifeNet, Virginia Beach, VA) e plasma rico emplaque-tas
(PRP) comregeneração
óssea guiada (ROG) para elevação do seio maxilar ouau-mento
da crista(17 áreas
diferentes:14
seios e3
cristas) para posteriorcolocação
de implantes.Avaliação hematológica
foi realizada nopré-operatório.
Foi colhido1000
a1200 ml
de sangue porvenipuntura 1
h antes da cirurgia paraobtenção
de50
a150
cc de PRP.0
gel de PRP foi preparado em2
etapas. Primeiro foi adicionado33 ml
declo-reto
de cálcio a10 %
a100m1
de PRP e deixado coagular de6
a8
min, em seguida foi espremido para liberar atrombina
derivada das plaquetas. Depois o plasma rico emtrombina autóloga
foi misturado ao PRP naproporção
de1:4
e deixado coagular de3
a5
min. Este foi colocado sobre diversas gazes para que o excesso de soro fosse absorvi-do e deixasse o gel de PRP formaabsorvi-do. Trinta e seis implantes foram colocaabsorvi-dos, senabsorvi-do que29
foram colocados no momento do enxerto associado a ROG onde houvesse alturaPRP) foi usado em todos os
sítios.Antes da utilização
oenxerto foi saturado com
trom-bina autóloga edeixado
gelificarpor alguns minutos para facilitar sua
colocaçãono sitio
cirúrgico.A cirurgia de segundo
estagiofoi realizada
4a
5meses depois
epermitiu a
colocação de
3implantes adicionais. Foi usada uma
trefmade
2 mmde
diâmetroem
2pacientes
e omaterial colhido submetido à
avaliação histológicaEm
váriospacientes
foi
necessário osteotomiapara colocação do
abutmentde
cicatrização e omaterial
obti-do também enviaobti-do para
análise histológica.Trinta
edois dos
36implantes
(89%) obti-veramsucesso clinico
e radiográfico.Quatro implantes que falharam foram removidos
no segundo
estagio cirúrgico e substituidospor outros implantes que foram bem
sucedi-dos.
Histologicamentehouve presença de osso vital
próximoas
partículas residuaisde
FDBA e áreasde pontes
ósseas e coalescênciadas
partículasdo enxerto. Isto sugere
quea combinação de
FDBAcom PRP suporta a
formaçãode novo osso. Ficou demonstrado
que ouso do PRP facilita a
manipulaçãodo material do enxerto, sua
utilizaçãonum
períodode até
6 hminimiza
orisco de
transmissãode
doença e contaminação,que
osangue colhido para
obtençãodo PRP resulta em minima perda
sanguínea,tendo os
ui-veisde
hematócrito ehemoglobina praticamente inalterados
após otratamento
e nãohouve
evidenciaclinica de aumento de tempo de
formaçãodo
coáguloou
complicação sangiiinea intraou
pós-operatória. 0enxerto de seio maxilar
e oaumento da crista com
FDBA ePRP
éuma alternativa terapêutica
viávelna
preparaçãode um sitio para
poste-rior colocação de implante, porém estudos futuros
são necessáriospara determinar se
oPRP aumenta a nova
formação ósseaou a
maturação quandoassociado com enxertos
alogenicos.Rosenberg
e Torosian (2000)apresentaram um protocolo clinico de
obtençãode
PRP denominado
plasmaférese, oqual permite, juntamente com enxerto
ósseo,restaurar
pacientes parcialmente
edêntulosna ¡Tea posterior da maxila, com
elevaçãoda
mem-branado seio maxilar para posterior
colocaçãode implantes. É também apresentado um
caso clinico inicial. A
plasmaférese érealizada no dia da cirurgia, onde um
angiocatétercolhe em uma bolsa aproximadamente
450 ccsde sangue. A bolsa
é centrifugadaa
5600rpm
e quando finalizado ofracionamento a velocidade diminui para
2400rpm para
libe-raras plaquetas.
0plasma pobre
édevolvido ao paciente
e oPRY armazenado.
Soluçãosalina
éadicionada ao
póde
trombina,esta mistura (lee)
écolocada em uma seringa
estérila qual
éadicionado
1cc de cloreto de
cálcio e 1cc de ar.
Apósagitar,
oar
ématerial é colocado em uma seringa e levado a área receptora, onde é injetado e com-pactado até obter o volume necessário. Em aproximadamente 4 meses o paciente recebe os implantes com carga inicial com a prótese provisória. Após 6 meses é colocada a prótese definitiva e o paciente encaminhado para manutenção periódica da prótese e avaliação da osseointegração. Foi apresentado um caso clinico onde um paciente de 70 anos foi submetido à levantamento de seio maxilar com enxerto alógeno com PRP, o qual recebeu 3 implantes 3 meses depois, onde a prótese provisória de 4 elementos foi instalada 1 mês após e a definitiva 6 meses depois. Os resultados deste procedimento parecem favoráveis visto que o PRP, além de proporcionar material adequado para en-xertar no sitio deficiente, diminui significativamente o período de regeneração, pois se acredita que os fatores de crescimento presentes no PRP contribuam para a regeneração óssea.
Sonnleitner; Huemer; Sullivan (2000) descreveram a modificação de uma técni-ca simples, usada para preenchimento de alvéolos, para ser utilizada em enxertos maio-res com a combinação de PRP e um adesivo de fibrina chamado Tissel (Baxter Health-care Corporation, Deerfield, IL) produzido através de soro humano que consiste princi-palmente de 2 componentes: um concentrado de fibrinogênio enriquecido com fator XIlla e Trombina, ao qual é adicionado o cloreto de cálcio. A extração do concentrado de plaquetas obtida através de um processo denominado plasmaférese, no qual apenas o PRP é retirado do paciente e os demais componentes são devolvidos ao seu corpo, em-bora seja possível obter ótimas concentrações de PRP, é uma técnica cara e geralmente inviável para ser efetuada em consultório. Uma técnica alternativa é o sangue ser colhi-do de 3 a 8 vacuotainers de 6 ml (6 necessário de 4 a 5 vacuotainers para cada seio ma-xilar) contendo citrato como anticoagulante e submetido à centrifugação por 20 min a
zido no leito receptor em camadas, sendo a trombina gotejada sobre este com a função de consolidação ou
então o
material obtido pode ser moldado fora da cavidade oral, aplicadoe
fixado com adesivo de trombina. Outra alternativaé
misturar PRP ao Tissel na proporção 1:1,o
que resulta em uma estrutura similar a uma membrana, que pode ser usada para cobrir fenestrações ou preenchimento de pequenas cavidades. 0 equipamen-to necessário para esta técnica estádisponível
com representantes de produtos médicos e, sendo a centrifuga pequena,é compatível
para um ambiente cirúrgico de tamanho médio. 0 uso de vacuotaineré
uma alternativa auxiliar parao
pacientee
segurança parao
operadore o
uso do adesivo Tissel, amplamente testadoe
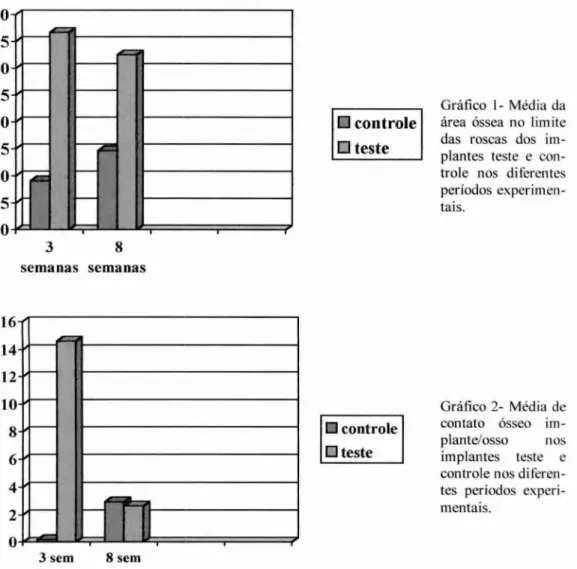
aprovado, tem demonstrado maior eficiência na manipulação de materiais de enxerto com PC.buir positivamente no processo de recuperação do osso entre implante/osso, pois a quantidade de preenchimento ósseo foi maior no grupo teste do que no grupo controle. A porcentagem de contato osso/implante alcançou valores mais altos no grupo teste comparado com o controle em 3 semanas, o que indica que a maior atividade da forma-ção óssea foi observada no primeiro período do reparo ósseo, o que esta de acordo com publicações prévias, porém, sendo este um estudo piloto com pequeno número de ani-mais e implantes, é necessário um estudo ani-mais amplo para confirmar os resultados desta investigação.
Scarso Filho et al. (2001) fizeram uma abordagem concernente aos conhecimen-tos científicos e estágio atual do PRP e apresentaram um protocolo para sua obtenção. 0 plasma rico em plaquetas apresenta em sua constituição plasma, leucócitos e plaquetas. As plaquetas possuem elementos de depósito dentre os quais estão os grânulos a pla-quetdrios, responsáveis pela liberação dos fatores de crescimento. Dentre estes fatores os mais importantes são: fator de crescimento derivado das plaquetas (PDGF), fator de crescimento transformador beta (TGF-Ps) e o fator de crescimento similar A insulina (IGF-I). 0 PDGF é o principal fator de crescimento das plaquetas, é o primeiro a chegar na ferida, guia a revascularização, a síntese de coldgeno e a regeneração óssea. 0
bolsa, ficando na primeira as células vermelhas. Novamente as bolsas são centrifugadas, mas a velocidade
é
alterada para 4100 rpm por 10 min a 22 ° C e o sobrenadanteé
trans-ferido para a última bolsa coletora, deixando na segunda, aproximadamente, 70 ml de PRP. Sete ml de PRPé
aspirado em uma seringa de 10 ml, juntamente com 2 ml de are
1 ml de cloreto de cálcio a 10 %. Agita-se
e
adiciona-se ao osso aut6geno particulado. Ao final de 150 s já se observa um aglomerado plaquetdrio. 0 enxerto ósseo deve ser levado ao sitio a ser enxertado quando este der os primeiros sinais de gelificação. PRP reduzo
risco de transmissão de doenças, permite a concentração de grande número de plaquetas com seus fatores de crescimentoe
estes fatores permitem a iniciação da atividade de células ósseas indiferenciadas de forma mais completa do que ocorreria naturalmente. Clinicamenteo
valor do PRPé
permitir a colocação de implantes mais rápida. Além disso, a quantidade de osso regeneradoé
maior, sendo vantajoso especi-almente naquelesindivíduos
com regeneração óssea mais pobre: idosos, osteoporóticos, diabéticose
irradiados. Embora seja um compostoorgânico,
atóxico, não imunorreativoe
desprovido de morbidade elevada, sua tecnologia de processamento bioquímico ne-cessita ser aperfeiçoadae
seu mecanismo de ação melhor esclarecido para alcançar apli-cabilidade clinica rotineira.Após 5 meses, embora a crista tenha aumentado 2 mm ainda havia necessidade de au-mento horizontal e utilizaram FDBA, PRP e membrana e-PTFE. Após 6 meses observa-ram clinicamente um ganho de 4 mm de crista, os implantes foram colocados e a biópsia apresentou partículas de DFDBA residual envolvidas por osso vital, com osteblastos e oste6citos. 0 terceiro paciente havia perdido 2 molares e um segundo pré-molar na mandíbula, com perda de altura e espessura, a qual foi solucionada com DFDBA mistu-rado com PRP, colocados sob uma armação de titânio e cobertos com membrana Bio-Gide. Cinco meses após foi executado novo enxerto com DFDBA e membrana BioGide e colhido material com trefina de uma regido para análise histológica a qual apresentou partículas de DFDBA residual encapsuladas por tecido conjuntivo fibroso no aspecto coronal e raramente no aspecto mais apical. Seis meses após a crista foi reavaliada e os implantes foram colocados, pois clinicamente houve ganho de 2 mm de largura e 3 a 4 mm de altura. Avaliar o efeito do PRP neste estudo é complexo diante de inúmeras var áveis como o tipo de osso adicionado (autógeno, substitutos/derivados ósseos), mem- branas de barreira, uso de trombina e adição de perfurações corticais. Como os 3 casos apresentados necessitaram de enxertos múltiplos, os autores sugeriram que o PRP não demonstrou capacidade osteoindutiva. E que o PRP com DFDBA não pareceu aumentar a qualidade do osso recém-formado e que as partículas de DFDBA residuais não vitais não pareceram suportar qualquer atividade osteogênica. Nos casos apresentados o PRP demonstrou melhorar a manipulação do material de enxerto, facilitando sua colocação e estabilidade e demonstrou suportar formação óssea em defeitos localizados de crista quando utilizado em conjunto com substitutos/derivados ósseos e com uma membrana de barreira, porém estudos ainda são necessários para determinar se existe efeito signifi-cativo quando o PRP é associado a materiais de enxerto alogênico, aloplástico e xeno-gênico.
pacientes foram divididos em grupos de
3
e oespaço
antral foi enxertado com uma
mis-tura
de osso
autógeno/PRP,
osso
alográfico/PRP,
osso
xenográfico/alográfico/PRP
ou
osso
xenográfico/PRP.
De cada paciente, uma
biópsia
foi colhida com broca
trefma
no
momento da
colocação
do implante. Dois métodos foram utilizados para
oprocessa-mento
do PRP.
0
primeiro descrito foi a unidade de
DIDECO
Compact Advanced
DCA), que tem
múltiplas funções
na medicina, porém complexa de operar. Tem inicio
com a coleta de
200
a
250 ml
em bolsa de sangue
30
min antes da cirurgia, a qual passa
por uma
centrifugação
aproximada de
5600
rpm que separa
oPPP do PRP.
Automati-camente
a velocidade
éreduzida para
2400
rpm
e oPRP vai para uma bolsa designada,
oqual
serácoletado juntamente com um pouco de células
sangiiineas
vermelhas,
obten-do-se aproximadamente de
30
a
40 cm3
de PRP.
0
segundo
emais recente método de
processamento de PRP
éa unidade Harvest
SmartPReP,
que
écapaz somente de
produ-zir
PRP, mas
érelativamente simples de operar.
0
sangue
éautomaticamente separado
em células
ePRP. Inicia com a retirada de
60 ml
de sangue do paciente
30
min antes da
cirurgia,
oqual
étransferido para a
câmara
da unidade
SmartPReP
para centrifugar. Ao
término do processo,
oPC
está
no fundo da
câmara
de plasma que contém
oPPP. Oito
cm3
de PRP
são
aspirados em uma seringa.
0
PRP processado
e oativador são
deposi-tados
sobre
omaterial de enxerto via seringa dupla especial que mistura igualmente
oPRP
ea mistura de cloreto de
alcio/trombina.
Weibrich
et al.
(2002) realizaram
um estudo para
fornecer
dados sobre
concen-trações
dos fatores de crescimento das plaquetas
einvestigar a influência da idade
esexo do doador na contagem de
trombócitos
no sangue
eno PRP. Foram coletadas
a-mostras
de sangue de
213
doadores sendo
158
homens
e55
mulheres, com idade entre
17
e62
anos. Antes da
separação, 50 ml
de sangue foi coletado para
análise sorológica
e400
a
450 ml
foi para uma centrifuga que separa os componentes celulares do sangue
efrações
de plasma.
0 PRP e
as amostras de sangue foram
submetidos
à
contagem
auto-matizada
de
plaquetas.
Foram medidos os
níveisde
PDGF-AB
ePDGF-BB, TGF-P1
e132
eIGF-I.
A contagem média de
plaquetas
obtida no sangue foi de
266.000411
enquan-to no PRP atingiu
1.408.0004d,
tendo aumentado a
concentração
de plaquetas em
5 x
quando
comparado com a
concentração
inicial do sangue. Os
3
fatores de crescimento
principais encontrados no PRP foram
PDGF-AB, TGF-P1
eIGF-I.
O
PDGF-BB
equena relação entre si. Por outro lado os níveis de PGDF-AB, PDGF-BB e TGF-P1 ti-veram correlações relevantes. A concentração de plaquetas no sangue e no PRP foi li-geiramente mais alta para mulheres do que para homens. Os níveis de PDGF-AA, PDGF-BB, TGF-I31 e TGF-f32 não revelaram nenhuma influência de sexo ou idade. Os níveis de IGF-I não revelaram nenhuma influencia com relação ao sexo do doador, po-rém exibiram um pequeno decréscimo na concentração com a idade. A previsão de ní-veis de fatores de crescimento baseada na contagem de trombócitos do sangue ou do PRP não é segura. Os fatores que influenciam nas variações individuais no conteúdo dos fatores de crescimento do PRP são merecedores de investigação adicional e uma técnica que possa avaliar rapidamente o conteúdo dos fatores de crescimento no PRP pode ser um beneficio terapêutico.
rimento pode ser usado como referência para a utilização de testes com materiais alo-plásticos. Sabe-se que estruturas corticais autógenas podem conter fatores osteoinduto-res
e
por isso, as placase
as lacunas foram parcialmente cobertas com osso. Este expe-rimento demonstrou quemandíbulas
com defeito de continuidade podem ser estabiliza-das como
sistema de placas utilizado no modelo animal escolhido, proporcionando es-tabilidade suficiente para que os animais comessem, ruminasseme
sobrevivessem du-ranteo período
experimental.Robiony et al. (2002) avaliaram
o
aumento de formação óssea usando simulta-neamente PRPe
enxerto ósseo duranteo
procedimento de distração osteogênica em 5 pacientese
assim apresentaram um protocolo para tratarmandíbulas
severamente atrófi-cas. Cinco pacientes com atrofia severa demandíbula
completamente edêntula foram tratados com a técnica de distração de crista alveolar combinada com a mistura de osso autógeno com um concentrado de plaquetas autógeno derivado do PRP (gel de plaquetae
osso autógeno-ABPG). 0 procedimento foi executado em pacientes com crista alveo-lar residual de 8 a 10 mm, avaliada por radiografiapanorâmica,
radiografia cefalométri-cae
tomografia computadorizada. Foram colhidos de 55 a 60 ml de sangue de cada pa-ciente em tubos vacuotainer contendo citrato de sódio. A primeira centrifugação foi executada por 15 min em 180G
quandoo
hematócrito foi menor que 40 %e
em 200G
quandoo
hematócrito foi maior que 40 %; assim os componentes do sangue ficaram separados em PRP (sobrenadante claro)e
em eritr6citose
leucócitos. 0 PRP foi aspira-doe
centrifugado novamente por 15 min a 560 G,o
que permitiu a precipitação de pla-quetas no fundo do tubo, obtendo cerca de 8 ml de um concentrado de plapla-quetas autólo-go (APC). Para formaro
gel foi adicionada ao APC uma mistura de cloreto decálcio
asomente 60 dias depois do final da distração. Resultados radiográficos em longo prazo mostraram considerável aumento da regeneração óssea 6 meses após a colocação dos implantes. Ultra-sonografias executadas em 1 e em 2 meses após a distração mostraram sinais de ossificação homogênea, com características de desenvolvimento de cortical. A combinação destes métodos regenerativos parece ser uma excelente solução para restau-rar mandíbulas severamente atróficas e proporciona encorajamento para continuar a aplicar esta técnica visto que, no momento da colocação dos implantes, foi encontrado tecido ósseo suficiente, embora não remodelado, capaz de assegurar estabilidade primá-ria aos implantes.
Kim et al. (2002) propuseram avaliar a integração tecidual através de histomor-fometria em implantes enxertados com pó de osso desmineralizado (DBP), associado ou não ao plasma rico em plaquetas (PRP) em cães. Foram utilizados 10 cães e coletados
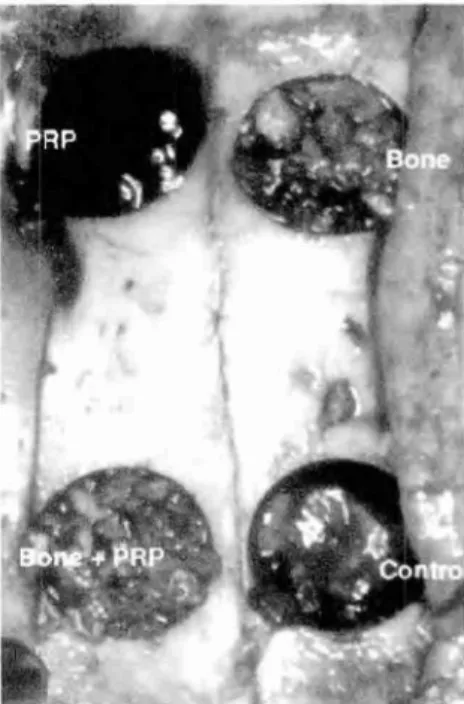
Neste estudo, a melhor formação óssea e contato ósseo foram obtidos no grupo com DBP/PRP, porém este é um estudo limitado visto a crista iliaca ser uma Area de baixa contaminação bacteriana e o período de tempo limitado do trabalho. De qualquer forma, ao adicionar DBP ou DBP/PRP o período de cicatrização da interface implante/osso diminuiu e esta técnica pode ser utilizada quando defeitos ósseos são tratados no mo-mento da colocação do implante.
Aghaloo; Moy; Freymiller (2002) elaboraram este estudo para avaliar a efetivi-dade do PRP na cicatrização óssea em um modelo animal. Foram incluídos neste estudo
adição de PRP ao osso autógeno radiográfica e histologicamente. Isto contradiz resulta-dos de esturesulta-dos anteriores em humanos que foram trataresulta-dos com enxerto ósseo endocon-dral de crista iliaca. Este trabalho foi executado em crânio de coelhos e o enxerto utili-zado é de origem membranosa, além de ser uma amostra pequena para dados conclusi-vos, por isso outros testes científicos com PRP são ainda necessários.
Schliephake (2002) revisou a literatura focalizada em fatores de crescimento, em particular os fatores envolvidos na regeneração do tecido ósseo. A pesquisa tratou da aplicação de fator de crescimento derivado das plaquetas (PDGF), fator de crescimento insulinico (IGF), fator de crescimento transformador beta (TGF-P), proteínas morfoge-néticas ósseas (BMP) e plasma rico em plaquetas autógenas (PRP). 0 PDGF é uma gli-coproteína, tendo 3 isoformas: PDGF-AA e PDGF-BB estão nas plaquetas, enquanto o PDGF-AB é secretado por células não estimuladas da linhagem osteoblastica. PDGF é muito importante no desenvolvimento embrionário de muitos tecidos e órgãos e estimu-la céluestimu-las alvo especificas. In vitro, PDGF-AA e PDGF-BB aumentam a proliferação de muitos tipos de células ósseas. 0 uso de PDGF em cirurgia reconstrutiva obteve resulta-dos contraditórios em vários experimentos. 0 IGF é um peptideo existente em 2 isofor-mas: IGF-I e IGF-II. Em contraste com fatores de crescimento que agem em nível local ou regional, os IGFs agem em muitas células e tipos de tecidos, sendo o IGF-I impor-tante para ambos os desenvolvimentos pré e pós-natal, enquanto IGF-II parece ser ne-cessário principalmente no estagio pré-natal. Além do desenvolvimento geral, estão envolvidos no desenvolvimento de órgãos, músculos e crescimento do esqueleto bem como para manutenção da massa do esqueleto. 0 potencial proliferativo de IGFs, in vitro, é contraditório pois alguns enfatizam a proliferação de células osteoblásticas
ambíguos
comrelação
àregeneração
óssea. As proteínasmorfogenéticas
ósseas(BMP)
pertencem à
superfamilia
dasTGFs-P.
Tem papel de pivô no desenvolvimento fetal. Estudos, in vitro, demonstraram que asBMPs
agem principalmente namorfogênese
e não namitogênese
em célulasmesenquimais indiferenciadas.
In vivo, promovem um efeito cascataque
envolve o recrutamento de célulasmesenquimais indiferenciadas
e aprodução
de matrizextracelular,
tem efeitoquimiotático
paraosteoblastos
e célulasos-teoprogenitoras. 0
uso deBMPs
emreconstrução
do esqueletonão
temaplicação
clini-ca
rotineira pois, embora farta a literatura, são pesquisas em animais e, dados sobre o uso deBMPs
em humanos são escassos.0
plasma rico em plaquetas (PRP)autógeno
é uma fração do sangueapós
centrifugação, o qual possuiconcentrações
altas detrombó-citos,
os quais contémvários
fatores de crescimento comoPDGF, TGF-I3, IGF
eVEGF.
Embora aplicação crescente em cirurgia
há
poucaevidência
sobre aeficácia
destaapli-cação,
e nenhum estudo experimental que prove o beneficio de seu uso, apenasobserva-ções
clinicas semparâmetro
de sucesso bemdefinido
ou grupo-controle.Publicações
clinicas
estão
limitadas a poucos casos onde o efeito do PRP foi comparado emradio-grafia
panorâmica ou pequenos espécimes de osso, mas descrevem melhoria naincorpo-ração
de enxertos e mais rapidez nacicatrização
de tecidos moles.0
aumento darege-neração óssea
parece ser melhor alcançado pelo uso deBMPs, porém
dosagensindivi-duais
e tipo de portador ainda serãodefinidos
para ospropósitos reconstrutivos.
Martinez-Gonzalez et al.
(2002)
fizeram uma revisão de literatura sobre os pos-síveis efeitos dasaplicações
terapêuticas dos fatores de crescimento(GFs),
incluindo o PRP, no processo decarcinogênese,
suainfluência
sobre tecidos com displasia ou carci-noma oral e suarelação
com crescimento einvasão
tumoral. Uma dasações
dosGFs
é adiferenciação
edivisão
celular.Após
oGF
unir-se ao seu receptor e enviar o sinal, sua ação se inativa porinternalização,
necessitando a chegada de um novo sinal para voltar a dividir-se. Atualmente é conhecida a teoriaepigenética
dacarcinogênese
pela qual se estabelece uma primeira fase de"iniciação" (alterações
no DNA), seguida por"promo-cão"
(aumento da probabilidade de novasalterações
genéticas) e terminando com areceptores normais, os quais apresentam urna morfologia aberrante truncada estando continuamente ativados, mesmo sem a união do GF. 0 processo de internalização (de-gradação do complexo GF-receptor de membrana) nesta circunstância é mais lento e assim os sinais mitogênicos seguem de forma continuada. Uma vez que o complexo GF-receptor tenha enviado o sinal, sofre o processo de internalização ou, quando ocor-rem alterações mutacionais que interferam na internalinção, volta à membrana onde reinicia o sinal mitogênico, aumentando a proliferação celular e sua transformação em fenótipos malignos. As vias de sinalização saturadas por uma sobreconcentração exter-na de GFs poderia dar lugar a siexter-nais anômalos e pouco conhecidos, já que as vias de sinalização estão conectadas funcionalmente de forma transversal (cross-talk). Se os
alvos das vias dos GFs estão saturados possivelmente os sinais de receptores adicionais serão ignorados. Tem-se estabelecido relações entre sobreexpressão de GFs e seus re-ceptores com tecidos tumorais e displásicos. Em geral a sobreexpressão é de GFs nor-mais, induzida pela célula tumoral de forma autócrina ou paracrina para manter o fen& tipo tumoral sem aporte externo de GFs enquanto a ativação de células tumorais por GFs mutados é pouco conhecida. Em células tumorais têm-se observado também um aumento de receptores normais dos GFs que parecem favorecer o crescimento e invasão de células tumorais visto manter uma estimulação autócrina.Têm-se observado sobreex-pressão de GFs em carcinomas e em outros tumores. Num estudo em osteossarcoma e osteoblastoma verificou-se positividade para PDGF-AA e PDGFR-a. Tem-se relaciona-do o TGF-I3 como inibirelaciona-dor da proliferação de células epiteliais, porém a sobre expressão de TGF-P esta associada com progressão tumoral epitelial por facilitar a proliferação estromal, angiogênese e atuar como imunossupressor. Em hamsters a aplicação exógena de EGF sobre tumor induzido na mucosa oral aumentou de tamanho. As plaquetas ten-dem a facilitar o processo de metástase. Concentrações terapêuticas de GFs poten-dem agir como promotores de carcinogênese, entretanto para que isto ocorra é necessário a apli-cação de doses continuadas de GFs, e as doses terapêuticas de GFs do PRP se degradam de
7
a 10 dias. Tem-se designado a capacidade antiapoptótica ao IGF e VEGF. Aoentes com
condiçõespré-cancerosas orais
e próximoa
lesõespré-cancerosas ou tecidos
com displasia
epitelialoral; evitar
ouso de PRP em pacientes com
exposiçãoprévia a
carcinógenos
ou antecedentes de carcinoma oral de célula
escamosa primário,bem
co-mo é
pouco
recomendável ouso de PRP em fumantes,
alcoólatras,ou ambos, os quais
DI
SCUSSÃ
O
3.1 Considerações
iniciais0
plasma rico emplaquetas
(PRP)é
uma fonteautóloga
de fatores de crescimento, que pode ser obtido através doseqüestro
e
concentração
de plaquetas porcentrifugação
de gradiente de densidade em um equipamento deautotransfusão
caroe
impossível
de utilizar emconsultório odontológico,
o
qual separao
sangue em plasma rico em plaquetas (PRP), plasma pobre emplaquetas
(PPP)e
células
do sangue. (MARX et al.,1998;
MARX,1999; KASSOLIS;
ROSEN; REYNOLDS,2000;
ROSENBERG;
TOROSIAN, 2000; SHANAMAN; FILSTEIN; DANESH-MEYER,
2001).
Umavariação
deste procedimentoé
a coleta de sangue nopré-operatório
emtu-bos
tipovacutainer,
quesão
submetidos a1
ou2 centrifugações
em mini-centrifugas(ANITUA, 1999; VENTURELLI, 1999; SONNLEITNER; HUEMER;
SULLIVAN,2000; LANDESBERG;
ROY; GLICKMAN,2000;
KIM et al.,2002; ROBIONY
et al.,2002).
Após
aobtenção
do PRP, esteé
combinado com produtosativadores
capazes de produzir um gel,o
qualé
misturado ao material de enxerto escolhido pelo profissional.Do ponto de vista
hematológico,
o
termo concentrado de plaquetas (PC)é
usado em hematologia para denotar umaconcentração
de plaquetas maior do que1m1411
e é
sinônimo
de plasma rico em plaquetas (PRP)(LOZADA
et al.,2001).
No momento de uma
injúria
a membrana da plaqueta se une a parede vascular(adesão)
e
as plaquetas se unem entre si(agregação)
através dasglicoproteínas.
Aativa-
cão
(degranulação)
das plaquetas pode dar-se por mecanismosmecânicos
ouquímicos,
seja pelaadesão
daplaqueta
aocolágeno
ou a outros componentes dosubendotélio
ou pelapresença
detrombina,
estimulandoo
recrutamentoe
ativação
de plaquetascircun-
dantes.
Após
ativadas, as plaquetas expulsamgrânulos
a de suasorganelas
dearmaze-
namento
que contém os fatores de crescimento (MARTINEZ-GONZALEZ et al.,2002).
De maneira geral, os fatores de crescimento atuam em
nível
de membranacelu-
lar
através de receptoresespecfficos,
que iniciam no citoplasma uma atividade de rotas especificas detransdução
de sinais,que
depende do tipo de célulae
do fator decresci-
mento,
pois diferentes fatores podem produzir diferentes efeitos numa mesma célula.necessitando a chegada de um novo sinal para voltar a dividir-se (MARTINEZ-GONZALEZ et al., 2002).
A terapêutica do PRP fundamenta-se na aceleração e amplificação dos efeitos dos fatores de crescimento de modo a iniciar uma atividade nas células ósseas indife-renciadas de forma mais completa do que normalmente ocorreria (MARX, 1999).
Os principais fatores de crescimento encontrados no PRP são: o PDGF- Fator de Crescimento Derivado das Plaquetas; o TGF-I31 e 132- Fator de Transformação do Crescimento e o IGF-I - Fator de Crescimento Similar à Insulina. Sabe-se que além destes existem muitos outros fatores de crescimento no PRP, porém ainda não descobertos ou pouco citados na literatura como o VEGF (fator de crescimento endotelial vascular), EGF (fator de crescimento epidérmico), ECGF (fator de crescimento celular epitelial) e bFGF (fator de crescimento fibroblastic° básico).
O PDGF possui 3 formas diméricas (PDGF-AA, PDGF-BB e PDGF-AB) mas somente PDGF-AB e PDGF-BB estão presentes nas plaquetas. E o primeiro fator de crescimento a chegar na ferida e é mitogênico para células mesenquimais indiferencia-das, promove a angiogenese e quimiotaxia de macrófagos e outras células.
Os TGF-I3s existentes no PRP são o TGF-131 e TGF-I32, que estão ligados com a cicatrização do tecido conjuntivo e ósseo, respectivamente. 0 TGF-P promove a dife-renciação das células para osteoblastos (morfogênese) e também tem efeito mitogênico sobre elas e é quimiotatico para outras células, tornando o reparo auto-sustentável.
O IGF promove o anabolism° celular (as células que já foram atraidas, diferen-ciadas e proliferadas vão manter o tecido ósseo em atividade), aumenta a osteogênese e acelera a deposição óssea.
Podemos afirmar, de forma simplificada, que o tempo de vida da plaqueta na fe-rida e a ação direta de seus fatores de crescimento é em torno de 5 dias e que o PDGF atrai os macrófagos e, assim que a influência dos macrófagos enfraquece, os fatores de crescimento liberados pelos macrófagos e fatores angiogênicos assumem. Posteriormen-te as células mãe secretam TGF-f3 e em 4 semanas o macrófago deixa o enxerto que agora é auto-sustentado mesmo que imaturo. A maturação do enxerto ósseo desorgani-zado em osso maduro depende da ação das IGFs e das proteínas morfogenéticas ósseas (MARX et al, 1998; MARX, 1999).
Para permitir a
máxima concentração
de plaquetas por unidade de volume
é
im-portante analisar
a velocidade de
rotação
da centrifuga, a qual depende da centrifuga, do
material da bolsa
e
do volume coletado em cada bolsa
(SCARSO
FILHO et al.,
2001).
Porém, para analisar a velocidade da
centrifuga,
as taxas de
centrifugação
em
rpm
são inválidas,
pois a
força G
durante a
centrifugação é o
fator principal de
influen-cia e o
mesmo
é
obtido em
função
da forma
e tamanho
do recipiente (raio da
centrifuga)
(MARX,
2000).
Landesberg;
Roy; Glickman
(2000)
avaliaram
o
enriquecimento de plaqueta com
base na variação da
força G e
tempo de centrifugação, onde, na primeira
centrifugação,
o
enriquecimento
ótimo
das plaquetas foi alcançado com
200 G
por
10
min. Na segunda
centrifugação,
a
força
foi avaliada utilizando um intervalo de tempo de
10
min onde
tanto
200 G
como
250 G
obtiveram um
enriquecimento
de plaquetas em
200 %. Forças
acima de
250 G
resultaram em uma bolinha de plaqueta
e
tempo menor que
5
min
fa-lhou
em alcançar
qualquer
enriquecimento significativo das plaquetas.
importante fazer uma
avaliação médica
criteriosa do paciente antes de
subme-te-lo
a esta técnica visto que a contagem de plaquetas
e o conteúdo
dos fatores de
cres-cimento
no PRP dependem, além da técnica usada para a
obtenção,
da condição
bioló-gica
do doador,
que
pode ser um fator determinante na
composição
do PRP
e
nos efeitos
biológicos
observados. A contagem de plaquetas do sangue total pode ser usada como
uma
provável
estimativa grosseira da contagem de plaquetas a ser produzida no PRP
(WEIBRICH
et al.,
2002).
Para Marx
(2000),
um concentrado de PRP deve se aproximar de
400 % (4x)
da
contagem periférica, mas indices
10 x
acima
(1000 %)
da contagem inicial foram
atin-gidos
no trabalho de
Kassolis;
Rosen; Reynolds
(2000).
Por outro lado,
Landsberg;
Roy; Glickman
(2000)
atingiram somente
200 %,
provavelmente pelo fato de terem
considerado como PRP
50 %
do plasma obtido,
quando
normalmente esta quantidade
é
avaliada visualmente pela diferença de cor do PRP
e
PPP ou se considera em
torno
de
20 %
a
30 %
do fundo do tubo como sendo PRP.
0
PRP obtido através de um separador celular em
laboratório especifico
ou em
nível
hospitalar, num processo
o
qual apenas
o
PRP
é
retirado do paciente
e
os demais
componentes
são
devolvidos ao seu corpo
é
denominado
plasmaférese (SONLEITNER;
HUEMER;
SULLIVAN;
2000).
UFSC
O./33
linga; Janssen (2002) em animais. Rosenberg
e
Torosian (2000) relataram a devoluçãosomente do PPP para minimizar qualquer depleção do volume sangUineo no paciente. Por outro lado Kassolis; Rosen; Reynolds (2000) acreditam que a tecnologia que permite a utilização de pequenas quantidades de sangue, ao evitar a necessidade de
rein-fusão de células vermelhas no paciente, minimiza os riscos associados.
Marx et al. (1998) obtiveram
o
PRP por meio de um aparelho de autotransfusãoque inicia com uma velocidade de centrifugação de 5600 rpm
e
diminui para 2400 rpm para permitir uma separação precisa do PRP das células vermelhas do sangue. Amostras de PRP que foram submetidas à contagem de plaquetas atingiram 338 % sobre aconta-gem de plaquetas do sangue inicial.
Weibrich et al. (2002) também usaram esta técnica
e
obtiveram a contagem de plaquetas no PRP aproximadamente 5 x maior que a contagem de plaquetas no sangue inicial. Técnica semelhante foi usada por Shanaman; Filstein; Danesh-Meyer (2001),que fizeram a coleta até
que
aconcentração
desejada deplaquetas
atingisse 3.000.000 plaquetas/pl.Kassolis; Rosen; Reynolds (2000) coletaram uma quantidade bastante signi
fi
ca-tiva (1000 a 2500 ml) de sangue em 15 pacientes parao
processo de aférese para obter50 a 150 cc de PRP
e
mesmo assim exame laboratorial posterior a cirurgia demonstrou medidas hematológicas dentro das variações normais. A análise do PRP indicou um aumento de 3 a 10 vezes acima dosníveis
séricos pré-cirárgicos.Lozada et al. (2001) apresentaram 2 métodos de processamento de sequestro de plasma: a DIDECO Compact Adavanced (DCA)
e o
Harvest SmartPReP. A DCAtam-bém
é
uma máquina de autotransfusão, enquantoo
Harvest Smart PrePé o
método maisrecente de processamento de PRP, relativamente simples de operar, consiste de um
mi-croprocessador
e
centrifuga automatizada, somente capaz de produzir PRP,o
qual émisturado com
o
ativador via seringa dupla especial que mistura igualmenteo
PRP mistura de cloreto de calcio/trombina.Rosenberg
e
Torosian (2000) utilizaram uma bolsa de transferência de 450 cc ondeo
sangue foi coletadoe
transferido para a centrifuga com uma velocidade de 5600rpm
e
depois 2400 rpm para obter um concentrado de plaquetas de 30 a 40 cc.Scarso Filho et al. (2001) também utilizaram bolsa coletora, porém trata-se de uma tripla bolsa coletora com volume total de 440 a 460 ml, centrifugada a 2200 rpm por 5 min. Em seguida
o
lacre que separa a primeira bolsa da segundaé
rompidoe o
por 10 mm e agora o PPP é extraído para a última bolsa, deixando na segunda
aproxi-madamente 70 ml de PRP.
Quando partimos para análise de protocolos de obtenção de PRP em nível
ambu-latorial a variabilidade de técnica é muito ampla.
Anitua (1999) coletou de 10 a 20 ml de sangue e fez uma única centrifugação a
160 G por 6 min. Após a separação do sangue o PRP foi considerado como sendo a
por-ção que ficou no meio do tubo. Porém, não foi apresentado o enriquecimento das
pla-quetas no PRP obtido com esta técnica.
Venturelli (1999) colheu 16 ml de sangue e também fez uma centrifugação (de
800 a 1000 rpm por 15 min) e após a separação o PRP representava aproximadamente
20 % do volume. Com esta técnica obteve 340 % de aumento na contagem de plaquetas
do PRP.
Sonnleitner; Huemer; Sullivan (2000) colheram o sangue e centrifugaram por 20
min a 1200 rpm (160 G) obtendo uma fração inferior opaca vermelha que é o
compo-nente celular sangUineo e uma fração superior amarelo pardo turva com plasma e
pla-quetas, chamada componente do soro. Todo o componente do soro e uma parte do
com-ponente celular sangUineo são pipetados em tubo estéril e submetidos à nova
centrifuga-cão por 15 min a 2000 rpm (400 G) e, após a remoção da parte superior amarela, a
subs-tância restante é o concentrado de plaquetas (PC).
Kim et al. (2002) e Aghaloo; Moy; Freymiller (2002) utilinram 2
centrifuga-ções em animais e obtiveram, respectivamente, 392 % e 730 % de enriquecimento.
3.3 Composição do PRP
A composição bioquímica do PRP inclui plasma (soro e fatores de coagulação),
leucócitos (que são responsáveis pela resistência a processos infecciosos, alergênicos ou
ambos) e plaquetas (SCARSO FILHO et al., 2001).
Após a primeira centrifugação, onde temos separado os 3 componentes
sanguí-neos (PRP, PPP e células), as maiores plaquetas mais recentemente sintetizadas e por
isso com grande atividade, são maiores e se misturam no milímetro superior das células
vermelhas do sangue e por isso esta camada (de 1 a 2 mm) deve ser incluída no PRP,
dando-lhe uma tonalidade palha (MARX et al., 1998; MARX, 1999; ANITUA, 1999;
VENTURELLI, 1999; LOZADA et al., 2001).
•
68.035
pardo-turva
(22.000
a
24.000
plaquetas),
6 mm
abaixo do limite superior
(37.000
a
45.000
plaquetas), dentro dos primeiros
6 mm
da
fração
inferior opaca vermelha
(90.000
plaquetas)
e9 mm
dentro da
fração
inferior opaca vermelha a
concentração
voltou a cair
(53.000
plaquetas),
demonstrando
que a maior
concentração
de plaquetas
foi na
porção
mais superior do componente celular,
oque justifica a
inclusãodesta
ca-mada
no PRP.
Apósa segunda centrifugação,
ocomponente amarelo apresenta
8000
a
11.000
plaquetas
e ocomponente vermelho (PC) indicou uma contagem que excedeu
2.000.000
de
plaquetas.
Portanto,
onúmero
de plaquetas aumentou significativamente
com duas
centrifugações quando
comparado com uma
centrifugação.
Na zona de
transição
da fase vermelha
(porção
superior) a
proporção
de
leucóci-tos
éalta
edeve ser usada nas misturas, pois os
leucócitos
também liberam fatores de
crescimento
(SONNLEITNER; HUEMER;
SULLIVAN,
2000).
Pelo fato de ocorrer alguma
retração
imediata do
coágulo,uma pequena
quanti-dade
de
liquido
parece
não
permanecer incorporada ao gel e, pelo fato deste fluido
apre-sentar quantidades
significativas de fator de crescimento, este também deve ser
adicio-nado
ao enxerto ao invés de descartado
(LANDESBERG;
ROY; GLICKMAN,
2000).
3.4 Produtos usados como anticoagulante
Quando
osangue
éretirado do vaso
eentra em contato com qualquer
superficie,
que não
oendotélio
do vaso, este inicia a
coagulação,
por isso,
quando
omesmo
école-tado,
os recipientes devem conter
anticoagulante
e,
quando
a técnica de
obtenção
for em
tubos,
ooperador deve
fazer
a
inversãodos tubos
várias
vezes para garantir que
osan-gue
nãoinicie a
coagulação.
0
produto mais usado como
anticoagulante
foi
ocitrato. Quando
o ácidoetile-nodiaminotetracético (EDTA)
foi utilizado como
anticoagulante,
embora consistentes
produções
mais altas de plaquetas (aproximadamente
2 x
mais) tenham sido atingidas
do que
quando
do uso do citrato, as plaquetas parece que foram danificadas. As
amos-tras anticoaguladas
com
EDTA
pareceram, através de
microscopia
de luz, estarem
im-perfeitas
ehouve
considerável
quantidade de debris presentes
(LANDESBERG;
ROY;
GLICKMAN,
2000).
de crescimento, porém sua estrutura terciária
é
alteradae
sua atividadee
efetividadeé
diminuída.
3.5 Processo de gelificacio do PRP
Para aplicar
o
PRP este deve ser misturado a um agente coagulante.A maior parte dos autores relatam
o
uso de cloreto de cálcio a 10 % com trombi-na bovitrombi-na para promover a gelfficação do PRP (MARX et al., 1998; MARX, 1999; SONNLEITNER; HUEMER; SULLIVAN, 2000; ROSENBERG; TOROSIAN, 2000; SHANAMAN; FILSTEIN; DANESCH-MEYER, 2001; KIM et al., 2002; AGHALOO; MOY; FREYMILLER, 2002; FENNIS; STOELINGA; JANSSEN, 2002).Anitua (1999)
e
Scarso Filho et al. (2001) utilizaram somenteo
cloreto decálcio
a 10 % associado ao osso aut6geno enquanto Robiony et al. (2002) utilizaram, além do cloreto decálcio
a 10 %, igual volume de Botropase.Kassolis; Rosen; Reynolds (2000) relataram a utilização de trombina autóloga produzida pela mistura de cloreto de cálcio a 10 % (33 ml) com uma parte do PRP (100 ml) que, ao coagular
e
ser espremido liberou trombina autóloga, a qual foi misturada ao PRP numa proporção de 1:4. Venturelli (1999) utilizou a mesma técnica, porém, cálcio gluconado (2 ml) foi utilizado como agente gelificador misturado com uma parte do PRP (4 a 5 ml) e, a trombina autóloga produzida, misturada ao PRP numa proporção de1:2.
Landesberg; Roy; Glickman (2000) utilizaram
o
cloreto de cálcio associado trombina bovinae
compararam ao cloreto de cálcio associado a um agente de gelifica-cão chamado ITA. Os coágulos foram similares em tamanhoe
consistência, maso
coá-gulo com cloretoe
trombina começou a retrair mais rapidamente.A trombina bovina efetua a polimerização da fibrina
e
causa a quebra das pla-quetas enquanto no cloreto decálcio o
fator XIII associado ao fibrinogénio produz o gelde plaquetas (SCARSO FILHO et al., 2001).
Porém,