i Universidade de Trás-os-Montes e Alto Douro
Neoplasias do Aparelho Reprodutor
em Animais de Companhia
Dissertação de Mestrado Integrado em Medicina Veterinária
- Versão definitiva -
Carolina Gonçalves Ribeiro
Orientadoras:
Professora Doutora Ana Celeste Andrade Martins de Carvalho Bessa Professora Doutora Rita Maria Payan Martins Pinto Carreira
iii Universidade de Trás-os-Montes e Alto Douro
Neoplasias do Aparelho Reprodutor
em Animais de Companhia
Dissertação de Mestrado Integrado em Medicina Veterinária
Carolina Gonçalves Ribeiro
Composição do júri:
Presidente: Professor Doutor Dario Joaquim Simões Loureiro dos Santos Arguentes: Professora Doutora Fernanda Aurora Gomes de Seixas Travassos
Professora Doutora Isabel Cristina Ribeiro Pires
Orientadora: Professora Doutora Ana Celeste Andrade Martins de Carvalho Bessa
iv Os fundamentos apresentados neste trabalho são da inteira responsabilidade da autora.
v AGRADECIMENTOS
Às minhas orientadoras, Professora Doutora Ana Celeste Andrade Martins de Carvalho Bessa e Professora Doutora Rita Maria Payan Martins Pinto Carreira, por terem aceite o meu pedido de orientação, pela transmissão de conhecimentos, pelo profissionalismo e pela pron-tidão que sempre demonstraram para comigo.
À Professora Doutora Maria do Anjos Pires e ao Professor Dr. Hugo Vilhena pela dispo-nibilização das imagens microscópicas para descrição dos casos clínicos e pelos esclareci-mentos durante a elaboração deste trabalho.
À equipa do Hospital Veterinário do Baixo Vouga que me acolheu de braços abertos desde o dia um e que sempre se mostrou disponível para ensinar sobre a profissão e sobre a vida.
Às minhas colegas de estágio, Joana, Oliveirinha, Francisca, Teresa, Evangelista e Va-nessa, pelo apoio, amizade, boa disposição e ensinamentos.
Aos meus pais, que no meio das dificuldades encontraram solução para que eu pudesse realizar o meu sonho de ser Médica Veterinária.
À Judite, pelas gargalhadas e apoio constante desde que comecei esta aventura.
À Adriana, que me acolheu como se filha fosse durante o meu estágio em Águeda.
Ao Daniel, pela paciência, por ser o meu suporte e por estar lá sempre.
vii RESUMO
Com a generalização de procedimentos cirúrgicos eletivos como a ovariohisterectomia e a orquiectomia, a ocorrência de neoplasias no aparelho reprodutor tem vindo a diminuir substancialmente na prática clínica.
Muitas vezes, o desenvolvimento e diagnóstico de neoplasia está limitado a animais em idade geriátrica, sendo, na maior parte dos casos, o diagnóstico feito quando o tumor atingiu dimensões substanciais ou é mesmo descartado em animais previamente ovariohisterectomi-zados ou orquiectomiovariohisterectomi-zados. Todavia, foram documentados casos de neoplasias com sede no trato reprodutor em animais muito jovens, assim como casos de tumores que se desenvolve-ram em estruturas do trato reprodutor remanescentes, pelo que deve ser uma patologia inclu-ída na lista de diagnósticos diferenciais de todos os animais, quando a situação assim o jus-tifica. Para além de tumores primários, os diversos órgãos pertencentes ao aparelho reprodu-tor podem também ser local de implantação de metástases.
O tempo de sobrevida após o diagnóstico tende a ser reduzido devido à conjugação de três fatores principais: uma idade avançada do animal, o tamanho considerável da massa neoplásica no momento do diagnóstico e um diagnóstico tardio. Por estes motivos, sublinha-se a importância de consultas de rotina e a implementação de consultas de geriatria mais regulares, nas quais se usarão meios imagiológicas correntes (como a ecografia e radiografia) para um diagnóstico mais precoce, um prognóstico mais favorável e uma vida com mais qua-lidade.
Nesta dissertação de mestrado foram compiladas informações de várias fontes biblio-gráficas sobre neoplasias do aparelho reprodutor, incidindo nas particularidades epidemioló-gicas, apresentação clínica e maneio clínico. Foram também descritos e discutidos três casos ilustrativos de neoplasias do aparelho reprodutor acompanhados durante o estágio curricular, os quais foi obtiveram um diagnóstico histopatológico: um caso de tumor das células da gra-nulosa do ovário de uma cadela, um caso de tumor das células de Leydig de um cão e uma situação de adenocarcinoma do endométrio em gata.
Palavras-chave: neoplasia; tumor; reprodução; células da granulosa ovárica; células de Leydig; adenocarcinoma do endométrio.
ix ABSTRACT
Elective surgical procedures such as ovariohysterectomy and orchiectomy have become more and more common, driving to a reduction in the prevalence of neoplastic changes in the reproductive tract.
Consequently, the development and diagnosis of a reproductive tract tumour mainly oc-curs in older animals. A neoplastic change of the reproductive tract is often diagnosed when the tumour has grown to reach a considerable size and may even be discarded on animals previously submitted to ovariohysterectomy or orchiectomy. However, cases of tumours of the reproductive organs in very young animals have been reported, as well as cases of tumours developing on remnants of reproductive organs, therefore this medical condition should be included in the list of differential diagnoses of every animal, when the situation justifies so. Oher than primary tumours, reproductive system can also be a site for metastases to implant. The life span after diagnosis is frequently short due to three main factors: the animal’s advanced age, the large size of the tumour at the time of the diagnosis and the typical late diagnosis. That is why regular check-up appointments are encouraged as well as frequent geriatric consultations and exams (ultrasound and radiography), to provide an earlier diagno-sis, a better prognosis and a life with more quality.
This dissertation aims to compile information from various sources, about neoplasias of the reproductive tract, exploring their epidemiological details, clinical presentation and clinical management. Here are also reported three cases (followed during the internship) that explore three different types of tumours, which were given a diagnosis via histopathologic exam: a granulosa cell tumour of a female dog, a Leydig cell tumour of a male dog, and a feline endo-metrial adenocarcinoma.
Key-words: neoplasia; tumour; reproduction; ovarian granulosa cells; Leydig cells; en-dometrial adenocarcinoma.
x ÍNDICE GERAL
Nota de responsabilidade do autor ... iv
Agradecimentos ... v
Resumo ... vii
Abstract ... ix
Índice geral ... x
Índice de figuras ... xiii
Índice de gráficos ... xv
Índice de tabelas ...xvii
Índice de abreviaturas, siglas e acrónimos ... xviii
I. Introdução ... 1
II. Revisão bibliográfica ... 3
A. Neoplasias do aparelho reprodutor masculino ... 3
A1. Neoplasias dos testículos ... 3
Tumor das células de Sertoli ... 4
Tumor das células de Leydig ... 6
Seminoma ... 8
Teratoma ... 10
A2. Neoplasias da próstata ... 11
Carcinoma prostático ... 11
A3. Neoplasias do pénis, prepúcio e escroto ... 15
Tumor venéreo transmissível ... 16
Tumores do osso peniano ... 19
B. Neoplasias do aparelho reprodutor feminino ... 23
B1. Neoplasias dos ovários ... 23
B1.1 Tumores com origem nos cordões sexuais e estroma ... 23
Tumor das células da granulosa ... 23
Luteoma ... 27
Tumor das células da teca ... 28
B1.2 Tumores com origem no epitélio ... 28
Adenoma papilar, cistadenoma papilar, adenocarcinoma papilar e cistadenocarci-noma papilar ... 29
B1.3 Tumores com origem nas células germinativas ... 32
Disgerminoma ... 32
xi
B2. Neoplasias do útero ... 36
B2.1 Tumores com origem no epitélio ... 37
Adenoma e adenocarcinoma do endométrio ... 37
B2.2 Tumores com origem mesenquimatosa ... 40
Leiomioma e leiomiossarcoma ... 40
B3. Neoplasias da vagina e vulva ... 42
Tumor venéreo transmissível ... 43
Leiomioma, leiomiossarcoma, fibroleiomioma e lipoleiomioma ... 43
Adenoma e adenocarcinoma ... 46
III. Objetivos do trabalho ... 49
IV. Materiais e métodos ... 51
V. Apresentação e discussão de casos clínicos ... 55
Caso clínico 1 – Neoplasia ovárica ... 55
Caso clínico 2 – Neoplasia testicular ... 63
Caso clínico 3 – Neoplasia uterina ... 70
VI. Conclusões ... 75
VIII. Referências bibliográficas ... 77
xiii ÍNDICE DE FIGURAS
Figura 1. Apresentação característica de síndrome de feminização associada a tumor das
células de Sertoli. ... 5
Figura 2. Testículo criptorquídeo de cão com tumor das células de Sertoli. ... 5
Figura 3. Imagem microscópica de tumor das células Leydig. ... 7
Figura 4. Imagem ecográfica de testículo de cão com seminoma. ... 8
Figura 5. Radiografia torácica de cão com metástases pulmonares decorrente de seminoma. ... 9
Figura 6. Imagem ecográfica de próstata neoplásica de cão. ... 13
Figura 7. Imagem microscópica de carcinoma prostático em gato macho. ... 14
Figura 8. Lesão proliferativa característica de TVT em pénis de cão. ... 17
Figura 9. Lesões de TVT no escroto e mucosa anal. ... 17
Figura 10. Imagem de citologia por aposição de lesões de TVT. . ... 18
Figura 11. Radiografia de pénis e prepúcio de cão com hemangiossarcoma. . ... 20
Figura 12. Uretrografia de contraste em cão com hemangiossarcoma. ... 21
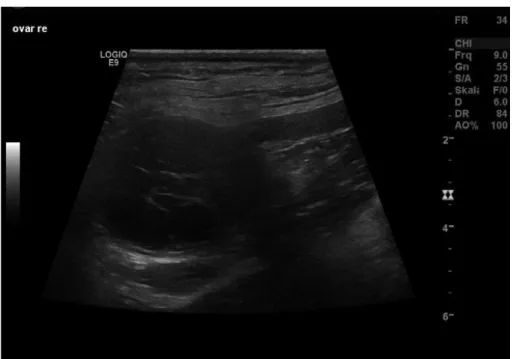
Figura 13. Imagem ecográfica de uma massa abdominal correspondente a tumor das células da granulosa em cadela. ... 25
Figura 14. Imagem macroscópica de um tumor das células da granulosa. ... 25
Figura 15. Imagem microscópica de tumor das células da granulosa canino. ... 26
Figura 16. Imagem macroscópica de luteoma felino. ... 28
Figura 17. Imagem macroscópica de adenocarcinoma papilar ovárico em cadela. ... 31
Figura 18. Imagem microscópica de adenocarcinoma papilar ovárico em cadela. ... 32
Figura 19. Imagem macroscópica de disgerminoma em cadela. ... 33
Figura 20. Imagem microscópica de disgerminoma em cadela. ... 34
Figura 21. Radiografia abdominal de cadela com teratoma e tumor das células da granu-losa. ... 35
Figura 22. Sinais clínicos de adenoma/adenocarcinoma do endométrio. ... 38
Figura 23. Imagem microscópica de adenocarcinoma do endométrio de gata. ... 39
Figura 24. Imagem ecográfica de útero com leiomioma em cadela. ... 41
Figura 25. Aspeto macroscópico característico de TVT. ... 43
Figura 26. Sinais clínicos associados a tumores vaginais e vulvares. ... 44
Figura 27. Massa exposta com localização na fossa clitoriana de uma cadela com carcinoma clitoriano. ... 47
xiv
Figura 29. Radiografia torácica do caso clínico 1. ... 58
Figura 30. Útero e ovários excisados por OVH. ... 59
Figura 31. Imagem macroscópica do ovário neoplásico. ... 59
Figura 32. Imagens ecográficas do caso clínico 2. ... 64
Figura 33. Testículos removidos por orquiectomia bilateral. ... 65
Figura 34. Hematoma escrotal pós-cirúrgico. ... 66
Figura 35. Imagens microscópicas do caso clínico 2. ... 67
Figura 36. Imagens microscópicas do caso clínico 3. ... 71
Figura 37. Invasão local por parte do adenocarcinoma endometrial. ... 72
Figura 38. A rotura da serosa uterina alerta para possível disseminação das células neoplá-sicas na cavidade abdominal. ... 72
xv ÍNDICE DE GRÁFICOS
Gráfico 1. Comparação da prevalência das patologias neoplásicas do aparelho reprodutor na espécie canina e na espécie felina com a prevalência encontrada durante o estágio curricular. ……….………….……….………….……. 53
xvii ÍNDICE DE TABELAS
Tabela 1. Discriminação de atividades e casos relativos ao aparelho reprodutor masculino acompanhados durante o estágio curricular e respetivas frequências relativas. ……..…... 51
Tabela 2. Discriminação de atividades e casos relativos ao aparelho reprodutor feminino acompanhados durante o estágio curricular e respetivas frequências relativas. ………... 52
xviii ÍNDICE DE ABREVIATURAS, SIGLAS E ACRÓNIMOS
μL – microlitro
μm – micrómetro / micra AINE – anti-inflamatório não esteroide BID – a cada 12 horas / duas vezes por dia bpm – batimentos por minuto
fL – fentolitro
H&E – Hematoxilina e Eosina
HVBV – Hospital Veterinário do Baixo Vouga IV – intravenosa / endovenosa
N – número
OVE – ovariectomia OVH – ovariohisterectomia PCT – procalcitonina
PDW – índice de dispersão plaquetária pg – picograma
PLQ – plaquetas PO – per os / via oral
RBC – Red Blood Cells / eritrócitos
RDW-CV – Red Blood Cell Distribution Width measured by Variantion Coefficient / índice de dispersão eritrocitária medido como coeficiente de variação
RDW-SD – Red Blood Cell Distribution Width measured by Standart Deviation / índice de dis-persão eritrocitária medido como desvio-padrão
rpm – respirações por minuto
SID – uma vez por dia / a cada 24 horas TVT – tumor venéreo transmissível
UTAD – Universidade de Trás-os-Montes e Alto Douro VPM – volume plaquetário médio
1 I. INTRODUÇÃO
Esta dissertação de mestrado resulta do Estágio Curricular de final do curso de Mes-trado Integrado em Medicina Veterinária da Universidade de Trás-os-Montes e Alto Douro (UTAD) realizado no Hospital Veterinário do Baixo Vouga (HVBV), em Águeda, Aveiro, o qual decorreu entre setembro de 2018 e fevereiro de 2019, num período total de seis meses.
O estágio consistiu num sistema de rotação entre internamento, consultas e cirurgias, nos quais foram realizadas diversas atividades de apoio ao internamento geral, infetocontagi-oso e cuidados intensivos (colocação de catéteres, colheita de sangue, realização de exames físicos gerais e dirigidos, administração de medicações, alimentações, passeios, banhos e escovagens), manutenção da limpeza e ordem das infraestruturas, realização de radiografias, apoio a ecografias e procedimentos ecoguiados, realização de procedimentos laboratoriais (análises sanguíneas, análises coprológicas, realização e análise microscópica de citologias e esfregaços), participação em cirurgias (ajudante de cirurgião, circulante, monitorização dos parâmetros vitais) e assistência e apoio em consultas de diversas áreas clínicas.
Ao longo destes seis meses foram também apresentadas várias a palestras dirigidas a médicos veterinários, enfermeiros veterinários e estagiários, as quais abarcaram diversos te-mas da realidade da prática clínica.
O trabalho aqui apresentado incide na área da medicina da reprodução, mais concreta-mente nas neoplasias com origem no aparelho reprodutor, as quais têm vindo a assumir baixa prevalência no mundo veterinário de animais de companhia, muito devido à generalização da prática de ovariohisterectomias e orquiectomias eletivas precoces.
3 II. REVISÃO BIBLIOGRÁFICA
A. Neoplasias do aparelho reprodutor masculino
A1. Neoplasias dos testículos
Os testículos são os órgãos do aparelho reprodutor masculino onde mais neoplasias se desenvolvem e o segundo órgão no geral mais propenso a desenvolver estas patologias em machos inteiros da espécie canina (Nødtvedt et al., 2011). Por oposição, são extremamente raros em gatos (Doxsee et al., 2006), o que se pode atribuir à prática de orquiectomia em idade pré-púbere, muito comum nesta espécie. Os testículos podem ser afetados de forma unilateral ou bilateral e podem inclusive ter mais de um tipo de tumor num testículo só, como descrito por Dhaliwal et al. (1999) e Outerbridge et al. (2016). A orquiectomia não é um método infalível para evitar neoplasias de natureza testicular, pois foram já descritos por Doxsee et al. (2006) casos de animais orquiectomizados com tumores primários atribuídos a uma origem testicular. Doxsee et al. (2006) também refere a possibilidade de transplantação de células neoplásicas durante a castração por rotura de estruturas anatómicas limitantes (como a túnica albugínea do testículo), pelo que o Médico Veterinário deve ter especial cuidado durante a orquiectomia, tanto de testículos neoplásicos como de testículos aparentemente normais.
Os três principais tipos de tumores testiculares são os tumores das células de Sertoli, os tumores das células de Leydig e os seminomas, os quais ocorrem com frequências relati-vas similares (Hayes & Pendergrass, 1976; Grieco et al., 2008). Apesar de poderem ocorrer, os teratomas testiculares são muito raros nas espécies canina e felina, sendo a informação disponível muito limitada (Miyoshi et al., 2001).
Os testículos criptorquídeos, em particular os alojados na cavidade abdominal, têm maior probabilidade de desenvolver neoplasias (Hayes & Pendergrass, 1976; Patnaik & Mos-tofi, 1993; Dhaliwal et al., 1999; Holst & Dreimanis, 2015; Stokowski et al., 2016; Bigliardi et al., 2019) e torsões do cordão espermático (Quartuccio et al., 2012; Stokowski et al., 2016). As neoplasias em testículos retidos são potencialmente mais agressivas que as que se de-senvolvem em testículos escrotais (Ciasca et al., 2015), pelo que está aconselhada a orqui-ectomia de testículos criptorquídeos, mesmo daqueles aparentemente livres de neoplasia.
4 Tumor das células de Sertoli
Os tumores das células de Sertoli são também apelidados de sertolinomas, tumores das células de sustentação e adenomas/adenocarcinomas tubulares (Benazzi et al., 2004). Estes tumores são comuns em testículos retidos mas raros em testículos escrotais. Pensa-se que raças de grande porte estejam mais propensas a desenvolver este tipo de neoplasia (Marshall, 2018). Estão referidas como raças predispostas o Boxer, o Weimaraner e o Pastor de She-tland (Hayes & Pendergrass, 1976). A idade média ao diagnóstico situa-se em torno dos 8,6 anos (Nødtvedt et al., 2011). É um tumor muito raro na espécie felina.
Os sinais clínicos que acompanham estas situações estão sobretudo associados à sín-drome de feminização (Figura 1), a qual acontece quando a massa tumoral é endocrinologi-camente ativa, produzindo e secretando estrogénio, e mais raramente, progesterona. O hipe-restrogenismo, que ocorre entre 20% (Benazzi et al., 2004) a 70% dos casos (Quartuccio et al., 2012), pode originar alopécia bilateral e simétrica dos flancos, tronco, abdómen, tórax, pescoço e/ou região perigenital e perianal, hiperpigmentação e liquenificação da pele, gine-comastia, galactorreia, prepúcio pendular e edematoso, eritema linear do prepúcio, atrofia do pénis, atrofia do testículo contralateral (em afeções unilaterais), doenças prostáticas (hiper-plasia benigna da próstata, meta(hiper-plasia escamosa da próstata ou quistos prostáticos), atração de machos, redução da líbido, disúria e adoção de postura feminina aquando da micção (Dha-liwal et al., 1999; Carreira et al., 2012; Quartuccio et al., 2012; Ciasca et al., 2015; Withers et al., 2016). A supressão da medula óssea faz também parte dos efeitos tóxicos que o estrogé-nio exerce no organismo e pode estar na origem de uma pancitopenia por aplasia medular, podendo levar o animal a casos extremos de anemia, leucopenia e trombocitopenia (Carreira et al., 2012). Já o hiperprogesteronismo está ligado a doença das glândulas adrenais (Hern-don et al., 2012). Para além destes sinais clínicos, poderá ser palpável uma massa tumoral a nível do abdómen ou do escroto.
Este tipo de tumor tem habitualmente apresentação unilateral (embora esporadicamente possa ser bilateral). À ecografia observa-se um testículo de diâmetro aumentado, possuindo forma globoide, com ou sem presença do mediastino testicular e de ecogenicidade hipo- a anecogénica (Johnston et al., 2001; Ciasca et al., 2015). É importante reforçar a ideia de que a ecografia serve o propósito de confirmar a presença de uma alteração testicular (a qual poderá ser potencialmente tumoral) e nunca o propósito de distinguir entre os tipos de tumores possíveis de existir no testículo. O diagnóstico final é sempre dado pela histopatologia.
5 A descrição macroscópica detalha muitas vezes um testículo aumentado em diâmetro (até 8 cm), lobulado e multinodular, de consistência firme, superfície de corte homogénea e de coloração branca a cinzenta (Figura 2) (Benazzi et al., 2004; Grieco et al., 2008; Carreira et al., 2012). Microscopicamente podemos visualizar um padrão difuso, trabecular ou intratu-bular, com células em paliçada, vacúolos citoplasmáticos de grandes dimensões, citoplasma pálido, abundante e eosinofílico, núcleos redondos a ovais e mitoses escassas (Doxsee et al., 2006; Grieco et al., 2008; Banco et al., 2010; Moreau & Scruggs, 2018). O padrão difuso está associado a malignidade (Benazzi et al., 2004). Podem ser visíveis também corpos de Call- -Exner (Banco et al., 2010; Carreira et al., 2012; Moreau & Scruggs, 2018).
Figura 1. Apresentação característica de síndrome de feminização associada a tumor das
cé-lulas de Sertoli. A) Alopécia do ventre, flancos e tórax, hiperpigmentação da pele e ginecomas-tia. B) Prepúcio pendular. Ambas as imagens foram extraídas de Ferreira et al. (2018).
Figura 2. Testículo criptorquídeo de cão com tumor das células
de Sertoli. A) Testículo aumentado em tamanho. B) A superfície de corte revelou uma massa homogénea de coloração esbranqui-çada. Ambas as imagens foram extraídas de Hong et al. (2011).
6 O tumor das células de Sertoli é geralmente benigno (Banco et al., 2010), pelo que a abordagem terapêutica consiste na remoção cirúrgica da massa neoplásica - orquiectomia, de preferência bilateral - após a qual todos os sinais ligados à síndrome paraneoplásica de-saparecerão. O prognóstico é bom na ausência de metastização (Johnston et al., 2001) mas esta pode ocorrer em até 15% dos casos (Herndon et al., 2012), afetando os linfonodos regi-onais (ilíacos, sublombares e inguinais), pulmões, fígado e/ou baço (Dhaliwal et al., 1999; Johnston et al., 2001; Holst & Dreimanis, 2015). Em casos malignos deve ser estabelecido um protocolo quimioterápico à base de cisplatina (Dhaliwal et al., 1999; Johnston et al., 2001; Carreira et al., 2012) ou com uma conjugação de vimblastina, ciclofosfamida e metotrexato (Johnston et al., 2001). Deve ser mantido um controlo mais apertado nos cães com mielossu-pressão, e, se necessário, instituírem-se os tratamentos necessários (antibioterapia, transfu-são sanguínea, entre outros) (Marshall, 2018).
Tumor das células de Leydig
Também designados de tumor das células intersticiais, os tumores das células de Ley-dig originam-se nas células com o mesmo nome; são geralmente encontrados em testículos escrotais (Nødtvedt et al., 2011). Não parece haver predisposição racial para este tipo de neoplasia (Hayes & Pendergrass, 1976; Johnston et al., 2001), estando identificada uma pre-disposição com a idade do animal (Taniyama et al., 2001).
São, por norma, neoplasias que não manifestam sinais clínicos visíveis, pelo que a idade ao diagnóstico costuma ser avançada - média de 11 anos no cão (Theilen & Madewell, 1987; Ramos-Vara & Miller, 2009) - ou só são diagnosticadas post mortem. Pode ter apresentação unilateral ou bilateral (Grieco et al., 2008). Apesar da escassez de sinais clínicos, foram já relatados casos em que foi verificada síndrome de feminização (Mischke et al., 2002; Peters et al., 2003) ligada à atividade hormonal do tumor. Outras consequências advindas desta pa-tologia incluem doença prostática, hiperplasia e tumores das glândulas perianais e hérnias perineais, os quais estão relacionados com a produção exagerada de testosterona por parte do tumor em questão (Theilen & Madewell, 1987; Dhaliwal et al., 1999; Canadas et al., 2016). Quando descoberto in vivo, é detetado por palpação testicular, encontrando-se uma di-ferença de consistência entre testículos, estando o testículo neoplásico mais túrgido que o contralateral (em casos unilaterais). Como acontece com os outros tumores testiculares, a palpação não é dolorosa e a temperatura escrotal não está alterada (Lorenz & Cornelius, 1990). À ecografia testicular, observam-se áreas nodulares hipo- a hiperecogénicas dispersas no parênquima testicular normal (Burk & Ackerman, 1996; Green, 1996) mas o seu diagnós-tico definitivo só pode emitido após análise histopatológica.
7 Macroscopicamente são descritas como massas nodulares de pequena dimensão (de 1 a 3 cm de diâmetro), arredondadas, bem delimitadas, de consistência mole e de coloração que varia do amarelo ao acastanhado, com superfície de corte abaulada (Johnston et al., 2001; Grieco et al., 2008). Ao microscópio observa-se uma proliferação difusa de células dis-postas em cordões separados por tecido fibroso (padrão sólido-difuso) (Figura 3) ou um pa-drão quístico vascular (Doxsee et al., 2006; Banco et al., 2016). Estas células podem ser redondas a poliédricas, bem delimitadas, com citoplasma abundante, eosinofílico e finamente vacuolizado (Doxsee et al., 2006; Grieco et al., 2008; Farjanikish & Oryan, 2017). Os respeti-vos núcleos são tipicamente redondos e variam da posição excêntrica à central. As figuras de mitose raramente estão presentes (Doxsee et al., 2006; Grieco et al., 2008).
Os tumores das células de Leydig são descritos como tumores geralmente benignos; se malignos, o potencial de metastização é reduzido (Peters et al., 2003; Hohšteter et al., 2014). Contudo, foram já relatados casos de tumores malignos com metastização à distância em cães (Togni et al., 2015; Canadas et al., 2016), nomeadamente nos linfonodos regionais (ilía-cos, sublombares e inguinais), pulmões, músculo e pele (Theilen & Madewell, 1987; Togni et
Figura 3. Imagem de corte histológico de testículo com tumor das células de Leydig. Hematoxilina
8 al., 2015; Canadas et al., 2016). O tratamento indicado é a orquiectomia bilateral que, quer pelo diagnóstico usualmente benigno, quer pelo baixo potencial metastático em caso de ma-lignidade, é considerada suficiente, não estando sequer descritos protocolos quimioterápicos dirigidos para esta patologia (Canadas et al., 2016). Pelos motivos anteriormente descritos, o prognóstico é excelente, na maioria dos casos (Bostock & Owen, 1975).
Seminoma
As neoplasias da linha germinativa testicular têm tipicamente apresentação unilateral (Takiguchi et al., 2001; Lucas et al., 2012) e desenvolvem-se mais em testículos retidos que em escrotais (Nødtvedt et al., 2011; Lucas et al., 2012). O Pastor Alemão e Boxer têm sido apontados como raças predispostas (Hayes & Pendergrass, 1976; Johnston et al., 2001) e a idade média ao diagnóstico está estimada entre 10 a 11 anos (Johnston et al., 2001).
Os seminomas produzem poucos sinais clínicos, no entanto pode ser notada assimetria testicular, detetável à palpação testicular, com o aumento das dimensões testiculares e es-crotais. Podem também originar sinais clínicos associados à síndrome paraneoplásica de fe-minização (Kim & Kim, 2005; Dugat et al., 2015).
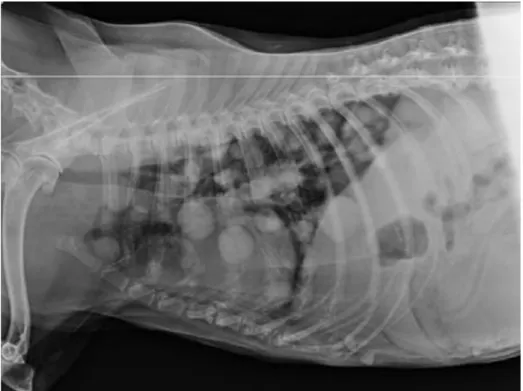
A imagem ecográfica de um seminoma (Figura 4) é variável, podendo existir nódulos hipoecogénicos no parênquima testicular normal (Lucas et al., 2012) e perda do mediastino testicular (Takiguchi et al., 2001). A radiografia torácica pode ser usada como método de pes-quisa de metástases (Figura 5).
Figura 4. Imagem ecográfica de testículo de cão. Alteração
completa da normal arquitetura testicular. Imagem gentil-mente cedida pela Professora Doutora Rita Payan Carreira, Departamento de Medicina Veterinária, Universidade de Évora.
9 Os seminomas apresentam-se como massas de dimensões que variam entre 1 e 10 cm de diâmetro e que na sua superfície de corte são homogéneas ou lobuladas, de coloração que varia do rosa ao cinzento ou castanho avermelhado (Johnston et al., 2001; Takiguchi et al., 2001). Podem ter uma apresentação microscópica intratubular ou difusa ou uma mistura de ambas (Grieco et al., 2008; Hohšteter et al., 2014). No padrão intratubular as células proli-feram confinadas no túbulo seminífero enquanto no padrão difuso as células podem proliferar em cordões ou em agregados isolados não estando restringidas aos túbulos seminíferos (Be-nazzi et al., 1995). As células observadas nestas neoplasias tendem a ser redondas e gran-des, com citoplasma anfofílico, por vezes vacuolizado e núcleo redondo a oval. As figuras de mitose são comuns nestas populações neoplásicas (Taniyama et al., 2001; Owston & Ramos-Vara, 2007; Grieco et al., 2008).
Os seminomas são neoplasias geralmente localizadas, benignas ou malignas de baixo potencial metastático (Hohšteter et al., 2014), pelo que em caso de doença localizada, a or-quiectomia bilateral é o tratamento de eleição e tido como curativo (Dugat et al., 2015). No entanto, metástases podem ser encontradas em até 10% dos casos (Takiguchi et al., 2001), nomeadamente nos linfonodos (ilíacos, mesentéricos, inguinais, sublombares), escroto, pul-mões, fígado, baço, rim, pâncreas, peritoneu, cérebro, olho, pele, língua, palato mole, tra-queia, pericárdio e osso (Dhaliwal et al., 1999; Takiguchi et al., 2001; Lucas et al., 2012; Dugat et al., 2015). Estão recomendados protocolos envolvendo radioterapia (Johnston et al., 2001;
Figura 5. Radiografia torácica de cão. Padrão pulmonar nodular, consistente
com metástases pulmonares decorrente de seminoma. Extraído de Kumar et
10 Takiguchi et al., 2001) e quimioterapia com carboplatina ou junção de bleomicina, cisplatina e etoposido (Dugat et al., 2015), cisplatina isolada (Johnston et al., 2001) ou ainda vincristina e ciclofosfamida (Lucas et al., 2012). O prognóstico é usualmente bom, já que os seminomas tendem a ser benignos (Hohšteter et al., 2014).
Teratoma
Os teratomas testiculares pertencem ao grupo dos tumores do testículo com origem nas células germinativas e são extremamente raros no cão e no gato (Moulton, 1978; Dhaliwal et al., 1999; Miyoshi et al., 2001; Bigliardi et al., 2019), pelo que há um número reduzido de literatura disponível. Nestas espécies, estes tumores são diagnosticados mais frequente-mente a partir dos 8 anos de idade, contudo, animais jovens podem ser também diagnostica-dos com teratoma testicular (Moulton, 1978; Miyoshi et al., 2001). É mais frequente encontrar teratomas em testículos criptorquídeos que em escrotais (Moulton, 1978). Não existe predis-posição racial (Bostock & Owen, 1975; Moulton, 1978), no entanto, existe a nível de género, sendo o ovário mais afetado que o testículo (Moulton, 1978; Miyoshi et al., 2001).
Os teratomas podem produzir sinais clínicos vagos como assimetria testicular, distensão abdominal, dor abdominal (por compressão de órgãos vizinhos) e ascite (Miyoshi et al., 2001; Bigliardi et al., 2019). Na radiografia abdominal, observa-se uma massa composta por tecidos com radiopacidade característica de tecidos moles, por vezes acompanhadas de áreas mais radiopacas, correspondentes a tecido mineralizado (osso ou dentes) (Johnston et al., 2001; Coggeshall et al., 2012). Na ecografia abdominal, a massa neoplásica pode apresentar um padrão sólido com ou sem componente quística (Moulton, 1978; Kennedy et al., 1998; Coggeshall et al., 2012). Na presença de tecido mineralizado, podem ser observados focos hiperecogénicos que provocam sombra acústica (Diez-Bru et al., 1998).
Macroscopicamente, as massas neoplásicas variam da forma esférica à forma irregular e podem possuir cápsula (Moulton, 1978). A superfície de corte apresenta normalmente áreas sólidas de coloração branca a cinzenta ou amarela e áreas quísticas de tamanho variável; podem ser compostas por gordura, pêlo e dentes (Bostock & Owen, 1975; Moulton, 1978). Ao microscópio podem ser identificados numerosos tecidos derivados de duas ou mais linhas germinativas embrionárias (endoderme, mesoderme e/ou ectoderme), sendo os mais comuns pêlo, osso e dentes (Nielsen & Lein, 1974). Podem, no entanto, também ser encontrados te-cidos do sistema nervoso, cartilagem, epitélio glandular, gordura, pele, entre outros, em várias fases de maturação (Moulton, 1978; Miyoshi et al., 2001).
O tratamento escolhido é a remoção da massa neoplásica através de orquiectomia e o prognóstico é favorável, já que os teratomas tendem a ser benignos (Bostock & Owen, 1975;
11 Moulton, 1978; Patnaik & Nafe, 1980). No entanto, situações de tumores malignos foram des-critas, sendo encontradas metástases nos linfonodos regionais, omento e peritoneu (Patnaik & Mostofi, 1993; Miyoshi et al., 2001).
A2. Neoplasias da próstata
As neoplasias prostáticas não são comuns no cão, representando 0,2 a 0,6% de todos os tumores caninos (Johnston et al., 2001; Ravicini et al., 2018; Ros et al., 2018) e 5% (Do-mosławska et al., 2018) a 13% (Fonseca-Alves et al., 2018a) de todas as patologias prostáti-cas caninas. São, por sua vez, muito raras no gato (Caney et al., 1998; Johnston et al., 2001; Tursi et al., 2008). A neoplasia prostática diagnosticada com maior frequência é o carcinoma (Bennett et al., 2018). Podem existir outros tipos de tumores com origem no tecido mesenqui-matoso da próstata, mas são ainda mais raros; entre eles incluem-se o leiomioma, o fibroma e o sarcoma (Hall et al., 1976). Qualquer que seja o seu tipo, um tumor prostático tem sempre mau prognóstico, não só pelo comportamento agressivo, mas sobretudo porque é tipicamente diagnosticado muito tardiamente (Bennett et al., 2018).
Carcinoma prostático
Os tumores epiteliais que se desenvolvem na próstata podem ser, por ordem decres-cente de frequência, o adenocarcinoma prostático (com origem nas células basais e ductais do epitélio glandular), o carcinoma das células de transição, o carcinoma das células escamo-sas (com origem no trato urinário inferior e que podem atingir a próstata por continuidade anatómica) e o carcinoma indiferenciado (Caney et al., 1998; Teske et al., 2002; Bennett et al., 2018; Domosławska et al., 2018). Os tumores primários da próstata são menos frequentes do que os tumores do trato urinário, tendo sido referida uma incidência de 0,2 a 0,6% (Griffin et al., 2018).
Apesar de terem sido descritos mais casos de adenocarcinoma prostático afetando a espécie canina existem também alguns casos descritos em gatos (Caney et al., 1998; LeRoy & Lech, 2004; Tursi et al., 2008; Zambelli et al., 2010). A média de idade ao diagnóstico é de 10 anos para o cão e o intervalo de idades para o gato situa-se entre os 6 e 12 anos (Tursi et al., 2008). Não existe predisposição racial (Hall et al., 1976; Johnston et al., 2001) mas parece haver predisposição no que concerne ao estatuto reprodutor, sendo mais comum em machos castrados (Johnston et al., 2001; Teske et al., 2002; Ravicini et al., 2018).
12 Os tumores da próstata podem ser difíceis de diferenciar de outras afeções prostáticas (como hiperplasia prostática benigna, a doença prostática mais comum nos cães) pela seme-lhança dos sinais clínicos (Pinheiro et al., 2017). Clinicamente, o animal pode manifestar disú-ria, hematúdisú-ria, estrangúdisú-ria, polaquiúdisú-ria, tenesmo, disquezia, obstipação e o ato de lamber excessivamente a região perineal (Hall et al., 1976; Caney et al., 1998; Johnston et al., 2001; LeRoy & Lech, 2004; Ravicini et al., 2018). Outros sinais clínicos podem estar presentes caso haja metastização, incluindo anorexia, vómito, perda de peso, letargia, tosse, dispneia, fra-queza dos membros posteriores e intolerância ao exercício (Hall et al., 1976; Tursi et al., 2008; Fonseca-Alves et al., 2015; Ravicini et al., 2018). Ao toque retal, verifica-se a presença de uma massa globoide em localização ventral ao reto, com um aumento marcado das dimen-sões prostáticas (prostatomegália), com lóbulos simétricos ou assimétricos, margens irregu-lares e consistência firme (Caney et al., 1998; Johnston et al., 2001; Bennett et al., 2018). A palpação pode ser dolorosa ou indolor (Johnston et al., 2001; Zambelli et al., 2010).
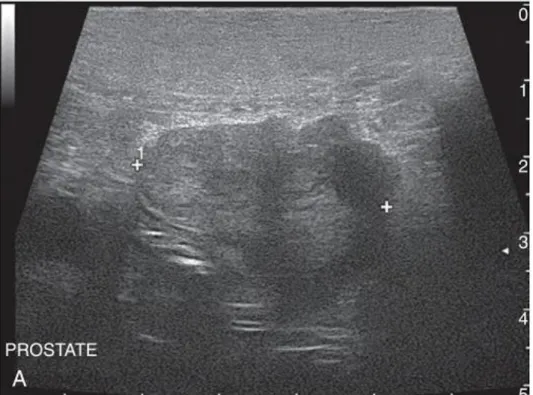
A radiografia, para além de poder permitir descartar metástases (Johnston et al., 2001; Ravicini et al., 2018), permite evidenciar uma massa de grandes dimensões no local anató-mico da próstata, de radiopacidade característica de tecido moles que pode deslocar dorsal-mente o cólon ou o reto, ocluindo-lhes também o lúmen (Caney et al., 1998; LeRoy & Lech, 2004; Zambelli et al., 2010). É também característico observar-se a bexiga distendida e de difícil esvaziamento (LeRoy & Lech, 2004). Por vezes são visíveis focos mais radiopacos, correspondentes a mineralização (Johnston et al., 2001). Pode ser realizada uretrografia re-trógrada para revelar a extensão local do tumor, contornos prostáticos e irregularidades da uretra prostática, como obstrução desta (Caney et al., 1998; Johnston et al., 2001; LeRoy & Lech, 2004). Na ecografia prostática (Figura 6), observa-se uma massa de dimensões consi-deráveis que normalmente substitui o parênquima prostático na sua totalidade e o órgão ad-quire contornos irregulares mas definidos (Johnston et al., 2001; LeRoy & Lech, 2004; Zam-belli et al., 2010; Ravicini et al., 2018). A ecotextura do parênquima tende a ser heterogénea, alternando áreas hipoecogénicas com focos anecogénicos e/ou hiperecogénicos, os quais correspondem a mineralização do parênquima (Caney et al., 1998; Johnston et al., 2001; Zambelli et al., 2010; Ravicini et al., 2018; Ros et al., 2018). A bexiga está muitas vezes dila-tada (Zambelli et al., 2010).
13 À inspeção visual macroscópica, a massa neoplásica tende a ser mais ou menos esfé-rica, simétrica ou assimétesfé-rica, bem circunscrita e de consistência variável (firme, mole ou friá-vel) (Caney et al., 1998; Zambelli et al., 2010). A superfície de corte evidencia lobulação mais ou menos regular e coloração branca ou creme (Zambelli et al., 2010).
O fluido prostático colhido por lavagem prostática ou as citologias aspirativas com agu-lha fina do parênquima prostático alterado (Johnston et al., 2001) demonstram células neo-plásicas, mas o diagnóstico final é dado pelo exame histopatológico (Domosławska et al., 2018; Ros et al., 2018). Existem quatro padrões histológicos principais: o acinar/ductal, o pa-pilar alveolar, o organoide/em roseta e o pouco diferenciado, para além dos padrões mistos (Hall et al., 1976) (Figura 7). O padrão mais comum é o acinar ou ductal (Fonseca-Alves et al., 2018a): é composto por uma ou duas camadas de células epiteliais pequenas que formam ácinos de diferentes tamanhos no citoplasma, separados por estroma fibroso. As células são poligonais, de citoplasma eosinofílico escasso e núcleos redondos a ovais (Zambelli et al., 2010). Ocasionalmente, estas podem também ser encontradas aleatoriamente no estroma. No centro dos ácinos são visualizadas quantidades variadas de mucina. Este padrão é carac-terizado por hiperplasia fibromuscular intensa, o que confere ao tumor uma aparência cirrótica (Hall et al., 1976; Palmieri & Riccardi, 2013; Bongiovanni et al., 2018). Podem ser também encontradas áreas de necrose (Bongiovanni et al., 2018). No padrão papilar alveolar, são
Figura 6. Imagem ecográfica de próstata neoplásica de cão em varrimento
transversal mostrando assimetria entre lóbulos e um parênquima heterogéneo. Comprimento entre cursores de 3,27 cm. Extraído de Mattoon & Nyland (2014).
14 visíveis células epiteliais projetando-se para espaços que se assemelham a alvéolos redon-dos, ovais ou quísticos, os quais estão rodeados por tecido conjuntivo muitas vezes invadido por células neoplásicas. As células neoplásicas são redondas a ovais, com citoplasma eosi-nofílico, abundante e por vezes granular. Os núcleos estão muitas vezes deslocados para a periferia da célula e têm forma redonda a oval. Por vezes, estão presentes inclusões proteicas (localizadas no citoplasma celular) (Hall et al., 1976), assim como áreas de necrose e de he-morragia (Tursi et al., 2008; Bongiovanni et al., 2018).
Já no padrão organoide/em roseta, são evidentes alvéolos com proliferações celulares sólidas ou que se dispõem em rosetas. As células são normalmente pequenas, cuboides a colunares, de margens bem delimitadas, com citoplasma eosinofílico abundante e com nú-cleos de tamanho médio a grande, redondos a ovais, localizados na porção central da roseta (Hall et al., 1976; Ros et al., 2018). O estroma pode ser invadido por células neoplásicas e áreas de necrose na parte central do tumor são comuns (Hall et al., 1976; Palmieri & Riccardi, 2013). Por fim, o carcinoma pouco diferenciado (também designado por padrão sólido) (Bon-giovanni et al., 2018) é caracterizado por células neoplásicas distribuídas difusamente no
es-Figura 7. Imagem de corte histológico de carcinoma prostático em gato. H&E.
15 troma fibrovascular de forma individual, em sincícios, cordões ou agregados isolados. As cé-lulas variam do fusiforme à forma redonda com núcleos pequenos e vesiculados. São eviden-tes muitas vezes figuras de mitose e invasão linfática, vascular e perineural (Hall et al., 1976).
O tratamento das neoplasias da próstata costuma ser paliativo e não curativo (Johnston et al., 2001). Pode ser realizada orquiectomia bilateral mas esta pode não surtir os efeitos desejados, uma vez que neoplasias prostáticas podem tornar-se androgénio-independente (Johnston et al., 2001; Teske et al., 2002; LeRoy & Lech, 2004; Fonseca-Alves et al., 2018b; Ravicini et al., 2018; Rivera-Calderón et al., 2019). Outra opção cirúrgica é a prostatectomia (parcial ou radical) mas este procedimento é fonte de variadas complicações pós-cirúrgicas que afetam particularmente o trato urinário (principalmente incontinência urinária) (Johnston et al., 2001; Bennett et al., 2018). Foram ensaiados tratamentos quimioterápicos com carbo-platina, doxorrubicina (Fonseca-Alves et al., 2015), mitoxantrona, epirrubicina, vimblastina e clorambucilo (Ravicini et al., 2018), mas não se conseguiu remissão total em qualquer um dos ensaios. A radioterapia é também uma opção de tratamento mas está ainda pouco estudada (Bennett et al., 2018; Ravicini et al., 2018).
Os carcinomas da próstata são tumores de prognóstico reservado a mau, devido ao seu comportamento agressivo e invasivo e à elevada frequência de metastização (Bennett et al., 2018; Fonseca-Alves et al., 2018a; Rivera-Calderón et al., 2019), que ocorre em 40 a 80% dos casos (Ravicini et al., 2018). A metastização ocorre principalmente nos linfonodos ilíacos, ossos e pulmões (Hall et al., 1976; Teske et al., 2002; LeRoy & Lech, 2004; Fonseca-Alves et al., 2018b; Ros et al., 2018) mas também nos linfonodos sublombares e inguinais, uretra, bexiga, cólon, reto, fígado, baço, pâncreas, mesentério, coração, rim, glândulas adrenais e cérebro (Hall et al., 1976; Caney et al., 1998; Johnston et al., 2001; Tursi et al., 2008; Bennett et al., 2018; Ros et al., 2018). Infelizmente, o tempo de sobrevida após diagnóstico é diminuto (Fonseca-Alves et al., 2015; Bennett et al., 2018) e a maior parte dos animais são eutanasia-dos pela qualidade de vida pobre (Palmieri & Riccardi, 2013; Bennett et al., 2018; Rivera-Calderón et al., 2019).
A3. Neoplasias do pénis, prepúcio e escroto
O pénis, o prepúcio e o escroto são locais de desenvolvimento neoplásico improváveis (Marolf et al., 2006; Kustritz & Fick, 2007) exceto no que concerne ao tumor venéreo trans-missível (TVT). Neoplasias na genitália externa de gatos são praticamente inexistentes (Johnston et al., 2001). O tumor peniano/prepucial com maior expressão na literatura dispo-nível é de longe o TVT (Mirkovic et al., 2004; Furtado et al., 2015; Jenkins et al., 2017).
16 Outros tumores são raros e incluem o hemangiossarcoma (Burchell & Kirberger, 2014), osteossarcoma (Peppler et al., 2009), condrossarcoma, fibroma, fibrossarcoma, fibropapi-loma, papiloma escamoso, adenocarcinoma, linfoma e mastocitoma (Hall et al., 1976; Mirkovic et al., 2004; Marolf et al., 2006; Kustritz & Fick, 2007; Furtado et al., 2015; Jenkins et al., 2017). Os tumores do escroto são raros; num estudo retrospetivo conduzido por Trappler et al. (2014), estes representavam apenas 0,4% da amostra total. Foram diagnosticados mastoci-tomas, melanocimastoci-tomas, melanomas, hamartomas vasculares, hemangiossarcomas, hemangi-omas e histiocithemangi-omas (Trappler et al., 2014).
Tumor venéreo transmissível
O TVT é também designado por sarcoma de Sticker, sarcoma venéreo transmissível, granuloma venéreo transmissível, sarcoma infecioso e condiloma canino (Eze et al., 2007). É um tumor característico de populações de cães sem controlo de atividade reprodutora, sobre-tudo cães errantes (Tella et al., 2004; Varughese et al., 2012; Hantrakul et al., 2014; Komne-nou et al., 2015; Vural et al., 2018) e afeta ambos os sexos (Tella et al., 2004; Varughese et al., 2012; Komnenou et al., 2015; Vural et al., 2018). A transmissão faz-se por transplantação de células neoplásicas viáveis em mucosas lesionadas (Booth, 1994; Albanese et al., 2006; Eze et al., 2007; Komnenou et al., 2015) através do coito ou outros hábitos sociais, como o ato de lamber ou cheirar áreas afetadas (Varughese et al., 2012; Komnenou et al., 2015) ou durante lutas (Trevizan et al., 2012). É mais comum em cães com idades compreendidas entre os 2 e 5 anos (Eze et al., 2007; Varughese et al., 2012; Komnenou et al., 2015) e sexualmente ativos, mas todos os cães são suscetíveis à infeção, independentemente do género, raça ou idade (Johnston et al., 2001; Eze et al., 2007; Komnenou et al., 2015; Vural et al., 2018).
Nos machos, as lesões neoplásicas desenvolvem-se com maior frequência no pénis (Figura 8) (Eze et al., 2007; Varughese et al., 2012), no prepúcio e no escroto (Figura 9A) (Booth, 1994; Setthawongsin et al., 2016). Podem ainda ser encontradas lesões em localiza-ções extragenitais como a mucosa anal (Figura 9B), conjuntiva ocular, lábios, nariz e pele (Albanese et al., 2006; Eze et al., 2007; Trevizan et al., 2012; Vural et al., 2018). É comum observar-se um corrimento prepucial persistente ou intermitente, serosanguinolento, hemor-rágico ou purulento, o qual emana mau odor (Booth, 1994; Johnston et al., 2001; Tella et al., 2004; Varughese et al., 2012). Para além destes sinais clínicos é possível observar-se tume-fação do prepúcio, fimose/parafimose, estrangúria e lamber excessivo dos genitais (Johnston et al., 2001).
17 Numa fase inicial, as lesões correspondem a pequenas pápulas hiperémicas com 1 a 3 cm de diâmetro (Den Otter et al., 2015) que progridem para proliferações que se assemelham ao aspeto de couve-flor, de coloração avermelhada (Booth, 1994; Eze et al., 2007; Varughese et al., 2012; Den Otter et al., 2015). As massas podem ser nodulares, sésseis, multilobuladas,
Figura 8. Lesão proliferativa característica de TVT em pénis de cão. Extraído de
Dar et al. (2017).
Figura 9. Lesões de TVT. A) Lesão nodular em escroto de cão (círculo
preto). Extraído de Ahuja et al. (2017). B) Lesão com localização retal em cão (seta preta). Extraído de Arif et al. (2017).
B
18 papilares ou pedunculadas (Booth, 1994; Eze et al., 2007; Varughese et al., 2012) e atingir diâmetros de 15 cm (Eze et al., 2007; Den Otter et al., 2015). Podem também ter áreas de necrose, ulceração e hemorragia (Eze et al., 2007; Varughese et al., 2012). Usualmente é uma massa circunscrita e não capsulada (Komnenou et al., 2015).
A imagiologia auxilia na deteção de metástases; para isso podem ser realizadas radio-grafias, ecografias e até rinoscopias (Eze et al., 2007). As proliferações tumorais podem ser isoladas ou múltiplas, de coloração branca-acinzentada a vermelha, de consistência friável e têm o aspeto característico de couve-flor. A superfície é rugosa e irregular (Booth, 1994).
O diagnóstico exato é confirmado por análise cromossómica – em casos de TVT as células neoplásicas possuem aproximadamente 59 cromossomas, face aos normais 78 cro-mossomas das células somáticas caninas (Booth, 1994; Kennedy et al., 1998; Johnston et al., 2001; Den Otter et al., 2015) - mas esse exame pode não ser necessário, já que a citologia é um método fiável e prático para diagnosticar TVT (Booth, 1994; Varughese et al., 2012). No entanto, o diagnóstico é facilmente emitido após a realização de uma anamnese cuidadosa, observação da massa neoplásica e observação de uma citologia (Varughese et al., 2012; Hantrakul et al., 2014), obtida quer por aposição, quer por recurso à aspiração com agulha fina (Booth, 1994; Albanese et al., 2006).
A imagem citológica de TVT (Figura 10) é muito característica: população uniforme de células redondas a ovais, bem delimitadas, com citoplasma basofílico pálido, com diversos vacúolos distintos e núcleos grandes e redondos (Booth, 1994; Kegler et al., 2013; Komnenou et al., 2015; Vural et al., 2018). A presença de figuras de mitose é recorrente (Johnston et al., 2001; Albanese et al., 2006; Komnenou et al., 2015).
Figura 10. Imagem de citologia por aposição de lesões de TVT. A) Presença de células redondas
com grandes núcleos. Coloração de Giemsa. Objetiva de 40x. B) Presença de vacúolos intraci-toplasmáticos. Coloração de Giemsa. Objetiva de 100x. Ambas as imagens foram extraídas de Islam et al. (2017).
19 O tratamento de eleição é a quimioterapia e o quimioterápico ideal é a vincristina, já que é um tumor altamente responsivo a esta substância (Bilbrey et al.,1990; Varughese et al., 2012; Hantrakul et al., 2014). Outras sustâncias foram testadas como ciclofosfamida, meto-trexato, doxorrubicina ou conjugações destes com vincristina ou vimblastina. Contudo, uso isolado de vincristina mostrou-se mais eficaz no tratamento desta patologia, não só pela re-missão do tumor mas também por ser mais seguro (Booth, 1994; Tella et al., 2004; Eze et al., 2007; Varughese et al., 2012; Den Otter et al., 2015), ter um custo menos elevado e por não surtir tantos efeitos secundários, face às combinações de quimioterápicos. Está indicado ad-ministrar 0,025mg/kg de vincristina diluída em solução salina estéril, por via intravenosa (IV) lenta, a cada 7 dias até completa remissão do tumor (Booth, 1994; Tella et al., 2004; Eze et al., 2007; Varughese et al., 2012; Vural et al., 2018). Alguns autores indicam que sejam ne-cessários 2 a 8 ciclos de tratamento (Albanese et al., 2006; Hantrakul et al., 2014). Outros tratamentos possíveis são a excisão cirúrgica da massa tumoral com boas margens, radiação, crioterapia e imunoterapia (Johnston et al., 2001; Eze et al., 2007; Hantrakul et al., 2014).
A metastização só está presente em menos de 5% dos casos (Booth, 1994; Eze et al., 2007; Varughese et al., 2012) e as metástases podem ser encontradas na pele, linfonodos (inguinais, ilíacos externos e submandibulares), cavidades oral e nasal (nariz, amígdalas, lín-gua e lábios), olho, cérebro, hipófise, meninges, medula espinhal, fígado, pâncreas, baço, omento, peritoneu, pulmões, rim, testículo e músculo (Johnston et al., 2001; Eze et al., 2007; Trevizan et al., 2012; Varughese et al., 2012; Komnenou et al., 2015). A remissão espontânea pode ocorrer e está dependente do sistema imunitário em animais imunocompetentes. Após remissão, o animal adquire imunidade contra nova infeção (Albanese et al., 2006; Marino et al., 2012). Está descrito que os casos mais agressivos e os casos de metastização ocorrem em cães que falham na produção de anticorpos em número suficiente contra o tumor, ou seja, em cães imunodeprimidos, em situações de stresse ou em cachorros (Albanese et al., 2006; Marino et al., 2012; Trevizan et al., 2012; Setthawongsin et al., 2016).
Tumores do osso peniano
Embora seja muito raro, o osso do pénis pode ser sede de desenvolvimento tumoral (Mirkovic et al., 2004; Marolf et al., 2006; Peppler et al., 2009; Burchell & Kirberger, 2014). Poucos são os casos descritos, mas entre eles foram descritos casos de hemangiossarcoma (Marolf et al., 2006; Burchell & Kirberger, 2014; Fry et al., 2014; Bolfer et al., 2015), osteos-sarcoma (Bleier et al., 2003; Peppler et al., 2009), fibroma ossificante (Mirkovic et al., 2004) e osteocondrossarcoma (Webb et al., 2009). Burchell & Kirberger (2014) referiram que o he-mangiossarcoma é o tumor do osso peniano mais comum. A idade média ao diagnóstico não
20 está bem definida, sendo referenciada a idade média ao diagnóstico da patologia em geral, não associada à localização peniana. Os osteossarcomas são diagnosticados por volta dos 8,7 anos de idade (Peppler et al., 2009) e os hemangiossarcomas costumam afetar animais entre os 8 e 13 anos de idade (Fry et al., 2014). Não parece existir predisposição racial para tumores do osso do pénis (Webb et al., 2009).
Os sinais clínicos são principalmente do foro urinário e encontram-se associados à com-pressão da uretra peniana pela massa tumoral, incluindo disúria, estrangúria, polaquiúria e hematúria (Bleier et al., 2003; Marolf et al., 2006; Peppler et al., 2009; Burchell & Kirberger, 2014; Fry et al., 2014). Durante a palpação abdominal é comum encontrar-se a bexiga disten-dida, resultado da obstrução uretral (Mirkovic et al., 2004; Marolf et al., 2006; Peppler et al., 2009; Burchell & Kirberger, 2014). O pénis e prepúcio podem estar aparentemente normais quer à inspeção visual, quer à palpação (Peppler et al., 2009; Webb et al., 2009) ou evidenciar tumefação (Mirkovic et al., 2004; Burchell & Kirberger, 2014; Bolfer et al., 2015) ou nódulos (Bleier et al., 2003; Bolfer et al., 2015).
É comum, na radiografia pélvica, visualizarem-se áreas radiolucentes de osteólise do osso peniano (Figura 11), o qual adquire uma superfície irregular (Marolf et al., 2006; Webb et al., 2009; Burchell & Kirberger, 2014; Fry et al., 2014; Bolfer et al., 2015) acompanhadas ou não de massas de radiopacidade característica de tecidos moles. Estas massas podem levar ao desvio e/ou obstrução da uretra peniana e defeitos da uretra, visualizados na uretrografia de contraste (Figura 12) (Mirkovic et al., 2004; Marolf et al., 2006; Peppler et al., 2009). A bexiga está normalmente dilatada (Fry et al., 2014), o que é comprovado durante a ecografia abdominal, assim como a distensão da uretra pélvica (Burchell & Kirberger, 2014). A ecografia ao pénis pode evidenciar massas hipoecogénicas com focos hiperecogénicos corresponden-tes a mineralização, os quais produzem sombra acústica (Peppler et al., 2009; Burchell & Kirberger, 2014; Fry et al., 2014; Bolfer et al., 2015).
Figura 11. Radiografia de pénis e prepúcio de cão. Áreas de osteólise do
osso peniano causadas por hemangiossarcoma. Extraído de Burchell & Kir-berger (2014).
21 A citologia é um método prático, fácil e fiável para detetar osteossarcomas mas o diag-nóstico final só poderá ser emitido através do exame histopatológico (Peppler et al., 2009; Fry et al., 2014). Macroscopicamente, a massa tumoral pode ter até 6 cm nas suas maiores di-mensões (Bleier et al., 2003), ser bem delimitada e pode possuir cápsula (Peppler et al., 2009). A superfície de corte pode variar da coloração branca à cinza e evidenciar áreas de necrose (Bleier et al., 2003). Pode afetar apenas o pénis ou também a uretra (Marolf et al., 2006; Webb et al., 2009). A imagem microscópica vai variar consoante o tipo de tumor, mas em tumores do tecido ósseo propriamente dito é comum haver substituição do tecido ósseo por células neoplásicas (Peppler et al., 2009) e haver evidências de remodelação óssea (Mirkovic et al., 2004). Podem ser visualizadas células fusiformes de citoplasma escasso a moderado, pálido, eosinofílico ou basofílico e com núcleos redondos a ovais e excêntricos, compatíveis com fibroblastos, organizados em agregados separados por matriz hialina de fibras de colagénio (Mirkovic et al., 2004; Peppler et al., 2009; Burchell & Kirberger, 2014). Células ovais a redon-das com citoplasma basofílico e núcleos excêntricos são compatíveis com osteoblastos. Po-dem ainda estar presentes áreas de necrose, mineralização, trombose, hemorragia e infiltra-ção linfocítica ou neutrofílica (Bleier et al., 2003; Marolf et al., 2006; Peppler et al., 2009).
Figura 12. Uretrografia de contraste. Diminuição do lúmen da uretra
peniana e consequente defeito de preenchimento (seta preta). Ex-traído de Fry et al. (2014).
22 Os hemangiossarcomas são compostos por uma proliferação de células sem matriz os-teoide, que se infiltra tanto nos tecidos moles como no tecido ósseo do pénis (Burchell & Kirberger, 2014). As células neoplásicas são grandes, poligonais a fusiformes, com citoplasma anfofílico e vacuolizado e os respetivos núcleos tendem a ter forma ovoide (Burchell & Kirber-ger, 2014; Fry et al., 2014; Bolfer et al., 2015). Podem ser observadas células dispostas em canais vasculares que formam anastomoses e que contêm sangue (Bolfer et al., 2015).
O tratamento envolve quase sempre amputação do pénis (para assegurar a exérese da massa tumoral com boas margens), uretrostomia escrotal, ablação do escroto e orquiectomia (em animais inteiros) (Marolf et al., 2006; Peppler et al., 2009; Webb et al., 2009; Bolfer et al., 2015). É recomendado realizar quimioterapia adjuvante à base de doxorrubicina, carboplatina, ciclofosfamida e/ou vincristina (Peppler et al., 2009; Webb et al., 2009; Burchell & Kirberger, 2014; Fry et al., 2014; Bolfer et al., 2015). Tanto o osteossarcoma como o hemangiossarcoma têm elevada capacidade metastática, pelo que o prognóstico é usualmente mau (Peppler et al., 2009; Fry et al., 2014; Bolfer et al., 2015). Podem ser evidentes metástases nos linfonodos, pulmões, rim e peritoneu (Bleier et al., 2003; Peppler et al., 2009; Webb et al., 2009; Fry et al., 2014; Bolfer et al., 2015).
23 B. Neoplasias do aparelho reprodutor feminino
B1. Neoplasias dos ovários
Os tumores ováricos primários representam 0,5 a 1,2% de todos os tumores caninos (Bertazzolo et al., 2004), 6,25% das neoplasias de cadelas inteiras (Pires et al., 2019) e 0,2 a 0,4% (Johnston et al., 2001) a 3% (Cellio & Degner, 2000) de todos os tumores felinos, sendo relativamente incomuns em ambas as espécies. As fêmeas submetidas a ovariohisterectomia (OVH) não estão totalmente protegidas de tumores ováricos, já que foram descritos casos de neoplasias ováricas em animais com síndrome do ovário remanescente (Sivacolundhu et al., 2001; Sontas et al., 2010).
Estes tumores são separados segundo a sua origem em três grandes categorias: os tumores dos cordões sexuais e estroma (incluem os tumores das células da granulosa, luteo-mas e tumores das células da teca), os epiteliais (compreendem os adenoluteo-mas papilares, ade-nocarcinomas papilares, cistadenomas papilares, cistadeade-nocarcinomas papilares e carcino-mas indiferenciados) e os da linha germinativa (grupo constituído por disgerminocarcino-mas, terato-mas e teratocarcinoterato-mas) (Nielsen et al., 1976; Christensen et al., 2013). Stone (1985) defende que as neoplasias ováricas afetam sobretudo fêmeas nulíparas e as de idade avançada. Os mais comuns na cadela são os tumores de origem epitelial (Banco et al., 2011) e na gata, os de origem nos cordões sexuais e estroma (Yamini et al., 1997; Cellio & Degner, 2000).
B1.1 Tumores com origem nos cordões sexuais e estroma
Este grupo abarca os tumores das células da granulosa, os luteomas e os tumores das células da teca. Todos estes representam 35 a 50% de todos os tumores ováricos caninos (Christensen et al., 2013). O tumor das células da granulosa é o mais comum dentro deste grupo, seja na cadela (Christensen et al., 2013) como na gata (Stone, 1985; Cellio & Degner, 2000). Coggeshall et al. (2012) defende que metade dos tumores originários dos cordões se-xuais e estromais são endocrinologicamente ativos/funcionais.
Tumor das células da granulosa
São os tumores do ovário mais comuns na cadela, representando até 50% dos tumores ováricos caninos (Christensen et al., 2013). São também considerados os tumores ováricos mais frequentes na espécie felina (Gelberg & McEntee, 1985; Stone, 1985; Johnston et al., 2001), no entanto, informações acerca da prevalência não estão disponíveis. Formam-se a
24 partir de células da granulosa de folículos atrésicos (Buijtels et al., 2010). A idade média ao diagnóstico é de 12 anos para a cadela (Bertazzolo et al., 2004) e afeta gatas entre os 3 e 16 anos de idade (Johnston et al., 2001). A existência de predisposição racial não está definida. Os sinais clínicos estão relacionados com a atividade endócrina manifestada pelo tumor e com os reflexos da existência de uma massa a nível abdominal. Se for endocrinologicamente ativo, pode produzir e secretar estrogénio, progesterona e/ou testosterona (Cellio & Degner, 2000; Christensen et al., 2013), o que origina um vasto leque de sinais clínicos. Em caso de hiperestrogenismo, os sinais verificados incluem estro persistente, intervalo interéstrico dimi-nuído, atração de machos, alopécia e tumefação da vulva e da cadeia mamária (Norris et al., 1969; Buijtels et al., 2010; Walter et al., 2018; Matos et al., 2019). Pode também observar-se pancitopenia por aplasia medular em resultado do efeito crónico do estrogénio sobre a medula óssea (Johnston et al., 2001; Sivacolundhu et al., 2001). O hiperprogesteronismo potencializa a ocorrência do complexo hiperplasia quística do endométrio-piómetra com apresentação de corrimento vulvar sanguinolento e polidipsia/poliúria (Norris et al., 1969; Buijtels et al., 2010; Walter et al., 2018; Matos et al., 2019). Já o excesso de produção de testosterona provoca virilização, podendo a fêmea adquirir uma estrutura mais masculina, mostrar comportamentos agressivos e exibir vocalizações de registo mais grave (Cellio & Degner, 2000). Caso o tumor não seja funcional, é natural que se demonstrem sinais clínicos menos específicos, os quais estão normalmente relacionados com a presença de uma massa a nível abdominal. Esses sinais clínicos compreendem letargia, vómito, anorexia/hiporexia, poliúria/polidipsia, distensão abdominal, dor abdominal (por compressão de órgãos vizinhos) e ascite (Johnston et al., 2001; Buijtels et al., 2010; Walter et al., 2018; Matos et al., 2019). Frequentemente o diagnós-tico é feito num estadio avançado da doença (Borzacchiello et al., 2010), pelo que, regra geral, é palpável uma massa a nível abdominal durante o exame físico (Christensen et al., 2013).
A radiografia abdominal evidencia a presença de uma massa com radiopacidade carac-terística de tecidos moles, caudalmente ao rim, no quadrante abdominal cranial a médio. O rim pode estar deslocado lateral- ou cranialmente pela massa e a presença de fluido abdomi-nal muitas vezes mascara a massa neoplásica (Burk & Ackerman, 1996). A imagem ecográ-fica (Figura 13) revela uma massa globoide com padrão sólido, com ou sem componente quística, localizada caudalmente ao rim, de limites irregulares e dimensões consideráveis. Pode ser acompanhada por uma imagem característica de piómetra, hiperplasia quística do endométrio ou ainda ascite devido a metastização por vasos sanguíneos ou linfáticos (Coggeshall et al., 2012).
25
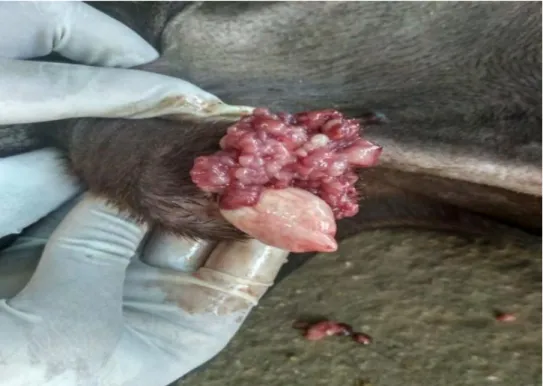
Macroscopicamente (Figura 14), a massa é geralmente unilateral e pode ter dimensões variáveis, a maior das quais descritas até ao momento tem 15 cm de diâmetro (Walter et al., 2018). Ao corte, a massa tem coloração branca a amarela e uma consistência mole (Matos et al., 2019). Apresenta-se muitas vezes multilobulada com grandes quistos, zonas de hemorra-gia e de necrose (Nielsen et al., 1976).
Microscopicamente pode apresentar um padrão macrofolicular, microfolicular, trabecu-lar, difuso, tubular (semelhante a tumor das células de Sertoli) ou uma mistura dos anteriores
Figura 13. Imagem ecográfica de um tumor das células da granulosa em
cadela. Extraído de Walter et al. (2018).
Figura 14. Imagem macroscópica de um tumor das células da
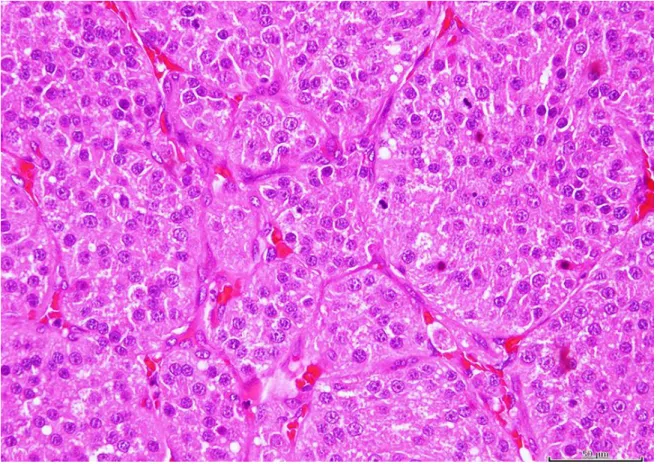
26 (Kennedy et al., 1998; Buijtels et al., 2010; Banco et al., 2011). São compostos por uma po-pulação celular uniforme, de células redondas a poliédricas, com citoplasma eosinofílico, pouco corado e escasso e núcleos esféricos a ovais e excêntricos (Nielsen et al., 1976; Buijtels et al., 2010). As figuras de mitose são esporádicas. Devido à variedade de apresentações microscópicas, um tumor das células da granulosa é difícil de diagnosticar (Riccardi et al., 2007); os corpos de Call-Exner (Figura 15) são muito característicos desta neoplasia, o que ajuda não só ao diagnóstico (Kennedy et al., 1998; Sivacolundhu et al., 2001; Matos et al., 2019) como ao prognóstico, já que tais estão associados a benignidade (Nielsen et al., 1976).
Após descarte de metástases por radiografia e ecografia, está indicada a realização de OVH, embora ovariectomia (OVE) do ovário afetado também seja possível para detentores que desejem manter a capacidade reprodutora do animal (Gorman, 1998). A presença de uma cápsula bem desenvolvida em torno da massa neoplásica confere baixo potencial de invasão e metastização, mas deve ter sido em conta que esta ocorre em 10 a 20% dos casos em cadelas (Christensen et al., 2013) e até 50% em gatas (Gelberg & McEntee, 1985; Cellio & Degner, 2000). As metástases podem ser encontradas no ligamento largo, peritoneu, omento, mesentério, fígado, pulmões, diafragma, baço, rim, bexiga e linfonodos (lombosacrais, renais,
Figura 15. Imagem de corte histológico de um tumor das células da
granulosa em cadela. Os corpos de Call-Exner são compostos por células arranjadas radialmente em torno de material eosinofílico (setas pretas). H&E. Bar = 16 μm. Extraído de Matos et al. (2019).