Orientador:
Dr. Franklim Peixoto Marques Professor Auxiliar
Assistente Hospitalar Graduado do Centro Hospitalar do Porto – Hospital de Santo António
Artigo de Revisão Bibliográfica
Mestrado Integrado em Medicina
Porto 2012
ANEMIA
INDUZIDA
PELO
CANCRO,
TRATAMENTO
E
CONTROVÉRSIAS
1 RESUMO
Trinta a noventa por cento dos cancros acompanham-se de anemia. A correção da anemia pode ser obtida pelo tratamento da causa subjacente, transfusão de concentrado de eritrócitos ou administração de agentes estimulantes da eritropoetina, com ou sem suplementos de ferro.
Neste artigo, faz-se uma revisão dos desenvolvimentos mais recentes relativos ao tratamento da anemia no cancro.
A anemia no doente com cancro é muitas vezes multifatorial e pode ser atribuída às comorbilidades subjacentes ou ao cancro por si, como fator precipitante ou agravante da anemia. Efeitos indiretos como deficiências nutricionais pela anorexia, hemólise mediada por anticorpos, alterações na coagulação, contribuem para que a anemia seja prevalente na apresentação inicial do cancro. Por outro lado, o efeito mielossupressor da quimioterapia contribui significativamente, assim como a radioterapia incluindo o osso produtor de sangue.
Para delinear um plano terapêutico inicial é fundamental avaliar a anemia quanto à sua etiologia e risco. A terapêutica com agentes estimulantes da eritropoetina é geralmente restrita ao tratamento da anemia do cancro induzida por quimioterapia mielossupressora, quando o resultado antecipado da terapêutica não é a cura, dados os potenciais riscos dos agentes estimulantes da eritropoetina.
A deficiência “funcional” de ferro é frequente após uso continuado de poietinas, devido ao atraso da libertação do ferro armazenado no sistema reticuloendotelial na medula óssea. A suplementação de ferro pode ser necessária na maior parte dos doentes para manter ótima eritropoiese.
Dadas as atuais controvérsias nos vários aspetos do tratamento da anemia, ensaios bem desenhados são necessários para responder às questões relacionadas com a segurança dos agentes estimulantes da eritropoiese, o papel do ferro intravenoso, efeitos a curto e longo prazo da suplementação com ferro, entre outros.
Palavras-chave: Anemia, cancro, agentes estimuladores da eritropoiese, transfusão de concentrado de eritrócitos, eritropoetina, ferro endovenoso.
2 ABSTRACT
Thirty to ninety percent of cancers are followed by anemia. Anemia’s correction may be obtained by treatment of the underlying etiology or by red blood cells transfusions or by administration of erythropoiesis-stimulating agents, with or without iron supplementation.
In this article it is made a review of the most recent developments on the treatment of anemia in cancer patients.
Causes of anemia in cancer patients are often multifactorial and they may be attributed to underlying comorbidities or to cancer itself as a precipitating factor of the anemia. Indirect effects as nutritional deficiency caused by loss of appetite, hemolysis by immune-mediated antibodies and changes in coagulation capability contribute to making anemia prevalent among cancer patients at initial presentation. In addition, the myelosuppressive effect of chemotherapy and radiation therapy directed to the bone producing blood is significant contributing factors to anemia.
To elaborate a therapeutic plan it is crucial to start with an evaluation of anemia to delineate the etiology and the risk. The erythropoiesis-stimulating agents treatment is generally restricted to the treatment of cancer’s induced anemia by myelosuppressive chemotherapy when the expected result of the treatment isn’t the cure, due to the potential risks of erythropoiesis-stimulating agents.
Iron’s functional deficiency is common during the continued use of erythropoietin because of the delay of iron release from the usable iron pool in the reticuloendothelial system in the bone marrow. Iron supplementation may be required in most of the patients in order to maintain optimal erythropoiesis.
Due to the current controversy of the aspects of anemia’s treatment, well-designed trials are required in order to answer questions about the safety of erythropoiesis stimulating agents for lower hemoglobin levels, the role of intravenous iron, short and long term effects of iron supplementation, among others.
Key-words: Anemia, cancer, erythropoiesis-stimulating agents, red blood cell transfusion, epoetin, intravenous iron.
3 INTRODUÇÃO
Trinta a noventa por cento dos cancros acompanham-se de anemia[1] e a sua frequência aumenta com a duração da quimioterapia[2]. A prevalência da anemia varia de acordo com o tipo de cancro, estando presente em 13,8% dos doentes com tumores sólidos e em 44,2% nas neoplasias hematológicas. Nos tumores sólidos, a severidade da anemia relaciona-se com o local do tumor primário, sendo mais severa nos tumores ginecológicos e da cabeça e pescoço. Nas neoplasias hematológicas, são as síndromes mielodisplásicas que englobam mais doentes com anemia moderada a severa.[3]
A anemia, só por si, associa-se a um impacto negativo na qualidade de vida e sobrevida do doente com cancro[4], dado que a hipoxia não só induz alterações na expressão de genes que promovem a angiogénese (levando ao crescimento tumoral) como também promove um fenótipo tumoral mais agressivo, por mutações do gene p53. Estas mutações levam a que as células escapem à apoptose, tornando o tumor geneticamente mais instável, com maior agressividade e pior prognóstico.[5]
Segundo a classificação do National Cancer Institute (NCI-CTCAE V4.0)[6] a anemia pode ser escalada em quatro graus de acordo com os valores de hemoglobina (Hb) em g/dL (Tabela I):
Tabela I: Classificação da anemia no cancro – NCI-CTCAE v4.0[6] 1 2 3 4 Anemia Hgb <LIN 10.0 g/dL Hgb <10.0 8.0 g/dL Hgb <8.0 6,5g/dL Hgb <6.5 g/dL
LIN: Limite inferior do normal
NCI-CTCAE: National Cancer Institute - Common Terminology Criteria for adverse events v4.0
ETIOLOGIA DA ANEMIA NO CANCRO A fisiopatologia da anemia pode ser dividida em três grupos: i) diminuição da produção de eritrócitos, ii) aumento da destruição dos eritrócitos, e iii) perda de sangue [1].
A anemia no doente com cancro é frequentemente multifatorial o que aumenta a complexidade da sua avaliação e tratamento. Pode ser atribuída às comorbilidades subjacentes como hemorragia, hemólise, doença hereditária, insuficiência renal, défices nutricionais, anemia de doença crónica, ou combinação destas.[7, 8]
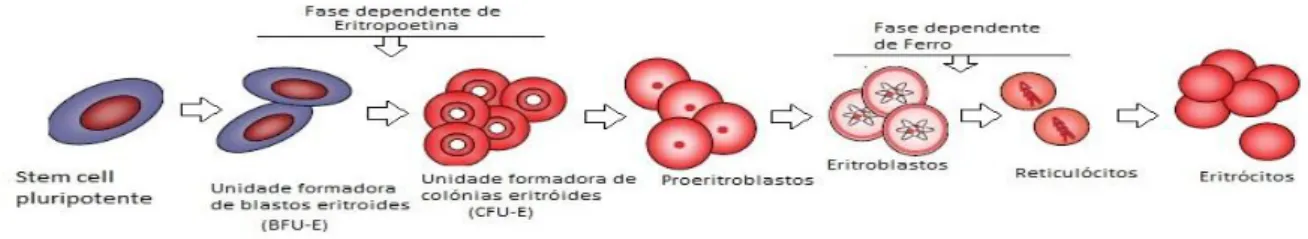
O cancro, por si, pode levar à anemia ou exacerba-la, por infiltração da medula óssea, perda crónica de sangue no local do tumor e lesão de órgão e pela produção de citoquinas inflamatórias[1] (fator de necrose tumoral alfa (TNF-α), interferon gama, interleucina 6 e interleucina 1)[2] que levam à sequestração do ferro. O aumento de ferro
4 intracelular leva ao aumento da degradação do fator indutor de hipoxia (HIF-1α), fator responsável pela transcrição do gene EPO, resultando na redução da produção de eritropoetina, diminuição da produção de eritrócitos e da sua sobrevida.[1, 2] Na figura
1[9] mostra-se a progressão das células eritroides progenitoras até à formação de eritrócitos maduros, bem como a influência das citocinas inflamatórias e do ferro neste processo.
Figura 1: Importância da eritropoetina e do ferro na eritropoiese.
As células progenitoras eritroides expressam recetores para citocinas inflamatórias, necessários para o normal desenvolvimento dos eritrócitos, contudo, na ausência de eritropoetina as citocinas promovem a morte celular.
Efeitos indiretos como deficiências nutricionais causadas pela anorexia, hemólise mediada por anticorpos, mudanças na coagulação são motivos adicionais que tornam a anemia prevalente na apresentação inicial do cancro (ex. 32% nos linfomas
não-Hodgkin[10] e 49% no cancro
ginecológico[11]). Por outro lado, o efeito mielossupressor da quimioterapia contribui significativamente para a anemia em doentes que se encontram em tratamento citotóxico[12], assim como a radioterapia que inclui toxicidade hematológica no osso produtor de sangue [13].
ANEMIA ASSOCIADA À
QUIMIO-TERAPIA
A anemia associada à quimioterapia é um problema muito comum nos doentes em tratamento para o cancro e está associado a um aumento da necessidade de transfusões de eritrócitos, assim como uma diminuição da qualidade de vida.[14]
Os estudos atuais permitem-nos predizer quais os doentes sob quimioterapia mais propensos a desenvolver anemia: doentes com valor inicial de hemoglobina ≤ 12,9 g/dl nas mulheres e ≤ 13,4 g/dl nos homens; doentes com cancro do pulmão ou cancro ginecológico; doentes com cancro em outras localizações, mas tratados com esquema de quimioterapia com grande mielossupressão e doentes do sexo feminino.[15]
5 hematopoiese, impedindo a produção de células precursoras de eritrócitos na medula óssea. Contudo, a citotoxicidade não se restringe à medula óssea, sendo também nefrotóxica levando a uma diminuição na produção de eritropoetina.[16] O tratamento com agentes estimuladores da eritropoetina (AEE) aumenta os níveis de hemoglobina em 40% a 70%, diminuindo concomitantemente a necessidade de transfusões.[17] O efeito nefrotóxico da quimioterapia verifica-se especialmente em esquemas de quimioterapia que contêm cisplatina[16], muito utilizados no tratamento dos cancros do pulmão, ovário, cabeça, pescoço e testículo[12]. Alguns estudos contestam a relação da anemia com um fármaco em particular, mas sim com a duração e intensidade da quimioterapia. Num estudo da The European Cancer Anemia Survey (ECAS)[11] verificou-se um aumento significativo de anemia consoante o número de ciclos de quimioterapia (19,5% ao ciclo 1 e 46,7% ao ciclo 5), estabelecendo também uma relação de associação entre o agravamento do grau da anemia com o aumento do número de ciclos de tratamento.
AVALIAÇÃO DA ANEMIA
Segundo a National Comprehensive Cancer Networks® (NCCN), nos doentes oncológicos um valor de hemoglobina de 11 g/dL ou inferior deve ser imediatamente avaliado. Contudo, nos doentes que
apresentem valores de base mais elevados, uma diminuição do valor de hemoglobina superior ou igual a 2 g/dL deve também ser sujeita a uma avaliação cuidadosa no sentido da caracterização da anemia e identificação de alguma comorbilidade passível de ser corrigida. [1]
Para uma caracterização inicial da anemia é fundamental um hemograma completo, para despiste de eventuais citopenias concomitantes, e um esfregaço de sangue periférico de modo a avaliar o tamanho, coloração e forma dos eritrócitos. De igual forma, é crucial a colheita de uma história clínica detalhada e um exame físico completo. A história clínica deve conter toda a informação essencial para o estudo de uma anemia, como o início dos sintomas, comorbilidades que possam existir, história familiar e história de quimioterapia e/ou radioterapia.
Os sintomas mais comuns nos doentes com anemia são a fadiga não relacionada com a sua atividade profissional ou as atividades de vida diária, síncope, cefaleia, dispneia para grandes esforços, dor torácica, vertigem, palidez, hemorragias e as mulheres podem apresentar menorragias abundantes aquando dos cataménios.[1] A fadiga relacionada com o cancro é definida pela NCCN como “sensação subjetiva angustiante e persistente de cansaço ou exaustão relacionada ao cancro ou seu tratamento que não é
6
proporcional à atividade recente e que interfere com o funcionamento normal do indivíduo”.[18] Uma forma de distinguir entre fadiga relacionada com o cancro e fadiga num indivíduo saudável é que a primeira não melhora com o repouso.[19]
Laboratorialmente, a anemia deve ser avaliada de duas formas: morfológica e cineticamente.
Morfologicamente, é possível caracterizar a anemia consoante o volume globular médio (VGM) ou o tamanho dos eritrócitos como normocítica (80-100 fL), microcítica (< 80 fL) ou macrocítica (> 100 fL). A anemia normocítica normalmente é causada por hemorragia, hemólise, falência da medula óssea, anemia da inflamação crónica ou insuficiência renal. Por outro lado, a anemia microcítica tem geralmente na sua origem uma deficiência em ferro, embora possa ter outras causas como talassemia, anemia da doença crónica ou anemia sideroblástica. A anemia macrocítica é maioritariamente megaloblástica indicando uma deficiência de folato ou vitamina B12, por falta de fator intrínseco. Existem outras causas para anemia macrocítica como o alcoolismo, síndrome mielodisplásico e alguns fármacos, nomeadamente, hidroxiureia ou difenitoina, contudo, são causas menos comuns.[1]
A avaliação cinética da anemia permite estudar o seu mecanismo,
distinguindo se a causa se encontra na produção, na destruição ou na perda de eritrócitos. Estas informações são obtidas através da contagem de reticulócitos. O valor normal corrigido de reticulócitos situa-se entre 1.0% e 2.0% e indica-nos se a medula óssea é capaz de produzir eritrócitos. Desta forma, valores baixos de reticulócitos indicam uma diminuição da produção de eritrócitos sugerindo uma deficiência de ferro, folato/vitamina B12, anemia aplástica ou disfunção da medula óssea por invasão neoplásica ou por quimio/radioterapia. Por outro lado, valores elevados de reticulócitos indicam uma produção normal ou aumentada de eritrócitos sugerindo hemorragia ou hemólise.[1]
Qualquer causa de anemia que seja passível de tratamento deve ser tratada independentemente do tratamento do cancro. Contudo, se não se identifica a etiologia da anemia, esta deve ser considerada como uma consequência da inflamação relacionada com o cancro ou da quimioterapia mielos-supressora (caso se aplique).[1]
Se a causa provável da anemia é a inflamação relacionada com o cancro ou a quimioterapia mielossupressora, uma avaliação do risco da anemia é necessária para determinar o plano terapêutico inicial. A consideração de terapêutica com AEE é geralmente uma decisão de tratamento a longo prazo, dados os seu potenciais riscos.[1]
7 As decisões sobre se a correção imediata da anemia é necessária devem ser baseadas na avaliação das características individuais do doente, graus de gravidade da anemia, presença e gravidade das comorbilidades.[1]
As manifestações clínicas da anemia dependem do seu início, da gravidade, duração e necessidade de oxigénio nos tecidos e, portanto, a decisão de transfusão de concentrado de eritrócitos não se pode basear exclusivamente no nível de hemoglobina que o doente apresenta, mas sim em associação com os sintomas. Neste sentido, existem três categorias diferentes que determinam a atitude terapêutica: i) doente assintomático e sem comorbilidades significativas, tem indicação para manter observação e reavaliação periódica; ii) doente assintomático, com comorbilidades ou risco elevado, torna-se prudente considerar a transfusão; iii) doente sintomático tem indicação para transfusão. [1]
Contudo, existem situações que não se enquadram nas três categorias já descritas e que tornam fundamental o julgamento clínico, sendo exemplo, o doente anémico sem sintomas ou comorbilidades significativas, mas que apresenta um declínio progressivo do valor da hemoglobina após o tratamento do cancro. Neste caso pode ser apropriado fazer uma transfusão de concentrado de eritrócitos, ou AEE.[1]
TRATAMENTO
A correção da anemia pode ser obtida por tratamento da etiologia subjacente ou suportada por transfusão de concentrado de eritrócitos ou administração de AEE, com ou sem suplementos de ferro. Estudos recentes têm revelado efeitos deletérios dos AEE na saúde, o que levou a mudanças significativas nas recomendações do seu uso.[1]
CONCENTRADO DE ERITRÓCITOS O concentrado de eritrócitos é o produto de escolha para transfusão com o objetivo de corrigir a anemia. Uma unidade de concentrado de eritrócitos (UCE) constituída por 300 ml, contém 42,5 a 80 g de hemoglobina ou 128 a 240 ml de eritrócitos, com 147 a 278 mg de ferro e pode aumentar o hematócrito em 50 a 80%.[20]
Benefícios da transfusão de Concentrado de Eritrócitos
A transfusão de UCE é a única forma de tratamento da anemia que permite um rápido aumento dos valores de hemoglobina e hematócrito, dado que uma UCE aumenta a hemoglobina cerca de 1 g/dL e o hematócrito em 3% num adulto que não se encontre com perdas hemáticas. Nos doentes submetidos a quimioterapia mielossupressora que necessitam de uma imediata correção da anemia, a opção terapêutica adequada é a transfusão de UCE.[20, 21]
8 Alguns estudos, como o de Kader AS et al[22], verificaram que a transfusão de UCE também aumenta a sobrevida. Muito recentemente, uma grande revisão sistemática[23] sobre a utilização da transfusão de UCE em doentes com cancro em estadio avançado mostrou que existe uma melhoria de dois dos principais sintomas da anemia (dispneia e fadiga) imediatamente após a transfusão, contudo, este benefício começa a diminuir após 14 dias, mostrando ser um benefício transitório.
Riscos da transfusão de Concentrado de Eritrócitos
A transfusão de UCE acarreta alguns riscos, dos quais se destacam as reações adversas relacionadas com a transfusão, insuficiência cardíaca congestiva, sobrecarga de ferro e infeções bacterianas ou virais.[2] O risco de transmissão de infeções diminuiu significativamente desde 1984, ano em que se iniciaram uma série de cuidados adicionais de modo a despistar amostras infetadas.[24, 25] Um dos efeitos adversos mais comuns das transfusões de UCE é a febre não-hemolítica que pode ser reduzida pela leucorredução das amostras transfundidas.[26, 27]
Na transfusão de concentrado de eritrócitos é fundamental verificar a compatibilidade do sistema ABO e outros antigénios como o fator rhesus. Normalmente, não é necessário fazer qualquer tipo de
medicação antes da transfusão. Porém, quando se prevê que os doentes sejam submetidos a várias transfusões de UCE é prudente a administração de paracetamol ou um anti-histamínico, assim como a leucorredução, a fim de diminuir as reações adversas relacionadas com a transfusão.[1]
Khorana et al,[28] num estudo em doentes com cancro, observou um aumento do risco de tromboembolismo venoso, tromboembolismo arterial e aumento da mortalidade nos doentes submetidos a transfusões de UCE.
A sobrecarga de ferro não é frequente em doentes que recebem transfusões de UCE apenas durante a quimioterapia, que geralmente não ultrapassa um ano.[1] Por outro lado, nos doentes com Síndrome Mielodisplásico pode existir sobrecarga de ferro pela necessidade de várias transfusões de UCE ao longo de vários anos.[29]
Objetivos da transfusão de Concentrado de Eritrócitos
O principal objetivo da transfusão de UCE é manter a oferta de oxigénio aos tecidos.
O valor ótimo de hemoglobina para um transporte de oxigénio adequado varia de acordo com o volume de sangue. Conforme a hemoglobina aumenta, assim aumenta o transporte de oxigénio até que se atinge um valor de hemoglobina a partir do qual o
9 transporte de oxigénio começa a decair, estando este fenómeno relacionado com a hiperviscosidade. Da mesma forma, a qualidade de vida também varia consoante os níveis de hemoglobina. Até se atingir o valor ideal de hemoglobina a qualidade de vida aumenta proporcionalmente, mas ultrapas-sando o valor ideal, a qualidade de vida começa a diminuir.[30]
Os valores-alvo de hemoglobina a atingir, no doente com cancro, de acordo com as condições clínicas específicas foram estabelecidos pela NCCN: i) para doentes assintomáticos, com anemia crónica, mas hemodinamicamente estáveis e sem síndrome coronário agudo, o objetivo é manter os valores de hemoglobina entre 7 e 9 g/dL; ii) para doentes sintomáticos, com hemorragia ativa, hemodinamicamente instáveis ou com oferta insuficiente de oxigénio aos tecidos, a transfusão tem como principal objetivo a correção da instabilidade hemodinâmica e a manutenção adequada de oxigenação tecidular; iii) nos doentes sintomáticos com taquicardia, taquipneia e/ou hipotensão postural e com valores de hemoglobina inferiores a 10 g/dL, o objetivo será manter a hemoglobina com valores entre 8 e 10 g/dL a fim de prevenir sintomas; iv) nos doentes com anemia e síndrome coronário agudo ou enfarte agudo do miocárdio, a transfusão adquire um papel importante para manutenção da hemoglobina acima de 10 g/dL.[1]
Raras são as situações em que se torna necessário fazer transfusão de UCE quando o valor de hemoglobina é superior ou igual a 10 g/dL e o estudo multicêntrico de Hebert et al[31] confirma que não existe diferença na mortalidade entre os doentes que fazem transfusão para manter a hemoglobina com valores entre 7 e 9 g/dL e os doentes cujo objetivo da transfusão é manter a hemoglobina entre 10 e 12 g/dL.
AGENTES ESTIMULADORES DA
ERITROPOETINA
Os AEE, constituindo eritropoetina humana recombinante, foram usados pela primeira vez em 1989 com o objetivo de estimular a eritropoiese em doentes com níveis baixos de eritrócitos[1], através do aumento da produção dos mesmos na medula óssea pela ativação do recetor de eritropoetina nas células eritroides progenitoras.[32, 33] Normalmente, os eritrócitos são produzidos na medula pela estimulação da eritropoetina, citocina produzida nos rins.[1]
Ao contrário da transfusão de UCE que aumenta rapidamente os níveis de hemoglobina, os AEE poderão levar semanas até se verificar este efeito. Contudo, através de administrações repetidas, estes agentes são efetivos na manutenção dos valores-alvo de hemoglobina. Atualmente, existem três AEE comercializados: epoetina alfa, epietina beta e darbepoetina alfa.[1]
10 Benefícios dos agentes estimulantes da eritropoiese
A utilização dos AEE nos doentes com cancro em quimioterapia tem demonstrado diminuir a necessidade de transfusões de UCE, como resultado do aumento da concentração de hemoglobina.[34-37]
Riscos do tratamento com agentes estimulantes da eritropoiese
Embora esta terapêutica tenha demonstrado vários benefícios, apresentando-se como uma alternativa de tratamento da anemia, recentemente a evidência de potenciais efeitos adversos tem vindo a alterar a sua utilização. Diversos estudos demonstram o aumento da mortalidade e da progressão tumoral, bem como o risco de tromboembolismo e aplasia pura de células vermelhas.[1]
Aumento da mortalidade e progressão tumoral
Oito estudos sobre a utilização de AEE em doentes com cancro avançado da mama, cabeça e pescoço, linfomas e cancro do pulmão não pequenas células alertaram as agências reguladoras (FDA e EMA) para a necessidade de uma melhor regulamentação e restrição desta terapia, por se ter registado uma diminuição da sobrevida e do controlo loco-regional da doença.[38-45]
Recentemente, estes dados foram
confirmados através de meta-análises realizadas por Bohlius et al[46], Tonelli et al[47] e Bennett et al[48]. Contudo, esta associação do aumento da mortalidade com o uso de AEE foi refutada por outras duas meta-análises[49, 50] que demonstram não existir um efeito significativo dos AEE na mortalidade ou progressão tumoral. Em defesa destas duas últimas meta-análises, existem alguns estudos recentes de farmacovigilância que apontam para não existir diminuição da sobrevida com o uso de AEE nos doentes com anemia relacionada com a quimioterapia.[51-53]
A relação entre a expressão de recetores de eritropoetina nas células tumorais e a proliferação tumoral não está ainda totalmente esclarecida.[54-57] Contudo, sabe-se que à semelhança da eritropoetina, os AEE ligam-se e ativam o recetor da eritropoetina (EpoR) nas células eritroides progenitoras[58], que por sua vez estimula a enzima JAK2 cinase[59]. Uma vez ativada, a JAK2 cinase estimula uma série de vias de sinalização nas células eritroides progenitoras, sendo fundamental para a translocação do EpoR para a superfície celular.[60] No seguimento deste conhecimento, surge a hipótese de que se as células tumorais apresentarem este recetor, os AEE podem ativá-lo e induzir a proliferação das células tumorais.[61]
Recentemente foi desenvolvido um anticorpo monoclonal específico para o EpoR com o objetivo de estudar a sua expressão e
11 funcionamento.[62] Swift et al[63] desenvol-veram um estudo usando esse anticorpo e mostram que muitas linhagens de células tumorais expressam níveis de EpoR muito baixos ou indetetáveis, e mesmo nas que expressam EpoR verifica-se que este não é funcional. Noutro estudo[64] realizado com várias amostras de diferentes tipos de tumores epiteliais, não foram também identificados EpoR na superfície celular ou EpoR funcionais, pelo que a hipótese de que os AEE aumentam o risco de progressão tumoral pela ativação do EpoR nas células tumorais perde sustentabilidade.
Surgiu também a hipótese de que a progressão tumoral esteja relacionada com a utilização de AEE, mas por mecanismos indiretos, nomeadamente via angiogénese. Hipoteticamente, se as células endoteliais dos vasos sanguíneos expressarem EpoR, os AEE podem estimular a neovascularização ou angiogénese. No entanto, um estudo recente[65] mostra que as células humanas endoteliais, cardíacas, renais e neuronais contêm mRNA do EpoR em níveis dez a cem vezes inferiores aos das células altamente responsivas à eritropoetina. Assim, mantém-se a dúvida de como os AEE podem estimular indiretamente a progressão tumoral através da angiogénese.
Risco de tromboembolismo
A associação dos AEE ao aumento do risco de tromboembolismo pode ser devida a uma série de fatores[66], nomeadamente o seu efeito na massa eritrocitária e o volume de plasma, induzindo um estado de hipercoagu-labilidade[2]. O tromboembolismo tem como principais fatores de risco uma história prévia de tromboembolismo, hipercoagulabilidade, trombocitose, cirurgias recentes, longos períodos de imobilização associados à hospitalização e comorbilidades, como hipertensão.[37, 66, 67] O cancro só por si é um importante fator de risco, tal como a quimioterapia.[68-71]
Vários estudos e meta-análises[47-50], encontraram uma associação significativa entre a utilização de AEE e o aumento do risco de eventos tromboembólicos. Uma análise combinada de seis estudos[72] com a darbepoetina confirmaram a existência de risco aumentado de tromboembolismo em doentes com valores de hemoglobina superiores a 12 g/dL ou que aumentam o seu valor em 1 g/dL em menos de 14 dias. Pfeffer et al[73] também verificou uma associação entre a utilização da darbepoetina alfa em doentes com doença renal crónica e o risco de acidente vascular cereral (AVC).
Foram colocadas duas hipóteses para explicar o mecanismo subjacente ao
12 aumento do risco de tromboembolismo com o uso de AEE: estimulação da produção de plaquetas e ativação da JAK2 cinase. Contudo, até à data ainda não se estabeleceu qualquer relação causal que apoie estas hipóteses. Mais estudos serão necessários para compreender o mecanismo preciso por detrás deste aumento do risco de tromboembolismo[74].
No entanto, é fundamental que os médicos estejam atentos aos sinais e sintomas de tromboembolismo nos doentes que se encontram a fazer tratamento com poietinas e as suspendam quando a hemoglobina atinge o valor de 12 g/dl.
Risco de aplasia eritroide pura
A aplasia eritroide pura é uma síndrome de anemia rara que se caracteriza por valores baixos de reticulócitos, perda de eritroblastos na medula óssea, anticorpos contra a eritropoetina e resistência ao tratamento com AEE.
Quando um doente deixa de responder à terapêutica com AEE, apresentando anemia severa e baixa contagem de reticulócitos é necessário investigar a etiologia da perda de efeito e excluir um quadro de aplasia eritroide pura. A administração dos AEE deverá ser suspensa e pesquisada a presença de anticorpos neutralizantes da eritropoetina. Nestes doentes não se deve administrar outros agentes estimuladores da eritropoetina sob
pena de poder existir reação cruzada de anticorpos.[1]
Indicações para tratamento com agentes estimulantes da eritropoiese
Segundo as recomendações de segurança da FDA, os AEE em doentes com cancro devem ser utilizados apenas em doentes com anemia relacionada com a quimioterapia[75] e com valores de hemoglobina <10 g/dl [37, 67] e a sua administração deve ser suspensa assim que termine a quimioterapia[75]. Ademais, este tratamento só deve ser uma opção quando o resultado antecipado da terapêutica não é a cura, visto que alguns estudos sugerem que os AEE podem promover o crescimento tumoral[1], aumentando o risco de mortalidade.
Existe evidência de que doentes com tumores sólidos a fazer quimioterapia com cisplatina apresentam maior benefício do tratamento com AEE, quando comparados com outros tipos de tumor ou outros esquemas de quimioterapia.[67]
Nos doentes em quimioterapia paliativa pode-se usar os AEE em vez das transfusões de UCE.[1]
Nem sempre é possível estabelecer com clareza que o tratamento com quimioterapia não será curativo, pelo que não se identificando outra causa de anemia as opções de tratamento deverão começar com a
13 transfusão de UCE deixando para última opção os AEE. Apenas a doença renal crónica se apresenta como uma indicação independente para o tratamento com AEE.
Quando a solução passa pelo uso de AEE, é necessário que estes sejam administrados na menor dose necessária para que se evite o recurso a transfusões. Os riscos deste tratamento parecem estar relacionados com as altas doses dos AEE e/ou níveis elevados de hemoglobina, pelo que a FDA recomenda a utilização de doses individualizadas com o objetivo de manter os valores de hemoglobina entre 10 e 12 g/dL.[1] Num doente com doença renal crónica e com tumor sólido curável, os AEE não devem ser administrados durante a quimioterapia, contudo, assim que esta termine podem ser uma opção, mantendo presente a possibilidade de existir doença residual e ponderando o risco benefício destes fármacos no que respeita ao risco de trombose.[1]
Nas situações de transplante de medula óssea, e particularmente no caso de um transplante autólogo, há uma redução da resposta à eritropoetina endógena, contudo, existe uma produção apropriadamente aumentada pelo rim e, posteriormente, uma recuperação desta resposta com consequente diminuição da necessidade de transfusões de UCE.
Por outro lado, após um transplante
alogénico há uma resposta mais rápida da medula óssea à eritropoetina endógena. As citocinas inflamatórias, características da reação enxerto versus hospedeiro e da terapia imunossupressora, levam a uma redução da produção de eritropoetina, assim como uma diminuição da resposta à mesma, pelo que, neste tipo de transplante existe benefício em recorrer ao tratamento com AEE.[67]
Nos transplantes de células estaminais hematopoiéticas, normalmente é necessário o recurso a transfusões de suporte e os AEE podem ser usados em determinadas circunstâncias, nomeadamente no pós-transplante, para aumentar a hemoglobina de modo evitar a sobrecarga de ferro relacionada com transfusões.[76-78]
Durante o tratamento com AEE é essencial que se estude analiticamente o ferro, através do ferro sérico, da ferritina e capacidade total de ligação ao ferro, de modo a monitorizar o défice “funcional” de ferro.[1]
Esquema terapêutico com agentes etimulantes da eritropoiese
A epoetina alfa e a darbepoetina alfa são consideradas equivalentes e as doses iniciais recomendadas nos doentes em quimioterapia encontram-se no quadro 1, embora existam esquemas terapêuticos alternativos, assinalados no quadro 2, igualmente eficazes e seguros.
14 cada doente e baseia-se no objetivo de aumento gradual dos valores de hemoglobina de modo a evitar a necessidade de transfusão.[37] A avaliação da hemoglobina deve ser realizada semanalmente até que os seus valores estabilizem, tendo presente que os AEE demoram pelo menos 2 semanas até ao início de efeito. Se o valor de hemoglobina aumentar 1 g/dL ou mais em duas semanas, ou se atingir níveis suficientes para evitar a
transfusão (hemoglobina 10-12 g/dL) deve-se diminuir a dose da epoetina alfa e darbepoetina alfa[1, 37], em 25% e 40%, respetivamente.
Uma das causas mais comuns para a falha na resposta ao tratamento com AEE é o défice de ferro absoluto ou “funcional”, pois leva a uma eritropoiese restrita e pior resposta aos AEE.[79]
Quadro 1 – Esquema terapêutico com AEE
Origem: Adaptado das Guidelines de NCCN versão 2.2012[1]
Quadro 2 – Esquema terapêutico alternativo com AEE
Poietina Dose inicial Sem resposta – ajustamento de dose
Epoetina alfa 80.000 U cada 2 sem.
Ou
120.000 U cada 3 sem. SC
Darbepoetina alfa 100 mcg/sem. SC
Ou 200 mcg cada 2 sem. SC Ou 300 mcg cada 3 sem. SC 150-200 mcg/sem. SC Ou 300 mcg cada 2 sem. SC Ou 500 mcg cada 3 sem. SC Legenda: U - unidades; sem. - semana; SC –subcutânea
Origem: Adaptado das Guidelines de NCCN versão 2.2012[1]
O tratamento com AEE deve ser suspenso se o doente não responde ao fim de oito a nove
semanas de tratamento, apesar do suplemento com ferro e nesta situação deverá ser
Poetina Dose inicial Sem resposta-Ajustamento de dose
Epoetina alfa 150 U/kg 3x/sem. SC
Ou
40.000U/ sem. SC
300 U/kg 3x/sem. SC ou
60.000 U/sem. SC
Darbepoetina alfa 2.25 mcg/kg/sem. SC
Ou
500 mcg a cada 3 sem. SC
4.5 mcg/kg/sem. SC
15 considerada a transfusão de UCE[1], além da averiguação da progressão tumoral, défice de ferro ou outras etiologias da anemia[37]. Nos doentes em quimioterapia que fazem AEE, estes devem ser suspensos assim que terminar o tratamento citotóxico e/ou a anemia estiver resolvida.[1]
SUPLEMENTO DE FERRO
Na sequência do tratamento continuado com poetinas, pode surgir um défice “funcional” de ferro caracterizado por ferritina ≤ 800 ng/mL e saturação de transferrina <20%, devido ao atraso da libertação do ferro armazenado no sistema reticuloendotelial da medula óssea, provocado pelas citoquinas inflamatórias libertadas pelo tumor ou relacionadas com a quimioterapia. Estas citoquinas inflamatórias levam a hiperregulação da hepcidina, que bloqueia a libertação de ferro para o seu transportador transferrina.[79-82] A suplementação de ferro pode, eventualmente, ser necessária na maior parte dos doentes para manter ótima eritropoiese, visto que a rápida produção de eritrócitos estimulada pelos AEE aumenta a mobilização de ferro do sistema retículoendotelial na medula óssea.[80, 81] A suplementação de ferro pode reduzir a necessidade de transfusões de UCE.[67]
Antes de iniciar o tratamento com AEE, os doentes devem fazer um estudo da cinética do ferro através do doseamento do
ferro sérico, ferritina, capacidade total de fixação do ferro e saturação de transferrina para despistar um défice absoluto de ferro, que se caracteriza por saturação de transferrina < 15% e ferritina < 30 ng/ml.[1]
O ferro pode ser administrado por via oral ou parentérica (ferro-sacarose, ferro dextrano e gluconato férrico)[83]. A administração de ferro endovenoso pode superar o défice “funcional” de ferro promovendo o ferro numa forma prontamente biodisponível para o desenvolvimento do eritron.[84]
Desde 2004, foram publicados cinco estudos randomizados[85-89] onde se comparou o uso de AEE isoladamente, ou associado a ferro oral ou endovenoso, verificando-se vários benefícios com o ferro endovenoso, nomeadamente, aumento da resposta da hemoglobina ao uso de AEE, aumento significativo da hemoglobina relativamente aos valores de base, diminuição da dose necessária de AEE e aumento da qualidade de vida. Por outro lado, não se verificou diferença com suplemento de ferro oral.[85]
Em 2011, foi publicado um grande estudo[90] sobre o efeito das diferentes formas de administração do ferro na resposta da terapêutica com darbepoetina alfa em doentes com anemia associada à quimioterapia, que veio contrariar os resultados dos estudos anteriores. Uma das explicações apontadas seria o facto do défice “funcional” de ferro
16 não ser um fator limitante na eritropoiese para muitos doentes inseridos nesse estudo, e que este défice não poderia ser ultrapassado por doses farmacológicas de AEE ou suplementos de ferro biodisponível. Outra explicação possível seria a diferença dos índices de ferro nos doentes desse estudo em comparação com os estudos anteriores. No estudo de Auerbach et al[85], todos os doentes apresentavam um valor de saturação de transferrina < 20%, ao contrário dos doentes do estudo de Steensma et al[90] em que um fator de elegibilidade para o estudo era valor de saturação de transferrina < 60%, o que poderia explicar que muitos dos doentes inseridos no estudo de Auerbach et al não apresentassem um défice funcional de ferro, mas sim um défice absoluto.
Atualmente, não existe consenso na literatura acerca da possibilidade do ferro endovenoso promover a inflamação e proliferação bacteriana[91]. Contudo, sabe-se que doses suprafisiológicas de ferro representam um risco aumentado de infeção em doentes com anemia de doença crónica, com base na premissa de que alguns patogéneos necessitam de ferro para o seu desenvolvimento[92]. Assim, recomenda-se que a suplementação de ferro endovenoso não seja utilizada em doentes com infeção ativa.[1] Nos doentes com cancro e défice absoluto de ferro recomenda-se ferro endovenoso usado isoladamente, sem a associação de AEE.
Quadro 3 - Recomendações para a administração de ferro por via parentérica
Ferro dextrano Gluconato férrico Ferro sacarose
Dose teste Obrigatória Decisão médica Decisão médica
25 mg em bólus EV lento e aguarda 1h. 25 mg em bólus EV lento ou por infusão. 25 mg em bólus EVlento. Dose 100 mg EV em bólus
lento (pelo menos 5 min).
Para doses maiores, repetir dose 1x/sem até dose total calculada.
125 mg EV em pelo menos 60 min.
Para doses maiores, repetir dose 1x/sem até dose total calculada.
200 mg EV em pelo menos 60 min. Ou 200 mg EV em bólus lento de 10 minutos.
Para doses maiores repetir dose a cada 2/3 semanas até dose total calculada.
Via de administração Infusão EV Bólus/infusão EV Bólus/infusão EV Origem: Adaptado das Guidelines de NCCN versão 2.2012
17 Apesar de não existirem estudos sobre a utilização de ferro endovenoso em monoterapia nos doentes com cancro e défice “funcional” de ferro, recomenda-se o tratamento com AEE associado a ferro endovenoso.[1]
No cálculo da dose de ferro a administrar[93] deve-se primeiro calcular a dose total necessária pela fórmula – Dose total de substituição de ferro (mg ferro) = Peso em Kg x (Hgb ideal – Hgb real em g/l) x 0, 24* + reserva de ferro em mg**
* Fator 0,24 = 0.0034 x 0,07 x 1000; Taxa de ferro na Hgb 0,34%; Volume sanguíneo 7% do peso corporal; Fator 1000 = conversão de g para mg.
** Reserva de ferro - até 35 kg de peso corporal = 15 mg x peso em Kg; Reserva de ferro - acima de 35 Kg de peso corporal = 500 mg
A dose total de substituição de ferro (mg ferro) deve ser repartida por várias tomas, administradas segundo o quadro 3.
TERAPÊUTICAS FUTURAS
Todas as opções terapêuticas referidas anteriormente trazem benefícios, mas não são isentas de riscos. Contudo, nos doentes que apresentam anemia por doença crónica, nem o ferro, nem os AEE tratam as causas principais da anemia, nomeadamente
o excesso de hepcidina e a reduzida atividade da ferroportina.
Apresentam-se como boas possíveis terapêuticas as que diminuam a produção de hepcidina e aumentem a atividade da ferroportina, que por sua vez aumenta a biodisponibilidade de ferro adquirido pela dieta e mobiliza o ferro existente nas reservas corporais para a eritropoiese, sem os riscos das doses suprafisiológicas de ferro ou dos AEE. Nesse sentido, encontram-se atualmente em investigação estratégias para inibir a função da hepcidina através de antagonistas diretos da mesma (anticorpos monoclonais antihepcidina), para prevenir a transcrição da hepcidina através de inibidores da produção desta (hepcidina RNA interferência, oligonucleótidos antisense e inibidores da via de sinalização IL-6) e para promover a resistência da ferroportina à ação da hepcidina através de agonistas/estabilizadores da ferroportina (anticorpo monoclonal antiferroportina).[82]
Verificou-se ainda que a Vitamina D, implicada numa diversidade de atividades celulares, como a diferenciação de células hematopoiéticas e diminuição da transcrição de citocinas pró-inflamatórias, pode diminuir a dose necessária de AEE[94], aumentar a eritropoiese[95] e diminuir a inflamação[96].
18 CONCLUSÕES
A anemia é muito prevalente em doentes com cancro, sobretudo nos que se encontram sob quimioterapia. O impacto do ponto de vista físico e psicológico é muito significativo pelo que um ótimo tratamento da anemia parece ser um componente de grande relevo no tratamento do cancro.
Dadas as atuais controvérsias nos vários aspetos do tratamento da anemia, são necessários ensaios bem desenhados para
responder às questões relacionadas com a segurança dos agentes estimulantes da eritropoiese, o papel do ferro intravenoso, efeitos a curto e longo prazo da suplementação com ferro, entre outros.
Novos desenvolvimentos no conhecimento da fisiopatologia da anemia de doença crónica levaram a novos alvos e “armas” terapêuticas, que atualmente se encontram sob investigação e se apresentam como promissoras.
BIBLIOGRAFIA
1. Rodgers, G.M., et al., Cancer and
Chemotherapy induced Anemia. Version
2.2012 NCCN. Clinical practice guidelines in oncology. Available at: http://www.nccn.org/professionals/physici an_gls/pdf/anemia.pdf on September 28, 2011.
2. Spivak, J.L., P. Gascon, and H. Ludwig,
Anemia management in oncology and hematology. Oncologist, 2009. 14 Suppl 1:
p. 43-56.
3. Verbeke, N., et al., High prevalence of
anaemia and limited use of therapy in cancer patients: a Belgian survey (Anaemia Day 2008). Support Care Cancer, 2012. 20(1): p. 23-8.
4. Caro, J.J., et al., Anemia as an independent
prognostic factor for survival in patients with cancer: a systemic, quantitative review. Cancer, 2001. 91(12): p. 2214-21.
5. Vaupel, P., Hypoxia and aggressive tumor
phenotype: implications for therapy and prognosis. Oncologist, 2008. 13 Suppl 3: p.
21-6.
6. Trotti, A., et al., CTCAE v3.0: development
of a comprehensive grading system for the adverse effects of cancer treatment. Semin
Radiat Oncol, 2003. 13(3): p. 176-81. 7. Schwartz, R.N., Anemia in patients with
cancer: incidence, causes, impact,
management, and use of treatment
guidelines and protocols. Am J Health Syst
Pharm, 2007. 64(3 Suppl 2): p. S5-13; quiz S28-30.
8. Steensma, D.P., Is anemia of cancer
different from chemotherapy-induced ane-mia? J Clin Oncol, 2008. 26(7): p. 1022-4.
9. Besarab, A., W.H. Horl, and D. Silverberg,
Iron metabolism, iron deficiency,
thrombocytosis, and the cardiorenal anemia syndrome. Oncologist, 2009. 14 Suppl 1: p. 22-33.
10. Moullet, I., et al., Frequency and
significance of anemia in non-Hodgkin's lymphoma patients. Ann Oncol, 1998. 9(10): p. 1109-15.
11. Ludwig, H., et al., The European Cancer
Anaemia Survey (ECAS): a large,
multinational, prospective survey defining the prevalence, incidence, and treatment of anaemia in cancer patients. Eur J Cancer,
2004. 40(15): p. 2293-306.
12. Groopman, J.E. and L.M. Itri,
Chemotherapy-induced anemia in adults: incidence and treatment. J Natl Cancer Inst,
1999. 91(19): p. 1616-34.
13. Jefferies, S., et al., Haematological toxicity
of cranio-spinal irradiation. Radiother
Oncol, 1998. 48(1): p. 23-7.
14. Spivak, J.L., The anaemia of cancer: death
by a thousand cuts. Nat Rev Cancer, 2005. 5(7): p. 543-55.
15. Barrett-Lee, P.J., et al., Independent risk
19
receiving chemotherapy: results from the
European Cancer Anaemia Survey.
Oncology, 2006. 70(1): p. 34-48.
16. Wilson, J., et al., A systematic review and
economic evaluation of epoetin alpha, epoetin beta and darbepoetin alpha in anaemia associated with cancer, especially that attributable to cancer treatment.
Health Technol Assess, 2007. 11(13): p. 1-202, iii-iv.
17. Bohlius, J., et al., Erythropoietin or
darbepoetin for patients with cancer.
Cochrane Database Syst Rev, 2006. 3: p. CD003407.
18. Berger, A.M., et al., Cancer-Related Fatigue. Version 1.2012 NCCN. Clinical practice guidelines in oncology. Available at: http://www.nccn.org/professionals/physici an_gls/pdf/fatigue.pdf on September 28, 2011.
19. Glaus, A., R. Crow, and S. Hammond, A
qualitative study to explore the concept of fatigue/tiredness in cancer patients and in healthy individuals. Eur J Cancer Care
(Engl), 1996. 5(2 Suppl): p. 8-23.
20. Miller, Y., et al., Practice Guidelines for
Blood Transfusion: A compilation from recent peer-reviewed literature. (ed 2);
2007.
21. Wiesen, A.R., et al., Equilibration of
hemoglobin concentration after transfusion in medical inpatients not actively bleeding.
Ann Intern Med, 1994. 121(4): p. 278-30. 22. Kader, A.S., et al., Prognostic significance of
blood transfusions in patients with esophageal cancer treated with combined chemoradiotherapy. Am J Clin Oncol, 2007. 30(5): p. 492-7.
23. Preston, N.J., et al., Blood transfusions for
anaemia in patients with advanced cancer.
Cochrane Database Syst Rev, 2012. 2: p. CD009007.
24. Hill, S.R., et al., Transfusion thresholds and
other strategies for guiding allogeneic red blood cell transfusion. Cochrane Database
Syst Rev, 2002(2): p. CD002042.
25. Blajchman, M.A. and E.C. Vamvakas, The
continuing risk of transfusion-transmitted infections. N Engl J Med, 2006. 355(13): p.
1303-5.
26. King, K.E., et al., Universal leukoreduction
decreases the incidence of febrile nonhemolytic transfusion reactions to RBCs. Transfusion, 2004. 44(1): p. 25-9.
27. Yazer, M.H., et al., The effect of prestorage
WBC reduction on the rates of febrile nonhemolytic transfusion reactions to platelet concentrates and RBC. Transfusion,
2004. 44(1): p. 10-5.
28. Khorana, A.A., et al., Blood transfusions,
thrombosis, and mortality in hospitalized patients with cancer. Arch Intern Med,
2008. 168(21): p. 2377-81.
29. Jabbour, E., et al., Red blood cell
transfusions and iron overload in the treatment of patients with myelodysplastic syndromes. Cancer, 2008. 112(5): p.
1089-95.
30. Crawford, J., et al., Relationship between
changes in hemoglobin level and quality of life during chemotherapy in anemic cancer patients receiving epoetin alfa therapy.
Cancer, 2002. 95(4): p. 888-95.
31. Hebert, P.C., et al., A multicenter,
randomized, controlled clinical trial of transfusion requirements in critical care. Transfusion Requirements in Critical Care Investigators, Canadian Critical Care Trials Group. N Engl J Med, 1999. 340(6): p.
409-17.
32. Egrie, J.C., et al., Darbepoetin alfa has a
longer circulating half-life and greater in vivo potency than recombinant human erythropoietin. Exp Hematol, 2003. 31(4):
p. 290-9.
33. Egrie, J.C., et al., Characterization and
biological effects of recombinant human erythropoietin. Immunobiology, 1986. 172(3-5): p. 213-24.
34. Littlewood, T.J., et al., Effects of epoetin
alfa on hematologic parameters and quality of life in cancer patients receiving nonplatinum chemotherapy: results of a
randomized, double-blind,
placebo-controlled trial. J Clin Oncol, 2001. 19(11):
p. 2865-74.
35. Vansteenkiste, J., et al., Double-blind,
placebo-controlled, randomized phase III trial of darbepoetin alfa in lung cancer patients receiving chemotherapy. J Natl
Cancer Inst, 2002. 94(16): p. 1211-20. 36. Bohlius, J., et al., Recombinant human
20
erythropoietins and cancer patients: updated meta-analysis of 57 studies including 9353 patients. J Natl Cancer Inst,
2006. 98(10): p. 708-14.
37. Rizzo, J.D., et al., American Society of
Clinical Oncology/American Society of Hematology clinical practice guideline update on the use of epoetin and darbepoetin in adult patients with cancer. J
Clin Oncol, 2010. 28(33): p. 4996-5010. 38. Hedenus, M., et al., Efficacy and safety of
darbepoetin alfa in anaemic patients with
lymphoproliferative malignancies: a
randomized, double-blind,
placebo-controlled study. Br J Haematol, 2003. 122(3): p. 394-403.
39. Henke, M., et al., Erythropoietin to treat
head and neck cancer patients with
anaemia undergoing radiotherapy:
randomised, double-blind,
placebo-controlled trial. Lancet, 2003. 362(9392): p.
1255-60.
40. Leyland-Jones, B., et al., Maintaining
normal hemoglobin levels with epoetin alfa in mainly nonanemic patients with metastatic breast cancer receiving first-line chemotherapy: a survival study. J Clin
Oncol, 2005. 23(25): p. 5960-72.
41. Smith, R.E., Jr., et al., Darbepoetin alpha for
the treatment of anemia in patients with active cancer not receiving chemotherapy or radiotherapy: results of a phase III, multicenter, randomized, double-blind, placebo-controlled study. J Clin Oncol,
2008. 26(7): p. 1040-50.
42. Thomas, G., et al., Phase III trial to evaluate
the efficacy of maintaining hemoglobin levels above 12.0 g/dL with erythropoietin vs above 10.0 g/dL without erythropoietin in anemic patients receiving concurrent radiation and cisplatin for cervical cancer.
Gynecol Oncol, 2008. 108(2): p. 317-25. 43. Wright, J.R., et al., Randomized,
double-blind, placebo-controlled trial of
erythropoietin in non-small-cell lung cancer with disease-related anemia. J Clin Oncol,
2007. 25(9): p. 1027-32.
44. Untch, M., et al., PREPARE trial: a
randomized phase III trial comparing preoperative, dose-dense, dose-intensified chemotherapy with epirubicin, paclitaxel
and CMF with a standard-dosed
epirubicin/cyclophosphamide followed by paclitaxel +/- darbepoetin alfa in primary breast cancer: A preplanned interim analysis of efficacy at surgery [abstract].J
Clin Oncol 2008:26(Suppl15):Abstract 517.
Available at:
http://meeting.ascopubs.org/cgi/content/a nstract/26/15_suppl/517.
45. Overgaard, J., et al., Randomized study of
darbepoetin alfa as modifier of
radiotherapy in patients with primary squamous cell carcinoma of the head and neck (HNSCC): Final outcome of the DAHANCA 10 trial [abstract]. J Clin Oncol,
2009:27(Suppl15):Abstract 6007. Available at:
http://meeting.ascopubs.org/cgi/content/a bstract/27/15S/6007.
46. Bohlius, J., et al., Recombinant human
erythropoiesis-stimulating agents and mortality in patients with cancer: a meta-analysis of randomised trials. Lancet, 2009. 373(9674): p. 1532-42.
47. Tonelli, M., et al., Benefits and harms of
erythropoiesis-stimulating agents for anemia related to cancer: a meta-analysis.
CMAJ, 2009. 180(11): p. E62-71.
48. Bennett, C.L., et al., Venous thromboembolism and mortality associated with recombinant erythropoietin and
darbepoetin administration for the
treatment of cancer-associated anemia.
JAMA, 2008. 299(8): p. 914-24.
49. Ludwig, H., et al., Pooled analysis of
individual patient-level data from all
randomized, double-blind,
placebo-controlled trials of darbepoetin alfa in the treatment of patients with chemotherapy-induced anemia. J Clin Oncol, 2009. 27(17):
p. 2838-47.
50. Glaspy, J., et al., Erythropoiesis-stimulating
agents in oncology: a study-level meta-analysis of survival and other safety outcomes. Br J Cancer, 2010. 102(2): p.
301-15.
51. Engert, A., et al., Epoetin alfa in patients
with advanced-stage Hodgkin's lymphoma: results of the randomized placebo-controlled GHSG HD15EPO trial. J Clin
21 52. Moebus, V., et al., Intense dose-dense
sequential chemotherapy with epirubicin,
paclitaxel, and cyclophosphamide
compared with conventionally scheduled chemotherapy in high-risk primary breast cancer: mature results of an AGO phase III study. J Clin Oncol, 2010. 28(17): p.
2874-80.
53. Untch, M., et al., PREPARE trial: a
randomized phase III trial comparing preoperative, dose-dense, dose-intensified chemotherapy with epirubicin, paclitaxel and CMF versus a standard-dosed epirubicin/cyclophosphamide followed by paclitaxel +/- darbepoetin alfa in primary breast cancer--results at the time of surgery. Ann Oncol, 2011. 22(9): p.
1988-98.
54. Osterborg, A., et al., Preclinical studies of
erythropoietin receptor expression in tumour cells: impact on clinical use of erythropoietic proteins to correct cancer-related anaemia. Eur J Cancer, 2007. 43(3):
p. 510-9.
55. Elliott, S., et al., Anti-Epo receptor
antibodies do not predict Epo receptor expression. Blood, 2006. 107(5): p. 1892-5.
56. LaMontagne, K.R., et al., Recombinant
epoetins do not stimulate tumor growth in erythropoietin receptor-positive breast carcinoma models. Mol Cancer Ther, 2006. 5(2): p. 347-55.
57. Fandrey, J., Erythropoietin receptors on
tumor cells: what do they mean?
Oncologist, 2008. 13 Suppl 3: p. 16-20. 58. Broudy, V.C., et al., Erythropoietin receptor
characteristics on primary human erythroid cells. Blood, 1991. 77(12): p. 2583-90.
59. Witthuhn, B.A., et al., JAK2 associates with
the erythropoietin receptor and is tyrosine phosphorylated and activated following stimulation with erythropoietin. Cell, 1993. 74(2): p. 227-36.
60. Huang, L.J., S.N. Constantinescu, and H.F. Lodish, The N-terminal domain of Janus
kinase 2 is required for Golgi processing
and cell surface expression of
erythropoietin receptor. Mol Cell, 2001. 8(6): p. 1327-38.
61. Hadland, B.K. and G.D. Longmore,
Erythroid-stimulating agents in cancer
therapy: potential dangers and biologic mechanisms. J Clin Oncol, 2009. 27(25): p.
4217-26.
62. Elliott, S., et al., Identification of a sensitive
anti-erythropoietin receptor monoclonal antibody allows detection of low levels of EpoR in cells. J Immunol Methods, 2010. 352(1-2): p. 126-39.
63. Swift, S., et al., Absence of functional EpoR
expression in human tumor cell lines.
Blood, 2010. 115:4254-4263.
64. Rossi, J., et al., Analysis of cell surface
erythropoietin receptor (EpoR) expression and function in fuman epithelial tumor tissues. J Clin Oncol, 2009:27(Suppl 15):
Abstract 11104
65. Sinclair, A.M., et al., Functional erythropoietin receptor is undetectable in endothelial, cardiac, neuronal, and renal cells. Blood, 2010. 115(21): p. 4264-72.
66. Lyman, G.H., et al., American Society of
Clinical Oncology guideline:
recommendations for venous
thromboembolism prophylaxis and
treatment in patients with cancer. J Clin
Oncol, 2007. 25(34): p. 5490-505.
67. Schrijvers, D., H. De Samblanx, and F. Roila,
Erythropoiesis-stimulating agents in the treatment of anaemia in cancer patients: ESMO Clinical Practice Guidelines for use.
Ann Oncol, 2010. 21 Suppl 5: p. v244-7. 68. Heit, J.A., et al., Risk factors for deep vein
thrombosis and pulmonary embolism: a population-based case-control study. Arch
Intern Med, 2000. 160(6): p. 809-15. 69. Khorana, A.A., et al., Thromboembolism is a
leading cause of death in cancer patients receiving outpatient chemotherapy. J
Thromb Haemost, 2007. 5(3): p. 632-4. 70. Levine, M.N., et al., The thrombogenic
effect of anticancer drug therapy in women with stage II breast cancer. N Engl J Med,
1988. 318(7): p. 404-7.
71. Saphner, T., D.C. Tormey, and R. Gray,
Venous and arterial thrombosis in patients who received adjuvant therapy for breast cancer. J Clin Oncol, 1991. 9(2): p. 286-94.
72. Glaspy, J., et al., Evaluation of the
association between hemoglobin(Hb)
events and safety outcomes in cancer patients (pts) with chemotherapy-induced
22
anemia (CIA):an integrated analysis of patient-level data from 6 randomyzed, placebo-controlled trials (RCTs) of darbepoetin [abstract]. Eur J Cancer Suppl,
2007:5:Abstract 147.
73. Pfeffer, M.A., et al., A trial of darbepoetin
alfa in type 2 diabetes and chronic kidney disease. N Engl J Med, 2009. 361(21): p.
2019-32.
74. Aapro, M., et al., Effects of erythropoietin
receptors and erythropoiesis-stimulating agents on disease progression in cancer. Br
J Cancer, 2012. 106(7): p. 1249-58.
75. Food and Drug Administration. Epoetin alfa
label. Available at:
http://www.acessdata.fda.gov/drugsatfda_ docs/label/2011/103234Orig1s5166_1032 34Orig1s5266lbl.pdf.
76. Ballen, K.K., et al., Autologous stem-cell
transplantation can be performed safely without the use of blood-product support. J
Clin Oncol, 2004. 22(20): p. 4087-94. 77. Ballen, K.K., et al., Successful autologous
bone marrow transplant without the use of blood product support. Bone Marrow
Transplant, 2000. 26(2): p. 227-9.
78. Brown, N.M., S.Y. Kim, and P.A. Ford,
Autologous stem cell transplants in
Jehovah's Witnesses. Bone Marrow
Transplant, 2009. 44(6): p. 391-2.
79. Goodnough, L.T., Erythropoietin and
iron-restricted erythropoiesis. Exp Hematol,
2007. 35(4 Suppl 1): p. 167-72.
80. Henry, D.H., Supplemental Iron: A Key to
Optimizing the Response of Cancer-Related Anemia to rHuEPO? Oncologist, 1998. 3(4):
p. 275-278.
81. Weiss, G. and L.T. Goodnough, Anemia of
chronic disease. N Engl J Med, 2005. 352(10): p. 1011-23.
82. Sun, C.C., et al., Targeting the
hepcidin-ferroportin axis to develop new treatment strategies for anemia of chronic disease and anemia of inflammation. Am J
Hematol, 2012. 87(4): p. 392-400.
83. Silverstein, S.B., et al., Intravenous Iron
Therapy: A summary of treatment options and review of guidelines. Journal of
Pharmacy Practice, 2008:21:431-443. 84. Bohlius, J., Is intravenous iron
supplementation with
erythropoiesis-stimulating agents beneficial in cancer patients with anemia? Nat Clin Pract Oncol,
2008. 5(12): p. 688-9.
85. Auerbach, M., et al., Intravenous iron
optimizes the response to recombinant human erythropoietin in cancer patients with chemotherapy-related anemia: a multicenter, open-label, randomized trial. J
Clin Oncol, 2004. 22(7): p. 1301-7.
86. Bastit, L., et al., Randomized, multicenter,
controlled trial comparing the efficacy and safety of darbepoetin alpha administered every 3 weeks with or without intravenous iron in patients with chemotherapy-induced anemia. J Clin Oncol, 2008. 26(10): p.
1611-8.
87. Hedenus, M., et al., Addition of intravenous
iron to epoetin beta increases hemoglobin response and decreases epoetin dose requirement in anemic patients with
lymphoproliferative malignancies: a
randomized multicenter study. Leukemia,
2007. 21(4): p. 627-32.
88. Henry, D.H., et al., Intravenous ferric
gluconate significantly improves response to epoetin alfa versus oral iron or no iron in anemic patients with cancer receiving chemotherapy. Oncologist, 2007. 12(2): p.
231-42.
89. Pedrazzoli, P., et al., Randomized trial of
intravenous iron supplementation in
patients with chemotherapy-related
anemia without iron deficiency treated with darbepoetin alpha. J Clin Oncol, 2008. 26(10): p. 1619-25.
90. Steensma, D.P., et al., Phase III, randomized
study of the effects of parenteral iron, oral iron, or no iron supplementation on the erythropoietic response to darbepoetin alfa for patients with chemotherapy-associated anemia. J Clin Oncol, 2011. 29(1): p.
97-105.
91. Lapointe, M., Iron supplementation in the
intensive care unit: when, how much, and by what route? Crit Care, 2004. 8 Suppl 2:
p. S37-41.
92. Maynor, L. and D.F. Brophy, Risk of infection
with intravenous iron therapy. Ann
Pharmacother, 2007. 41(9): p. 1476-80. 93. Auerbach, M., H. Ballard, and J. Glaspy,
23
anaemia. Lancet, 2007. 369(9572): p.
1502-4.
94. Lac, P.T., et al., The effects of changing
vitamin D levels on anemia in chronic kidney disease patients: a retrospective cohort review. Clin Nephrol, 2010. 74(1): p.
25-32.
95. Aucella, F., et al., Calcitriol increases
burst-forming unit-erythroid proliferation in
chronic renal failure. A synergistic effect with r-HuEpo. Nephron Clin Pract, 2003. 95(4): p. c121-7.
96. Panichi, V., et al., Calcitriol modulates in
vivo and in vitro cytokine production: a role for intracellular calcium. Kidney Int, 1998. 54(5): p. 1463-9.
![Tabela I: Classificação da anemia no cancro – NCI- NCI-CTCAE v4.0 [6] 1 2 3 4 Anemia Hgb <LIN 10.0 g/dL Hgb <10.0 8.0 g/dL Hgb <8.0 6,5g/dL Hgb <6.5 g/dL](https://thumb-eu.123doks.com/thumbv2/123dok_br/19200770.953678/4.892.497.837.154.391/tabela-classificação-anemia-cancro-nci-nci-ctcae-anemia.webp)