Avaliação in vitro da citotoxidade e genotoxidade dos polímeros de albumina magnéticos
Texto
(2) CAMILA DE ARRUDA SALDANHA. AVALIAÇÃO IN VITRO DA CITOTOXICIDADE E GENOTOXICIDADE DOS POLÍMEROS DE ALBUMINA MAGNÉTICOS. Dissertação apresentada ao curso de PósGraduação em Biologia Animal, do Instituto de Ciências Biológicas da Universidade de Brasília, para obtenção do Grau de Mestre.. Orientadoras: Profa. Dra. Zulmira Guerrero Marques Lacava Profa. Dra. Maria de Fátima Menezes Almeida Santos. Brasília – D F Dezembro- 2007.
(3) DEDICATÓRIA. Dedico este trabalho à minha família (Amariles, Délcio, Caroline e Felipe) pelo carinho, incentivo e dedicação prestados a mim hoje e sempre..
(4) AGRADECIMENTOS À Deus pela oportunidade diária de vida e graças recebidas diariamente; Às professoras Zulmira Guerrero Marques Lacava e Maria de Fátima M. A. Santos pela oportunidade, paciência, incentivo e orientação; Aos meus pais pela confiança e apoio nos momentos necessários; Aos colegas Bruno Lacava, Andreza Simioni e A. C. Tedesco por gentilmente ter cedido a amostra de polímeros de albumina magnético; À Luciana Pereira pela grande ajuda na elaboração do trabalho; À professora Isabel pela grande ajuda para análise da estatística dos meus dados; Aos professores César Grisólia e Ricardo Bentes por me ajudarem nos momentos que precisei; Aos meus colegas queridos (Luciana, Dani, Júlia, Neda, Mirian, Débora, Elisa, Grazi e Carol) por tudo de bom que vocês me proporcionaram durante estes dois anos. Obrigada pelos ensinamentos, carinho, amizade, gargalhadas (que foram muitas), companhia e respe ito que vocês sempre tiveram por mim. Adoro vocês; Aos técnicos Djalma, Felipe e Ornil por toda ajuda e dicas no laboratório; E todos aqueles que de alguma forma convivem comigo e me auxiliam..
(5) ÍNDICE. ABREVIATURAS RESUMO ABSTRACT 1 INTRODUÇÃO................................................................................................................01 2 OBJETIVO.......................................................................................................................07 3 MATERIAL E MÉTODOS............................................................................................09 3.1 Polímeros de Albumina Magnéticos...............................................................................10 3.2 Caracterização das partículas de maghemita dispersa em solução aquosa de albumina bovina por Microscopia Eletrônica de Transmissão.............................................................11 3.3. Manutenção e propagação das células submandibulares humana – HSG - e das células mesangiais humanas – CM....................................................................................................11 3.4 Determinação das concentrações de PAM a ser administradas às células HSG e CM...11 3.5 Tratamento das células HSG e CM com PAM para os ensaios de toxicidade e genotoxicidade......................................................................................................................12 3.6 Distinção entre apoptose e necrose das células HSG e CM por meio de ensaio de coloração com alaranjado de acridina e brometo de etídeo..................................................13 3.6.1 Critérios para classificação das células em apoptóticas, necróticas ou viáveis...........14 3.6.2 Análise estatística........................................................................................................14 3.7 Avaliação dos danos no DNA por meio de eletroforese de células isoladas em microgel – “Ensaio Cometa”................................................................................................................15.
(6) 3.7.1 Critérios para análise dos danos no DNA....................................................................16 3.7.2 Análise Estatística.......................................................................................................18 3.8 Análise da morfologia das células HSG e CM tratadas com PAM................................18 3.8.1 Processamento das células HSG e CM para análise da morfologia celular em microscopia de luz ...............................................................................................................18 3.8.2 Processamento das células HSG e CM para análise da morfologia celular em microscopia eletrônica de transmissão..................................................................................19 4 RESULTADOS................................................................................................................21 4.1 Caracterização das nanopartículas magnéticas...............................................................22 4.1.1 Determinação do diâmetro das amostras do FMF.......................................................22 4.2 Efeitos da amostra de polímeros de albumina magnéticos sobre a viabilidade das células HSG e CM ...........................................................................................................................23 4.2.1 Células HSG.................................................................................................................24 4.2.2 Células CM..................................................................................................................24 4.3 Distinção entre apoptose e necrose das células HSG e CM por meio de ensaio de coloração de alaranjado de acridina e brometo de etídeo.....................................................25 4.3.1 Células HSG.................................................................................................................25 4.3.2 Células CM..................................................................................................................27 4.4 Avaliação dos danos no DNA em células HSG e CM tratadas com polímeros de albumina magnéticos (PAM)................................................................................................28 4.4.1 Células HSG.................................................................................................................28 4.4.2 Células CM..................................................................................................................30 4.5 Análise da morfologia e da ultra-estrutura das células HSG e CM tratadas com polímeros de albumina magnéticos.......................................................................................32.
(7) 4.5.1 Análise da morfologia das células HSG - microscopia de luz.....................................32 4.5.2 Análise da morfologia das células CM - microscopia de luz.......................................34 4.5.3. Análise. da. morfologia. das. células. HSG –. Microscopia. Eletrônica. de. Transmissão...........................................................................................................................35 4.5.4 Análise da morfologia das células CM por Microscopia Eletrônica de Transmissão..35 5 DISCUSSÃO.....................................................................................................................38 6 CONCLUSÂO..................................................................................................................48 7 REFERÊNCIAS BIBLIOGRÁFICAS .........................................................................50.
(8) ABREVIATURAS. AA – Alaranjado de acridina BE – Brometo de etídio CM – Célula mesangial DNA – Ácido desoxirribonucléico DMSA - Ácido dimercapto succínico HCL – Ácido clorídrico HSG – Células ductais d e glândula salivar humana irradiada ID – Índice de danos no DNA MET – Microscópio eletrônico de Transmissão NPM – Nanopartículas magnéticas PAM – Polímeros de albumina magnéticos RNA – Ácido ribonucléico UA – unidade arbitraria.
(9) I. RESUMO.
(10) A nanotecnologia tem despertado crescente interesse na área biomédica. Materiais nanoestruturados e, em particular fluidos magnéticos, magnetolipossomas e polímeros magnéticos, constituídos a partir de nanopartículas magnéticas (NPM) têm sido propostos como entregadores de drogas, para separação de células, diagnóstico in vitro ou in vivo, e para o tratamento de diversas patologias. Uma nova amostra magnética que possa efetuar estes procedimentos foi desenvolvida: polímeros de albumina magnéticos (PAM) contendo nanopartículas de maghemita (diâmetro 9,2nm; 2,46 × 1014 partículas/mg). Para atender aos requisitos de que os efeitos biológicos de um novo material sejam conhecidos antes que sejam testados clinicamente, este trabalho teve como objetivo a avaliação, in vitro, de possíveis efeitos citotóxicos e genotóxicos dos polímeros de albumina magnéticos (PAM). Células de glândula submandibular humana (HSG) e células mesangiais (CM) foram cultivadas na presença da amostra PAM em três diferentes concentrações (250µg/mL, 150µg/mL e 75µg/mL) por 24 horas. A citotoxicidade foi avaliada por meio de ensaio de coloração de alaranjado de acridina/brometo de etídio e a genotoxicidade por meio de ensaio de cometa. Além disso, foram realizadas análises morfológicas em microscopia de luz e da ultra-estrutura em microscopia eletrônica de transmissão. Os resultados mostraram que a amostra PAM: (1) apresenta citotoxicidade relacionada à concentração da amostra e tipo celular; (2) induz, como principal via de degeneração, a apoptose, que é sempre menor do que 20%; (3) tem atividade genotóxica, mas, em sua maioria, os danos são de intensidade leve (classe 1 e 2); (4) em concentrações menores, pode apresentar atividade genotóxica e não ter correspondente atividade citotóxica; (5) não apresentou alterações na morfologia ou ultra-estrutura de ambas as células; (6) teve suas NPM interiorizadas por algumas células. A citotoxicidade e genotoxicidade observadas podem ter relação com radicais livres induzidos pela presença de ferro nas NPM. Esses resultados sugerem uma possível biocompatibilidade da amostra PAM, sugerindo que testes in vivo sejam realizados para aprofundar o entendimento das interações entre os polímeros de albumina – nanopartículas de maghemita e as células-tecidos animais..
(11) II. ABSTRACT.
(12) Nanotechnology is marked by an increasing interest in the biomedical field. Nanostructured materials, such as magnetic fluids, magnetoliposomes, and magnetic polymers, composed of magnetic nanoparticles (NPM’s) have been proposed for several applications: drug delivery systems, cell sorter, in vitro and in vivo diagnosis, and also for the treatment of several pathologies. A new sample, the ma gnetic albumin polymers (PAM) composed of maghemite nanoparticles (diameter 9.2nm; 2.46 × 1014 particle/mg) has been developed for biomedical applications purposes. New materials have to be biologically investigated before their clinical tests. In accordance with this requirement, the aim of this work was to evaluate, in vitro, the cytotoxicity and genotoxicity degrees of PAM sample. Human submandibular duct cells (HSG) and mesangial cells (CM) were cultivated during 24 hours in the presence of the PAM sample at three different concentrations (250µg/mL, 150µg/mL e 75µg/mL). The cytotoxicity was evaluated through acridine orange/ethidium bromide staining assay. The genotoxicity was investigated through the comet assay. Further, cells morphology and ultra structure were investigated by both light and transmission electronic microscopes analyses. The data show that the sample PAM (1) presents cytotoxicity related to the sample concentration and cellular type; (2) conducts less than 20% of cell to death; death are mainly by apoptosis; (3) presents genotoxic activity but the induced damage s are not intense (classes 1 and 2); (4) at the minor concentrations may present genotoxic activity without parallel cytotoxicity; (5) does not induce morphological or ultra structural alterations on both cellular types; (6) NPM’s may be internalized by HSG and CM cells. The PAM cytotoxicity and genotoxicity activities may be related to the free radical production induced by the NPM’s iron content. The results suggest that PAM is possibly biocompatible and also that this sample deserves to be investigated through in vivo tests that can elucidate the albumin po lymers- maghemite particles and animal cell-tissues interactions..
(13) 1. INTRODUÇÃO.
(14) Nas últimas décadas, a área da ciência denominada nanotecnologia tem despertado interesse crescente, pois utiliza materiais e sistemas cujas estruturas e componentes exibem propriedades físicas, químicas e/ou bio lógicas significativamente novas. Muitas dessas novas propriedades surgem em função do tamanho extremamente pequeno das nanopartículas que, de forma ideal, varia entre 1 e 100 nm (Reith, 2003; Chan, 2006; Naschie, 2006). Dentre os materiais nanoestruturados, as nanopartículas magnéticas (NPM) têm se destacado nas áreas biomédicas por apresentarem características como alta proporção na relação superfície/volume e capacidade de responder a um gradiente de campo magnético. Além disso, quando em escala nanométrica, esses materiais se comportam como partículas superparamagnéticas, ou seja, não retém magnetismo após a remoção do campo magnético (Berry & Curtis, 2003a; Gupta & Gupta, 2005b). Dentre as várias aplicações biomédicas das NPM destacam-se a separação, a purificação e a concentração de biomoléculas e de células, diagnóstico por imagem de ressonância magnética, sistema de entrega de drogas em sítios específicos, indução de hipertermia para tratamento de diversas patologias, em particular o câncer. Para separar, purificar e concentrar biomoléculas e células, as NPM são, usualmente, associadas a moléculas que possam identificá- las. Quando adicionadas a uma solução, ou suspensão, contendo essas biomoléculas e/ou células, as NPM formam um complexo que pode ser recolhido por meio de um separador magnético. Um caso particular de separação de células pode ser obtido ao ligar-se as NPM a um anticorpo específico. Quando as células alvo são reconhecidas pelo anticorpo ficam marcadas magneticamente e, dessa forma, são separadas por meio de colunas magnéticas e removidas com o auxílio de um magneto externo (Safarik & Safarikova, 1999). Utilizando essa tecnologia de separação imunomagnética, em 2006, Matsunaga e colaboradores, conseguiram. isolar células. CD14+. para serem posteriormente. diferenciadas em células dendríticas. Também em 2006, Chen e colaboradores isolaram células CD34+ umbilicais de um pool de células hematopoiéticas com o objetivo de utilizá- las em terapias de transplante celular. As NPM são capazes de funcionar como agente de contraste nas imagens por ressonância magnética (MRI), aumentando a sensibilidade do diagnóstico (Berry &.
(15) Curtis, 2003a; Ito et al., 2005; Neuberger et al., 2005). Para tanto, basta que as nanopartículas, mesmo em baixas concentrações, sejam capturadas pelas células e nelas permaneçam pelo tempo necessário para o diagnóstico. A eficácia das NPM como agentes de contraste depende de suas propriedades físico-químicas como tamanho e da ligação que estabelecem com outras moléculas, como por exemplo, aquelas utilizadas para recobrí- las, o que afetará sua farmacocinética e biodistribuição (Berry & Curtis, 2003a; Neuberger et al., 2005). NPM específicas para o fígado foram utilizadas como agente de contraste pela primeira vez na Europa, em 1995. Desde então, vários trabalhos têm mostrado que NPM, principalmente as de óxido de ferro, são veiculadas espontânea e preferencialmente para nódulos linfáticos. Assim, por meio de MRI, podem ser detectadas, em fase precoce, metástases para nódulos linfáticos dos tumores de testículo (Harisinghani et al., 2005), bexiga, próstata, uretra, mama, cólon (Harisinghani et al., 2004) e gástricos (Tatsumi et al., 2006). Esse método é mais específico e mais sensível do que o método convencional, que considera somente o tamanho do nódulo linfático. Em 2005, Harisinghani e colaboradores observaram que na detecção de nódulos linfáticos malignos em pacientes com câncer de testículo, a MRI com nanopartículas mostrava sensibilidade e especificidade de 88,2% e 92%, enquanto no critério convencional esses parâmetros são de 70,5% e 78%, respectivamente. As NPM também podem ser utilizadas como sistemas entregadores de drogas em sítios específicos, para tratamento de diversas doenças, entre elas o câncer. Assim, as nanopartículas associadas a quimioterápicos podem ser levadas a um local específico por meio de um campo magnético externo, aumentando a eficácia do tratamento e reduzindo os efeitos colaterais em tecidos normais (Arruebo et al., 2007). A primeira tentativa clínica que utilizou NPM como entregadores de drogas foi realizada por Lübbe e colaboradores (1996). Esses autores utilizaram nanopartículas de óxido de ferro associadas ao quimioterápico Epirrubicina em pacientes com tumores sólidos e demonstraram que o complexo nanopartículas-quimioterápico não era tóxico e acumulava-se no tecido tumoral. Mais recentemente, Alexiou e colaboradores (2005) administraram nanopartículas conjugadas ao quimioterápico Mitoxantrona em coelhos e observaram que este complexo aparecia mais concentrado no tecido tumoral, mesmo quando apenas 50% da dose do quimioterápico livre era aplicada..
(16) Além das aplicações já citadas, as NPM podem ser utilizadas para destruir células tumorais (magnetotermocitólise), pois quando submetidas a um campo magnético de freqüência alternada, absorvem energia que é convertida em calor, induzindo hipertermia (Hilger et al., 2005; Wang, Gu et al., 2005). Na hipertermia gerada magneticamente, processo denominado magnetohipertermia (Guedes et al., 2005), a temperatura nas células tumorais pode chegar até 41º - 45ºC (Lee et al., 2007), calor suficiente para destruí-las. O calor é normalmente dissipado pela circulação sanguínea, mas os tecidos tumorais possuem uma rede de vasos sanguíneos desordenada, o que torna a circulação do sangue lenta e irregular, tornando as células mais susceptíveis ao calor (BSD Medical Corporation, 2002; Hildebrandt et al., 2002). Vários trabalhos mostram que a hipertermia induz danos no citoesqueleto, na membrana citoplasmática e nas membranas de organe las, como as das mitocôndrias, lisossomas e retículo endoplasmático. Além disso, aumenta a imunogenicidade do tumor, potencializa os efeitos da radioterapia e aumenta a ação de drogas antineoplásicas (BSD Medical Corporation, 2002; Hildebrandt et al., 2002; Wust et al., 2002; Tanaka et al., 2005). Seu papel sobre os efeitos da radioterapia e das drogas antineoplásicas é provavelmente devido ao aumento da perfusão tecidual, indução da dispersão de radicais de oxigênio na radioterapia e distribuição mais adequada da droga antineoplásica (Hildebrandt et al., 2002; Wust et al., 2002; Sreenivasa et al., 2006). Consideradas não tóxicas, as NPM mais testadas nas aplicações biomédicas são as de óxido de ferro, quer na forma de magnetita (Fe3 O 4 ) ou em sua forma oxidada, a maghemita (?Fe 2 O 3). Quando dispersas em soluções coloidais, constituem os fluidos magnéticos, que podem ser iônicos, quando a estabilidade coloidal é controlada por uma maior ou menor repulsão eletrostática entre as nanopartículas, surfactantes, qua ndo as NPM são recobertas por uma camada molecular (que pode ser de cadeias carbônicas relativamente longas), ou ainda iônico-surfactantes. Com o propósito de realizar aplicações biomédicas das NPM, pesquisadores do Centro de Nanociência e Nanobiotecnologia da UnB (CNANO) desenvolveram um fluido. magnético. iônico. constituído. por. nanopartículas. de. maghemita. que,. subseqüentemente, foram encapsuladas em polímeros de albumina (PAM) que apresentaram alta susceptibilidade magnética. Devido a essa característica, esse novo.
(17) material deve possibilitar a magnetohipertermia, como também favorecer a entrega de drogas sítio -específica. Antes de sua utilização em aplicações biomédicas, entretanto, os efeitos da administração de novos materiais devem ser testados em sistemas biológicos. A genotoxicidade e a citotoxidade de uma substância podem ser avaliadas por meio de estudos que envolvam a análise de danos no DNA. Um deles é o ensaio de eletroforese de células isoladas em microgel – Ensaio Cometa – o qual envolve lise e eletroforese de células embebidas em agarose, tornando possível a detecção de quebras no DNA de núcleos interfásicos. Neste método, células com maior quantidade de danos no DNA apresentam migração mais rápida do material genético durante a eletroforese, sendo a extensão do dano avaliada pelo deslocamento do material genético (cauda do cometa formada) em relação ao núcleo (Oliver et al., 1990; Lee, Kwon & Chung, 2003). A realização dessa técnica em condições alcalinas permite mensurar não somente quebras nas duas fitas do DNA, mas também em uma única fita do DNA de núcleos interfásicos, além de permitir detectar sítios susceptíveis a ataques alcalinos. Apresenta várias vantagens em relação a outros testes de genotoxicidade, como requerimento de pequena quantidade de células que não precisam estar em proliferação, baixo custo, facilidade e rapidez, e alta sensibilidade na detecção de baixos níveis de danos no DNA (Tice et al., 2000). Essas características validam o ensaio cometa como uma ferramenta eficiente em estudos de toxicologia genética, como monitoramento de lesões e reparos de DNA de vários tipos celulares (Fracasso et al., 2004; Choy, Benzie & Cho, 2005). O presente momento parece ser pioneiro na utilização deste ensaio na investigação de materiais nanoestruturados. Quebras no DNA podem ser originadas no processo apoptótico e, dessa forma, a interpretação dos resultados obtidos por meio de ensaio cometa pode ser mais precisa quando essa técnica é associada a testes de detecção de células em apoptose (Lee et al., 2003). Um procedimento simples para isso consiste na coloração das células com alaranjado de acridina associado ao brometo de etídio, o que permite a distinção de células viáveis, apoptóticas e necróticas (Kosmider et al., 2004). Outro estudo de grande importância na avaliação da biocompatibilidade e citotoxicidade de células expostas a novos materiais é a análise da morfologia e ultra-estrutura das células..
(18) A avaliação de danos ao material genético utiliza uma variedade de sistemas biológicos que incluem células da medula óssea de roedores, linfócitos e várias outras linhagens celulares cultivadas in vitro (Carrano & Natarajan, 1988). Dentre os modelos experimentais in vitro, diferentes linhagens celulares podem ser utilizadas, incluindo células duc tais de glândula submandibular humana (HSG) e células mesangiais humanas (CM). Estabelecida em 1981, a partir de uma glândula salivar humana irradiada (Shirasuna, Sato & Miyazaky, 1981), a linhagem de células HSG tem sido utilizada em testes de citotoxicidade e genotoxicidade de substâncias terapêuticas (Atsumi et al., 2001; Kaneko et al., 2001) e em estudos de diferenciação celular (Daniels et al., 2000). Por sua vez, a linhagem de células CM foi imortalizada a partir de uma cultura de células primárias, conforme descrito por Banas e colaboradores (1999). É um dos tipos celulares encontrados nos glomérulos dos rins, nos espaços intercapilares imersos em uma matriz mesangial. Elas participam, por contração, da hemodinâmica intraglomerular e do ritmo da filtração glomerular, além de apresentar funções fagocitárias e de depuração de substâncias como imunocomplexos (Menezes, 2005). Células mesangiais têm sido utilizadas em testes de citotoxicidade de citocinas (Lang et al., 2002; Wörnle et al., 2004). A incidência crescente do câncer tem estimulado a busca de processos de diagnóstico e terapia alternativos mais efetivos que possam minimizar os efeitos colaterais severos dos procedimentos convencionais, cirurgia, quimioterapia e radioterapia. Neste contexto, materiais em escala nanométrica, como os polímeros de albumina magnéticos, têm sido desenvolvidos com estes propósitos. A necessidade de se entender os mecanismos de interações entre as nanopartículas e as células, bem como conhecer os efeitos biológicos resultantes dessa interação, justificam esta pesquisa..
(19) 2. OBJETIVOS.
(20) Considerando que os polímeros de albumina magnéticos, amostra recentemente desenvolvida, apresentam alta susceptibilidade magnética e, por conseguinte, grande potencial para aplicações biomédicas, seja como sistema entregador de fármacos ou no processo de magnetohipertermia, procedimentos promissores na terapia do câncer, e considerando ainda que os efeitos biológicos de novos materiais precisam ser conhecidos antes que possam ser testados clinicamente, este trabalho tem como objetivo geral avaliar os efeitos in vitro dos polímeros de albumina magnéticos (PAM) e como objetivos específicos:. 1- Determinar o diâmetro modal das NPM constituintes de PAM; 2- Avaliar possível efeito citotóxico de diferentes concentrações de PAM em células HSG e CM, por meio de ensaio de coloração de alaranjado de acridina/brometo de etídio; 3- Determinar a principal via de degeneração celular após tratamento com PAM; 4- Avaliar possível efeito genotóxico do PAM em células HSG e CM, por meio do ensaio cometa; 5- Verificar uma possível relação entre citotoxicidade e genotoxicidade de PAM; 6- Investigar ocorrência de alterações morfológicas e ultra-estruturais e interiorização de NPM nas células HSG e CM tratadas com PAM..
(21) 3. MATERIAL E MÉTODOS.
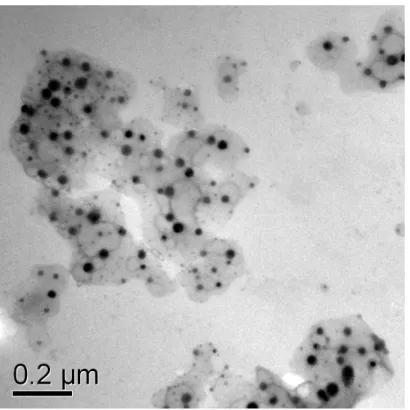
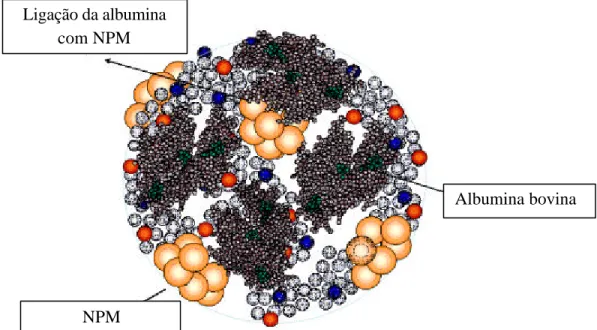
(22) 3.1 Polímeros de Albumina Magnéticos Nanopartículas de maghemita (?-Fe2O 3 ) de uma amostra de fluido magnético iônico (2,28 × 1017 partículas/mL) foram dispersas em solução aquosa de albumina bovina e posteriormente liofilizadas, tendo concentração final de 2,46 × 10 14 partículas/mg. O fluido magnético iônico foi sintetizado no laboratório de Química do Instituto de Física da UnB e suas nanopartículas foram encapsuladas em polímeros de albumina (Figura 1) pelo Grupo de Fotobiologia e Fotomedicina do Departamento de Química da Faculdade de Filosofia, Ciências e Letras de Ribeirão Preto – USP. Para o tratamento das células, os polímeros de albumina magnéticos (PAM) foram diluídos em meio de cultura DMEM (GIBCO-BRL,USA), de forma a se obter diferentes concentrações, conforme descrito nos itens a seguir.. Ligação da albumina com NPM. Albumina bovina. NPM Figura 1. Desenho ilustrativo dos polímeros de albumina magnéticos (Simioni et al., 2006).
(23) 3.2 Caracterização das nanopartículas da amostra PAM por microscopia eletrônica de transmissão. Para determinar o diâmetro das NPM, a amostra PAM foi solubilizada em tampão fosfato pH 2,6 para aumentar a dispersão e facilitar a contagem. As nanopartículas foram analisadas e fotografadas em MET JEOL 1001, no laboratório de microscopia eletrônica da Universidade de Brasília. Das fotos, foram mensurados os diâmetros das nanopartículas (n=500) por meio do programa ImagePro Plus 5.1. A distribuição das partículas foi conseguida utilizando-se o melhor ajuste lognormal.. 3.3 Manutenção e propagação das células submandibulares humana – HSG - e das células mesangiais humanas – CM. As células HSG e CM foram mantidas em meio de cultura DMEM (GIBCO-BRL) suplementado com 10% de soro bovino fetal (GIBCO-BRL), 1% de penicilinaestreptomicina, tamponado com bicarbonato de sódio, sendo o pH 7,4 ajustado pela adição de ácido clorídrico (HCl). As culturas foram estabelecidas a partir de uma passagem inicial de 2 ×105 células em frascos de cultura de 75 cm2 e mantidas em estufa a 37°C, em uma atmosfera de 5% de CO 2 e umidade saturada. Uma vez atingido 80-90% de confluência, as células eram liberadas do fundo do frasco de cultura por tratamento com solução de tripsina 0,125%/EDTA 0,02% por dois minutos, centrifugadas a 175g por cinco minutos, contadas em câmara de Neubauer e passadas para novo frasco de cultura.. 3.4 Determinação das concentrações de PAM a serem administradas às células HSG e CM. De modo a determinar as concentrações dos polímeros de albumina magnéticos (PAM) a serem administradas às células para a realização dos ensaios biológicos foram.
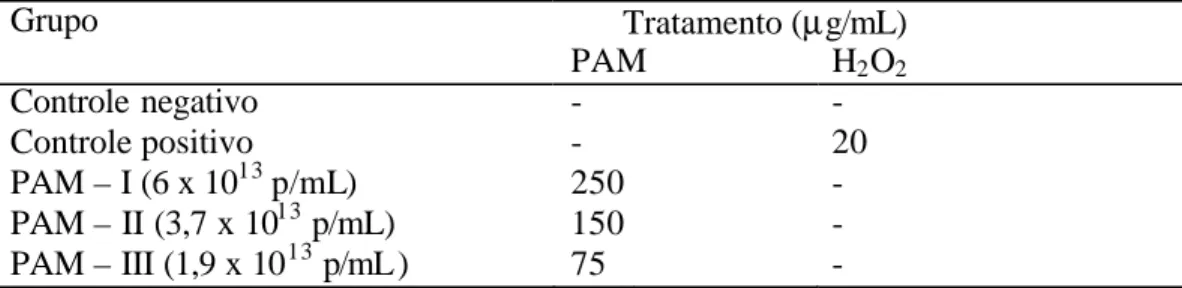
(24) realizados, em triplicata, testes de viabilidade celular. Para isso, as culturas foram mantidas conforme item 3.3 em placas de 9 poços contendo, inicialmente, 2 × 105 células. As concentrações iniciais de PAM foram definidas a partir das concentrações testadas, previamente, por Simioni e colaboradores (2006), em cultura de melanócitos. A amostra PAM foi diluída em meio de cultura, de forma que se obtivessem as duas concentrações de partículas magnéticas a serem testadas, como mostra a Tabela 1.. Tabela 1. Tratamentos administrados às células HSG e CM para o teste de viabilidade celular na presença de PAM Tratamento. Concentração (µg/mL). Sem tratamento. -. PAM. 250. PAM. 125. PAM = polímeros de albumina magnéticos (2,46 × 1014 partículas/mg). Após 24 horas de cultivo na presença da amostra PAM, as células foram tripsinizadas, centrifugadas e ressuspensas em dois mL de meio de cultura. A seguir, a uma alíquota de 10 µL dessa suspensão celular foram adicionados 40 µL do corante azul de tripan a 0,4%, de modo a efetuar-se, em câmara de Neubauer, a contagem das células viáveis. O corante azul de tripan penetra apenas nas células não viáveis, ou seja, as que perderam a integridade da membrana citoplasmática, de modo que, enquanto essas se coram, as células viáveis que mantêm a membrana citoplasmática íntegra, permanecem transparentes (Strober et al., 1997).. 3.5 Tratamento das células HSG e CM com PAM Com base nas concentrações de PAM utilizadas nos testes de viabilidade e seus resultados, foram estabelecidas as concentrações a serem adicionadas às culturas, mantidas por 24 horas nas condições descritas no item 3.4, conforme mostra a Tabela 2..
(25) Os ensaios biológicos foram realizados 24 horas após o cultivo das células. De modo a seguir os padrões estabelecidos nos estudos de genotoxicidade e citotoxicidade, foi incluído o controle positivo, constituído por grupo de células tratadas por uma hora com peróxido de hidrogênio na concentração final de 1mM (20 µg/mL).. Tabela 2. Grupos experimentais para avaliação dos efeitos do PAM sobre as células HSG e CM Grupo Controle negativo Controle positivo PAM – I (6 x 1013 p/mL) PAM – II (3,7 x 1013 p/mL) PAM – III (1,9 x 10 13 p/mL). Tratamento (µg/mL) PAM H2 O2 20 250 150 75 -. PAM = polímeros de albumina magnéticos (2,46 × 1014 partículas/mg). 3.6 Distinção entre as vias de degeneração apoptose e necrose por meio de ensaio de coloração com alaranjado de acridina e brometo de etídio. Para o ensaio de coloração com alaranjado de acridina (AA) e brometo de etídio (BE), realizado em triplicata, células HSG e CM foram cultivadas e mantidas segundo os procedimentos descritos no item 3.5. Após 24 horas da passagem das células, cada grupo experimental recebeu o respectivo tratamento, conforme descrito na Tabela 2 e, depois de 24 horas de tratamento, as células em suspensão e as aderidas aos frascos foram coletadas, submetidas à centrifugação a 750g por 5 minutos e ressuspensas em 100 µL de meio de cultura. De cada amostra foram retirados 20 µL aos quais foram subseqüentemente adicionados 2 µL de uma mistura recém preparada dos corantes de alaranjado de acridina (100 µL/mL água) e brometo de etídio (100 µL/mL água), na proporção 1:1. As células coradas foram então imediatamente colocadas sobre lâminas de microscopia (26 × 76 mm), previamente lavadas e identificadas e, após montagem com lamínulas (24 × 24 mm), foram analisadas por meio de teste cego, em microscópio de.
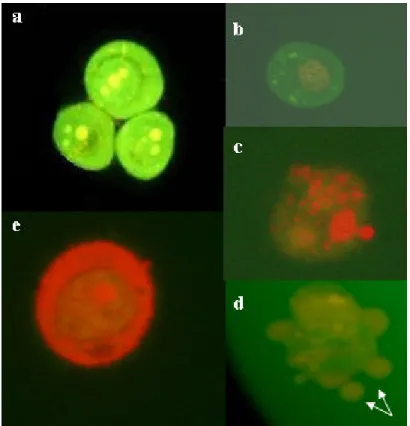
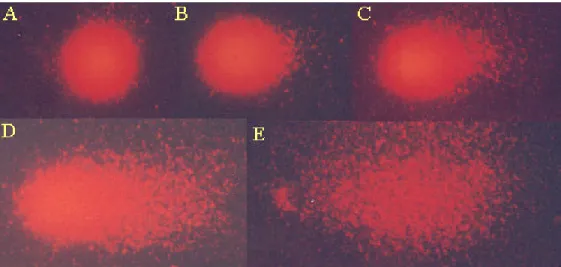
(26) fluorescência (Olympus, filtro de barragem de 530nm) do Laboratório de Genética da Universidade de Brasília. De cada tratamento foram analisadas cerca de 300 células, 100 células em cada uma das triplicatas, no mínimo. 3.6.1 Critérios para classificação das células em apoptóticas, necróticas ou viáveis. As análises para detecção e quantificação de células em apoptose e necrose foram realizadas por meio dos parâmetros cor e aspecto morfológico do núcleo, além da condensação e fragmentação da cromatina. Esta distinção é possível porque, enquanto o alaranjado de acridina (AA) penetra nas células vivas e mortas, resultando na emissão da fluorescência verde por intercalar no DNA e laranja, no RNA, o brometo de etídio (BE) só penetra nas células que já possuem alteração na membrana (apoptose tardia ou necrose), emitindo uma fluorescência laranja ao intercalar no DNA. Dessa forma, segundo Takahashi e colaboradores (2004) e Kosmider e colaboradores (2004), diferentes padrões celulares (representados na Figura 2) podem ser observados e classificados: i). Células vivas possuem núcleo verde uniforme (Figura 2a);. ii). Células em fases iniciais de apoptose ainda possuem suas membranas intactas e, portanto, apresentam núcleo verde, porém não uniformemente corado. Nelas ocorrem condensações da cromatina, clivagem do DNA e/ou fragmentação nuclear (Figura 2b);. iii). Células em fases tardias de apoptose apresentam condensação da cromatina e áreas alaranjadas no núcleo (Figura 2c), pois nas etapas finais do processo já perderam a integridade da membrana e o BE predomina sobre o AA. Células apoptóticas podem ainda apresentar corpos apoptóticos (Liu et al., 2004), como pode ser observado na Figura 2d;. iv). Células necróticas perderam a integridade da membrana e por isso apresentam núcleo alaranjado uniforme (Figura 2e).. 3.6.2 Análise estatística. Para análise dos dados foi aplicado o teste não paramétrico Kruskal-Wallis (ANOVA)..
(27) Figura 2. Análise em microscopia de fluorescência de células HSG classificadas em padrões pré-estabelecidos: (a) célula viável; (b), (c) e (d) células em apoptose; (e) célula em necrose. Aumento total de 400× (Campos da Paz, 2005).. 3.7 Avaliação dos danos no DNA por meio de eletroforese de células isoladas em microgel – “Ensaio Cometa”. O ensaio cometa foi realizado em triplicata, segundo técnica descrita por Singh e colaboradores (1988), modificada por Oliver e colaboradores (1990). Para esse ensaio, as células HSG e CM foram cultivadas e mantidas segundo os procedimentos descritos no item 3.3. Após 24 horas de cultivo, cada grupo experimental recebeu o respectivo tratamento, conforme apresentado na Tabela 2. Depois de 24 horas de tratamento, o meio de cultura foi retirado e colocado em frascos de centrífuga aos quais foram adicionadas as células depois de liberadas do fundo da placa. As amostras foram, então, centrifugadas a 750g, por 5 minutos e as células ressuspensas em 1 (um) mL de PBS. Esse procedimento foi repetido por duas.
(28) vezes. As células foram ressuspensas em 20 µL de agarose de baixo ponto de fusão (Low melting point - LPM-Sigma, USA) a 0,5% em PBS e aquecidas a 37 °C em banho - maria. Imediatamente após esse procedimento, 130 µL dessa mistura foram gotejados em uma lâmina de vidro 26 × 76 mm, previamente preparada. A preparação das lâminas foi feita imergindo-as em agarose tipo II diluída em PBS a 1,5% e depois mantendo-as à temperatura ambiente, por um período de 12 horas. Após o gotejamento das células em agarose LPM sobre as lâminas, uma lamínula foi acoplada a cada lâmina e o conjunto foi levado à geladeira. Para evitar novas quebras no DNA, a partir desta etapa as lâminas estiveram sempre protegidas da luz. Após cinco minutos na geladeira a 4°C, as lamínulas foram removidas e as lâminas mergulhadas em um Koplin contendo solução de lise final gelada ((2,2 M de NaCl, 89,0 mM de EDTA, 8,9 mM de Tris (pH 10), 1% de Triton X-100 e 10% de DMSO) e coberto com papel alumínio. Depois de 1 (uma) hora no tampão de lise, a 4º C, as lâminas foram colocadas em uma cuba horizontal de eletroforese contendo tampão de eletroforese (300 mM NaOH, 1mM EDTA) fresco, pH 13. Após 25 minutos em repouso, procedeu-se a eletroforese a 25 V (0,86 V/cm) e 300 mA por um período de 25 minutos. Uma vez concluída a eletroforese, as lâminas foram lavadas com solução tampão neutralizadora (0,4M Tris, pH 7,5). Esse processo foi repetido três vezes, em intervalos de 5 minutos. As lâminas foram guardadas a 4º C e os nucleóides foram corados no momento da análise. A coloração dos nucleóides foi realizada gotejando-se sobre as lâminas 50 µL de solução aquosa de brometo de etídio 2%.. 3.7.1 Critérios para análise dos danos no DNA A avaliação dos danos no DNA foi feita utilizando-se um microscópio de fluorêscencia, Axioplan-Carl Zeiss, filtro de 510-560 nm, barreira do filtro de 590 nm e aumento total de 400×, no Laboratório de Genética da Universidade de Brasília. De cada tratamento, cerca de 300 nucleóides, 100 em cada uma das triplicatas, no mínimo, foram analisados em teste cego e classificados de acordo com o comprimento da cauda do nucleóide, segundo critério descrito por Jalonszynski e colaboradores (1997),.
(29) em que os nucleóides analisados são classificados de 0 a 4, segundo seu grau de lesão, conforme ilustra a Figura 3.. Figura 3. Análise em microscopia de fluorescência de núcleos de células HSG classificados em padrões preestabelecidos: (A) Classe 0; (B) Classe 1; (C) Classe 2; (D) Classe 3; (E) Classe 4. Aumento total de 400× (Campos da Paz, 2005).. Para a quantificação dos danos no DNA, o escore total para os 300 nucleóides analisados varia de 0 (dano mínimo = nenhuma célula danificada) a 400 (dano máximo = todos os nucleóides com dano de classe 4), sendo estimado a partir da fórmula:. ID (ua) = N 1 + 2N 2 + 3N3 + 4N4 ? /100. onde, ID = índice de danos no DNA; ua= unidade arbitrária; N 1 .... N 4 = nucleóides classificados como de classe 1, 2, 3 ou 4; ? = número de nucleóides analisados, incluindo os da classe zero..
(30) 3.7.2 Análise Estatística. Para a análise estatística dos índices de danos no DNA verificados nas células HSG, foi aplicada a análise de variância (ANOVA). Aos casos em que foram detectadas diferenças entre os tratamentos, foi aplicado o teste Fisher em nível de significância 5% (p<0,05). Nas células CM foi utilizada a transformação “box cox”, adequada para números absolutos e, em seguida, foi aplicada a análise de variância (ANOVA). Do mesmo modo do que o empregado para as células HSG, quando foram detectadas diferenças entre os tratamentos nas células CM, foi aplicado o teste Fisher em nível de significância 5% (p<0,05). Para a análise estatística da freqüência de células com danos no DNA verificadas nas células HSG, foi também aplicada a análise de variância (ANOVA) e, quando detectadas diferenças entre os tratamentos, aplicado o teste Fisher em nível de significância 5% (p<0,05). No caso das células CM, as diferenças nas freqüências de células com danos no DNA foram analisadas pelo teste não paramétrico Kruskal-Wallis (ANOVA).. 3.8 Análise da morfologia e da ultra-estrutura das células HSG e CM tratadas com PAM 3.8.1 Processamento das células HSG e CM para análise da morfologia celular em microscopia de luz. As células foram preparadas para análise morfológica em uma placa de cultura de seis poços, contendo uma lamínula de microscopia (18 × 18mm) em cada poço. Foram cultivadas inicialmente 2 ×105 células que cresceram aderidas às lamínulas. Após 24 horas, cada grupo experimental recebeu tratamento com a amostra PAM, conforme descrito na Tabela 2. Os testes foram realizados em duplicata. Após o tempo de tratamento, o meio de cultura foi retirado e as células lavadas três vezes com PBS (NaCl 0,154 M; Na2 HPO4 0,1 M; pH 7,4). As células aderidas a uma das lamínulas foram fixadas com paraformaldeído 2% em tampão fosfato por 10 minutos. Depois de lavadas com PBS, as células foram coradas.
(31) com solução de violeta de cresilo 0,2% em etanol 20%, por cinco minutos. As células aderidas à outra lamínula, em cada um dos grupos experimentais, foram coradas com solução de Giemsa 4% em metanol, por 5 minutos, sem que passassem por processo de fixação. Após serem lavadas com PBS, as lamínulas foram retiradas dos poços e montadas sobre lâminas de vidro para microscopia (26 × 76 mm), com a face contendo as células coradas em contato com a lâmina. As células foram imediatamente analisadas e fotografadas em microscópio Zeiss Axiophot, com ocular de 10× e objetiva de 100×, no Laboratório de Genética da Universidade de Brasília.. 3.8.2 Processamento das células HSG e CM para análise da morfologia celular em microscopia eletrônica de transmissão. Para a análise da ultra-estrutura em microscopia eletrônica de transmissão, as culturas de células foram mantidas segundo os procedimentos descritos no item 3.3. Após a adesão das células ao fundo do frasco, foi adicionada a amostra PAM ao meio de cultura, conforme descrito na Tabela 02. Após 48 horas de tratamento, o meio de cultura foi retirado e colocado em frascos de centrífuga aos quais foram adicionadas as células previamente tripsinizadas. As amostras foram, então, centrifugadas a 750g por 5 minutos e as células ressuspensas em 1(um) mL de PBS. Esse procedimento foi repetido duas vezes. As células, depois de tripsinizadas e centrifugadas, foram processadas de acordo com o protocolo utilizado por Silveira e colaboradores (2003), com algumas modificações. As células foram ressuspensas em 1 mL de fixador constituído de glutaraldeído 2%, paraformaldeído 4%, diluído em tampão cacodilato de sódio 0,1 M, pH 7,4, e de sacarose 3%. Após uma hora, as amo stras foram centrifugadas a 750g e lavadas, por 10 minutos, com tampão cacodilato de sódio (0,1 M, pH 7,4) acrescido de sacarose 3%. Esse procedimento foi repetido duas vezes. Em seguida, as amostras foram pósfixadas por uma hora, protegidas da luz, na mistura composta por tetróxido de ósmio 1%, ferricianeto de potássio 0,8% e cloreto de cálcio 5mM diluído em tampão de sódio (0,1 M, pH 7,4). Após serem lavadas duas vezes com tampão cacodilato de sódio por 10 minutos, as células foram contrastadas in bloch com acetato de uranila aquoso 0,5% por.
(32) uma hora, protegidas da luz. Em seguida, foram lavadas com tampão cacodilato de sódio, por dez minutos e, posteriormente, com água destilada. As células foram então desidratadas em concentrações crescentes de acetona: 30%, 50%, 70%, 90% e 100% (esta última repetida três vezes). O tempo de desidratação foi de dez minutos para cada uma das concentrações de acetona. Após a desidratação, as amostras foram infiltradas na mistura resina: acetona em concentrações crescentes de resina Spurr e decrescentes de acetona, em movimento giratório. Cada infiltração teve duração de, aproximadamente, 12 horas. Uma última infiltração foi feita somente com resina Spurr, por 7 a 8 horas, com o tubo aberto de modo a facilitar a evaporação da acetona remanescente. Em seguida, as amostras foram incluídas em formas de emblocamento contendo nova resina. O material foi mantido em estufa a 57 ºC, por aproximadamente 72 horas. Os blocos contendo as células foram levados a um ultramicrótomo Reichert Supernova com navalha de diamante para obtenção de cortes ultrafinos, que foram colhidos em telas de cobre de 400 Mesh. A contrastação das amostras foi feita protegida da luz, colocando-se primeiramente as telinhas em contato com solução de acetato de uranila 3% durante 25 minutos. Depois de lavadas em água destilada, as mesmas foram colocadas em contato com citrato de chumbo por 5 minutos. Após as telinhas serem lavadas em água destilada e deixadas secar por pelo menos 12 horas, as células foram observadas e fotografadas em microscópio eletrônico de transmissão JEOL 1001 do Laboratório de Microscopia Eletrônica da Universidade de Brasília..
(33) 4. RESULTADOS.
(34) No presente estudo, com o intuito de avaliar os efeitos biológicos de nanopartículas magnéticas contidas em polímeros de albumina bovinos, foram realizados diferentes ensaios biológicos, cujos resultados estão descritos abaixo e ilustrados nas Figuras 4 a 17.. 4.1 Caracterização das nanopartículas magnéticas. 4.1.1 Determinação do diâmetro das amostras do PAM. Uma das abordagens experimentais inicialmente realizadas foi a determinação do diâmetro das partículas de maghemita presentes na amostra PAM, o que foi realizada por meio de análise ao microscópio eletrônico de transmissão (MET). Ao MET, as nanopartículas mostraram-se ligeiramente esféricas (Figura 4). A análise de 500 partículas nas fotomicrografias mostrou diâmetros que variavam entre 4 e 154nm, o que demonstra que essas partículas são polidispersas (Figura 5).. Figura 4 Fotomicrografia eletrônica mostrando nanopartículas magnéticas da amostra PAM..
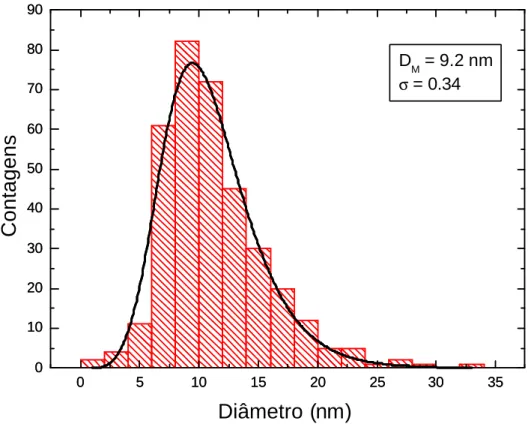
(35) A Figura 5 ilustra que diâmetro modal (DM ) das partículas é 9,2 nm e o desvio padrão (σ) 0,34.. 90 80. DM = 9.2 nm σ = 0.34. Counts Contagens. 70 60 50 40 30 20 10 0 0. 5. 10. 15. 20. 25. 30. 35. Diameter (nm) Diâmetro (nm) Figura 5 Histograma de distribuição dos diâmetros do PAM. A linha cheia representa o melhor ajuste para a polidispersão segundo uma lognormal.. 4.2 Efeitos da amostra de polímeros de albumina magnéticos sobre a viabilidade das células HSG e CM. Para determinar a concentração dos polímeros de albumina magnéticos (PAM) a ser administrada às células nos testes de genotoxicidade, foram realizados, em triplicata, testes de viabilidade com as linhagens celulares HSG e CM..
(36) 4.2.1 Células HSG Como mostra a Figura 6, os polímeros de albumina magnéticos na concentração 125 µg/mL permitiram sobrevivência de aproximadamente 70% das células HSG,. 5. Número de células viáveis (x 10 ). enquanto que na concentração de 250 µg/mL, sua taxa de sobrevivência foi de 50%.. 7. a. 6 5. a. 4. b. 3 2 1 0 Controle negativo PAM 125 µg/mL. PAM 250 µg/mL. Figura 6 Número de células HSG viáveis após cultivo com diferentes concentrações do PAM. Letras diferentes nas colunas denotam diferença significativa (p<0,05). Com bases nesses dados, decidiu-se utilizar o PAM na concentração 250 µg/mL, pois o número de células viáveis ou em degeneração seria suficiente para análise de genotoxicidade e citotoxicidade induzidas pelos polímeros de albumina magnéticos. Além dessa, foram utilizadas também outras duas concentrações, 150 e 75 µg/mL, que correspondem, respectivamente, a 60% e 30% daquela concentração que permitiu aproximadamente a viabilidade de 50% das células (250 µg/mL).. 4.2.2 Células CM Para as células CM, como mostra a Figura 7, nos grupos tratados com 250 e 125µg/mL, a taxa de sobrevivência das células foi de aproximadamente 70 e 60% respectivamente. Pelo fato de não ter sido encontrada diferença significativa na.
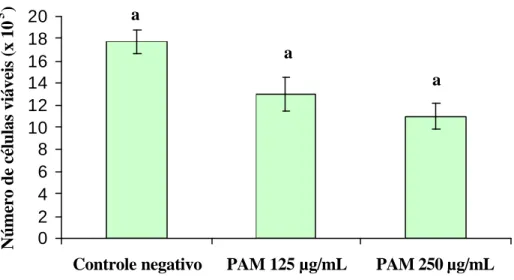
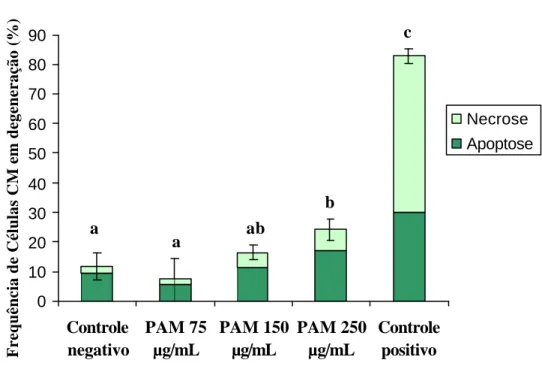
(37) freqüência de células viáveis com estas duas concentrações diferentes, optou-se por utilizar nos experimentos com as células CM, as mesmas concentrações utilizadas nos. 5. Número de células viáveis (x 10 ). testes com as células HSG (250, 150 e 75 µg/mL).. 20 18 16 14 12 10 8 6 4 2 0. a a a. Controle negativo. PAM 125 µg/mL. PAM 250 µg/mL. Figura 7 Número de células CM viáveis após cultivo com diferentes concentrações do PAM. Letras diferentes nas colunas denotam diferença significativa (p<0,05). 4.3 Distinção entre apoptose e necrose po r meio de ensaio de coloração de alaranjado de acridina e brometo de etídio. O ensaio de coloração com alaranjado de acridina e brometo de etídio, permitiu a distinção entre células viáveis, necróticas e apoptóticas, em cada um dos grupos experimentais.. 4.3.1 Células HSG. A Figura 8 ilustra a freqüência de células HSG em processo de degeneração, bem como sua via de degeneração. Pode-se observar que a freqüência de células em degeneração foi significativamente maior nos grupos tratados com PAM na.
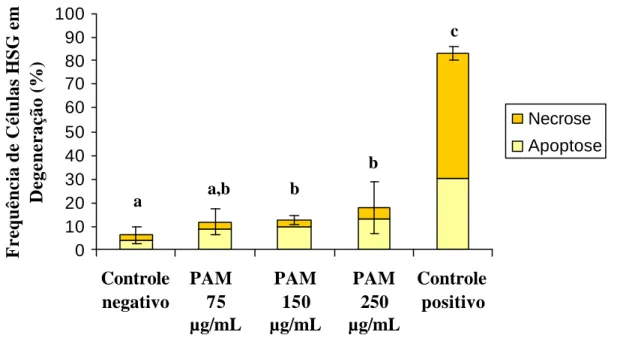
(38) concentração 250µg/mL e 150µg/mL (17,66% e 12,66%, respectivamente) quando comparado à freqüência de células em degeneração no grupo controle negativo (6,33%). Embora a freqüência de células em degeneração no grupo tratado com PAM na concentração 75 µg/mL (11%) não tenha se mostrado significativamente diferente daquela do controle negativo, ela também não foi significativamente diferente da freqüência induzida pelas concentrações maiores (250µg/mL e 150µg/mL de PAM). Em relação às vias de degeneração pode-se observar que, a exemplo do controle negativo, em todos os grupos tratados com PAM (250µg/mL, 150µg/mL e 75µg/mL), a via de degeneração mais freqüente foi a apoptose. Esta só é menor do que a necrose no controle. Frequência de Células HSG em Degeneração (%). positivo.. 100 90 80 70 60 50 40 30 20 10 0. c. Necrose Apoptose. b a. Controle negativo. a,b. b. PAM 75 µg/mL. PAM 150 µg/mL. PAM Controle 250 positivo µg/mL. Figura 8 Efeitos do tratamento com PAM (24h) sobre a freqüência de células HSG nas vias de degeneração necrose e apoptose.Letras diferentes nas colunas denotam diferença significativa (p<0,05)..
(39) 4.3.2 Células CM. As células CM também foram avaliadas quanto à degeneração celular e os resultados estão ilustrados na Figura 9. Diferentemente do ocorrido nas células HSG, nas células CM apenas na concentração 250µg/mL o PAM induziu freqüência de células em degeneração (24,3%) significativamente maior que o controle negativo (11,6%). Vale ressaltar que, a freqüência de células em degeneração no grupo tratado com 150µg/mL de PAM (16,3%) não foi significativamente diferente daquela observada no grupo tratado com a concentração de 250µg/mL de PAM. Assim como nas células HSG, nas células CM a via de degeneração mais freqüente, tanto nos grupos tratados com PAM, como no sem tratamento foi a apoptose,. Frequência de Células CM em degeneração (%). excetuando-se o controle positivo (Figura 9).. c. 90 80 70. Necrose. 60. Apoptose. 50 40 30 20. b a. a. ab. 10 0. Controle PAM 75 PAM 150 PAM 250 Controle negativo µg/mL µg/mL µg/mL positivo. Figura 9 Efeitos do tratamento com PAM (24h) sobre a freqüência de células CM nas vias de degeneração necrose e apoptose. Letras diferentes nas colunas denotam diferença (p<0,02)..
(40) 4.4 Efeitos dos polímeros de albumina magnéticos - PAM sobre os danos no DNA. No ensaio cometa, para cada linhagem celu lar, foram analisados cerca de 300 nucléoides por tratamento. As diferentes classes de cometa, descritas no item 3.7.1 do capítulo Material e Métodos, foram detectadas em quase todos os grupos experimentais. É importante salientar que os danos observados estavam, em sua maioria, concentrados nas classes 1 e 2. Os resultados obtidos para cada linhagem celular estão apresentados de duas formas: i) freqüência de células com danos no DNA, o que indica a freqüência de células em cada grupo experimental, classificadas como cometas de classe 1, 2, 3 e 4; ii) índice de danos no DNA, o que reflete a intensidade do dano no DNA das células.. 4.4.1 Células HSG. A freqüência de células HSG com danos no DNA está representada na Figura 10. Pode-se observar que nos grupos tratados com PAM, nas diferentes concentrações, foi significativamente maior que no grupo sem tratamento, o controle negativo (7%). O PAM na maior concentração (250µg/mL), induziu freqüência de células com danos no DNA (84,33%) significativamente maior do que nas concentrações 150µg/mL e. 75µg/mL (45,33% e 36,33%, respectivamente),. que. não. se. mostraram. significativamente diferentes entre si. A Figura 11 ilustra a intensidade de danos no DNA apresentados pelas células HSG. Todos os grupos de células tratadas com PAM nas diferentes concentrações 250, 150 e 75µg/mL apresentaram índice de danos (120, 57 e 41 ua, respectivamente) significativamente maior do que o apresentado pelo controle negativo (7 ua). Vale ressaltar que o índice de danos no DNA das células tratadas com o PAM nas concentrações 150 e 75µg/mL não diferiram significativamente entre si. A tabela 3 mostra a percentagem de danos no DNA leves e intensos encontrados em cada tratamento..
(41) Tabela 3. Percentagem de danos no DNA leves e intensos nos tratamentos utilizados Danos leves (classe 1 e 2). Danos intensos (classe 3 e 4). Controle negativo. 7%. 0%. PAM 75µg/mL. 35%. 1,3%. PAM 150µg/mL. 43,3%. 2,3%. PAM 250µg/mL. 80,6%. 7%. Controle positivo. 45,3%. 8%. Frequência de Células com Danos no DNA (%). Tratamento. c. 100 90 80 70 60. b,d. 50. d. b. 40 30 20. a. 10 0. Controle negativo. PAM 75 µg/mL. PAM 150 PAM 250 µg/mL µg/mL. Controle positivo. Figura 10 Efeito do tratamento com PAM sobre a freqüência de células HSG com danos no DNA. Letras diferentes nas colunas denotam diferença significativa (p<0,05)..
(42) Índice de Danos no DNA (ua). c. 140 120 100. d b. 80 60. b. 40. a. 20 0. Controle negativo. PAM 75 µg/mL. PAM 150 µg/mL. PAM 250 µg/mL. Controle positivo. Figura 11 Efeito do tratamento com PAM nas células HSG sobre o índice de danos no DNA. Letras diferentes nas colunas denotam diferença significativa (p<0,05).. 4.4.2 Células CM. Em relação à freqüência de células CM com danos no DNA (Figura 12), a análise dos dados mostrou que o PAM, em todas as concentrações utilizadas (250µg/mL, 150µg/mL e 75µg/mL) induziu freqüência de células com danos no DNA (81%, 82,66% e 80,66%, respectivamente) significativamente maior que o grupo controle negativo (3,33%). Em relação ao índice de danos no DNA apresentados pelas células CM (Figura 13), a análise dos dados mostrou que o índice dos grupos tratados com PAM (250µg/mL, 150µg/mL e 75µg/mL – 85, 89 e 81, respectivamente) é significativamente maior que o do grupo controle (3,33ua). A tabela 4 mostra a percentagem de danos no DNA leve e intensos encontrados em cada tratamento..
(43) Tabela 4. Percentagem de danos no DNA leves e intensos nos tratamentos utilizados Danos leves (classe 1 e 2). Danos intensos (classe 3 e 4). Controle negativo. 3,3%. 0%. PAM 75µg/mL. 80,6%. 0%. PAM 150µg/mL. 82,3%. 0,7%. PAM 250µg/mL. 79,3%. 1%. Controle positivo. 21,3%. 11%. Frequência de Células com Danos no DNA (%). Tratamento. 100. b. 90 80 70 60. b. b. a. 50 40 30 20 10 0. a Controle negativo. PAM 75 µg/mL. PAM 150 µg/mL. PAM 250 µg/mL. Controle positivo. Figura 12 Efeito do tratamento com PAM sobre a freqüência de células CM com danos no DNA. Letras diferentes nas colunas denotam diferença significativa (p<0,025)..
(44) Índice de Danos no DNA (ua). 120. b. 100. b. b. b 80. 60. 40. 20. a 0. Controle negativo. PAM 75 µg/mL. PAM 150 µg/mL. PAM 250 µg/mL. Controle positivo. Figura 13 Efeito do tratamento com PAM nas células CM sobre o índice de danos no DNA. Letras diferentes nas colunas denotam diferença significativa (p<0,05).. 4.5 Efeitos do tratamento com polímeros de albumina magnéticos sobre a morfologia e a ultra-estrutura das células HSG e CM. De modo a verificar se o PAM induzia alterações na morfologia e na ultra-- estrutura das células, as mesmas foram analisadas ao microscópio de luz e ao microscópio eletrônico de transmissão. 4.5.1 Análise da morfologia das células HSG - microscopia de luz. Ao microscópio de luz, as células HSG sem tratamento apresentam forma poligonal que pode variar de um pouco alongada a mais arredondada de acordo com a confluência da cultura e projeções citoplasmáticas que ligam uma célula à outra. O núcleo dessas células é esférico ou ovóide, sendo evidente um ou outro nucléolo (Figura.
(45) 14a e 14b). O tratamento com o PAM, nas diferentes concentrações, não induziu alterações na morfologia dessas células, como ilustra a Figura 14 (c, d).. a. 10 µm. b b. 10 µm. c. 10 µm. d. 10 µm. Figura 14. Fotomicrografias de células HSG submetidas a diferentes tratamentos: (a) controle negativo, lâmina fixada e corada com Violeta de Cresil; (b) controle negativo, corada com Giemsa; (c) e (d) 250 µg/mL de PAM, corada com Giemsa. Aumento 1000 x..
(46) 4.5.2 Análise da morfologia das células CM - microscopia de luz. As células CM apresentam-se de forma irregular, possuem prolongamentos citoplasmáticos, denominados de processos citoplasmáticos primários, o que lhes confere um aspecto estrelado. Apresentam o núcleo oval, central com nucléolos evidentes (Figura 15a e 15b). Quando tratadas com a amostra PAM, as células CM não apresentaram alterações morfológicas (Figura 15c). Entretanto, foram encontrados aglomerados de polímeros de albumina magnéticos, aparentemente não interiorizados pelas células (Figura 15d).. a. 10 µm. b. 10 µm. d. c. 100 µm. 10 µm. Figura 11.Fotomicrografias de células CM submetidas a diversos tratamentos: (a) controle negativo, fixado e corado com Violeta de Cresil; (b) controle negativo lâmina corada com Giemsa; (c) 250 µg/mL de PAM, corada com Giemsa (aumento total de 100x); (d) 250 µg/mL de PAM, corada com Giemsa (aumento total de 1000x); (c) e (d) setas indicam presença de aglomerados de nanopartículas magnéticas..
(47) 4.5.3 Análise da ultra-estrutura das células HSG – microscopia eletrônica de transmissão Para elucidar os efeitos de PAM sobre a ultra-estrutura das células e investigar uma possível interiorização de nanopartículas magnéticas foi feito um estudo por MET. Ao MET, as células HSG apresentam forma irregular, núcleo volumoso e numerosas projeções citoplasmáticas. Seus citoplasmas são ricos em organelas membranosas, mantendo o padrão ultra-estrutural característico de células secretoras. Quando tratadas com PAM, essas células não mostravam alterações na ultraestrutura. Entretanto, apesar de ao microscópio de luz, não serem visualizadas nanopartículas de PAM associadas às células, ao microscópio eletrônico essas células apresentavam alguns aglomerados de nanopartículas no seu interior, alguns localizados nas projeções citoplasmáticas, como pode ser visualizado na Figura 16c e 16d. Aglomerados de NPM foram observados em maior quantidade quando dispersos no exterior das células (Figura 16f). 4.5.4 Análise da ultra-estrutura das células CM – Microscopia Eletrônica de Transmissão Ao MET, as células CM se caracterizam por apresentarem superfície irregular com protrusões, núcleo volumoso e irregular com nucléolos evidentes. O citoplasma é rico em organelas membranosas como retículo endoplasmático, mitocôndrias ovais e complexo de Golgi desenvolvido. Quando tratadas com PAM, as células CM também não mostravam alterações na ultra-estrutura, mas apresentavam aglomerados de nanopartículas no seu interior (Figura 17e e 17f). As micrografias mostravam maior quantidade de aglomerados de NPM no exterior das células (Figura 17d)..
(48) a. b. c. d. e. f. Figura 16.Fotomicrografias da ultraestrututa das células HSG submetidas a diferentes tratamentos: (a) controle negativo (aumento total 10000x); (b) 75 µg/mL de PAM (aumento total 10000x); (c) 75 µg/mL de PAM (aumento total 8000x); (d) 250 µg/mL de PAM (aumento total 30000x); (e) 175 µg/mL de PAM (aumento total 80000x); (f) 250 µg/mL de PAM (aumento total 80000x); (c), (d), (e) e (f) setas indicam presença de aglomerados de nanopartículas magnéticas..
(49) a. c. e. b. d. f. Figura 17. Fotomicrografias da ultraestrututa das células CM submetidas a diferentes tratamentos: (a) controle negativo (aumento total 10000x); (b) 250 µg/mL de PAM (aumento total 10000x); (c) 75 µg/mL de PAM – célula em apoptose (aumento total 12000x); (d) 75 µg/mL de PAM (aumento total 20000x); (e) 250 µg/mL de PAM (aumento total 120000x); (f) 250 µg/mL de PAM (aumento total 100000x); (c), (d), (e) e (f) setas indicam presença de aglomerados de nanopartículas magnéticas..
(50) 5. DISCUSSÃO.
(51) Nas últimas décadas, a nanotecnologia intensificou o desenvolvimento de materiais e sistemas nanoestruturados que possam ser utilizados no tratamento de diversas patologias. Uma classe particularmente interessante de material nanoestruturado é constituída pelas nanopartículas magnéticas. No Brasil, pesquisadores do Centro de Nanociência e Nanobiotecnologia da UnB (CNANO) desenvolveram uma amostra de fluido magnético iônico constituído por nanopartículas de maghemita (?-Fe2 O3 ), que, subseqüentemente, foram encapsuladas em polímeros de albumina (PAM). A albumina é a proteína plasmática cuja seqüência é conservada entre as albuminas de mamíferos. A albumina humana, por exemplo, apresenta aproximadamente 75% de homologia com as seqüências das albuminas bovina e eqüina (Carter & Ho, 1994). Sua função fisiológica inclui o controle da pressão osmótica do sangue e o transporte, metabolismo e distribuição de várias substâncias endógenas ou exógenas, como hormônios, aminoácid os, ácidos graxos e íons metálicos e drogas (He & Carter, 1992). Sendo a proteína mais abundante do plasma sanguíneo, o encapsulamento das NPM em polímeros constituídos por essa proteína poderia conferir alto grau de biocompatibilidade à amostra. Sintetizados a partir de uma amostra de fluido magnético iônico caracterizado por ter alta susceptibilidade magnética, os polímeros de albumina magnéticos também apresentam essa característica e, por conseguinte, grande potencial para aplicações biomédicas, seja como sistema entregador de fármacos ou no processo de magnetohipertermia, procedimentos promissores na terapia do câncer. Os polímeros de albumina magnéticos utilizados neste estudo são constituídos de maghemita, óxido de ferro que se encontra na forma oxid ada. O fato de estar na forma oxidada torna a maghemita menos reativa, ou seja, com menor potencial de toxicidade às células. Como demonstrado por Brugin (2007), nanopartículas de maghemita apresentam menor toxicidade do que as de magnetita, óxido de ferro que se encontra na forma reduzida. Para serem utilizadas na área biomédica, é interessante que, no organismo, as nanopartículas magnéticas atravessem a barreira endotelial e se acumulem especificamente nas células-alvo, sem induzir dano às células normais . As nanopartículas devem, portanto, apresentar características que levam à sua biocompatibilidade (Chouly et al., 1996; Gupta & Gupta, 2005a). Dentre essas características destacam-se a natureza química das nanoparticulas e sua cobertura. Em 2007, Giri e colaboradores demonstraram que.
(52) nanopartículas de natureza química diferente, mas complexadas com a mesma cobertura, o ácido láurico, induziam, em células HeLa, índices de toxicidade diferentes. Quando as nanoparticulas de óxido de ferro estavam livres ou associadas a um átomo de manganês, induziam toxicidade dose-dependente e, quando associadas a um átomo de cobalto, a toxicidade era maior. Da mesma forma, Berry e colaboradores (2003b) demonstraram que nanopartículas de mesma natureza química (magnetita), mas recobertas com diferentes coberturas induziam resultados também diferentes. Esses autores mostraram que nanopartículas de magnetita recobertas com dextran induziam toxicidade em fibroblastos da linhagem HTERT-BJ1. Contudo, quando eram recobertas com albumina, induziam aumento no índice de proliferação celular. Outro fator importante é o tamanho das nanopartículas; é necessário que as nanopartículas sejam pequenas o suficiente para que não haja precipitação, permitindo que o movimento browniano atue como agente dispersor (Silveira, 2006). Vale ressaltar que o tamanho das partículas pode também influenciar na velocidade e no tempo que essas nanopartículas levam para ultrapassar a barreira endotelial (Moghimi et al., 2001). De modo geral, nanoparticulas de tamanhos reduzidos podem ser rapidamente interiorizadas pelas células. Além disso, o tamanho reduzido das partículas pode também dificultar o seu reconhecimento pelo sistema fagocitário mononuclear. Usando a microscopia eletrônica de transmissão (Giri et al.,2003; Hergt et al., 2004), determinou-se que o diâmetro modal das nanopartículas de maghemita encapsuladas em PAM é de 9,2 nm. Este tamanho é similar ao de amostras de nanopartículas já testadas in vitro (Giri et al., 2003; Gupta & Gupta, 2005b; Simioni et al., 2006; Phadran, 2007), com variados graus de compatibilidade. Alguns estudos in vivo (Lacava, informação pessoal) mostram que NPM com diâmetro na faixa 8-10nm apresentam características mais favoráveis às suas aplicações. A biocompatibilidade de uma nanopartícula é também determinada pela sua incapacidade de induzir danos nas células normais. Assim, faz-se necessário a realização de testes biológicos capazes de determinar a toxicidade e a genotoxicidade das nanopartículas. Nesse contexto, visando determinar a biocompatibilidade dos polímeros de albumina magnéticos (PAM) foram realizados no presente estudo, ensaios de toxicidade e genotoxicidade; além da avaliação da morfologia e da ultra-estrutura de células CM e HSG.
Imagem
Documentos relacionados
b) Execução dos serviços em período a ser combinado com equipe técnica. c) Orientação para alocação do equipamento no local de instalação. d) Serviço de ligação das
A presente pesquisa tem como objetivo identificar o percentual de sobrepeso e obesidade infantil em escola localizada no distrito de Ourânia, interior do estado do Rio de
segunda guerra, que ficou marcada pela exigência de um posicionamento político e social diante de dois contextos: a permanência de regimes totalitários, no mundo, e o
O decisum configura o corolário da exordial; a correlação entre pedido e sentença é medida que se impõe, mostrando-se vedado ao julgador decidir aquém (citra ou
Este estudo apresenta como tema central a análise sobre os processos de inclusão social de jovens e adultos com deficiência, alunos da APAE , assim, percorrendo
4 Este processo foi discutido de maneira mais detalhada no subtópico 4.2.2... o desvio estequiométrico de lítio provoca mudanças na intensidade, assim como, um pequeno deslocamento
Sendo assim, o presente estudo visa quantificar a atividade das proteases alcalinas totais do trato digestório do neon gobi Elacatinus figaro em diferentes idades e dietas que compõem
Estes autores citam que algumas ideias que apareceram no passado e inclusive propostas atualmente no Brasil, como a de que o sistema de capitalização é sempre mais