Avaliação do Risco Nutricional em Doentes Com Patologia
Cardíaca Hospitalizados
Assessment of Nutritional Risk in Patients Hospitalized With
Heart Pathology
José Pedro Santos Pereira
Orientado por: Professora Doutora Maria Flora Correia
2
“Iatrogenic malnutrition has become a significant factor in
determining the outcome of illness for many patients.”
4
Agradecimentos
Começo por agradecer, e dedicar esta obra, às pessoas que me proporcionaram
tudo isto, os meus pais. Obrigado por me tornarem na pessoa que sou hoje, pelo
apoio e pelos bons conselhos que sempre me deram.
Um agradecimento especial,
À Professora Doutora Flora Correia, por me acolher como seu orientando, por me
transmitir os seus conhecimentos, pelo carinho com que sempre me recebeu e
pelo seu trabalho ao longo deste anos em prol desta profissão. Foi para mim uma
honra e um orgulho ser seu orientando.
À Professora Doutora Júlia Maciel, pela oportunidade de realizar esta
investigação no Serviço de Cardiologia do H.S.J.
A todo o pessoal do Serviço de Cardiologia, pela simpatia e ajuda prestada.
À Dra. Sílvia Pinhão, que juntamente com a Professora Doutora Flora, foram as
minhas mentoras nesta área.
Ao Dr. Rui Poínhos e ao Professor Bruno Oliveira, pela ajuda na produção dos
resultados, e pela disponibilidade que tiveram para me ajudar.
À Dra. Marta, pela ajuda na organização das referências bibliográficas.
À Carla Morais, Miguel Afonso e Miguel Garcês, meus colaboradores na
ii
José Pedro Pereira, 2010
A todos os meus professores, que durante estes largos anos contribuíram para a
minha formação académica e pessoal.
À minha família.
Aos meus amigos.
À minha irmã.
E por fim a ti Ritinha, por acreditares em mim, por estares sempre lá nos bons e
maus momentos, por toda a ajuda e por tudo que me deste na vida mesmo sem
Índice
Agradecimentos ... i
Lista de Abreviaturas ... v
Lista de Gráficos e Tabelas ... vi
Resumo ... viii Palavras-chave ... ix Abstract ... x Keywords... xi Introdução ... 1 Causas da DAD ... 2 Consequências da DAD ... 3
Prevalência e diagnóstico da DAD ... 4
Rastreio da DAD ... 6
Métodos de avaliação do risco nutricional ... 7
MUST ... 8
NRS-2002 ... 8
PG-SGA ... 9
NRI... 10
iv
José Pedro Pereira, 2010
Materiais e Métodos ... 11 Amostra ... 11 Recolha de dados ... 12 Tratamento estatístico ... 12 Resultados ... 14 Discusão ... 23 Conclusão... 27 Referências Bibliográficas ... 28 Lista de Anexos ... 32
Lista de Abreviaturas
%PP – Percentagem de Perda de Peso
BAPEN - British Association for Parenteral and Enteral Nutrition
DAD – Desnutrição Associada à Doença EAM – Enfarte Agudo do Miocardio
ESPEN - European Society for Clinical Nutrition and Metabolism
H.S.J. – Hospital São João, EPE
ICD – International Classification of Diseases
ICD-9-CM - International Classification of Diseases, 9th revision, Clinical
Modification
IL- Interleucina
IMC - Índice de Massa Corporal ou Índice de Quetelet
MUST – Malnutrition Universal Screening Tool NHS - National Health Service
NRI - Nutritional Risk Index
NRS-2002 – Nutritional Risk Screening 2002 OMS – Organização Mundial de Saúde
PG-SGA - Patient-Generated Subjective Global Assessment
SGA - Subjective Global Assessment
vi
José Pedro Pereira, 2010
Lista de Gráficos e Tabelas
Gráfico 1. Percentagem de pacientes em risco nutricional de acordo com a
ferramenta de avaliação usada……….……… 15 Gráfico 2. Distribuição da amostra pelas categorias “MUST”……….……. 16 Gráfico 3. Distribuição da amostra pelas categorias “PG-SGA”………..………… 16 Gráfico 4. Distribuição da amostra pelas categorias “NRI”………...…… 16 Gráfico 5. Associação entre o tempo de internamento e a percentagem de perda
de peso em um mês e em seis meses………. 21 Gráfico 6. Mediana dos dias de internamento em função do motivo de
internamento………. 22
Tabela 1. Factores que contribuem para a DAD……….. 2 Tabela 2. Prevalência de DAD no momento da admissão hospitalar……...……… 4 Tabela 3. Deficiências nutricionais consideradas na ICD-9-CM…………..……….. 6 Tabela 4. Características da amostra estudada……….………… 14 Tabela 5. Características da amostra de segundo a classificação de risco
nutricional, nas quatro ferramentas de avaliação…………...……… 18 Tabela 6. Motivos de internamento segundo a classificação de risco nutricional,
Tabela 7. Ocorrência de sintomas de impacto nutricional preconizados pelo
PG-SGA……… 20 Tabela 8. Comparação entre o risco nutricional, em função da faixa etária…..… 22
viii
José Pedro Pereira, 2010
Resumo
Introdução: Nos últimos anos, vários trabalhos têm sido realizados
demonstrando que a desnutrição associada à doença está directamente
relacionada com graves consequências físicas e psicossociais para os doentes,
aumentando significativamente, não só a morbilidade e mortalidade, como
também o tempo de internamento dos doentes e os custos com os cuidados de
saúde hospitalares. Apesar destes factos, a prevalência de DAD continua
elevada, afectando cerca de 10 a 60% dos doentes no momento da admissão
hospitalar e cerca de 8 a 11% na comunidade.
O rastreio do risco nutricional como rotina clínica é recomendado por muitas
organizações internacionais, mas continua a não ser efectuado na maioria dos
casos, e mesmo quando é aplicado, muitas vezes a DAD não é reconhecida como
um sério problema, levando ao aumento da sua frequência. Várias ferramentas de
rastreio têm sido sugeridas para avaliar o risco nutricional no momento da
admissão hospitalar e na comunidade, contudo quase todas são publicadas sem
uma adequada avaliação da sua eficiência e com insuficiente informação sobre o
modo de aplicação, tornando difícil a escolha do método a usar.
O propósito deste trabalho foi avaliar a frequência de risco nutricional em doentes
com patologia cardíaca hospitalizados, e comparar a aplicabilidade e a
capacidade de detecção do risco nutricional de algumas ferramentas de avaliação
de risco.
Métodos e Materiais: O Malnutrition Universal Screening Tool (MUST), o
Nutritional Risk Screening de 2002 (NRS-2002), o Patient-Generated Subjective
Global Assessment (PG-SGA) e o Nutritional Risk Index (NRI) foram aplicados a
cardíaca. Pacientes com um score superior a 0 no MUST, com um score igual ou
superior a 3 no NRS-2002, pacientes avaliados globalmente no estado B e C no
PG-SGA e pacientes com um score inferior a 97,5 no NRI, foram considerados
como estando em risco nutricional e os restantes, como estando sem risco
nutricional, tornando assim a comparação das ferramentas de risco possível.
Resultados: NRS-2002, MUST, PG-SGA e NRI identificaram, respectivamente,
24,5% (n=12), 22,4% (n=11), 18,4% (n=9) e 59,2% (n=29) dos pacientes em risco
nutricional. Foram encontradas nulas ou muito fracas concordâncias entre as
ferramentas na detecção de doentes em risco (κ<0,25), sem significado estatístico (p>0,05). Para cada uma das ferramentas, não foram encontradas diferenças
significativas (p>0,05) entre doentes com risco e sem risco, para o sexo, idade,
tempo de internamento, e Índice de Massa Corporal (IMC), à excepção do NRS
2002, cujos doentes em risco apresentaram um IMC inferior (23,3 kg/m2) em
relação aos doentes sem risco (27,4 kg/m2), com significado estatístico (p<0,05).
Também não foram encontradas diferenças significativas (p>0,05) entre as
percentagens de perda de peso em um mês e em seis meses, e o tempo de
internamento.
Conclusão: A frequência de doentes com patologia cardíaca em risco nutricional
é de 18,4% a 59,2%, nesta população. A capacidade de detecção do risco
nutricional varia consoante a ferramenta usada, sendo que todas as ferramentas
exigem bastante preparação dos examinadores para serem aplicadas.
Palavras-chave: Desnutrição, Risco Nutricional, Rastreio Nutricional, Prevalência, Patologia Cardíaca.
x
José Pedro Pereira, 2010
Abstract
Introduction: Many studies have been performed in the last few years,
demonstrating that disease-related malnutrition (DRM) is directly associated with
serious physical and psychosocial consequences for the patient: significant
escalations not only of their morbidity and mortality, but also of the length of
hospital stay and the amount of hospital health care expenses. In spite of these
facts, the prevalence of DRM remains high, affecting approximately 10 to 60% of
the patients at the moment of their hospital admittance and 8 to 11 % in the
community.
Numerous international organizations recommend the screening for nutritional risk
as a routine clinical practice, which in most of the cases is not implemented. Even
when it is, DRM still isn't regarded as a serious problem, which leads to an
increase of its prevalence. Many screening tools have been suggested to assess
nutritional risk at the moment of hospital admittance and in the community,
however most of these tools are published without adequate efficiency evaluation
and lack information on application methods, making the choice for a screening
method a difficult one.
The purpose of this study is to assess the prevalence of nutritional risk in
hospitalized patients diagnosed with heart disease and compare the applicability
and detection capabilities of some tools used for nutritional risk assessment.
Methods and materials: The Malnutrition Universal Screening Tool (MUST), the
2002 Nutritional Risk Screening (NRS-2002), the Patient-Generated Subjective
Global Assessment (PG-SGA) and the Nutritional Risk Index (NRI) were
disease. Patients with a score higher than 0 in MUST, equal or higher than 3 in
NRS-2002, globally evaluated in the B or C states in PG-SGA and with a score of
less than 97,5 in NRI were all considered at nutritional risk and remaining patients
were considered free from nutritional risk, allowing for a comparison between the
different risk assessment tools.
Results: The NRS-2002, MUST, PG-SGA and NRI identified respectively 24,5%
(n=12), 22,4% (n=11), 18,4% (n=9) and 59,2% (n=29) patients at nutritional risk.
None or very few points of agreement were found between the tools in the
detection of patients at nutritional risk (κ<0,25), with no statistical relevance (p>0,05). No significant differences have been found for each tool (p<0,05)
regarding whether patients were or not at risk considering their gender, age, length
of hospital stay and Body Mass Index (BMI), except in NRS-2002, according to
which, patients at risk shown a lower BMI (23,3) compared to patients free from
risk (27,4), with statistical significance (p<0,05).
Furthermore, there have not been found noticeable differences in weigh lost
percentages over one or six months, and length of hospital stay.
Conclusion: The prevalence of nutritional risk in patients diagnosed with heart
disease is 18,4% to 59,2%. The capability of nutritional risk detection varies
according to the tool used, while all of the screening tools require preparation on
the part of the examiners in order to be applied.
Keywords: Malnutrition, Nutritional Risk, Nutrition Screening, Prevalence, Cardiac
Introdução
A malnutrição pode ser definida como um “termo geral usado para descrever a
desnutrição devido à ingestão inadequada de alimentos, desequilíbrios
alimentares, deficiências de nutrientes específicos e a sobrenutrição causada por
um consumo excessivo de comida”(1)
. Mais recentemente, a malnutrição aparece
definida como “um estado de deficiência, excesso ou desequilíbrio de energia,
proteínas e outros nutrientes, que resulta em efeitos adversos a nível corporal e
em consequências funcionais e clínicas”(2)
. Apesar de malnutrição ser um termo
bastante citado na bibliografia actual, a sua definição é ainda hoje alvo de
controvérsia e de falta de consenso científico, não existindo uma definição
amplamente aceite que reflicta a sua patofisiologia e o seu operacionalismo no
diagnóstico e tratamento(3).
De acordo com as definições apresentadas, malnutrição pode ser associada ao
excesso, deficiência e/ou desequilíbrios de energia/alimentos, contudo nesta
investigação apenas se descreve a deficiência, assim será usado o termo
desnutrição, ou especificamente o termo desnutrição associada à doença, em
substituição de malnutrição.
A European Society for Clinical Nutrition and Metabolism (ESPEN) define
desnutrição como “…primariamente usada no contexto de deficiência na ingestão proteica ou energética ou na absorção, e é muitas vezes descrita como
malnutrição proteico-energética. É frequentemente acompanhada por múltiplas ou
únicas deficiências de micronutrientes e/ou minerais, …”(4). É caracterizada por
perda de peso e alterações na composição corporal, nomeadamente, perda de
2
José Pedro Pereira, 2010
fluido extra-celular(4). Infelizmente não existe um único parâmetro que possa
definir e avaliar adequadamente a desnutrição, devendo a esta ser caracterizada
por um conjunto de parâmetros, nos quais se incluem frequentemente o Índice de
Massa Corporal (IMC) ou Índice de Quetelet, perda de peso e/ou albumina
sérica(5).
Causas da DAD
A DAD deve-se essencialmente a quatro factores(6):
ingestão alimentar deficiente;
deficiências na digestão e/ou absorção de nutrientes;
alterações no metabolismo e nas necessidades nutricionais; perda de nutrientes excessiva.
As causas destes factores estão descritas na tabela 1.
Problema Causa
Ingestão alimentar deficiente
Anorexia: doença (a maior e mais comum causa); dor/náusea quando come; depressão/angústia; aversão à comida;
medicação; dependência de narcóticos.
Incapacidade de comer: inconsciência; confusão; fraqueza ou artrite nos braços ou mãos; disfagia; vómitos; dores na boca; falta de higiene dentária ou dentição; restrições impostas por cirurgia ou investigações.
Falta de alimentos: pobreza; dieta de baixa qualidade em casa, nos hospitais ou em lares; problemas com compras ou
confecção de refeições. Deficiências na
digestão e/ou absorção de
nutrientes
Problemas médicos ou cirúrgicos que afectem o estômago, intestino, pâncreas e fígado.
Necessidades alteradas
Necessidades metabólicas aumentadas ou alteradas relacionadas com doença, cirurgia, disfunção orgânica, ou tratamento.
Perda de nutrientes excessiva
Perdas gastrointestinais: vómitos; diarreia; fístulas; ostomia; perdas por sonda nasogástrica e outras drenagens.
Outras perdas: ex. exsudado pela pele em queimados.
Fonte: National Collaborating Centre for Acute Care, 2006(6).
Consequências da DAD
A desnutrição associada à doença é ao mesmo tempo causa e efeito da doença.
Se por um lado a doença é causa de desnutrição, como já descrito, por outro lado
a desnutrição é responsável pelo aparecimento e agravamento da doença(2).
Alguns dos efeitos físicos e psicossociais da desnutrição são:
Resposta imunológica enfraquecida(7-8)
;
Cicatrização defeituosa(9)
;
Redução da força muscular e fadiga(10)
;
Redução da força muscular respiratória(11)
;
Desregulação da temperatura corporal(12-13)
;
Distúrbios hidroelectrolíticos(6)
;
Deficiências de vitaminas e minerais(6)
;
Irregularidades menstruais/amenorreia(14)
;
Função psicossocial alterada(2)
.
Para além de consequências físicas e psicossociais para o paciente, a
desnutrição é responsável pelo aumento do tempo de internamento dos
pacientes(15-16). O aumento do tempo de internamento, as complicações clínicas
geradas pela desnutrição, bem como o tratamento da desnutrição não
diagnosticada correctamente, reflectem-se num aumento dos custos
4
José Pedro Pereira, 2010
Prevalência e diagnóstico da DAD
Apesar das consequências da DAD já descritas, e do reconhecimento de que esta
se trata de um grave problema, as projecções mundiais apontam para uma
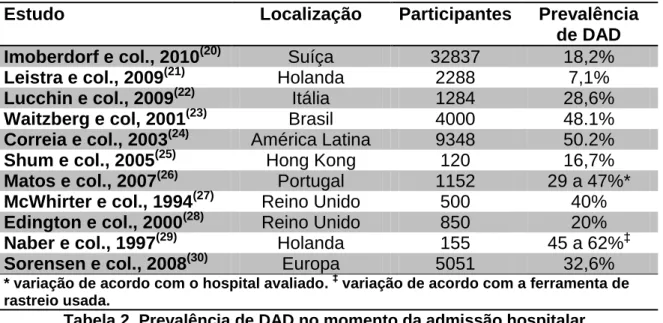
prevalência de DAD a nível hospitalar inaceitavelmente elevada(19). A tabela 2
resume alguns dos estudos que avaliaram a prevalência de desnutrição na
admissão hospitalar, nas últimas duas décadas.
Estudo Localização Participantes Prevalência
de DAD
Imoberdorf e col., 2010(20) Suíça 32837 18,2%
Leistra e col., 2009(21) Holanda 2288 7,1%
Lucchin e col., 2009(22) Itália 1284 28,6%
Waitzberg e col, 2001(23) Brasil 4000 48.1%
Correia e col., 2003(24) América Latina 9348 50.2%
Shum e col., 2005(25) Hong Kong 120 16,7%
Matos e col., 2007(26) Portugal 1152 29 a 47%*
McWhirter e col., 1994(27) Reino Unido 500 40%
Edington e col., 2000(28) Reino Unido 850 20%
Naber e col., 1997(29) Holanda 155 45 a 62%‡
Sorensen e col., 2008(30) Europa 5051 32,6%
* variação de acordo com o hospital avaliado. ‡ variação de acordo com a ferramenta de
rastreio usada.
Tabela 2. Prevalência de DAD no momento da admissão hospitalar.
A DAD na comunidade é relativamente mais difícil de estimar, contudo vários
estudos demonstram que o problema se mantém, existindo uma prevalência de
desnutrição elevada(31-32).
Outro problema enfrentado, deve-se ao facto de para além da DAD não ser
detectada, esta também não é reconhecida(33). Apesar da desnutrição ser
rastreada e muitas vezes detectada em alguns locais, posteriormente esta não é
registada nos processos clínicos dos pacientes, ou pior, os pacientes não são
reencaminhados para serviços competentes no seu tratamento(33). Vários estudos
pacientes identificados como estando em risco nutricional, não foram
diagnosticados. Mowe e col.(35) observaram que a apenas 64% da sua amostra foi
reconhecida desnutrição, sendo que esta não se encontrava diagnosticada em
nenhum deles no momento da alta. Pennington e col.(36) referiram que “menos de
metade” dos pacientes desnutridos foram reconhecidos, e poucos receberam
tratamento nutricional. Mais recentemente Lamb e col.(37) mencionaram que
apenas 68,9% da sua amostra foi rastreada e 13,7% estavam em elevado risco
nutricional, dos quais apenas 45,2% foram adequadamente referenciados aos
serviços de nutrição e dietética. Waitzberg e col.(23) apontaram para menos de
18,8%, num total de 1924 pacientes desnutridos, como estando devidamente
referenciados.
A falta de formação e treino dos profissionais de saúde é apontada como a maior
causa da falha dos cuidados nutricionais de doentes hospitalizados(33).
Outro entrave ao correcto diagnóstico da DAD consiste na dificuldade em
enquadra-la nas definições estabelecidas pela International Classification of
Diseases (ICD), publicada pela Organização Mundial de Saúde (OMS). Neste
momento muitos países (incluindo Portugal) utilizam a Modificação Clínica da 9ª
revisão dessa classificação (ICD-9-CM), para a nomenclatura hospitalar das
doenças(38). A ICD-9-CM foi publicada em 1975, e apesar de actualizada
anualmente, ainda não considera especificamente a desnutrição hospitalar (tabela
3).
A actualização de 2010 da 10ª revisão do ICD, destinada a substituir o ICD-9-CM,
e que deverá entrar em vigor em 2013, também não considera a DAD na sua
6
José Pedro Pereira, 2010
Código de 3 dígitos Diagnóstico
260 Kwashiorkor 261 Marasmus Nutritivo
262 Outra desnutrição proteico-energética grave 263 Desnutrição proteico-energética inespecífica 264 Deficiência de vitamina A
265 Deficiência de tiamina e niacina
266 Deficiências em vitaminas do complexo B 267 Deficiência de ácido ascórbico
268 Deficiência de vitamina D 269 Outras deficiências nutricionais
Fonte: USA National Center for Health Statistics, 2009(40).
Tabela 3. Deficiências nutricionais consideradas na ICD-9-CM.
Rastreio da DAD
Apesar da elevada prevalência de desnutrição na admissão hospitalar, o rastreio
ainda não é realizado na maioria da instituições de saúde, nem a nível
comunitário, apesar dos custos para identificar pacientes em risco ser baixo(33).
O rastreio do risco nutricional como rotina clínica é recomendado por muitas
organizações internacionais, tais como, UK Department of Health(41); Council of
Europe(42); Royal College of Physicians(43); ESPEN(44); National Health Service
(NHS) Quality Improvement Scotland(6).
Para além destas organizações, o Conselho da Europa, através da Resolução
submetidos à avaliação do risco nutricional, desde o período prévio da admissão
hospitalar até ao final do seu internamento(42), sendo este factor considerado na
avaliação da qualidade do serviço hospitalar(45). O Scotland NHS determina que
para além dos pacientes internados, também a comunidade deve ser rastreada,
quando houver indícios de risco(46).
Métodos de avaliação do risco nutricional
Existe um grande número de métodos utilizados para determinar o risco
nutricional em indivíduos quer a nível hospitalar, quer comunitário(47-48), contudo
quase todos são publicados sem uma adequada avaliação da sua eficiência e
com insuficiente informação sobre o modo de aplicação(48), tornando difícil a
escolha do método a usar. A maioria dos métodos é apresentada sob a forma de
questionário de aplicação directa ou indirecta, que incluem variáveis subjectivas
e/ou objectivas associadas á desnutrição e que determinam um score de risco(48).
A ESPEN recomenda o Malnutrition Universal Screening Tool (MUST) para
adultos, como ferramenta de excelência para determinação do risco nutricional na
comunidade, o Nutritional Risk Screening de 2002 (NRS-2002), como ferramenta
a usar em ambiente hospitalar e o Mini Nutritional Assessment na avaliação de
idosos(44). A American Society for Parenteral and Enteral Nutrition aconselha o
uso do Subjective Global Assessment (SGA)(49).
Para este estudo foram escolhidos os inquéritos de avaliação de risco MUST,
NRS-2002, Patient-Generated Subjective Global Assessment (PG-SGA) e o
8
José Pedro Pereira, 2010
MUST
O MUST foi concebido pelo Malnutrition Advisory Group da British Association for
Parenteral and Enteral Nutrition (BAPEN). Foi inicialmente desenvolvido para uso
na comunidade(44), contudo tem sido validado para uso hospitalar e clínico com
aparente sucesso(19). Classifica-se como sendo fácil, rápido, reprodutível e
consistente na sua aplicação(15, 19). É constituído por cinco passos, sendo
atribuída uma pontuação nos três primeiros. Primeiro passo: determinação do
IMC. Se IMC>20, o score é 0, se IMC entre 18,5 e 20, score 1 e se IMC<18,5
score 2. Segundo passo: determinação da percentagem de perda de peso (%PP)
involuntária nos últimos 3 a 6 meses. Se %PP<5%, o score é 0, se %PP entre 5 e
10%, score 1 e se %PP>10% score 2. Terceiro passo: considerar a doença
aguda. Se o doente se encontrar privado de nutrição por período igual ou superior
a cinco dias, adicionar 2 ao score. Quarto passo: Somar os scores obtidos no
primeiro, segundo e terceiro passo. Se score=0 “Risco baixo”, se score=1 “Risco médio” e se score≥2 “Risco Elevado”. O quinto passo consiste no tratamento segundo as orientações recomendadas, que podem ser observadas no anexo A.
Os resultados obtidos devem ter em atenção se algumas das seguintes
circunstâncias estão presentes: presença de edema, gravidez, lactação, doença
crítica, amputações e/ou uso de gesso no tratamento(50).
O NRS-2002 é uma ferramenta, desenvolvida por investigadores dinamarqueses,
validada para avaliar risco nutricional e para diagnosticar desnutrição em
hospitais(51). Esta ferramenta contém os componentes do MUST, ou seja avalia o
IMC e a %PP, mas em adição avalia também a severidade da doença como
reflexo do aumento das necessidades energéticas(44). É constituído por dois
grupos. O primeiro grupo é composto por quatro questões fechadas, que podem
ser observadas no anexo B. Caso a resposta seja “sim” a algumas das questões, passa-se ao segundo grupo, do qual se obtém um score final. Este segundo
grupo avalia o estado nutricional do paciente, através da perda de peso ou
redução da ingestão alimentar, e a severidade da doença, atribuindo-se um score
de 0 a 3, consoante a classificação, em cada uma das duas vertentes, os quais
são somados. Se o paciente tem idade igual ou superior a 70 anos, é atribuído um
score adicional de 1, que é somado ao anterior, obtendo o score final. Se score
final menor que 3 o paciente não está em risco, se igual ou maior que 3, o
paciente encontra-se em risco nutricional.
PG-SGA
O PG-SGA é uma adaptação do SGA feita por Ottery para ir de encontro às
necessidades específicas dos pacientes oncológicos, tendo sida acrescentada
uma secção com sintomas gastrointestinais, de modo a incluir os sintomas de
impacto nutricional comuns nos doentes oncológicos na avaliação(52). Esta
ferramenta encontra-se validada para detectar doentes oncológicos
desnutridos(53). É composto por um grupo de questões preenchidas pelo paciente
e outro preenchido pelo examinador, e no total é composto por oito grupos aos
10
José Pedro Pereira, 2010
impacto nutricional e uma avaliação física, como pode ser observado no anexo C.
No final é obtido um score numérico, que quando superior a 1 requer intervenção
nutricional/alimentar, e uma avaliação subjectiva classificada como PG-SGA A
“Bem nutrido ou anabólico”, PG-SGA B “Mal nutrição moderada ou suspeita de mal nutrição” e PG-SGA C “Mal nutrição Severa”.
NRI
O NRI foi proposto por Buzby(54), ficando também conhecido pelo nome do seu
criador: índice de Buzby. Este índice foi desenvolvido pelo cálculo da associação
de vários índices nutricionais usados para avaliar doentes com complicações
pós-operatórias(55), sendo determinado pela seguinte fórmula:
NRI = 15,9 * Albumina sérica(g/L) + 0,417 * % Perda de Peso(54)
A % perda de peso corresponde ao Peso actual/Peso habitual*100, onde o peso
habitual, é o peso mais alto dos últimos 2 a 6 meses(54).
Perante o valor obtido pelo cálculo obtém-se a seguinte classificação: a) não
desnutrido se NRI>100, b) desnutrição leve se 100≥NRI≥97,5, c) desnutrição
moderada se 97,5>NRI≥83,5 e d) desnutrição grave se NRI<83,5(55)
.
Objectivos
O objectivo deste estudo foi avaliar a frequência de risco nutricional de doentes
com patologia cardíaca hospitalizados, e comparar a aplicabilidade e a
capacidade de detecção do risco nutricional de algumas ferramentas de avaliação
Materiais e Métodos
Amostra
Neste estudo participaram pacientes internados no Serviço de Cardiologia do
Hospital S. João, EPE – Porto (H.S.J.), entre os dias 20 de Março e 18 de Junho de 2010. A selecção da amostra e a escolha desta unidade hospitalar ocorreu por
razões de conveniência. Foram seleccionados aleatoriamente pacientes com
idade igual ou superior a 18 anos e com admissão hospitalar até 72h. Como
critérios de exclusão definiu-se doentes impossibilitados de responder aos
inquéritos, por estado cognitivo alterado, patologia psiquiátrica grave e/ou estado
crítico.
Apesar de este estudo incluir apenas informação de natureza observacional,
todos os doentes que cumpriam os critérios de inclusão que estavam conscientes
ou em alternativa, os seus familiares, foram informados sobre os objectivos do
estudo, os métodos a usar e sobre o seu direito à recusa, de acordo com o
expresso na última revisão da Declaração de Helsínquia(56). Foi obtido então o
consentimento informado, após explicação do estudo e de que a participação era
voluntária, sendo garantida a protecção e a confidencialidade das informações
recolhidas em todos os casos. Foi dado apoio nutricional/alimentar a todos os
doentes identificados como estando em risco nutricional ou desnutridos.
Foram classificados como estando em risco nutricional pacientes com um score
superior a 0 no MUST, com um score igual ou superior a 3 no NRS-2002,
pacientes avaliados globalmente no estado B e C no PG-SGA e pacientes com
12
José Pedro Pereira, 2010
Recolha de dados
Utilizou-se um questionário constituído por questões fechadas e abertas, o qual
foi preenchido por inquérito do paciente, ou recorrendo a informações contidas no
processo clínico do paciente. A detecção do risco foi feita através das ferramentas
de rastreio de risco nutricional NRS-2002, MUST, PG-SGA e NRI.
Os parâmetros antropométricos peso actual e altura foram obtidos através dos
registos no processo clínico do paciente. Fez-se cálculo do IMC, através da
divisão do peso em quilos pelo quadrado da altura em metros, de modo a
classificar os doentes segundo os critérios da OMS(57).
Os parâmetros bioquímicos foram obtidos através de doseamentos bioquímicos
realizados no serviço de bioquímica do H.S.J. de acordo com a metodologia
usada pela unidade hospitalar.
Os restantes parâmetros foram obtidos por consulta do processo clínico ou
questionando o paciente, ou na sua impossibilidade, os familiares directos.
A recolha de dados foi realizada durante o período supra citado.
Tratamento estatístico
O tratamento estatístico deste estudo foi realizado através do programa SPSS ®
for Windows, versão 17.0 (Statistical Package for the Social Sciences, SPSS Inc.,
Chicago).
Calcularam-se os parâmetros de localização e de dispersão para as variáveis
contínuas e as frequências absolutas e relativas para as variáveis categóricas.
distribuições das variáveis contínuas. Quando as distribuições eram normais
usou-se o teste t de Student para comparar as médias e o coeficiente de
correlação de Pearson para quantificar o grau de associação entre os pares de
variáveis. Quando as distribuições não eram normais usou-se o teste de
Mann-Whitney para comparar ordens médias e o coeficiente de correlação de
Spearman. Usou-se o teste do χ2 para verificar a independência entre pares de
variáveis. Usou-se ainda o coeficiente de correlação Kappa de Cohen para
quantificar o grau de associação entre pares de variáveis. As associações foram
categorizadas pela classificação qualitativa segundo Finney(58).
Rejeitou-se a hipótese nula quando o nível de significância crítico para a sua
14
José Pedro Pereira, 2010
Resultados
Neste estudo foram avaliados 49 indivíduos, cujas características estão
registadas na tabela 4.
Parâmetro avaliado Valor obtido
Sexo, n (%) Feminino Masculino 11 (22,4) 38 (77,6) Idade (anos) * Idade ≥ 65 anos, n (%) 63,9 (±11,8) 24 (49) IMC (kg/m2) * 26,4 (±4,2) Hábitos alcoólicos, n (%) Ausentes/Ligeiros Moderados/Graves 43 (87,8) 6 (12,2) Hábitos Tabágicos, n (%) Fumador Ex-fumador Não fumador 17 (34,7) 12 (24,5) 20 (40,8) Perda de Peso em 1 mês, (%) * 6,0 (±8,3)
Perda de Peso em 6 meses, (%) * 7,3 (±8,0)
Tempo de internamento (dias)† 8 (3-38)
* Média ± desvio-padrão. † Mediana (mínimo-máximo)
Tabela 4. Características da amostra estudada.
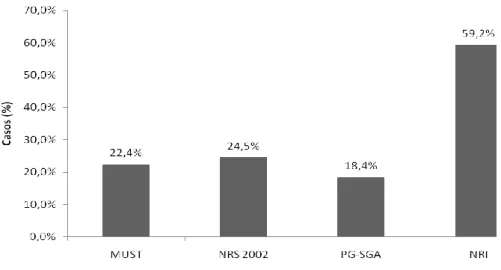
A frequência de doentes em risco nutricional na amostra variou de acordo com a
ferramenta de avaliação usada, oscilando entre 18,4% e 59,2%. Assim o
NRS-2002 identificou 24,5% de pacientes em risco (n=12), o MUST identificou 22,4%
(n=11), o PG-SGA identificou 18,4% (n=9) e o NRI identificou 59,2% (n=29) dos
pacientes. Os resultados podem ser observados no gráfico 1. O coeficiente kappa
fraca) entre o MUST e o NRS-2002, uma concordância de 0,248 (p=0,080,
concordância muito fraca) entre o MUST e o PG-SGA, uma concordância de
-0,038 (p=0,722, sem concordância) entre o MUST e o NRI, uma concordância de
-0,025 (p=0,861, sem concordância) entre o NRS-2002 e o PG-SGA, uma
concordância de 0,067 (p=0,544, concordância muito fraca) entre o NRS-2002 e o
NRI, e uma concordância de -0,024 (p=0,806, sem concordância) entre o PG-SGA
e NRI.
Gráfico 1. Percentagem de pacientes em risco nutricional de acordo com a ferramenta de avaliação usada.
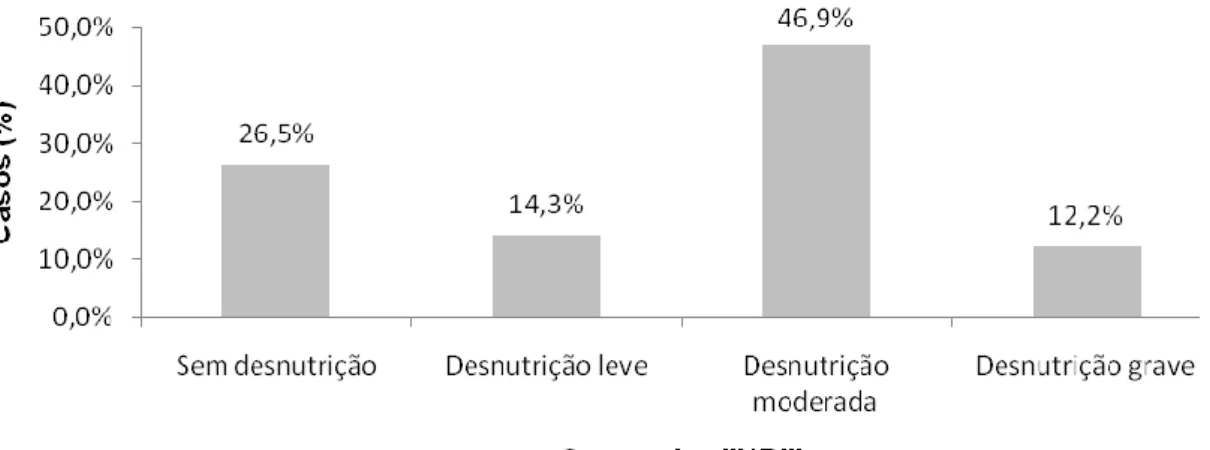
O MUST identificou ainda 6 (12,2%) pacientes como tendo um risco nutricional
alto e 5 (10,2%) com um risco médio, como observado no gráfico 2. Por sua vez,
o PG-SGA identificou 3 pacientes (6,1%) com tendo malnutrição severa e 6
(12,2%) com malnutrição moderada ou suspeita de malnutrição, de acordo com o
gráfico 3. O NRI identificou 6 (12,2%) pacientes como estando gravemente
desnutridos, 23 (46,9%) moderadamente desnutridos e 7 (14,3%) como
16
José Pedro Pereira, 2010
Gráfico 2. Distribuição da amostra pelas categorias “MUST”.
Gráfico 3. Distribuição da amostra pelas categorias “PG-SGA”.
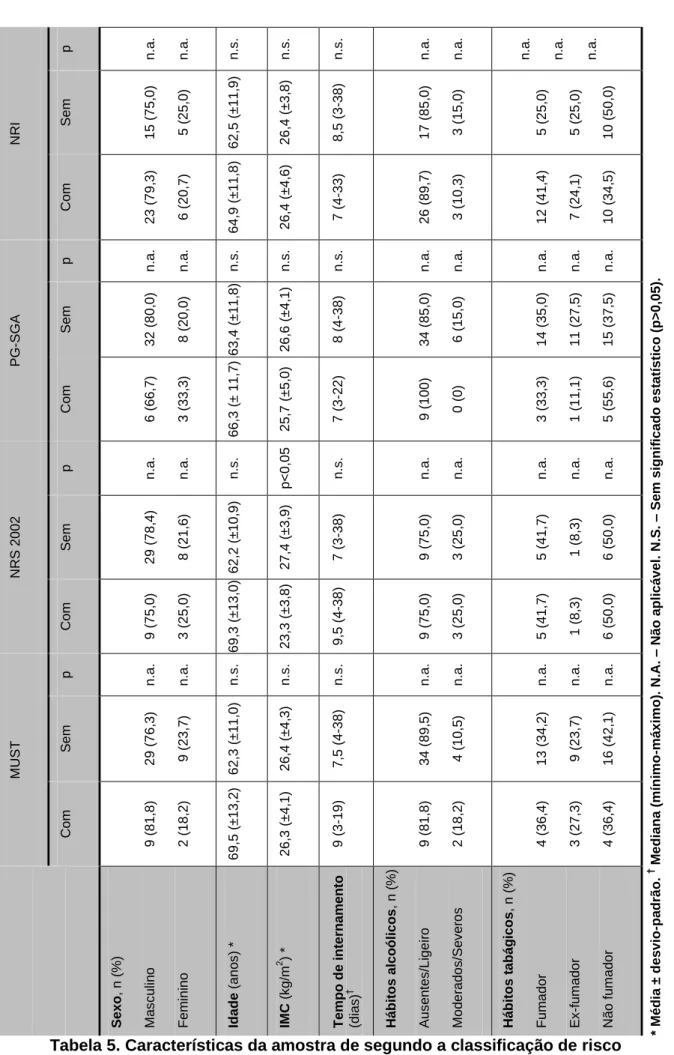
A tabela 5 resume algumas das características da amostra segundo a
classificação de risco nutricional, nas quatro ferramentas de avaliação.
Não foram encontradas diferenças (p>0,05), entre os pacientes com risco e sem
risco, para a média de idades e mediana do tempo de internamento, em nenhum
dos métodos de avaliação de risco nutricional. Também não foram encontradas
diferenças (p>0.05) entre a média de IMC dos pacientes com risco e sem risco,
com excepção dos paciente detectados pelo NRS 2002, onde a média de IMC
dos paciente com risco é menor (23,3 kg/m2), do que os pacientes sem risco (27,4
kg/m2). Devido à amostra ser demasiado pequena não foi possível avaliar as
diferenças dos pacientes com e sem risco, para o sexo, hábitos tabágicos e
hábitos alcoólicos.
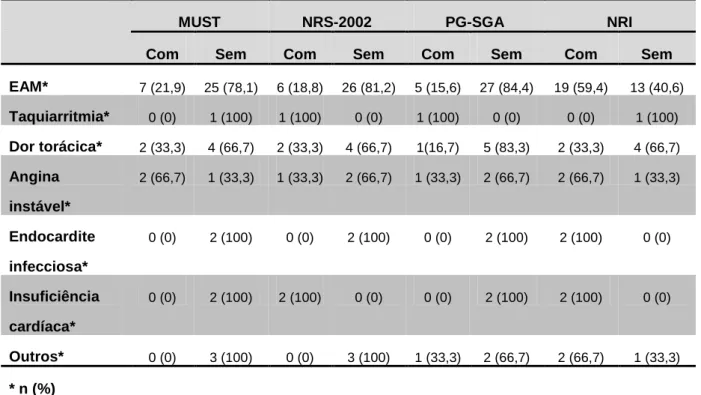
Dos 49 doentes, 32 (65,3%) foram admitidos no hospital devido a enfarte agudo
do miocárdio (EAM), 1 (2%) por taquiarritmia, 6 (12,2%) por dor torácica, 3 (6,1%)
por angina instável, 2 (4,1%) por endocardite infecciosa, 2 (4,1%) por insuficiência
cardíaca e 3 (6,1%) por anomalias da função/estrutura cardíaca. A tabela 6
resume a distribuição dos motivos de internamento segundo a classificação de
18
José Pedro Pereira, 2010
NRI p n .a . n .a . n .s . n .s . n .s . n .a . n .a . n .a . n .a . n .a . * M é di a ± d e s v io -pa drã o. † M e di a na (m ín im o -m á x im o) . N. A. – Não a pl ic á v e l. N.S . – Se m s ig ni fic a d o e s ta tís ti c o (p> 0 ,0 5 ). Se m 1 5 (7 5 ,0 ) 5 (2 5 ,0 ) 6 2 ,5 (±1 1 ,9 ) 2 6 ,4 (±3 ,8 ) 8 ,5 (3 -38) 1 7 (8 5 ,0 ) 3 (1 5 ,0 ) 5 (2 5 ,0 ) 5 (2 5 ,0 ) 1 0 (5 0 ,0 ) Com 2 3 (7 9 ,3 ) 6 (2 0 ,7 ) 6 4 ,9 (±1 1 ,8 ) 2 6 ,4 (±4 ,6 ) 7 (4 -33) 2 6 (8 9 ,7 ) 3 (1 0 ,3 ) 1 2 (4 1 ,4 ) 7 (2 4 ,1 ) 1 0 (3 4 ,5 ) PG -SG A p n .a . n .a . n .s . n .s . n .s . n .a . n .a . n .a . n .a . n .a . Se m 3 2 (8 0 ,0 ) 8 (2 0 ,0 ) 6 3 ,4 (±1 1 ,8 ) 2 6 ,6 (±4 ,1 ) 8 (4 -38) 3 4 (8 5 ,0 ) 6 (1 5 ,0 ) 1 4 (3 5 ,0) 1 1 (2 7 ,5 ) 1 5 (3 7 ,5 ) Com 6 (6 6 ,7 ) 3 (3 3 ,3 ) 6 6 ,3 (± 1 1 ,7 ) 2 5 ,7 (±5 ,0 ) 7 (3 -22) 9 (1 0 0 ) 0 (0 ) 3 (3 3 ,3 ) 1 (1 1 ,1 ) 5 (5 5 ,6 ) NR S 2 0 0 2 p n .a . n .a . n .s . p <0 ,0 5 n .s . n .a . n .a . n .a . n .a . n .a . Se m 2 9 (7 8 ,4 ) 8 (2 1 ,6 ) 6 2 ,2 (±1 0 ,9 ) 2 7 ,4 (±3 ,9 ) 7 (3 -38) 9 (7 5 ,0 ) 3 (2 5 ,0 ) 5 (4 1 ,7 ) 1 (8 ,3 ) 6 (5 0 ,0 ) Com 9 (7 5 ,0 ) 3 (2 5 ,0 ) 6 9 ,3 (±1 3 ,0 ) 2 3 ,3 (±3 ,8 ) 9 ,5 (4 -38) 9 (7 5 ,0 ) 3 (2 5 ,0 ) 5 (4 1 ,7 ) 1 (8 ,3 ) 6 (5 0 ,0 ) M UST p n .a . n .a . n .s . n .s . n .s . n .a . n .a . n .a . n .a . n .a . Se m 2 9 (7 6 ,3 ) 9 (2 3 ,7 ) 6 2 ,3 (±1 1 ,0 ) 2 6 ,4 (±4 ,3 ) 7 ,5 (4 -38) 3 4 (8 9 ,5 ) 4 (1 0 ,5 ) 1 3 (3 4 ,2 ) 9 (2 3 ,7 ) 1 6 (4 2 ,1 ) Com 9 (8 1 ,8 ) 2 (1 8 ,2 ) 6 9 ,5 (±1 3 ,2 ) 2 6 ,3 (±4 ,1 ) 9 (3 -19) 9 (8 1 ,8 ) 2 (1 8 ,2 ) 4 (3 6 ,4 ) 3 (2 7 ,3 ) 4 (3 6 ,4 ) Se x o , n (% ) M a s c u lin o Fe m in in o Id a de (a n o s ) * IM C ( k g /m 2 ) * T e m po d e i nte rna m e nto (d ia s ) † Háb ito s a lc o ól ic o s , n ( % ) Au s e n te s /L ig e ir o M o d e ra d o s /Se v e ro s Háb ito s t a bá g ic os , n (% ) Fu m a d o r Ex -fu m a d o r Não f u m a d o r
Tabela 5. Características da amostra de segundo a classificação de risco nutricional, nas quatro ferramentas de avaliação.
MUST NRS-2002 PG-SGA NRI
Com Sem Com Sem Com Sem Com Sem
EAM* 7 (21,9) 25 (78,1) 6 (18,8) 26 (81,2) 5 (15,6) 27 (84,4) 19 (59,4) 13 (40,6) Taquiarritmia* 0 (0) 1 (100) 1 (100) 0 (0) 1 (100) 0 (0) 0 (0) 1 (100) Dor torácica* 2 (33,3) 4 (66,7) 2 (33,3) 4 (66,7) 1(16,7) 5 (83,3) 2 (33,3) 4 (66,7) Angina instável* 2 (66,7) 1 (33,3) 1 (33,3) 2 (66,7) 1 (33,3) 2 (66,7) 2 (66,7) 1 (33,3) Endocardite infecciosa* 0 (0) 2 (100) 0 (0) 2 (100) 0 (0) 2 (100) 2 (100) 0 (0) Insuficiência cardíaca* 0 (0) 2 (100) 2 (100) 0 (0) 0 (0) 2 (100) 2 (100) 0 (0) Outros* 0 (0) 3 (100) 0 (0) 3 (100) 1 (33,3) 2 (66,7) 2 (66,7) 1 (33,3) * n (%)
Tabela 6. Motivos de internamento segundo a classificação de risco nutricional, nas quatro ferramentas de avaliação.
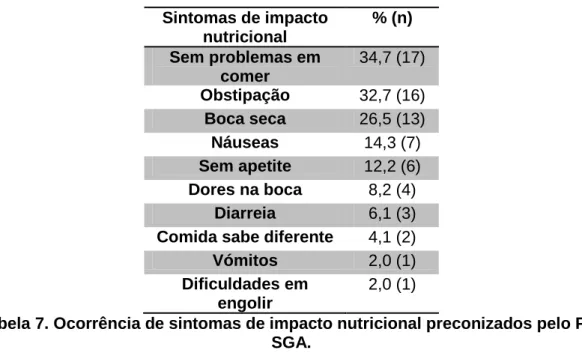
A redução da ingestão alimentar na semana anterior ao internamento foi um factor
tido em conta na realização dos inquéritos, e revelou que 42,9% (n=21) da
amostra reduziu a sua ingestão, sendo que dos que reduziram, 47,6% (n=10)
afirmaram “comer um pouco menos do que o habitual” e 52,3% (n=11) ingeriram menos de metade da quantidade habitual. Os sintomas de impacto nutricional que
20
José Pedro Pereira, 2010 Sintomas de impacto nutricional % (n) Sem problemas em comer 34,7 (17) Obstipação 32,7 (16) Boca seca 26,5 (13) Náuseas 14,3 (7) Sem apetite 12,2 (6) Dores na boca 8,2 (4) Diarreia 6,1 (3)
Comida sabe diferente 4,1 (2)
Vómitos 2,0 (1)
Dificuldades em engolir
2,0 (1)
Tabela 7. Ocorrência de sintomas de impacto nutricional preconizados pelo PG-SGA.
A análise da perda de peso dos pacientes revela que 34,7% (n=17) afirmaram
terem perdido peso dos últimos três meses. O cálculo da perda de peso no último
mês, pelo peso referido pelo paciente, indicou que 30,6% (n=15) dos doentes
perderam peso nesse período, sendo que 2 (13,3%) pacientes perderam mais de
10% de peso no mês anterior, 3 (20%) perderam entre 5 a 10% de peso e 10
(66,7%) perderam até 5% de peso. Dos 49 pacientes, 2 (4,1%) não conseguiram
indicar o seu peso do mês anterior ao internamento. Relativamente à perda de
peso em seis meses, 38,8% (n=19) perderam peso, 3 (15,8%) pacientes
perderam mais de 10% de peso, 7 (36,8%) entre 5 a 10% e 9 (47,4%) até 5%.
Apenas 1 (2,0%) paciente não conseguiu indicar o seu peso há seis meses atrás.
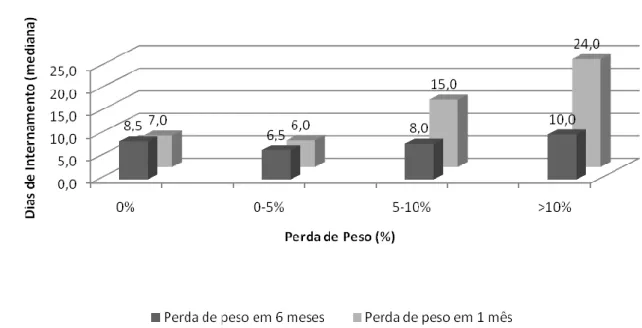
A associação entre o tempo de internamento e a percentagem de perda de peso
em um mês e em seis meses pode ser observada no gráfico 5. Parece existir uma
tendência para que o aumento da categoria de perda de peso, seja acompanhado
por um aumento de dias de internamento, para perdas de peso superiores a 5%.
Esta relação é notória na perda de peso em um mês, no entanto a análise dos
(ρ=0,129), sem significado estatístico (p>0,05). A perda de peso a seis meses
revela uma associação inversa muito fraca (ρ=-0,043), também sem significado
estatístico (p>0,05).
Gráfico 5. Associação entre o tempo de internamento e a percentagem de perda de peso em um mês e em seis meses.
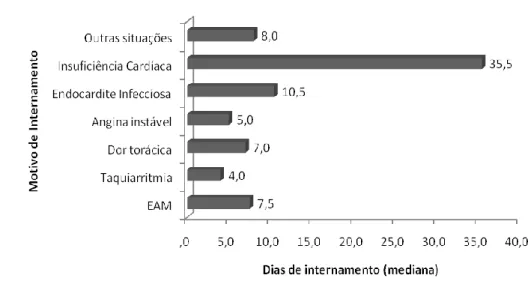
O tempo de internamento variou de acordo com o motivo de internamento, como
22
José Pedro Pereira, 2010
Gráfico 6. Mediana dos dias de internamento em função do motivo de internamento.
Relativamente à idade, aproximadamente metade da amostra (49%) tem idade
igual ou superior a 65 anos. Dos doentes identificados como estando em risco
nutricional, a maioria encontra-se nesta faixa etária:
72,7% (n=8) dos doentes identificados pelo MUST; 58,3% (n=7) quando usado o NRS-2002;
55,6% (n=5) com o PG-SGA;
52,8% (n=19) dos identificados pelo NRI.
No estudo não foram encontradas diferenças com significado estatístico (p>0,05)
para o risco nutricional, nesta faixa etária (ver tabela 7).
Idade < 65 anos
Idade ≥ 65
anos p
MUST, n (%) Sem risco 22 (88,0) 16 (66,7)
0,074
Com risco 3 (22,0) 8 (33,3)
NRS 2002, n (%) Sem risco 20 (80,0) 17 (70,8)
0,456
Com risco 5 (20,0) 7 (29,2)
PG-SGA, n (%) Sem risco 21 (84,0) 19 (79,2)
0,662
Com risco 4 (16,0) 5 (20,8)
NRI, n (%) Sem risco 7 (28,0) 13 (54,2)
0,062 Com risco 18 (72,0) 11 (45,8)
Outra nota de relevo é o IMC dos pacientes cuja média é 26,4 kg/m2. Foi possível
observar que PG-SGA e MUST identificaram, cada um, 1 (2,0%) paciente como
estando em risco cujo IMC é igual ou superior a 30, ou seja, é obeso. O NRI
identificou 8 (16,3%) pacientes obesos em risco nutricional. O NRS-2002 não
identificou nenhum paciente obeso em risco. A prevalência de obesidade
(IMC≥30) foi 20% (n=10) e de excesso de peso (25≥IMC<30) foi 41% (n=20). É importante referir que dos 49 pacientes, em apenas 1 (2,0%) estava registado
no seu processo clínico uma possível desnutrição.
Discussão
A patologia cardíaca associa-se frequentemente a excesso de peso, ingestão
energética e lipídica elevada, e a indicadores antropométricos como IMC e
perímetro da cintura altos(59-60). Este facto leva a que muitas vezes seja esquecido
que doentes com este tipo de patologia podem também estar em risco nutricional,
sendo importante e necessário o rastreio da DAD aquando da sua admissão
hospitalar.
O presente estudo detectou uma frequência de pacientes em risco que variou
entre 18,4% e 59,2%, o que é comparável a outros estudos efectuado(23-24, 26-27,
29)
, demonstrando que o risco nutricional em meio hospitalar continua a ser uma
realidade, não sendo de desprezar o rastreio em serviços de cardiologia.
O problema toma contornos ainda maiores, pois as ferramentas aqui usadas
detectaram uma prevalência de doentes gravemente desnutridos ou em risco
24
José Pedro Pereira, 2010
Durante a realização do trabalho verificou-se uma grande dificuldade de aplicação
dos inquéritos contrariamente ao referido por alguns autores(15, 19). De facto as
ferramentas de rastreio usadas não demonstraram ser de fácil aplicação, muito
contribuindo para isso o facto da maioria delas não especificar informação
suficiente sobre quem devem ser os aplicadores dos inquéritos, o grau de treino
dos aplicadores e a forma como se deve aplicar os inquéritos(48). Esta falta de
informação faz aumentar o grau de dificuldade da sua aplicação, podendo
eventualmente levar a um viés na estimativa da frequência de DAD, devendo isso
ser tido em consideração em futuros estudos. Além disto, é notória a diferença
entra a percentagem de doentes em risco identificados pelo NRI com as restantes
ferramentas. Durante o processo de inflamação, são produzidas,
predominantemente por macrófagos activados, citocinas IL-1, IL-6 e TNF-α, que
são estimuladores da resposta aguda pelo fígado(61-62). Entre as alterações que
ocorrem durante a resposta aguda, existe uma diminuição das concentrações
plasmáticas de proteínas de fase aguda “negativas”, nas quais se inclui a
albumina(62-63). Este facto pode explicar a disparidade verificada entre o NRI e as
restantes ferramentas na detecção de pacientes em risco, pois nos pacientes com
episódio cardíaco os marcadores inflamatórios estão elevados(64). Assim a
diminuição de produção hepática de albumina explicará os níveis baixos de
albumina sérica, que não reflecte uma baixa ingestão proteica, nem desnutrição, e
leva o NRI sobrestimar doentes desnutridos. Apesar de não serem feitas
advertência para o uso do NRI em situações deste tipo, esta ferramenta não
Outro ponto observado é que em ambiente hospitalar, o MUST e NRI podem
tornar-se ferramentas demasiado redutoras, devido ao facto de avaliarem poucos
parâmetros, levando facilmente a sobrestimativa ou subestimativa do risco.
O PG-SGA, ao avaliar um número maior de parâmetros, requer relativo treino e
sensibilidade por parte do examinador, pois verificou-se uma tendência dos
pacientes para exagerar no seu auto-diagnóstico.
Uma limitação deste trabalho foi o facto de o peso actual e a altura não serem
obtidos no momento exacto da avaliação e não se saber a fiabilidade do seu
valor, já que pouco se sabe da metodologia usada pelas equipas que avaliaram o
peso e a altura. Contudo todos os doentes foram avaliados segundo os mesmos
critérios, o que permite uma comparação isenta das ferramentas de rastreio.
Esclarecidas as limitações do estudo, passemos à análise da influência das
características da amostra na frequência de risco.
Não foram encontradas diferenças na idade e tempo de internamento entre os
pacientes com e sem risco em nenhuma das ferramentas de avaliação, no
entanto devem ser feitas algumas considerações.
O aumento da idade, principalmente idade superior a 65 anos, tem sido
preconizada como um factor de risco para a ocorrência de sarcopenia(65-66),
situação que leva a uma acentuada perda de massa muscular(66). Este fenómeno
pode aumentar o risco nutricional dos indivíduos com idade superior a 65 anos.
Para isso, a amostra foi dividida em 2 grupos, um com faixa etária superior a 65
anos, e outro inferior, comparando depois o risco nutricional. Os resultados
demonstraram não haver diferenças de risco para os dois grupos.
Vários estudos têm relatado o aumento do tempo de internamento dos doentes
26
José Pedro Pereira, 2010
Neste estudo não foram encontradas diferenças entre o tempo de internamento
dos doentes com risco nutricional e sem risco em nenhuma das ferramentas de
rastreio, e foram encontradas correlações fracas entre perda de peso a 1 mês e a
6 meses e o tempo de internamento, no entanto, a hipótese sugerida parece ser
plausível, dado que a mediana dos dias de internamento é maior para os
pacientes com perda de peso superior a 10% tanto em 1 mês, como em 6 meses.
Não obstante, a DAD nunca deve ser encarada como um problema isolado(67),
devendo outros factores ser associados na avaliação do tempo de internamento,
como por exemplo a gravidade da doença, pois neste estudo os doentes com
insuficiência cardíaca permaneceram em média cerca de 5 vezes mais tempo
internados.
O IMC foi a única característica na qual foram encontradas diferenças
estatisticamente significativas quando comparadas as médias dos pacientes com
e sem risco conforme o NRS-2002. Não surpreende que os pacientes em risco
tenham um IMC inferior, mas é curioso que foram detectados pacientes em risco
nutricional com IMC>30, ou seja, obesos. Este facto já foi verificado noutro
estudo(21), determinando que obesidade e risco nutricional são conceitos que
podem prevalecer juntos. Preocupante é também a elevada prevalência de
obesidade e excesso de peso, principalmente pelo facto de no serviço de
cardiologia do H.S.J. não existir nenhum profissional especializado no tratamento
destes problemas.
O tamanho reduzido da amostra não permitiu tirar conclusões sobre a influência
dos hábitos tabágicos e alcoólicos na frequência do risco nutricional, ficando por
Para finalizar, é de referir que dada a prevalência encontrada de risco nutricional
e de excesso de peso/obesidade, os cuidados alimentares prestados no serviço
de cardiologia do H.S.J. parecem ser insuficientes, devendo ser reforçada a
sensibilidade dos profissionais de saúde que nela operam para a importância do
rastreio nutricional e a necessidade da prescrição de cuidados alimentares,
devendo também ser criada uma equipa especializada neste tipo de cuidados.
Conclusão
Com este trabalho poderemos concluir que a frequência de indivíduos em risco
nutricional é de 18,4% a 59,2%. As ferramentas de avaliação MUST, NRS-2002,
NRI e PG-SGA demonstraram ter diferentes capacidades de detecção de
indivíduos com risco, 22,4%, 24,5%, 18,4% e 59,2%, respectivamente.
O NRI poderá apresentar limitações quando aplicado em doentes com patologia
cardíaca, que podem levar à sobrestimada do risco nutricional. Das restantes
ferramentas, nenhuma delas sobressai como tendo melhor aplicabilidade e
28
José Pedro Pereira, 2010
Referências Bibliográficas
1. Keller HH. Malnutrition in institutionalized elderly: how and why? J Am Geriatr Soc. 1993; 41(11):1212-8.
2. Stratton R, Green CJ, Elia M. Disease-related malnutrition an evidence-based approach to treatment. Wallingford: CAB International; 2003.
3. Meijers JM, van Bokhorst-de van der Schueren MA, Schols JM, Soeters PB, Halfens RJ. Defining malnutrition: mission or mission impossible? Nutrition. 2010; 26(4):432-40.
4. Lochs H, Allison SP, Meier R, Pirlich M, Kondrup J, Schneider S, et al. Introductory to the ESPEN Guidelines on Enteral Nutrition: Terminology, definitions and general topics. Clin Nutr. 2006; 25(2):180-6.
5. Margetts BM, Thompson RL, Elia M, Jackson AA. Prevalence of risk of undernutrition is associated with poor health status in older people in the UK. Eur J Clin Nutr. 2003; 57(1):69-74. 6. National Institute for Clinical Excellence. Nutrition Support for Adults Oral Nutrition Support, Enteral Tube Feeding and Parenteral Nutrition [Internet]. London: National Collaborating Centre for Acute Care; 2006. [citado em: 2010 Jul]. Disponível em:
http://guidance.nice.org.uk/CG32/Guidance/pdf/English.
7. Lesourd B, Mazari L. Nutrition and immunity in the elderly. Proc Nutr Soc. 1999; 58(3):685-95.
8. Chandra RK. Nutrition and the immune system: an introduction. Am J Clin Nutr. 1997; 66(2):460S-63S.
9. Trujillo EB. Effects of nutritional status on wound healing. J Vasc Nurs. 1993; 11(1):12-8. 10. Anker SD, Swan JW, Volterrani M, Chua TP, Clark AL, Poole-Wilson PA, et al. The influence of muscle mass, strength, fatigability and blood flow on exercise capacity in cachectic and non-cachectic patients with chronic heart failure. Eur Heart J. 1997; 18(2):259-69.
11. Rochester DF, Esau SA. Malnutrition and the respiratory system. Chest. 1984; 85(3):411-5. 12. Brooke OG. Influence of malnutrition on the body temperature of children. Br Med J. 1972; 1(5796):331-3.
13. Mansell PI, Fellows IW, MacDonald IA, Allison SP. Defect in Thermoregulation in Malnutrition Reversed by Weight Gain. Physiological Mechanisms and Clinical Importance. QJM. 1990; 76(2):817-29.
14. The Eshre Capri Workshop Group. Nutrition and reproduction in women. Hum Reprod Update. 2006; 12(3):193-207.
15. Stratton RJ, King CL, Stroud MA, Jackson AA, Elia M. 'Malnutrition Universal Screening Tool' predicts mortality and length of hospital stay in acutely ill elderly. Br J Nutr. 2006; 95(2):325-30.
16. Pichard C, Kyle UG, Morabia A, Perrier A, Vermeulen B, Unger P. Nutritional assessment: lean body mass depletion at hospital admission is associated with an increased length of stay. Am J Clin Nutr. 2004; 79(4):613-8.
17. Amaral TF, Matos LC, Tavares MM, Subtil A, Martins R, Nazare M, et al. The economic impact of disease-related malnutrition at hospital admission. Clin Nutr. 2007; 26(6):778-84. 18. Rowell DS, Jackson TJ. Additional costs of inpatient malnutrition, Victoria, Australia, 2003-2004. Eur J Health Econ. 2010;
19. Stratton RJ, Hackston A, Longmore D, Dixon R, Price S, Stroud M, et al. Malnutrition in hospital outpatients and inpatients: prevalence, concurrent validity and ease of use of the 'malnutrition universal screening tool' ('MUST') for adults. Br J Nutr. 2004; 92(5):799-808.
20. Imoberdorf R, Meier R, Krebs P, Hangartner PJ, Hess B, Staubli M, et al. Prevalence of undernutrition on admission to Swiss hospitals. Clin Nutr. 2010; 29(1):38-41.
21. Leistra E, Neelemaat F, Evers AM, van Zandvoort MH, Weijs PJ, van Bokhorst-de van der Schueren MA, et al. Prevalence of undernutrition in Dutch hospital outpatients. Eur J Intern Med. 2009; 20(5):509-13.
22. Lucchin L, D'Amicisb A, Gentilec MG, Battistinid NC, Fuscoe MA, Palmof A, et al. An Italian investigation on nutritional risk at hospital admission: The PIMAI (Project: Iatrogenic MAlnutrition in Italy) study. e-SPEN. 2009; 4(4):e199-e202.
23. Waitzberg DL, Caiaffa WT, Correia MI. Hospital malnutrition: the Brazilian national survey (IBRANUTRI): a study of 4000 patients. Nutrition. 2001; 17(7-8):573-80.
24. Correia MI, Campos AC. Prevalence of hospital malnutrition in Latin America: the multicenter ELAN study. Nutrition. 2003; 19(10):823-5.
25. Shum NC, Hui WW, Chu FC, Chai J, Chow TW. Prevalence of malnutrition and risk factors in geriatric patients of a convalescent and rehabilitation hospital. Hong Kong Med J. 2005; 11(4):234-42.
26. Matos L, Teixeira MA, Henriques A, Tavares MM, Alvares L, Antunes A, et al. [Nutritional status recording in hospitalized patient notes]. Acta Med Port. 2007; 20(6):503-10.
27. McWhirter JP, Pennington CR. Incidence and recognition of malnutrition in hospital. BMJ. 1994; 308(6934):945-8.
28. Edington J, Boorman J, Durrant ER, Perkins A, Giffin CV, James R, et al. Prevalence of malnutrition on admission to four hospitals in England. The Malnutrition Prevalence Group. Clin Nutr. 2000; 19(3):191-5.
29. Naber TH, Schermer T, de Bree A, Nusteling K, Eggink L, Kruimel JW, et al. Prevalence of malnutrition in nonsurgical hospitalized patients and its association with disease complications. Am J Clin Nutr. 1997; 66(5):1232-9.
30. Sorensen J, Kondrup J, Prokopowicz J, Schiesser M, Krahenbuhl L, Meier R, et al. EuroOOPS: an international, multicentre study to implement nutritional risk screening and evaluate clinical outcome. Clin Nutr. 2008; 27(3):340-9.
31. Edington J, Kon P. Prevalence of malnutrition in the community. Nutrition. 1997; 13(3):238-40.
32. Thomas DR, Zdrowski CD, Wilson MM, Conright KC, Lewis C, Tariq S, et al. Malnutrition in subacute care. Am J Clin Nutr. 2002; 75(2):308-13.
33. Beck AM, Balknas UN, Camilo ME, Furst P, Gentile MG, Hasunen K, et al. Practices in relation to nutritional care and support--report from the Council of Europe. Clin Nutr. 2002; 21(4):351-4.
34. Kelly IE, Tessier S, Cahill A, Morris SE, Crumley A, McLaughlin D, et al. Still hungry in hospital: identifying malnutrition in acute hospital admissions. QJM. 2000; 93(2):93-8.
35. Mowe M, Bohmer T. The prevalence of undiagnosed protein-calorie undernutrition in a population of hospitalized elderly patients. J Am Geriatr Soc. 1991; 39(11):1089-92.
36. Pennington CR, McWhirter JP. Patients go hungry in British hospitals. Malnutrition is common, unrecognised, and treatable in hospital patients. BMJ. 1997; 314(7082):752.
37. Lamb CA, Parr J, Lamb EIM, Warren MD. Adult malnutrition screening, prevalence and management in a United Kingdom hospital: cross-sectional study. Br J Nutr. 2009; 102(04):571-75. 38. Administração Central do Sistema de Saúde (ACSS). RSE- Registo de Saúde Electrónico. R1:Documento de Estado da Arte [Internet]. Ministério da Saúde 2009. [citado em: 2010 Jul]. Disponível em: http://www.acss.min-saude.pt/Portals/0/RSER1_Estado_da_Arte_V3.pdf.
39. World Health Organization. International Classification of Diseases, 10th revision, Clinical Modification. Tabular List of Diseases and Injuries. [Internet]. USA National Center for Health Statistics (NCHS); 2010. [citado em: 2010 Jul]. Disponível em:
http://www.cdc.gov/nchs/icd/icd10cm.htm#10update.
40. World Health Organization. International Classification of Diseases, 9th revision, Clinical Modification (ICD-9-CM). Appendix E, List of Three-Digit Categories. [Internet]. USA National
30
José Pedro Pereira, 2010
Center for Health Statistics (NCHS); 2009. [citado em: 2010 Jul]. Disponível em:
http://www.cdc.gov/nchs/icd/icd9cm.htm.
41. England Department of Health. The Essence of Care: Patient-focused benchmarking for health care practitioners [Internet]. DH; 2001. [citado em: 2010 Jul]. Disponível em:
http://www.dh.gov.uk/en/Publicationsandstatistics/Publications/PublicationsPolicyAndGuidance/
DH_4005475.
42. Council of Europe Committee of Ministers. Resolution ResAP(2003)3 on food and nutritional care in hospitals [Internet]. CE; 2003. [citado em: 2010 Jul]. Disponível em: https://wcd.coe.int/ViewDoc.jsp?id=85747.
43. Kopelman P, Lennard-Jones J. Nutrition and patients: a doctor's responsibility. Clin Med. 2002; 2(5):391-4.
44. Kondrup J, Allison SP, Elia M, Vellas B, Plauth M. ESPEN guidelines for nutrition screening 2002. Clin Nutr. 2003; 22(4):415-21.
45. Elia M, Zellipour L, Stratton RJ. To screen or not to screen for adult malnutrition? Clin Nutr. 2005; 24(6):867-84.
46. National Institute for Health and Clinical Excelence (NHS). Nutrition support in adults: oral nutrition support, enteral tube feeding and parenteral nutrition. 2006. Disponível em:
http://guidance.nice.org.uk/CG32;
47. Beghetto MG, Manna B, Candal A, Mello EDd, Polanczyk CA. Triagem nutricional em adultos hospitalizados. Rev Nutr. 2008; 21:589-601.
48. Jones JM. The methodology of nutritional screening and assessment tools. J Hum Nutr Diet. 2002; 15(1):59-71; quiz 73-5.
49. American Society for Parenteral and Enteral Nutrition. Guidelines for the use of parenteral and enteral nutrition in adult and pediatric patients. JPEN J Parenter Enteral Nutr. 1993; 17(4 Suppl):1SA-52SA.
50. Malnutrition Advisory Group (MAG). The "MUST" explanatory booklet: a guide to the "Malnutrition Universal Screening Tool" ("MUST") for adults [Internet]. British Association for Parenteral and Enteral Nutrition (BAPEN); 2003. [citado em: 2010 Jul]. Disponível em:
http://www.bapen.org.uk/must_notes.html.
51. Kondrup J, Rasmussen HH, Hamberg O, Stanga Z. Nutritional risk screening (NRS 2002): a new method based on an analysis of controlled clinical trials. Clin Nutr. 2003; 22(3):321-36. 52. Elliott L, Molseed LL, McCallum PD. The Clinical Guide to Oncology Nutrition Second Edition. American Dietetic Association; 2006.
53. Bauer J, Capra S, Ferguson M. Use of the scored Patient-Generated Subjective Global Assessment (PG-SGA) as a nutrition assessment tool in patients with cancer. Eur J Clin Nutr. 2002; 56(8):779-85.
54. Buzby GP, Knox LS, Crosby LO, Eisenberg JM, Haakenson CM, McNeal GE, et al. Study protocol: a randomized clinical trial of total parenteral nutrition in malnourished surgical patients. Am J Clin Nutr. 1988; 47(2 Suppl):366-81.
55. Naber TH, de Bree A, Schermer TR, Bakkeren J, Bar B, de Wild G, et al. Specificity of indexes of malnutrition when applied to apparently healthy people: the effect of age. Am J Clin Nutr. 1997; 65(6):1721-5.
56. World Medial Association. WMA Declaration of Helsinki - Ethical Principles for Medical Research Involving Human Subjects [Internet]. Seoul: WMA; 2008. [citado em: 2010 Jul]. Disponível em: http://www.wma.net/en/30publications/10policies/b3/index.html.
57. World Health Organization. Global Database on Body Mass Index [web page]. WHO; cop 2006-2010. [citado em: 2010 Jul]. BMI classification. Disponível em:
http://apps.who.int/bmi/index.jsp?introPage=intro_3.html. .
58. Finney DJ. Statistics for biologists. London: Chapman and Hall; 1980.
59. Oliveira MAMd, Fagundes RLM, Moreira EAM, Trindade EBSdM, Carvalho Td. Relação de indicadores antropométricos com fatores de risco para doença cardiovascular. Arq Bras Cardiol. 2010; 94:478-85.
60. Srinivasan SR, Bao W, Wattigney WA, Berenson GS. Adolescent overweight is associated with adult overweight and related multiple cardiovascular risk factors: The Bogalusa Heart Study. Metabolism. 1996; 45(2):235-40.
61. coord. Arosa F, Cardoso EM, Pacheco FC. Fundamentos de imunologia. Lisboa: Lidel; 2007.
62. Gabay C, Kushner I. Acute-phase proteins and other systemic responses to inflammation. N Engl J Med. 1999; 340(6):448-54.
63. Ritchie RF, Palomaki GE, Neveux LM, Navolotskaia O, Ledue TB, Craig WY. Reference distributions for the negative acute-phase serum proteins, albumin, transferrin and transthyretin: a practical, simple and clinically relevant approach in a large cohort. J Clin Lab Anal. 1999; 13(6):273-9.
64. Pearson TA, Mensah GA, Alexander RW, Anderson JL, Cannon RO, 3rd, Criqui M, et al. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: A statement for healthcare professionals from the Centers for Disease Control and Prevention and the American Heart Association. Circulation. 2003; 107(3):499-511.
65. Iannuzzi-Sucich M, Prestwood KM, Kenny AM. Prevalence of Sarcopenia and Predictors of Skeletal Muscle Mass in Healthy, Older Men and Women. J Gerontol A Biol Sci Med Sci. 2002; 57(12):M772-M77.
66. Muscaritoli M, Anker SD, Argilés J, Aversa Z, Bauer JM, Biolo G, et al. Consensus definition of sarcopenia, cachexia and pre-cachexia: Joint document elaborated by Special Interest Groups (SIG) "cachexia-anorexia in chronic wasting diseases" and "nutrition in geriatrics". Clin Nutr. 2010; 29(2):154-59.
67. Venzin RM, Kamber N, Keller WCF, Suter PM, Reinhart WH. How important is malnutrition? A prospective study in internal medicine. Eur J Clin Nutr. 2007; 63(3):430-36.
32
José Pedro Pereira, 2010
Lista de Anexos
Anexo A. Malnutrition Universal Screenning Tool (MUST)………...… 33 Anexo B. Nutritional Risk Screening de 2002 (NRS-2002)………...…… 37 Anexo C. Patient-Generated Subjective Global Assessment (PG-SGA), versão
Ane
xo
A
Malnutrition
Univer
sa
l S
creen
ning To
ol
(MUST)
34
Fonte: BAPEN(I)
I. Malnutrition Advisory Group (MAG). Malnutrition Universal Screening Tool (MUST) [internet]. BAPEN; 2006. [citado em: 2010 Jul]. Disponível em:
36