1
UNIVERSIDADE DE LISBOA
FACULDADE DE FARMÁCIA
MONOGRAFIA
Pré-Eclâmpsia:
Diagnóstico e Risco associado
MESTRADO EM ANÁLISES CLÍNICAS
Orientação:
Professora Doutora Maria João Silva
Bruno Marques Miguel
2
UNIVERSIDADE DE LISBOA
FACULDADE DE FARMÁCIA
MONOGRAFIA
Pré-Eclâmpsia:
Diagnóstico e Risco associado
MESTRADO EM ANÁLISES CLÍNICAS
Orientação:
Professora Doutora Maria João Silva
Bruno Marques Miguel
3
Agradecimentos
Em primeiro lugar quero agradecer à Professora Doutora Maria João Silva pelo excelente apoio, disponibilidade e orientação na realização da presente monografia.
Um especial agradecimento aos meus familiares em particular à minha esposa e filha, pela compreensão demonstrada nos momentos em que não estive presente por estar a dedicar esse tempo a este trabalho.
4
Índice
Abreviaturas ... 1
Índice de Figuras ... 2
Índice de Tabelas ... 2
Resumo/Abstract ... 3
I- Introdução
...
5
I.1-
Definição e Epidemiologia
...
5
I.2- Etiologia e Fatores de risco ...
6
I.3- Fisiopatologia ...
9
I.3.1 Mecanismo Fisiopatológico ... 9
I.3.1.1 Placentação anormal (Fase I) ... 9
I.3.1.2 Síndrome Materno (Fase II) ... 11
I.3.2 Manifestações clínicas maternas ... 12
I.3.2.1 Sistema Cardiovascular ... 12
I.3.2.2 Sistema Renal ... 13
I.3.2.3 Hemostase ... 13
I.3.2.4 Sistema Hepático ... 14
I.3.2.5 Eclâmpsia ... 14
I.3.2.6 Síndrome de HELLP ... 14
...
I.4- Diagnóstico e Classificação ...
15
I.5- Diagnóstico Precoce – Avaliação de risco ...
17
I.5.1 Fatores de Risco Materno ... 18
I.5.2 Marcadores Ecográficos ... 18
I.5.3 Marcadores Clínicos ... 20
5
I.5.4.1- - Proteína plasmática A associada à gravidez (PAPP-A) ... 22
I.5.4.2-
-Marcadores angiogénicos ... 22
I.5.4.3- -
Proteína placentária 13 (PP13) ... 25
I.5.4.4- - P-selectina ... 25
I.5.4.5- - Inibina A e Activina A ... 26
I.5.4.6- - Cistatina C ... 26
...
I.5.4.7- - Hemoglobina fetal ... 26
I.5.4.8- - DNA fetal ... 27
I.5.5 Screening Combinado ... 28
I.6- Metodologias Analíticas ...
32
II- Perspetivas
...
33
III- Conclusões ...
35
1
Abreviaturas
A1M- α-1 microglobulina antioxidante
ACOG- American College of Obstetricians and Gynecologists Colégio Americano de Obstetrícia e Ginecologia
DCV- Doença cardiovascular
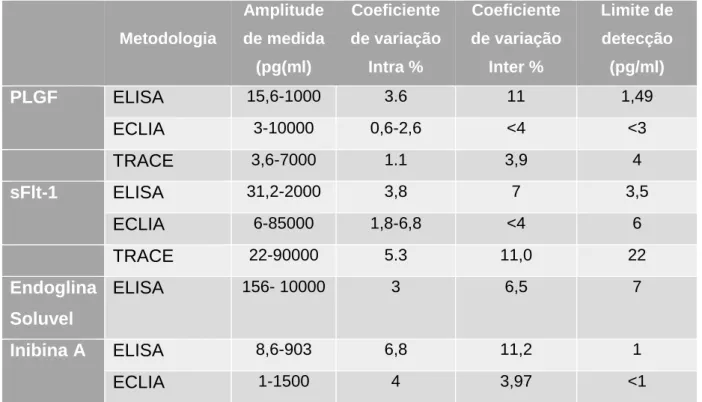
ECLIA- Electro-chemiluminescence immunoassay Eletroquimioluminescência ELISA- Enzyme-linked immunosorbent assay Ensaio de imunoabsorção enzimática ENGs- endoglina solúvel
HbF- hemoglobina fetal
HELLP- hemolysis, elevated liver enzymes and low platelets Hemólise, elevação das enzimas hepáticas e trombocitopénia
IC- Intervalo de confiança
IGF- Insulin-like growth factor Fator de crescimento semelhante à insulina IMPROVED- Improved Pregnancy Outcomes by Early Detection
MoM- múltiplo da mediana MPA- média da pressão arterial
NICE- National Institute for Health and Clinical Excellence NK- Natural Killer
NO- Nitric oxid Óxido nítrico
NOS- Nitric oxid synthase Óxido nítrico sintase OMS- Organização Mundial de Saúde
PAPP-A- Pregnancy-associated plasma protein A Proteína plasmática A associada à gravidez
PE- Pré-eclâmpsia
PI- pulsatility index Índice de pulsatilidade
PIERS- Pre-eclampsia Integrated Estimate of Risk
PIGF- Placental growth factor Factor de crescimento placentar PP13- Placental Protein 13
RAS- Renin angiotensin system Sistema renina-angiotensina mRNA- messenger ribonucleic acid
RFP- Ratio de falsos positivos
2 sFlt-1- Soluble fms-like tyrosine kinase-1 Forma solúvel-tirosina-cinase 1
TD- taxa de deteção
TGF β-1-Transforming Growth Factor beta 1
TNF-α- Tumor necrosis factor Factor de necrose tumoral TRACE- time-resolved amplified cryptate emission
uA-PI- Uterine Artery Pulsatility Index Índice de pulsatilidade da artéria uterina VEGF- Vascular endothelial growth factor Factor de crescimento endotelial vascular VPP- Valor preditivo positivo
Índice de Figuras
Figura 1- Invasão trofoblástica
Índice de Tabelas
Tabela 1- Principais fatores e percentagem de risco associada ao desenvolvimento da pré-eclâmpsia
Tabela 2- Classificação da pré-eclâmpsia
Tabela 3- Marcadores bioquímicos descritos como preditores de pré-eclâmpsia Tabela 4 - Algoritmos para predição de pré-eclâmpsia precoce e tardia
Tabela 5- Ratios de deteção estimada para a pré-eclâmpsia precoce e tardia
Tabela 6- Caracteristicas dos principais testes analíticos disponiveis para despiste da pré-eclâmpsia
3
Resumo
A Pré-eclâmpsia (PE) é uma patologia hipertensiva associada à gravidez que surge a partir da 20ª semana de gestação e constitui uma das principais causas de mortalidade e morbilidade materna e perinatal no mundo.
A sua causa ainda não foi totalmente determinada, mas sabe-se que decorre da disfunção na junção uteroplacentária, com remodelação das artérias espirais e com défice hemodinâmico que origina vasoconstrição e dano vascular, conduzindo aos sintomas mais claros usados no diagnóstico da doença: pressão arterial elevada e proteinúria. Existem vários factores de risco, tais como, hipertensão crónica, história anterior de PE, nuliparidade, diabetes mellitus, etnia, idade materna, entre outros cuja presença se relaciona, mais ou menos, com o diagnóstico subsequente de PE.
As manifestações clínicas ocorrem, habitualmente, no 2º/3º trimestre e podem ser tão variáveis desde uma doença grave, com início precoce e restrição do desenvolvimento fetal tornando necessária a indução de parto antes da 34ª semana de gestação (PE precoce), até uma doença leve de início tardio e sem comprometimento fetal significativo (PE tardia). A PE quando não diagnosticada pode evoluir para eclâmpsia e síndrome HELLP que são importantes indicadores de disfunções orgânicas severas e de mortalidade.
Nos últimos anos foram propostos vários tipos de biomarcadores para a deteção precoce da PE e apesar de nenhum deles apresentar valor preditivo positivo suficientemente elevado para poder fornecer um rastreio preciso, conclui-se que a incorporação de determinados marcadores (fatores de risco maternos e história clínica, estudo Doppler das artérias uterinas, média da pressão arterial e parâmetros bioquímicos) em algoritmos e modelos combinados permite melhorar substancialmente a predição da PE. Apesar dos resultados promissores, não existe até à data um modelo/algoritmo de rastreio para a PE clinicamente validado, limitando a sua aplicabilidade.
Encontram-se em curso novos estudos com o objetivo de avaliar e aperfeiçoar novos testes para a predição da PE, com base em tecnologias emergentes como a biologia molecular, a proteómica e a metabolómica.O diagnóstico precoce da PE assume-se como uma prioridade da Obstetricia, no sentido de prevenir ou retardar a progressão da doença e evitar consequências graves tanto para a mãe como para o feto.
4
Abstract
Pre-eclampsia (PE) is a hypertensive disorder associated with pregnancy that appears after the 20th week of gestation and is one of the main causes of maternal and perinatal mortality and morbidity in the world.
Its cause has not been fully determined but it is known that it results from a dysfunction at the uteroplacental junction with conversion of the spiral arteries and with hemodynamic deficit that causes vasoconstriction and vascular damage leading to the symptoms used in the diagnosis of the disease: high blood pressure and proteinuria. There are several risk factors such as chronic hypertension, previous history of PE, nulliparity, diabetes mellitus, ethnicity, maternal age, among others whose presence is more or less related to the subsequent diagnosis of PE. Clinical manifestations usually occur in the 2nd / 3rd trimester and may be as a severe disease, with early onset and fetal development restriction, demanding the induction of childbirth before the 34th week of pregnancy (early PE) or a late onset illness without significant fetal impairment (late PE). PE when undiagnosed may progress to eclampsia and HELLP syndrome which are important indicators of severe organ dysfunction and mortality.
In the last years, several types of biomarkers have been proposed for the early detection of PE and although none of them have sufficiently high positive predictive value to provide accurate screening, it has been concluded that the incorporation of certain markers (maternal risk factors and clinical history, Doppler study of uterine arteries, mean blood pressure and biochemical parameters) in combined algorithms and models allows to substantially improve the prediction of PE. Despite the promising results, to date there is no screening model / algorithm clinically validated to PE, limiting its applicability.
New studies are in progress to evaluate and improve new tests for PE prediction based on emerging technologies such as molecular, proteomics and metabolomics. Early diagnosis of PE is a priority of Obstetrics in order to prevent or delay the progression of the disease and avoid serious consequences for both mother and fetus.
5
I-
INTRODUÇÃO
I.1- Definição e Epidemiologia
Os distúrbios hipertensivos são uma das principais complicações clínicas que ocorrem durante a gravidez, afetando cerca de 10% das mulheres grávidas em todo o mundo. Este grupo de doenças e condições, que incluem pré-eclâmpsia (PE)/eclâmpsia, hipertensão gestacional e hipertensão crónica, constituem uma importante causa mundial de morbilidade grave, prematuridade, atraso no crescimento intra-uterino e mortalidade materna e perinatal(1,2).
A PE é uma patologia multisistémica definida pelo aparecimento de hipertensão (pressão sistólica>140mmHg e pressão diastólica >90mmHg) e proteinúria significativa (>300mg/24h) a partir da 20ª semana de gravidez e destaca-se pelo seu impacto na saúde materna e neonatal(3,4).
Estima-se que aproximadamente 2-8% das grávidas em todo o mundo sejam afetadas pela PE sendo responsável por 12% de restrições de crescimento fetal e 19% de partos prematuros
(2). Das pacientes que desenvolvem PE, 25% são classificadas como grave e 75% como leve. Aproximadamente 1% de todos os casos de PE e 10% dos casos de PE grave exigem parto antes da 34ª semana de gestação. Quanto mais precocemente ocorrer a PE, maior o risco de morte materna e perinatal(1,2,5).
Segundo os dados mais recentes da Organização Mundial de Saúde (OMS), 14 % da mortalidade materna mundial está diretamente relacionada com esta patologia e é a principal causa de morte materna na América Latina e Caraíbas (5).
Os dados epidemiológicos relacionados com a PE podem variar dependendo das populações em estudo e da presença de fatores de risco. Nos países subdesenvolvidos as taxas de incidência podem atingir os 18% em algumas zonas africanas e a mortalidade associada é 5 a 9 vezes superior (1) (3). Em Portugal a prevalência da PE atinge 2% das gravidezes (6). A disfunção orgânica materna associada à PE pode apresentar várias características clinicas, incluindo a eclâmpsia e a síndrome HELLP (hemólise, elevação das enzimas hepáticas e trombocitopénia) que são importantes indicadores de alterações orgânicas adicionais e de mortalidade (1).
A eclâmpsia, caracterizada pela ocorrência de convulsões generalizas, ocorre em cerca de 5 a 8% dos casos de PE em países subdesenvolvidos, enquanto a síndrome de HELLP ocorre em 0,5% a 0,9% de todas as gravidezes e em 10 a 20% das mulheres com PE grave (1).
6
I.2 - Etiologia e Fatores de risco
A etiologia da PE permanece desconhecida e apesar das várias suposições à sua volta, apenas, se concluiu que é uma patologia multifactorial. Existem vários fatores incluindo a história familiar, pessoal e da própria gravidez, cuja presença se relaciona, mais ou menos, com o diagnóstico subsequente de PE.
Idade Materna - As mulheres grávidas com idade igual ou superior a 40 anos têm duas vezes mais risco de desenvolvimento de PE independentemente da paridade (2,7); Etnia - A incidência é maior nas mulheres afrodescendentes. Em relação à população de
primíparas, a incidência de PE é o dobro na população afro-descendente, quando comparada com a população branca (8,9);
Tabagismo - Estudos mostram uma associação inversa entre tabagismo e PE, com relatos de diminuição até 30% na incidência desta patologia em mulheres fumadoras. Estes dados estão relacionados com uma inibição do tromboxano, um indutor de vasoconstrição e inibição de fatores antiangiogénese. As fumadoras apresentam baixas concentrações circulantes destes fatores quando comparadas com não fumadoras. Estudos in vitro mostram que o monóxido de carbono, e não a nicotina, diminui a concentração dos factores antiangiogénicos em culturas de células endoteliais. Contudo, tabagistas que desenvolvem PE apresentam piores resultados perinatais, com maior ocorrência de restrição de crescimento intra-uterino, descolamento prematuro de placenta, baixo peso ao nascer e prematuridade. A proteção conferida pelo fumo parece ser dependente da idade, havendo queda progressiva com o seu avanço (10,11,12);
Obesidade - A obesidade é um importante fator de risco para PE, cuja taxa aumenta quanto maior o índice de massa corporal (IMC). O tecido adiposo produz hormonas específicas (adipocinas) com potente ação anti-inflamatória e relacionada com o desenvolvimento da PE, atuando como marcadores na identificação precoce da doença. A concentração de adiponectina, uma adipocina com ação anti-inflamatória, diminui à medida que o IMC aumenta com incremento da resistência periférica à insulina (13); História prévia ou familiar de PE - As mulheres grávidas, que tenham PE na primeira
gravidez, têm uma grande probabilidade de desenvolver a doença em gravidezes subsequentes. Por outro lado, estudos mostram alta incidência de PE entre familiares. O antecedente da patologia na mãe e/ou irmã parece exercer forte influência no desenvolvimento da mesma. Mulheres provenientes de gestações complicadas por PE, têm elevado risco de desenvolverem a patologia durante as suas gestações (14);
Paridade sexual – a nuliparidade está associada a um elevado risco de desenvolver PE devido a factores imunológicos. Vários estudos epidemiológicos suportam o conceito de que a inadaptação imunológica materna ao antigénio paterno fetal está intimamente
7 relacionada com o desenvolvimento da PE. Essa má adaptação determina uma resposta imune materna inadequada aos antigénios fetais oriundos do DNA paterno podendo estar origem do desencadeamento do processo fisiopatológico da PE (7);
Outro aspecto relacionado com a paridade sexual e que parece influenciar a incidência da PE é a duração da relação sexual entre a mulher e o pai biológico. Um estudo prospetivo realizado com 2.507 grávidas nulíparas demonstrou que as relações sexuais de curta duração entre a mulher e o pai biológico aumentam a incidência de PE. O efeito protetor do contacto sexual pode ser explicado pela tolerância materna aos antigénios paternos, a partir do contato repetido do esperma com a mucosa materna (15).Outros estudos confirmam que a exposição ao sêmen paterno induz um processo de aloimunização na mulher (7);
Um estudo mais recente demonstrou que grávidas nulíparas apresentavam níveis de fatores antiagiogénicos mais elevados que grávidas multíparas, sugerindo uma associação com um desequilíbrio angiogénico. Tendo em conta o papel patogénico destes fatores, os dados reforçam que a nuliparidade é um factor de risco importante para o desenvolvimento da PE (16);
Também por razões imunológicas, parece existir uma relação entre a multiparidade e o desenvolvimento de PE (7);
Infecções - A gestação normal induz uma série de respostas inflamatórias sistémicas que estão agravadas na PE. Acredita-se que qualquer fator que intensifique a reação inflamatória materna, como processos infeciosos e doenças reumáticas, podem predispor à PE. A literatura mostra que infeções maternas como as do trato urinário, periodontal, por
Chlamydia sp. e Citomegalovírus potenciam o desenvolvimento desta patologia (7);
Gestação múltipla - o risco aumenta consoante o número de fetos (17);
Tempo entre gestações – o risco de PE aumenta mediante o intervalo de tempo entre as gestações. Quando o intervalo é superior a 10 anos o risco iguala o da uma paciente nulípara (17);
Alta altitude – o aumento da incidência de PE em altas altitudes tem sido atribuído a uma maior hipoxia placentária, menor diâmetro e menor fluxo sanguíneo da artéria uterina (18); Presença de outras patologias
Diabetes mellitus – a diabetes mellitus pré gestacional quadruplica o risco de PE; Hipertensão crónica – a hipertensão pré gestacional aumenta o risco de PE e, quando se desenvolve, está associada a maiores taxas de mortalidade perinatal e partos prematuros;
Patologias renais – A prevalência de patologias renais é maior em mulheres com PE do que em mulheres sãs;
8 Patologias autoimunes – as gestantes com patologias autoimunes tem risco
acrescido de desenvolver PE;
Síndrome anti-fosfolipídico – a presença de anticorpos anti-cardiolipina e/ou anticoagulante lúpico aumentam o risco de PE
(7,17,19)
Genética - Existem vários estudos que descrevem associações entre polimorfismos genéticos e o desenvolvimento da PE. Dos genes estudados até hoje os mais relevantes foram:
o Polimorfismo MTHFR - ocorre em genes que regulam a pressão arterial; o Polimorfismo GSTP1 - ocorre em genes que regula o stress oxidativo;
o Polimorfismo eNOS - ocorre em genes que geram o óxido nítrico (NO) e regulam a função vascular;
Polimorfismos em genes que codificam proteínas do sistema imunitário (factor de necrose tumoral (TNF-α) e interleucina-6)
(20,21)
A tabela 1 resume os principais fatores e percentagem de risco associada ao desenvolvimento de PE.
Tabela 1- Principais fatores e percentagem de risco associada ao desenvolvimento da pré-eclâmpsia
DCV- doença cardiovascular ; IC- Intervalo de confiança
Fatores de Risco
Risco Relativo
(ICde 95%)
Síndrome anti-fosfolipídico 9,7 (4,3-21,7)
Doença renal 7,8 (2,2- 28,2)
História anterior de pré-eclâmpsia 7,2 (5,8- 8,8)
Lúpus Eritematoso Sistémico 5,7 (2,0-16,2)
Nuliparidade 5,4 (2,8-10,3) Hipertensão crónica 3,8 (3,4-4,3) Diabetes mellitus 3,6 (2,5-5,0) Alta altitude 3,6 (1,1-11,9) Gestações múltiplas 3,5 (3,0- 4,2) História familiar de DCV 3,2 (1,4- 7,7) Obesidade 2,5 (1,7-3,7)
História familiar(1º grau de parentesco) de Pré-eclâmpsia
2,3 (1,8-3,6)
Idade materna avançada (>40 anos) 1,68 (1,23- 2,29) para nuliparas 1,96(1,34-2,87) para
9
I.3 Fisiopatologia
I.3.1 Mecanismo Fisiopatológico
Os mecanismos responsáveis pela patogénese da PE ainda não estão totalmente esclarecidos, embora nos últimos anos se tenham desenvolvido enormes progressos na sua compreensão.
É consensual o conceito de que a placenta desempenha um papel central na patogénese da PE e que a reduzida perfusão útero-placentária desencadeia uma série de eventos que originam as complicações materno-fetais. Contudo, esta patologia é bastante complexa envolvendo vários órgãos e depende da interação de vários fatores: imunológicos, genéticos e ambientais (22,23,24).
Vários autores têm sugerido um modelo explicativo para a génese da PE baseado em duas fases: a primeira (1º e 2º trimestres) caracteriza-se por uma placentação anormal e a segunda, denominado Síndrome Materno, ocorre quando se desencadeiam as principais manifestações clínicas da doença (6,23,24).
As investigações atuais têm-se focalizado no estudo dos mecanismos imunológicos (tolerância imunológica - antigénios leucocitários humanos e células Natural Killer (NK), auto anticorpos agonistas do receptor de angiotensina I), resposta inflamatória exagerada, stress oxidativo, patologia mitocondrial e genes relacionados com hipoxia (23).
I.3.1.1 Placentação anormal (Fase I)
Durante uma gravidez normal os citotrofoblastos fetais invadem as artérias espiraladas uterinas, substituindo e diferenciando o seu endotélio vascular. Este complexo e não definido processo, resulta na conversão de vasos de alta resistência em vasos de pequeno diâmetro e de baixa resistência, capazes de receber um fluxo sanguíneo dez vezes superior para prosseguir o normal desenvolvimento da gravidez. Por outro lado, é iniciada uma tolerância imunológica materno-fetal (6).
Vários estudos desenvolvidos sugerem que, nas grávidas com PE, há uma invasão anormal das artérias espiraladas pelo trofoblasto, provocando a redução da perfusão útero-placentária, o que originará o desenvolvimento da patologia (Figura 1) (22,25). O exame citopatológico de placentas de gestações com PE revelam, geralmente, enfartes placentários e estreitamento das artérias e arteríolas, com características de invasão endovascular diminuída pelos citotrofoblastos e remodelação inadequada das arteríolas uterinas (23).
10 A invasão e diferenciação anormal das células trofoblásticas provocam vasoconstrição uterina persistente, originando hipoxia e isquemia placentária, levando à libertação de fatores solúveis placentários antiangiogénicos e pro-inflamatórios. Uma vez na circulação materna, estes factores levam à ativação/disfunção generalizada do endotélio vascular materno, com consequente estímulo à formação de vasoconstritores (endotelina-1, tromboxano, superóxidos), citocinas inflamatórias, maior sensibilidade vascular à angiotensina II e diminuição da produção de vasodilatadores (NO e prostaciclinas). Os primeiros efeitos patológicos são o aumento da resistência vascular sistémica, presença de reactividade vascular e modificação da distribuição do fluxo sanguíneo na pélvis, que precede o início da hipertensão (23,25).
Factores Angiogénicos
Na PE, devido à isquémia placentária, há um desequilíbrio na produção e libertação para o circulação materna de factores reguladores da angiogénese. Vários estudos enfatizam o papel dos factores antiangiogénicos produzidos pela placenta no desenvolvimento da PE, com destaque para duas proteínas antiangiogénicas: a forma solúvel-tirosina-cinase 1( sFlt-1) e a endoglina solúvel (ENGs) (24,25).
A sFlt-1 é um receptor do factor de crescimento placentar (PIGF) e do factor de crescimento endotelial vascular (VEGF). Quando os seus níveis aumentam na circulação materna reduzem a forma livre e a estimulação angiogénica vasodilatadora destes factores, originando a disfunção endotelial. No rim acredita-se que a inactivação do VEGF esteja na origem da
Placenta
Troflobasto
Miométrio Artéria espiral Artéria arqueada
Não grávida Pré- eclampsia Gravidez normal
Figura 1- Invasão trofoblástica.
11 endoteliose glomerular e proteinúria. Vários estudos suportam que os níveis de sFlt-1 estão fortemente relacionados com a gravidade da PE (24,25).
A ENGs é um receptor angiogénico que é expresso nas células endoteliais e trofoblastos placentários. Actua como co-receptor do factor de crescimento (TGF β-1)-um potente pró-angiogénico. A ENGs impede a ligação do factor de crescimento (TGF β-1) aos receptores endoteliais diminuindo a vasodilatação dependente do NO. Verificou-se que nas placentas pré eclâmpticas há uma sobrexpressão do mRNA da ENGs sendo libertadas grandes quantidades desta proteína para a circulação materna. Em estudos realizados em ratos, verificou-se que potencia os danos vasculares mediados pelo sFlt-1, originado PE graves incluindo o desenvolvimento da Síndrome de HELLP e restrições do crescimento fetal (23,24).
I.3.1.2 Síndrome Materno (Fase II)
A síndrome materno ocorre quando as manifestações clínicas da doença se acentuam, dependendo não só dos efeitos citotóxicos e dos fatores placentários quando entram na circulação materna, mas também do estado geral de saúde da mãe, incluindo doenças pré existentes (obesidade, doenças metabólicas, como a diabetes e disfunções endócrinas), fatores genéticos e ambientais que possam afetar a função vascular (23,25).
Nem todas as grávidas evoluem para esta fase. De acordo com o modelo de interação materno/fetal/placentária, a contribuição dos fatores relacionados com cada uma das partes influencia a evolução da PE e a gravidade do quadro clínico. Daí as manifestações clínicas poderem ser tão variáveis, desde uma doença grave com início precoce e restrição do desenvolvimento fetal até uma doença leve de início tardio e sem comprometimento fetal significativo (25).
12
I.3.2 Manifestações clínicas maternas
As manifestações clínicas da PE são desencadeadas pelos fatores placentários e disfunção das células endoteliais que vão originar vasoespamo sistémico, permeabilidade vascular aumentada, stress oxidativo, agregação plaquetária e uma resposta inflamatória sistémica provocando danos em órgãos/sistemas alvo. Estas manifestações clínicas ocorrem normalmente após a 20ª semana de gravidez (23,24).
I.3.2.1 Sistema Cardiovascular
A hipertensão arterial é uma das principais manifestações clínicas da PE. Durante uma gravidez normal há uma diminuição da pressão arterial, tanto sistólica como diastólica, resultado de uma diminuição da resistência vascular sistémica, principalmente secundária à vasodilatação. A relaxina, que é libertada pelos ovários sob a influência da gonadotrofina coriónica humana, regula positivamente a óxido nítrico sintase (NOS), a enzima que gera um potente vasodilatador o NO, através do receptor endotelial, endotelina B. Na PE a disfunção do endotélio vascular origina uma diminuição na produção de factores vasodilatadores (NO, prostaciclinas) e um aumento na produção dos vasoconstritores (endotelina, tromboxano), o que estimula o vasoespamo, originando aumento da resistência vascular periférica e o consequente aumento da pressão arterial (23). Outras das manifestações clínicas originadas pelo vasoespasmo incluem: hemoconcentração, hematócrito elevado, leucocitose, deficiente perfusão orgânica e edema generalizado (6).
Mais recentemente, a atenção centrou-se no sistema renina-angiotensina (RAS) com o intuito de se proporcionar um melhor entendimento fisiopatológico da hipertensão na PE. Numa gravidez normal, todos os componentes do RAS estão regulados positivamente, mas a resistência aos efeitos pressores da angiotensina II permite uma tensão arterial normal baixa (23).
Nas mulheres com PE verificou-se um aumento da sensibilidade à angiotensina II que pode ser explicado por aumento da sensibilidade do recetor da angiotensina II ou diminuição dos níveis em circulação de angiotensina I (potente contrarregulador da angiotensina II) (24). Novos estudos identificaram autoanticorpos agonistas do recetor da angiotensina I capazes de estimular a sua heterodimerização com o receptor da bradicinina, o que pode desempenhar um papel importante no aumento da sensibilidade vascular à angiotensina II. Para além disso, podem induzir a produção de radicais livres de oxigénio, que bloqueiam a invasão trofoblástica e que estão na origem de várias características clínicas de pré-eclâmpsia (23).
13
Risco cardiovascular
A PE pode causar dano metabólico e vascular permanente, elevando o risco de doença cardiovascular (DCV) subsequente. Esse risco parece ser, ainda, maior em mulheres com história de PE recorrente e severa (26).
Uma série de estudos epidemiológicos retrospectivos demonstraram elevado risco para muitos tipos de DCV (hipertensão crónica, doença coronária aguda, tromboembolismo venoso) em mulheres com história de PE. Estas patologias possuem mecanismos fisiopatológicos semelhantes à PE, como disfunção endotelial, alteração metabólica e stress oxidativo e compartilham alguns fatores de risco como obesidade, doença renal e diabetes. Por conseguinte, a PE constitui um factor de risco para DCV, bem como a DCV em relação à PE (27).
I.3.2.2 Sistema Renal
A hemodinâmica renal aumenta, significativamente, em condições normais de gestação, contudo, nas grávidas com PE, observa-se uma diminuição da perfusão renal e da taxa de filtração glomerular de aproximadamente 25%, uma vez que, o endotélio glomerular é muito sensível à vasoconstrição (24).
A lesão renal na PE está intimamente associada à existência de podocitopatia. O VEGF é muito importante para a manutenção da função podocitária e glomerular como um todo. Na PE, a lesão endotelial dos podócitos (células epiteliais glomerulares), associada à diminuição dos níveis de VEGF, originam o desenvolvimento da entoteliose glomerular que, clinicamente, se manifesta pela constante proteinúria (26).
Os rins são os principais órgãos afectados pela PE, podendo o nível de proteinúria estar relacionado com o prognóstico e o risco de desenvolver complicações graves como o Sindrome de HELLP (27).
I.3.2.3 Hemostase
Na PE ocorrem alterações na hemostase, sendo a trombocitopenia a complicação mais frequente. Há uma ativação das plaquetas, devido ao tromboxano produzido em resposta à lesão endotelial vascular, aumento do seu tamanho e diminuição da sua produção (17). A trombocitopenia está relacionada com a retenção plaquetária na parede vascular lesada e pode associar-se à destruição de eritrócitos que passam nas arteríolas e capilares, originando
14 esquisocitose, reticulocitose e hemoglobinúria. Por outro lado, o habitual estado de hipercoagulabilidade da grávida acentua-se com diminuição da antitrombina III, Proteina C e S e aumento da fibronectina. O prolongamento do tempo de trombina e o aumento dos produtos de degradação do fibrinogénio podem levar a complicações mais graves, como a Síndrome de HELLP(6,17,23,24).
I.3.2.4 Sistema Hepático
A lesão hepática é provocada pelo vasoespasmo portal originando elevações séricas das transaminases (AST e ALT) e da lactato desidrogenase (LDH). Nos casos mais graves, como a Síndrome de HELLP, há necrose hepatocelular provocada pela acumulação de depósitos de fibrina, originando valores muito elevados de transaminases (25).
I.3.2.5 Eclâmpsia
A eclâmpsia é caracterizada pela ocorrência de convulsões generalizadas em mulheres com PE, considerando que as mesmas não são atribuíveis a outras causas (por ex.: epilepsia). O mecanismo através do qual surgem as convulsões ainda não está esclarecido, mas as teorias propostas incluem vaso-espasmo e edema cerebral, bem como a possibilidade de que hipertensão grave possa perturbar a barreira hematoencefálica (1,23).
As cefaleias, visão turva e perda temporária da visão são alguns dos sintomas da eclâmpsia e devem ser vigiados e monitorizados (6).
I.3.2.6 Síndrome de HELLP
A PE não tratada e alguns casos de PE grave podem progredir para uma complicação com risco de morte - a Síndrome de HELLP. Esta síndrome está associada a lesão endotelial extensa e caracteriza-se por hemólise (H), alterações das enzimas hepáticas (EL) e trombocitopenia (LP).
Os principais sintomas são: hipertensão arterial elevada e persistente, náuseas, vómitos cefaleias e dores nos quadrantes superiores. Em termos analíticos caracteriza-se por: trombocitopenia grave (<50.000/ul), transaminases e LDH muito elevadas, aumento da bilirrubina total, diminuição da haptoglobina e presença de esquisocitos no esfregaço de sangue periférico. As suas complicações são muito graves e incluem: coagulopatia intravascular disseminada, insuficiência renal aguda, hematoma hepático, edema pulmonar, morte fetal e materna (6,21).
15
I.4 Diagnóstico e Classificação
O diagnóstico de PE deve ser feito com base num conjunto de características clínicas e laboratoriais. Os principais critérios incluem:
pressão arterial ≥ 140/90 mmHg medida em duas ou mais ocasiões, com um intervalo de 4-6 horas e um máximo de 7 dias, a partir da 20ª semana de gravidez, em grávidas previamente normotensas;
proteinúria definida pela excreção de proteínas na urina ≥ 300mg/24h ou um ratio proteínúria/creatinúria ≥ 30mg/dL. Nos casos em não seja possível obter uma amostra de urina de 24 horas, deve considerar-se como significativa uma proteinúria ≥30mg/dL (resultado 1+ em tira de urina) obtida em 2 amostras de urina colhidas com intervalo 4-6 horas.
(4,22,28,29)
Embora a proteinúria seja usada como principal critério de diagnóstico diferencial entre a PE e outras síndromes hipertensivos na gravidez, de acordo com as guidelines mais recentes do Colégio Americano de Obstetrícia (ACOG) e da Sociedade Internacional para Estudo da Hipertensão Gestacional, o diagnóstico de PE pode não requer, necessariamente, a deteção de níveis elevados de proteinúria. As complicações órgão-alvo podem ocorrer sem proteinúria significativa e a sua quantidade não permite prever com certeza a evolução da doença. É recomendado que os casos de pressão arterial elevada persistente, sem proteinúria mas associados a complicações como trombocitopenia, problemas renais e hepáticos, edema pulmonar ou a sinais de problemas cerebrais (distúrbios visuais e/ou convulsões), sejam diagnosticados como PE (28,29).
16 A PE é, normalmente, classificada como ligeira ou grave (Tabela 2) (6,30).
Tabela 2- Classificação da pré-eclâmpsia
Pré-Eclâmpsia Ligeira
Pré-Eclâmpsia Grave
Pressão Arterial
Sistólica
<160 mmHg
≥160 mmHg
Pressão Arterial
Diastólica
<110mmHg
≥110 mmHg
Proteinúria
≥ 300mg/24h
>5000mg/24h
Contagem de
plaquetas
Normal ou ligeiramente diminuída
(>100.000/ul)
<100.000/ul
<50.000/ul
(Síndrome de HELLP)Creatinémia
Normal ou ligeiramente aumentado
(<1,1mg/dL)
>1,2 mg/dL
Ácido úrico
Normal ou ligeiramente elevado
>6mg/dL
Transaminases
Normal ou ligeiramente aumentado
Aumento do dobro dos
valores normais
LDH
Normal ou ligeiramente aumentado
(<600 U/L)
>600U/L
Dores abdominais
persistentes
Não
Sim
Cefaleias e
Tonturas
Não
Sim
Convulsões
Não
Sim
Oligúria
Não
<500mL/24horas
Edema Pulmonar
Não
Sim
Restrição no
Crescimento fetal
Não
Sim
Oligohidramnios
Não
Sim
Segundo a OMS, a PE deve ser sempre classificada como grave quando alguma das seguintes condições está presente: hipertensão grave (pressão arterial ≥ 160/110 mmHg), proteinúria intensa e persistente ou disfunção orgânica substancial materna. Em algumas partes do mundo, o início precoce da PE e a morbidade fetal são, também, usados como
17 critérios independentes para classificar a PE como grave. As mortes maternas podem ocorrer nos casos graves, mas a progressão de sintomas leves para graves pode ser rápida, inesperada e, ocasionalmente, fulminante (1).
A PE também pode ser diferenciada entre precoce, quando ocorre antes das 32 a 34 semanas de gravidez, e tardia (mais frequente) quando ocorre após as 34 semanas de gestação. No primeiro caso há maior risco de morbilidade e mortalidade perinatal e complicações maternas (1).
Como já referido anteriormente, pensa-se que a PE precoce resulte da invasão trofoblástica anormal das artérias espirais causando isquemia placentária e stress oxidativo. Os exames histológicos de placentas de grávidas com PE precoce demonstraram alterações trombóticas nas vilosidades placentárias, suportando esta teoria. Por outro lado, para a PE tardia pensa-se que esteja mais relacionada com a predisposição à disfunção endotelial e prepensa-sença de fatores de risco semelhantes aos das DCV, como hipertensão, obesidade, diabetes e dislipidémia (1,31).
I.5 Diagnóstico Precoce
– Avaliação de risco
A PE é definida pelo aparecimento de hipertensão arterial e proteinúria a partir da 20ª semana de gestação. No entanto, o uso dessas medidas para prever a PE antes do seu início clínico não é confiável e as evidências sugerem que a patologia e as suas complicações mais graves como a Eclâmpsia e o Síndrome de HELLP se podem desenvolver sem hipertensão ou proteinúria evidente (32).
Devido à sua imprevisibilidade, variabilidade nas manifestações clínicas e potenciais consequências graves tanto para a mãe como para o feto, as mulheres grávidas com suspeita de PE requerem um acompanhamento intensivo ou hospitalização. Assim sendo, há uma necessidade na prática clínica para o uso de marcadores preditivos mais confiáveis para que se possa melhorar a deteção precoce da patologia e implementar medidas profiláticas, com o objetivo de prevenir a progressão da doença e melhorar os resultados maternos e fetais (33). O biomarcador ideal para a predição da PE exige a coexistência de várias características: não invasivo, alta sensibilidade e especificidade, reprodutibilidade e alto valor preditivo positivo (VPP). A capacidade de predição da PE com razoável margem temporal relativamente ao início dos sintomas, conheceu alguns avanços na última década, tendo sido testados vários marcadores clínicos, biofísicos e bioquímicos bem como a sua combinação (22).
18
I.5.1 Fatores de Risco Materno
A abordagem mais tradicional no rastreio da PE é identificar os fatores de risco materno e a história clínica. O National Institute for Health and Clinical Excellence (NICE) emitiu recomendações para que as mulheres sejam consideradas com alto risco de desenvolver PE se apresentarem 1 fator de alto risco ou 2 de risco moderado. São considerados fatores de alto risco doença hipertensiva em gravidez anterior, doença renal ou vascular crónica, doença autoimune e hipertensão crónica. Os fatores de risco moderado englobam idade (≥ 40 anos), nuliparidade ou intervalo de gravidez > 10 anos, índice de massa corporal ≥ 30 Kg / m2, história prévia ou familiar de PE e gravidezes múltiplas. A implementação de cuidados pré-natais (por ex. início de terapêutica preventiva) e frequência na monitorização da grávida varia consoante o risco estipulado. Também o ACOG recomenda a avaliação detalhada da história clínica materna para estimar o risco de PE (34,35).
Apesar das recomendações, vários estudos indicam que a precisão deste tipo de rastreio é baixa permitindo apenas taxas de deteção estimadas entre 29-37%. Esta é, apenas, considerada uma avaliação de risco à priori que para ser útil deve contemplar a combinação de todos os fatores de risco materno num algoritmo de análise multivariada e que deve ser associada a outros marcadores biofísicos, ecográficos e bioquímicos para aprimorar as taxas de deteção dos casos de PE (33,36).
I.5.2 Marcadores Ecográficos
Um dos marcadores mais promissores na predição da PE é o estudo Doppler das artérias uterinas (33).
Numa gravidez normal, a velocidade do fluxo sanguíneo nas artérias uterinas diminui com a idade gestacional; estudos histopatológicos sugerem que esta situação é devida à invasão trofoblástica das artérias espirais e a sua conversão em vasos de baixa resistência, originando um fluxo sanguíneo útero-placentário inadequado. Vários estudos de Doppler demonstraram uma associação entre o aumento do fluxo nas artérias uterinas e o posterior desenvolvimento da PE, restrição de crescimento fetal e morte perinatal (37,38).
Nos últimos anos, múltiplos estudos realizados, principalmente, no 2º trimestre, envolvendo mais, concretamente, a quantificação de índices de resistência ao fluxo (como o índice de pulsatilidade (PI) e índice de resistência) e a deteção de notching no espectro obtido por Doppler pulsado, sugeriram que esta poderia ser uma forma eficaz de prever o risco de PE (22,31).
19 Uma metanálise de 74 estudos de PE (total de 79.547 gestações) mostrou que o estudo Doppler das artérias uterinas tem um melhor desempenho no segundo trimestre do que no primeiro e é útil para identificar a PE grave de inicio precoce. Entre as mulheres de baixo risco, um aumento do PI da artéria uterina (uA-PI) no segundo trimestre tem uma sensibilidade de 78% e especificidade de 95% para detetar PE grave. Concluiu-se que o aumento do uA-PI, isolado ou com a deteção de notch diastólico precoce, é o melhor índice Doppler para predição de PE em pacientes de baixo e de alto risco (39).
Mais recentemente, têm sido realizados estudos doplerfluxométricos, no 1º trimestre da gravidez, com o intuito de detetar mais precocemente as pacientes com risco elevado de desenvolver PE. As evidências sugerem que este exame também pode oferecer, no primeiro trimestre, uma boa predição, especialmente, na PE grave de início precoce (33).
Uma metanálise de 11 estudos (43.122 gravidezes), em que foi avaliado o papel do estudo Doppler das artérias uterinas no primeiro trimestre na predição da PE, revelou uma sensibilidade e especificidade global de 26% e 91% respetivamente. Constatou-se, também, que o uA-PI no primeiro trimestre se encontra significativamente aumentado em gestações entre 11-13 semanas de mulheres que posteriormente desenvolveram PE precoce e que é afetado pela idade gestacional, peso materno, raça e história prévia de diabetes mellitus, devendo ser expresso como um múltiplo da mediana (MoM) após o ajuste para estes fatores(31,40).
Apesar da baixa sensibilidade e de apresentar um valor preditivo positivo baixo, o que limita a sua utilidade como teste de rastreio isolado, um valor normal de uA-PI no final do 1º trimestre é altamente preditivo de uma placentação normal e indicador de um risco baixo de desenvolver PE (40).
Vários estudos têm proposto a utilização de algoritmos, que combinam o uA-PI no primeiro trimestre com a história materna e outros marcadores bioquímicos, tendo-se conseguido melhorar a taxa de deteção de PE precoce para mais de 90%. A ideal combinação destes marcadores e a sua validação em vários tipos de pacientes será o foco de futuras pesquisas (22).
20
I.5.3 Marcadores Clínicos
A medição da pressão arterial é um exame de triagem usado na rotina para detetar ou prever patologias hipertensivas. Embora a hipertensão arterial seja um sinal secundário de PE, é um sinal importante, pois é um indicador precoce da doença (33).
Há evidências substanciais que demonstram um aumento da pressão arterial em mulheres que desenvolveram PE no 1º e 2º trimestre de gravidez. A revisão sistemática de um conjunto de estudos realizados, que incluem mais de 60.000 mulheres com 3.300 casos de PE, concluiu que a média da pressão arterial (MPA) é significativamente melhor, do que a pressão sistólica e diastólica isoladas, na predição da PE. A MPA (calculada dividindo por 3 a soma da pressão sistólica com 2 vezes a pressão diastólica) pode ser útil na identificação de mulheres com elevado risco de desenvolver PE; contudo, a falta de estudos padronizados (a avaliação precisa da pressão arterial é dificultada pela considerável variabilidade intra e interindividual e pelos métodos utilizados) ainda não permitiu demonstrar o seu benefício evidente na predição da PE (33,41).
Por conseguinte, tem sido proposto que a MPA seja obtida com dispositivos automatizados validados, com as mulheres em posição sentada com as costas apoiadas e pernas descruzadas, devendo ser considerada a média de 4 medições (duas em cada braço) feitas com o braço ao nível do coração (33).
Constatou-se que a MPA no 1º trimestre, tal como a uA-PI, é influenciada por vários fatores, nomeadamente, peso materno, altura, idade, raça, tabagismo, história familiar prévia de PE e hipertensão crónica, devendo ser expressa como MoM após o ajuste para esses fatores (40). Há uma associação significativa entre a uA-PI e a MPA em gravidezes normais e com PE, portanto, quando se combinam os dois marcadores no cálculo do risco específico da paciente para a PE, a correlação dos fatores deve ser tida em consideração para evitar uma sobrestimação de cada marcador, a fim de fornecer uma avaliação de risco mais precisa (42). Vários autores defendem a incorporação da MPA em modelos combinados e algoritmos de predição de risco da PE para aperfeiçoar a sua precisão e ajudar a melhorar as decisões clínicas (22).
21
I.5.4 Marcadores Bioquímicos
Várias linhas de investigação realizadas nos últimos anos levantaram a possibilidade de se conseguir uma razoável predição do risco de PE pela avaliação dos valores séricos de determinadas moléculas envolvidas na patogénese desta doença (22).
Têm sido investigados um grande número de marcadores bioquímicos podendo classificar-se em diferentes categorias fisiopatológicas (Tabela 3). Com a utilização de técnicas moleculares e de proteómica há muitos mais em desenvolvimento (43).
Atualmente, existe uma infinidade de estudos destinados a identificar um marcador bioquímico ideal, no entanto, diferenças nas populações estudadas, nas metodologias e na interpretação dos resultados, tornam difícil realizar uma análise sistemática de todos os marcadores. Serão abordados os mais relevantes, com destaque para a proteína plasmática A associada à gravidez (PAPP-A) e os fatores angiogénicos, que são os mais amplamente estudados e que têm demonstrado resultados mais promissores na deteção precoce da PE (33).
Tabela 3- Marcadores bioquímicos descritos como preditores de pré-eclâmpsia Relacionados com a disfunção da perfusão placentária e resistência vascular Renina
Proteína de ligação da Angiotensina II placentária Resposta do cálcio plaquetário à Arginina-vasopresina Relacionados com a disfunção renal
Microalbuminúria Ácido úrico
Excreção urinária de cálcio
Relacionados com a disfunção endócrina fetoplacentária Gonadotrofina coriónica humana
Alfa fetoproteína
Proteína Plasmática Associada à gravidez (PAPP-A) Inibina A Activina A ADAM 12 Proteína placentária 13 Adiponectina Resistência à insulina
22 Relacionados com a disfunção endotelial e stress oxidativo
Anticorpos anti-fosfolipídicos Anti-trombina III
Inibidor do activador do plasminogénio Prostaciclinas
Tromboxano Citocinas
Fator de crescimento placentário (PLGF)
Fator de crescimento endotelial vascular (VEGF) Forma solúvel da tirosina cinase 1 (sFLT1) Endoglina solúvel
I.5.4.1- Proteína plasmática A associada à gravidez (PAPP-A)
A PAPP-A é uma glicoproteína de alto peso molecular pertencente à família das metaloproteinas que regula a invasão trofoblástica e melhora a função mitogénica dos fatores de crescimento semelhantes à insulina (IGF). É conhecido o papel importante dos IGF no desenvolvimento placentar, o que faz com que valores séricos baixos de PAPP-A possam estar relacionados com uma maior incidência de PE (33).
A PAPP-A é produzida pelo trofoblasto e secretada no soro materno a partir do vigésimo dia de gravidez. Em gestações normais a sua concentração aumenta com a idade gestacional até ao momento do parto, a partir do qual descem rapidamente (17).
Apesar de ser usada no despiste de aneuploidias, vários estudos têm demonstrado associação entre os níveis baixos de PAPP-A no soro materno de mulheres grávidas no 1º trimestre e o aumento do risco do desenvolvimento posterior de PE. A sua utilização como biomarcador isolado para rastreio de PE apenas permite taxas de deteção entre 8- 23% porém, a combinação com outros marcadores aumenta significativamente as mesmas (33,43).
I.5.4.2- Marcadores angiogénicos
Vários estudos têm enfatizado o papel do desequilíbrio entre os fatores próangiogénicos e antiangiogénicos, produzidos pela placenta, na patogénese de PE e a sua possível relevância no diagnóstico e prognóstico da doença (45). Entre os factores próangiogénicos existem o VEGF e o PLGF. Relativamente aos factores antiangiogénicos existem o sFlt-1 e a ENGs (46).
23 Em gravidezes normais, os níveis séricos de PLGF aumentam durante o 1º e 2º trimestre diminuindo a partir aproximadamente da 30-32ª semana de gestação. No 3º trimestre verifica-se um aumento do sFlt-1 e ENGs (45). Vários estudos têm demonstrado uma diminuição do PLGF e um aumento precoce do sFlt-1 e ENGs em gestantes que evoluem para PE (45). As alterações séricas dos marcadores angiogénicos precedem o aparecimento dos sintomas clínicos da PE por várias semanas ou meses, o que os torna excelentes potenciais marcadores de rastreiro precoce (46).
A revisão sistemática de 21 artigos sobre a utilização de marcadores angiogénicos na predição da PE revelou que:
as alterações séricas de PLGF e sFlt-1 são mais pronunciadas na PE precoce e estão relacionadas com a severidade da patologia. Também o aumento dos níveis de ENGs parece estar correlacionado com PE grave ou eclâmpsia;
o PLGF apresenta uma redução mais marcada no 1º trimestre tendo sido incluído em vários algoritmos de previsão de PE. Em contraste, o sFlt-1 e a ENGs aumentam mais tarde, sendo considerados mais úteis na previsão da PE no 2º e 3º trimestres;
a adição dos marcadores angiogénicos a modelos de predição de risco da PE pode melhorar significativamente o seu valor preditivo;
o uso do ratio sFlt-1 / PLGF é melhor preditor do que o uso isolado de qualquer um destes parâmetros e tem melhor aplicabilidade clínica a partir do 2º trimestre;
(47)
Estudos mais recentes têm-se centralizado no uso do ratio sFlt-1/PLGF para diagnóstico e predição de PE (48) .Uma metanálise de 20 estudos, revelou que a precisão do ratio sFlt-1 / PLGF para o rastreio de todos os tipos de PE foi moderada e alta para a PE precoce (49). Um outro estudo, em que foram realizados doseamentos séricos de sFlt-1 e PLGF em 388 gestantes com uma gravidez normal, 164 com PE, 36 com hipertensão gestacional e 42 com hipertensão crónica, revelou que as gestantes com PE apresentavam um aumento significativo do ratio sFlt-1 / PLGF em comparação com as restantes no período de gestação <34 semanas e> 34 semanas (P <.001). Para além disso, o momento do parto foi mais precoce em mulheres com PE no quartil mais alto do ratio sFlt-1/ PLGF (P <.001). Conclui-se, assim, que este cálculo é uma ferramenta que pode ser usada para discriminar a PE de outros distúrbios hipertensivos relacionados com a gravidez e na identificação de mulheres com risco de parto iminente (50). Estas conclusões são concordantes com as de outros estudos realizados (48).
24 Peritos internacionais, na investigação dos marcadores angiogénicos, têm-se esforçado para desenvolver um consenso sobre a utilização clínica do ratio sFlt-1 / PLGF. Muito recentemente, com base em 2 grandes estudos, foram propostos cut-offs do ratio sFlt-1 / PLGF para a predição e auxilio no diagnóstico da PE, utilizando a tecnologia Elecsys® (tipo de imunoensaio mais utlizado em investigação sobre marcadores angiogénicos) da Roche (48,51,52).
De acordo com os valores de cut-off propostos devem ser considerados 3 subgrupos de gestantes:
Ratio sFlt-1 / PLGF <38: é bastante provável, com um nível de confiança de 99,3% que as gestantes não desenvolvam PE durante, pelo menos, uma semana;
Ratio sFlt-1 / PLGF> 85 (PE precoce) ou> 110 (PE tardia): existe uma forte propensão de desenvolver PE ou outra forma de insuficiência placentária;
Ratio sFlt-1 / PLGF 38-85 (PE precoce) ou 38-110 (PE tardia): estas mulheres não têm um diagnóstico definitivo de PE, mas têm uma boa possibilidade (VPP de 36,7%) de desenvolver PE no prazo de quatro semanas
(51,52)
Verificou-se também que a monitorização da medição do ratio sFlt-1 / PLGF pode ajudar na gestão clínica, prognóstico e estratificação do risco de gestantes com sintomas e sinas de PE ou assintomáticas com elevado risco de desenvolver PE (48). Um encaminhamento atempado para um centro de cuidados perinatais é capaz, por si só, de reduzir a morbilidade e mortalidade perinatal em 20% pelo que se considera que o ratio sFlt-1 / PLGF pode ajudar nesse sentido (52).
Apesar das potencialidades considera-se que são necessários mais estudos padronizados para comprovar a utilidade clínica deste marcador, pelo que qualquer decisão clínica sobre a PE deve ser sempre tomada com base no historial, sinais e sintomas clínicos da gestante (48).
25
I.5.4.3- Proteína placentária 13 (PP13)
A PP13 é um membro da família de proteínas galectina e é produzida pelas células trofoblásticas da placenta. Pensa-se que a sua função esteja relacionada com a implantação placentária, remodelação da vasculatura materna e que representa um papel importante na migração trofoblástica (53).
Em gestações normais, os valores séricos de PP13 aumentam gradualmente. Vários estudos demonstraram, no entanto, diminuição dos seus níveis no 1º trimestre em gravidezes que desenvolveram PE. Em outros estudos, observou-se aumento dos níveis séricos no 2º e 3º trimestre em mulheres com PE e restrição de crescimento intrauterino. Pensa-se que o incremento das micropartículas necróticas, durante a progressão da PE, seja a principal causa da elevação da PP13 que é, por sua vez, proporcional à severidade dos sinais da patologia (45).
Na predição da PE é mais consensual o uso da PP13 no 1º trimestre, por apresentar maior capacidade preditiva, e aconselha-se a sua combinação com outros marcadores biofísicos e bioquímicos para aumentar as taxas de deteção (42).
I.5.4.4- P-selectina
A P-selectina é um membro da família das moléculas de adesão da superfície celular. É expressa nas plaquetas e células endoteliais activadas e desempenha um papel crucial nas reações inflamatórias. Após a ativação plaquetar é rapidamente libertada no soro (45). É sabido que a PE está associada a uma forte activação plaquetar. Foram detetadas em mulheres com PE, micropartículas de P-selectina com actividade pró-coagulante, libertadas de plaquetas activadas. Além disso, a P-selectina solúvel tem sido repetidamente, embora não sempre, observada em quantidades mais elevadas no soro de pacientes com PE (42) . Foi demonstrado existirem alterações séricas de P-selectina solúvel antes das 20 semanas de gestação, o que pode refletir os distúrbios iniciais, mas ainda assintomáticos, do sistema vascular materno (45).
Apesar do potencial, vários estudos mostraram resultados inconsistentes, pelo que se recomenda a realização de estudos mais aprofundados antes da adoção da P-selectina como marcador preditivo para a PE (42).
26
I.5.4.5- Inibina A e Activina A
A inibina e activina-A são glicoproteínas e membros da família TGF-β e são amplamente produzidas pela placenta durante a gravidez. A Inibina-A tem um importante papel endócrino no feedback negativo de gonadotrofinas e a activina-A está envolvida em várias actividades biológicas (30).
As concentrações de inibina e activina-A são maiores em mulheres que desenvolveram PE, o que pode refletir um mecanismo compensatório placentário para promover a invasão trofoblástica nos casos em que este processo é prejudicado. A Inibina A como marcador preditor de PE tem mostrado resultados inconsistentes. Embora, o aumento dos níveis séricos da inibina A esteja significativamente associado ao desenvolvimento subsequente de PE, têm pouca sensibilidade na predição da patologia (42).
São necessários mais estudos para que se possa confirmar a verdadeira utilidade da inibina e activina-A na predição da PE. Tal como acontece com outros marcadores, a sua combinação permite aumentar consideravelmente as taxas de deteção da PE (54).
I.5.4.6- Cistatina C
A cistatina C é um marcador sensível para avaliação da função renal e estimativa da taxa de filtração glomerular. Foi demonstrado que as concentrações de cistatina C, no 1º trimestre da gravidez, são significativamente mais elevadas em mulheres que posteriormente desenvolvem PE, sugerindo que este aumento pode ser causado pela diminuição da função renal e/ou aumento da síntese placentária (42).
Acredita-se que a cistatina C possa ser clinicamente útil na predição da PE, no entanto, os seus valores aumentam no 3º trimestre em gestações normais pelo que se aconselha o seu uso em conjunto com outros marcadores preditores de PE (45)
.
I.5.4.7- Hemoglobina fetal
A hemoglobina fetal (HbF) foi, recentemente, sugerida como um novo biomarcador preditivo para a PE e também como possível factor causador da patologia (55).
Foi observado o aumento dos níveis de mRNA de HbF e a acumulação de HbF extracelular no lúmen de placentas de mulheres com PE. A hemoglobina é uma molécula altamente reativa capaz de causar disfunção endotelial e de inactivar o óxido nítrico originando vasoconstrição. Os seus metabolitos podem gerar espécies reactivas de oxigénio (ROS) que contribuem
27 também para o desenvolvimento da PE. A α-1 microglobulina antioxidante (A1M) está envolvida na defesa fisiológica e o seu aumento é proporcional à HbF (45).
Estudos, avaliando as concentrações no soro materno da HbF e da A1M como marcadores preditivos e de diagnóstico para PE, têm mostrado resultados promissores. Em um estudo de coorte de 96 pacientes, as concentrações séricas de HbF e A1M encontravam-se significativamente aumentadas em 60 mulheres que posteriormente desenvolveram PE. A combinação dos 2 marcadores apresentou taxas de deteção de 69 e 90% para taxas de falsos positivos de 5 e 23% respetivamente (56). Apesar da potencialidade, estes marcadores precisam ser validados com estudos mais extensos e padronizados (45)
.
I.5.4.8- DNA fetal
Vários estudos têm relatado um aumento significativo das concentrações de DNA fetal livre no soro de mulheres com PE. Este aumento é provocado pela isquémia placentária que origina a libertação, para a circulação materna, de fragmentos troblobásticos apoptóticos que contem DNA fetal e também devido à redução da sua depuração nos casos com PE (57). Numa recente revisão sistemática foi investigada a utilidade da quantificação do DNA fetal na predição da PE. A revisão inclui um total de 440 casos de PE e 2576 controlos. Os autores relataram que em 11 dos 13 estudos foram encontradas concentrações significativamente maiores de DNA fetal em mulheres que desenvolveram PE. Em 4 estudos onde foram avaliados casos de PE grave ou início precoce, verificaram-se concentrações significativamente elevadas de DNA fetal antes do início da doença (58).
Apesar dos resultados promissores, os investigadores alertam para a heterogeneidade dos estudos publicados não sendo ainda possível retirar conclusões exatas sobre o uso deste biomarcador. Para além disso, a maioria dos estudos utiliza um gene marcador situado no cromossoma Y para quantificar o DNA fetal o que limita a sua aplicabilidade, sendo necessárias mais investigações para identificar marcadores que possam ser aplicados a todas as gravidezes (58,59).
28
I.5.5 Screening Combinado
Nos últimos anos foram propostos vários tipos de marcadores para a deteção precoce da PE, contudo, até ao momento nenhum deles apresentou, isoladamente, VPP suficientemente elevado para poder fornecer um rastreio preciso (22,60,61).
Vários estudos realizados concluíram que a incorporação de diversos marcadores (fatores de risco maternos e história clínica, estudo Doppler das artérias uterinas, MAP e parâmetros bioquímicos) em algoritmos e modelos combinados pode melhorar substancialmente a predição da PE, o que tem originado um interesse crescente, nos últimos anos, no desenvolvimento de modelos multiparamétricos (33,62).
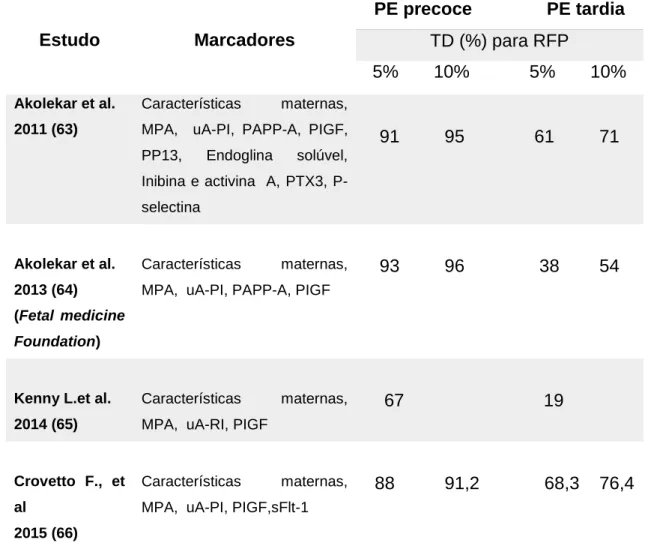
Foram desenvolvidos vários estudos testando diferentes algoritmos e modelos que relataram a superioridade da combinação dos biomarcadores na predição da PE. Os modelos que mostraram as melhores taxas de deteção estão resumidos na tabela 4.
Tabela 4- Algoritmos para predição de pré-eclâmpsia precoce e tardia
Estudo
Marcadores
PE precoce PE tardia
TD (%) para RFP
5% 10% 5% 10%
Akolekar et al. 2011 (63) Características maternas, MPA, uA-PI, PAPP-A, PIGF, PP13, Endoglina solúvel, Inibina e activina A, PTX3, P-selectina91 95 61 71
Akolekar et al. 2013 (64) (Fetal medicine Foundation) Características maternas, MPA, uA-PI, PAPP-A, PIGF93 96 38 54
Kenny L.et al. 2014 (65)
Características maternas, MPA, uA-RI, PIGF
67 19
Crovetto F., et al
2015 (66)
Características maternas, MPA, uA-PI, PIGF,sFlt-1
88 91,2 68,3 76,4
29 O modelo multiparamétrico que apresentou o melhor desempenho foi o proposto pela Fetal
Medicine Foundation, que combina os factores maternos e história clínica com os marcadores
biofísicos (MPA, uA-PI) e bioquímicos (PAPP-A e o PIGF). Os parâmetros devem ser medidos entre as 11-13 semanas de gestação e os marcadores biofísicos e bioquímicos ajustados às características maternas, da gravidez e outras variáveis, sendo expressos em MoM. O estudo foi realizado em 58.884 gestantes, em que 1.426 desenvolveram PE, e o modelo apresentou uma taxa de deteção de 96% para os casos de PE precoce e 54% para a PE tardia para uma taxa de falsos positivos de 10%. Foram também testadas várias combinações de diferentes parâmetros (tabela 5) (64). Este modelo foi recentemente validado na população australiana (𝑛 = 3.066), em que foram detetados 91,7% dos casos de PE precoce e em Espanha (𝑛 = 5.759), com uma taxa de deteção de 80,8% para uma taxa de falsos positivos de 10% (54). A grande vantagem deste modelo face a outros é de que, à semelhança do rastreio das aneuploidias, também fornece cut-offs de nível de risco (tabela 5), o que permite ao clínico identificar gestantes de alto risco que podem beneficiar de terapêuticas profiláticas logo a partir do primeiro trimestre. Contudo, é preciso não esquecer que um resultado de baixo risco não elimina por completo a possibilidade de ter a patologia, assim como um resultado de elevado risco não implica necessariamente que a vá desenvolver. É importante que a grávida mantenha as visitas regulares ao obstetra, que sabendo do seu risco, fará um acompanhamento apropriado da gestação (33,54).
Tabela 5 – Ratios de deteção e risco estimado para a pré-eclâmpsia
Teste de rastreio RFP
%
PE <34 semanas
Risco % DeteçãoPE <37 semanas
Risco % DeteçãoPE <42 semanas
Risco % Deteção Características maternas 5 1:93 36 1:35 33 1:9 29 10 1:143 51 1:51 43 1:12 40 Index de Pulsabitilidade da artéria uterina(uA-PI) 5 1:88 59 1:31 40 1:9 31 10 1:164 75 1.52 55 1:12 42 Pressão arterial média (MPA) 5 1:88 58 1:31 44 1:8 37 10 1:159 73 1:52 59 1:12 54 Proteína plasmática A associada à gravidez (PAPP-A) 5 1:88 44 1:33 37 1:9 32 10 1:151 55 1:52 48 1:12 42 Fator de crescimento placentar (PIGF) 5 1:95 59 1:33 41 1:9 29 10 1:170 72 1:55 54 1:12 40
30 MPA e uA-PI 5 1:96 80 1:31 55 1:7 35 10 1.197 90 1:57 72 1:12 57 PAPP-A e PIGF 5 1:101 60 1:34 43 1:9 30 10 1:181 74 1:56 56 1:12 41 uA-PI,MPA e PAPP-A 5 1:105 82 1:26 53 1:7 36 10 1:216 93 1:65 75 1:12 60 uA-PI,MPA e PLGF 5 1:126 87 1:36 61 1:8 38 10 1:261 96 1:67 77 1:12 53 uA-PI,MPA,PAAP-A e PLGF 5 1:128 93 1:36 61 1.8 38 10 1:269 96 1:67 77 1:12 54 PE- Pré-eclâmpsia ; RFP– Ratio de falsos positivos
Embora o rastreio combinado no 1º trimestre apresente resultados mais convincentes na deteção da PE precoce, o screening para a PE tardia, que corresponde a 2/3 de todos os casos de PE, continua a ser um desafio (61).
Um estudo desenvolvido pelos investigadores do Fetal Medicine Foundation, em que foi avaliado o potencial da combinação dos fatores maternos, MPA, uA-PI e os marcadores angiogénicos PIGF e sFlt-1 no despiste da PE entre a 30-33ª semana, permitiu identificar mais de 95% dos casos que desenvolveram PE e que requereram um parto até 4 semanas com uma taxa de falsos positivos de 5% e um valor preditivo positivo de 18%. Contudo, fora deste intervalo o desempenho do modelo foi fraco devendo ser feita uma avaliação mais aprofundada para o período entre 36-38 semanas (67).
Recentemente, num estudo realizado em Espanha, com 9.462 gestantes, foi desenvolvido um modelo de regressão preditivo que incluiu os factores maternos e historia clínica, MAP, o uA-PI, e os dois factores angiogénicos PlGFe sFlt-1. Os resultados para a predição da PE precoce (taxas de detecção de 87,7% e 91,2% para taxas de falsos positivos de 5% e 10%) foram semelhantes aos dos estudos anteriores, no entanto, para a PE tardia (n = 246) verificou-se uma melhoria, com taxas de detecção de 68,3% e 76,4% para taxas de falsos positivos de 5% e 10%, respectivamente, o que indicia que a inclusão do factor angiogénico sFlt-1 nos modelos multivariados pode melhorar a predição da PE tardia (66).
É sabido que a ocorrência da PE tardia depende bastante das características maternas (raça, idade e peso) e da presença de fatores de risco, tais como, história familiar de PE, hipertensão crónica e doenças autoimunes, o que pode tornar a sua predição mais complexa. A identificação precoce de gravidezes com elevado risco para PE tardia permitiria um